Contents
Antivirals that target the host IMPα/β1-virus interface
総説| 2021年1月13日
pubmed.ncbi.nlm.nih.gov/33439253/
アレクサンダー・J・マーティン
デビッド・A・ジャンス
要約
インポーチン(IMP)α/β1-ヘテロ二量体を介した核内輸送はウイルス感染の中心であるが、IMPα/β1依存性の核内輸送を阻害する低分子インヒビターが記述され、抗ウイルス活性を有することが示されたのはここ10年のことである。これらの強力な抗ウイルス活性は、ヒト免疫不全ウイルス-1(HIV-1)デング熱(デングウイルス)ジカ(ZIKV)などのRNAウイルスを含む多くの異なるウイルスがIMPα/β1-ウイルスインターフェースに強く依存していることに起因している。ハイスループットな化合物スクリーニングにより、この界面を特異的に標的とする多くの薬剤が同定されている。
これらのうち、IMPα/β1を直接標的とする薬剤には、FDA(アメリカ食品医薬局)(アメリカ食品医薬局)(アメリカ食品医薬局)の承認を受けた大環状ラクトンのイベルメクチンがあり、HIV-1,デングウイルス1-4,ZIKV、ウエストナイルウイルス(WNV)ベネズエラ馬脳炎ウイルス、チクングニア、および最近ではSARS-CoV-2(COVID-19)を含む、あらゆるウイルスに対して幅広いスペクトルの活性が報告されている。
イベルメクチンはこれまでのところ、デングウイルスを対象とした第III相ヒト臨床試験で試験されているが、SARS-CoV-2を対象とした試験は現在世界中で80件近く実施されており、無作為化臨床試験(RCT)や観察的/回顧的研究の予備的な結果は、イベルメクチンが臨床的に有用であることを示している。IMPα/β1-ウイルス界面のウイルス成分を標的とする薬剤には、N-(4-ヒドロキシフェニル)レチナミド(4-HPR)があり、これはデングウイルス/ZIKV/WNV非構造タンパク質5(NS5)を特異的に標的とする。
4-HPRは、ZIKVと同様に、抗体依存性強化動物チャレンジモデルを含め、デングウイルス1-4による感染を強力に阻害することが示されており、第II相臨床チャレンジ試験が計画されている。厳密なRCTの結果は、抗ウイルス剤開発のターゲットとしてのIMPα/β1ウイルスインターフェースの治療可能性を決定するのに役立つであろう。
序論
コンパートメント化は真核細胞の重要な特徴であり、異なるコンパートメント間の輸送は細胞機能に不可欠である [1]。核エンベロープの二重膜は、細胞の遺伝物質を封じ込める核コンパートメントを定義しており、RNAの転写プロセスや、mRNAスプライシングなどのRNAの成熟プロセスと同様に、核コンパートメントは細胞の遺伝物質を封じ込めている。タンパク質の翻訳は細胞質コンパートメントで行われるため、細胞が機能するためには、核への特定のシグナルに依存した輸送と核からの輸送が必要となる。すなわち、翻訳が起こるためにはmRNAを細胞質に輸出する必要があるが、一方で、転写[2-4]やmRNAのスプライシング/処理などの主要な核内プロセスを仲介したり調節したりするタンパク質機械のすべてのコンポーネントは核に輸入される必要がある。
核内への45 kDaを超えるタンパク質の輸送と核外への輸送は、インポートイン(IMP)スーパーファミリーのメンバーによって媒介され、その中には複数の異なるα型とβ型が存在する[5,6]。宿主タンパク質が核に入る経路として最もよく知られているのは、IMPα/β1ヘテロ二量体輸送複合体によって媒介される経路である [7]。核内への取り込みのために IMPα/β1 に依存する宿主タンパク質には、シグナル変換器および転写活性化因子(STAT)や核内因子κ-光鎖エンハンサー・オブ・活性化 B 細胞(NF-κB)転写因子ファミリーのメンバーなど、抗ウイルス応答の中心となるタンパク質が含まれている。
多くのウイルスは、宿主細胞の核輸送機械、特に宿主 IMPα/β1 ヘテロダイマーによって媒介される経路を利用して、複製能力を高めたり、宿主免疫応答を無効にしたりしている [3]。特定のウイルスタンパク質の核輸送は、フラビウイルス(例:デングウイルス-デングウイルスまたはジカウイルス-ZIKV;非構造タンパク質5-NS5)レンチウイルス(例:ヒト免疫不全ウイルス-HIV-1;インテグラーゼ-IN)アルファウイルス(例:ベネズエラ脳症ウイルス-HIV-1;インテグラーゼ-IN)アルファウイルス(例:ベネズエラ脳症ウイルス-HIV-1;インテグラーゼ-IN)による感染に極めて重要であることが示されている。アルファインフルエンザウイルス(インフルエンザA;核タンパク質-NP)リッサウイルス(例:狂犬病ウイルスのP1およびP3形態-RV;ホスホ-P-タンパク質)オルソニューモウイルス(例:呼吸器性合胞体ウイルス-RSV;マトリックス-M-タンパク質)およびその他 [3,4,8-13]。ここ10年ほどの間に、宿主-ウイルス界面(すなわち、ウイルスタンパク質のIMPα/β1認識)を標的としたハイスループットスクリーニング(HTS)アプローチを用いた研究により、宿主IMPα/β1ヘテロダイマーまたは特定のウイルスタンパク質のいずれかを標的とした低分子阻害剤が同定されている[14-17]。これらの多くは、抗ウイルス薬としての有望な展望である。
宿主細胞核輸入経路
核へのアクセスを得るために、タンパク質は一般的に核局在化シグナル(NLS)を必要とし、これはIMPα/β1ヘテロダイマー内のIMPαサブユニット、またはIMPβのいずれかによって直接認識される[5,6,2,5]。IMP:カーゴ複合体は、その後、核内孔複合体(NPC)を介してトランスロケーションされる。核内に入ると、Ran-GTPがIMPβに結合することで複合体が解離し、タンパク質カーゴが核機能を果たすために解放される [19,20]。このプロセスを図1に示す。上記で示唆されたように、複数の異なるIMPαが存在し、これらは3つのサブファミリーにグループ化されるが、すべてが非常に相同性が高く、NLS認識に関与する10回のα-ヘリカルアルマジロ(ARM)リピートの共有ドメイン構造と、柔軟なN末端のインポーチン-β結合(IBB)ドメイン(図2参照)を介して核輸入を媒介するために、IMPα/β1ヘテロダイマーの中で同じように機能している(21)[21]。X線結晶学的証拠は、NLSの結合は、IMPα ARMリピート2-4(「メジャーNLS結合部位」)[22]によって最も一般的に媒介され、IMPα ARMリピート6-8(「マイナーNLS結合部位」)[23]は、特定のNLSの場合にはメジャー部位と組み合わせて、より少ない範囲で使用されていることを示している。IBBドメイン自体は、IMPαのIBBドメインがIMPβ1に結合していない場合、この配列がNLS結合ポケットに結合するように、IMPαがIMPβ1の非存在下でNLS含有カーゴに結合するのを防ぐために、本質的にIMPαを「自動阻害」するように、NLSに類似した配列を含む[24]。異なるIMPαは、NLS結合特異性や組織分布に一定の違いがあると考えられており[3,21,25,26]、特定の輸入貨物の輸送においてより特殊な役割を持ち、他の貨物は輸送しないと考えられている[2]。例えば、STAT1は、IMPα5と相互作用し、IMPα1とは相互作用しないことが報告されている[27]一方で、Ranヌクレオチド交換因子RCC1は、IMPα3/α4によってのみ核内に輸送されるようである[28]。これと一致するように、特定のウイルスタンパク質は、特定のIMPαによってのみ認識されることが確認されている;これらには、ヘンドラおよびニパーウイルスWタンパク質[25,29]および鳥類ウイルスインフルエンザA核タンパク質(NP)が含まれ、これはIMPα3に優先的に結合するのに対し、哺乳類ウイルスインフルエンザA NPはIMPα7に結合する[30]。
図1
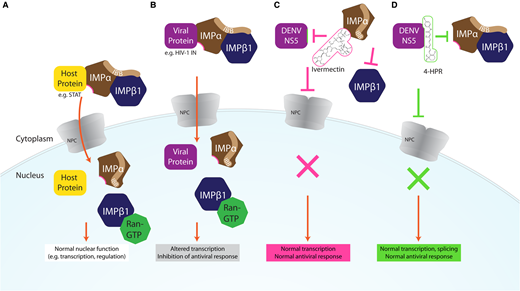
A)宿主タンパク質(例えば、転写因子STAT-2)は、IMPαの自己抑制性IMPβ結合(IBB)ドメインがIMPβ1と結合してIMPα/βヘテロ二量体を形成した後、IMPα(茶色)によって認識される核局在化シグナルを含んでいる。この複合体は、その後、核孔複合体(NPC)を横切ってトランスロケーションされ、Ran-GTPのIMPβ1への結合が複合体を解離させた後、カーゴが放出される。カーゴはその後、抗ウイルス応答の転写制御などの通常の核機能を果たすことができる。B)ウイルス感染の間、特定のNLS含有ウイルスタンパク質(例えば、HIV-1 IN、紫)は、同じIMPα/β1依存性メカニズムによって核内に取り込まれ、そこで、ウイルス産生の速度を最大化するために抗ウイルス応答に拮抗するために転写を変化させるなどの正常な細胞機能を妨害することができる。C)イベルメクチン(ピンク)はIMPαと結合し、IMPα/β1ヘテロ二量体を解離させ、そのウイルス(および宿主)タンパク質標的への結合を阻害し、それによって核内への取り込みおよび下流の転写効果を阻害する。D)4-HPR(緑)は、ウイルスタンパク質デングウイルス2 NS5と特異的に結合し、IMPα/β1の結合と核インポートを阻害し、それに伴う転写やスプライシングに対する下流への影響を抑制する。
宿主IMPα/β1依存性核内取り込み経路の模式図(A)ウイルス感染においてどのようにウイルスタンパク質に共役されているか(B)および低分子抗ウイルス剤がどのように経路に影響を与えうるか(C,D)を示している。
A)宿主タンパク質(例えば、転写因子STAT-2)は、IMPαの自己抑制性IMPβ結合(IBB)ドメインがIMPβ1と結合してIMPα/βヘテロ二量体を形成した後、IMPα(茶色)によって認識される核局在化シグナルを含んでいる。この複合体は、その後、核孔複合体(NPC)を横切ってトランスロケーションされ、Ran-GTPのIMPβ1への結合が複合体を解離させた後、カーゴが放出される。カーゴはその後、抗ウイルス応答の転写制御などの通常の核機能を果たすことができる。B)ウイルス感染の間、特定のNLS含有ウイルスタンパク質(例えば、HIV-1 IN、紫)は、同じIMPα/β1依存性メカニズムによって核内に取り込まれ、そこで、ウイルス産生の速度を最大化するために抗ウイルス応答に拮抗するために転写を変化させるなどの正常な細胞機能を妨害することができる。C)イベルメクチン(ピンク)はIMPαと結合し、IMPα/β1ヘテロ二量体を解離させ、そのウイルス(および宿主)タンパク質標的への結合を阻害し、それによって核内への取り込みおよび下流の転写効果を阻害する。D)4-HPR(緑)は、ウイルスタンパク質デングウイルス2 NS5と特異的に結合し、IMPα/β1の結合と核インポートを阻害し、それに伴う下流の転写やスプライシングへの影響を防止する。
図2
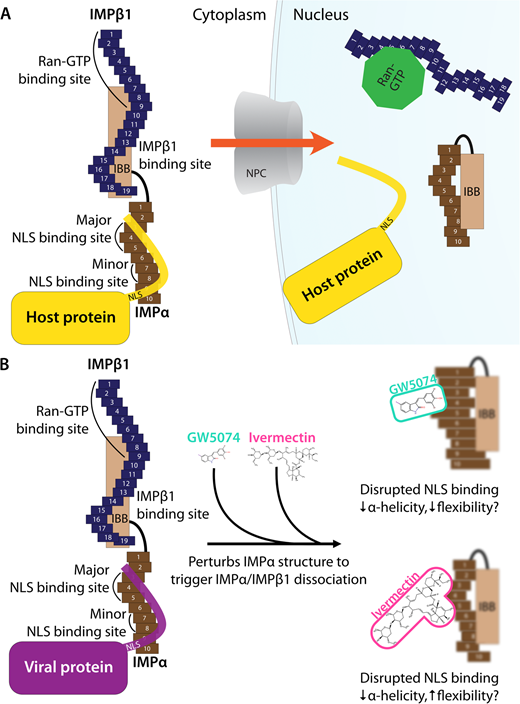
A)ヒトIMPαとIMPβ1の結晶構造に基づくIMPα/β1複合体の模式図。IMPαは、10個のアルマジロ(ARM)リピートとIMPβ結合(IBB)ドメインから構成されている。IMPαのARMリピート2-4はメジャーカーゴNLS結合部位を形成し、ARM7-8はマイナーNLS結合部位を形成している。IMPβ1は19のHEATリピートからなり、リピート7-19はIMPαのIBBドメインに結合し、Ran-GTPはN末端/リピート8に結合する。 細胞質では、IMPβ1(青)はIBBドメインを介してIMPα(茶色)に結合し、カーゴタンパク質(黄色)結合のための主要なNLS結合部位を露出させる。NPCを横切って核内に輸送された後、Ran-GTPはIMPβ1に結合し、その構造を変化させ、IBBドメインを変位させて放出し、その結果、自己抑制的にNLS結合部位に結合し、NLS結合を阻止する。B)イベルメクチンとGW5074はIMPαに直接結合し、円二色性、熱安定性分析、および分析的超遠心分離[44,47]を含む生物物理学的測定によって確認されたように、IMPαの構造的完全性を乱すために、IMPαのhelicity/インパクトの柔軟性を低下させ、それによってIMPαがNLS含有タンパク質またはIMPβ1に結合するのを防止することができる。
IMPαおよびIMPβ1の構造/機能ドメインの模式的表現;阻害剤の影響。
A)ヒトIMPαおよびIMPβ1の結晶構造に基づくIMPα/β1複合体の模式図。IMPαは、10個のアルマジロ(ARM)リピートとIMPβ結合(IBB)ドメインから構成されている。IMPαのARMリピート2-4はメジャーカーゴNLS結合部位を形成し、ARM7-8はマイナーNLS結合部位を形成している。IMPβ1は19のHEATリピートからなり、リピート7-19はIMPαのIBBドメインに結合し、Ran-GTPはN末端/リピート8に結合する。 細胞質では、IMPβ1(青)はIBBドメインを介してIMPα(茶色)に結合し、カーゴタンパク質(黄色)結合のための主要なNLS結合部位を露出させる。NPCを横切って核内に輸送された後、Ran-GTPはIMPβ1に結合し、その構造を変化させ、IBBドメインを変位させて放出し、その結果、自己抑制的にNLS結合部位に結合し、NLS結合を阻止する。B)イベルメクチンとGW5074はIMPαに直接結合し、円二色性、熱安定性分析、および分析的超遠心分離[44,47]を含む生物物理学的測定によって確認されたように、IMPαの構造的完全性を乱し、IMPαのhelicity/impact flexibilityを減少させ、それによってIMPαがNLS含有タンパク質またはIMPβ1に結合するのを阻止する。
ウイルスタンパク質は、宿主の核インポート機械系を破壊する
宿主細胞の核輸送は、核プロセスを標的とするウイルスタンパク質によって利用され、宿主の抗ウイルス反応に拮抗することができる。これには デングウイルス NS5 が含まれ、多くの宿主の核内プロセスに影響を与えるために核にアクセスする(図 1)。これは、インターロイキン8(IL-8)の産生を遅延させ、ウイルスの複製を助長する宿主細胞環境を助長する[8,31]、宿主細胞スプリソソーム複合体に作用して抗ウイルス応答に重要な遺伝子のプレmRNAスプライシングの効率を低下させる[32]、インターフェロン(IFN)刺激遺伝子を抑制するためのPaf1/RNAポリメラーゼII複合体コンポーネントPAF1Cのリクルートを阻害する[33]など、様々な結果をもたらす。宿主の抗ウイルス応答に拮抗する他の核局在化ウイルスタンパク質には、STAT-1および前骨髄球性白血病腫瘍抑制タンパク質に結合してIFNシグナリングに影響を与えるものの一部ではRV P3-タンパク質が含まれる[34]、および感染した宿主細胞の転写転帰を調節するRSV Mが含まれる[3,35]。
HIV-1 INやインフルエンザA NPなどの他のタンパク質の場合、核アクセスはウイルスのライフサイクルにとって重要である[4]。例えば、IMPα/β1 [36]に依存して、HIV-1 IN/HIV-1 preintegration complex (PIC)の核内インポートは、HIV-1ゲノムのDNA形態が宿主のDNAに統合されて生産的な感染を可能にするために不可欠である[4,9,36,37]。対照的に、VEEV CPは、宿主IMPα/β1ヘテロ二量体およびIMPβ同族核輸出タンパク質EXP1と結合し、核孔に蓄積し、宿主タンパク質の核内輸入を阻害する4量体複合体を形成し、それによって宿主のIFN-α/β応答を減少させるようである[38,39]。重症急性呼吸器症候群(SARS)の原因物質であるSARS-CoV-1の場合、オープンリーディングフレーム(ORF)6は、宿主IMPαを標的とし、それを粗いER/ゴルジで隔離し、STAT-1の核内輸入を媒介する重要な役割を阻止し、宿主細胞の抗ウイルス応答を和らげることが示されている[40]。
ウイルス感染におけるIMPα/β1-ウイルス軸の重要性は、デングウイルスを含む多くのウイルスについて正式に実証されており、IMPα/β1認識の障害を介したNS5 NLS核標的の変異誘発により、ウイルスが減衰し、感染性ウイルス産生が著しく減少することが示されている[8]。さらに、NS5 の核内インポートを阻害する構造的に異なるいくつかの低分子阻害剤(下記参照)も感染ウイルス産生を減少させており、デングウイルス 感染における NS5 の核内ターゲティングの重要性が強調されている。同様の結果がHIVでも得られており、HIV-1 INタンパク質の核内輸入を阻害することでHIV-1感染が劇的に減少している[41,42]。最後に、RV Pタンパク質の核内輸送が感染に重要であることは、高病原性RV西ヶ原(Ni)株の減衰した非致死性ニワトリ胚(CE)細胞適応株(Ni-CE)が、核細胞質分布に影響を与える変異を保有しているという観察からも示唆されている[12]。
IMPα/β1を標的とした阻害剤:イベルメクチン
化合物ライブラリーおよび組換えタンパク質を用いたHTSは、宿主IMPα/βを標的とする多くの低分子インヒビターを同定するために使用されてきた(表2参照)。これらの中で最もよく研究されているイベルメクチン(22,23-ジヒドロアベルメクチンB)は、1975年に発見され、10年後に抗寄生虫剤としてヒトでの使用が承認されたStreptomyces avermitilisという細菌によって産生される大環状ラクトンである。イベルメクチンは、様々な外寄生虫および内寄生虫の感染症の治療のために米国FDA(アメリカ食品医薬局)(アメリカ食品医薬局)(アメリカ食品医薬局)の承認を受けており、優れた安全性プロファイルを持ち、世界中でオンコセルカ症(河川失明症)およびリンパ系フィラリア症の治療に何百万人もの人々が治療を受けている[43]。イベルメクチンは、WHOの必須医薬品リストに掲載されている多くの薬剤の1つであり、その同定と特性の確立の研究は 2015年にノーベル生理学・医学賞を受賞している。
表1 抗ウイルス効果のあるIMPα阻害剤のinvitro特性
| 化合物 | 核輸入における文書化された行動(IC50) | 抗ウイルス剤 | 有効濃度(アッセイ)/減分(アッセイ) |
|---|---|---|---|
| イベルメクチン1 | 阻害相互作用試験管内試験でHIV IN [有するIMPαの14 ]、デングウイルス2 NS5(1μM)[ 42、44 ]、T-AG [ 15 ]、ヘンドラV(15μM)[ 48 ]、IMPβ1(7μM)[ 44 ] 定量的BiFcによって視覚化されるように、細胞内でのIMPαとT-agおよびNS5との相互作用を阻害する[ 44 ] IMPαの細胞溶解物からのCoIPをT-ag、アデノウイルスEIAで阻害する[ 81 ] IMPα/β1-のトランスフェクト細胞における核蓄積を阻害する。そのようなT-Ag等が、β1-認識されないウイルスタンパク質[ 16、42 ]、デングウイルス2 NS5 [ 42 ]、VEEVのCP [ 16 ]、PRV UL42 [60 ]、HIV-1 IN [ 14、42 ]、のhCMV UL44 [ 42 ]、インフルエンザA vRNPs [ 11 ]、ならびに宿主貨物(例えば、[ 8、42、46 ]) デングウイルス1-4の感染細胞に核局在を低減NS5 [ 82 ]、VEEV CP [ 51 ]およびアデノウイルスE1A [ 81 ] |
ベータ コロナウイルスSARS-CoV-2 |
EC 50 = 2.2 /2.8μM(qPCR /放出/細胞関連ウイルス)[ 59 ] 5μM> 5000倍[ 59 ] |
| HIV-1(VSV-G-疑似型NL4-3.Luc.RE-HIV) | 50μM> 2倍(ルシフェラーゼ)[ 42 ] | ||
| インフルエンザVLP(鳥インフルエンザA / MxAエスケープ変異体) | 10μMの総阻害(ルシフェラーゼ)[ 11 ] | ||
| フラビウイルス YFV(17D) |
EC 50 = 5 / 0.5 nM(CPE / qPCR)[ 83 ] 3μM> 50000倍(PFU)[ 46 ] |
||
| デングウイルス1(EDEN1) | EC 50 = 2.3 /3.0μM(CFI、2ホスト)[ 82 ] | ||
| デングウイルス2(NGC) | EC 50 =0.7μM(qPCR)[ 83 ] EC 50 = 3.3 /0.4μM(PFU、2ホスト2)[ 44 ] |
||
| デングウイルス2(EDEN2) | EC 50 = 0.4 /0.6μM(pfu / qPCR)[ 44 ] EC 50 = 2.1 /1.7μM(CFI、2ホスト)[ 82 ] 50μM総阻害(PFU)[ 42 ] |
||
| デングウイルス3(EDEN3) | EC 50 =1.7μM(CFI)[ 82 ] | ||
| デングウイルス4(EDEN4) | EC 50 =1.9μM(CFI)[ 82 ] | ||
| WNV(NY99) | EC 50 =4μM(qPCR)[ 83 ] | ||
| WNV(MRM61C) | EC 50 = 1 /0.5μM(PFU / qPCR)[ 44 ] | ||
| ZIKV(アジア/クック諸島/ 2014) | EC 50 = 1.6 /1.3μM(PFU、2ホスト2)[ 44 ] | ||
| アルファウイルス チクングニアウイルス(CHIKV-Rluc) シンドビス(HR) セムリキ森林ウイルス VEEV(TC83) |
EC 50 = 1.9/0.6μM(ルシフェラーゼ、2ホスト)[ 46 ] 3μM> 5000倍(PFU)[ 46 ] 3μM> 200倍(PFU)[ 46 ] 1μMc。20倍(PFU)[ 51 ] |
||
| ヘンドラ (オーストラリア/馬/ 1994) |
EST。EC 50 = 2μM(TCID /ルシフェラーゼ)[ 48 ] | ||
| アデノウイルス HAdV- C5HAdV-B3 |
EC 50 = c。2.5μM; 10μM20倍(qPCR)[ 81 ] 10μMc 。8倍(qPCR)[ 81 ] |
||
| BKポリオーマウイルス(BKPyV) | EST(東部基準時。EC 50 1.5μM(PFU / CPE /定量PCR)[ 84 ] | ||
| オーエスキー病 | EST(東部基準時。EC 50、C。0.8μM1000倍[ 60 ] | ||
| ゴシポール3 | IMPαとヘンドラウイルスV(10μM)とのinvitroでの相互作用を阻害する[ 48 ] NS5のWNV感染細胞における核蓄積を阻害する[ 49 ] |
WNV(MRM61C) | 10μM100倍(PFU)[ 49 ] |
| ヘンドラ (オーストラリア/馬/ 1994) |
10μM6倍(TCID /ルシフェラーゼ)[ 48 ] | ||
| GW5074 | IMPαとデングウイルス2NS5(5μM)[ 47 ]、Hendra(V 15 uM )[ 48 ]、IMPβ1(10μM)[ 47 ]とのinvitroでの相互作用を阻害するNS5のデングウイルス2感染細胞における核蓄積を阻害する[ 47 ] | フラビウイルス デングウイルス2NGC |
EC 50 = 0.8 / 1.4(PFU / PCR)[ 47 ] |
| ZIKV(アジア/クック諸島/ 2014) | EC 50 = 0.3 / 0.5(PFU / PCR)[ 47 ] | ||
| WNV(MRM61C) | EC 50 = 5.2 / 4.8(PFU / PCR)[ 47 ] | ||
| オタヴァ1111684 | 阻害相互作用試験管内試験でVEEV CPとIMPαの[ 17 ] トランスフェクトされた細胞におけるVEEV CP-GFPの阻害核蓄積[ 17 ] VEEV CPの感染細胞において核局在化を軽減[ 17 ] (VEEV CP-GFPの核輸入の速度/程度を低減するFRAP)[ 17 ] |
アルファウイルス VEEV(TC83) |
EC 50 =9.9μM(lum)4 [ 17 ] 10μM> 100倍[ 17 ] |
1米国食品医薬品局(FDA(アメリカ食品医薬局)(アメリカ食品医薬局))が承認した広汎な抗寄生虫剤で、内寄生虫感染症(ストロンギロイジダ症、オンコセルカ症)や疥癬、ペディキュラ症、酒さなどの原因となる外寄生虫を含む [66]。FRETベースのアッセイでデングウイルス2/YFV/WNV NS3のヘリカーゼ活性を阻害することが報告されている[83];2PBMCsにおけるヒト感染のex vivoモデルを除く;3副作用(低カリウム血症性麻痺、精巣障害)のためヒト男性避妊薬として中止された[85,86];4選択性指数は3である。 7
略語
ADE、抗体依存性感染増強;BiFc、二分子蛍光補体;デングウイルス、デングウイルス;CFI、細胞ベースフラビウイルス感染アッセイ(ウイルス免疫染色);CoIP、共免疫沈降;CP、カプシドタンパク質;CPE、細胞病原性効果(宿主細胞);CHIKV、チクングニヤウイルス;EC50,半最大有効濃度;Est. 推定;FRAP、フォトブリーチング後の蛍光回復;FRET、蛍光共鳴エネルギー移動;GFP、緑色蛍光タンパク質;HAdV、ヒトアデノウイルス;hCMV、ヒトサイトメガロウイルス;HCV、C型肝炎ウイルス;HIV、ヒト免疫不全ウイルス;IBB、インポーチンβ結合ドメイン;IC50,半最大阻害濃度;IN、インテグラーゼ;lum、発光アッセイ;NS5,非構造タンパク質5;PCR、ポリメラーゼ連鎖反応。PFU、プラーク形成単位(感染性ウイルス);PRV、シュードラビースウイルス;RdRp、RNA依存性RNAポリメラーゼ;SV40,シミアンウイルス40;T-ag、SV40大型T抗原;TCID、組織培養感染用量(CPEに基づくウイルス負荷量の推定)。VEEV、ベネズエラ馬脳炎ウイルス;VLP、ウイルス様粒子;vRNP、ウイルス性リボ核タンパク複合体;VSV-G、小水疱性口内炎ウイルス糖タンパク質;WNV、ウエストナイルウイルス;YFV、黄熱病ウイルス;ZIKV、ジカウイルス。
表2 抗ウイルス効果を持つウイルスタンパク質カーゴ標的阻害剤のinvitro特性
| 化合物 | 文書化された行動(IC50) | 抗ウイルス剤 | ウイルス産生の有効濃度(アッセイ、宿主)/倍数減少(アッセイ、宿主細胞株) |
|---|---|---|---|
| ミフェプリストン1 | HIVINとImpα/β(27μM)のinvitroでの相互作用を阻害する[ 14 ] HIV INコアドメインに結合するが、Impα/βには結合しない(HSQCNMR)[ 37 ] 50μMはトランスフェクトされた細胞におけるGFP-HIV- 1IN核蓄積を阻害する[ 14 ] 5μMはinvitro再構成核輸送アッセイでHIV-1IN核蓄積を5倍以上減少させる[ 37 ] 5μMは感染細胞におけるVEEVCP核蓄積を減少させる[ 51 ] VEEVCP-GFP核輸入の速度/程度を減少させる(FRAP)[ 52 ] 50μMはHAdVゲノムの核内移行を減少させる(細胞分画/ qPCR)[ 53 ] |
HIV-1 | 10μM> 8倍(EGFPレポーターウイルス、CEMx174)[ 50 ] 10μM> 20倍(ELISA、PBMC)[ 50 ] 200μM> 3倍(ルシフェラーゼ、HeLa)[ 42 ] |
| VEEV | EC50 =19.9μM(PFU、Vero)[ 52 ] 10μM> 10倍(PFU、U87MG)[ 51 ] 10μM> 5倍(PFU、Vero)[ 51 ] 10μM> 15倍(PFU、Vero )[ 52 ] |
||
| ヒトアデノウイルス HAdV5 |
EC50 =2μM(PFU)[ 53 ] | ||
| ミフェプリストン類似体50 2 | 50μMはトランスフェクトされたGFP-CP(FRAP)の 核移行を阻害するFRAP後のVEEVCP-GFP核蛍光の回復を減少させる[ 52 ] 50μMは感染細胞におけるCPの核蓄積を阻害する[ 52 ] |
VEEV | EC50 =7.2μM(ルシフェラーゼ、ベロ)[ 52 ] 10μM> 7倍(PFU、ベロ)[ 52 ] |
| ブデソニド3 | HIVINとImpα/β(1.2μM)とのinvitroでの相互作用を阻害する[ 37 ] HIV INコアドメインに結合するが、Impα/βには結合しない(HSQC NMR)[ 37 ] 5μMはHIV- 1IN核蓄積を2倍以上減少させるinvitroで再構成された核輸送アッセイ[ 37 ] 100μMはHIVPIC核輸入を阻害する[ 37 ] |
HIV-1 | EC50 =79.4μM(ルシフェラーゼ、MT-2,シングルサイクル)[ 37 ] EC50 =49.4μM(ルシフェラーゼ、TZMbl)[ 37 ] |
| フルニソリド4 | HIVINとImpα/β(1.4μM)とのinvitroでの相互作用を阻害する[ 37 ] HIV INコアドメインに結合するが、Impα/βには結合しない(HSQCNMR)[ 37 ] 250μMはHIVPIC核移行を阻害する[ 37 ] |
HIV-1 | EC50 =77.5μM(ルシフェラーゼ、MT-2,シングルサイクル)[ 37 ] EC50 =105μM(ルシフェラーゼ、TZMbl)[ 37 ] |
| G281-1564 | VEEV CPとImpα/β(12μM)のinvitroでの相互作用を阻害する[ 16 ] 50μMはトランスフェクトされた細胞におけるGFP-CP核蓄積の程度と速度を阻害する(それぞれ1.8倍、1.4倍)[ 16 ] |
VEEV | EC50 =10.8μM(ルシフェラーゼ、ベロ)5 [ 16 ] 50μM> 10倍(PFU、ベロ)[ 16 ] |
| N-(4-ヒドロキシフェニル)レチナミド/フェンレチニド/ 4-HPR 6 | デングウイルス1NS5:Impα/β(2.3μM)のinvitroでの相互作用を阻害する[ 82 ]。デングウイルス2NS5:Impα/β(0.8μM)[ 15 ]; デングウイルス2 NS5:ImpαΔIBB(1.1μM)[ 15 ]; ZIKV NS5:Impα/β(1.1μM)[ 87 ] 感染細胞におけるデングウイルス2 NS5核蓄積の阻害[ 15、47、77 ] 不安定化デングウイルス 3 NS5のRdRp(熱安定性アッセイ)[ 44、47 ] インフルエンザの15μM阻害核内蓄積vRNP(IF)[ 11 ] |
フラビウイルス デングウイルス1(EDEN1) |
EC50 =2.6μM(PFU、Huh-7)[ 15 ] EC50(ADE 7)=0.8μM(PFU、THP-1)[ 15 ] EC50(ADE 7)=0.8μM(PFU、PBMC)[ 15 ] |
| デングウイルス2(EDEN2) | EC50 =2.1μM(PFU、Huh-7)[ 15 ] | ||
| デングウイルス2(NGC) | EC90 =2.0μM(PFU、Vero)[ 77 ] | ||
| デングウイルス3(EDEN3) | EC50 =1.4μM(PFU、Huh-7)[ 15 ] | ||
| デングウイルス4(EDEN4) | EC50 =2.1μM(PFU、Huh-7)[ 15 ] | ||
| ZIKV(アジア/クック諸島/ 2014) | EC50 =2.6μM(PFU、Vero)[ 87 ] | ||
| ZIKV(アジア/ PF13-251013-1) | EC90 =1μM(PFU、複数のホスト)[ 78 ] | ||
| ZIKV(アフリカ/ MR-766) | 10μM> 1000倍(PFU、Vero)[ 78 ] | ||
| WNV(クンジン) | 10μM> 7倍(PFU、Vero)[ 15 ] 10μM> 100倍(PFU、Vero)[ 77 ] 10μM> 10倍(PFU、Vero)[ 49 ] |
||
| YFV | 3μM> 100倍(BHK-21,PFU)[ 46 ] | ||
| アルファウイルスチクングニア 熱 |
EC50 = 0.5 /3.1μM(PFU、複数のホスト)[ 46 ] | ||
| モドック | 10μM> 100倍(PFU、Vero)[ 77 ] | ||
| インフルエンザVLPは8(トリインフルエンザA /のMxAエスケープ突然変異体) | 10μM> 4倍阻害(ルシフェラーゼ)[ 11 ] |
1医療用妊娠中止薬、クッシング症候群患者の高血糖症治療におけるヒトへの使用が承認されている。 2プロゲステロン受容体拮抗作用を欠くミフェプリストン((8S,13S,14S,17S)-17-ヒドロキシ-13-メチル-11-フェニル-17-((トリメチルシリル)エチニル)-1,2,6,7,8,11,12,13,14,15,16,17-ドデカヒドロ-3H-シクロペンタ[a]フェナントレン-3-オン))の類似体[52]。 3喘息、慢性閉塞性肺疾患、アレルギー性鼻炎及び鼻ポリープ、炎症性腸疾患の治療薬として承認されている;4喘息、アレルギー性鼻炎の治療薬として承認されている;5選択性指数>9. 3;6乳がん、膀胱がん、小児がん、黄斑変性症などの適応症を対象とした臨床試験(第Ⅲ相を含む)に進展中;その他の作用としては、eIF2αのリン酸化亢進、長鎖セラミド生合成、PERK経路、ATF-4とは無関係な抗ウイルス状態の促進などが挙げられる[15,55,77]。
略語
ADE, antibody-dependent enhancement of infection; デングウイルス, Dengue virus; CFI, cell-based flavivirus infection assay (immunostaining for virus); CoIP, coimmunoprecipitation; CP, capsid protein; CPE, cytopathogenic effect (host cell); CHIKV, Chikungunya virus; EC50, half-maximal effective concentration; Est. 推定値;FRAP、フォトブリーチング後の蛍光回復;FRET、蛍光共鳴エネルギー移動;GFP、緑色蛍光タンパク質;HAdV、ヒトアデノウイルス;hCMV、ヒトサイトメガロウイルス;HCV、C型肝炎ウイルス;HIV、ヒト免疫不全ウイルス。HSQ NMR、ヘテロ核単一量子コヒーレンス核磁気共鳴;IBB、インポートインβ結合ドメイン;IC50,半最大阻害濃度;IF、免疫蛍光;IN、インテグラーゼ;lum、発光アッセイ;NS5,非構造タンパク質5;PBMC、末梢血単核球。PCR、ポリメラーゼ連鎖反応;PIC、プレインテグレーション複合体;PFU、プラーク形成単位(感染性ウイルス);PRV、シュードラビースウイルス;RdRp、RNA依存性RNAポリメラーゼ;SV40,シミアンウイルス40;T-ag、SV40大型T抗原;TCID、組織培養感染量(CPEに基づくウイルス負荷量の推定)。VEEV、ベネズエラ馬脳炎ウイルス;VLP、ウイルス様粒子;vRNP、ウイルス性リボ核タンパク複合体;VSV-G、小水疱性口内炎ウイルス糖タンパク質;WNV、ウエストナイルウイルス;YFV、黄熱病ウイルス;ZIKV、ジカウイルス。
イベルメクチンがウイルスタンパク質の核内インポートに影響を与える役割を持ち、それによって抗ウイルス剤としての可能性があることを初めて示唆したのは 2011年に化合物ライブラリーHTSを用いてIMPα/β1のHIV-1 INへの結合阻害剤を同定したときである [14]。イベルメクチンはINではなくIMPα/β1と直接相互作用してIMPα/β1:IN結合を阻害する可能性の高い薬剤であることが、ネストされたカウンタースクリーニング戦略によって確認された(IC50は約5μM)[14]。これと一致するように、イベルメクチンは、IN の核内蓄積と、よく知られている IMPα/β1 が認識する核内輸入貨物 SV40 大型腫瘍抗原 (T-Ag) を阻害するが、IMPβ1 が認識するテロメアリピート因子-1 のような、IMPαに依存しない IMP 依存経路を介して輸送される貨物は阻害しないことがわかった [14]。イベルメクチンは、その後、デングウイルス NS5(図1を参照)や宿主細胞タンパク質(表1を参照)を含む様々なウイルスタンパク質へのIMPα/βの結合を阻害することが示されてきた。
最近の研究では、イベルメクチンの作用機序がIMPαへの直接結合を介していることが確認されており、その結果、円形二色性(CD)/熱安定性(TSA)測定によって示唆されるように、αヘリシティを減少させ、柔軟性に影響を与える構造変化をもたらす可能性が高いことが示されている(図2参照) [44]。これらの変化は、IMPβ1と同様に、NLSを含むウイルス/宿主タンパク質カーゴとの相互作用を妨げる;イベルメクチンはまた、核輸入を媒介するためにIMPαが必要とする形態である、あらかじめ形成されたIMPα/βヘテロ二量体を解離させることができる[44]。したがって、イベルメクチンは、IMPαおよびIMPα/β1(図1Cを参照)による核輸入貨物の認識を阻害し、それらの核蓄積を有意に減少させ、それによって感染症における宿主抗ウイルス応答の抑制を減少させる。イベルメクチンによる核蓄積の阻害は、多くの異なるウイルスタンパク質[14,18]およびNF-κB p65[45]などの宿主タンパク質について、トランスフェクションした細胞系および感染した細胞系で実証されている(表1を参照)。イベルメクチンのウイルスタンパク質への IMPαの結合を阻害する能力は、生体分子蛍光相補化の手法を用いて細胞内でも示されている[32]。
イベルメクチンの IMPα依存性宿主標的作用モードは、イベルメクチンが試験管内試験および生体内試験の両方で抗ウイルス効果を実証している広範囲のウイルスを説明している[18]。試験管内試験での抗ウイルス特性は、Betacoronavirus SARS-CoV-2(COVID19)レンチウイルスHIV-1,アルファインフルエンザウイルス(インフルエンザA)フラビウイルス(デングウイルス、WNV、ZIKV)などの幅広いウイルスに対して実証されている。黄熱病ウイルス-YFV)アルファウイルス(CHIKV、シンドビス、セムリキ森林ウイルス、VEEV)ヘンドラヘニパウイルス、マスタデノウイルス(ヒトアデノウイルス-HAdV-BおよびC)BKベタポリマウイルスおよびPSVバリセロウイルス(表1)。デングウイルスやZIKVでは,末梢単核血単球(PBMCs)を用いたex vivoヒト疾患モデルにおいて,イベルメクチンの抗ウイルス活性が確認されている[15,44].また、イベルメクチンは、ルシフェラーゼレポーターを担持したウイルスを用いてCHIKVの複製を阻害することができる抗ウイルス剤としてHTSによって独自に同定されたことは注目に値する[46]。
IMPα/β1を標的とする他の阻害剤
化合物ライブラリーHTSにより、イベルメクチン以外の低分子IMPα標的阻害剤の同定が可能となった(表1,参照)。GW5074は、IMPα/β1-デングウイルス NS5結合の阻害剤として同定された[15,47]。GW5074 の特性を特徴づけるための最近の研究により、イベルメクチンと同様に IMPαに結合し、CD/TSA 測定で示唆されたα-helicity/flexibility の変化を誘発し(図 2 参照)IMPα/β1 ヘテロダイマーの解離/NS5 の核インポートの阻害につながることが明らかにされた [47]。これが、デングウイルス、ZIKV、およびWNVの感染性ウイルス産生を制限するGW5074の能力の基礎であると考えられる[47]。イベルメクチン(上記参照)[14]を同定したのと同じHTSで発見された別の宿主標的阻害剤、ゴシポール(GSP)は、IMPα/β1:ヘンドラウイルス(HENV)Vタンパク質の相互作用を阻害することが示されている[48]。GSPはまた、WNVに対して抗ウイルス効果を有することが示されている[49]。
また、in silico構造に基づくドラッグデザインHTSは、核輸送阻害剤の同定にも成功している[17]。IMPαのNLS結合部位にドッキングし、それによってVEEV CPのNLSとIMPαの結合を模倣する能力を持つ150万の化合物のin silicoスクリーニングにより、様々な低分子が同定され、その後、IMPα/β1とVEEV CPの結合を阻害する能力があることが実験的に確認された。1111864(表1参照)を含むいくつかのリード化合物は、感染した細胞におけるCPの核蓄積およびVEEVの複製を阻害することが確認された[17]。
特定のウイルスタンパク質を標的とした核内蓄積阻害剤
上述した宿主を標的とした阻害剤に加えて、IMPα/β1-ウイルス軸のウイルス側を特異的に標的とし、ウイルスタンパク質の核輸入を防ぐいくつかの阻害剤が同定されている(表2を参照)。ステロイドプロゲステロン/グルココルチコイド受容体アンタゴニストのミフェプリストンは、組換えIMPα/β1とHIV-1 INの相互作用を阻害する能力により、HTSで最初に同定されたそのような阻害剤であった[14]。その作用がIMPα/β1: INに特異的であり、IMPα/β1への直接的な影響によるものではないことを確認するために、ネステッドカウンタースクリーニングが使用された[14]。重要なことに、ミフェプリストンは試験管内試験再構成核輸入アッセイにおいて、INの核輸入を阻害することができた[37]。試験管内試験での結果は、以前にHIV-1に対する強い抗ウイルス活性を示しており[50]、VEEVおよびHAdV[51-53]に対する活性も報告されている;これらのウイルスはいずれもINホモログを持たないため、ミフェプリストンがVEEV感染細胞におけるCPの核蓄積に影響を与える正確なメカニズムは不明である[51]。ミフェプリストンの臨床的有用性の限界は、ミフェプリストンが産生抑制剤であるという事実である。薬理化学とSAR分析を用いて、検出可能なプロゲステロン受容体拮抗作用を欠くが、VEEV CP核蓄積を阻害し、VEEV感染を制限する能力を保持した新規ミフェプリストン類似体を生成することができた[52]。
グルココルチコイドのブデソニドは、ミフェプリストンと同じHTSキャンペーンで同定された(IC50は1μM)。密接に関連する分子のSAR/NMR解析から、フルニソリドはINにも結合しているが、ブデソニドよりも大きな構造変化を引き起こすことが示された。重要なことに、フルニソリドとブデソニドは、未統合核ウイルスDNAの定量的ポリメラーゼ連鎖反応解析から推測されるように、HIV PICの核内蓄積を阻害することが確認された[25]。また、ブデソニドとフルニソリドはいずれもHIV-1に対して強力な抗ウイルス活性を示した(表2)。
IMPα/β1:VEEV CP結合阻害剤のための14,000以上の化合物ライブラリーのHTSと、それに続く入れ子になったカウンタースクリーンから、強力な阻害活性を保持する多くの化学的足場が同定された [16]。その後、in silico情報を用いたSAR解析により、これらのいくつかの化学足場に焦点を当て、化合物G281-1564がIMPα/β1:CP相互作用の特異的な阻害剤であることが確認された。トランスフェクト細胞を用いた実験では、CPは阻害されたが、SV-40T-Agの核内蓄積は阻害されなかった。重要なことに、G281-1564は細胞培養におけるVEEV感染を抑制することが確認された(EC50:10.8 μM)[16]。その後、G281-1564は細胞周期の遅延を抑制することが示されたが、これはCPの核内局在化/IMPα/β1:CP結合に依存している可能性がある[54]。
IMPα/β1-ウイルス軸のウイルス側を標的とする最も有望な阻害剤の一つは、N-(4-ヒドロキシフェニル)レチナミド(4-HPR、別名フェンレチニド)であり、これはHTSによりIMPα/β1:デングウイルス NS5相互作用の特異的阻害剤として同定された(IC50は0.8μM) [15]。4-HPRは、感染細胞におけるデングウイルス NS5の核蓄積を減少させることが示され、また、PBMCsを用いた重度抗体依存性強化(ADE)ヒト感染のex vivoモデルを含め、EC50値が∼1-2μMの間で、4つの循環するデングウイルス株(デングウイルス1-4)のすべてのウイルス複製を強力に阻害することが示された[15]。4-HPRはまた、ZIKV(EC50値が1~2μM)WNV、YFVを含む他のフラビウイルスによる感染を制限する(表2参照)。SAR解析と他の阻害剤の使用により、4-HPRの特異性が確認され、その抗ウイルス作用のメカニズムは、他の作用(例えば、セラミド代謝への影響)よりもむしろNS5の核インポートを阻害していることが確認された[15]。4-HPR は デングウイルス2 NS5 RNA-dependent RNA polymerase (RdRp) ドメインを不安定化するが、IMPαは不安定化しないことが TSA アッセイで確認されている[44]。
4-HPRはまた、CHIKVの阻害剤としてHTS(上記参照)で同定されており(46)アルボウイルスModocおよびインフルエンザAウイルスによる感染を制限することが報告されていることは興味深いことである。CHIKVと同様に、Modocやインフルエンザウイルスは、感染した宿主細胞の核に局在して転写/スプライシングに影響を与えるフラビウイルスNS5(デングウイルス1-4,ZIKV、YFV、WNV、日本脳炎ウイルスによく保存されている)の相関体を持っていないため、この場合の4-HPRの抗ウイルス作用は、他の細胞経路(セラミド生合成/アンフォールドタンパク応答)を介している可能性があると考えられる[47,55]。
IMPαターゲティング阻害剤の前臨床/非臨床試験
核輸送のような本質的な細胞活動に影響を与える宿主指示薬は、臨床の場では注意して使用しなければならない。IMPα/β1:ウイルス界面の宿主 IMPα/β1 側を標的とした低分子阻害剤の中で、イベルメクチンは、ウイルス性の適応でヒト臨床試験まで進んだ唯一のものである。イベルメクチンは、ヒトにおいて確立された安全性プロファイルを有しており[43,56]、多くの寄生虫感染症[56-58]に対してFDA(アメリカ食品医薬局)(アメリカ食品医薬局)(アメリカ食品医薬局)の承認を受けているが、イベルメクチンは、抗ウイルス応答において紛れもなく重要な宿主核輸入機能を標的としており、細胞/組織/器官のIMPαレパートリーの大きな割合の滴定は毒性につながる可能性が高い。イベルメクチンのような宿主指示薬をウイルス感染症の治療に最適に使用することができるのは、感染の初期段階、あるいは潜在的に予防的にウイルス負荷を低く保つことで、体の免疫系が完全な抗ウイルス反応を起こす機会を持つようにすることであろう[44,59]。
致死性マウスPRVチャレンジ試験における前臨床試験では、感染後12時間後にイベルメクチン(0.2mg/kg)を投与すると50%のマウスが救われたが、感染時に同量を投与すると60%のマウスが救われたことが示されている[60]。発熱を呈し,デングウイルスの診断が確定した患者を対象としたヒト第III相臨床試験の結果では,1日投与(0.4mg/kgを3日間)はウイルスクリアランスの改善に安全かつ有効であることが示されたが,臨床的有用性を達成するためには投与時期に起因する可能性があり,投与レジメンの変更が必要であると著者らは結論づけている[61]。
現在のSARS-CoV-2パンデミックでは、すでに世界で6,700万人以上の感染と150万人以上の死亡者(米国だけで30万人近く[62])が発生している[63]。SARS-CoV-2は呼吸器系ウイルスであるため、標準的な0.2mg/kg投与によるヒト血清中のイベルメクチン濃度と大規模動物実験におけるロバストな測定値の両方に基づいた薬物動態モデリングにより、試験管内試験実験(表1)で示された2.5μM EC50の10倍以上のイベルメクチン濃度がヒト肺で達成可能である可能性が高いことが示されていることは注目に値する[64]。異なる仮定に基づくモデリングでは、より低い値が予測されるが、肺におけるイベルメクチンの長期安定性(>30日)が強調されている[65]。現在、SARS-CoV-2の治療または予防のために、投与レジメン、併用療法([69-71]も参照)予防プロトコルのバリエーションを含め、ほぼ80の臨床試験が世界的に進行中である[66-68]。COVID-19が確認された患者の無症状の家族の近親者を対象とした予防研究NCT04422561の予備的結果は、イベルメクチンの72時間間隔での2回投与(0.25mg/kg)が有効であり、その結果、症状発現の相対リスクが87%減少したことを示している(未投与群の58.4% vs イベルメクチン投与群の7.4%)。
イベルメクチンに関するレトロスペクティブ/観察的試験 [72-75] の結果もまた、SARS-CoV-2 感染症との関連において臨床的有用性と一致している。Mymensingh Medical College Hospital(バングラデシュ)では、イベルメクチン12mgの単回投与を受けた115人の被験者のうち、肺炎/心血管系合併症を発症した被験者はいなかったが、対照群133人の被験者では9.8%(肺炎)1.5%(虚血性脳卒中)であったと報告している[72]。イベルメクチン投与群では、SARS-CoV-2陰性化が早く(中央値4日 vs 15日)入院期間が短く(中央値9日 vs 15日)死亡率が低かった(0.9 vs 6.8%)。重要なことに、イベルメクチン投与群では、呼吸困難(2.6対15.8%)酸素吸入(9.6対45.9%)集中治療(0.09対8.3%)を必要とする患者が有意に少なかった。Broward Health Medical Centre(米国フロリダ州)で行われた196人の患者を対象としたコホート研究では、イベルメクチン(0.2mg/kg)を投与された被験者の死亡率(13.3%)が、投与されていない被験者の死亡率(24.5%)と比較して有意に低く、重度の肺病変を有する患者ではより有意な差が認められた(死亡率38.8対80.7%)。これらの初期の結果は有効性と一致しているが、SARS-CoV-2感染症の治療または予防に対するイベルメクチンの有用性は、大規模で厳格な無作為化臨床試験(RCT)[66,67]の結果のみであることは明らかである。
ウイルス性タンパク質標的阻害薬の前臨床/非臨床試験
IMPα/β1:ウイルス界面のウイルス側を標的とする低分子阻害剤のうち、ミフェプリストンのみが、これまでのところ臨床的に詳細に研究されている。ミフェプリストンは、HAdV感染マウスにおいて、ウイルス産生とウイルスDNAコピー数を減少させ、同時にHAdVゲノムの核インポートを阻害することが示された[53]。しかし、HIV患者を対象としたミフェプリストン(75-225mg/日)の第I/II相臨床試験では、安全で忍容性が高いことが示されたが、血漿HIV-1 RNAレベルやCD4+リンパ球数には有意な効果は認められなかった[76]。
フラビウイルス感染症の治療薬としての4-HPRの場合、その結果は今のところマウスモデルに限定されている。AG129マウスでは、4-HPRを180mg/kgで1日2回投与したところ(4-HPRの血漿中濃度は約15μM)デングウイルス2感染では50倍以上のウイルス感染が減少した[77]。AG129マウスのADE-デングウイルス1感染の致死的挑戦モデルでは、20mg/kgの4-HPRを1日1回投与すると20%のマウスが救われ、1日2回投与すると70%のマウスが救われた[15]。ZIKV感染症に対する有効性はAG129マウスでも認められ、4-HPR 60mg/kgを1日2回投与した場合、ウイルス感染症は約10倍に減少した[78]。様々な成人および小児固形癌を対象としたヒト第II/III相臨床試験では、4-HPRの血漿中トラフ濃度が7μMを超え(ピークは50μM以上)忍容性のある安全性プロファイルが達成可能であることが示されている[79,80]。これらの結果と、成人および小児における4-HPRの確立されたヒトにおける安全性および薬物動態プロファイルに基づいて、ヒト臨床試験が計画されており、デングウイルスに対する治療薬および潜在的な予防薬としての4-HPRのエキサイティングな可能性を調査している。
今後の展望
過去10年間で、宿主IMPα/β1:ウイルス界面を標的とした低分子が、強力な抗ウイルス活性を持ち、ヒト感染症を治療するための刺激的な可能性を持つことが明らかになってきた [66]。イベルメクチンのような宿主を標的とした「広範なスペクトル」阻害剤は、ライフサイクルの一部として同じ核輸入経路の必要性を共有する様々なウイルスに影響を与えることができるが、宿主細胞の機能にとってこれらの輸入経路の本質的な性質のため、潜在的な毒性を考慮しなければならない[4]。一方、4-HPRのようなウイルス標的阻害剤は、宿主タンパク質の核輸入を阻害しないため、毒性はないが、必然的に結果として抗ウイルス活性のスペクトルがより制限される[66]。
従来のHTS(例:[14-16])は、達成可能な濃度で特異的かつ有効な有望なリード化合物を同定するのに有効であることが証明されている。イベルメクチンや 4-HPR のような薬剤は、明らかにエキサイティングな見通しであるが、宿主 IMPα/β1:ウイルス軸を標的とする薬剤の可能性は、他の宿主 IMP:ウイルスインターフェースはもちろんのこと、まだまだ尽きることがない。これらのインターフェースや他のインターフェースを標的とする新規アプローチのさらなるHTSや開発は、既存および新興のウイルス病原体を制御するための新しい可能性のある薬剤を特定するという点で、現在の状況において有益であることが証明される可能性が高いことは明らかである。
展望
- 核インポートは、医学的に重要な様々なウイルスの感染サイクルに不可欠である。近年、IMPα/β1:ウイルス界面の宿主側またはウイルス側のいずれかを標的とした核輸入阻害剤が同定され、強力な抗ウイルス活性を有することが示されている。
- 宿主を標的とした核インポート阻害剤イベルメクチンは、COVID-19感染症の治療薬として、初期の段階で刺激的な結果を示している。フラビウイルスNS5の核輸入をウイルスを標的とした阻害剤である4-HPRは、将来の臨床試験に向けた有望な展望である。
- 核輸入のプロセス、特にIMPα/β1:ウイルス界面は、既存および新興のウイルス疾患に取り組むための抗ウイルス薬の将来の同定および開発のための実行可能なターゲットとして関心を集めている。
