コンテンツ
Body Localization of ACE-2: On the Trail of the Keyhole of SARS-CoV-2
オンラインで公開2020年12月3日
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7744810/
要旨
新型コロナウイルス(SARS-CoV-2)の爆発的なパンデミックにより、アンジオテンシン変換酵素2(ACE2)の役割が再び科学的に脚光を浴びるようになった。SARS-CoV-2はヒトの宿主細胞に侵入するためにACE2と結合しなければならないため、その発現と体内局在は、この感染症の潜在的な標的臓器を追跡し、疾患の進行と臨床転帰を概説する上で重要である。
ここでは、ACE2の生理的体内分布、発現、活性をマッピングし、その潜在的な相関性と、SARS-CoV-2患者に見られる様々な臓器レベルでの症状との変異的相互作用について議論した。我々は、SARS-CoV-2感染時にACE2を発現する臓器が直接の標的となり、重篤な病理学的症状やその後の多臓器不全を引き起こす可能性があるにもかかわらず、これらの臓器でACE2がどのように作用するのか、その正確なメカニズムや相互作用の可能性については、まだ多くの議論がなされていないことを明らかにした。
ACE2-SARS-CoV-2とCOVID-19との相互作用や長期的な健康影響について、患者の違いを考慮した個別化されたアプローチも考慮しながら、さらなる科学的努力が必要とされている。
キーワード
SARS-CoV-2,COVID-19,ACE2,ACE2受容体、体局在性
序論
SARS-CoV-2の臨床的特徴
2019年12月に発見されて以来、SARS-CoV-2誘導性肺炎として知られる新型コロナウイルスの感染によって引き起こされるコロナウイルス疾患(COVID-19)は 2020年10月までに全世界で3,780万人以上に感染し、108万人以上の死亡者を出している。COVID-19患者は主に発熱、息切れ、咳、痰の分泌、筋肉痛や倦怠感などの肺炎に関連する症状を呈していた(1,2)。
しかし、SARS-CoV-2感染症は呼吸器感染症であるにもかかわらず、腸や胃(下痢、食欲不振、吐き気、嘔吐、腹痛)肝臓(酵素値異常)膵臓(膵炎)腎臓(尿中の蛋白や血液、クレアチニン値異常)など多臓器に関連した症状を引き起こす可能性がある。脳(脳卒中、発作、錯乱、脳の炎症)心臓・血管(心臓損傷バイオマーカーの上昇、口蓋炎、胸部苦悶、心臓の炎症と損傷、不整脈、血栓)眼(結膜炎、目の前面と内眼瞼に並ぶ膜の炎症)鼻(無気力症)など(3-11)。
このように複数の臓器が関与していると、ウイルス感染の予後が悪くなり、しばしば入院や集中治療室(ICU)への入院が必要になることがある(12-14)。SARS-CoV-2による高い罹患率と死亡率のメカニズムは現在のところ不明であるが、公的データベースの利用可能な文献データに基づいて、年齢の上昇に伴って感染と死亡のリスクが増加することが知られており、また性二型を示すようであり、男性高齢者では感染と死亡のリスクが高いことが知られている(1, 2)。
また、COVID-19は健康な人も併存疾患を持つ人も感染する無差別疾患であるにもかかわらず、心血管疾患、高血圧、糖尿病、肥満、慢性肺疾患、癌などの既往症があると死亡率がさらに上昇することが報告されている(12-14)。これらの観察結果の背景にある生物学的メカニズムはまだ明らかにされていないが、ウイルスと宿主細胞の相互作用、免疫学的な違い、性に基づくホルモンの違いなどが関与している可能性が高い。
SARS-CoV-2とACE2の相互作用
SARS-CoV-2と宿主細胞の相互作用に関与するメカニズムは、細胞の感染と複製に重要な役割を果たしており、その結果、疾患や関連する損傷を引き起こすことになる。この文脈では、レニン-アンジオテンシン-アルドステロン系(RAAS)で重要な酵素であるアンジオテンシン変換酵素2(ACE2)が重要な役割を果たしていると考えられている(15,16)。
ACE2は、ACEのカウンターパートとして動作する:それはカルボキシペプチダーゼとして機能し、単一のアミノ酸を除去し、その代謝物であるアンジオテンシン-(1-7)(Ang1-7)に変換するAng IIの効果のバランスをとる。ACE2は、分極細胞の先端膜と基底膜の間に位置するACEとは異なり、上皮細胞の先端面に存在している。
ACE2は血圧を調節し、その結果として高血圧を引き起こすという極めて重要な役割を果たしている。この活性は、ACE2/Ang-(1-7)/Mas受容体軸によって媒介され、アンジオテンシンとAng-(1-7)および一酸化窒素(NO)の利用可能性を調節することによって血圧の変化を制御し、動脈硬化、肥大、より一般的には内皮の変化として血管組織に損傷を与える原因となる(17)。
ACE2には、(1)細胞外ドメインを細胞膜に固定できる構造的な膜貫通ドメインを持つ完全長ACE2と、(2)膜貫通ドメインを持たず、血液中を少量循環する可溶性ACE2がある(15, 16)。SARS-CoV-2は、ウイルスエンベロープに属し、「コロナ」のような形で外側に傾いているアミノ酸長タンパク質であるスパイク(S)ウイルスタンパク質がACE2受容体に結合することで細胞内に侵入する(16, 18)。
ウイルス侵入の最初のステップは、ウイルスタンパク質ユニットS1のN末端ドメインがACE2受容体のポケットに結合することで表される。この後、ACE2受容体に隣接するヘプシン/TMPRSSサブファミリーのメンバーである受容体膜貫通プロテアーゼセリン2(TMPRSS2)は、結合後の細胞内へのウイルスの侵入を促進するフーリンの助けを借りて、S1ユニットとS2ユニットの間のタンパク質の切断を誘導する(19,20)。
分泌経路のタンパク質を処理するサブチリシン様プロ蛋白質変換酵素ファミリーのメンバーであるフーリン[対塩基性アミノ酸切断酵素(PACE)とも呼ばれる]は、肺、肝臓、小腸などの複数の臓器で発現している。S糖タンパク質のACE2への結合に続いて、フーリンを介したSタンパク質のタンパク質分解的切断が、ウイルスの細胞内への侵入に必要である(18, 21)。したがって、TMPRSS2とフーリンの両方がSの活性化に極めて重要である。
これら、2つのプロテアーゼの重要な役割はまた、TMPRSS2およびフーリン活性を阻害することによって、Calu-3ヒト気道細胞におけるSARS-CoV-2の多サイクル複製が強く抑制されたことを示した最近の研究によって実証された(22)。
しかしながら、実質的には、他のヒトプロテアーゼ、例えば、カテプシンLおよびB、エラスターゼ、トリプシンおよび第X因子が、SARS-CoV-2のヒト細胞内への侵入およびACE2の脱落に関与している可能性がある。膜からの ACE2 の内因性脱落に関与する重要な細胞膜プロテアーゼは、腫瘍壊死因子α変換酵素(TACE)としても知られているジスインテグリンメタロプロテアーゼ 17(ADAM17)である(23)。TMPRSS2がACE2とSARS-CoV-2のSタンパク質の両方を切断し、膜融合とウイルスの細胞内取り込みを導くのに対し、ADAM17はACE2に直接かつ単独で作用し、ACE2の細胞外空間への脱落を導く。
このように、ADAM17とTMPRSS2は、ACE2の脱落に対して逆の作用をする可能性がある。TMPRSS2の発現は、ADAM17によるACE2の脱落を抑制することが示されている(24)。しかし、SARS-CoV-2感染時にTMPRSS2がどのようにしてADAM17を越えてACE2を切断するのかは不明である。
これまでに多くの情報が得られているにもかかわらず、SARS-CoV-2細胞感染におけるACE2の役割や、SARS-CoV-2 Sタンパク質を処理するプロテアーゼの正確な役割は明らかにされていない。確かに、遺伝学的特徴や人口統計学的特徴、ライフスタイル、併存疾患、薬の使用などが、SARS-CoV-2細胞感染におけるACE2の発現や活性に影響を与えている可能性がある。
COVID-19の重症度とACE2発現の危険因子
ACE2 は X 染色体上にマップする遺伝子(Xp22.2)によって制御されていることから、ACE2 の発現には男女間で差があることが示唆されている(25)。女性では、X染色体上に二重コピーで存在する遺伝子の産物の重複発現を防ぐために、2本の染色体のうちの1本で生理的なランダム不活性化が起こる(25)。不活化に逃れて残った染色体部分と、これらの領域に存在する遺伝子(〜15%)は、女性では過剰発現する可能性がある(25)。
ACE2は、2本のX染色体のうちの1本の不活性化を逃れるこれらの領域に正確にコードされており、女性においてACE2の発現がより大きいという仮説を支持している(25)。ACE2組織レベルもまた、ACE2受容体の存在を増加させることができるエストロゲンによって調節されているという証拠がある(26)。
したがって、文献のいくつかの解説で報告されているように、全身のACE2の存在が組織をSARS-Cov-2感染に対してより脆弱にする可能性があるとすれば、女性は男性よりもウイルスに対してより素因性が高いはずである(26)。
逆に、世界保健機関(WHO)の疫学データでは、SARS-CoV-2の臨床における性差が強調されており、男性患者、特に高齢者の死亡率が高いことが示されている(27)。この最新の情報でさえ、全身のACE2が組織をSARS-CoV-2感染に対してより脆弱にするという仮説とは対照的であるように見える。
実際、ACE2のレベルは加齢とともに低下し、若年者では重症度の低いCOVID-19を発症することが多いようであることが示されている(26)。ACE2受容体に対するウイルスの親和性の高さを考えると、軽度・中等度のACE2欠乏がSARS-CoV-2感染を予防するという反対の仮説もあり得ないことを強調しておくことが重要である。さらに、後者の仮説は、ACE2欠損の程度の違いが、糖尿病、肥満、心血管疾患など、SARS-CoV-2に感染しやすく、重篤な合併症を起こしやすい特定の疾患と関連していることから、この仮説も成り立たないと考えられる。これらの矛盾は、例えば、臓器特異的なACE2の分布および発現レベル、ならびに潜在的な共発現および特定のプロテアーゼとの相互作用などの他の因子が、SARS-CoV-2の重症化に寄与する可能性があることを強調している。
肺の炎症がSARS-CoV-2感染中の主な症状の一つであることが実証されているが、肺は、すべての臓器の中で、ACE2の中等度の発現を示し、上述のように、SARS-CoV-2は、他の臓器、すなわち、ACE2の高発現から中等度の発現を有する臓器に影響を及ぼす可能性がある。この文脈では、ACE2の生理的臓器特異的な分布、発現、および活性の詳細なマップを、臓器特異的な性別の偏りやよく考慮されていない臓器(特定の脳領域、口腔、甲状腺、膵臓、十二指腸、結腸、直腸、胆嚢)も考慮して作成した。また、これらの臓器とSARS-CoV-2との関連性を網羅的に理解することは、ウイルス感受性の臨床症状や機序の理解だけでなく、潜在的な感染経路の理解にも貢献すると考えられる。
ヒト生理学のACE2。体内局在・発現・機能・活動
約20年前、72の組織におけるACE2のマッピングが最初の論文で報告された(28)。年月を経て、ACE2の局在化は非常に厄介なものであることがますます明らかになってきた(28)。腎組織や循環器組織での局在から始まり、消化管のように当初は痕跡が検出されなかった組織や臓器にもACE2が存在することが時間の経過とともに明らかになっていた(図1)が、最近では循環白血球など、これまでACE2が存在しないと考えられていた場所でもわずかに陽性であることが報告されている(29-31)。
図1 ヒトの臓器におけるACE2発現の模式図
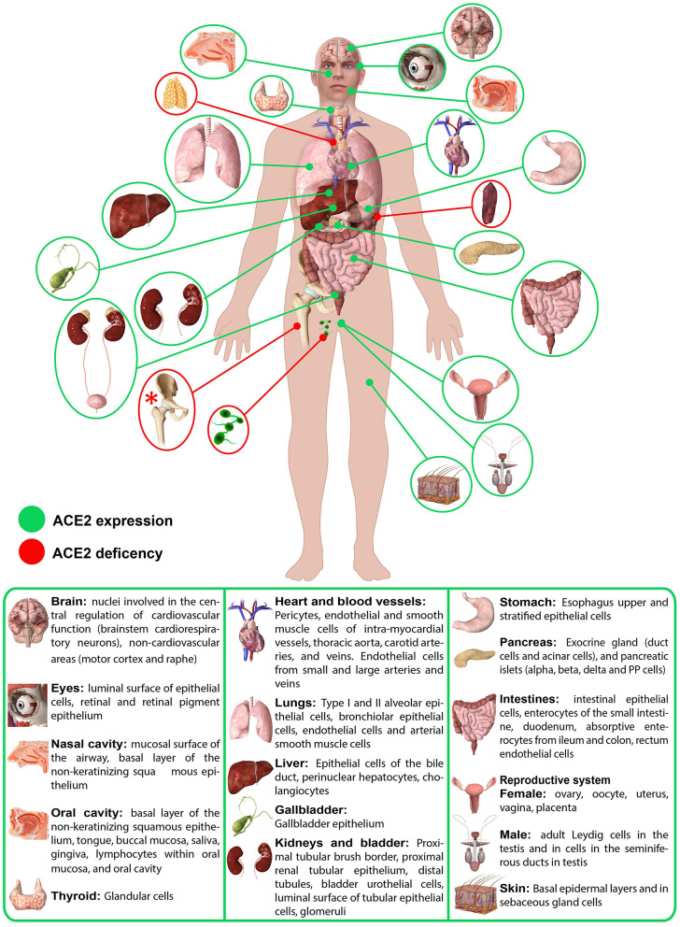
ACE2 mRNAはすべての臓器に存在する(28)。ACE2タンパク質の発現は、心臓、腎臓、精巣、肺(I型およびII型肺胞上皮細胞)鼻、口腔粘膜および鼻咽頭(非角化扁平上皮の基底層)胃、小腸および結腸の血管の平滑筋細胞および内皮、筋肉粘膜および筋肉前庭の平滑筋細胞に存在する。十二指腸、空腸、回腸(ただし、結腸)皮膚(皮脂腺、エクリン腺の細胞を取り囲む毛包平滑筋細胞の基底細胞層まで伸びる表皮の基底細胞層)内皮、および脳の平滑筋細胞(28)を含む小腸のすべての部分の腸球で。赤色のアスタリスク(*)。ACE2欠乏症は仮説のみ。
ACE2受容体は、呼吸器系の上皮(気管・気管支上皮細胞、肺胞上皮細胞、2型肺細胞)循環器系の上皮(冠動脈内皮、心筋細胞、心外膜脂肪細胞、血管内皮細胞、平滑筋細胞)のレベルでも発現していることは間違いない。消化管(食道ケラチノサイト、消化管上皮細胞、腸管上皮細胞、十二指腸、小腸、直腸)泌尿生殖器系(腎臓近位尿細管、膀胱尿路上皮細胞、尿細管上皮細胞の管腔表面、精巣、精液小胞)肝臓、胆嚢、神経系の各組織で発現している(25, 28, 32)。(25, 28, 32) しかし、mRNAはすべての組織で均一に発現しているように見えるが、タンパク質の発現については必ずしも同じではないということを強調しておくことが重要である(図1) (28)(28)。
長年にわたる多くの研究は、レニン-アンジオテンシン系(RAS)系の機能のために、また心臓病における新しい治療標的の研究のために、心血管系におけるACE2の役割に焦点を当ててきた(15, 16)。ACE2は血管組織の保護因子として認識されており、アンジオテンシンIIの作用のバランスをとり、内皮を保護し、再生のメカニズムを促進する(15)。直感的には、ACE2の障害は、アテローム性動脈硬化の増加、および内皮損傷を伴う重度の心機能障害につながる。ACE2は高血圧モデルでも研究されており、遺伝的変異が男性の収縮期機能と女性の心室容積に影響を与えることから、ACE2は高血圧モデルでも研究されている(33)。偶然ではないが、心筋損傷後に遺伝子レベルとタンパク質発現の両方で、また循環可溶性形態でもACE2のレベルが上昇していることが検出され、心臓バイオマーカーとしての役割の可能性が示唆されている(15)。心臓の変化は通常、甲状腺機能障害、特に甲状腺機能亢進症と相関している(34)。甲状腺ホルモンはACE2の発現にも作用し、受容体遺伝子の発現に影響を与え、肺内皮からのACEの放出を調節すると考えられている(35)。甲状腺がんでは、がんの分化度に比例してACE2/ACE比が増加し、ACE2の発現量が増加することが観察されており、がんマーカーとしても研究されている(36)。
ACE2は心血管系の制御を担う神経細胞領域で発現しているため、心筋梗塞時には発現が低下するが、脳内で過剰に発現すると炎症性サイトカインの減少やNO活性の増強を介して保護作用を示す(37)。脳におけるACE2の役割を研究するために、多くの動物モデルが使用されてきた。視床下部におけるACE2の降圧作用と交感神経作用は、Ang IIの低下とAng-(1-7)レベルの上昇を介しており、脳卒中からの神経細胞の回復にACE2のポジティブな効果があることがデータから明らかになっている(38)。ACE2 は、脳由来の神経栄養因子の発現調節や活性酸素の産生を介して記憶のメカニズムにも関与しており、ストレス応答、視床下部レベルでのコルチコトロピン放出ホルモンの調節、前駆体トリプトファンの利用可能性に依存したセロトニンレベルに関連する神経発生にも関与している(39, 40)。
トリプトファン合成とACE2の間には、多くの系で活性が交差し、その機能が結合している。実際、RAS を介した恒常性維持に関与する ACE2 は、腸内レベルでマイクロバイオームを制御し、アミノ酸の取り込みや抗菌ペプチドの発現に作用している(41)。ACE2 は小腸で中性アミノ酸トランスポーターである B0AT1 と結合してアミノ酸トランスポーターとして作用し、ACE2 欠乏症の動物モデルでは血中トリプトファン濃度の低下が示されている(42)。この減少は、大腸のレベルでの大きな炎症、内皮の変化と損傷反応への能力の低下と腸に反映され、また、哺乳類のラパマイシンの標的(mTOR)経路、タンパク質キナーゼのホスファチジルイノシトール3キナーゼ関連キナーゼファミリーのメンバーが関与している(43)。腸は最高レベルの ACE2 を発現することが知られているため、数年の間に腸にも注目が集まってた (28)。
ACE2 は腸内に局在するほか、胃や大腸の血管の平滑筋細胞や内皮、筋肉粘膜の平滑筋細胞、近位筋にも存在していた (28)。また、十二指腸、空腸、回腸を含む小腸のすべての部位の腸球にACE2が多く存在していたが、大腸の腸球には存在しなかった(28)。
消化管以外にも腎臓や膵臓でもACE2が発見されており、腎臓の近位尿細管の先端表面積や膵臓のアキニや膵島にもACE2と同様の転位が認められている(28)。膵臓では、ACE2 の存在が血圧や NO 放出の調節を介して膵島の状態に影響を与えるとともに、組織の線維化にも作用している(44)。ACE2 の役割は糖尿病の発症においても広く研究されており、ACE2 欠乏は第一期インスリン分泌障害や耐糖能障害と関連している(45-47)。RAS系の変化、特にACE2活性の変化は、NO産生のアンバランスによる膵島の変化を誘導し、血流に影響を与え、二次的にグルコースの利用可能性にも影響を与える(45-47)。
腎臓でのACE2の発現量が多いことは、この臓器におけるRAS系の重要な役割を考えると、驚くべきことではない。ACE2はRAS活性のバランスをとるように作用し、腎の恒常性を調節しており、その活性は血圧の全身的な調節よりも局所的な調節に関係していると推測されている(48)。ACE2の減少の影響は、蛋白尿、特にアルブミン尿、糸球体疾患を促進し、尿細管レベルでのACE2発現が低下する糖尿病性腎症に関連していると記述されている(48)。
肝のグルコース代謝における ACE2 の役割は完全に調査されていないにもかかわらず、ACE2 経路の変化は、この局在においても、代謝活動の障害、特にインスリン抵抗性の開発に関連している (48)。肝臓のACE2は、内皮細胞、胆管細胞、核周囲の肝細胞で発現しており、そのほとんどが肝線維抵抗性で上昇していることがわかっている(28)。特筆すべきは、インスリン抵抗性は内皮依存性およびインスリン介在性血管拡張と相関していることである(46,49)。さらに、ヒトタンパク質アトラスデータベースの最近のRNA-seqデータは、肝胆管細胞でACE2の発現が最も高く、次いで肝細胞であることを示している(50)
ACE2の発現は感覚器官と相関しているようである。しかし、実際の眼球レベルでのACE2の発現はまだ議論の対象となっているようである。ACE2はRAS系の構成要素の中では最も発現量が少ないが、粘液中では検出可能である(51, 52)。ヒト結膜におけるACE2のmRNAの存在と免疫反応性は有意ではないとする論文もあれば(53)、ヒト結膜と原発性翼状組織の両方でACE2遺伝子の発現が検出可能であるとする論文もある(54)。
ACE2は頬や歯肉よりも口腔レベル、特に口腔舌で発現しており、上皮細胞、T細胞(<0.5%)、B細胞(<0.5%)、線維芽細胞(<0.5%)で発現していることがわかった(31)。さらに、口腔粘膜および鼻咽頭では、非角化扁平上皮の基底層でACE2の発現が認められた(55)。また、鼻由来のヒト気道組織の繊毛化気道上皮細胞にもヒトACE2が検出された(55)。
耳レベルでの ACE2 の存在に関しては、ヒトでのデータはなかった。しかし、最近のオンライン研究では、猫の耳の先端でACE2が高発現していることが判明した(56)。
ACE2 が検出されたもう一つの感覚器官は皮膚レベルである(57)。細胞の増殖や分化を制御するRAS系の活性は、組織の損傷時にも損傷細胞の自己再生や新生血管新生のメカニズムに反映されており、表皮幹細胞はACE2を含むこの系の異なるプレーヤーを発現している(57)。健康な患者およびがん患者におけるACE2の存在を免疫組織化学的に評価すると、正常な表皮および皮脂腺の基底細胞層にACE2が存在し、前悪性病変(光線性角化症)および非黒色腫悪性皮膚癌(基底細胞癌および扁平上皮癌)に罹患した患者ではACE2の反応性が低下することが示され、疾患の病態への関与が示唆されている(58)。
月経周期におけるアンジオテンシンIIの役割を考えると、女性の生殖系におけるACE2の存在は非常に直感的に見える。実際、AngIIは卵胞期、排卵期、黄体期に作用し、卵胞の発達、卵母細胞の成熟、黄体進行に影響を与え、ステロイドホルモンのレベルをバランスさせる(59)。さらに、螺旋状動脈の血管収縮と子宮レベルでの子宮内膜の再生を促進する。アンジオテンシンⅡは、子宮内膜線維化および子宮内膜転移の担い手としても同定されている(59)。
驚くことではないが、妊娠中、ACE2/AngII/Ang1-7軸は血圧の維持に関与しており、この経路の変化は子癇前症や子癇症などの障害と相関しており、ACE2発現の低下は妊娠や胎児の出生に悪影響を及ぼす(60)。また、ACE2の発現は精巣、特に精母体、ライディッヒ細胞、セルトリ細胞でも検出されており、精子形成や精巣の機能的・構造的完全性の維持との相関が考えられている(61)。
最後に、多数の臓器、組織、細胞におけるACE2の存在は完全には解明されておらず、まだ調査されていないものも多いにもかかわらず、脾臓、胸腺、リンパ節、骨髄、免疫系のいくつかの細胞にはACE2は存在しないようである(15, 62)。
しかし、骨髄にはRAS系のすべてのプレーヤーが存在し、細胞増殖や骨髄抑制後の造血修復にも作用しており、ACE2は特にCD34+増殖に関与していると考えられていることから、骨髄におけるACE2の発現に関する多くの研究が現在進行中であることを強調しておくことが重要である(63)。
COVID-19パンデミックが進行している現在、ACE2の体内での分布、発現、活動を迅速に概観することは、SARS-CoV-2の体内を介した潜在的な感染経路についての理解を深め、改善することにつながると考えられる。したがって、では、特定の標的臓器におけるACE2の存在、分布、および豊富さが、COVID-19の臨床症状および症状とどのように関連しているかについて議論する。
SARS-COV-2の臨床的意義およびACE2との潜在的な相互作用
鼻腔
2020年10月5日、PubMed “COVID-19 OR COVID-2019 OR 重症急性呼吸器症候群コロナウイルス2 OR 重症急性呼吸器症候群コロナウイルス2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND コロナウイルス) AND (鼻腔 OR 鼻腔) “で検索したところ、388件の論文が見つかった。ほとんどの研究は、COVID-19感染症のスクリーニングのための鼻腔・口腔スワブ手順の実施方法に関するガイドラインでした。その他の研究では、COVID-19患者のさまざまな鼻症状を検出、分析、考察していた(64)。鼻咽頭症状はCOVID-19の一般的な症状であり、特に軽症または中等症の場合に見られた(65, 66)。
鼻腔および鼻甲介は、吸入された空気をろ過し、温め、加湿するという重要な生理的機能を有しており、鼻腔はウイルス侵入の主要なゲートウェイであるため、これらの機能はSARS-CoV-2感染時には極めて重要である。
実際、鼻腔内の上皮細胞はウイルスの早期発見に適した臨床サンプルと考えられている。SARS-CoV-2陽性患者では、嗅覚機能障害、嗅覚異常、カコスミア、ファントスミア鼻閉塞や鼻漏、鼻づまりなどの報告が増えている(1, 67-73)1。
また、いくつかのデータでは、他の症状を伴わない単離性の無気力症を有するSARS-CoV-2陽性患者を報告しており、これらの患者は急速なウイルス拡散の潜在的な源であることを示唆している(68,69,74)。SARS-CoV-2陽性患者の無嗅覚症は、一次症状として、または初期症状として現れることがあり、調査した研究では、6~80%の割合で、異なる割合で認められている(1, 70-73, 75)。Lechienらは、12日以下の無嗅覚症の患者の約87%がPCR SARS-CoV-2陽性であったことを示している(73)。
さらに、Kayeらは、COVID-19の患者237人を対象とした裁判を分析し、73%の患者が無嗅覚症を報告し、26.6%の患者が初期症状として嗅覚の喪失を報告していることを示している(70)。40歳以下の患者、特に女性は、低嗅覚症/無嗅覚症のみを呈するSARS-CoV-2型を発症しやすいようである(1, 69-72)。
しかし、アジアの研究では、ヨーロッパの患者に比べて嗅覚機能障害を有する患者の割合が低いことが報告されている(73)。このことは、アジア人とヨーロッパ人の間でACE2多型と発現レベルが多様であることに起因していると考えられる(74)。SARS-CoV-2患者における嗅覚障害は、局所的な嗅裂浮腫、嗅神経上皮の建築的奇形、または嗅神経経路の直接的な神経浸潤など、様々な要因によって引き起こされる可能性がある。以上のように、遺伝子発現データベースは、ヒト嗅粘膜においてACE2の発現が中程度から高程度であることを強調していることを強調しておくことが重要である(76)。
しかし、嗅覚上皮におけるACE2の発現が神経性なのか非神経性なのか、あるいは両方の細胞型で発現しているのかについては、現在のところ完全には明らかになっていない(77, 78)。SARS-CoV-2の脳感染は、繊毛状樹状突起/腫瘤に吸収され、その結果、嗅神経に沿った軸索前向性輸送を介した宿主受容体の神経性発現によって促進される可能性がある(79, 80)。
ACE2の非神経性発現については、鼻腔嗅上皮がウイルスの貯蔵庫として機能することが考えられる(79, 80)。ヒトおよびマウスの嗅覚上皮を用いたいくつかのRNaseqトランスクリプトームの報告では、TMPRSS2と同様にACE2の非神経性発現が示唆されている(79-82)が、これらの知見を確認するためにはさらなる研究が必要である。また、鼻腔のブラッシング上皮細胞、鼻の鼻甲介上皮細胞、鼻の気道上皮細胞には、ACE2発現細胞とTMPRSS2発現細胞のクラスターが存在することが示された(82)。
口腔
2020年10月5日、PubMed “COVID-19 OR COVID-2019 OR severe acute respiratory syndrome coronavirus 2 OR severe acute respiratory syndrome coronavirus 2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND coronavirus) AND oral cavity “で検索すると218件の論文が見つかった。
いくつかの研究では、口腔粘膜内膜細胞の直接感染を介して、呼吸器管からの飛沫を介して、歯肉粘膜液による血液循環から、または感染した細胞や組織から放出された細胞外小胞を介して、いくつかの潜在的な経路で口腔内への侵入を介して唾液中のSARS-CoV-2の存在を評価していた(83)。
Toらは、唾液サンプルの約92%でSARS-CoV-2がPCRによって検出されることを確認しており、唾液がSARS-CoV-2拡散の潜在的な供給源であることを示している(84)。患者の唾液中のSARS-CoV-2の存在はまた、唾液腺感染の可能性を示唆した。Chenらは、唾液腺から直接唾液を採取し、SARS-CoV-2核酸を発見し、唾液腺がSARS-CoV-2に感染していたという仮説を立てた(85)。この仮説は、唾液腺のACE2上皮細胞がSARS-CoV-2の初期標的であることが示されていることによって、さらに補強されている(86)。さらに、細胞プロテアーゼフーリンおよびTMPRSS2のmRNAおよびタンパク質レベルの高レベルも唾液腺で発見されている(86)。したがって、SARS-CoV-2の最初の侵入と進行における唾液腺細胞の役割と機能の可能性は、さらに検討され、検証されなければならず、また、数ヶ月間続く可能性のある持続的な感染を確立することができるウイルスの貯蔵庫としての機能の可能性も検証されなければならない (87)。さらに、唾液サンプルは唾液腺から分泌される唾液だけでなく、鼻咽頭からの分泌物と気道を覆う繊毛の作用を介して肺からの分泌物も含まれていることを強調する必要がある。したがって、より多くの研究は、唾液中の SARS-CoV-2 の本当のソースと機能を明確にする必要がある。
口腔に関連するもう一つの点は、SARS-CoV-2感染の頻繁な症状として、急性味覚喪失(低味覚/ageusia)が多くの研究で報告されていることで表されており、特に女性や若い人(~20~39歳)に多い(1, 84, 85)。最近の症例シリーズでは、SARS-CoV-2感染症のいくつかの症例で味覚喪失が口腔病変と関連していた(88)。
これらの病変は2つの異なるパターンを示し、1つはCOVID-19の軽症例の若年者における無咽頭様潰瘍に類似したものであり、もう1つはより重症で免疫抑制下にある高齢者における単純ヘルペスウイルス1の壊死性潰瘍に類似したより広範なパターンであった(89)。これらの病変がSARS-CoV-2による直接的なものなのか、それとも患者の重症化した状態に起因する関連症状なのかは、まだ明らかにされていない。しかしながら、味覚障害が広範な種類のウイルス感染症と関連していることがわかっている(90)。
上気道感染は、嗅上皮に対するウイルスの損傷により、急性発症の老年期障害を引き起こす可能性がある(90)。さらに、以前に鼻腔で報告されたように、ウイルスは中枢神経系(CNS)への経路として嗅神経を利用することができる。したがって、加齢臭は嗅覚機能障害の二次的な結果である可能性がある。しかし、ACE2は唾液腺や口腔組織に広く発現しているだけでなく、その発現は頬や歯肉よりも舌の方が高かったことを強調しておくことが重要だ(https://gtexportal.org)。さらに、ACE2陽性細胞は上皮細胞に富み、口腔粘膜上皮細胞の損傷がSARS-CoV-2患者で検出された加齢、口腔粘膜潰瘍、壊死を説明する可能性がある(31, 91)。また、口腔粘膜内のACE2はリンパ球にも発現していることが報告されており、消化器系の他の臓器でも同様の結果が報告されている(31)。しかし、ACE2陽性のリンパ球は非常に少ないため、このことがSARS-CoV-2がリンパ球を攻撃して重症化することを示しているのかどうかについては、今後の研究が必要である(31)。さらに一般的には、SARS-CoV-2が媒介する味覚障害はまだ確定的には同定されていない。
目
2020年10月5日にPubMed “COVID-19 OR COVID-2019 OR 重症急性呼吸器症候群コロナウイルス2 OR 重症急性呼吸器症候群コロナウイルス2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND コロナウイルス) AND (目 OR 眼の顕在化)で検索すると820件の論文が見つかった。そのほとんどが、SARS-CoV-2感染の予防・予防に関する眼科学会の公式勧告や、COVID-19発生が眼科医療に与える影響に関する研究であった。
現在、結膜炎と一致し、結膜充血、ケモシス、点滴、または分泌物の増加を含む、SARS-CoV-2感染症における眼症状の存在と有病率については、まだ議論の余地がある(92-95)。SARS-CoV-2陽性患者のごく一部(約1~6%)が結膜炎を発症したと報告されているにもかかわらず、他の研究ではSARS-CoV-2入院患者の31%までが結膜炎を呈したと報告されている(96-99)。
Wuらは、COVID-19患者の約31.6%に眼球異常が認められ、COVID-19患者の重症例では眼球症状がより頻繁に認められたことを示した(97)。実際、COVID-19患者の約50%の眼球異常は重症に分類され、16.7%が重症、33.3%が中等症に分類されていた(97)。
結膜炎に加えて、COVID-19の重症度と直接相関する他の眼の異常は、網膜とその血管系の変化であるように思われる(100)。COVID-19患者の網膜を評価した最近の研究では、全身症状の発症から30日以内に、より重症な症例では網膜動脈と静脈の肥大が認められ、症状の発症までの時間と逆の相関関係が示されている(100)。これに関連して、Casagrandeらは、ヒト網膜COVID-19患者におけるSARS-CoV-2核酸の存在を実証している(101)。
追加の研究はまた、結膜炎を有するCOVID-19患者の涙膜および/または結膜スワブ中のSARS-CoV-2 RNAの存在を強調したが、眼症状のない患者では存在しなかった(98, 102-105)。これとは異なり、Xieらは結膜炎のないCOVID-19患者の正常な眼表面にもSARS-CoV-2 RNAが存在することを示した(106)。この点についてはまだ議論されていないが、眼球表面は呼吸器ウイルスやコロナウイルスに大きなトロピズムを持っていることを強調しておくことが重要である(107, 108)。
SARS-CoV-2がヒトの網膜や結膜細胞に特異的に感染するかどうかは不明だ。現在の文献に基づいて、いくつかの報告では、眼球表面がSARS-CoV-2に曝露されることで、鼻涙管、特に涙管を介して、眼球表面から鼻腔内に涙を排出し、気道にウイルス粒子が排出されるために感染するのではないかという仮説が立てられている(109, 110)。この文脈では、他の報告でも角膜および結膜上のACE2およびTMPRSS2の存在をウイルスの可能性のある経路として考慮していることを強調することが重要だ(56, 111, 112)。角膜細胞上のACE2およびTMPRSS2の存在は、ウイルスが眼球表面を横切り、その後、眼から血流および/または神経系(三叉神経の眼科分枝)を介して体の他の部分に広がることを可能にする可能性がある(112,113)。しかし、現在までのところ、ヒトのSARS-CoV-2ウイルスが眼球内に侵入したり、角膜神経を介して脳に広がったりするという明確な証拠はない(114)。
肺
2020年10月5日にPubMed “COVID-19 OR COVID-2019 OR 重症急性呼吸器症候群コロナウイルス2 OR 重症急性呼吸器症候群コロナウイルス2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND コロナウイルス) AND 肺 “で検索すると、4,138件の論文が見つかった。SARS-CoV-2は多くの臓器系で検出されたが、肺はウイルスの影響を受ける主な臓器であるようだ(96, 115)。
実際、上気道と肺がウイルスの侵入と複製の優勢な部位として機能し、SARS-CoV-2患者が肺炎と肺胞障害の症状を示したことが知られている(116)。SARS-CoV-2患者の最も一般的で重篤な合併症は、急性低酸素血症性呼吸不全または急性呼吸窮迫症候群であり、酸素および換気療法が必要となる(1, 117-135)。これらの重症患者の中には、挿管や侵襲的人工呼吸を必要とするものもあった。SARS-CoV-2 陽性患者の肺の放射線画像とコンピュータ断層撮影(CT)スキャンは、感染の重症度に関する多くの情報を提供し、患者の約 86%で異常な結果を示した(1,117-135)。
放射線画像やCTスキャンで最も一般的なパターンは、地被膜不透明、圧密、遠心結節、建築的歪み、気管支壁肥厚、血管肥大、牽引性気管支拡張、網状化、狂い敷きパターン、胸腔内リンパ節肥大、胸膜下帯であり、肺の不快感を引き起こし、迅速な診断と治療が必要であった(1, 117-135)。また、剖検の結果、約48%の症例では、毛細血管のうっ血、微小血栓、中等度の肺胞内フィブリン滲出が主な病理組織学的所見であり、滲出性播種性肺胞損傷と重畳性気管支肺炎を呈していることが明らかになった(135)。肺の線維化の進展が大きい肺胞損傷のより広範な組織学的パターンは、長期の機械的換気の後に死亡した患者で観察された(136)。少数の症例では、好中球性顆粒球の肺胞内沈着も検出されたが、これはおそらく細菌感染が重畳したためであろう(137)。
さまざまな臓器におけるACE2の分布は、SARS-CoV-2感染の臨床症状と顕著に関連しているようであり、急性呼吸窮迫症候群はSARS-CoV-2の潜在的な致命的合併症であるため、ACE2ダウンレギュレーションの肺合併症に関する研究は、この文脈において重要な意味を持つ。肺障害に関するいくつかの研究では、ACE2受容体のダウンレギュレーションが呼吸器系の重要な炎症性病変(肺胞壁の肥厚、浮腫、炎症細胞の浸潤、出血)を引き起こすことが強調されており、これらの病変はアンジオテンシンIIによって引き起こされているようである(135,138-142)。
注目すべきポイントは、肺胞上皮細胞の広い表面が、肺のウイルス侵入に対する脆弱性を説明しているのではないかということである。以前に説明したように、ACE2は主にII型肺炎球に発現しているが、これは全肺炎球の5%に相当する小さな円筒形の細胞である(1)。これらのタイプの肺炎球は免疫調節機能を発揮し、肺胞界面活性剤の産生に重要な役割を果たしており、また、全肺炎球の95%を占め、ガス交換を担うI型肺炎球の前駆細胞である幹細胞としても機能している(142)。このように、SARS-CoV-2のACE2受容体への結合によるII型肺炎球の損傷は、いくつかの要因、すなわち、局所的なACE→アンジオテンシンII→AT1受容体軸の過剰活性化、損傷を受けたII型肺炎球による肺胞界面活性剤の産生低下による肺の弾力性の低下、そして最後に、ガス交換の障害と線維化をもたらすI型肺炎球の修復の低下にとって極めて重要だ(143)。
ACE2は気管支上皮およびタイプ2肺炎球に発現しているが、TMPRSS2は気管支および肺胞上皮細胞の細胞質に強く発現している(144)。ACE2は肺胞上皮細胞上にも肺全体とほぼ同じレベルで存在していることがわかっていたため、佐藤らはTMPRSS2の発現レベルが肺の末梢部と中央部でかなり異なることを発見した(145)。このことから、肺の末梢部ではACE2とともにTMPRSS2が強く発現していることから、SARS-CoV-2は感染初期に末梢部にダメージを与えていると考えられる。これらのデータは、胸部CTでCOVID-19例の両側末梢葉に圧密とグランドガラスの不透明性が認められた理由を説明している(146)。しかし、これらの因子は、初期のウイルス侵入に対する免疫応答の変化、または高炎症および血栓症に対する遺伝的感受性を含む他の機序の同時的な役割を妨げることさえできないであろう(8,147)。SARS-CoV-2肺炎では、血栓症はガス交換異常および多臓器機能障害において直接的かつ重要な役割を果たしている可能性がある。残念ながら、現在までのところ、SARS-CoV-2によって影響を受ける他のすべての臓器と同様に、この新しい感染症における肺の機能障害については、さらに明らかにされていない。
心臓と血管
2020年10月5日にPubMed “COVID-19 OR COVID-2019 OR severe acute respiratory syndrome coronavirus 2 OR severe acute respiratory syndrome coronavirus 2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND coronavirus) AND (循環器系 OR 心臓 OR 血管)で検索したところ、3,170件の論文が見つかった。これらの報告のほとんどで、SARS-CoV-2 感染における最も重要な症状として心血管系の合併症が浮上した(148-155)。
心筋炎、急性冠症候群、代償性心不全、肺塞栓症、心原性ショック、心臓移植患者の感染など、クレアチンキナーゼイソエンザイム-MB、ミオヘモグロビン、心筋トロポニンI、N末端プロ脳内ナトリウム利尿ペプチドのレベルの変化を伴うさまざまな心血管系合併症が報告されている(1, 149-155)。さらに、重症SARS-CoV-2患者では、高血圧、冠動脈疾患などの既往の心血管系病的疾患の高い有病率が検出されている(1,149,156)。また、COVID-19患者では、心血管疾患の既往があり、心筋トロポニン値が上昇している場合に最も高い死亡率が認められた(137,157)。さらに、心筋トロポニン値が高い患者では、C反応性タンパク質、インターロイキン(IL)-6,フェリチン、乳酸脱水素酵素(LDH)高好中球数、高アミノ末端プロB型ナトリウム利尿ペプチドなどの炎症のマーカーも上昇していた(158)。
当初、心血管疾患を有し、ACE阻害薬(ACEi)またはアンジオテンシン受容体拮抗薬(ARB)で治療されたCOVID-19患者は重症SARS-CoV-2感染症のリスクが高いという仮説が立てられていたにもかかわらず(155,159,160)高血圧症を有するCOVID-19患者を対象とした最近のレトロスペクティブ研究では、ACEI/ARB療法が炎症反応を減衰させることが示された(161)。さらに、高血圧症のSARS-CoV-2患者を対象とした研究では、ACEi/ARB治療を受けた患者の割合は、重症感染者と非重症感染者、および生存者と非生存者の間で差がないことが示された(162)。しかしながら、COVID-19におけるACEi/ARBの陽性または陰性の効果を理解することは複雑であり、これはウイルスの臨床段階(ウイルス汚染期と組織炎症期)によるものである可能性もある。この問題に関するいくつかの臨床試験が予定されている(NCT04329195,NCT04331574,NCT04351581,NCT04353596)。
現在までのところ、SARS-CoV-2が心臓症状を引き起こすメカニズムは明らかになっていない。これらの機序には、ウイルスによる直接的な損傷や炎症性サイトカインによる免疫介在性の損傷(すなわち、全身性心毒性サイトカインストーム)細胞傷害性免疫細胞応答などのいくつかの要因が関与していると考えられる。前節で報告したように、心臓組織は高いACE2発現レベルを呈している(163)。具体的には、心臓由来の心筋細胞には約6%のACE2発現細胞と0.8%のTMPRSS2発現細胞が存在し、心血管前駆細胞には12.5%のACE2発現細胞と0.4%のTMPRSS2発現細胞が存在することが示されており、SARS-CoV-2が心筋組織に直接感染する可能性があることが示されている(82)。さらに、フーリンは、ACE2受容体を介してSARS-CoV-2に有害な心血管系イベントを引き起こす重要な分子であると考えられる。この推測は、COVID-19患者の末梢血中に高レベルのフーリンが発生していることからも裏付けられている(164)。
さらに、PCR解析はまた、感染した患者の約35%の心臓組織においてSARS-CoV-2を同定し、直接的なウイルス障害が起こりうることをさらに支持している(165)。マウスモデルを用いたKubaらの研究では、SARS-CoV肺感染はACE2依存性の心筋感染を引き起こすことが示されている(138)。この感染は局所的な炎症反応を引き起こし、その結果として心筋炎を引き起こし、急性心障害や動悸や心不全を引き起こす可能性がある(166)。SARS-CoV-2陽性患者の剖検データは、単核炎症性心筋浸潤の存在を示しており、この新しいコロナウイルスについてもこの仮説を支持している(3)。また、SARS-CoV-2陽性患者の免疫学的異常も多数の研究で報告されている(167, 168)。この免疫学的状態の変化は心血管疾患のリスクの増加と関連しており、心臓の後遺症につながる免疫学的機能不全の間接的なメカニズムである可能性もある(166-168)。
さらに、多数のSARS-CoV-2陽性患者では、酸素ミスマッチによる二次的な心臓損傷を引き起こす低酸素血症を引き起こす呼吸窮迫が認められた(166-168)。SARS-CoV-2患者における心臓損傷の他の全身的な結果もまた、敗血症および播種性血管内凝固(DIC)に関連している可能性があり、その変化は、最小限の変化から間質性炎症性浸潤および筋細胞壊死性血管微小血栓症および血管炎症に至るまで様々である(166-168)。しかし、SARS-CoV-2感染が心臓に障害を及ぼすかどうかは、現在のところさらに明らかにされていない。
腎臓と膀胱
2020年10月6日、PubMed “COVID-19 OR COVID-2019 OR 重症急性呼吸器症候群コロナウイルス2 OR 重症急性呼吸器症候群コロナウイルス2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND コロナウイルス) AND (腎臓 OR 泌尿器系) “で検索すると、1,031件の論文が見つかった。
腎臓は、体内の毒素や老廃物、余分な水分を排泄するフィルターに重要な役割を果たす主要な臓器の一つである。腎臓移植やSARS-CoV-2感染時の透析患者の管理に焦点を当てた研究が多いにもかかわらず、いくつかの研究では感染時の急性腎障害の発生率の増加が報告されている(169, 170)。膀胱も影響を受け、最終的には多臓器不全や死に至る可能性がある(169,170)。
初期の報告では、SARS-CoV-2感染時の急性腎障害の負担は中程度(約0.5%)であることが示唆されていたが、最近の研究では、発生率が56.9%まで上昇していることが報告されている(115,169,171-174)。重症患者では、この発生率は61~76%と著しく高くなっていた(175)。
急性腎障害の発生率は中国よりも米国と英国で高いことが報告されている(96, 150, 174, 176)。また、いくつかの研究では、急性腎障害患者は他の患者に比べて死亡率が高いことが示されており、これは特にICUに入院している患者に当てはまる(177-179)。最近の研究では、COVID-19で入院した小児においても、腎機能障害(46%)と急性腎障害(29%)の発生率が高いことが示されている(180)。
急性腎障害の患者では、血清クレアチニンと血中尿素窒素の値が上昇し、白血球数が増加し、リンパ球数と血小板数が減少することが示された(169)。活性化部分トロンボプラスチン時間の延長および両凝固パラメーターであるDダイマーの上昇も、これらの患者ではより一般的であった(169)。さらに、急性腎損傷を受けたSARS-CoV-2患者の高い割合で蛋白尿アルブミン尿および血尿が認められ、尿からウイルスRNAが分離されていたが、これらはすべて腎臓に対するウイルスのトロピズムの可能性を裏付ける要因であった(181,182)。
このトロピズムは、SARS-CoV-2患者26人中7人の腎尿細管上皮にSARS-CoV-2が存在することを電子顕微鏡で確認したSuらによる剖検研究からも確認されている(176)。この研究では、ブラシ境界の喪失、非等尺性液胞変性、壊死、時としてヘモシデリン顆粒と色素性膿痂疹を伴うびまん性近位尿細管損傷の存在も示された(176)。さらに、血小板やフィブリノイド物質を伴わない毛細血管の内腔を閉塞する顕著な赤血球凝集体も検出された(176)。管状上皮およびポッドサイトに特徴的なスパイクを有するコロナウイルス様粒子のクラスターも検出された。
腎臓内のウイルス核カプシドタンパク質の死後検査でも、SARS-CoV-2抗原が腎尿細管内に蓄積されていることが示され、SARS-CoV-2が腎臓に直接感染し、急性腎障害を引き起こし、ウイルスの拡散に寄与する可能性があることが示唆された(183-185)。SARS-CoV-2のこの直接的な感染経路は、ACE2依存性の経路によるものである可能性がある。腎臓の近位尿細管細胞または尿細管前駆細胞の両方がACE2とTMPRSS2を共発現し、それらの発現レベルが腎臓のネフロン上皮細胞、上皮細胞、内皮細胞、および中膜細胞で高い結果をもたらしたことが明らかになった(82,186)。さらに、Panらは、TMPRSS2遺伝子が腎臓のポッドサイトにおいてACE2と共発現していることを示した(170)。
これらの細胞は、ウイルス感染に対して特に脆弱であり、その損傷は、SARS-CoV-2感染者の約43.9%に検出された高タンパク尿を容易に誘発する(181)。腎尿細管細胞におけるACE2とTMPRSS2の共発現は、SARS-CoV-2が腎臓のACE2陽性細胞に直接結合し、腎尿細管の機能を破壊する可能性を示唆している可能性がある。しかし、SARS-CoV-2患者における腎臓病の関与は多因子性である可能性が高く、サイトカイン障害(高レベルのIL-6)臓器クロストーク(Lung-kidney)その他の全身的な影響によるものである可能性もある(187,188)。
胃と腸
2020年10月6日、PubMed “COVID-19 OR COVID-2019 OR 重症急性呼吸器症候群コロナウイルス2 OR 重症急性呼吸器症候群コロナウイルス2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND コロナウイルス) AND (胃 OR 腸 OR 消化器系 OR 消化器系)で検索すると、977件の論文が見つかった。
多くの研究は、消化管がSARS-CoV-2感染の共通の標的臓器を表すことを示した(1,2,29,96,150-152,189-198)。最近の研究では、COVID-19患者の消化器症状は最大50%(39.6~50%)にまで発現し、吐き気、下痢、食欲不振、腹痛、腹痛、排便、嘔吐などの症状があることが示唆されている(199,200)。食欲不振は最も一般的な消化器症状であるように思われる(26.8%)が、COVID-19患者におけるその発症機序は明らかにされていない(4)。
しかし、この症状は、COVID-19患者の高い割合で認められた味覚障害によるものである可能性がある(201)。いくつかのデータでは、SARS-CoV-2感染中のこれらの消化器症状は、不良な病状経過と関連している可能性があることが報告されている;非重症患者と重症患者を比較すると、重症感染患者では消化器症状を発症するリスクが高いことが示されている(29, 202)。これらの消化器症状の発現は、他の症状と共存するだけでなく、SARS-CoV-2感染症の典型的な表現型に先行する可能性がある(203)。
小児患者やSARS-CoV-2感染症の小児でも、呼吸器症状がなくても消化器症状、特に下痢を呈することがあることが示されている(203,204)。小児患者と小児のSARS-CoV-2感染者では、より軽い病期症状などの臨床的特徴は異なるが、消化器症状は成人に見られる症状と類似しているようである(204)。SARS-CoV-2患者では消化器症状が頻繁に観察されたにもかかわらず、これらの症状の正確な意義はいまだに明らかにされていない。
SARS-CoV-2患者の剖検報告では、消化管病理学の詳細が記載されており、小腸の分節拡張と狭窄の存在が示されている(205)。現在までのところ、SARS-CoV-2感染に関連した消化管の外観を完全に記述した剖検データや報告は、明確な結論を出すにはまだ少ない。SARS-
CoV-2感染時の消化管障害によって誘発される臨床症状に加えて、これらの症状は、ウイルス感染のもう一つの経路、すなわち糞便-口腔感染を強調することができる。比較的長い期間(1日から 12日)感染している間、便サンプルには高濃度のSARS-CoV-2 RNAが含まれているというデータが増えている(193, 204, 206)。これらのデータは小児患者や小児でも確認されており、鼻咽頭検査が陰性であっても直腸スワブでは80%以上の患者が陽性となっている(204)。
このことから、SARS-CoV-2ウイルスの消化管内での複製の可能性が示唆されている。この仮説は、消化管症状を有する重症および非重症のSARS-CoV-2患者を内視鏡検査で解析した結果、重症患者では食道、胃、十二指腸、直腸にSARS-CoV-2 RNAが存在したが、非重症患者では4人のうち1人の十二指腸にのみ存在したというLinらの報告からも部分的に確認されている(4)。
SARS-CoV-2感染時の消化管症状に関するデータは多数あるが、ウイルスが消化管に影響を及ぼす正確なメカニズムはまだ明らかになっていない。いくつかの機序が考えられている。その一つは、消化管内のACE2受容体の存在が関与している可能性がある。Liangらは、ACE2が小腸、特に近位および遠位の腸管細胞で高度に発現していることを発見した(207)。また、Zhangらは、ACE2,TMPRSS2およびフーリンが食道上部上皮細胞および腺細胞、回腸および結腸の腸球に共発現していることを発見し、これらの臓器がまさにSARS-CoV-2の標的となる可能性を示唆している(208)。さらに、Guoらは、TMPRSS2が大腸、胃、小腸、食道を含む消化管のほぼすべての臓器で高発現していることを示唆している(209)。腸管腸球におけるACE2とTMPRSS2の共発現は、下痢を引き起こす腸管吸収の障害を説明することができるかもしれない。
しかし、第二のメカニズムは、炎症反応(サイトカインストーム)による消化管系の直接的な損傷を伴う可能性がある(208)。吸収性腸球はウイルスに感染して破壊され、おそらく吸収不良、腸管分泌の障害、および腸神経系の活性化を引き起こし、下痢のような症状を引き起こす可能性がある(210)。
肝臓
2020年10月6日にPubMed “COVID-19 OR COVID-2019 OR 重症急性呼吸器症候群コロナウイルス2 OR 重症急性呼吸器症候群コロナウイルス2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND コロナウイルス) AND 肝臓 “で検索したところ、1,319件の論文が見つかった。
いくつかのデータでは、SARS-CoV-2患者の約半数が肝生化学異常を示し、アミノトランスフェラーゼ、γ-グルタミルトランスフェラーゼ、ビリルビン、アルカリホスファターゼの値が上昇していることが報告されている(116,211-218)。中央値のアスパラギン酸アミノトランスフェラーゼ優位のアミノトランスフェラーゼ増加は、疾患の重症度を示すようであり、肝障害の指標となるようである(211)。
肝障害については、Bloomらは入院中に約5人に1人がグレード3または4の肝細胞障害を発症したと報告している(212)。また、重症化した患者では、発症時に肝異常を呈することが多いようだと報告されている(212)。実際、COVID-19患者3,428人を対象とした20件のレトロスペクティブ研究を含む最近のメタアナリシスでは、アラニンアミノトランスフェラーゼ、アスパラギン酸アミノトランスフェラーゼ、ビリルビンの高値がCOVID-19感染症の重症度の有意な増加と関連していることが明らかにされている(219)。最近のメタアナリシスでは、これらのマーカーの入院レベルの上昇が患者の死亡率に関連していた(220)。
肝障害と関連するその他の共通因子として、リンパ球数の減少、好中球数の増加、および男性の性別が挙げられた(213)。しかし、SARS-CoV-2患者の肝生化学的変化につながる正確な変化は、現在のところ明らかになっていない。死後の肝生検では、中等度の微小血管ステアトーシスと軽度の小葉・門脈活動が認められた(116)。別の研究では、ウイルス誘発性の細胞障害性T細胞による肝障害が副次的に示唆されている(221)。さらに、SARS-CoV-2患者では凝固マーカーの異常も報告されているので、微小血栓の存在が肝血流の変化とその結果としての肝細胞傷害とアスパラギン酸アミノトランスフェラーゼの増加につながる可能性がある(214, 215, 222)。
これらの変化が、ウイルスの直接的な細胞毒作用によるものなのか、SARS-CoV-2に関連したサイトカインの放出によるものなのか、虚血によるものなのか、既往症によるものなのか、あるいは薬剤誘発性肝障害のような他の原因によるものなのかは、SARS-CoV-2に関連した肝機能障害のメカニズムに関する研究が限られていることもあって、現在のところ不明である。
現在わかっていることは、ACE2受容体は胆管細胞で高発現(59.7%)肝細胞で低発現(2.6%)であることから、胆管細胞がウイルス性肝障害を媒介しているのではないかとの仮説を立てた研究もある(216)。しかし、Zhouらは、TMPRSS2が肝細胞で高発現していることを示した(223)。実際、SARS-CoV-2感染時には、胆管細胞傷害の指標であるアルカリホスファターゼは、肝細胞傷害の指標であるアミノトランスフェラーゼとγ-グルタミルトランスフェラーゼは、重症SARS-CoV-2患者では、より一般的で、ほとんどの場合、肝パラメータが変化することが示されている(116)。実際、SARS-CoV-2患者の肝臓組織の剖検分析では、胆管球損傷は示されていない(116)。先ほど述べたように、COVID-19における肝損傷は、ACE2の受容体を介した肝臓または胆汁細胞への直接的な侮辱である可能性があるが、それは、高炎症、サイトカインストームまたはバイスタンダー肝炎、および薬剤誘発性損傷によってさらに助長される。
もう一つの仮説は、SARS-CoV-2 RNAが便中にも存在していたことから、腸から肝臓への門脈循環による感染が考えられるというものである(224)。ウイルス性肝障害の正確なメカニズムについては、現在のところさらなる調査が必要である。
胆嚢
2020年10月7日にPubMed “COVID-19 OR COVID-2019 OR severe acute respiratory syndrome coronavirus 2 OR severe acute respiratory syndrome coronavirus 2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND coronavirus) AND gallbladder “で検索したところ、21件の論文が見つかった。
SARS-CoV-2感染時の胆嚢に関する論文は少なかったが、肝障害に関する論文では、新ウイルス感染時の胆嚢の変化に関する情報がいくつか見つかった(225, 226)。
胆嚢は肝臓で継続的に生産される胆汁の貯蔵袋であり、両者の機能は密接に関連している。SARS-CoV-2患者の胆嚢の右上腹部超音波検査では、約54%の患者で胆嚢スラッジと膨満が検出され、胆汁性胆汁症の存在を示唆している(226, 227)。
これらの患者における胆汁性胆汁症は、年齢、性別、ICUへの入院、または発症時の消化器症状とは関連していないようである(226)。致死率は、胆汁性胆汁症のある患者の方がない患者よりも高いようである(228)。肝臓については、胆嚢ではACE2を発現する胆嚢上皮細胞の割合が高いことから感染しやすいことが明らかになった(28)。この場合も、SARS-CoV-2感染時の胆嚢の変化が肝障害と関連していることは明らかであるが、ウイルスと関連した胆嚢の変化のメカニズムは不明である。
膵臓
2020年10月7日、PubMed “COVID-19 OR COVID-2019 OR 重症急性呼吸器症候群コロナウイルス2 OR 重症急性呼吸器症候群コロナウイルス2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND コロナウイルス) AND 膵臓 “で検索したところ、77件の論文が見つかった。
現在、SARS-CoV-2感染における膵臓の関与に関するデータは乏しい。しかし、COVID-19患者で膵臓障害を示した症例報告がいくつかあり、SARS-CoV-2感染症の非重症患者の約1~2%、重症患者の約17%が膵臓障害を呈したと報告されている(5, 229-231)。これらの患者のうち何人かは血糖値の異常も認められ、膵臓損傷は局所的なSARS-CoV-2複製による細胞病理学的効果によるものである可能性が示唆された(5, 229-231)。また、膵臓の損傷は、呼吸不全に対する全身反応やSARS-CoV-2によって誘導された有害な免疫反応によって間接的に引き起こされ、多臓器の損傷にもつながっている可能性がある(5)。
同様の結果は、LiuらもCTスキャンで膵臓の局所的な肥大や膵管の拡張に関連したアミラーゼとリパーゼのレベルの上昇を検出している(232)。Hadiらはまた、重度の急性膵炎を有するSARS-CoV-2患者についても報告しており、これ自体が成人の呼吸窮迫や腎不全を含む多臓器不全につながる可能性があるとしている(231)。SARS-CoV-2患者の膵臓障害の割合や膵臓(特に膵島細胞)におけるACE2およびTMPRSS2の発現を考慮すると、研究者や臨床医はSARS-CoV-2による障害の可能性に注意を払う必要がある。
脳
2020年10月7日にPubMed “COVID-19 OR COVID-2019 OR 重症急性呼吸器症候群コロナウイルス2 OR 重症急性呼吸器症候群コロナウイルス2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND コロナウイルス) AND 脳 “で検索したところ、1件見つかった。
293 件の論文があり、そのほとんどが SARS-CoV-2 が中枢神経系に侵入し、脳卒中、てんかん、無感覚・低脳症、発作、脳炎などの神経障害を発症することを示している(1, 66, 233-236)。
具体的には、Maoら(237)によるレトロスペクティブ解析では、SARS-CoV-2患者の約40%が頭痛、意識障害、その他の脳機能障害症状を発症していることが強調されており(1)解剖学的研究ではSARS-CoV-2患者の脳組織の浮腫に存在することが報告されている(66)。
また、いくつかの症例シリーズおよび2件のレトロスペクティブ研究では、COVID-19に関連した重篤な脳卒中状態が報告されている(238,239)。これに関連して、COVID-19患者の小規模コホートを調査したBeyroutiらは、重症SARS-CoV-2患者に関連した虚血性脳卒中(逆転写酵素PCRで確認)は、大血管閉塞やDダイマーレベルの上昇(240)に示されるように、急性脳血管イベントを起こしやすい全身性の高血栓状態に関連して起こることを強調している。
森口らは、鼻咽頭スワブにはSARS-CoV-2 RNAは存在しなかったが、脳脊髄液中には検出されたというCOVID-19に関連した髄膜炎の最初の症例を報告している(241)。SARS-CoV-2感染に関連した脳炎/脳症の症例も多数報告されており、死後の分析でも確認されており、急性播種性脳脊髄炎および新皮質微小梗塞が検出された(242-244)。
COVID-19患者に関連する神経学的合併症は中枢神経系に限定されない。実際、いくつかの著者はまた、SARS-CoV-2とギラン-バレー症候群との間に相関関係があることを報告しており、これは、多様な程度の四肢または頭蓋神経の脱髄および/または軸索の損傷によって生じる四肢または頭蓋神経の脱力、深部腱反射の欠如、感覚および自律神経障害症状を伴う急性/亜急性免疫介在性多発性神経障害である(245-248)。他の研究では、SARS-CoV-2感染の別の神経学的合併症としてミラーフィッシャー症候群も記載されている(249-251)。SARS-CoV-2感染者の脳におけるこれらの神経学的症状は、CTスキャン画像および磁気共鳴画像(MRI)スキャンによって確認・認識され、そこでは、壊死性出血性脳症、脳血栓症および急性梗塞、後膜増強、灌流異常、および脳虚血性脳梗塞、脱髄性病変、右側頭葉浮腫、および脳幹炎症の存在が認められた(252-255)。
また、透過型電子顕微鏡を用いて前頭葉組織にSARS-CoV2の存在が確認され(237)SARS-CoV-2患者の脳脊髄液中のゲノム配列決定により、この新しい肺炎ウイルスが神経系の障害を引き起こす可能性があることが裏付けられた(241)。上述の神経学的症状に加えて、いくつかのSARS-CoV-2感染者はせん妄および/または精神状態の変化を示した。これらの症状は、直接的な中枢神経系の侵襲、中枢神経系の炎症性メディエーターの誘導によるものであるが、他の臓器系の障害、鎮静策の効果、機械的換気時間の延長、または社会的孤立を含む環境因子の二次的な効果である可能性もある(256)。これらのデータから、SARS-CoV-2感染における脳の関与が明らかになったにもかかわらず、ウイルスの神経毒性の正確なメカニズムは、ウイルスの脳への侵入経路に依存しており、これまで完全には解明されなかった(257)。
脳へのウイルスの侵入経路は、主にSARS-CoV-2の細胞内受容体の伝達経路と分布に関連している可能性がある。Maoらは、SARS-CoV-2ウイルスが毛細血管内皮のACE2と相互作用して血液脳関門破壊を引き起こし、ウイルスの中枢神経系への侵入を促進し(237)、次に神経感染症を引き起こすのではないかと仮説を立てた。実際に、ACE2とTMPRSS2は、乏突起細胞前駆細胞や黒質・大脳皮質のアストロサイトで発現していることが明らかになっている(82)。
COVID-19は、潜在的に脳内の毛細血管内皮を損傷し、血圧上昇に寄与する可能性がある。ACE2受容体を介したSARS-CoV-2脳出血のリスクは、異常に高い血圧をもたらし、脳出血を増加させる可能性がある。しかし、ACE2およびTMPRSS2は神経系に存在するが、SARS-CoV-2の神経系への侵入には、嗅覚神経を介した直接的な経鼻からの脳への侵入、血行性またはリンパ系の拡散を介した血液脳関門を介した間接的な侵入、低酸素傷害、そして最後に免疫関連の傷害を含む追加の経路も仮説化されている(7, 258)。
コロナウイルスは、嗅覚神経を介して神経系に直接侵入し、潜在的に嗅覚と味覚の喪失を引き起こし、血液循環と神経経路を介して神経系に侵入することが知られている。さらに、SARS-CoV-2を含むコロナウイルスは、肺組織で有害な作用を引き起こし、肺病変とその結果としての低酸素状態を引き起こし、脳疾患の進行の原因となる可能性がある。これらのデータは、SARS-CoV-2患者の感染に関連した神経学的合併症についての認識、管理、およびタイムリーな分析が、重症患者の予後を改善する鍵となることを強調している。
皮膚
2020年10月7日にPubMed “COVID-19 OR COVID-2019 OR 重症急性呼吸器症候群コロナウイルス2 OR 重症急性呼吸器症候群コロナウイルス2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND コロナウイルス) AND (皮膚 OR 皮膚症状)で検索したところ、771件の報告が見つかった。
SARS-CoV-2感染による皮膚症状は様々なタイプがあり、現在、多数の症例報告、症例シリーズ、文献レビューで報告されている(259-264)。皮膚症状に関する最初の症例研究はRecalcatiらによって発表され、広範囲のじんま疹、紅斑性突出、水痘様小水疱を示した88人の患者が含まれている(265)。
その後、他の著者は血小板数の減少と関連して、時に好酸球増多を伴うじんま疹性発疹を記載している(265-270)。Zhangらは、SARS-CoV-2感染症の140人の患者を評価し、じんま疹が患者の1.4%(268)によって自己報告されたことを述べている。
大多数の研究では、じんま疹はSARS-CoV-2の重症度とは相関がないと報告されているが(265,268)プロスペクティブコホート研究では、じんま疹と黄斑状皮膚病変の存在は、より高い罹患率とより高い死亡率(2%)と関連していると報告されている(271)。蕁麻疹の皮膚症状に加えて、Manaloらは、SARS-CoV-2に関連した皮膚症状として一過性の網状皮斑(livedo reticularis)を報告している(272)。他の皮膚症状は、SARS-CoV-2患者の高凝固状態に関連することが多く、ウイルスの進化に否定的な予後の影響を及ぼすことが報告されている(273-275)。これらの症状は、SARS-CoV-2による血管内皮の直接的な損傷によって引き起こされる可能性があり、DIC、抗リン脂質症候群、および擬態血管炎を引き起こす可能性がある。
重症SARS-CoV-2患者に紫斑性皮膚病変を認めた症例があり、詳細には臀部の網状紫斑、手のひらと足の裏のくすんだ紫斑、胸部と四肢の網状皮斑が検出された(261, 273, 276)。皮膚および肺の組織生検では、血栓性血管障害とC5b-9およびC4d補体タンパク質の沈着が検出された(273)。これは補体の代替経路とレクチン経路の両方が広範囲に活性化されていることと一致しており、重症のSARS-CoV-2患者は肺だけでなく皮膚やおそらく他の臓器も巻き込む血栓性微小血管障害を受ける可能性があることを示唆している(273)。
皮膚病変は小児でも認められ、無症状または軽度の症状のある小児や青年では一般的に認められている(277-279)。SARS-CoV-2の小児患者における頭蓋骨周囲炎の皮膚生検では、表在性と深在性のリンパ球浸潤が認められ、液胞変化や紫斑も認められた(280, 281)。また、角質層の出血性脱角化症も検出され、皮膚浸潤と同様に、小血管の細い筋肉壁に強い血管周囲炎とリンパ球性血管炎が認められた(4, 205)。同様の結果は、SARS-CoV-2の成人患者の皮膚生検でも見られ、リンパ球性の血管周囲および介在細胞周囲浸潤が認められた(282, 283)。
今日まで、SARS-CoV-2感染の皮膚症状がどのようなものであるか、また、なぜそのような症状が生じるのかを定義するのに十分な研究はまだ存在していない。Recalcatiらの報告によると、これらの皮膚症状は「一般的なウイルス感染時に起こる皮膚病変と類似している」(265)。
臨床観察と文献からのデータを統合することでいくつかの仮説が立てられるが、これらの皮膚症状が神経原性なのか、微小血栓性なのか、免疫複合体を介したものなのかは今のところ不明である。しかし、ACE2が皮膚の基底表皮層や皮脂腺細胞に存在していることを考えると、SARS-CoV-2が皮膚自体から検出されるかどうかを理解するために組織サンプルを調べることは重要な意味を持つと考えられる(58)。さらに、最近の研究では、ACE2とTMPRSS2が皮膚の上皮部位で共発現していることが検出され、SARS-CoV-2におけるこれらの分子の潜在的な役割が強調されている(284)。しかし、COVID-19患者における皮膚症状(非そう痒性、紅斑性発疹、じんま疹、水痘様病変)が、ウイルスの複製の場所なのか、それとも全身感染に対する局所的な反応なのかは、今のところ不明である。
男女の生殖器系と妊娠
2020 年 10 月 7 日、PubMed “COVID-19 OR COVID-2019 OR 重症急性呼吸器症候群コロナウイルス 2 OR 重症急性呼吸器症候群コロナウイルス 2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND コロナウイルス) AND (生殖系 OR 卵巣 OR 精巣 OR 妊娠)で検索したところ、1,301 件の報告が見つかった。
これらの報告のほとんどは、精巣、精子、卵巣、卵管、胎盤、および子宮における高レベルのACE2発現を記載しており、ヒトの生殖系におけるSARS-CoV-2感染の潜在的な高リスクが強調されていた(61,285-288)。しかしながら、男性生殖系におけるSARS-CoV-2の存在に関するデータは相反するものである。
Liらによる研究では、感染者の精巣にSARS-CoV-2が存在することが明らかになった(289)。91人のCOVID-19感染者を対象とした死後の研究でも、精巣内の精子細胞の減少と損傷の程度にばらつきがあり、精巣内にSARS-CoV-2 RNAとウイルス粒子が存在することが示されている(290)。逆に、いくつかの臨床研究では、COVID-19患者の精液または精巣生検でSARS-CoV-2を検出しなかった(291-293)。したがって、一部のCOVID-19患者ではあるが、すべてのCOVID-19患者ではないSARS-CoV-2が男性生殖器系に侵入したと推測することが可能である。しかし、SARS-CoV-2は全身に影響を及ぼす可能性があるため、生殖器系にも影響を及ぼす可能性がある。いくつかの研究では、精巣がSARS-CoV-2陰性であっても、COVID-19患者の精巣不快感と精巣実質の破壊が報告されている(291, 293)。
周知のように、生殖健康上の問題は男性に限らず、女性にも影響があるかもしれない。かなり明らかになっているように思われるのは、女性の生殖系におけるACE2の分布と機能である。Jingらは、卵巣、子宮、膣、胎盤でのACE2発現を明確に報告している(60)。また、Ang II、ACE2,Ang-(1-7)は卵胞の発達や排卵を調節し、黄体血管新生や変性を調節し、子宮内膜組織の規則的な変化や胚の発達に影響を与えていることから、SARS-CoV-2感染は女性の生殖機能を障害し、不妊、月経障害、胎児の苦痛をもたらす可能性がある(60)と考えられた。これらのデータは、SARS-CoV-2が女性の生殖機能を障害する経路があることを示唆しているが、現在のところ、COVID-19患者の女性の生殖系への障害に関する研究は報告されていない。
女性の生殖器系におけるSARS-CoV-2の役割については、最近の研究では主に妊婦を対象とした研究が行われている。ACE2とTMPRSS2の同時発現は、母体-胎児界面の細胞レベルでは不足しているようである。
COVID-19妊婦の臨床症状は非妊婦と変わらないようであるが、COVID-19に感染した妊婦は早産のリスクがあることが示唆されている(294-296)。また、最近の論文では、COVID-19に感染した妊婦における子癇前症や妊娠高血圧症の発現例も報告されている(297-299)。COVID-19に関するWAPM研究の解析では、COVID-19に感染した母体の胎児において、感染時の早期妊娠年齢、母体の人工呼吸器支持、低出生体重が有害な周産期転帰の主な決定因子であることが報告されている(300)。しかし、重大な新生児呼吸器疾患は、SARS-CoV-2陽性の存在下ではまれであるように思われる(301)。
この文脈において、重要な問題は、SARS-CoV-2がCOVID-19に感染した女性から胎児に感染するかどうかである。出生直後(数時間から数日)の乳児への感染の証拠は、子宮内垂直感染を介した母体胎児感染の可能性、または母乳育児を媒介とした感染の可能性を示唆している。この後者のケースでは、母乳中のSARS – Cov2の存在の証拠はまだ議論の余地があり、これらの段階で母と子の間の緊密な接触で伝送の真の方法がある可能性がある。その代わり、中国からの一次報告にもかかわらず、垂直伝播の可能性は低いことが示唆されているにもかかわらず、いくつかのケースシリーズは、陽性のSARS-CoV-2女性からの垂直伝播の可能性を明らかにした(302,303)。
経胎盤感染が可能であるためには、以下の2つの条件が必要である。
- (1)SARS-CoV-2が胎盤に到達していること、
- (2)ACE2が胎盤に存在していること。
前者については、いくつかの論文で胎盤組織中にSARS-CoV-2が存在することが支持されている。特に、SARS-CoV-2の影響を受けた妊婦では、炎症状態と血管供給の変化の証拠を伴って、胎盤の変質の病理組織学的徴候が観察されている。(304–308). 第二の状態については、まだ議論の余地のある結果がある(309, 310)。
しかし、最近の研究では、絨毛間空間で母体の血液と直接接触している絨毛細胞が妊娠中に強いACE2の発現を示し、SARS-CoV2が受容体を介して胎盤に感染することを支持していることが示された(311)。さらなる研究では、妊娠初期の感染経路の可能性を調査したところ、トロフォブラスト、胚盤胞、低胚芽細胞でACE2の発現とTMPRSS2の共発現が確認された(312)。しかし、フーリン、トリプシン、およびカテプシンBおよびLなどの他のプロテアーゼも関与している可能性がある(16,313,314)。このように、臨床的証拠がないにもかかわらず、SARS-CoV-2感染は生殖器系の潜在的なリスクをもたらす可能性がある。
甲状腺
2020年10月7日にPubMed “COVID-19 OR COVID-2019 OR severe acute respiratory syndrome coronavirus 2 OR severe acute respiratory syndrome coronavirus 2 OR 2019-nCoV OR SARS-CoV-2 OR 2019nCoV OR (武漢 AND coronavirus) AND thyroid “で検索すると112件の論文が見つかった。
SARS-CoV-2感染における甲状腺の直接関与に関するデータはarescarceであり、報告のほとんどは甲状腺機能低下症とCOVID-19に関連した転帰との間の可能性のある関連を特定することに焦点を当てている。SARS-CoV-2パンデミック時の甲状腺機能障害に特有の問題に関するコンセンサス声明が英国甲状腺学会と内分泌学会によって発表された(315)。
このコンセンサスでは、甲状腺機能低下症または甲状腺機能亢進症の患者には投薬を継続することが推奨されているが、抗甲状腺薬を服用している患者は無顆粒球症のリスクがあること、つまりSARS-CoV-2の症状と重なることが多いことが強調されている(315)。
しかし最近、van Gerwenらは、COVID-19患者3,703人を評価したが、そのうち251人(6.8%)は甲状腺機能低下症の既往があり、甲状腺ホルモン療法を受けていた(316)。甲状腺機能低下症は入院、機械換気、死亡のリスク増加とは関連していないことが明らかになった(316)。COVID-19に関連した甲状腺の直接的な病変は、Campos-Barreraらによって強調され、健康な37歳女性のCOVID-19の非常に軽度の症状に関連した亜急性甲状腺炎を同定した(317)。
亜急性甲状腺炎はCOVID-19に関連する唯一の甲状腺疾患ではなかった。実際、サイロキシン性甲状腺中毒症の症例も記載されている(318)。いくつかの症例報告と症例シリーズは、ICUからCOVID-19の重症提示を受けた患者における亜急性甲状腺炎とサイロキシン性甲状腺中毒症の有病率に焦点を当てていた(319-324)。
最近、50人のCOVID-19患者を対象としたレトロスペクティブな研究では、56%の患者で総T3とTSH濃度が低下していることが明らかになった(325-327)。T3濃度の低下は、重症のSARS-CoV-2患者でより顕著であった(325)。SARS-CoV-2感染時の甲状腺の関与に関するデータが少ないにもかかわらず、以前に報告されたように、ACE2の発現レベルは甲状腺で高く、その発現は男性と女性で免疫シグネチャーと正負の関連があったことを強調することが重要である(328)。さらに、TMPRSS2も甲状腺で発現していた(82)。したがって、SARS-CoV-2感染における甲状腺の潜在的な関与を理解するためには、さらなる研究が重要であることは間違いない。
議論
世界中で非常に多くの人が感染した新型SARS-CoV-2は、ACE2を利用して細胞内に侵入することが明らかになったことから、ACE2の役割、機能、分布、そしてSARS-CoV-2感染を助ける特定のプロテアーゼとの相互作用に注目した研究が増えている。実際、ACE2との結合によりウイルスがヒト細胞内に侵入した後、Sタンパク質はTMPRSS2によりフーリンの助けを借りて切断され、結合後のウイルスの細胞内への侵入を促進することが知られている。しかし、理論的には他のヒトのプロテアーゼ(カテプシンLとB、エラスターゼ、トリプシン、第X因子)もこの複雑なプロセスに関与している可能性があり、現在多くの研究が進行中である。
ACE2受容体はユビキタスであり、心臓、血管、腸、肺、腎臓、精巣、脳など多くのヒト組織や臓器に広く発現しており、SARS-CoV-2感染時の様々な臓器の関与とその後の障害に重要な役割を果たしている可能性があることが明らかになった。ACE2は、典型的には細胞膜に結合し、循環中の可溶性形態では貧弱に存在する。SARS-CoV-2感染および他のウイルスにおけるその負の役割に加えて、膜結合型および可溶性ACE2はまた、有益な生物学的機能を果たし、その主なものはアンジオテンシンIIのアンジオテンシン1-7への分解によって代表される。このように、ACE2受容体は、アンジオテンシンIIがAT1受容体に結合することで生じる、血管収縮、炎症の増大、血栓症などの有害な作用を抑制している(329)。しかし、膜融合によるSARS-CoV-2の細胞内への侵入は、ACE2受容体をダウンレギュレーションするため、SARS-CoV-2は膜の外部部位から機能的に切り離された膜受容体で細胞内に侵入しているように思われる。この現象は、SARS-CoV-2の感染に有害な影響を及ぼす可能性がある。遺伝学、人口統計学、生活習慣、併存疾患、薬剤の使用など、他のいくつかの要因がACE2の発現および活性に潜在的な影響を与える可能性があることを強調しておくことが重要である。実際、SARS-CoV-2患者は、高齢、高血圧、糖尿病、心血管疾患など、感染や重症度に関連したいくつかの特徴を有しており、ACE2欠乏の程度が異なるため、ウイルスによる有効なダメージの評価に偏りが生じることが広範囲に報告されている(1)。しかし、SARS-CoV-2感染時にACE2を発現する臓器が直接の標的となり、重篤な病理学的症状や多臓器不全、さらには死に至る可能性があるにもかかわらず、ACE2がこれらの臓器に作用する正確なメカニズムや効果的な作用については、未だに多くの議論がなされていないのが現状である。
臨床と科学的な議論の中心にあるもう一つの点は、可溶性のACE2が有益な効果を発揮する可能性があるかどうかという点である。Battleらの論文では、可溶性のACE2は、表面結合型の完全長ACE2へのウイルスの結合を回避して、SARS-CoVの競争的なインターセプターのように振る舞うのではないかと仮説を立てている(330)。この証拠は、試験管内試験での研究とも一致している(331, 332)。COVID-19患者の鼻咽頭サンプルから分離されたSARS-CoV-2に感染したVero-E6細胞の前臨床モデルでは、ヒト組換え可溶性ACE2(hrsACE2)のウイルス複製を用量依存的に阻害する有効性が実証された。このような活性は、ヒト毛細血管オルガノイド培養物およびヒト胚性幹細胞から作製した腎臓オルガノイド培養物においても確認された(331)。さらに、可溶性ACE2形態は、免疫グロブリンのFc部分と協働して、SARS-CoV-2の複製をブロックし、ウイルスに対する免疫応答にも関与しているようである(331)。rhACE2の投与はまた、重度のCOVID-19患者におけるIL-6レベルの低下を誘導するようである(333)。IL-6および他の炎症性サイトカイン(IL-1β、IL-2,IL-7,IL-8,IL-10,顆粒球コロニー刺激因子、顆粒球マクロファージコロニー刺激因子、インターフェロン誘導性タンパク質-10,単球化学戦術タンパク質1,マクロファージ炎症タンパク質-1α、IFN-γ、およびTNF-α、2,3,12)の産生の増加。 15)は、COVID-19患者におけるリンパ球減少、リンパ球の活性化と機能不全、顆粒球と単球の異常、免疫グロブリンG(IgG)と総抗体の産生量の増加とともに、SARS-CoV-2がいかに正常な免疫反応をも破壊し、免疫系の障害につながるかを指摘している(334-339)。リンパ減少は重症COVID-19患者の主な特徴である(334)。これらの患者では、CD4+ T、CD8+ T、NKおよびB細胞の数の著しい減少が検出された(335)。さらに、CD4+およびCD8+ T細胞上のCD69,CD38およびCD44の高発現が認められた(336)。重症COVID-19患者からのウイルス特異的T細胞はまた、高レベルのインターフェロン(IFN)-γ、腫瘍壊死因子(TNF)-α、およびIL-2を有する中枢記憶表現型を強調している。それにもかかわらず、リンパ球は、プログラムされた細胞死タンパク質-1(PD1)T細胞免疫グロブリンドメインおよびムチンドメイン-3(TIM3)およびキラー細胞レクチン様受容体サブファミリーCメンバー1(NKG2A)のアップレギュレーションを伴う枯渇表現型を有する(337)。重症COVID-19患者で減少した好酸球、好塩基球、単球の割合とは異なり、好中球のレベルは増加した(338)。このように、リンパ球減少症、T細胞枯渇およびサイトカイン放出症候群、および臓器特異的なACE2発現細胞(内皮、肺の肺胞、腎臓の近位尿細管および糸球体、心臓の周皮細胞など)によって引き起こされる免疫系の損傷および非効率性は、急性呼吸器疾患症候群や多臓器不全などの合併症を引き起こす可能性がある。これらの合併症は、SARS-CoV-2感染の予後を悪くするだけでなく、肺線維症、神経変性疾患、心血管疾患および腎臓疾患など、ウイルス感染(Long-COVID-19)後も長く持続する恒久的な変化をもたらす可能性がある(340, 341)。
COVID-19の病理学的基礎とメカニズム、およびウイルス感染中のACE2のすべての機能と活性を明らかにすることは、疾患の病態生理の理解に不可欠であろう。我々の理解に大きな助けとなるのは、より大規模な一連の剖検所見の病理学的研究であろう。さらに、先進的で代替的な前臨床モデルの開発は、SARS-CoV-2感染過程そのものの解明、SARS-CoV-2の病態生理とACE2の特定の側面を解析すること、そして最も重要なことは、ヒトで観察されている疾患の進行パターンを知ることに役立つであろう。また、ACE2の生理的局在や活性に関する網羅的かつ系統的な研究は、感染メカニズムの理解に役立つ可能性がある。この点では、組織内に存在する免疫細胞における ACE2 の同定に関する予備的な科学的証拠を考慮して、免疫系の細胞の調査に注意を払うべきである。このことは、ウイルスの拡散メカニズムと組織障害の両面で、さらなるシナリオを切り開く可能性がある。
SARS-CoV-2患者の臨床管理のためには、科学的な努力を惜しまず、個々の患者に合わせた治療を行うことを目的とした個別化戦略を検討することが必要であると考える。本報告で示したように、この側面では、ACE2-SARS-CoV-2の相互作用における特定の患者の違いと疾患の病態生理への影響を考慮する必要がある。疾患を克服した患者において探索され得るもう一つの興味深い側面は、臓器およびシステムにおいて上記のような変化の可能性のある発症または持続、およびそれらが一過性であるか永久的であるかの評価(Long-COVID-19)であり、SARS-CoV-2感染によるACE2活性障害の程度を評価することである。
著者寄稿
FS、MF、MLは原稿のデザインを行った。FSとMMは文献の収集・分析、原稿執筆、編集、投稿用原稿の作成を行った。MLとMFは原稿の修正を行った。最終原稿は著者全員が読み、承認した。
利益相反
著者らは、利益相反の可能性があると解釈されるような商業的または経済的な関係がない状態で研究が行われたことを宣言している。
