Contents
Receptor for advanced glycation end-products axis and coronavirus disease 2019 in inflammatory bowel diseases: A dangerous liaison?
www.ncbi.nlm.nih.gov/pmc/articles/PMC8130044/
2021年5月21日オンライン公開
概要
進行性糖化最終産物受容体(RAGE)軸の活性化が、多くの臨床症状において重要な役割を果たしていることは、説得力のある証拠である。コロナウイルス感染症2019年のパンデミック以降、炎症性腸疾患(IBD)などの炎症性消化管疾患における重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)感染症のリスクと対応について関心が高まっている。しかし、パンデミック時に得られた臨床データによると、IBD患者がSARS-CoV-2感染症に罹患したり、感染症の経過が重篤化したりするリスクは高くないと考えられる。
今回の総説では、IBD患者のSARS-CoV-2感染に対する炎症反応に重要な役割を果たす可能性のある2つの要素、すなわちRAGE軸の活性化とレニン・アンジオテンシン系とのクロストークが、RAGEとアンジオテンシン変換酵素(ACE)2の可溶性型の高発現によって抑制されていることを強調したい。RAGEの可溶型はそのリガンドのデコイとして機能し、可溶型ACE2はRAGE軸の活性化をさらに弱める役割を果たしていると思われる。特に、ウイルスによってACE/アンジオテンシンII/アンジオテンシンII受容体タイプ1経路のバランスが崩れることで生じるRAGE軸のトランザクティヴ化を回避することができる。
キーワード
COVID-19,炎症性腸疾患、進行性糖化、アンジオテンシン変換酵素2,アラメリン、進行性糖化最終産物受容体、進行性糖化最終産物軸受容体、炎症
コアなヒント
パンデミックの際に挙がったデータによると、炎症性腸疾患では重症急性呼吸器症候群新型コロナウイルス感染症に罹患するリスクが増加したり、より重篤な感染症の経過をたどることはないという。これらの知見は、炎症性腸疾患が消化管の慢性炎症状態であることを考えると、ある意味で予想外である。本論文では、進行性糖化エンドプロダクツ受容体とアンジオテンシン変換酵素2の可溶型を高発現させることにより、進行性糖化エンドプロダクツ受容体軸の活性化やレニン・アンジオテンシン系とのクロストークが抑制されることを述べた。
序論
2019年末、中国では原因不明の重症肺炎が数例報告され、その後、コロナウイルスである重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)が病因物質として特定された[1]。世界中で急速に広まったため、世界保健機関は2020年1月30日に「コロナウイルス感染症2019(COVID-19)」をパンデミックと定義した。
COVID-19の主な症状は下気道に影響を与え、急性窮迫性呼吸器症候群などの死亡率の高い合併症を引き起こす[2-6]。しかし、最近の報告では、SARS-CoV-2感染による胃腸(GI)症状が、COVID-19を発症した患者に共通する臨床症状であることが明らかになっている[7-11]。
SARS-CoV-2は、細胞膜貫通型のアンジオテンシン変換酵素2(ACE2)分子をウイルス細胞侵入のための受容体として利用している。生理的条件下では、上皮性ACE2はいくつかの組織で広く発現している。しかし、回腸末端と大腸における上皮性ACE2の発現は、体内で最も高いレベルにあり、COVID-19患者がいくつかのGI症状を経験する理由を説明することができる[12-16]。
その結果、炎症性腸疾患(IBD)などの炎症性GI疾患におけるSARS-CoV-2感染のリスクと対処法について、懸念が高まっている。IBDは、クローン病(CD)や潰瘍性大腸炎からなる慢性腸疾患で、慢性的かつ再発性の腸炎を特徴としている[17,18]。そのため、SARS-CoV-2のパンデミックが始まった当初から、IBD患者はSARS-CoV-2感染症の重症度や有害な転帰が増加するハイリスクグループと考えられてた[19,20]。
しかし、パンデミック期間中に得られた臨床データによると、IBD患者はSARS-CoV-2感染のリスクを高めたり、より重篤な感染経過を辿ったりすることはないことが示唆されている[21-25]。多くの慢性炎症性疾患において、RAGE(Advanced Glycation End-products)受容体の活性化が重要な役割を果たしていることは、臨床的にも実験的にも明らかになっている[26-31]。最近では、SARS-CoV-2感染症の臨床経過に おいてRAGE軸の活性化が重要な役割を果たしていることが明ら かになった[32]。
本レビューでは、SARS-CoV-2感染とIBD患者の臨床経過におけるRAGE軸の活性化の役割を強調したいと思う。
RAGEアクシス
RAGEは、1992年に初めて発表されたI型1パスの膜貫通タンパク質で、AGEs(Advanced Glycation End Products)と結合することができる。この分子は、細胞表面の受容体である免疫グロブリンスーパーファミリーに属し、現在ではパターン認識受容体と考えられており、慢性炎症や免疫反応の中心的なメディエーターとみなされている[33-35]。
RAGEは通常、肺を除く多くの細胞種や組織で低レベルで発現している。しかし、この発現は、炎症状態で顕著に増加する[36-38]。
RAGEは膜貫通型の他に、いくつかの可溶性アイソフォー ム(sRAGE)が、代替スプライシングや、マトリックスメタ ロプロテアーゼ-9(MMP-9)ADAM-10,ADAM-17などの膜関連プロテ アーゼの作用によって生成される[39-42]。これらの可溶性変異体は、リガンドに対するデコイ受容 体として機能し、膜に固定された完全長のRAGEとの相互作用を妨 げることができる。その結果、sRAGEのバイオアベイラビリティーが高ければ、完全長のRAGEの活性化による炎症反応が減少することになる[35,43,44]。RAGEはAGEs以外にも、アラーミンである高移動度グループボックス1(HMGB1)S100タンパク質ファミリー、グリコサミノグリカン、アミロイドβペプチドなど、多くのリガンドを認識することができる[35,45]。
RAGEがリガンドと結合した結果、活性酸素種、p21ras、細胞外シグナル調節プロテインキナーゼ1/2(p44/p42)マイトジェン活性化プロテイン(MAP)キナーゼ、p38およびストレス活性化プロテインキナーゼ/c-Jun N-terminalキナーゼマイトジェン活性化プロテインキナーゼなどの複数のシグナル伝達経路が引き起こされる。その結果、核内因子カッパB(NF-κB)、AP-1,転写因子3(signal transducer and activator of transcription)の活性化など、下流の炎症に重要な影響を与えることになる[35]。
実際、RAGE軸のシグナルは、炎症性遺伝子の発現を引き起こ すだけでなく、炎症性刺激がNF-κBを活性化し、それがRAGEの 発現を誘導し、その後、炎症反応が増強・持続するという正のフィード フォワードループを形成している[35,46-48]。
IBDにおけるRAGE軸の活性化
当初、RAGE軸の活性化は、大血管や小血管の合併症などの糖尿病の合併症と関連していた[49,50]。しかし、RAGEが多くの慢性炎症性疾患に関与する重要な分子であることを示す証拠が増えていた[28-30,51]。
多くの基礎的な分子機構が疾患の発症と持続に関与しており、特に、IBD患者に見られる強固な炎症性シグナルを促進する分子機構がある[26,52]。注目すべき点は、IBD患者の腸管細胞、特に炎症部位において、RAGEとそのリガンドの発現が増加していることを示す証拠がいくつかあることである[53-55]。また、RAGEのリガンドであるHMGB1やS100タンパク群の放出が、 炎症下で増加していることにも注目したい[54-57]。このように、RAGEの関与は、腸管傷害や炎症環境の維持に重要な役割を果たしていると考えられる[53-57]。
驚くべきことに、IBD患者ではMMP-9とADAM17の両方のレベルが上昇していることが報告されている[58,59]。両メタロプロテアーゼはRAGEの脱落に関与しているため、sRAGEのレベルが上昇し、IBD患者のRAGE軸の活性化によって引き起こされる炎症反応を調節することができる[58]。現在、多くの臨床現場では、sRAGEレベルの上昇がRAGE活性化を介した炎症反応の低下と相関しているという事実を裏付ける説得力のある証拠がある[60-63]。また、最近ではSARS-CoV-2の受容体としても機能することが示されている[66]。注目すべきは、RAGE 活性化を介した炎症反応を抑制すると、CD147 の発現が減少することである[67]。
レニン・アンジオテンシン系
レニン・アンジオテンシン系(RAS)は、炎症、線維化、細胞 増殖に対して相反する作用を媒介する2つの相補的な経路に よって制御されるホルモン系である[68-70]。したがって、この2つの経路のバランスが、心血管系、腎系、呼吸器系などのいくつかのシステムにおける炎症促進状態または抗炎症状態を決定する[71-74]。
ACE,アンジオテンシンII(Ang II)およびその受容体であるAng II受容体1型(AT1R)を介した古典的経路は,酸化ストレスやニトロソストレスなどの炎症性シグナルの活性化,サイトカインや細胞接着分子の誘導,さらにはNF-κBなどの転写因子の活性化を引き起こす[75-78].逆に、ACE2,Ang (1-7)およびその受容体Mas (MasR)が主に介在する代替経路は、AT1R活性化とは逆の作用を誘導し、ACE/Ang II/AT1Rの作用に対する抗炎症・抗線維化のカウンターレギュレーターとなる[71,75,79,80]。ACEとACE2は、肺、腎臓、血管などのいくつかの組織で高発現している。しかし、両酵素が最も多く発現している組織は、回腸と大腸のブラシボーダーである[13-16,81]。どちらの酵素もアンジオテンシンを切断し、異なる副産物を生成し、RAS系の両経路のバランスを調整することができる[79,82,83]。
IBDにおけるRASの不均衡
最近の研究では、回腸と結腸全体で、両方のRAS経路の主要成分が多く発現していることが示唆されている[81]。この意味で、腸はRAS経路の不均衡に対して特に影響を受けやすい器官であると考えられる。したがって、これらの構成要素の調節障害は、IBD患者の炎症や線維化に影響を及ぼす可能性がある[84,85]。驚くべきことに、いくつかの研究では、ACE2の腸内発現がIBD患者の線維化と逆相関していることが明らかになっている[81,86]。
また、Ang (1-7) は、MasRを介して大腸の筋線維芽細胞のコラーゲン分泌を改善する[81]。さらに、アンジオテンシン受容体拮抗薬やACE阻害薬は、IBD患者において、粘膜の炎症性サイトカインを減少させ、大腸炎を改善し、合併症、手術、入院率を低下させることが報告されている[87-89]。
通常、ACE2は、Ang IIをAng 1-7ペプチドに分解することで、RASの炎症促進経路の活性化を回避する。しかし、SARS-CoV-2はACE2をハイジャックし、宿主細胞への侵入に利用することができる[12,90]。注目すべきは、可溶性ACE2の高いバイオアベイラビリティがIBD患者で報告されていることである[81,84]。これは主に、これらの患者で観察されたADAM17の増加に起因している[58,91-93]。これがSARS-CoV-2のデコイ受容体として機能することで、対抗する酵素のハイジャックを回避できる可能性がある。
最近、AT1RがAng-IIによって活性化されると、リガンド非依存的にRAGEが活性化され、NF-κB依存的に炎症性メディエーターが発現することが報告されていることを考えると、これは特に重要なことである。
SARS-COV-2に感染したIBD患者におけるRAGE軸の活性化とRASの不均衡
IBDの病態生理を考慮すると、予想に反して、COVID-19に感染したIBD患者の臨床転帰が悪くなるリスクが高まるという証拠は今のところない[21-25]。IBDの病態生理におけるRAGE軸の役割は、様々な報告で示唆されている[53-57]。IBD患者では、RAGEとRAGEリガンドであるHMGB1やS100蛋白質ファミリーのメンバーの大腸での発現が有意に高くなっている[54-56]。その上、この受容体は、COVID-19の炎症反応の調節不全や誤作動の主要な原因とも考えられている[32,94]。
しかし、このシナリオには、対抗する要素を加える必要がある。可溶性RAGEである。可溶性RAGEは、代替スプライシングや膜結合型RAGEのエ クトドメインの切断によって生成されるが、これらはIBD患者に高発現しているMMP-9とADAM17の両方の作用を受けている[58,59]。したがって、IBD患者の炎症を起こした腸管粘膜には、 受容体とリガンドの両方が豊富に存在するにもかかわらず、可溶性 RAGEの高い生物学的利用能がRAGEの活性化を弱めている可能 性がある。
一方、特にIBD患者の消化管では、ACE2が高発現しているため、この組織はSARS-CoV-2の感染にとって特に栄養的なニッチとなっている。さらに、SARS-CoV-2の侵入によってACE2が枯渇すると、RASのバランスが崩れ、炎症を引き起こすACE/Ang II/AT1R経路が優位になる可能性がある[95]。これらの観察結果は、IBD患者の炎症を起こした腸がSARS-CoV-2の侵入に最適なドアウェイとなり、COVID-19を発症したIBD患者の臨床転帰が悪くなることを示唆している。
しかし、この仮説的シナリオには、ADAM17によって膜に結合したACE2が除去されるためにIBD患者で増加する可溶性型のACE2という重要な相殺因子も存在する[58-59]。このことは、RAGEがAng IIによるAT1Rの活性化のために、非認知的なトランザクティヴ・メカニズムを説明していることを考えると特に重要であり[48]、このメカニズムは、膜に結合したACE2の排出が可溶性フォームによって保存されることによって弱められる。
IBD患者では、全身の免疫抑制剤の使用は、COVID-19患者のリスク増加と関連していないことを示す証拠が増えている[96-100]。さらに、IBDにおける薬理学的治療の主な目的は、炎症レベルを低下させることであることも心に留めておく必要がある。この意味で、現在の治療に用いられている多くの薬剤は、 シグナル伝達経路を阻害するだけでなく、RAGEの発現を低下させ、 RAGEリガンド、特にアラメリンであるHMGB1やS100蛋白質ファミリ ーのバイオアベイラビリティを低下させている[96,97]。実際、何人かの著者は、SARS-CoV-2感染に対するIBD治療の保護的役割の可能性を指摘している。特に、COVID-19の臨床経過で観察されたサイトカイン活性を妨害することである[98-100]。
さらに、IBD患者は高いセルフケア基準を持っており、良好な栄養レベルを維持し、病気をコントロールするのに役立つ食生活を行っている[101]。これらの栄養療法の中には、低AGE食に関連するものがあり、これがRAGE活性化を媒介とする炎症性腸内環境の軽減に寄与している可能性がある[102](図(図1).1)。
図1
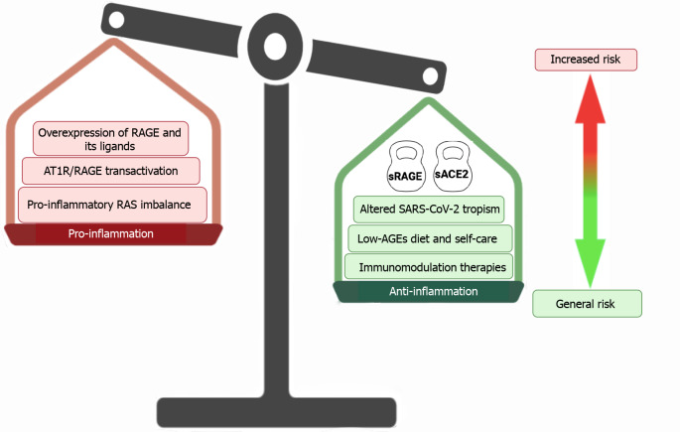
炎症性腸疾患患者では、さまざまな炎症を起こしやすいメカニズムが活性化されていることが知られている。その中でも、RAGE(receptor for advanced glycation end-products)の過剰発現とそのリガンドの豊富さは、この軸の持続的な活性化をもたらす可能性があり、また、炎症促進性のラットサルコーマのアンバランスによる非認知的なメカニズムによっても促進される可能性がある。これらの要素は、新型コロナウイルス感染症を発症した炎症性腸疾患(IBD)患者の経過を悪化させる決定的な要因となっているようだ。しかし、RAGEとアンジオテンシン変換酵素2の両方の可溶性型の高いバイオアベイラビリティなど、他の要素がこれらの炎症性の寄与を弱める可能性がある。可溶性のアンジオテンシン変換酵素2は、重症急性呼吸器症候群新型コロナウイルスの上皮細胞への侵入を妨害する可能性さえある。さらに、IBD患者のほとんどは、炎症を抑制するための薬理学的治療を受けている。IBD患者は食生活にも気を配る必要があり、その結果、食事からの終末糖化産物受容体の摂取も制限されていると考えられる。
RAGE: receptor for advanced glycation end-products; RAS: RAS:レニン・アンジオテンシン、ACE2:アンジオテンシン変換酵素2,SARS-CoV-2:重症急性呼吸器症候群新型コロナウイルス,AT1R:アンジオテンシンII受容体1型、AGEs:終末糖化産物受容体、SARS-CoV-2:Severe acute respiratory syndrome coronavirus 2。AGEs: 終末糖化産物受容体; sRAGE: この受容体にはいくつかの可溶性アイソフォームがある。
おわりに
COVID-19パンデミックは、世界中の医療システムにとって、この100年間で最悪の課題である。重症度と死亡率は、基礎疾患を持つ人々で最も高くなっている。そのため、SARS-CoV-2が、炎症環境の慢性化が疾患の発症に関連する多くの臨床症状において、どのようにして特に炎症を促進するのかを理解するために、特別な努力が払われてきた。IBD患者が特に炎症を起こしていることから、RAGE軸の活性化やRASの不均衡が腸内の炎症を悪化させる重要な要因であると考えられている。しかし、パンデミックの際に得られたデータによると、IBD患者がSARS-CoV-2に感染するリスクが高まったり、感染症が重症化したりすることはないと考えられている。
RAGE軸の活性化は、可溶性受容体が高いバイオアベイラビリティを持ち、そのリガンドのデコイとして機能することで弱められるようだ。さらに、可溶性のACE2は、RAGE軸の活性化を弱めるもう一つの要因であると考えられる。特に、ウイルスが媒介するACE/Ang II/AT1R経路の不均衡によって生じるRAGE軸のトランザクティヴ化を回避することができる。このように、COVID-19 IBD患者におけるRAGE軸の活性化は、決して危険なリエゾンではないようである。
