Contents
The Role of Macrophages in the Pathogenesis of SARS-CoV-2-Associated Acute Respiratory Distress Syndrome
www.ncbi.nlm.nih.gov/pmc/articles/PMC8141811/
オンラインで2021年5月10日に公開
概要
マクロファージは,自然免疫と適応免疫の両方の反応を媒介する細胞であり,生理的過程と病理的過程の両方において重要な役割を果たしている。SARS-CoV-2による全身性合併症には,急性呼吸窮迫症候群(ARDS),播種性血管内凝固症候群,浮腫,肺炎などがある。これらは主にマクロファージの大規模な活性化の影響であり、まとめてマクロファージ活性化症候群と定義することができる。この総説では、COVID-19におけるマクロファージの役割に焦点を当てている。なぜなら、新型コロナウイルス感染症の病態は、特にARDSを合併した症例では、マクロファージの表現型と機能性に大きく依存しているからである。SARS-CoV-2関連のARDSにおける単球、単球由来および肺の常在マクロファージの関与を説明し、特に安定した炎症促進または抗炎症の表現型を持つ再プログラムされたマクロファージの使用など、細胞治療の可能性について議論する。
キーワード
M1/M2マクロファージ、炎症、ARDS、細胞治療、SARS-CoV-2
はじめに
2019年に武漢(中国)で最初に発生して以来、新型コロナウイルス感染症は急速にパンデミックに進行した。このような状況では、世界的な緊急事態の兆候がはっきりと現れ、人間の活動が大幅に制限され、大規模な対策が必要となった。効率的な抗ウイルス剤がない状況下で 2019年のコロナウイルス感染症(COVID-19)の致死率は悲惨なほど高い。COVID-19の患者管理の主な努力は、対症療法と病原体の治療に向けられており、結果に対処する効果的な新しい方法が大いに求められている。COVID-19の重症例では、ウイルスがサイトカインストームを促進し、炎症性サイトカインが制御されずに大量に放出され、急性呼吸窮迫症候群(ARDS)や急性心不全を引き起こす。これらの症状は生命を脅かすものであり、二次的な細菌感染を引き起こす可能性がある。SARS-CoV-2感染者のサイトカインストームを防ぐことは非常に重要であり、そのための安全な手段は世界中の医学研究の主要な目標である。ARDSは、間葉系間質細胞(MSC)を用いた細胞療法によって安全に管理できることが明らかになっている。この総説では、SARS-CoV-2関連ARDS(COVID-19-ARDS)を中心に、ARDSの病態におけるマクロファージの役割を明らかにしている。ARDSにおけるマクロファージの役割に関連する細胞・分子メカニズムを明らかにすることは、COVID-19の潜在的な治療戦略を開発する上で非常に重要である。
SARS-CoV-2(Severe acute respiratory syndrome-related coronavirus 2)は、コロナウイルス科に属するウイルスである。SARS-CoV-2の粒子は、一本鎖(+)RNAを含み、膜(M)エンベロープ(E)ヌクレオカプシド(N)スパイク(S)など、宿主細胞への侵入とウイルスの複製を担うタンパク質が複雑に組み合わさっている(1)。Sは、アンジオテンシン変換酵素2(ACE2)を受容体として特異的に認識する受容体結合ドメインを持ち、ACE2を発現しているII型肺胞上皮細胞(肺細胞)へのウイルスの侵入に不可欠である(2, 3)。Sタンパク質が肺上皮のACE2と相互作用すると、局所的にアンジオテンシンIIの産生が促進され、ブラジキニン濃度が上昇して、炎症反応が急増する(4)。
さらに、SARS-CoV-2のSタンパク質がACE2と結合すると、多核融合した合胞体の形成が促進される(4, 5)。感染細胞の表面に存在するSタンパク質は、隣接する細胞との融合を効果的に促進し、その結果、上皮細胞や骨髄系細胞を取り込んだシンシティアが形成される(6)。SARS-CoV-2患者の肺ではシンシクシャの形成が確認されているが、ウイルスの持続性や拡散における役割を明らかにする必要がある。
COVID-19の臨床症状は、感染したキャリアとの接触後2~14日目(平均5日目)に始まる(7)。最初の症状が出てから6~41日目(平均14日目)に致死的な結果に至る可能性がある。この病気の期間、重症度、致死率は、患者の年齢、免疫状態(8,9)慢性合併症(特に糖尿病、血管障害を伴う慢性高血圧、肺の慢性炎症状態、悪性新生物)の有無(10)遺伝的特徴、肥満の状態、グルコースレベル(11,12)によって異なる。例えば、年齢的に生理的に自然免疫が強い子どもでは、COVID-19の臨床症状は成人に比べて顕著ではない(10)。また、重度の肥満(BMI≧35kg/m2)は集中治療室への入室と関連しており、心臓病の既往歴と肥満(BMI≧30kg/m2)は侵襲的人工呼吸の使用と独立して関連している(11)。
COVID-19の臨床症状は、無症状のキャリッジから急性呼吸窮迫症候群まで様々で、典型的な症状としては、発熱、乾いた咳、息切れ、筋肉痛、疲労などが挙げられる(8,13,14)。重症のコロナウイルス関連肺炎は、上皮細胞でのウイルスの急速な増殖と、マクロファージや好中球の肺胞内隔壁や肺胞腔への大量浸潤を伴う上皮細胞の死に起因する。浸潤した免疫細胞が炎症性メディエーターを大量に産生することで、急性肺損傷(ALI)やARDSが引き起こされる(15, 16)。コロナウイルス感染症における顕著な炎症反応は、防御的な役割と破壊的な役割の両方を担っている(15-17)。免疫細胞の活性化は、ウイルスの除去を可能にするが、その過剰な浸潤と機能は組織の損傷につながる。SARS-CoVに感染した患者では、浸潤した免疫細胞による炎症性メディエーターの大量放出と、ウイルスによる上皮細胞への直接的な細胞傷害作用が相まって、肺の損傷を引き起こす(18)。
SARS-CoV-2は、SARS-CoV-1やMERS-CoVなどの他のコロナウイルスと類似している(19, 20)。SARS-CoV-1やMERS-CoV感染症の死亡例と同様に、COVID-19で死亡した患者の肺の剖検では、マクロファージが優勢な広範囲の細胞浸潤が認められる。高レベルのIFNγ、IL-6,IL-12,TGFβ、CCL2,CXCL9,CXCL10,IL-8は、SARS-CoV-2とSARS-CoV-1に関連した死亡例の両方で典型的に見られ、SARS-CoV-1ではIL-1βのレベルが高く、IL-10のレベルが低かった。
SARSやMERSコロナウイルスでは、呼吸器症候群の重症度とマクロファージ数が正の相関を示している(21,22)。SARS-CoV-1から得られたウイルスタンパク質は、末梢血単球による炎症性サイトカインの放出を刺激する(23)。末梢血のマクロファージや単球は、SARS-CoV-1によって活性化され、好中球や免疫エフェクター(NK細胞、T細胞、B細胞)を呼び込んで、初期の適応免疫を形成する(24,25)。
SARS-CoV-2による免疫応答においてマクロファージが重要な役割を果たしていることを考えると、マクロファージの機能的活性を標的として調節することは、重症のCOVID-19患者の管理に新たなアプローチを提供する可能性がある。
急性呼吸困難症候群(ARDS)について
急性肺損傷(ALI)が急速に進行してARDSになることは、SARS-CoV-2関連肺炎を含む肺炎の高致死率の主な原因である(2,26,27)。ALIからARDSへの移行は、外傷、熱傷、肺炎、敗血症などによる肺の損傷に反応した過剰で制御不能な全身性の炎症反応が、内皮や上皮のバリアーを破壊することで生じる(29)、びまん性の肺胞損傷に起因する(28)。COVID-19に関連したびまん性肺胞損傷のパターンは、ARDSに典型的に見られる(30-32)。ARDSはCOVID-19患者の42%が肺炎を発症するか、COVID-19を発症した集中治療患者の61-81%が発症する(33)。COVID-19の致命的な合併症のうち、ARDSが90%と圧倒的に多いことは 2000人の剖検例で実証されている。その他の致命的な合併症としては、肺塞栓症(6%)敗血症(1.5%)などがある(31)。SARS-CoV-2関連ARDS(COVID-19-ARDS)の予後は、他の原因のARDSよりも悪いことに注意が必要である。一般的なARDSの院内死亡率は35.3%を超えない(33)が、COVID-19-ARDSの院内死亡率は62%と推定され、人工呼吸器を装着した集中治療患者では65.7~94%に達する。予後不良の危険因子としては、高齢であること、合併症(高血圧、心血管疾患、糖尿病、腎不全)があること、リンパ球数の減少やDダイマーの上昇などが挙げられる。COVID-19-ARDS による死亡は、ほとんどが呼吸不全(53%)または心不全(33%)によるものであり、心筋梗塞や循環不全(7%)によるものははるかに少ない(33)。
ALIの初期段階では、マクロファージや樹状細胞などの抗原提示細胞の活性化により免疫反応が引き起こされ、炎症性サイトカイン(特にTNF-α、IL-1,IL-6)やプロスタグランジン、ヒスタミンの産生が促進される(34, 35)。これらの物質は内皮の伝染性を高め、好中球、マクロファージ、リンパ球の炎症部位へのホーミング/マイグレーションを促進し、傷害を悪化させ、ARDSを促進する。血液の毛細血管や肺胞間の隔壁に好中球が蓄積すると、肺胞内の浮腫や雪崩式活性酸素の発生を引き起こし、低酸素血症や肺機能の致命的な悪化の原因となる(36)。微小循環血管の伝染性が高まると、気血関門が閉ざされ、出血やフィブリンの沈着が促進される(37)。
前述の2000人の剖検例を分析した結果、患部の肺組織には、膨張の程度が異なるだけで、同様の病理学的変化が見られた。これらの変化は、基礎となる微小循環不全(微小血管症、血栓症、時には破壊的生産性血管炎)と肺出血を伴うびまん性肺胞損傷と表現できる。このような血管・出血成分が顕著な間質性ウイルス性肺炎は、COVID-19-ARDSの不変の形態学的基質である(31)。
ARDSの病態はいくつかの段階を経て進行し、最も一般的には滲出期、増殖期(リハビリテーション)線維化期(線維増殖期)と定義されている(38-40)。
ARDSの滲出期は、上皮細胞や内皮細胞の大量死を伴うびまん性の肺胞損傷で区別される。COVID-19は主に呼吸器系に影響を及ぼし、他の臓器への影響は軽微である。SARS-CoV-2は肺胞上皮細胞(肺細胞)や内皮細胞に悪影響を及ぼすと考えられている(41)。肺細胞が大量に死滅すると、ガス交換が著しく阻害される(42)。また、内皮細胞の損傷とそれに伴う毛細血管の伝染性の増加により、血管周囲および肺胞内に浮腫が生じ、血漿タンパク質、特にフィブリノーゲンBが肺胞に移行する。ARDS発症の初期段階では、循環中の好中球が大量に活性化し、移動することが特徴的である(43, 44)。浮腫に伴うII型肺細胞の損傷により、サーファクタントの産生が低下し、炎症メディエーター(炎症性サイトカインIL-1β、IL-6,IL-18など)の産生が増加し、マクロファージや好中球の化学走性による肺へのホーミングを促進する(45,46)。内皮の機能不全と肺組織の酸素供給の乱れは、雪崩式に活性酸素を発生させる(47)。細菌の侵入はこの段階ですでに可能であり、細菌性肺炎や敗血症の発症につながる可能性がある。肺胞内でのヒアルロン酸膜の形成(ARDSの指標)は、この段階で進行する(5)。マクロファージと肺細胞の両方のマーカーを含む多核巨細胞の存在(48)は、マクロファージの掃引作用に関与していることを示している。
ARDSの滲出期は、炎症性サイトカインの産生が抑制された状態で、肺細胞と内皮が容易に再生される増殖期(リハビリテーション期)に移行することで終了する(49,50)。好中球がエフェロサイトーシスによって大量に死滅すると、マクロファージは貪食によって患部の剥離を行い、抗炎症性因子(IL-10やTGF-βなど)の産生能力が増大する(50)。ファゴサイトーシスは、iNOSの発現と競合し、Arg-1の発現を刺激するため、マクロファージによるROSの産生を抑制する(49)。
成人ARDS患者の30-50%が本格的な炎症反応を起こし、深刻な組織構造の変化、嚢胞性再構築を伴う線維性肺胞炎の発症、マクロファージ、線維細胞、線維芽細胞の異常な活性化を伴う全体的な肺機能の低下を引き起こすことから、感染後の肺組織の長期的な回復過程もARDSの一局面と考えられている(29, 51)。COVID-19が確認された患者の約17%では、コンピュータ断層撮影により肺線維化の兆候が明確に検出される。肺炎後の回復期には、上皮細胞がコラーゲンや細胞外マトリックス(ECM)成分に徐々に置き換わる追加の線維性病変が形成されることがある(52,53)。現在のところ、COVID-19患者の顕著な肺線維症と予後との真の関係については議論の余地がある。いくつかの証拠(52)は、線維化の存在を予後の良さや患者の状態の安定化と関連付けている。とはいえ、炎症プロセスの結果は、肺線維症の有病率と進行度に確実に依存している(54, 55)。
肺線維症は、線維芽細胞の過剰な増殖と、これらの線維芽細胞によるECM成分の過剰な産生に起因する(39, 56)。この段階では、患者は機械式人工呼吸器による長期的な呼吸サポートを必要とし、死亡率も極めて高い(56)。組織レベルでは、この段階では様々な線維化促進分子(TGF-α、TGF-β、IL-1β、血小板由来成長因子など)が放出され、フィブロネクチン、コラーゲンなどのECM成分の過剰な沈着が促進される(57)。線維増殖反応は、免疫細胞による血管新生促進サイトカインおよび成長因子(MIP-2,アンジオポエチン2,VEGFなど)の発現上昇によって促進される(58-61)。機械的換気は、上皮を損傷し、サーファクタントの産生を妨げることで線維化の進行を悪化させ、最終的には人工呼吸器関連の肺障害を促進する可能性がある(62-65)。
マクロファージの関与はARDS発症のすべての局面で必須であることから、マクロファージはARDS治療の潜在的なターゲット/ツールとなる。
マクロファージの一般的特性
マクロファージは、自然免疫と適応免疫の両方を媒介する細胞であり、様々な生理的・病理的プロセスにおいて重要な役割を果たしており、組織の損傷には、損傷を誘発するものとしても、修復を促進するものとしても関与することができる。マクロファージの前駆体である単球は、骨髄から発生し、末梢血白血球の約5~9%を占めている。単球は血中に1-2日留まり、その後、アポトーシスにより死滅するか、血中から組織内に移動してマクロファージに分化する(66)。肺胞マクロファージ(AM)クッパー細胞、ミクログリア細胞、ランゲルハンス細胞、脾臓赤血球のマクロファージ、腹膜マクロファージなどの常在マクロファージは、出生前に卵黄嚢や胚の肝臓から発生する(67,68)。
健康なヒトでは、血液中の単球は、古典的単球(CD14++CD16-、約90%)非古典的単球(CD14+CD16++、約5-10%)中間的単球(CD14++CD16+、1-5%の最小の亜集団)の3つの亜集団から構成されている(69)。これらの亜集団は、ケモカイン受容体の発現レベルや、食細胞の能力、生理的条件下や炎症過程における特定の組織での分布によって区別される。CD14++単球は成熟していると考えられ、顕著な食細胞活性を持ち、Toll様受容体(TLR)の活性化により活性酸素種(ROS)やサイトカインを産生することができる(70)。CD16++細胞は、サイトカイン(主に炎症誘発性)の合成に従事し、活性酸素は産生しない(69,70)。中間亜集団の役割は不明であるが、これらの単球にはMHC-IIが多く発現していることから、抗原提示やT細胞の活性化に関与していることが示唆されている(71)。
最近の研究では、遺伝子やタンパク質の発現パターンに基づいて、さらにいくつかの単球の表現型が特徴づけられている(72-74)。炎症性疾患の重症化は、通常、非古典的な単球と中間型(CD16+)単球の割合の増加と関連している(75, 76)。
生理的条件下では、循環している単球のかなりの割合が(弱いケモカインシグナルの下で)自発的に組織内に移動し、死細胞を除去したり、免疫モニタリングを行ったりすることで、恒常的な調節機能を果たす常駐マクロファージに分化する(77, 78)。炎症状態では、単球は炎症の焦点に強く惹きつけられ、貪食・殺菌活性が非常に高まった炎症性マクロファージに分化する。組織内で何年も生存している常駐マクロファージに比べて、これらの炎症性マクロファージは一過性である(長くても数週間しか生存しない)。
細胞タイプとして、マクロファージは高い可塑性を示し、すなわち表現型を切り替えることが可能である(79, 80)。マクロファージが表現型を切り替え、微小環境に特異的な反応を起こす過程を「分極」と呼ぶ。マクロファージの極性を決定する重要な要因の一つは、局所的なサイトカインレベルである。哺乳類(ヒト、マウス、ラットを含む)の末梢組織には、「古典的」に活性化された炎症性マクロファージ(一般にM1と呼ばれる)と「代替的」に活性化された抗炎症性マクロファージ(一般にM2と呼ばれる)という2つの機能的サブタイプのマクロファージが存在することが示されている(図1)。この区別は、特異的なマーカーの発現や生理活性物質の産生に基づいている(81-86)。M1の極性化は通常、IFN-γやTNF-αなどの炎症性サイトカインや、リポポリサッカライド(LPS)などの病原体関連刺激に対する反応である。M1マクロファージは、TNF-α、IL-1,IL-6,IL-12,IL-23に加えて、ケモカインCCL8,単球走化性タンパク質1(MCP-1)マクロファージ炎症性タンパク質2(MIP-2)活性酸素、シクロオキシゲナーゼ2(COX-2)CD16,CD32を産生する。マクロファージによる誘導性NOシンターゼ(iNOS)の発現は、げっ歯類におけるM1偏向のマーカーである。M1マクロファージは、炎症反応の発現、走化性、フリーラジカルの産生、細胞外マトリックスの分解、抗菌・抗腫瘍作用などに関与している(38, 87)。
図1 マクロファージの2つの機能的サブタイプ
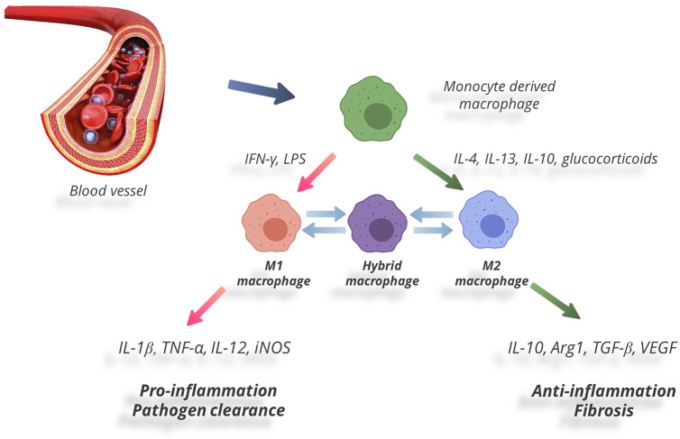
マクロファージの極性の反対タイプであるM2は、Th2サイトカイン(IL-4,IL-13)と抗炎症サイトカイン-特にIL-10とトランスフォーミング成長因子β(TGF-β)に反応して生じる(88)。M2マクロファージは、IL-1受容体アンタゴニスト(IL-1RA)アルギナーゼ1(Arg-1)IL-10,TGF-β、CCL18の発現量が多く、IL-12の産生量が少ないことが特徴である。M2マクロファージは、エフェクターT細胞を抑制することで炎症を抑え、成長因子(VEGF、EGF、PDGF、IL-10)を産生することで創傷治癒や組織修復を促進する。また、Th2を介した反応や細胞外マトリックスのリモデリングにも関与している(88-92)。病的な状況下では、M1/M2のバランスが抗炎症性のМ2表現型にシフトすることで、再生と修復が促進されることが示されている。M2マクロファージは、糖尿病マウスの皮膚の創傷治癒(93)、実験的な脊髄損傷(94-96)、マウスの心筋症(97)、実験モデルの動脈硬化病変の予防(98)、糖尿病患者の心筋梗塞の管理(99, 100)など、損傷を受けた状態でポジティブな効果を発揮することが示された。
M1/M2のパラダイムは、最近、あまりにも原始的であると批判されている。最近のデータでは、マクロファージは誘導刺激がなくても、連続した表現型を示す傾向があることが示されている(101)。マクロファージの可塑性の連続的な性質は、様々な生理的・病理的条件で現れる(102)。炎症促進状態と抗炎症状態の切り替えについては、別の場所で詳しく検討されており(102, 103)、明確なM1またはM2マーカーを持たない不明瞭な機能の状態は、従来、ハイブリッド表現型として分類されていた(102, 104)(図1)。M1/M2パラダイムは、生体内の状態を試験管内試験で極端にしたものであるという意見が広まっているにもかかわらず、多くの実験結果に良い枠組みを提供している(105-107)。
主要なサイトカイン産生細胞および抗原提示細胞であるマクロファージは、エフェクターT細胞のホメオスタシスを制御し、T細胞のプライミングを促進し、Th17細胞の分化を誘導する(108)。つまり、マクロファージは、自然免疫応答を直接媒介するとともに、適応免疫応答のエフェクター期にも重要な役割を果たしている(109)。SARS-CoV-2がマクロファージに感染すると、ウイルスに対する適応免疫反応が損なわれる(110)。
肺マクロファージ
肺マクロファージ(肺マクロファージ)の2つの異なる集団は、どちらも混合型で、出生前は卵黄嚢と胎児の肝臓から、出生後は骨髄から由来する(111, 112)。その中で最初に最も多く存在する肺胞マクロファージ(AM)は、肺胞の上皮壁に結合している(113)。
肺胞マクロファージは、顆粒球-マクロファージコロニー刺激因子(GM-脳脊髄液)の作用下でペルオキシソーム増殖剤活性化受容体γ(PPARγ、脂質代謝調節因子)を発現し(114)主な機能は、貪食と界面活性剤の異化である(115)。肺胞マクロファージsは、その機能的状態と発生源によって、さらに2つの亜集団、すなわち、長寿命のレジデント肺胞マクロファージsとリクルート肺胞マクロファージsに分けられる(39)。長寿命のレジデント肺胞マクロファージは、均一で静止しており、免疫抑制的で、主にM2の表現型を示す(39, 116)。常駐肺胞マクロファージは、組織と空気の境界面におけるセンチネルであり、免疫モニタリングを実行し、組織のホメオスタシスを維持する(38,116,117)。これらの肺胞マクロファージは、ある刺激に反応して循環系から肺胞にリクルートされた末梢血単球によって対抗され(39)これらの単球は「リクルートされた」M1 肺胞マクロファージに分化する(117)。蓄積された証拠は、常駐肺胞マクロファージとリクルート肺胞マクロファージの両方がARDSに深く関与していることを示唆している(39,40)。
第2の集団は間質性マクロファージ(IM)であり、肺マクロファージの30〜40%を占める(113)。炎症時にのみ循環単球から分化する肺胞マクロファージとは対照的に(118)、IMは常駐する単球由来のマクロファージとして分類される(113)。IMは、組織のリモデリングや修復、抗原提示、樹状細胞の機能調節などに関連している(113, 119)。
最近では、神経・気道関連マクロファージ(NAMs)という新しいIMの亜集団がマウスで特徴づけられた(120)。NAMsは他の肺居住マクロファージサブセットとは異なり、他のマクロファージ集団よりもMHCII、Cx3cr1,C1q、C3ar1,F13a1を高レベルで発現し、Lyve1(Lymphatic vessel endotheli hyaluronan receptor 1)を低レベルで発現している(120)。免疫と組織のホメオスタシスの維持に関与するNAMsは、IL-10などの免疫抑制因子を分泌することで感染による炎症を制御する。
肺マクロファージの少数の集団は、血管内マクロファージによって構成されている(111)。Evrenら(121)が示したように、肺の血管系には、CD14loCD16+の単球やCD14+の単球が巡回するだけでなく、血管内マクロファージも存在する。血管内マクロファージは、同じ解剖学的ニッチに存在するにもかかわらず、形態、表現型、遺伝子発現の点で血液中の単球とは異なる。血管内マクロファージは、脾臓の赤血球マクロファージや肝臓のクッパー細胞と機能的に関連しており、赤血球のターンオーバーや鉄代謝に関わる遺伝子(CD163,HMOX1,FTL、SLC40A1,SLC48A1)や、白血球と血管内皮の接着に関わる遺伝子を優先的に発現する(121)。
他の組織のマクロファージと同様に、肺胞マクロファージとIMは、微小環境に依存した2つの機能的表現型に分けられる。M1マクロファージとM2マクロファージである(122, 123)。Mitsiら(124)は、常駐する肺胞マクロファージはほとんどがハイブリッドな表現型、すなわちM1とM2のマーカーを同時に発現していることを示し、常駐する肺胞マクロファージのこのようなハイブリッドな表現型は、地理的な生息地によらず、ヒト集団において安定していることを示した。Spechtら(101)は、単一細胞プロテオミクス解析を用いて、偏光刺激のない培養肺胞マクロファージにおいてM1とM2のシグネチャーが同時に発現していることを示した。安定したハイブリッドM1/M2表現型の存在は、マクロファージの分極に関する従来の(当初の)見解を明らかに超えている。このようなハイブリッド表現型は、特定の刺激に反応してM1とM2に特異的な機能を切り替えることにより、揮発性の微小環境の要求に居住肺胞マクロファージsが迅速に適応することを可能にするかもしれない。
ウイルス感染症におけるマクロファージと単球の機能性
マクロファージや単球は、ウイルス病原体と最初に相互作用する免疫細胞であり、感染することもあれば、ウイルスの拡散に貢献することもある(125)。また、マクロファージや単球は、他の細胞集団と直接接触することで、ウイルスの拡散に貢献する。マクロファージや単球は、免疫反応や炎症プロセスに重要な役割を果たすケモカインやサイトカインを産生しながら、損傷部位に積極的このような行動は、ウイルスが体内で脳を含む様々な組織や臓器に拡散する際にも利用される。ヒト免疫不全ウイルス(HIV)(126-128)、ヒトヘルペスウイルス(HCV)(129)、ヒトサイトメガロウイルス(HCMV)(125)、日本脳炎ウイルス(JEV)(130)などの感染症では、感染した単球が血液・組織の障壁を越えて侵入し、ウイルス粒子を中枢神経系に送り込む「トロイの木馬」現象がよく見られる。これは、安定したウイルスプールを提供し、その再活性化のための最適な条件に応じて突然強化することができる。
ウイルスは、マクロファージや単球に感染して複製するために、特定の障壁を越えてマクロファージや単球と相互作用しなければならない。内部の遺伝子プログラムに基づいて、血流に乗って3日後には、単球はアポトーシスの経路をたどるか、組織マクロファージに分化しなければならない(125)。このような場合、ウイルスは、細胞が分解されるのを避け、代わりに生体内で効果的に複製されるように、細胞を調節し、調整する究極の可能性を示す。ウイルスは、アポトーシス経路を減少させ、アポトーシス経路の制御(NF-κBとPI3K)や、マイクロRNAの関与が示唆されている(131, 132)ミトコンドリア経路の調節(133)により、細胞の寿命を延ばす。これらは、細胞の極性を変化させ、ウイルスの受容体を細胞表面から隠し、サイトカインやケモカインの発現に影響を与え、免疫反応から逃れようとするものである。また、ウイルスを体内に分散させるために、細胞の運動性にも影響を与える。これにより、障害、慢性炎症、さらには認知疾患、多発性硬化症、炎症性脱髄疾患、前癌状態、癌などの素因となる(134)。
末梢血のマクロファージや単球は、ウイルスを臓器や組織に送り込む能力を持っているが(135)、これらの細胞はSARS-CoV-1に非生産的に感染することが明らかにされている。それにもかかわらず、マクロファージ/単球の反応はSARSの病因の中心となっている(137, 138)。なお、SARS-CoV-1の単核食細胞への感染は頓挫するが、MERS-CoVは単球、マクロファージ、樹状細胞で複製できる(16)ことに留意すべきである。
SARS-CoV-2関連のARDSにおける単球および単球由来マクロファージの役割
COVID-19の発症後7~10日目にピークを迎える急激で急速な臨床症状は、古くから知られているサイトカインストームという現象と同一視されている(139)。マクロファージの大量活性化に起因するこの全身反応は、「マクロファージ活性化症候群」(MAS)と呼ばれ、ARDS、播種性血管内凝固症候群(DICS)浮腫、肺炎などのSARS-CoV-2関連の合併症に中心的な役割を果たしている(2,26,27,140)。Huangら(141)が示したように、COVID-19患者(特に集中治療室に収容された患者)は、IL-1β、IL-2,IL-7,IL-9,IL-10,IL-17,G-脳脊髄液、GM-脳脊髄液、IFN-γ、TNF-α、CCXL8,CCXL10,MCP1,MIP1A、MIP1Bの血中濃度が上昇している。COVID-19患者の単球/マクロファージの血中濃度はしばしば基準範囲内に収まっているが、その中の活性化細胞の割合は劇的に上昇している。
COVID-19におけるマクロファージの役割についての研究は少ないが、血中単球の表現型と数にはかなりの努力が払われている。Zhouら(142)は、COVID-19と診断された入院患者33人のコホートを調査し、特にARDSを発症した患者では、CD16+単球(非古典的なCD14+CD16++と、IL-6を高発現する中間的な炎症性CD14++CD16+亜集団を含む)の数が有意に増加していることを観察した。特に、重症のCOVID-19患者では、中間型単球の相対数が血液中の単球全体の45%にまで増加していた(健常者では1〜5%)。この結果は、新型コロナウイルスの感染によって引き起こされる炎症反応の全般化に単球が重要な役割を果たしていることを示している。
Zhangら(143)は、COVID-19患者28人のコホートにおいて、血中単球の中間的な炎症性CD14++CD16+亜集団の発現プロファイルを詳細に検討した。その結果、これらの単球は、炎症性(CD80+)と抗炎症性(CD163+、CD206+)の両方の分化マーカーを発現し、汎マクロファージマーカーであるCD68+にも陽性であることが確認された。これらの結果は、疾患が急性に進行する条件下では、単球が循環中にマクロファージに分化することを示している。この単球/マクロファージの集団は、IL-6,TNF-α、IL-10を高レベルで産生し、サイトカイン・ストームを効果的に促進していた。このような細胞の数は、重度のCOVID-19を発症した入院患者で最も多く、集中治療室での滞在期間と正の相関が見られた。他の研究と同様に、COVID-19患者では、古典的な単球の数が減少する一方で、非古典的な単球と中間的な単球の数が大幅に増加していた(143)。単球では、SARS-CoV-2がデフォルトの転写プログラム(M2型遺伝子に富む)を刺激し、SARS-CoV-2に感染した単球のCD163の発現が非感染対照と比べて有意に高く、一方でHLA-DRの発現は減少した(144)。
前述のように、SARS-CoV-2のウイルス粒子は、単核食細胞に生産的な感染を起こさない(144)。さらに、Liuら(145)は、COVID-19感染者とマッチさせたSARS-CoV-2非感染者との間で、単球上のCD80,CD86,CD72,PD-L1の表面発現に有意な差がないことを明らかにし、SARS-CoV-2が単球に長期的な影響を与えていないことを示した(145)。しかし、別の研究では、SARS-CoV2が単球におけるミトコンドリア活性酸素の産生を誘発し、これが低酸素誘導因子-1α(HIF-1α)の安定化を誘導し、結果的に解糖を促進することが示されている(12)。グルコース濃度の上昇は、単球におけるSARS-CoV-2の複製を促進し、サイトカインの発現を誘導するため、T細胞の反応を直接阻害し、上皮細胞の生存率を低下させる(12)。
COVID-19肺生検の免疫スコアリングでは、特に単球、M1マクロファージ、好中球による大量の骨髄系浸潤が認められ(146)、重症のCOVID-19ではこれらの細胞が優勢であることが確認されている。このようなサンプルではリンパ系のスコアが有意でないことから、重症のCOVID-19では適応免疫が水没していることが示唆される(147)。Shaathら(148)は、単一細胞トランスクリプトーム解析を用いて、重症COVID-19患者の気管支肺胞洗浄液(BALF)マクロファージが炎症性遺伝子発現シグネチャーを示すことを示した。
Liaoら(149)は、新たに登場したシングルセルRNAシーケンシング(scRNA-seq)とシングルセルTCRシーケンシングを用いて、COVID-19患者から分離したBALF細胞の特徴を調べた。その結果、単球由来のマクロファージは、肺胞マクロファージに代わって、重度の損傷を受けた肺のマクロファージ系譜の中で優勢であり、炎症性が高く、強力なケモカインを産生することがわかった。軽症の患者の肺でCD8+T細胞が大量に増殖していることは、COVID-19の制御には迅速で強固な適応免疫反応が極めて重要であるという考えと一致する。COVID-19における適応免疫の主な役割は、Grant (150)による最近の研究でも強調されており、SARS-CoV-2感染患者の大部分でT細胞と単球が肺胞腔内に持続的に濃縮されていることが明らかになっている。
SARS-CoV-2感染に伴うARDSにおける肺胞マクロファージsの役割
ARDSの発症には、マクロファージが関与していることを示す証拠が増えてきている。肺胞マクロファージとIMはARDSにおいて重要な役割を果たしており、マクロファージの分極の時期と程度が、疾患の重症度とその転帰を決定している(152)。
糖尿病、慢性閉塞性肺疾患(COPD)うっ血性心不全(CHF)患者のCOVID-19による高い罹患率と死亡率は、BALF中の肺胞マクロファージ数の増加と関連している(153)。BALF中の肺胞マクロファージ数の増加は、COPD患者でも観察され、疾患の重症度と相関している(154)。また、ディーゼル排気粒子に長期間暴露したマウス(155)、老齢のネズミ(156)、高血圧を増強して心不全に陥ったマウス(157)、拡張型心筋症と運動を組み合わせたモデル(158)でも観察されている。さらに、実験的な老化や糖尿病状態は、肺胞マクロファージの表現型の分布の変化や殺菌能力の低下と関連していた(159-161)。したがって、COVID-19が重症化しやすいということは、ACE2を豊富に発現している肺胞マクロファージの量が増加していることと関連していると考えられる。
重症のCOVID-19では、肺胞マクロファージは好中球やリンパ球との混合浸潤を伴って肺胞腔に拡大する(147)。SARS-CoV-2によって誘発された肺胞マクロファージsの凝集は、急性炎症反応を通して明らかになっている(147, 162, 163)。ARDSの初期段階では、肺胞マクロファージはTLRや他のパターン認識受容体(PRR)の活性化を介して、M1極性になりやすい。マクロファージは一般に様々な種類のPRRを発現しており、ウイルスの病原体関連分子パターン(PAMマクロファージPs)を認識することができる(164, 165)。その結果、M1偏極した肺胞マクロファージは、ウイルス、細菌、エンドトキシンなどの病原因子からの第一防衛ラインとして機能する(166-168)。M1偏極肺胞マクロファージは、活性酸素や、IL-1β、IL-6,IL-18,MCP-1,MIP-2,TNF-αなどのさまざまな炎症性サイトカインを放出する(45, 169, 170)。肺胞マクロファージsによる炎症性サイトカインの産生は、循環器系から肺胞間隔や肺胞空間への好中球の移動を促す(39, 171)。この段階で天然または合成のM1極性阻害剤を投与することにより、ALI関連の死亡率を大幅に減少させることができるかもしれない。このような物質を同定し、ALI/ARDS実験モデルで使用する試みが報告されている(172-176)。メチルプレドニゾロンをマウスに投与すると、肺胞マクロファージの極性がM2表現型に誘導され、ARDSにおける肺の酸素化機能の維持に役立つことが示されている(177)。これらの知見は、M1に偏った肺胞マクロファージとその微小環境がALI/ARDSの進行に主要な役割を果たしていることを示している。同時に、M1偏極肺胞マクロファージはその異なる炎症性行動にもかかわらず、アンフィレグリン(上皮成長因子受容体の強力なリガンド)を発現し、上皮バリアを保護し、炎症性サイトカインの発現を抑制し、炎症の程度を低下させることが、リポ多糖誘発ALIモデルを用いて実証されている(178,179)。COVID-19 におけるアンフィレグリン発現の変化に関するデータはまだ得られていない。
COVID-19の重症度と肺胞マクロファージによるPPARγ複合体の抑制との関連性が最近Desterkeらによって示され(146)、COVID-19だけでなく他のウイルス感染症においても、このマクロファージの制御異常が影響していることが確認された(180-182)。重篤な症状を呈している患者では、肺胞マクロファージsの凝集と活性化がサイトカインストームに直接関係している可能性がある。
肺胞マクロファージは、その炎症促進作用に加えて、抗炎症作用を発揮することもある。炎症時に肺胞マクロファージsを枯渇させると、他の白血球の肺への動員も減少する(118, 164, 183, 184)。肺の炎症が治まった段階では、肺胞マクロファージは食作用によってアポトーシス細胞を剥ぎ取る。このエフェロサイトーシス過程は、肺胞マクロファージによるトランスフォーミング成長因子β(TGF-β)プロスタグランジンE2(PGE2)および血小板活性化因子(PAF)の分泌による炎症性サイトカインおよびケモカインの産生と競合する(185)。COVID-19における肺胞マクロファージの大規模な浸潤と活性化は、古典的に活性化された表現型(M1)から代替的に活性化された表現型(M2)への移行を表しているのかもしれない(147)。ARDSでは、特に抗体依存性亢進の場合、このようなシフトが気道の炎症性損傷や線維化に寄与している可能性がある(186)。SARS-CoV-2は、Sタンパク質とACE2受容体の相互作用を介して肺胞マクロファージに侵入することが示唆されており、肺マクロファージの表面には高レベルのSタンパク質が結合し、ACE2の受容体密度も高い(142, 147)。
新たに報告されたNAMsのIM亜集団は、ARDS治療の有望なターゲットである。これらの細胞は、強い制御遺伝子プロファイルを発現しており、生体内試験で肺の炎症を制御する上で重要な役割を果たしている。NAMsは、インフルエンザ感染やポリイノシン:ポリシチジル酸(Poly(I:C))による活性化後に強力に増殖することが示されているが、NAMsが存在しない場合、炎症反応が増大し、炎症性サイトカインの過剰産生や自然免疫細胞の浸潤が生じる(120)。NAMsが存在しない状態でのウイルス感染では、IL-6,CCL2,CCL3,CCL5などの炎症性サイトカインやケモカインが過剰に産生され、最終的には肺の大規模な損傷と死に至る(187)。
血管内の少数の肺マクロファージsは、ARDSの初期段階で明らかに関与している。これらの細胞は、肺毛細血管に過剰に凝集し、PAMPsに反応して炎症性因子を産生することで、血管傷害に貢献している(121, 188)。
肺での炎症反応は、常にマクロファージの流入によって支えられている(21, 22)。ARDSでは、末梢血単球が肺に集積し、肺組織に侵入してM1マクロファージに分化する(50, 117)。
ARDSの後期になると、M1マクロファージはマトリックスメタロプロテアーゼ(MMP)やCXCL10などの様々なケモカインを産生することでECMの分解を促進し(189, 190)、線維化の回復をサポートする。また、M1マクロファージは、筋線維芽細胞によるMMP-13やMMP-3の発現を誘導することもある(190, 191)。M2マクロファージは、抗炎症性サイトカインやメタロプロテアーゼの組織阻害剤(TIMP)を産生し、ECMの過剰なリモデリングを妨害し、その沈着を促進する(190, 192)。例えば、筋線維芽細胞は、M2マクロファージと共培養することでECM複合体の沈着を誘導することができる(190)。肺病変におけるM2マクロファージの存在は、線維化の進行を示している。IL-4,IL-13,TGF-β、およびArg-1の持続的な発現は、コラーゲンの沈着を促進する可能性がある(193, 194)。筋線維芽細胞の活性化とECMの沈着の程度、そしてそれに伴って生じる線維化の程度は、肺病変の局所微小環境の他の要因に加えて、M1とM2に分極したマクロファージのバランスに依存する。
したがって、ARDSの発症には、リクルートされた炎症性の単球性マクロファージと、抗炎症性(またはハイブリッド)の常駐肺胞マクロファージの両方が関与している。急性肺炎の治療には、M2の分極化/再編成を伴う細胞療法が非常に有効である。マクロファージの極性を抗炎症表現型に強制的にシフトさせることで、ARDSの症状が緩和され(49,195)命が救われるかもしれない。
ARDSに対するマクロファージを用いた細胞治療法
ARDS、特にSARS-CoV-2関連のARDSには100%有効な治療法はなく、治療のほとんどは対症療法にとどまっている。ARDSの生存率は、過去10年間で、中等度および重度の症例に人工呼吸器を使用することで向上した(196)。
この点で、損傷のメカニズムを標的とし、病原体に対する身体の防御機能を維持または強化し、肺の回復を促進する新たな治療法に大きな関心が寄せられている。マクロファージの極性を調節して、M1からM2へ、またはその逆に切り替えることができれば(いわゆる再極性化、またはリプログラミング)COVID-19を含む広範な自己免疫疾患や炎症性疾患に対する新しい治療戦略を提供することができるかもしれない(38,86,197-199)。
マクロファージを対象とした研究が、その後の細胞治療の標的や薬剤として利用されることとの関連性は否定できない。損傷を受けた組織や臓器のマクロファージの表現型を変化させ、in situおよびex vivoの両方のリプログラミングアプローチを用いて(その後、改変されたマクロファージを逆に移植する)病理学的条件下で細胞のホメオスタシスを制御することができるという見通しは最も明白である。しかし、マクロファージの分極を制御する正確なメカニズムはまだ解明されていない。マクロファージの分極は細かく制御されたプロセスであり、豊富な転写因子やその他の主要な制御因子を含むシグナル伝達経路の幅広いネットワークが関与している。M1/M2バランスの変化は、M1偏極の抑制またはM2偏極の促進(またはその両方を同時に、またはその逆)の結果として起こる可能性があり、さらに、マクロファージの中には無極性のままのものもある。マクロファージの強制的なM1極性化は、炎症や細胞死を促進するため、増殖性疾患、特に腫瘍の治療に有用なツールとなる(200, 201)。マクロファージを強制的にM2に分極させると、逆の効果が得られる。M2マクロファージの割合が増加すると、再生、血管新生、ECMリモデリングを刺激することができるため、炎症性疾患の治療に有用なツールとなる。安定したM2極性のマクロファージを得ることは、移植学にとって非常に重要な目標である(202)。
マクロファージを所望の表現型に向けて指向的に分極させることによるARDS治療に関する論文の数は十分ではなく、発表された論文はすべて近年のものである(39, 40, 195, 203-205)。マクロファージが主に炎症を起こすARDSの滲出期に表現型を操作するという目的は、この病気の急性期の症状を防ぐための魅力的な戦略である。Wangらの研究では、CLPFFDという配列のヘキサペプチドをコーティングしたP12金ナノ粒子を開発し、ALIのLPS誘発マウスモデルにおいて、肺胞マクロファージの表現型に影響を与える能力を調べた(203)。その結果、P12はBALF中のM1サイトカイン(IL-12p40,IFN-γ)の有意な減少とM2サイトカイン(IL-10,IL-4,IL-13)の増加を促進することが明らかになった。In vitroの実験では、P12ナノ粒子が骨髄由来のマクロファージの培養において、LPSによる炎症性サイトカインの増加を抑制することが示された。ヘキサペプチドをコーティングしたP12粒子の作用の主な仮説として、著者らは、TLR4シグナル伝達経路を阻害することでALI/ARDSの初期段階におけるマクロファージの過剰な活性化を防止するとともに、炎症性マクロファージを抗炎症性マクロファージに再プログラムし、炎症の修復と停止を促進することを提案している(203)。
別の研究では、好中球の死の特異的なタイプである好中球細胞外トラップ(NET)と、マクロファージの分極との関係を調べた(204)。好中球は、炎症部位に最初に到着する免疫細胞である。NETsが放出され、続いてDNAストランドが放出されて病原体を捕捉することがALIの特徴である。Song et al 204)は、ARDS患者のNETレベルが炎症性マクロファージマーカーと正の相関があることを示している。また、LPS誘発ALIモデルマウスを用いて、NET阻害剤(NE阻害剤およびPAD4阻害剤)を使用すると、BALF中の好中球数が減少し、M1様マクロファージの偏りが緩和されることを実証した(NET阻害剤を実験的に投与すると、炎症性マーカーであるiNOS、CD11c、CD54のレベルが低下することで示される)。NETのM1偏向作用は、試験管内試験でも確認されている。
マクロファージの炎症性・非炎症性の両極化は、マクロファージの代謝状態の変化と関連している。M1マクロファージは主に解糖系でATPを産生し、M2マクロファージは好気的呼吸を行う(206)。Liuらは、LPS誘発ALI/ARDSモデルにおいて、肺胞マクロファージをリプログラミングする手段として、α-ケトグルタル酸(α-KG)の腹腔内投与を提案した(205)。まず著者らは、α-KGが試験管内試験で抗炎症作用を示すことを明らかにした。α-KGは、M1極性を有するMH-S細胞において、IL-1β、IL-6,TNF-αの発現を有意に低下させ、細胞内ATPレベルを上昇させた。ALI/ARDSマウスモデルでは、α-KGは、LPSによって引き起こされる炎症性サイトカインIL-6およびIL-12の血清レベルの上昇、および炎症性遺伝子(IL-1β、IL-6,TNF-α)の発現を抑制する一方、肺におけるM2マーカー遺伝子(Arg1およびMrc1)の発現を促進した。これらの結果から、α-KGはマクロファージの分極を制御することで、LPSによるALI/ARDSを抑制することが明らかになった。
特にARDSにおいては、マクロファージは有望な治療ターゲットである。マクロファージの活性化と偏りを効果的にコントロールすることで、過剰な炎症を抑制し、組織の損傷を抑えることができる。ARDS治療におけるマクロファージの極性を標的としたアプローチの可能性は、多くの前臨床試験で証明されている(173-177, 207)。一方で、無制限の抗炎症性分極は、線維化の進行や二次感染の感受性を高める可能性がある(208, 209)。このセクションで紹介した論文の著者は、LPS誘発ALI/ARDSモデルにおいて得られたマクロファージの抗炎症性分極化の悪影響に関するデータを提供していないが、そのような影響は常に考慮されるべきである。おそらく、低分子ノンコーディングRNAのような一過性の修飾や、因子放出を制御した化学薬剤の使用が望ましい技術であると思われる。
特異的なノックアウトを得るための最も効果的な方法の1つは、CRISPR/Cas9複合体の使用であり、これを用いて再プログラムされたM1/M2マクロファージを安定化させることができる。その成功例が、マクロファージのIFNシグナルに関与するユビキチン特異的プロテアーゼUSP18のノックアウトである(210)。しかし、炎症過程におけるマクロファージの代謝およびシグナル伝達経路は複雑であるため、CRISPR/Cas9複合体の適切な標的を選択することは困難な課題である。現在までに、炎症を起こしているマクロファージと炎症を起こしていないマクロファージで発現が異なる2つの標的遺伝子候補が同定されている。これらの遺伝子を改変することで、マクロファージに安定した炎症促進および抗炎症の表現型を与えることができ、ARDSやCOVID-19細胞療法のツールとなる可能性がある。
結論
要約すると、新型コロナウイルス感染症の病態は、特にARDSで悪化した症例では、肺組織の単球、単球由来のマクロファージ、常駐マクロファージの表現型と機能性に依存する。傷害部位における炎症促進性マクロファージと抗炎症性マクロファージの比率は、肺の病理学的プロセスの経過と重症度に強く影響しており、このバランスは潜在的な治療ターゲットとなっている。マクロファージのリプログラミング戦略の選択は、治療を行うべき疾患の特定の段階(早期または後期)を考慮する必要がある。例えば、ARDSの初期段階では、肺組織の急性炎症に伴い、常在肺胞マクロファージとリクルートされた肺胞マクロファージは主に炎症性に分極されている。したがって、この段階を緩和するには、マクロファージを抗炎症性の表現型にリプログラミングする必要がある。対照的に、ARDSの次の段階では、肺のマクロファージの常駐とリクルートの両方が、炎症性表現型から抗炎症性表現型へと大きく変化する。炎症性マクロファージはECMの分解を促進して線維化を抑制し(過剰な線維化を防ぎ、最終的には線維化の回復を促進する)一方、抗炎症性マクロファージは抗炎症性サイトカインやメタロプロテアーゼの組織阻害剤を発現して線維化を促進するというように、最終段階では炎症性マクロファージと抗炎症性マクロファージの表現型の絶妙なバランスが重要となる。この段階でのECM沈着の程度と肺線維症の重症度は、マクロファージの表現型と機能に強く依存している。
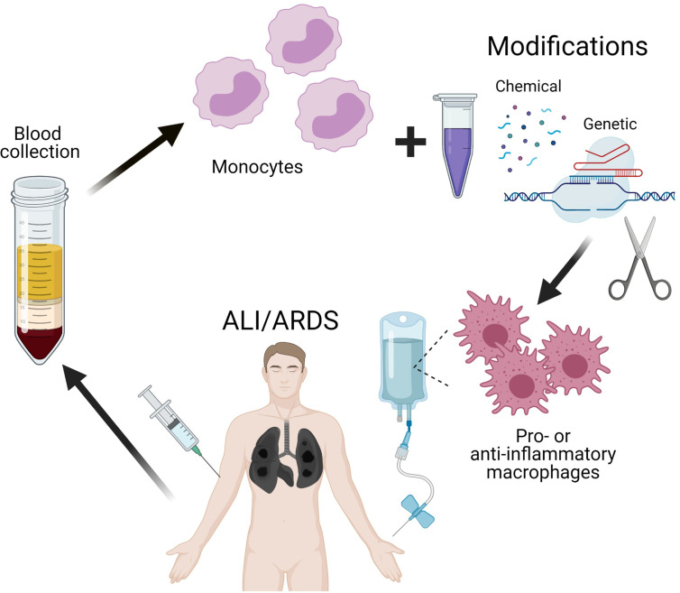
したがって、COVID-19では、ARDSの治療に再プログラムされたマクロファージを用いた細胞治療を成功させることができるかもしれない。ARDSの初期段階でマクロファージの極性を炎症性表現型から抗炎症性表現型に切り替えることで、炎症性サイトカインの膨大な産生を緩和し、サイトカインストームを防ぎ、コロナウイルス感染症患者の死亡率を低下させることができる。そのためには、マクロファージを一過性に遺伝子組み換えして、極性化に関与する特定の遺伝子をノックダウンするなど、マクロファージの効率的な改変技術(安全性が高く、臨床目的に適したもの)が必要である。マクロファージの細胞株を用いることで、試験管内試験および生体内試験で説得力のある予備的な結果が得られた(212)。遺伝子を細胞に導入する既存の方法を継続的に改善することで、単離血単球を含むマクロファージの初代培養細胞を自己移植用に改変することが可能になると確信している(図2)。
図2 マクロファージのリプログラミングによるALI/ARDSの遠近法治療のスキーム