Contents
DECODING INFORMATION ON COVID – 19: ONTOLOGICAL APPROACH TOWARDS DESIGN POSSIBLE THERAPEUTICS
www.ncbi.nlm.nih.gov/pmc/articles/PMC7691137/
要旨
現在までのところ、重症急性呼吸器症候群コロナウイルス2(SARS CoV-2)によって引き起こされるCOVID-19に対する有効な予防的または治癒的な医学的介入は存在しない。利用可能な介入は、本質的には支持的で緩和的なもののみである。
COVID-19による死亡率の新たな説明の中で人気があるのは、この新しい病原体に対する体の積極的な免疫反応に起因する「サイトカイン・ストーム」である。COVID-19は1年足らずでほぼすべての国に広がったが、死亡率は国によって大きく異なっており、人口構成、併存疾患の有病率、コロナ科のウイルスへの先行感染などの要因に基づいている。
このレビューでは、世界中の死亡率に関する現在の文献を調査し、考えられる理由を探り、それによってばらつきを解読している。COVID-19の研究者は、構造的および宿主と病原体の相互作用におけるユニークな特徴に注目し、宿主へのSARS CoV-2の侵入を制御することができるいくつかの可能性のある標的タンパク質および部位を同定したが、これについては本稿で詳細にレビューする。
ウイルスと宿主の両方で新しい標的を同定することは、COVID-19に対する有効なワクチンや治療薬の探索を加速させる可能性がある。さらに、本レビューのオントロジー的アプローチは、研究者が将来出現する可能性のある突然変異ウイルスを予測し、それに備えるための洞察を提供してくれるものと思われる。
キーワード
COVID-19,死亡率、オントロジー、ワクチン、薬剤の再利用
はじめに
重症急性呼吸器症候群コロナウイルス2(SARS CoV-2)による高伝染性呼吸器疾患「COVID-19」が、中国湖北省の省都・武漢の地元の食肉・海産物市場で、動物から人に感染したと考えられている(1)。当初、人から人への感染は不可能とされていたが 2019年12月に発生した。2019年12月の初期発生は武漢でのみ報告されていたが、間もなく武漢の肉海産物市場とは直接関係のない人々の間で中国の他の地域でも症例が発見され、人内伝播が行われていることが確認された。2020年1月30日、世界保健機関(WHO)はCOVID-19aを世界的な緊急事態(2)と宣言し 2020年3月11日にはパンデミック(3)に格上げした。2020年8月中旬までに、全世界で2,060万人の確定症例と749,000人の死亡が報告された(4)。2020年11月中旬の時点で、これらの数字は220カ国で5,320万人の確定症例と130万人の死亡者に上っている。
COVID-19に関連する研究データが世界各地から急速に蓄積されているため、膨大な量のデータが生み出されており、その中には関連性の高いデータも含まれている。生物学的プロセスの全体的な理解を促進し、標的とする医薬品開発の可能性を高めることが期待されるオントロジー的アプローチ。オントロジーとは、対象分野や領域における概念やカテゴリーの集合であり、それらの特性や関係性を示すものと定義される。分子および遺伝子のオントロジーを生成することは、様々なシグナル伝達経路を制御している可能性のある類似した他の分子と関連してタンパク質や遺伝子を分析し、共通の概念を開発することである。同じオントロジーの概念が宿主と病原体のような2つの異なる種を記述する場合、その遺伝子とタンパク質の相互作用を理解するための新鮮な方法を提供することができるかもしれない。個々のタンパク質やDNAを中心とした生物学的な用語は、ユーザーのコマンドに基づいて検索する機能を備えたコンピュータ内の巨大なデータとしてプログラムされていた。オントロジーは、関連する研究分野の様々な研究論文から収集された用語や生物学的動詞であり、検索された情報は、オントロジー研究への応用のための信頼性が高い。
したがって、本レビューでは、オントロジー的なアプローチをとり、医薬品開発のあらゆる角度を無視することなく、学際的な専門家が連携して取り組んだ成果をまとめた。これにより、副作用のない、あるいは最小限の標的薬の開発に向けて、最大限の予測が可能となる。オントロジーは、薬理学、ワクチン設計、個別化医療、新規標的同定など、同じ探求に従事する異なる専門分野の専門家間のコミュニケーションを促進する共通の用語を提供する。個々の部門はそれぞれの分野の専門家を好む傾向があるため、機関は学際的な専門知識とオントロジー的なスキルを持つチームリーダーを任命する必要があるかもしれない。疾患状態の間に活性化または抑制される特定の遺伝子または遺伝子のセットを特定できることは、新薬の標的開発に役立つ。従来の手作業によるアプローチでは、単一の遺伝子または遺伝子の集合を大規模な遺伝子群の中から特定することが面倒であるのに対し、遺伝子オントロジーは、最も可能性の高い遺伝子とその産物をより迅速に特定することができ、それによって創薬プロセスをより信頼性が高く、より迅速かつ安価にすることができる。したがって、遺伝子オントロジーと生物医学オントロジーの異なるブランチは、新薬、新薬ターゲット、およびワクチン開発の開発を加速させる。様々な遺伝子オントロジーコンソーシアムは、遺伝子と遺伝子産物の統合された管理された語彙の開発を促進するプラットフォームを提供している。遺伝子オントロジー(GO)感染症オントロジー(IDO)ワクチンオントロジー(VO)などのいくつかのコンソーシアムは、オープンソースのオントロジーデータベースを提供し、国際的な協力を促進している。本論文では、これらのデータベースの有用性について詳細に議論する。
COVID-19の歴史
コロナウイルスは、アルファ、ベータ、ガンマ、デルタの4つの亜分類に分類され、ヒト以外の哺乳類や爬虫類に感染することが古くから知られている。変異型人獣共通感染性コロナウイルスによるヒトへの最初の感染は 2003年の重症急性呼吸器症候群(SARS)の発生でした。それ以来、以前は病原性のないコロナウイルスがヒトに感染した例が、中東呼吸器症候群(MERS)ウイルスとCOVID-19の原因となるSARS CoV-2であることが報告されている。疫学者は、将来的に変異コロナウイルスによるパンデミックが増える危険性があると警告している。このような状況下では、この一連のウイルスを深く理解し、ヒトに害を及ぼすことのないように抑制するための科学者の世界的な協調的な努力が最優先されるべきである。
SARS CoV-2は 20003年の発生時に774人の死者を出したSARS CoV-1から、最小限のゲノム改変/突然変異を受けている(5)。これまでのところ、3つのコロナウイルス株がヒトに感染し、重篤な症状を引き起こす可能性があると考えられている。MERS-CoV、SARS CoV-1,およびSARS CoV-2である。MERSウイルスは 2012年に発生したMERSウイルスが中東諸国でパンデミックし 2019年には858人が死亡したと推定されている(6)。これらのウイルスは同属に属し、分子的な側面、伝播様式、ヒトの臨床症状が類似しているが、それぞれの発現行動は異なっている。
これは,生殖率,人獣共通感染行動,宿主における臨床症状の種類などの要因によるものと考えられる.MERSの生殖率はR0=1で表され、SARS CoVでは1.7~1.9,SARS CoV-2では2.5であり、後者の方が他の2つよりも生殖速度が速い(7)。再発率が低いにもかかわらず 2012年以降、MERS CoV感染症の致死率(FP)は高く、合計2,494人の確定症例が858人の死亡をもたらした(FP:34.4%)。MERSの再生産率が低いことは、医療システムが感染拡大を抑制するための時間的余裕をもたらしたと考えられる。MERS-CoVは、受容体の宿主細胞への侵入や抗原性ペプチドの宿主細胞への利用など、他の2つのコロナウイルスとは異なる挙動を示している。SARS-CoV-1の感染は2002年から 2004年の間に合計8,089人で検出され、774人が死亡し、FPは9.5%であった(9)。一方、SARSのCoV-2感染は、その繁殖速度がはるかに速いため、COVID-19の感染拡大がはるかに速く(8)、COVID-19の確定症例は2060万人に達し、FP3.9%の死亡者数は749,000人と、はるかに低いものであった。
COVID-19の治療管理
現在のところ、COVID-19に対する特異的な治療法はなく、COVID-19患者の臨床管理は、症状の管理や二次的な細菌感染症の予防、緩和策を目的とした非標的療法で行われている。感染が拡大するにつれ、集団免疫の達成が期待されている。
提案されている治療法は大きく分けて、(1)ワクチンや新薬、(2)既存の抗ウイルス薬の再利用、(3)非抗ウイルス薬とそれに付随する治療管理戦略の3つのカテゴリーに分類される。
ワクチン開発の戦略
Esteban et al(2020)は、COVID-19に対するワクチン開発について幅広く議論している(10)が、今回のレビューでは、システムバイオロジーのアプローチを用いたワクチン設計の様々な側面に焦点を当てている。表1は、WHOの推奨するワクチンの種類とワクチンプラットフォームを示したもので、8つのワクチンプラットフォームのうち、オントロジーを利用することができない生ワクチンと不活化ワクチンを除いたものである。除外された2つのカテゴリーは、ウイルス全体またはウイルス部分を使用しているため、ワクチン設計の機会がない。残りの6つのプラットフォームのうち、オントロジー的アプローチを利用できるものはすべてここで議論され、特に、これまでで最も成功したアプローチであるタンパク質サブユニットワクチンの作成に向けた方法論が議論されている。Gussow et al 2020)のシステム生物学的研究は、すべてのカテゴリーの病原性コロナウイルスと非病原性コロナウイルスのいくつかの抗原性部分を明らかにし、現在の非病原性コロナウイルスが将来的に病原性を獲得する可能性も明らかにした。Gussow氏は、核内局在化シグナルをヌクレオカプシドタンパク質によって増強し、スパイクタンパク質に存在する受容体結合モチーフ(RBM)に挿入することで、コロナウイルスが病原性を持つ可能性があることを明らかにした。したがって、RBMに対するタンパク質サブユニットワクチンの開発は、COVID-19に対する免疫を提供する可能性があると推測される(11)。さらに、現在のヒトコロナウイルス(SARS CoV-1,SARS CoV-2,MERS)の共通の抗原性領域は、長期間にわたって配列が変更されないままである可能性がある。したがって、様々な種のコロナウイルスに共通する遺伝的に保存された抗原性領域を標的とするタンパク質サブユニットワクチンを設計することは、数年間有効であり続ける予防効果をもたらす可能性が高い。
ワクチンは比較的短期間で開発することができるが、副作用を理解して緩和し、ヒト臨床試験に適合するようにするには、複雑で困難で時間のかかるプロセスである。10年前までは、臨床試験がワクチンの副作用を評価する唯一の実行可能な方法であった。現在では、異なるオントロジープロセスにより、ワクチン生産とそれに伴う副作用に関連する障害を予測することが容易になっている。
Vaccine Ontology (VO) (12)は、Vaccine Investigation and Online Network (VIOLIN) (13)の一部であり、いくつかのオントロジー的に価値のある情報を提供している。VOや類似のオントロジーデータベースによって導入された新しい技術は、副作用の原因となる抗原の可能性や性質を絞り込むのに役立つ。後者の抗原は、動物実験を行って副作用を緩和する技術を進化させ、成功すれば限定的な臨床試験のためのワクチンを検討することができる。多くの研究グループは、関心のある生物に対する有効で建設的な抗原/抗原の選択を改善し、宿主系におけるその有益な効果と副作用を予測するためにVOを使用している。Hur J et al 2017)は、ワクチン開発に利用できる特定の遺伝子の選択と絞り込みにVOと相互作用ネットワークオントロジー(INO)を利用した(14)。Xie J et al 2016)が行った別の研究では、膀胱がんの治療薬としての結核ワクチンBCGに関連する有害事象(AE)をオントロジー的に同定した。結核ワクチン使用時の免疫系、皮膚、呼吸器系のAEに関連する遺伝子を含む多くの新規知見が報告されているのに対し、膀胱がん治療における尿路合併症に関連する遺伝子が発見されている(15)。
抗ウイルス薬と非抗ウイルス薬の失敗
COVID-19パンデミックに関する新たな文献やSARSやMERSの発生に関する過去の知見に基づき、科学者たちはCOVID-19を治療するために既存の抗ウイルス薬を修正する作業を行っている。ロピナビルとリトナビルは、以前のコロナパンデミックやHIV治療にも使用されていた。これらの薬剤は、COVID-19ウイルスにも存在する3C様プロテアーゼとして知られるキモトリプシン様システインプロテアーゼを阻害するように設計されている。ロピナビルは試験管内試験でプロテアーゼ阻害剤として有意な活性を示す傾向があるのに対し、リトナビルはロピナビルの半減期を増加させるために共同導入されている(16)。いくつかの研究にもかかわらず、ロピナビルとリトナビルの併用はCOVID-19ウイルスに対して有益な効果を示すことができず、もはや推奨されていない(17,18)。別の抗ウイルス薬であるレムデシビルは、COVID-19患者に対して比較的有益な効果を示すことから、現在では好まれている(19, 20)。レムデシビルはヌクレオチド類似体であり、これはウイルスの繁殖を防ぐと考えられている(21)。この薬剤が市場で最高の薬剤であると主張されているにもかかわらず、現在までに臨床評価で証明された薬剤に対するエビデンスは発表されていない。もう一つの抗ウイルス薬候補として、RNAウイルスのRNA依存性RNAポリメラーゼ(RdRp)を選択的に阻害するように設計されたFavilavir(Favipiravir)がある(22)。これらの薬剤はどちらも同じ原理で作用するが、問題は、これらの薬剤がウイルスゲノムに変異を導入してウイルスをさらに危険なものにしてしまう可能性があることである。これらの薬剤は、ウイルスの繁殖を抑制する目的で製造されているにもかかわらず、その効果は非常に限定的であり、副作用も高いため、連続した臨床試験では不合格となっているようである(23)。COVID-19アウトブレイクの後、いくつかの研究チームは、新たな脅威に対処するために、既存の抗ウイルス薬の改変に取り組んだ。Riva L et al 2020は、12,000以上のFDA承認の小薬様分子を広範囲に分析し、その中からウイルスの複製を阻害する分子を100個見つけ、その中には21の既知の抗ウイルス薬が含まれてた。また、iPSC由来の肺炎球様細胞およびヒト初代肺モデルにおいて抗ウイルス活性を有する化合物として、MDL-28170,ONO 5334,Apilimodを同定した(24)。上記の研究は、in silicoモデルと試験管内試験モデルを組み合わせて広範囲に行われているが、純粋にin silicoを用いてウイルス複製の強力な阻害剤を同定する研究もある(25)。
現在、いくつかの非抗ウイルス薬がCOVID-19症状の治療に使用されている。それらの中では、クロロキン(クロロキン)およびヒドロキシクロロキン( ヒドロキシクロロキン)が最も顕著である。これらはもともと抗マラリア薬として使用されていたが、化学予防、関節リウマチ、一部の血液疾患の治療にも使用され、最近ではHIVの治療にも使用されている。SARS CoV2は、宿主細胞内のエンドソームを生存に、ゴルジ装置を生殖に利用する。どちらの細胞内小器官も酸性環境下でのみ活性化する。クロロキンと ヒドロキシクロロキンは弱塩基であるため、小胞を弱酸性にし、ウイルスの生存をより強固なものにする(26)。また、これらの薬剤は、潜在的にIL-6媒介炎症経路を阻害し、それによって宿主系内のサイトカインストームを防ぐのに役立つ。クロロキンおよび ヒドロキシクロロキンに関連する問題は、吐き気、視力障害、消化器障害、および最も重要なQT間隔の延長などの強い副作用であり、これは心停止につながる可能性がある(27,28)。クロロキン/ ヒドロキシクロロキンは2020年2月末にFDAから緊急代替薬として正式に承認されたが、その後取り消されたが、ブラジルなど一部の国ではまだ許可されている。
トシリズマブも抗炎症薬の一つで、関節リウマチの治療に使用される。これは、IL-6シグナル伝達を特異的に阻害するモノクローナル抗体であり、それによってCOVID-19の重症度を低下させる(29)。上で議論した非抗ウイルス薬は、ウイルスに対して作用するのではなく、サイトカインストームなどの二次的合併症を最小化するための抗炎症薬として使用される。ここで論じた抗ウイルス剤のメカニズムは、製造業者によって指定されたものであるが、これらの薬剤がウイルスの複製を停止させることができないことは、宿主-病原体相互作用に関連したより詳細な研究の必要性を示している。このような詳細な理解は、病原体の脆弱性をより明確にし、それを標的とした薬剤を開発するために不可欠である。
薬理学的管理とは別に、COVID-19患者の治療には回復期血漿療法(CPT)が用いられている。CPTはウイルスに対する抗体のプールを提供し、受動的人工免疫を提供する。CPTは初期段階ではCOVID-19患者に有効であると考えられているが、疾患の急性段階では有意な効果はないようである(30)。さらに、低酸素症や敗血症の影響を受けたICU内のCOVID-19患者には、酸素レベルを維持するための機械換気が推奨されている(31, 32)。全体として、COVID-19の薬理学的側面に関する見解は、このウイルスの病態生理学をよりよく理解する必要があることを示している。薬理学者、ウイルス学者、分子生物学者、生化学者、免疫学者、バイオインフォマティシャンなど、異なるタイプの専門家による膨大なデータの大量解析を行い、それらを一つの傘の下にまとめて利用することで、宿主およびウイルス自体のSARS CoV2の様々な標的を同定することができる。このような統合的なアプローチを促進するために、現在、大量のデータを解析するためのシステムバイオロジーのプラットフォームがいくつか利用可能である。これらのプラットフォームは、宿主と病原体の相互作用の様々な側面をよりよく理解することを可能にしている。以下に、これらのシステムベースのアプローチの主な特徴をいくつか紹介する。
COVID-19 のオントロジーベースのアプローチ
遺伝子オントロジー(Gene Ontology: GO)は、生物学の異なる種の遺伝子や遺伝子産物の属性付けを行うために広く利用されているオンラインデータベースであり、実験的に証明された大量のデータや公開されたデータを、特定の用語のボキャブラリーの下でアラインメントした後にプログラム化したものである(33)。これは、異なる種間の遺伝子/遺伝子/タンパク質/タンパク質の組み合わせに関する膨大なデータベースを収集し、整理するようにプログラムされている。
多くの研究では、GOウェブサイト geneontology.orgからアクセス可能なデータベースを利用して、宿主と病原体の相互作用に関する情報を検索し、病原体と宿主との相互作用を形成する可能性の高いタンパク質のタイプを異なるレベルで特定するために利用している(34, 35, 36)。GOデータベースは、COVID-19アウトブレイク後のGordon DE et al 2020)による重要な研究で使用された。研究者らは、26個のSARS CoV-2タンパク質をクローン化して発現させ、ヒトタンパク質との相互作用を同定し、GOを広範囲に利用して宿主細胞と相互作用するタンパク質の情報を収集し、タンパク質-タンパク質相互作用ネットワーク解析を利用して、合計332個の高信憑性のタンパク質-タンパク質相互作用を発見した。また、化合物PB28がmRNA翻訳の阻害剤として機能し、シグマ-1およびシグマ-2受容体の予測される調節因子として機能する抗ウイルス薬として機能する可能性があることも報告している(37)。
重要な成功にもかかわらず、少数のウェットラボの生物学者は、このような出力をコンピュータによる理論的な予測であり、事実ではないと過小評価しているように見える。現実には、これらのコンピュータは、膨大なデータベースから、前の文献から属性によって与えられたコマンドに従って、複数の組み合わせや組み合わせを迅速に計算するようにプログラムされている。人間の心はまた、様々な組み合わせや組み合わせをテストするが、よくプログラムされたデータ分析が1時間で出力できる結果が、小さなチームのために6ヶ月かかるかもしれないようにゆっくりと。これはまた、主にルーチンワークに費やされている貴重な工数の浪費を招くことになる。さらに、gene ontology.orgでは、多様な専門分野の多様な情報の中から使用可能なデータを絞り込むためのツールがいくつか追加で提供されている。分子オントロジーツールとともに、このサイトは、異なるタイプの病原体および他の変数に対する宿主の免疫システム間のダイナミクスを研究するための免疫学者のための免疫オントロジープラットフォームを提供する。(38). このサイトはまた、SARS CoV-2とヒトの遺伝子やタンパク質との相互作用の基本的な理解を提供する別のリンクも提供している(39)。すなわち、1)ヒト細胞に侵入するためにウイルスによって利用可能なヒトタンパク質の機能、2)ウイルス侵入後の細胞内の脆弱なヒトタンパク質の機能である。
遺伝子オントロジー(Gene Ontology: GO)は、大きく分けて3つの要素から構成されている。1)分子機能、2)生物学的プロセス、3)細胞構成要素。与えられた病原体と宿主との相互作用を3つのカテゴリーとサブカテゴリーに分けて表示し、濃い青色では「強く反応する」、マイルドな青色では「中程度に反応する」を強調表示し、「非反応」は強調表示しない。このようなユーザーフレンドリーなオプションは、ソフトウェアに組み込まれている。
SARS CoV-2の膜タンパク質(Mタンパク質)と宿主のタンパク質を選択して、GOによる宿主病原体相互作用の予備解析を行った。その結果、ウイルスのMタンパク質は30種類の宿主タンパク質と相互作用し、ナトリウム・カリウム輸送ATPase subunit beta-1(ATP1B1)と高い反応性を示し、Anoctamin-6(ANO6)遺伝子とは中程度の反応性を示した(図1)。興味深いことに、これらの遺伝子のタンパク質産物はいずれも肺疾患に大きく関与している。. ATP1B1遺伝子は、Na+/K+およびH+/K+ ATPaseのβ鎖をコードし、また、Na+/K+ -ATPaseのサブファミリーをコードしている。Na+/K+-ATPaseは、細胞膜を横切るNaとKイオンの電気化学的勾配の確立と維持に関与する膜タンパク質である(40)。別の研究では、いくつかの臨床的に意義のある化合物をハイスループットスクリーニングでスクリーニングした結果、心臓配糖体であるジゴキシンがNa+/K+およびH+/K+-ATPasesポンプを阻害することでチクングニヤウイルスの侵入を防ぐのに有効であることが報告されている(41)。さらに、Li B et al 2019)は、ATP1B1が正常な肺機能に必須であり、その調節がダウンすると肺線維症につながる可能性があることを報告した(42)。これら2つの研究は、ATP1B1と宿主細胞へのウイルスの侵入との間の強い関連性を明らかにし、このタンパク質がCOVID-19に対する薬剤開発において貴重なものである可能性を示唆している。
図1 COVID-19のMタンパク質と宿主遺伝子との相互作用を収集したデータベース。ATP1B1とANA6がハイライトされている
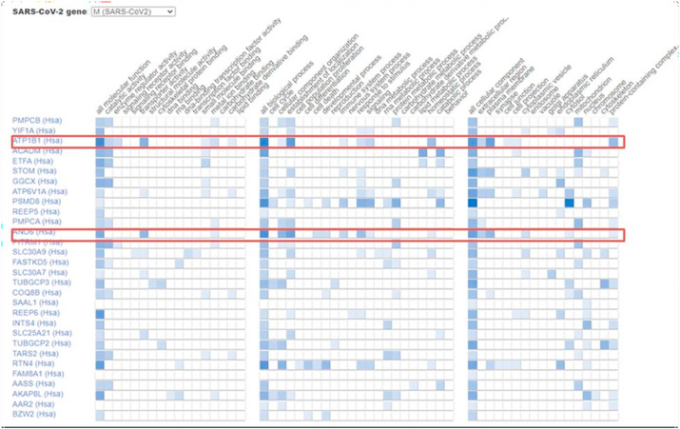
もう一つのヒト宿主タンパク質であるANO6は、ウイルスのMタンパク質と適度な反応性を示すことが(GOを介して)明らかになっている。ANO6は、肺や腸の組織におけるCl-輸送に関与している。最近の研究では、ANO6はCFTR遺伝子の発現および正常な肺機能に必須であることが報告された。このように、GOを用いた単純な解析では、このような解釈が多く出てく。このように、GOを用いた簡単な解析では、様々な分野の専門家の協力を得て、COVID-19と宿主タンパク質との相互作用を解析することができる。このことは、より多くの創薬標的や積極的な治療戦略を特定し、将来のウイルス変異を予測し、それらに対抗するための準備を整えるための潜在的な高速道路を開くことになるかもしれない。Dyer MD et al 2008)は、190以上の病原体に関連するタンパク質-タンパク質相互作用(PPI)ネットワークを用いた膨大なデータセット解析を実証している。彼らは、PPIのほとんど(10,477の宿主-病原体PPIの98.3%)がウイルスと関連していることを報告している。彼らの精巧な研究では、病原体と戦うための新しいターゲットの開発に役立つ可能性のあるいくつかのGOのプロセスと機能を明らかにした(44)。
先行研究では、(Karadeniz et al 2015)が独自のGOモデリングにより、ブルセラの多くの宿主-病原体相互作用遺伝子を明らかにした。彼らは、いくつかの文献マイニングプロトコルとカーネルベースの方法を使用して、宿主-病原体遺伝子相互作用を抽出した(45)。
上記の大量データ解析実験は、病原体の侵入様式、生存戦略、生殖、突然変異の可能性と脆弱性の包括的な理解を開発する研究者の可能性が高いことを示している。さらに、変数の修正や絞り込みによって選択プロセスを洗練させることで、COVID-19ウイルスだけでなく、コロナウイルスファミリー全体の分野での生物学的研究の新次元を切り開くことが可能である。したがって、今回のパンデミックの緊急時には、新たな創薬標的を同定するための最新のアプローチ(GOプロセスによる宿主-病原体相互作用など)(i)創薬標的と相互作用する最適なリガンドの選択のためのハイスループットバーチャルスクリーニング、(ii)創薬と標的タンパク質の安定性を解析するための分子動力学的シミュレーション研究の組み合わせを利用することが推奨される。これらの方法は、COVID-19パンデミックに対する研究を加速させ、何百万人もの感染者を救うのに役立つ可能性がある。
COVID-19患者の死亡率を低下させるMERS感染前の国でのCOVID-19感染症の研究
中東地域におけるCOVID-19感染の研究からは、いくつかの興味深いパターンが得られている。これらの国のいくつかは以前にMERSの影響を受けていた。WHOによると、MERSは2012年6月にサウジアラビアで最初に報告され、その後、それは世界中の27以上の国に広がり始めた。この病気は東地中海(EMR)地域の12カ国に広がっており、そのうち8カ国でかなりの数の病気が蔓延していると報告されている(46)。驚くべきことに、イランを除くこれら8カ国は、他のすべての国と比較してCOVID-19感染症の致死率が有意に低いことがわかった。表2は、WHOが発表したMERSファクトシートに記載されているMERS感染国の致死率とCOVID-19の現状(2020年8月13日現在)を示したものである。MERS感染国でCOVID-19感染の致死率が低い理由については、MERSはCOVID-19とゲノムの50%を共有していることが知られている。共有されている領域は、より抗原性が強く、宿主と病原体の相互作用を展開することが可能である。その強い抗原性のために、空気、エアロゾル、触覚、または病原性の低い用量であっても他のモードを介してMERSウイルスへの軽度の曝露を有する集団は、それらの間で自然免疫を提供することができる。したがって、MERSの過去の感染歴のある中東7カ国の人々が、MERSウイルスだけでなく、COVID-19のゲノムを共有していることから、COVID-19に対しても免疫を獲得している可能性があると考えられる。今回のシナリオでは、MERS感染者の間では上記と同様の現象が見られたが、他の国の集団では同様の現象は見られず、WHOの公式サイトからデータを収集した(表2)。さらに、SARSのCoV-1感染集団の地域でも、COVID-19に対する免疫力が高いとは言えないようである。したがって、MERS CoVの抗原性領域は、サブユニットワクチンの開発に重要であり、MERSだけでなくCOVID-19との戦いにも役立つ可能性があると考えることができる。
表1 WHOに記載されているワクチンの種類とその作用機序
| S. いいえ |
ワクチンの種類 | アクションモード | 参照 |
|---|---|---|---|
| 1 | RNA | 免疫原性領域または微生物のmRNA配列の抗原がベクターワクチンにロードされ、宿主システムでの抗体産生を直接引き起こします | verbek R et al 2019 |
| 2 | DNA | 免疫原性領域または微生物のDNA配列の抗原がベクターワクチンにロードされ、宿主システムでの抗体産生を直接引き起こします | DNAワクチン-WHO |
| 3 | 弱毒生ウイルス | 実験室で弱体化した病原性ウイルスは、宿主系に免疫を誘導するために使用されます | Badgett MR et al 2002 |
| 4 | 不活化ウイルス | 実験室の管理された環境で増殖した殺されたウイルスの粒子が宿主に導入されます。粒子に存在するウイルス抗原は、宿主の免疫系を刺激します。 | Petrovsky N et al 2004 |
| 5 | 非複製ウイルスベクター | 抗原領域を宿主に導入するために使用されるウイルスベクターは、宿主細胞内で複製することができない。これは、免疫をアクティブに保つためにブースター用量を必要とします。 | マージョリーRG2007 |
| 6 | ウイルスベクターの複製 | これらのウイルスベクタースキャンはホストシステム内で複製されるため、ブースター用量は必要ありません。 | マージョリーRG2007 |
| 7 | ウイルス様粒子 | 人工的に合成されたウイルス様粒子が宿主系に導入されます。これにより、ホストシステムに病原性を引き起こすリスクが排除されます。 | Zeltins A et al 2013 |
| 8 | タンパク質サブユニット | タンパク質サブユニットワクチンは、病原体の特定の免疫原性タンパク質部分から調製され、宿主系に直接免疫を誘導する可能性があります | フランシスMJ2018 |
出典は、「WHO 2020」である。WHO 2020. www.who.int/publications/m/item/draft-landscape-of-COVID-19-candidate-vaccines
表2 中東のMERS既感染国でCOVID-19感染率が低下
| 国の名前 | MERSパンデミック
|
日付29までのCOVID-19%致死番目年7月 2020年までに |
||||
|---|---|---|---|---|---|---|
| 感染者(数 | 死亡者数 | 死亡率% | 感染者(数 | 死亡者数 | 死亡率% | |
| サウジアラビア | 1030 | 453 | 44% | 270,831 | 2,789 | 1.03% |
| アラブ首長国連邦 | 77 | 10 | 13% | 59,546 | 347 | 0.58% |
| ヨルダン | 19 | 6 | 32% | 1,182 | 11 | 0.93% |
| オマーン | 6 | 3 | 50% | 77,904 | 402 | 0.52% |
| カタール | 13 | 5 | 39% | 109,880 | 167 | 0.15% |
| クウェート | 3 | 2 | 66% | 65,149 | 442 | 0.68% |
併存疾患とグローバルCOVID-19死亡率
COVID-19感染は、免疫系が健康な若年者にはほとんど致命的にならないようである。COVID-19による死亡率が高い社会では、共存疾患を持つ高齢者が多い傾向にある(47)。糖尿病、喘息、高血圧、肥満などの持病を持つ人はCOVID-19による死亡リスクが高い。現在までのところ、COVID-19に関連する併存疾患のリスクの程度と性質を示す統計は得られていない。それにもかかわらず、国や地域のCOVID-19による死亡とその通常の主要な死因とを比較すると、その関係は明らかである。図1は、COVID-19に感染した上位10カ国の死因となる疾患・理由をグラフ化したものである。COVID-19の死因と他の疾患との関連付けを行うためには、現時点での疾患の病態を知ることが不可欠である。
SARSのCoV1およびMERSウイルスに対しては、宿主システムの自然および適応免疫反応は、I型インターフェロン(IFN)の大量産生を含みます。一方、SARS CoV2に対しては、主要な防御は、宿主系におけるサイトカインプールの産生で構成されている。宿主細胞は、SARS CoV2に対して、IL-2,IL-7,IL-10,G-脳脊髄液、IP-10,MCP-1,MIP-1A、TNF-αなどの炎症性サイトカインを大量に産生することが報告されている。サイトカインストームは、肺炎、広範な肺損傷、急性呼吸窮迫症候群(ARDS)につながる可能性があることが研究で示されている(48)。ARDSによる呼吸不全は、COVID 19関連の死亡率の主な原因と考えられている。心血管疾患(心血管疾患)がん、認知症、呼吸器疾患、下気道感染症などの疾患は、COVID-19感染率の高いこれらの上位10カ国での死亡原因の第一位と関連している。疾患の併存疾患による悪化を明確に理解することで、これらの国でのCOVID-19の死亡率の高さを説明できるはずである。これらの疾患のいくつかは、患者の体内の炎症性サイトカインレベルを上昇させることができるため、サイトカインストームへの感受性が高まり、ARDSの発症にさらにつながる(49)。
米国や欧州連合のような裕福な国は、特定の疾患に対する国民の完全なスクリーニングデータセットで示されているように、上記のすべての疾患状態で高いスコアを示している。いくつかの発展途上国も同様のシナリオを提供しているかもしれない。しかし、これらの国のデータは不完全であることが多く、時には存在しないこともある。インドのような国では、COVID-19に感染した人々の合併症に関する信頼できる情報が入手できない場合がある。現在、COVID-19患者の予後を左右する併存疾患の重要性についての理解が高まってきている。
コモロビディティへの論理学的アプローチ
特定の疾患の併存性を予測するための特定のデータベースやオントロジー的アプローチは存在しないため、併存性を予測する研究イニシアティブが開始されてきた。Ko, Y et al 2016)は、OMIM(Online Mendelian Inheritance in Man)HPO(Human Phenotype Ontology)GAD(Genetic Association Database)DO(Disease Ontology)の4つの異なる疾患データベースから情報を収集した後、併存性に関連する遺伝子や経路を同定することに着手した。実験の結果、糖尿病、強直性脊椎炎、その他の炎症性脊椎症など、さまざまな疾患に共通して関与する重要な遺伝子や経路を同定した。その結果、インターロイキン-10受容体結合、免疫応答の調節、インスリンへの応答に関するGO項の共有が40%も濃縮されていることが報告された(50)。したがって、彼らは、併存疾患、共通経路、遺伝子のリンクを治療計画に組み込むことを強く推奨している。併存症はより高い死亡率と関連しているので、COVID-19の場合も同様の現象を利用して共通のシグナル伝達経路を特定することができる。最近の技術的進歩により、より迅速かつ正確な併存遺伝子の同定が容易になった。Zheng et al 2018は、多発性硬化症(MS)乾癬、肥満における共病遺伝子の関連付けを行い、遺伝子や経路に加えて、多くの薬剤もこれらの疾患を治療するために共通の特性を共有していることを示した(51)。したがって、COVID-19に起因する臨床症状の併存性解析を行うことは、現在のパンデミックに対する既存の薬物作用の可能性を明らかにすることにつながると強く確信している。併存疾患の解析に必要なデータは、OMIM、HPO、GAD、DOデータベースから検索することができる。
年齢とCOVID-19
年齢はCOVID-19の死亡リスクを評価するための重要なパラメータである。COVID-19による死亡の年齢ベースの詳細については、現在までに信頼できる報告がないため、すべての機関は、年齢がCOVID-19による死亡と関連していることを強く示唆している(図2)。加齢は、肺組織の弾力性が徐々に失われることで肺機能を低下させ、呼吸の効率を低下させることが知られている。平均年齢が65歳以上になると、糖尿病、高血圧、心血管疾患などの病的疾患が発症しやすくなり、加齢に伴う呼吸効率の低下が加速し、重度のCOVID-19感染症にかかりやすくなり、死亡のリスクが高くなる。表3は、COVID-19感染が確認された上位10カ国の高齢者人口の詳細を示したものである。米国は症例致死率(CFR)が低いにもかかわらず、高齢者(50歳以上)の割合が高く、上位にとどまっている。特にイタリア、スペイン、フランスは50歳以上の年齢層が人口の40%以上を占めており、COVID-19の発症・死亡原因の第一位を頼りにしている。
図3 韓国、スペイン、中国、イタリアの年齢別症例死亡率(CFR)
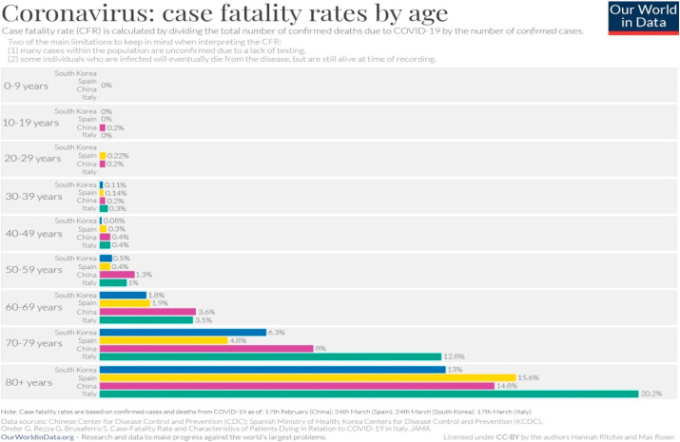
年齢の上昇は CFR に正比例しており、これが現在までに入手可能な唯一のデータである。出典 ourworldindata.org/
図4 COVID-19に対する新たな戦略の開発に必要な概念図
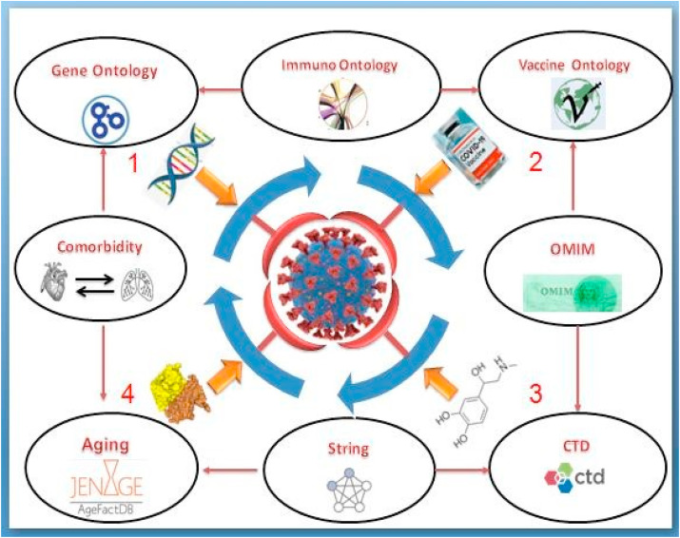
異なるシステム生物学的アプローチを組み合わせることで、1) 新しい標的遺伝子の同定、2) 新しいワクチン候補の開発、3) 新しい薬理学的薬剤の開発、4) 新しいタンパク質標的の開発に関する貴重な情報が得られる可能性がある。
図2
図2 COVID-19感染による死亡率が高い国トップ10とその併存疾患の詳細
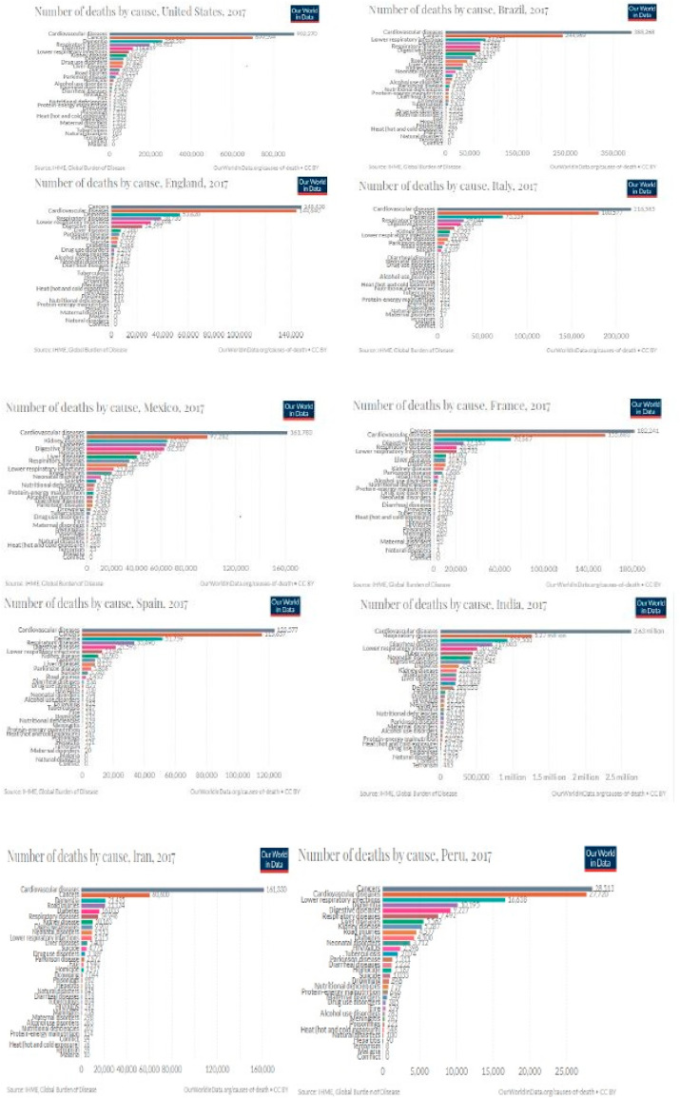
表3 COVID-19死亡率の年齢的上昇は各国間での増加と関連している
| S. いいえ |
国の名前 | 確認されたCOVID19例 | 確認されたCOVID19の 死亡 |
すべての年齢層の人口(000代) | b / w 50-100 +(000’s)歳の人口 |
白黒50〜100歳以上の年齢の割合 | 白黒65-100 +歳の割合 |
|---|---|---|---|---|---|---|---|
| 1 | アメリカ | 4,426,281 | 1,51,374 | 331,002 | 1,17,838 | 35.60% | 16.63% |
| 2 | ブラジル | 2,484,649 | 88,634 | 212,559 | 54,278 | 25.54% | 9.59% |
| 3 | イギリス | 300,692 | 45,878 | 67,887 | 25,743 | 37.92% | 18.65% |
| 4 | イタリア | 246,488 | 35,123 | 60,463 | 27,610 | 45.66% | 23.30% |
| 5 | メキシコ | 402,697 | 44,876 | 128,934 | 27,249 | 21.13% | 7.62% |
| 6 | フランス | 183,804 | 30,223 | 65,274 | 26,155 | 40.07% | 20.75% |
| 7 | スペイン | 280,610 | 28,436 | 46,753 | 19,324 | 41.33% | 19.98% |
| 8 | インド | 1,531,669 | 34,193 | 13,80,004 | 2,67,742 | 19.40% | 6.57% |
| 9 | イラン | 296,273 | 16,147 | 83,994 | 16,942 | 20.17% | 6.57% |
| 10 | ペルー | 395,005 | 18,612 | 32,971 | 7,437 | 22.56% | 8.72% |
下表の人口と年齢の詳細は世界銀行から収集したものであり、COVID-19 のデータは手動で比較した。
注目すべき例外は日本で、人口の48%が50歳以上であるにもかかわらず、CFRが非常に低いことである。その理由は様々な推測があるが、おそらく健康的な生活習慣、遺伝的要因、社会的規律の高さなどが組み合わさって、日本人は社会的距離を置くこと、マスク着用、公衆衛生の維持などの指示に従う傾向が強いのではないであろうか。
VOデータベースや併存疾患データベースと同様に、加齢に関連した情報を提供する年齢ベースがある。JeneAgeはそのようなデータベースの一つであり、専ら加齢に関連した合併症のオントロジー研究に特化している(52)。このデータベースは、寿命情報、食事制限、化学物質を含む加齢表現型データの収集と統合に関する情報を提供している(53)。しかしながら、このデータベースは、COVID19研究者によってまだ比較的利用されていない。Hühne R et al 2018)は、このデータベースを用いて寿命に関連する遺伝子ネットワークを研究している(54).同じ戦略は、SARS CoV-2や他のコロナウイルスに感受性のある遺伝子の年齢関連性の可能性を研究するために採用することができる。
次の概略図は、SARS CoV-2ウイルス、ひいてはコロナウイルスファミリー全体を飼いならすための効果的なワクチンや治療法を見つけるための統合オントロジーアプローチの重要性を説明している。
結論
COVID-19パンデミックは、個人的、社会的、文化的、経済的、政治的に関わらず、人間の日常生活を根本的に混乱させている(55, 56, 57, 58, 59, 60).世界中の研究グループは、この前例のないパンデミックの治療法を見つけるために時間と努力と資源を投資している。創薬やワクチン開発のための従来のアプローチに頼るのではなく、統合された協力的なものに道を譲る必要がある。ここで、現代のオントロジー的アプローチは、病原体と宿主の遺伝子とタンパク質の間の複雑な相互作用の秘密を明らかにするための強力なツールを提供している。新たな知見は、新薬やワクチンの設計におけるパラダイムシフトのブレイクスルーにつながるかもしれない。新しいバイオインフォマティクスツールによって可能になった発表された結果や予測は、単一のチームとして、あるいは創薬アプローチやワクチン開発に限定して取り組むことの有効性の低さを示唆している。
戦争は、現代医学における最大の進歩のいくつかを生み出していた。第二次世界大戦は私たちに抗生物質をもたらした。コロナウイルスの将来の突然変異によってもたらされる新興の脅威は、新しい戦争であり、そのためにCOVID-19は、しかし、練習場である。抗生物質がどのように細菌を打ち負かしたかとは異なり、現在進行中のウイルスとの戦争は、はるかに複雑で協力的である。SARS CoV-2に対する確立された薬やワクチンの過去の失敗は、新薬開発に入る前に慎重に研究され、無駄な繰り返しを防ぐために世界的な研究コミュニティと共有されるべきである。古典的な方法は、標的同定ツールの進化を助ける遺伝子オントロジーやその他のオントロジーのようなオープンソースの新興技術にスペースを与える必要があり、共通の薬物データベース情報は、効果的なワクチンや治療薬の開発に役立つかもしれない。
