コンテンツ
- 要旨
- 序論
- 治療法の選択肢
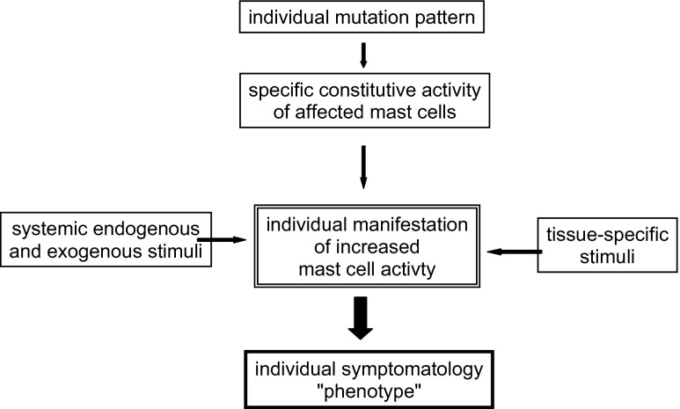
- 図2 MCADにおける個々の表現型の発達のための条件のスキーム
- 一次治療の選択肢
- 表4 全身性肥満細胞症と肥満細胞活性化症候群の症例シリーズと臨床試験
- 表5 肥満細胞(MC)活性化疾患の治療に使用可能な第一選択薬とその標的部位・作用機序
- 表6 MCADにおける対症療法(必要に応じて経口投与)(Molderings et al 2014)より改変
- 下位の治療法の選択肢
- 図3 肥満細胞活性化疾患のための提案された治療法の選択肢
- 表7 肥満細胞活性化疾患の治療に使用できる可能性のある第二、第三選択薬とその標的部位、作用機序
- 表8 肥満細胞活性化疾患の第4選択薬として使用される可能性のあるキナーゼ阻害剤とその標的部位および作用機序
- 表9 肥満細胞活性化疾患の治療に使用する可能性のある最後の選択薬とその標的部位と作用機序 R-レビュー論文(そこにさらに参考文献がある)
- 最後の手段
- 治験薬
- 表10 肥満細胞活性化疾患の単発症例の治療に適応外使用された薬剤(または適応外使用されなかった薬剤
- MCADの薬物治療に関する一般的な考察
- MCADで使用すべきでない薬物
- 表12肥満細胞からのメディエーター放出の高リスクに関連する薬剤およびその治療代替品のコンパイル
- 結論と今後の展望
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4903110/
要旨
マスト細胞活性化疾患(MCAD)は、マスト細胞(MC)メディエーターの可変サブセットの異常放出と、MC増殖による形態学的に変化した変異MC(全身性肥満細胞症[SM]およびMC白血病[MCL])またはアポトーシスの低下による形態学的に普通のMC(MC活性化症候群[MCAS]および十分に分化したSM)の蓄積を特徴とする不均一な疾患群を指す用語である。
MCADの臨床徴候および症状は、疾患のサブタイプによって異なり、MCによる過剰なメディエーターの放出に起因し、また、侵攻性の場合には、MCの浸潤に関連した臓器不全に起因する。ほとんどの場合、MCADの治療は、主にMCのメディエーター放出に関連した症状のコントロールを目的としている。
侵攻性SMおよびMCLのような進行型では、キナーゼ阻害剤のようなMC増殖を標的とする薬剤が提供されることがある。突然変異タンパク質バリアントおよび/または下流のシグナル伝達経路をブロックすることを目的とした標的治療が現在開発されている。
腫瘍性MC上に発現する特異的表面抗原のような他の標的は、将来の治療法の開発のために考慮されるかもしれない。臨床医は、この臨床的に異種疾患であるMCADの評価、診断、効果的な治療法について十分な知識を有していないことが多いため、本研究ではMCADについての知識を深め、現在および将来の治療法を検討することを目的としている。
キーワード
肥満細胞、肥満細胞活性化疾患、全身性肥満細胞症、全身性肥満細胞活性化症候群、治療法
序論
マスト細胞(MCs、図1)1)は、ヒトのすべての組織、特に環境との境界に存在する造血系由来の免疫細胞である。マスト細胞は、エフェクター細胞と調節細胞の両方として作用し、適応免疫や自然免疫において中心的な役割を果たしている(Anand er al)。
免疫学的にも非免疫学的にも重要な役割を果たしているのは、ヒスタミンやトリプターゼのような事前に蓄積されたものだけでなく、ケモカインやサイトカインのようなアレルギー性や非免疫性のトリガーに反応して自発的に合成された多数のメディエーター(200以上)であり、これらのメディエーターが他の細胞に影響を与える可能性がある(Lundequist and Pejler 2011; Ibelgaufts 2016)。MCの機能不全が出現したときに感覚と応答メカニズムの彼らの進化したアレイは、多様な大混乱を巻き起こす。
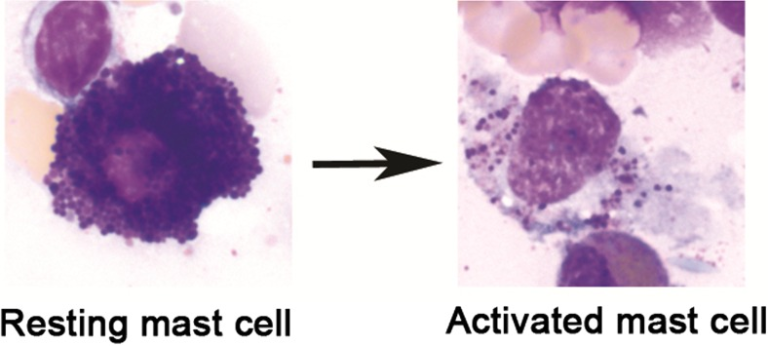
図1 安静時のヒト肥満細胞と活性化誘導脱顆粒後の肥満細胞のMay-Grünwald/Giemsa染色
顆粒染色の損失に注意してほしい。ヒト骨髄から得られた肥満細胞、倍率1000×。
肥満細胞活性化疾患(MCAD; Akin er al 2010)という包括的な用語は、原発性全身性MC疾患の全領域、すなわち全身性肥満細胞症(SM)から構成されており、これはさらにいくつかのサブタイプ(Valent er al 2007; 表11および2),2)原発性MC活性化症候群(MCAS; 表3;3; Molderings er al 2011a; Hamilton er al 2011; Valent er al 2012)およびMC白血病(MCL)に分類されている。
病原学的には、MCADは、MCメディエーターの可変サブセットの異常放出によって特徴づけられる多遺伝子性MC障害のグループ(Molderings 2015,2016)を示し、また、MC増殖(SMおよびMCL)または減少したアポトーシス(MCAS;Kohno et al 2005;Aichberger et al 2009;Kallberg et al 2010a)に起因する形態学的に変化した変異MCおよび免疫組織化学的に識別可能な変異MCのいずれかの蓄積によっても特徴づけられる。
最近の分子遺伝学的知見(Molderings 2015, 2016; Haenisch er al 2014; Lasho er al 2016)によれば、MCADのサブクラスおよび臨床サブタイプは、異なる疾患実体を表すものではなく、より正確には、MC機能障害の共通の一般的な状態の可変性の提示とみなすべきである(Molderings er al 2007, 2010; Hermine er al 2008; Akin er al 2010)。
MCの広範な分布および異常なメディエーターの発現パターンの大きな不均一性の両方のために、症状は事実上すべての臓器および組織で発生する可能性がある;したがって、MCADの臨床症状は非常に多様であり、時には異なる患者(または異なる時間に同じ患者で、または同じ患者の異なる部位で同時に)で反対の異常を示すという、さらなる混乱を招くポイントに至るまで。
ヨーロッパ人におけるSMの有病率は10万人あたり0.3~13人であるが(Haenisch er al 2012; Cohen er al 2014; van Doormaal er al 2013)MCASの有病率は17%(ドイツでは;Molderings er al 2013a, b)と高い。
表 1 全身性肥満細胞症のWHO 2008年診断基準(Valent er al)
主な基準
1. 骨髄またはその他の皮外組織の切片に多巣性の密なMCの集合体(15個以上)があり、トリプターゼ免疫組織化学またはその他の特殊な染色で確認されたもの。
マイナー基準
- 1. 診断生検でのMCの少なくとも25%の非定型的または棘のある外観
- 2. 骨髄、血液または皮外臓器におけるMCによるCD2および/またはCD25の発現
- 3. 骨髄、血液または皮外臓器におけるKITコドン816の突然変異
- 4. 持続的な血清総トリプターゼ上昇>20ng/ml
(1)大基準と小基準のいずれか1つ、または(2)3つの小基準のいずれかによってSMと診断される。
表2 全身性肥満細胞症の分類(Valent er al)
全身性肥満細胞症の分類(修飾型原子価ら、2007)
| 全身性肥満細胞症(SM)のカテゴリー | サブタイプ |
|---|---|
| 怠惰な全身性肥満細胞症 | •くすぶっている全身性肥満細胞症
* * •孤立した骨髄肥満細胞症 •高分化型全身性肥満細胞症 |
| 積極的な全身性肥満細胞症(ASM) | •変革のASM |
| 関連するクローン造血系非肥満細胞系列疾患を伴う全身性肥満細胞症 | •SM-急性骨髄性白血病
* * •SM-骨髄異形成症候群 •SM-骨髄増殖性腫瘍 •SM-慢性骨髄単球性白血病 • SM-慢性好酸球性白血病 •SM-非ホジキンリンパ腫 •SM-多発性骨髄腫 |
表3 肥満細胞活性化症候群(MCAS);Afrin and Molderings 2014より修正を定義するための現在の暫定基準
主な基準
病理的な肥満細胞活性の亢進に起因する臨床的愁訴の星座(肥満細胞メディエーター放出症候群)
マイナー基準
- 骨髄および/または皮外臓器(例えば、消化管生検;CD117-、トリプターゼおよびCD25染色)における局所的または播種性の肥満細胞数の増加
- 骨髄または他の皮外臓器の肥満細胞の25%以上における紡錘形の形態異常
- CD2および/またはCD25の異常な肥満細胞発現(すなわち、CD117/CD25またはCD117/CD2の共発現
- 血液、骨髄、皮外臓器からの肥満細胞の遺伝的変化の検出で、影響を受けた肥満細胞の活動状態に活性の増加という点で影響を与えることが証明されているもの。
- マスト細胞メディエーターの正常値を超えるレベルの証拠(典型的には全血、血清、血漿、尿などの体液から)。* *・血液中のトリプターゼ・尿中のヒスタミンまたはその代謝物(例えば、N-メチルヒスタミン)。* *
・血液中のヘパリン
・血中のクロモグラニンA(心不全または腎不全、神経内分泌腫瘍、または最近のプロトンポンプ阻害薬使用の潜在的交絡因子は除外された
・他の比較的肥満細胞特異的なメディエーター(例えば、プロスタグランジンPGD2,その代謝物である11-β-PGF2α、またはロイコトリエンE4を含むエイコサノイド)。
- 肥満細胞活性化または肥満細胞メディエーターの産生または作用の阻害剤(例えば、ヒスタミンH1および/またはH2受容体拮抗薬、クロモリン)に対する症状反応
(1)大基準と小基準のいずれか1つ、または(2)3つの小基準のいずれか1つでMCASの診断を行う。
本レビューでは、SMおよびMCASにおける薬物治療の現状に焦点を当て、薬物治療のための有望な新規アプローチの展望を述べている。前臨床および臨床開発の様々な段階にある化合物を表にまとめた。まず、現在入手可能な薬剤のうち、MCAS治療に日常的に使用されている薬剤、あるいはMCASの単発症例で成功した薬剤について述べる。この文脈では、MCADの治療に関する公式ガイドラインがないことに留意すべきである。
治療法の選択肢
遺伝的なルーツのため、MCADは一般的に不治の病と考えられている。最近の突然変異研究により、各患者は細胞内のシグナル伝達経路や感覚に関与する受容部位に影響を及ぼす可能性のある遺伝的およびエピジェネティックな変化の個々のパターンを持っていることが明らかになった。
その結果、メディエーターの形成や放出、アポトーシスの抑制や増殖の亢進は、個々の遺伝的・エピジェネティックな条件によって決定され(図2)治療のターゲットとなる可能性がある。したがって、この疾患に対する高度に個別化された治療法が求められている。
残念ながら(検出のしやすさに関して)ほとんどの遺伝的変化(チロシンキナーゼKITのある種の変異、例えばKITD816Vのような少数の例外を除いて)は、罹患したMCの表面の形態や免疫組織化学に変化を与えません。したがって、確実に識別可能なD816V変異を有する患者を除いて、ほとんどの場合において、生検で発見されたMCが遺伝的に変化したMCであるか生理学的なMCであるかは、単純な検査によって決定することができない。
図2 MCADにおける個々の表現型の発達のための条件のスキーム
一次治療の選択肢
不適切なMC活性化の多くの状況を管理するためのステップ1は、患者さん固有の誘因(化学的、物理的、その他)を可能な限り正確に特定し、可能な場合には脱感作し(実際にはほとんどない)それ以外の場合には回避を実践することである。薬物治療に関しては、SMでの臨床治療試験は数例(ミドスタウリン、クラドリビン、マシチニブ;表4),4)しか行われておらず、MCASでの治療試験はまだ行われていない。
MCADの治療効果に関する情報のほとんどは、小規模な症例シリーズ(表4)4)と単発症例の報告に基づいているが、この疾患の突然変異の異質性、したがって臨床症状のパターンと治療反応性の異質性を考えると、おそらく驚くに値しない。
したがって、将来的には、既存の登録機関と協力して国際的な患者登録を確立し、分子的および臨床的な MCAD 表現型に関連する問題に適切に対処できるようにすることが有用であろう。MCADの主な特徴は不適切なMC活性化であるので(Molderings et al 2011a,b; Pardanani 2013; Cardet et al 2013)第一選択の管理の主な要素は、誘因の特定と回避、およびMCメディエーターの産生を制御するための治療法(一次的および二次的/反応性の両方;表5)5およびその作用である(表(表66)。
表4 全身性肥満細胞症と肥満細胞活性化症候群の症例シリーズと臨床試験
全身性肥満細胞症および肥満細胞活性化症候群における症例シリーズおよび臨床治療試験
| 化合物 | 研究またはケースシリーズに含まれる患者の数 | 参考文献 |
|---|---|---|
| H 1 -antihistamines | ||
| ルパタジン | 30 | Siebenhaar etal。 |
| アゼラスチン対クロルフェニラミン | 15 | フリードマン等。 |
| ケトチフェン対ヒドロキシジン | 8 | Kettelhut etal。 |
| クロルフェニラミンとシメチジン | 8 | Frieri etal。 |
| 継続的なジフェンヒドラミン注入 | 10 | アフリン2015 A |
| マスト細胞安定剤 | ||
| クロモグリク酸(クロモリン) | 5 | Soter etal。 |
| 11 | Horan etal。 | |
| 4 | マレット他 1989年 | |
| 8 | Frieri etal。 | |
| 2 | ウェルチ等。 | |
| 2 | Zachariae etal。 | |
| トラニラスト | 2 | 加藤ほか 1996年 |
| キナーゼ阻害剤 | ||
| イマチニブ(STI571) | 14 | Droogendijk etal。 |
| 20 | Vega-Ruiz etal。 | |
| 22 | Lim etal。 | |
| 17 | Pagano etal。 | |
| 12 | パルダナニら 2003 | |
| 5 | ハインリッヒ等。 | |
| 3 | ヘネシー他 2004年 | |
| ニロチニブ(AMN107) | 61 | Hochhaus etal。 |
| ダサチニブ(BMS-354825) | 33 | Verstovsek etal。 |
| 4 | Purtill etal。 | |
| ミドスタウリン(PKC412) | 9 | Papayannidis etal。 |
| 11 | Knapper etal。 | |
| 22 | Chandesris etal。 | |
| 89 | Gotlib etal。 | |
| 14 | Strati etal。 | |
| マシチニブ | 25 | ポール等。 |
| 細胞増殖抑制剤 | ||
| ヒドロキシ尿素 | 26 | Lim etal。 |
| 5 | アフリン2013 A | |
| クラドリビン(2-クロロデオキシアデノシン) | 22 | Lim etal。 |
| 10 | Kluin-Nelemans etal。 | |
| 4 | パルダナニら 2004年 | |
| 3 | Pagano etal。 | |
| 68 | Barete etal。 | |
| 免疫調節 | ||
| インターフェロン-α | 20 | カサッソスら。 |
| 5 | Hauswirth etal。 | |
| 10 | Laroche etal。 | |
| 40 | Lim etal。 | |
| 8 | Pagano etal。 | |
| 6 | Giraldo Castellano etal。 | |
| 9 | ヘネシー他 2004年 | |
| 3 | Worobec etal。 | |
| サリドマイド | 16 | Gruson etal。 |
| IgE抗体 | ||
| オマリズマブ | 4 | モルダリングスら。
2011b a |
| 2 | カーター等。 | |
| 2 | リーベロスとトムセン2015 | |
| ß-交感神経刺激薬 | ||
| イソプレナリン、テルブタリン | 5 | van Doormaal etal。 |
| シクロオキシゲナーゼ阻害剤 | ||
| アセチルサリチル酸 | 4 | バターフィールドとワイラー2008 |
| 20 | バターフィールド2009 | |
表5 肥満細胞(MC)活性化疾患の治療に使用可能な第一選択薬とその標的部位・作用機序
| ターゲットの場所/作用機序 | 成長阻害 | メディエーターリリースの減少 | 症状を和らげるには | 参考文献 | |
|---|---|---|---|---|---|
| 第一選択薬 | |||||
| H 1-抗ヒスタミン薬(できれば第2世代および第3世代) | Hを介してマスト細胞のブロック相互活性化1ヒスタミン受容体。
拮抗H 1ヒスタミン受容体媒介症状 |
バツ | バツ | Church and Gradidge 1980
Valent etal。 2007 R * * ピカードら。 2013 R * * Nurmatov etal。 Siebenhaar etal。 Escribano etal。 2006 R |
|
| H 2 -antihistamines | Hを介してマスト細胞のブロック相互活性化2 -ヒスタミン受容体。
拮抗H 2 -ヒスタミン受容体媒介症状 |
バツ | バツ | Valent etal。
2007 R * * Escribano etal。 2006 R |
|
| クロモグリク酸(クロモリンとしても知られています) | GPR35; 塩化物電流の変調 | バツ | バツ | Soter etal。
Valent etal。 2007 R * * Yangら。 エドワーズ他 2011 エドワーズとHagberg 2010 Zhangら。 Escribano etal。 2006 R |
|
| ビタミンC | ヒスタミンの分解の増加; ヒスチジンデカルボキシラーゼの阻害によるヒスタミン形成の減少 | バツ | バツ | Hagel etal。
ジョンストン他 1992 内田ほか 1989年 Chatterjeeetal。 |
|
原則として、これらの薬剤は、MC活性の十分な低下を達成するために組み合わせて使用する必要があります。患者への耐性が以前の適用からわからない場合は、治療に使用する前に、すべての薬剤を低単回投与で耐性についてテストする必要があります。
治療の成功の前提条件は、MC活性化の識別可能なトリガーを回避することです。この文脈では、薬物療法の開始と並行して、グルテン、牛乳タンパク質、およびパン酵母を3〜4週間食事から除外する必要があります。
R総説(その中のさらなる参考文献)
表6 MCADにおける対症療法(必要に応じて経口投与)(Molderings et al 2014)より改変
- 大腸炎⇒ブデソニド;数日はプレドニゾン>20mg/日
- 下痢⇒c(h)オレスチラミン;ニスタチン;モンテルカスト;5-HT3受容体阻害剤(オンダンセトロンなど);アセチルサリチル酸の増量(50~350mg/日;肥満細胞の脱顆粒を誘発する可能性があるので細心の注意);下痢が改善するまで5日間、各薬剤を段階的に検査する。
- はっきりとした流星症による鼓腸の腹痛⇒メタミゾール;ブチルスコポラミン
- 血管性浮腫⇒トラネキサム酸;icatibant
- 吐き気⇒ジメンヒドラート;ロラゼパム;5-HT3受容体阻害剤;アプレピタントなどのNK1拮抗剤
- 呼吸器症状(主に粘性粘液の産生亢進と強制的な喉のクリアリングを伴う閉塞が原因)⇒モンテルカストなどのロイコトリエン受容体遮断薬;国によってはジレトンなどのロイコトリエン合成阻害薬;緊急:短時間作用型ßシンパトミメティック
- 胃の不定愁訴⇒プロトンポンプ阻害剤(用量設定の解除
- 骨粗鬆症、オステオライシス、骨痛⇒ビスホスホネート系薬剤(成功例の報告は限られており、腎結石や尿管結石を発症するリスクが高いため、MCアルツハイマー病患者ではビタミンD+カルシウムの塗布が第二選択治療となる);カルシトニン;テリパラチド(注意が必要である。この薬剤による胆汁性肝障害の症例が報告されている)デノスマブなどの抗RANKL薬(歯並びの悪い患者や最近の侵襲的な歯科治療では重症化する可能性のある顎の骨壊死のリスクがあるため、ビスフォスフォネートや抗RANKL薬の治療の前に歯科クリアランスが必要となる
- 非心臓性胸痛⇒必要に応じてH2-ヒスタミン受容体拮抗薬の追加投与;また、実績のある胃食道逆流に対するプロトンポンプ阻害薬の投与
- 頻脈⇒AT1受容体拮抗薬;イブラジン
- 神経障害性疼痛・麻痺⇒α-リポ酸
- かゆみ⇒パルミトイルエタノールアミン含有ケア用品、クロモリン含有軟膏
- リウマチ症状⇒エトリコキシブやセレコキシブなどのCOX2阻害剤;パラセタモール
- 貧血⇒鉄欠乏性貧血では、肥満細胞の活性化が激しくなる可能性があるため、鉄の補給(経口、非経口を問わず)は慎重に行う必要がある;代わりに赤血球輸血を考慮すべきである。
- 間質性膀胱炎⇒ペントサン、アンフェタミン
- 睡眠導入型不眠症・睡眠維持型不眠症⇒トリアゾラム
- 結膜炎⇒二次疾患の除外、それ以外の場合はH1-アンチヒスタミン、クロモリン、ケトチフェン、または短期コースのグルココルチコイドを含む防腐剤不使用の点眼薬* *高コレステロール血症⇒(おそらく細胞内への輸送が阻害されているため、食事とは無関係)HMG-CoA還元酵素阻害剤アトルバスタチンによる300mg/dL以上の治療試験
下位の治療法の選択肢
ジフェンヒドラミンの連続注入
時折、間欠的に投与されるエピネフーリン、抗ヒスタミン薬、およびステロイドによって、ほぼ連続的なアナフィラクトイドおよび/または自律神経失調症の状態がうまくコントロールされない患者がいる。以下でより詳細に議論されるように、このような患者の中には、特に広範囲の薬物賦形剤によって誘発されるものもあり、そのような患者は、いかなる偽薬(非純薬)の試験にも耐えることが困難であるが、このような患者における薬物試験を追求するためには、ある程度の安定性が必要である。
ジフェンヒドラミンは、MCの活性化を速やかに抑制し、アレルギー反応やアナフィラキシーの治療に使用されているヒスタミンH1受容体拮抗薬(他の非致死的な副作用として、めまいや食欲増進を引き起こす可能性がある)として、忍容性の高い薬である。
しかし、その半減期は1時間と短い(www.drugbank.ca/drugs/DB01075)。しかし、間欠的に投与されると、初期の治療用血清レベルは急速に治療レベル以下にまで低下し、患者はさらに別のフレアへと足踏み状態に陥る。
ジフェンヒドラミン連続注入の安全性は、成人および小児の難治性化学療法誘発性嘔吐を対象とした「BAD」レジメン(ジフェンヒドラミン[ベナドリル]、ロラゼパム[アチバン]、およびデキサメタゾン)の試験で確立された(Dix et al 1999;Jones et al 2007)。
ほぼ継続的なアナフィラクトイド/自律神経失調症性フレアに苦しんでいるMCAS患者10人の小規模シリーズにおいて、ジフェンヒドラミンを10-14.5mg/hで継続的に注入することは、ほとんどの患者でフレア率を劇的に低下させる効果があり、少なくとも21ヵ月間は安定した投与量で安全に持続すると考えられている(Afrin 2015)。安定化により、他の有用な薬剤の試験が成功したが、ジフェンヒドラミンの継続投与を中止することに成功した患者はまだいない。
急性および慢性免疫抑制療法
典型的には第一選択薬ではないが、急性および慢性の免疫抑制療法が考慮されうる(図3;3;表7)。グルココルチコイドは、幹細胞因子(SCF、およびおそらく他のサイトカイン)の産生を減少させ、MC の活性化を減少させることを含む MCAD の有益な効果を発揮する可能性がある、様々 なメカニズムによって、Oppong ら 2013 年に広範囲にレビューされている。
そうでなければ難治性の急性(および慢性)症状を効果的にコントロールするためには、1日あたり20mg以上のプレドニゾン相当量のグルココルチコイドが頻繁に必要とされる。それらの慢性毒性プロファイルは、長期使用には不利であるが、そのような毒性は、いくつかのケースでは受け入れなければならない。
アザチオプリン、メトトレキサート、シックロスポリン、ヒドロキシ尿素、およびタモキシフェンのMC活性に対する影響は、個々の疾患因子に応じて、影響がないものから中等度のものまで様々である。関節リウマチの治療と同様に、アザチオプリンおよびメトトレキサートは、がん治療や免疫抑制療法後の移植治療で使用される量よりも低い1日量で使用することができる。
シクロスポリンによる効果的なMCAD療法には、移植医療で使用されるものと同じくらいの高用量が必要である(M. Raithel、個人通信)。メトトレキサートは、有効であるためには非経口的に投与しなければならず(未発表の観察、G.J. Molderings)リスク-ベネフィット分析では、MCからの非免疫学的ヒスタミン放出の可能性を考慮しなければならない(Estévez er al)。 1996)。したがって、本化合物の使用は、メトトレキサート感受性の併存疾患(例えば、関節リウマチおよび血管炎)を有する MCAD に限定されるべきである。
図3 肥満細胞活性化疾患のための提案された治療法の選択肢
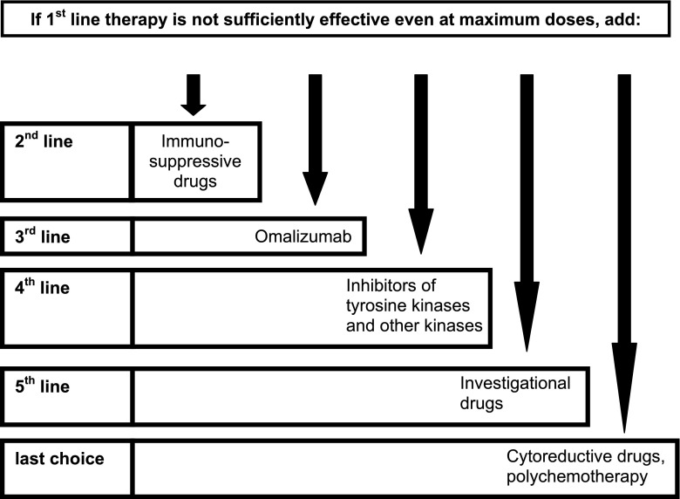
すべての薬剤は、先の適用から患者における耐性が不明な場合は、治療前に低用量の単回投与で耐性試験を行うべきである。
適応症の詳細については、本文
表7 肥満細胞活性化疾患の治療に使用できる可能性のある第二、第三選択薬とその標的部位、作用機序
| ターゲットの場所/作用機序 | 成長阻害 | メディエーターリリースの減少 | 症状を和らげるには | 参考文献 | |
|---|---|---|---|---|---|
| 二次治療薬 | 免疫抑制薬 | ||||
| アザチオプリン | 複数のターゲット | バツ | バツ | Nolte and Stahl Skov 1988、未発表のデータを所有 | |
| シクロスポリン | カルシニューリン阻害剤 | バツ | バツ | 黒澤ほか 1999、Broyd etal。 | |
| 糖質コルチコイド | 複数のターゲット | (バツ) | バツ | バツ | Zen etal。
2011 R |
| ヒドロキシ尿素 | 複数のターゲット | バツ | バツ | Lim etal。 | |
| タモキシフェン | MCADにおける正確な作用機序は不明 | バツ | バツ | 単一の場合 | Butterfield and Chen 2016、Duffy etal。
2003 ; |
| メトトレキサート | 複数のターゲット | ? | バツ | サギら 2011、Vrugt etal。 | |
| サードラインの薬 | |||||
| オマリズマブ | 抗IgE抗体 | バツ | モルダリングスら。
ベルとジャクソン2012 ; Kibsgaard etal。 Kontou-Fili etal。 |
||
| エトリコキシブ
* * アセチルサリチル酸 |
COX阻害剤 | バツ | Butterfield and Weiler 2008
Breslow etal。 バターフィールド2009 |
||
| モンテルカスト | アンタゴニストのCys-LT 1つの受容体 | バツ | Tolar etal。
Cikler etal。 Breslow etal。 ターナー他 2012年 |
||
| ジロートン | 5-リポキシゲナーゼ阻害剤 | バツ | ロドリゲス等。 |
R総説(その中のさらなる参考文献)
最近、ヒト化抗IgEマウスモノクローナル抗体オマリズマブは、確定的な試験はまだ実施されていないが、MCADにおいて安全かつ有効であると複数の症例報告で報告されている(例えば、Molderings et al 2011b;Kontou-Fili et al 2010;Bell and Jackson 2012;Kibsgaard et al 2014)。
オマリズマブによる治療は許容できるリスクとベネフィットのプロファイルを持っているので、少なくとも数種類の治療法に抵抗性のあるMCADの症例では検討されるべきである。この薬剤の費用が高いため、第三選択(またはそれ以降)の治療となる可能性が高い(表(表7)。7)。
プロスタグランジン濃度の上昇が持続的な潮紅などの症状を引き起こす場合には、アセチルサリチル酸(ASA;50-350mg/日)の増量によるシクロオキシゲナーゼの阻害は、おそらく有機酸としての化学的性質によりMCの脱顆粒を誘発する可能性があるため、細心の注意を払って使用することができる。
ロイコトリエン拮抗薬モンテルカスト(1日2回の投与でより効果的な可能性がある;個人的観察、L.B. Afrin)および5-リポキシゲナーゼ阻害薬ジルトンは、MCADを有する患者、特に難治性の胃腸症状および尿症状を有する患者において有用なアジュバントであり得る(Tolar et al 2004;Turner et al 2012;Akhavein et al 2012)。
* *
キナーゼ阻害剤の研究は、市販薬(例えば、イマチニブ、ニロチニブ、ダサチニブ)および実験的なもの(例えば、ミドスタウリン、マシチニブ)の両方で、SMにおいて無反応から部分的または完全な反応に至るまでの可変的な反応をもたらした(図3;3;表8)8)。
MCADの治療に使用されるすべての薬剤と同様に、治療の成功は個々の患者さんに強く依存しているようであり、この疾患の観察される突然変異の異質性を改めて強調している。SM患者を対象とした正式な研究では、いくつかのキナーゼ阻害剤は骨髄の組織学的正常化や実験室での代替マーカー(例えば、血中トリプターゼレベル)の改善に反映されてMC負担を減少させたが、メディエーターに関連した症状の改善はせいぜい部分的なものにとどまった(Droogendijk et al 2006年;Gotlib et al 2008年;Verstovsek et al 2008年;Vega-Ruiz et al 2009)。
MCADの症状は、病理学的に過剰に活性化された変異MCによって二次的に活性化された正常MCからのメディエーター放出の方が多いのではないかという示唆が繰り返されてきた(Galli and Costa 1995; Rosen and Goetzl 2005; Boyce 2007; Kaneko er al 2009; 図22,Molderings er al)。
Molderings et al 2014年の図22)症状の強さおよびパターンがMCの増殖および浸潤の程度と相関しない理由を説明するのに役立つ(Topar et al 1998年;Hermine et al 2008年;Broesby-Olsen et al 2013年;Erben et al 2014年;Quintás-Cardama et al 2013)。
MCの増殖を促進するMC内の経路の違いと、メディエーターの産生/放出の違いは、キナーゼ阻害剤がMCの負担およびMCに起因する症状を異なる程度に減少させる理由を説明するかもしれない(Droogendijk et al 2006; Gotlib et al 2008; Verstovsek et al 2008; Vega-Ruiz et al 2009; Table Table8)。8)。
しかしながら、いくつかの症例報告では、キナーゼ阻害剤が症状の緩和に有意に有効であった。したがって、これらの薬剤の潜在的な重篤な副作用にもかかわらず、早期に個々の症例で治療試験を行うことが正当化される可能性がある。MCASにおいても、これらの薬剤のいくつかで部分的および完全奏効が報告されている(例えば、Afrin 2010,2011,2012,2015;Afrin et al 2015a)。
本人におけるキナーゼ阻害剤の投与量は、しばしば、他の用途(例えば、イマチニブ、スニチニブ;Afrin et al 2015a)でそのような薬剤がどのように投与されるかに比べてかなり低い。おそらく、複数の細胞内経路の同時活性化につながる複数の遺伝子における原因変異のために、ミドスタウリンおよびスニチニブのようなマルチターゲットキナーゼ阻害剤は、1つの細胞内経路のみを選択的にダウンレギュレートする薬剤よりも効果的であるかもしれない。
表8 肥満細胞活性化疾患の第4選択薬として使用される可能性のあるキナーゼ阻害剤とその標的部位および作用機序
| ターゲットの場所/作用機序 | 成長阻害 | メディエーターリリースの減少 | 症状を和らげるには | 参考文献 | |
|---|---|---|---|---|---|
| 四次薬 | チロシンキナーゼおよび他のキナーゼの阻害剤 | ||||
| イマチニブ | キット(D816Xを除く)、PDGFR、Bcr-Abl、Arg / Abl2、DDR-1 | バツ | (バツ) | バツ | パルダナニら 2003
Droogendijk etal。 Lim etal。 Vega-Ruiz etal。 Aman etal。 Vaali etal。 QUINTAS-Cardamaら。 2011 R * * マートンら。 |
| ニロチニブ | キット、PDGFR、Bcr-Abl | バツ | (バツ) | Hochhaus etal。
QUINTAS-Cardamaら。 2011 R * * Hochhaus etal。 El-Agamy 2012 |
|
| ダサチニブ | キット、BCR-ABL1、Lyn、Btk、Tec | バツ | (バツ) | Verstovsek etal。
Hantschel etal。 Gleixner etal。 QUINTAS-Cardamaら。 2011 R |
|
| スニチニブ | VEGFR、PDGFR、KIT、FLT3、RET、CSF1R、SRC、
* * 313の潜在的なキナーゼ標的 |
バツ | バツ | バツ | アフリン等。
ヤマキとヨシノ2012 パパエティスとシリゴス2009 ベアライン2010 |
| マシチニブ | キット、PDGFRα、Lck、LYN、FGFR3、FAK | バツ | バツ | マレクら 2014
Moussy and Kinet 2014 Paul etal。 QUINTAS-Cardamaら。 2011 R |
|
| ミドスタウリン | PKC、FLT3、KIT、PDGFR、VEGFR2 | バツ | バツ | バツ | Gotlib etal。
Papayannidis etal。 Knapper etal。 QUINTAS-Cardamaら。 2011 R |
| ポナチニブ | Bcr-Abl、KIT、FLT3、FGFR1、PDGFRα、Lyn | バツ | ジンら 2014
Gleixner etal。 |
||
| バフェチニブ | キット(D816Xを除く)、Abl、Lyn | バツ | ピーターら。 | ||
| ボスチニブ | リン、Btk | バツ | ASM患者では効果がない | Gleixner etal。
Randall etal。 |
|
重度のMC負荷および/または侵攻的な臨床経過を有する肥満細胞症患者では、細胞破砕療法が処方される(Lim er al 2009; Valent er al 2010)。残念ながら、SMにおける有効な細胞破壊的治療法は現在のところ数が少なく、典型的には中程度の奏効率、質、および持続時間しか提供されていない。
細胞破壊的な選択肢には、インターフェロン-αおよび2-クロロデオキシアデノシン(クラドリビン、2-CdA;図33および表9)9)が含まれる。インターフェロン-αはプレドニゾンと併用されることが多く、侵攻性SMの細胞破砕療法として一般的に使用されている。
インターフェロン-αは、症例の割合で肥満細胞症に関連した器官障害を改善するが、かなりの副作用(例えば、インフルエンザ様症状、骨髄抑制、抑うつ、甲状腺機能低下症)を伴うことがあり、MCADにおける使用が制限される可能性がある(Simon et al 2004;Butterfield 2005)。
PEGイル化インターフェロン-αは、いくつかの骨髄増殖性新生物において非PEGイル化型と同等の効果があり、非PEGイル化型よりも毒性が低いことが示されているが、MCADでは特に研究されていない。2-クロロデオキシアデノシンは一般的に、インターフェロン-αに対して不応性または不耐性である侵攻性SM患者の最後の選択薬として予約されている。2-CdAの潜在的な毒性には、日和見感染症のリスクを伴う骨髄抑制およびリンパ減少症の著しい長期化が含まれる。
表9 肥満細胞活性化疾患の治療に使用する可能性のある最後の選択薬とその標的部位と作用機序 R-レビュー論文(そこにさらに参考文献がある)
| ターゲットの場所/作用機序 | 成長阻害 | メディエーターリリースの減少 | 症状を和らげるには | 参考文献 | |
|---|---|---|---|---|---|
| 最終選択薬 | |||||
| インターフェロン-α | 複数のターゲット | バツ | (バツ) | サイモンら。
カサスス他 2002 Hauswirth etal。 バターフィールドら。 バターフィールド2005 R * * 吉田ら。 Lim etal。 QUINTAS-Cardamaら。 2011 R |
|
| クラドリビン | ヌクレオシドアナログ | バツ | バツ | バツ | テフェリら 2001
Kluin-Nelemans etal。 Pardanani etal。 Lim etal。 ベーム他 2010 Radojkovićら。 QUINTAS-Cardamaら。 2011 R * * Lock etal。 Barete etal。 |
最後の手段
急性骨髄性白血病の治療に用いられるような集中的な導入療法や、幹細胞レスキューを用いた高用量療法を含むポリ化学療法は、ごくまれな特定の患者に限定された治療法である。
同種幹細胞移植は、長い間永久的ではないと考えられていた肥満細胞症の寛解をもたらすことがある(Spyridonidis er al 2004; Nakamura er al 2006; Bae er al 2013; Gromke er al 2013)が、最近のデータは新たな希望を与えてくれるかもしれない(Ustun er al 2014)。
治験薬
MCAD 以外の適応症で承認されている薬剤はいくつかあるが、これらの薬剤は MCAD の単離例で既に成功している(表(表 10)。10)。
第一選択から第四選択までの治療が奏功しなかった症例では、これらの化合物が治療の選択肢として検討されることがある。
表10 肥満細胞活性化疾患の単発症例の治療に適応外使用された薬剤(または適応外使用されなかった薬剤
| ターゲットの場所/作用機序 | 成長阻害 | メディエーターリリースの減少 | 症状を和らげるには | 参考文献 | |
|---|---|---|---|---|---|
| 治験薬 | |||||
| サリドマイド | 正確な作用機序は不明 | バツ | ダマジら 2008
Gruson etal。 |
||
| レナリドマイド | 無効 | Kluin-Nelemans etal。 | |||
| フラボノイド(例、ルテオリン、ケルセチン、ゲニステイン) | 複数 | バツ | (バツ) | (バツ) | アレクサンドラキスら。
Kempuraj etal。 Min etal。 Finn and Walsh 2013 R * * Weng etal。 Lee etal。 ウェング他 2015年 |
| ミルテフォシン | いかだモジュレーター | バツ | (バツ) | ウェラー等。
Maurer etal。 2013 R |
|
| メポリズマブ | IL-5抗体 | バツ | 大谷ほか 2012年 | ||
| リツキシマブ | CD20抗体 | バツ | Borzutzky etal。 | ||
| ルキソリチニブ | JAK | バツ | バツ | Yacoub and Prochaska 2016
Kvasnicka etal。 |
|
| カンナビノイド | カンナビノイド受容体のアゴニスト | バツ | De Filippis etal。
Frenkel etal。 自分の未発表の経験 |
||
| メチレンブルー | グアニル酸シクラーゼ阻害剤 | アナフィラキシー治療 | Rodrigues etal。
エヴォラとサイモン2007 R |
||
| ピメクロリムス | カルシニューリン阻害剤 | バツ | 皮膚症状; (マウス) | Ma etal。
Correia etal。 |
|
| エベロリムス | mTOR | 無効 | パリクら。 | ||
| リバビリン | KITおよび他のタンパク質の体細胞変異の発生に関与している可能性のあるゲノム内の活性化されたレトロウイルス要素の抑制の可能性 | バツ | バツ | Marquardt etal。
モルダリング2016 自分の未発表の経験 |
|
様々な薬剤が、試験管内試験および生体内試験の動物モデルにおいて、MC増殖を阻害し、MCメディエーター放出を減少させ、および/またはメディエーター誘発症状を緩和することが示されている(表(表11)。11)。
これらの薬剤のいくつかは、特定の適応症(アンブロキソール、スタチン、メフロキイン、およびルキソリチニブなど)で承認されており、したがって、MCアルツハイマー病患者が適応症の障害(例えば、高コレステロール血症-スタチン、粘液うっ血-アンブロキソール、多血症ベラ-ルキソリチニブ)およびMCADの両方に苦しんでいる場合には、(いくつかの薬剤の財政的な考慮を考慮して入手可能であれば)使用されるかもしれない。
重要な問題は、適応症が承認されていない他の化合物が臨床現場でどのような役割を果たすべきかということである。一般に、新規標的治療薬の臨床導入を妨げる可能性のあるいくつかの課題がある。これらの課題のいくつかには、前臨床所見の臨床への翻訳における固有の問題、疾患における複数の共役性調節障害経路の存在、臨床試験の最適なデザイン(例えば、適格性基準やエンドポイント)に関する疑問が含まれている。
特に、新規な標的治療の単離された方法での試験は問題があり、実際にはこれらの新規化合物の有効性を過小評価する可能性がある。並行する重要な経路を標的とするためには、併用療法が鍵となると考えるのが妥当である。
表11 肥満細胞のアポトーシスを誘導し、試験管内試験および/または生体内試験で肥満細胞メディエーターの放出を抑制することから、肥満細胞活性化疾患に対して活性を有する可能性のある治験薬
| ターゲットの場所/作用機序 | 成長阻害 | メディエーターリリースの減少 | 症状を和らげるには | 体外で調査 | インビボで調査 | 参考文献 | |
|---|---|---|---|---|---|---|---|
| 治験薬 | |||||||
| ABT-737 {(R)-4-(3-ジメチルアミノ-1-フェニルスルファニルメチル-プロピルアミノ)-N {4- [4-(4′-クロロ-ビフェニル-2-イルメチル)-ピペラジン-1-イル]-ベンゾイル} -3-ニトロ-ベンゼンスルホンアミド)} | BH3ミメティック | バツ | マウスBMMC、ヒト臍帯血由来MC、C57 MCライン、MC / 9MCライン | マウス | Karlberg etal。 | ||
| 17-アリルアミノ-17-デメトキシゲルダナマイシン、
* * ゲルダナマイシンガネテスピブ(STA-9090) |
熱ショックタンパク質90への結合 | バツ | HMC-1、イヌBMMC、C2 MC系統、BRイヌ肥満細胞腫細胞株 | Fumo etal。
Lin etal。 |
|||
| アンブロキソール | 複数 | バツ | 人間のMC | ギブスら。 | |||
| アミトリプチリン、クロミプラミン、マプロチリン | まだMCADで定義されていません | バツ | オスのウィスターラット | グルジェル等。
Clemons etal。 |
|||
| ベンゾジアゼピン | まだ定義されていません | (バツ) | バツ | バツ | モルダリングスら。2013b ; Dueñas-Laitaetal。
2009 ; Bidri etal。 |
||
| BI 2536 {(R)-4-(8-シクロペンチル-7-エチル-5-メチル-6-オキソ-5,6,7,8-テトラヒドロプテリジン-2-イルアミノ)-3-メトキシ-N(1-メチルピペリジン-4-イル)ベンズアミド} | ポロ様キナーゼ-1 | バツ | HMC-1、一次ヒト腫瘍性MC | ピーターら。 | |||
| BLU-285(化学構造はまだ公開されていません) | キット | バツ | HMC-1.2、
* * P815マウス肥満肉腫細胞 |
Evans etal。 | |||
| ボツリヌス毒素A | SNAREタンパク質の切断 | バツ | バツ | SDラット | パーク2013 | ||
| ブタプロスト | EP 2受容体アゴニスト | バツ | ヒト肺MC | ケイら。 | |||
| セリバスタチン、フルバスタチン、アトルバスタチン | MCADでは不明 | バツ | バツ | プライマリヒトMC、HMC-1、P815 | Krauth etal。
Paez etal。 |
||
| ケモカイン受容体拮抗薬 | MCで発現する活性化ケモカイン受容体を標的とする | バツ | マウス | Koelink etal。
2012 R |
|||
| シンナムアルデヒド | シグナル伝達分子、例えば、ERK1 / 2、JNK、p38、Akt | バツ | ヒトMC、RBL-2H3細胞 | Hagenlocher etal。
ビビ他 2014 R |
|||
| アルギニンとグルタミンの組み合わせ | 複数 | バツ | 人間の腸のMC | Lechowski etal。 | |||
| クマリン(スコポレチン) | まだMCADで定義されていません | バツ | HMC-1 | ムーンら 2007
フィンとウォルシュ2013 R |
|||
| CRA1000 { N-エチル-4- [4-(3-フルオロフェニル)-3,6-ジヒドロ2 Hピリジン-1-イル] -6-メチル- N – (2-メチルスルファニル-4-プロパン-2-イルフェニル)ピリミジン-2-アミン} | 非ペプチド性コルチコトロピン放出因子拮抗薬 | バツ | マウス皮膚MC | 下田他 2010年 | |||
| クレノラニブ | FLT3 | バツ | HMC-1、p815、SM患者からのMC | Schittenhelm etal。 | |||
| クルクミン | 複数 | バツ | HMC-1、マウスBMMC | BALB / cマウス | ペクら。
キニーら 2015年 |
||
| 脱メチル化剤(5-アザシチジン、5-アザ-2 ‘デオキシシチジン) | DNAメチル化 | バツ | (バツ) | HMC-1 | Krug etal。
Meeran etal。 2010 R |
||
| EXEL-0862(WO2004050681 A2) | キット、STAT3 | バツ | HMC-1 | Pan etal。 | |||
| フェドラチニブ(TG101348) | JAK2阻害 | バツ | HMC-1 | Lasho etal。 | |||
| GLC756 {(3R、4aR、10aR)-1,2,3,4,4a、5,10,10a-オクタヒドロ-6-ヒドロキシ-1-メチル-3-[(2-ピリジル-チオ)メチル]-ベンゾ[gq]ウイノリン塩酸塩)} | ドーパミンD 1およびD 2受容体アゴニスト | バツ | RBL-2H3セル | Laengle etal。 | |||
| Gly-Phe-CHN 2、PZ610、PZ709、PZ889(化学構造はまだ公開されていません) | ジペプチジルペプチダーゼ-1阻害剤 | LAD2 MC | El-Feki etal。 | ||||
| ヒスタミンH 4受容体アゴニスト | ヒスタミンH 4受容体 | バツ | バツ | HMC-1、マウスMC | exvivoのモルモットとネズミの心臓 | Aldi etal。 | |
| ヒストンデアセチラーゼ阻害剤:ボリノスタット、AR-42 { N-ヒドロキシ-4-[[(2S)-3-メチル-2-フェニルブタノイル]アミノ]ベンズアミド} | ヒストンデアセチラーゼ | バツ | HMC-1.2、プライマリヒトMC、マウス、およびイヌMC | ミューレンバーグ他 2009
Hadzijusufovic etal。 Meeran etal。 2010 R * * Abdulkadir etal。 Lin etal。 |
|||
| ヒポテマイシン | KITとBtkの阻害 | バツ | 人間のMC | マウス | ジェンセン等。 | ||
| IMD-0354 { N- [3,5-ビス(トリフルオロメチル)フェニル] -5-クロロ-2-ヒドロキシベンズアミド} | NF-κB阻害剤 | バツ | HMC-1 | 田中ほか 2005年 | |||
| JTE-052 {3 – {(3R、4R)-4-メチル-3- [メチル- (7 Hピロロ[2,3-d]ピリミジン-4-イル) -アミノ] -ピペリジン-1-イル} -3-オキソ-プロピオニトリルモノクエン酸塩} | JAK1,2,3阻害剤、Tyk2阻害剤 | バツ | 人間のMC | DBA / 1Jマウス、ルイスラット | 谷本ほか 2015年 | ||
| メフロキン | 分泌顆粒の透過性 | バツ | ヒトおよびマウスのMC | Paivandy etal。 | |||
| ミロタルグ(ゲムツズマブオゾガマイシン) | CD-33標的薬 | バツ | HMC-1、ヒト臍帯血由来のMC | Krauth etal。 | |||
| ネラメキサン | おそらくNMDA拮抗薬 | バツ | HMC-1セル | Kurzen 2009 | |||
| オバトクラックス | BH3ミメティック | バツ | HMC-1、ヒト腫瘍性BMMC | Aichberger etal。 | |||
| ONO-4053(化学構造はまだ公開されていません) | プロスタグランジン受容体DP1拮抗薬 | バツ | 人間のBMMC | 山口ほか 2016年 | |||
| 8-OH-DPAT(7-(ジプロピルアミノ)-5,6,7,8-テトラヒドロナフタレン-1-オール) | 5-HT 1A受容体 | 無効 | バツ | リッターら。 | |||
| パルミトイルエタノールアミド | PPAR-α、カンナビノイド受容体、カリウムチャネル、TRPV1 | バツ | ラット腹膜MC | Facci etal。
Mattace Raso etal。 2014 R |
|||
| PD180970 {6-(2,6-ジクロロフェニル)-2-(4-フルオロ-3-メチルアニリノ)-8-メチルピリド[2,3-d]ピリミジン-7-オン} | キット、Bcr-Abl、PDGFR | バツ | HMC-1、P815 MC | コービン等。 | |||
| ホスホジエステラーゼ阻害剤 | ホスホジエステラーゼ | バツ | ヒト肺MC、ラットMC | ウィスターラット | ラウとカム2005 ; Eskandari etal。
ババエイとバヤット2012 |
||
| ホスファチジルエタノールアミン、ホスファチジルセリン | CD300a | バツ | ヒト臍帯血由来MC、ヒト肺MC、マウスBMMC | バチェレ他 2005
Simhadri etal。 |
|||
| プロスタグランジンD 2受容体アンタゴニスト | CRTH2 | バツ | Harvima etal。
2014 R |
||||
| プロテアーゼ阻害剤 | トリプターゼ、キマーゼ、カテプシン、カルボキシペプチダーゼ | バツ | ヒトおよびマウスのMC | マウス | Caughey 2016 R
* * Harvima etal。 2014 R |
||
| ラパマイシン | mTOR経路阻害剤 | バツ | HMC-1 | チャンら 2013年 | |||
| RNAi | RNA干渉KIT RNA | バツ | HMC-1 | Ruano etal。 | |||
| ロシグリタゾン、ピオグリタゾン | PPARγ | バツ | マウスBMMC | 橘ほか 2008年 | |||
| シラメシン | シグマ2受容体アゴニスト | バツ | ヒトおよびマウスのMC | Spirkoski etal。 | |||
| シタグリプチン | ジペプチジルペプチダーゼ-4阻害剤 | バツ | ラット腹膜MC | Nader 2011 1845 | |||
| ソマトスタチン | ソマトスタチン受容体 | バツ | ウィスターラット | Tang etal。 | |||
| Sykキナーゼ阻害剤 | Sykキナーゼ | バツ | ヒト、マウス、およびラットのMC; RBL-2H3 | 松原ほか 2006
フィンとウォルシュ2013 |
|||
| タンドゥチニブ(MLN518) | キット、STAT3 | バツ | HMC-1、P815 MC | コービン等。 | |||
| テトラサイクリン | 複数 | バツ | バツ | ラット漿膜MC、HMC-1 | 人間 | Sandler etal。
Joksとダーキン2011 R |
|
| α-トコフェロール | 複数 | バツ | HMC-1 | ケンプナ等。
Ruano etal。 |
|||
| トラニラスト | まだ定義されていません | バツ | (バツ) | ラット腹膜MC | ラット; ウサギ | 足立ほか 1999
Cooper etal。 馬場ら 2016年 |
|
| Whi-P131 {4-[(6,7-ジメトキシキナゾリン-4-イル)アミノ]フェノール} | JAK3 / STAT経路阻害剤 | バツ | HMC-1 | チャンら 2013
Bibi etal。 2014 R |
|||
MCADの薬物治療に関する一般的な考察
症状や治療効果のバイオマーカーはまだ検証されていないが、MCADで試みられたほとんどの治療法の忍容性と有効性(開始し、慎重に投与量と組成をエスカレート)は、1-2ヶ月以内に臨床的に明らかになる。代替の投与量および/または投与頻度の適度な実験は不合理ではない。
臨床的に有用であることが明らかに示された治療法は継続すべきである;この高い基準を満たさない治療法は、このような患者に起こりやすい厄介な多剤併用療法を避けるために中止すべきである。反応の予測因子がまだ得られていないため、特定の患者を対象とした治療試験のシーケンスを作成するためのコストベースのアプローチは合理的であると思われる。
診断検査で上昇しているメディエーター(例えば、ヒスタミンが上昇している患者では抗ヒスタミン薬、プロスタグランジンが上昇している患者では非ステロイド性抗炎症薬、ロイコトリエンが上昇している患者ではロイコトリエン阻害薬)を標的とした薬物療法が確実に有効であることはまだ明らかになっていない。成功したレジメンは非常に個別化されたものである。
* *
投薬レジメンの複数の同時(またはほぼ同時に)変更は、改善(または悪化)の原因となる特定の治療法の特定を混乱させる可能性があるため、推奨されない。効果のない薬剤や有害な薬剤は速やかに中止すべきである。処方者は、後述するように、新しい薬物(または以前に十分に忍容性のあった薬物の新しい製剤)の不耐容性が急速に示された場合には、賦形剤反応性を示唆することが多いが、いくつかの活性分子(例えば、クロモリン)自体が初期症状のフレアを引き起こすことがあり、通常はすぐに症状が緩和されることに注意すべきである。
薬物療法の最初の3~4週間は、グルテン、酵母、および牛乳タンパク質を含む食品を一時的に放棄することで、反応率を改善することができる(Biesiekierski et al 2011年;Rodrigo et al 2013年;自身の未発表の経験)。MCADが疑われる場合、免疫系を強く活性化させる治療法(例えば、生ワクチンによるワクチン接種や自己血行再建療法)は注意して行わなければならない(特に、同様の治療法が以前に忍容性が悪かった場合)。
* *
どのような薬剤も、個々の MCAD 患者に不耐性症状を引き起こす可能性がある。一部のMCアルツハイマー病患者では、MCの構成的な活性化だけでなく、MCの異常な反応性が顕著な状態になるため、そのような患者では、残念ながら、様々な薬物の引き金となる薬物に悪影響を及ぼす傾向がある。
それらのMCアルツハイマー病患者は、新しい薬を開始した後すぐに(急性または亜急性のいずれか)奇妙な/異常な/奇妙な/奇妙な/奇妙な/奇妙な/予期せぬ症状を示し始める。このような患者は、しばしば薬の賦形剤(すなわち、充填剤、結合剤、染料、防腐剤)に有効成分よりも反応する傾向が強いことに注意することが非常に重要である。
患者が、同じ有効成分を含有しているが、問題のある製剤に含まれる賦形剤を可能な限り少なく(好ましくは何も含有していない)1つまたは複数の代替製剤を試した場合、患者は、少なくとも忍容性があり、おそらくかなり効果的であることを発見する可能性がある。
さらに、このようなシナリオは、明らかに患者(および医師と薬剤師)に、患者の機能不全MCにおいて異常な反応性を誘発している特定の賦形剤のうちの1つ以上を特定する絶好の機会を提供するものであり、それらの特定の賦形剤(薬全体ではなく)こそが、患者のアレルギーリストに追加され、患者が服用している現在のすべての薬および患者のために提案されている将来のすべての薬に対してスクリーニングされるべきである。
MCアルツハイマー病患者の医師は、ある賦形剤が多くの医薬品に非常に広く使用されており、大多数の患者には無害でよく耐えられると思われるからといって、同じ賦形剤が必ずしもMCアルツハイマー病患者にもよく耐えられると決めつけない方が賢明であろう(著者の未発表の観察)。
時々、反応の特異性が非常に異常であることがある。例えば、木質ベースの微結晶セルロースに反応する患者は、綿質ベースの微結晶セルロースに全く問題なく耐えられるかもしれないし、その逆もある。場合によっては、薬剤師は、問題のある製剤に含まれる賦形剤をほとんど、あるいは全く共有していない代替の市販の製剤を特定することができず、そのような場合には、患者が耐えられるカスタム配合の製剤を特定/開発するために、配合薬剤師が関与する必要があるかもしれない。しかし、調剤薬局へのアクセスには、地理的および経済的な問題がある場合がある)。
時には、MCアルツハイマー病患者は、(防腐剤を使用せずに)水で再構成された純粋な薬物塩として提供された場合にのみ、与えられた薬に耐えることができるように、多種多様な賦形剤に対して非常に反応性が高い場合がある。不耐性症状は、IgE抗体によって媒介されることがあるが、抗IgEモノクローナル抗体オマリズマブによって症状が改善されないため、このシナリオは稀であると考えられる(未発表の観察、G.J.モルデリングス)。
あるいは、それらはIgG抗体によって媒介されている可能性があり、ガンマグロブリン(それ自体が忍容性がある場合)がそのような患者において有用な補助療法であるかどうかという疑問が生じている(おそらく、MC表面のIgG受容体を直接標的とすることによって、あるいは間接的な経路を介して)。最近、MRGPRX2と呼ばれるMC特異的な受容体が同定され、これは疑似アレルギー性薬物反応に決定的に関与しているようである(McNeil et al 2015;Seifert 2015)。
MCADで使用すべきでない薬物
いくつかの薬物は、MCメディエーター放出を誘発する能力を持っている。MCからのメディエーター放出の高いリスクと関連することが知られている薬物のまとめが、表12に示されている。しかしながら、これらの薬物の治療的代替物が存在することが多い(表(表1212)。
表12肥満細胞からのメディエーター放出の高リスクに関連する薬剤およびその治療代替品のコンパイル
(Mousli et al 1994;Sido et al 2014;Afrin et al 2015b;McNeil et al 2015)
| 物質グループ | 肥満細胞活性化のリスクが証明された、または理論的に高い薬剤 | 代替治療法 |
|---|---|---|
| 静脈内麻薬 | メトヘキシタール
* * フェノバルビタール チオペンタール |
プロポフォール
* * ケタミン エトミデート ミダゾラム |
| 筋弛緩薬 | アトラク
* * リウム ミバクリウムロクロニウム |
シス-アトラクリウム
* * ベクロニウム |
| 抗生物質 | セフロ
* * キシムジャイレース阻害剤 バンコマイシン |
ロキシスロマイシン |
| 選択的ドーパミンおよびノルエピネフリン再取り込み阻害薬 | ブプロピオン | アミトリプチリン、ドキセピン、クロミプラミン、マプロチリン |
| 選択的セロトニン再取り込み阻害薬 | すべて | |
| 抗けいれん薬 | カルバマゼピン、トピラマート | クロナゼパム |
| オピオイド鎮痛薬 | メペリジン、モルヒネ、コデイン | レミフェンタニル、アルフェンタニル、フェンタニル、オキシコドン、ピリトラミド |
| 末梢作用性鎮痛薬 | ASSやイブプロフェンなどの酸性非ステロイド性抗炎症薬 | パラセタモール、メタミゾール |
| 局所麻酔薬 | アミドタイプ:リドカイン
* * アーティ カインエステルタイプ:テトラカイン、 プロカイン |
ブピバカインなどのアミド型を好む |
| ペプチド作動薬 | イカチバント、セトロレリックス、セルモレリン、オクトレオチド、リュープロリド | |
| X線造影剤 | ヨウ素化造影剤
* * ガドリニウムキレート |
非イオン性造影剤:イオヘキソール、イオパミドール、イオプロミダ、イオキシラン、イオベルソル、イドラトラン、イオジキサノール |
| 血漿代替物 | ヒドロキシエチルスターチ
* * ゼラチン |
アルブミン溶液、0.9%-NaCl溶液、リンゲル液 |
| 心血管薬 | ACE阻害薬
* * β-アドレナリン受容体拮抗薬 |
サルタン、カルシウムチャネル拮抗薬、イバブラジン、その他多数 |
結論と今後の展望
MCAD を持つ患者の治療管理は複雑であり、症状のスペクトル全体を見直す必要がある。ランダム化された対照研究が少ないため、難治性疾患の治療は困難であり、患者と管理者の両方の部分で忍耐、粘り強さ、および方法論的なアプローチを必要とする。
症状のコントロールが遅れると、罹患率が高くなることがある。効果的な治療法は、抗ヒスタミン薬とMC安定化化合物に、特定の症状や合併症を対象とした薬剤を加えただけのものであることが多い(表(表13)13)。難治性疾患に対する現在の治療法の選択肢は、主に観察研究および症例報告に基づいている。
難治性疾患の治療法についてより多くの指針が得られるように大規模なランダム化比較試験が実施されるまでは、臨床家は、臨床の専門知識と利用可能な薬剤の副作用プロファイルと併せて、利用可能なデータを用いて治療法の決定を行うべきである。
MCAD の病態生物学をよりよく理解するためには、特にどのような規制緩和された遺伝子が特定の症状や症状群に寄与しているかを特定するために、より多くの研究が必要であることは確かである。新しい合理的な治療法を発見するためのトランスレーショナルリサーチにおける最大の課題は、基礎科学の研究室と臨床医を巻き込んだ高度にインタラクティブな学際的アプローチを必要とすることである。主要な構成要素を理解することで、これらすべての破壊的な MCAD 表現型に対する新規治療の進展を早めることができるかもしれない。
表 13 MCADにおける薬理学的介入の選択された潜在的ターゲットの概略
MCADにおける薬理学的介入の選択された潜在的なターゲットの概略図
| 原形質膜にある薬物の標的 | |
| ヒスタミンH 1受容体 | H 1 -antihistamines |
| ヒスタミンH 2受容体 | H 2 -antihistamines |
| CB1 / CB2カンナビノイド受容体 | カンナビノイド |
| cysLTR1ロイコトリエン受容体 | CysLTR1拮抗薬、例えばモンテルカスト |
| ß-アドレナリン受容体 | ß-交感神経刺激薬 |
| EP 2受容体 | EP 2受容体アゴニスト、例えば、ブタプロスト |
| ケモカイン受容体 | ケモカイン |
| FcεRI | IgE抗体、例えばオマリズマブ |
| FcγRIII | IgG |
| Siglec-8 | Siglec-8リガンド |
| CD300a | ホスファチジルエタノールアミン、ホスファチジルセリン |
| 放出された肥満細胞メディエーターを標的とする | |
| トリプターゼ | トリプターゼ阻害剤、例えば、ナファモスタット |
| キマーゼ | キマーゼ阻害剤、例えば、BCEAB(4- [1- [ビス-(4-メチル-フェニル)-メチル] -3-(2-エトキシ-ベンジル)-4-オキソ-アゼチジン-2-イルオキシ]-安息香酸) |
| カテプシンG | カテプシンG阻害剤、例えば、RWJ355871(β-ケトホスホネート1) |
| TNFα | インフリキシマブ、アダリムマブ |
| IL-4 | パスコリズマブ |
| IL-5 | 例、メポリズマブ |
| IL-6 | 例、シルクマブ |
| IL-17 | 例、セクキヌマブ |
| メディエーター形成の細胞内阻害 | |
| ヒスタミン | 例えばビタミンCによるヒスチジンデカルボキシラーゼ阻害 |
| ロイコトリエン | 5-リポキシゲナーゼ阻害剤、例えば、ジロートン |
| プロスタグランジン | シクロオキシゲナーゼ阻害剤、例えば、アセチルサリチル酸、エトリコキシブ |
| 細胞質ゾル経路の阻害 | |
| プロテインキナーゼを含むシグナル伝達経路 | プロテインキナーゼの阻害剤(表を参照) 表88) |
| mTOR経路 | 例、ラパマイシン、エベロリムス |
| アポトーシス経路 | 例えば、ABT-737、obatoclaxによるアポトーシスの刺激 |
| 核内標的 | |
| ヒストンデアセチラーゼ | ヒストンデアセチラーゼ阻害剤、例えばボリノスタット |
| DNAメチル化 | 脱メチル化剤、例えば、5-アザシチジン、5-アザ-2 ‘デオキシシチジン |
| DNA | ヌクレオシドアナログクラドリビン |