Contents
SARS-CoV-2感染症の病態は、攻撃性への応答としての酸化ストレスと関連している
SARS-CoV-2 infection pathogenesis is related to oxidative stress as a response to aggression
www.sciencedirect.com/science/article/pii/S0306987720317540
WHOがCOVID-19をパンデミックと宣言して以来、この深刻な病気を理解するために多大な努力がなされてきた。何千もの研究が、このウイルス感染症の疫学、分子的特徴、メカニズム、臨床的進化の理解に費やされている。
しかし、本疾患の病態や進行過程における宿主応答機構については、ほとんど発表されていない。そこで本研究では,酸化ストレスがサイトカインストームの増幅と永続化,凝固障害,細胞低酸素症への関与など,COVID-19患者に見られる変化と関連しているとの仮説を提案する。
最後に、抗酸化剤、NF-κB阻害剤、Nrf2活性化剤、鉄錯形成剤を用いた酸化ストレス低減のための治療戦略を提案する。この仮説は、このテーマに関する新たな研究や治療戦略の指針になると考えている。
序論
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)[1]は、近年、医学の新たな課題として浮上してきた。コロナウイルス疾患2019、COVID-19は主に呼吸器疾患を引き起こすが、その病態はまだ十分に理解されていない。
COVID-19は、世界中に広く広がり、ヒトからヒトへの高い感染率を提示したことから 2020年3月11日に世界保健機関(WHO)によりパンデミックとされた。COVID-19の進行には、軽度の悪寒と乾いた咳の初期症状、発熱、疲労、呼吸困難を伴う息切れ、さらに重症化すると酸素飽和度85%以下の低酸素血症が伴うことが報告されている[2]。
COVID-19患者が呈するいくつかの徴候および症状が報告されており、軽度の寒気を伴う無症状の患者から、重度の臓器不全および死亡に進行する臨床検査および臨床検査での重要な変化までが報告されている。
観察される変化としては、総リンパ球の減少、プロトロンビン時間の延長、乳酸脱水素酵素の上昇、細胞性免疫不全、凝固活性化、心筋、肝、腎障害 [3], [4]、肺、心臓、小腸の内皮炎 [5], [6]などが挙げられる(図1)。
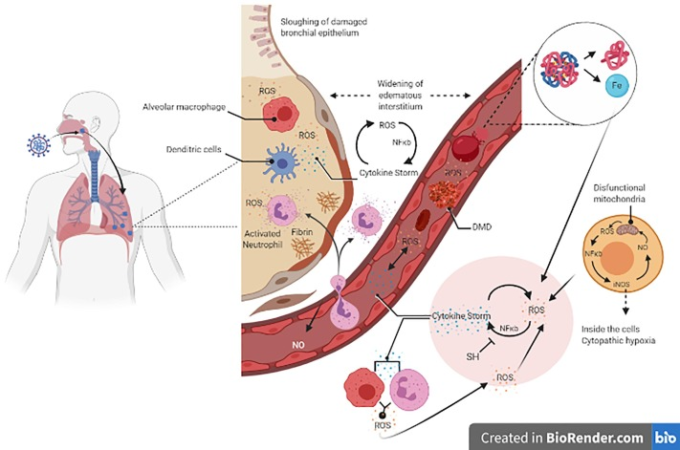
図1に示すように、ウイルスが気道に侵入した後には、マクロファージや樹状細胞が活性化され、炎症性サイトカインの産生に対抗して免疫自然反応が始まる。ウイルスが気道に侵入した後、その複製が起こり、炎症性サイトカインおよび活性酸素種(ROS)の産生に対するToll様受容体およびNOD受容体を介したマクロファージおよび樹状細胞の活性化から免疫の自然応答が始まる。
その結果、血液への広がりは2つの結果をもたらす。1)赤血球は活性酸素や他の炎症性メカニズムによって損傷を受け、ヘムと遊離鉄の生成を引き起こする。酸化ストレスと遊離鉄は、可溶性血漿フィブリノーゲンを、緻密なマット状の堆積物(酵素分解に抵抗性のあるDMD;血栓)の形で異常なフィブリン血栓に変換し、血管系および肺微小循環における微小血栓症を引き起こす。
サイトカインストームは、NF-κBを介したサイトカイン発現のアップレギュレーションを介して発生する。このシナリオが確立された後、サイトカインストームはマクロファージおよび好中球呼吸バースト活性を介して酸化ストレスを誘導し、酸化ストレスはサイトカインストームを誘導する。
このサイクルは、ウイルスとは無関係に深刻な組織損傷を誘発する。さらに、ミトコンドリアは活性酸素を産生し、これはNF-κBを介してiNOS発現を増加させ、その結果、NO形成を引き起こす。NO は機能不全のミトコンドリアを誘導し、その結果、細胞病理学的な低酸素状態を引き起こする。
さらに、ウイルスは酵素性抗酸化物質の増加に関与する Nrf2 を阻害し、酸化ストレスを確立する。全体として、低ヘモグロビンキャリア、高肺プロテイナーゼ滲出液は、肺低酸素症、細胞性低酸素症、内皮障害をもたらし、播種性凝固は多臓器崩壊をもたらす。
これらの変化の機序は不明であるが、SARS-CoV-2患者の肺を肉眼で観察すると、滲出性蛋白質病変の病理学的特徴が認められ、顕微鏡検査では炎症性リンパ球浸潤が認められた[7]。生検や死後の調査では、ヒアリン膜の形成、単核細胞やマクロファージの気道への浸潤、肺胞壁のびまん性肥厚を伴うびまん性肺胞障害が認められた。
また、脾臓萎縮、肝門リンパ節壊死、腎臓の局所出血、炎症性細胞浸潤を伴う肝肥大などの病状悪化が見られる[2], [8]。COVID-19では予後不良の患者もいるが、これは主にサイトカインストームの臨床的・検査的特徴と相関している。
さらに、多臓器における高凝固および低酸素血症は最悪のシナリオである。活性酸素種(ROS)による酸化ストレスは、他の炎症性疾患や感染症で観察されるすべての主な変化に関連しており、これらすべての事象を結びつける接続点である可能性がある。我々の研究では、ウイルス感染に対する宿主の反応に焦点を当て、ウイルスの攻撃機構よりも酸化ストレスを強調した。
サイトカインストームと酸化ストレス
多くの研究で、サイトカインストームがCOVID-19感染による患者の病状悪化に関連しており、急性呼吸窮迫症候群や多臓器不全の発症の主要な要因と考えられている[2]、[9]、[10]、[11]、[12]、[13]、[14]。先行研究では、インフルエンザ感染は、肺上皮細胞、マクロファージ、樹状細胞のToll様受容体TLR3、TLR7、TLR8、レチノイン酸誘導遺伝子I、NOD様受容体ファミリーメンバーを含むパターン認識受容体の活性化を介してサイトカインの発現を誘導することが示されている[4], [15]。
COVID-19感染における自然免疫応答は、同じ経路をたどっている可能性がある。インフラマソームはサイトカインストームの重要な要素であり[16]、研究は、活性酸素がNLRP3(NOD様受容体P3)インフラマソームを誘発するための強力なリガンドおよび直接メディエーターであることを示している。さらに、TLRおよびNLRリガンドは、NLRP3のNF-κB駆動転写レベルを増強した。
NF-κB は活性酸素によって活性化されるため、直接的にも間接的にも、インフラマソームは活性酸素によって増加する[17], [18], [19]。活性酸素以外にも、H2O2は主にNF-κBを活性化して炎症性サイトカインを産生する[20], [21]。
IL-6、TNF-α、IL-1β、インターフェロン-γ誘導性タンパク質10、顆粒球-コロニー刺激因子、単球化学吸引性因子、マクロファージ炎症性タンパク質1-αの高産生、および血中フェリチンの上昇もCOVID-19患者で観察される[16]。
インフルエンザ感染と同様に、COVID-19感染は、ウイルスの複製と炎症からなる初期肺期を有しているようであり、直接的および間接的なNLRP3炎症ソーム活性化因子としての活性酸素の関与、およびその後の血液拡散を有しており、おそらく全身損傷のメカニズムとしての酸化ストレスに対する適応免疫応答に関連していると考えられる。
SARS-CoV-2が肺および全身の傷害を誘発するメカニズムを理解することは重要であり,ウイルスのみが原因なのか,それとも他の相乗的なメカニズムが本疾患で観察される組織障害を維持し,悪化させるのかを理解することが重要である.
血液学的所見と酸化ストレス
疾患の進行中、COVID-19患者は播種性血管内凝固症を示し、フィブリン/フィブリノーゲン分解産物(D-ダイマー)[12]、[13]、[23]の顕著な上昇を特徴とし、これらは血管外空間に移動し、組織内の細胞を損傷する可能性がある[24]。
血液学的障害も炎症バイオマーカーとして報告されている。ヘモグロビン値については、COVID-19患者1,210人を対象としたメタアナリシス研究で、7.1g/Lまたは重症例では5.9g/Lという有意なヘモグロビン値の低下が示されている[24]。
別の研究では、ヘモグロビンの低下のほかに、コロナウイルス肺炎患者は血清フェリチン、赤血球沈降速度、乳酸脱水素酵素活性、アシドーシスの上昇を示した[16]。炎症マーカーに加えて、播種性の血管内凝固は低酸素による臓器不全の成立に寄与している[25], [26]。
27名のコロナウイルス患者に対してヘパリンによる治療を行ったところ、すべての患者で回復が促進された[27]ことから、入院患者に適用する治療プロトコルの提案につながった。
重度のCOVID-19進行患者についてのもう一つの観察は、ウイルス性敗血症への進行に特徴的なショックの典型的な臨床症状を呈していることである[4]。敗血症患者の血液中の遊離ヘモグロビンとヘムが溶血により増加することが示されている[23]。
溶血に関与するいくつかのメカニズムは、ウイルス感染でも記述されているが、活性酸素が赤血球の膜の損傷に役割を果たしていることを示す多くの研究がある[23], [28]。敗血症患者における高活性酸素レベルの産生は、赤血球膜の変化につながり、マクロファージおよび好中球の貪食を誘導し、活性酸素のさらなる産生とのサイクルを永続化させる[29]。これは、遊離ヘモグロビンの増加および組織への酸素輸送の低レベル化に寄与する可能性がある [29], [30]。遊離ヘモグロビンは解離してヘムを生成し、ヘムオキシゲナーゼ(OH-1)によって分解されて遊離鉄を生成する;ヘムと遊離鉄の両方が細胞にとって有害である[30]。
盲腸結紮穿刺(CLP)による敗血症モデルのマウス研究では、対照群と比較して体全体の遊離鉄が最大3倍に増加していることが示された[31]。また、アポフェリチン(鉄と結合しないフェリチン)を投与し、フェリチン重鎖の発現を誘導することで、CLPマウスの死亡率を低下させる[32]。
酸素飽和度の低下は、ミトコンドリアによるスーパーオキシドラジカルとH2O2の発生をもたらす[33]、[34]、[35]。スーパーオキサイドアニオンラジカルは、鉄(III)を鉄(II)に還元し、これは、同じく炎症環境下で食細胞によって生成されるH2O2の存在下で、細胞膜脂質過酸化物およびタンパク質酸化の形成を促進し、アポトーシスおよび/または壊死による細胞死を誘発する極端に毒性の強い剤であるヒドロキシルラジカル(-OH)を生成する[36]。
また、III鉄がヒドロキシルラジカルを介して血液凝固を誘導することも実証されている[37]。ヒドロキシルラジカルは、可溶性血漿フィブリノーゲンを、酵素分解に抵抗性のある緻密なマット状の堆積物の形で異常なフィブリン血栓に変換する[37], [38]。
一度開始されると、これらの事象はすべて原因物質とは無関係に発生し、患者の状態を悪化させると考えられている。
低酸素と酸化ストレス
播種性血管内凝固症、敗血症、および組織への酸素輸送の低下は、COVID-19患者が示す主要な要素のいくつかである[22]。さらに、血中の遊離ヘムは循環一酸化窒素(NO)を減少させ、臓器の虚血をさらに悪化させる [24], [39], [40]。低酸素血症にもかかわらず、肺のコンプライアンスは維持されており[27]、ミトコンドリアの障害の可能性を示唆している。ミトコンドリアのATP産生能力の欠如[41]は、正常な酸素飽和度と緊張状態での実験的敗血症およびヒト敗血症において記述されている。
このことは、ミトコンドリアの機能不全が敗血症の病態形成に重要な役割を果たしていることを示唆している[41]。ミトコンドリアの機能障害は、活性酸素の発生とエネルギー産生の低下を伴う酸素部分の減少をもたらす細胞性低酸素症[40], [41], [42]をもたらす。
この点で、敗血症に伴う低酸素は、主にミトコンドリア呼吸鎖によってスーパーオキシド、H2O2、および他の反応性種を生成することが知られている[40], [41], [43], [44]。過酸化水素は、IL-1、IL-6、およびTNF-αなどのプロ炎症性サイトカイン、ならびにNF-κB経路の活性化を介して誘導性一酸化窒素合成酵素(iNOS)をアップレギュレートする多くの遺伝子の発現を誘発する[20], [21], [22]。
周期的に、これらの炎症性サイトカインは、NADPHオキシダーゼ(NOx)を介してマクロファージ、好中球、内皮細胞を活性化し、より多くのスーパーオキサイドとH2O2を産生する [20]。さらに、スーパーオキサイドラジカルは、NF-κB 経路を介して発現する iNOS によって生成された NO と反応し、ペルオキシナイトライトを生成する。
ペルオキシナイトライトとNOは共にミトコンドリアに毒性を持つ[44]。これは、正常な組織の酸素飽和度にもかかわらず、ミトコンドリアが酸素を利用できないことを説明していると考えられる[41]。活性酸素とサイトカインの間のこの相互作用は、サイトカインストームと酸化ストレス産生の間の自己維持サイクルを生成し、最終的には敗血症およびショックに進行するCOVID-19患者の多臓器不全をもたらす(図1)。
ウイルスと酸化ストレス
いくつかの 試験管内試験(in vitro) および 生体内試験(in vivo) の研究では、いくつかのウイルスが生存するために細胞の酸化還元バランスを変化させる戦略が強調されている。ウイルス感染による酸化ストレスの開始は、病原微生物を撃退するためのサイトカインの NF-κB 生成を介した自然免疫の活性化に重要な役割を果たすことが示されている [45], [46], [47], [48]。
呼吸器合胞体ウイルス(RSV)感染は、活性酸素産生を誘導し、炎症性サイトカインの発現と自然免疫防御を誘導することが示されている [49], [50], [51]。さらに、いくつかのウイルスは、細胞内での複製を促進するために酸化ストレスを誘発する [52]。活性酸素レベルを制御する方法として、これらのウイルスはNrf2経路を有利に操作する能力を獲得するように進化していた [52], [53], [54]。
いくつかのケースでは、ウイルスはNrf2経路を抑制する能力を持っている[54], [55]。例えば、RSVは、ヒト肺胞Ⅱ型様上皮細胞および小気道上皮細胞において、脂質過酸化を増加させ、GSHを減少させ、Nrf2経路の活性化を阻害する。
その結果、ヘモキシゲナーゼ-1(HO-1)、スーパーオキシドジスムターゼ1(SOD1)、スーパーオキシドジスムターゼ3(SOD3)、グルタチオンSトランスフェラーゼ(GST)、カタラーゼ(CAT)、およびグルタチオンペルオキシダーゼ(GPx)を含むNrf2標的遺伝子の発現が低下する[54]。同時に、Toll様受容体やインターフェロン(IFN)経路は、ウイルス感染に対抗するために、感染誘発性酸化ストレスによってトリガーされる[56], [57]。
一方、宿主細胞による酸化還元バランスの異常は、酸化ストレスによって引き起こされる細胞死を大量に誘発し、その結果、ウイルスの発病に寄与することが示されている[58]。インフルエンザウイルスは肺胞上皮細胞においてアポトーシスと細胞毒性を誘導し、それはカスパーゼ1と3、および炎症性サイトカインであるIL-8の発現増加を伴うことが示された[59]。
このウイルスは酸化ストレスを誘導すると同時に、Nrf2の核内転座を促進し、それに続くヒト肺胞上皮細胞の酸化傷害に対する保護酵素であるHO-1の発現を促進する[59]。これらの知見は、酸化ストレスがウイルス感染に対する応答の成否に重要な関与をしているという考えを裏付けるものである。
治療戦略
病態が不明瞭な疾患に対する治療法の確立は困難である。酸化ストレスがSARS-CoV-2感染のために知られているあらゆるメカニズムのリンクであると考えられるならば、ビタミンE、SH基供与体(N-アセチルシステイン)、鉄錯形成剤(デフェロキサミン)、NF-κBの阻害剤、Nrf2の活性化剤(クルクミン、レスベラトロール)などの抗酸化剤の使用、および特異的な炎症性サイトカイン阻害剤および抗凝固剤の使用は、COVID-19を有する患者の回復を助けることができるだろう。
多くの疾患の治療における抗酸化剤の有効性を示す臨床研究および実験研究があることを強調することは有用である。試験管内試験(in vitro)敗血症モデルでは、ビタミンE(αトコフェロール)、トロックス(可溶性ビタミンE)、およびmotVit E(極性誘導体)が、ミトコンドリアの損傷/機能不全、NF-κB転写分子、およびサイトカイン発現を減少させることが示された。ミトコンドリア内に蓄積するmotVit Eは、TLRsに関連する遺伝子に対してより効率的な保護効果を有していた[60]。また、急性敗血症モデルの動物にビタミンEを投与したところ、有益な効果が認められた[61]。
トリテルペノイド(オルティプラズ(ブチル化ヒドロキシアニソール)、スルホラファンおよびフマル酸ジメチル、クルクミン、シリビニン、レスベラトロール)は、Nrf2を活性化し、NF-κB経路を阻害することで抗酸化活性を発揮する[62]。敗血症患者18名の血中ペルオキシナイトライトの高値は、鉄過多症患者に用いられる鉄キレート剤であるデフェロキサミンを用いて減少した[29]。このことは、敗血症患者における鉄複合体化およびペルオキシナイトライト消去への本剤の応用の可能性を示している。
グルタチオン(GSH)は哺乳類の主要な抗酸化物質であり、肺では最も重要な抗酸化防御物質である[64]。H2O2 の増加により GSH/GSSG のバランスが崩れると、より酸化的な環境が Nrf2 を制御する KEAP-1 や NF-κB を制御する IκB などの転写因子の活性化や局在化を制御するタンパク質を酸化させる [45]。
これにより、Nrf2 の活性化因子である KEAP-1、NF-κB の抑制因子である IκB を介した SH 群ドナーは、SARS-CoV-2 感染症の治療薬として期待されている。症例報告では、この戦略がCOVID-19患者の重篤な症状を回復させることに成功したことが示されている[65]。同じくSHドナーであるリポ酸も無作為化試験で使用され、死亡率を77.8%から37.5%に低下させた[66]。
確かに、SARS-CoV-2ウイルスではなく、ウイルスの攻撃に対する宿主の反応を直接標的とした新しい薬物戦略を模索するという別のアプローチが考えられる。
結論
酸化ストレスがCOVID-19の病因に役割を果たし、サイトカインストームサイクル、血液凝固機構を永続化させ、低酸素を悪化させることが明らかになった。この証拠は、ミトコンドリアの機能不全を含むすべての直接的な組織傷害、およびプロセスのシグナル伝達におけるウイルス感染症の発症における酸化ストレスの重要な関与を示している(図1)。
さらに、低酸素や臓器不全で終結する組織傷害を持続・悪化させるメカニズムとして、酸化ストレスとサイトカインストームの相互作用を示している。さらに、SARS-CoV-2 ウイルスがサイトカインの発現に関与する NF-κb 転写分子と抗酸化酵素の発現に関与する Nrf2 活性化の平衡を阻害する可能性があることも明らかにした(まだ決定的な証明はされていない)。
我々は、ウイルス感染症や敗血症の病態における酸化ストレスの役割の重要性を認識しているが、COVID-19病における酸化ストレスの関与は明らかにされていない[63]。我々は、サイトカインストームと酸化ストレスの間にはクロストークがあると考えている。
このクロストークは、COVID-19感染症患者が呈する症状の重症度に重要な役割を果たしている可能性がある。このように、コロナウイルス症候群の病態モデルは、酸化ストレスの関与による一次肺障害、晩期の血液学的、組織的低酸素血症(細胞性低酸素血症)、ミトコンドリア機能障害を伴うものであり、科学的文献に示された実験的証拠に裏付けられたものである。これにより、合理的な治療法の決定に貢献することを目指している。
