Contents
COVID-19, Mitochondria, and Interferon
序論
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)として知られる新型コロナウイルスによる現在のパンデミックコロナウイルス疾患2019(COVID-19)は、世界的な健康上の緊急事態である。特定の抗ウイルス剤とワクチンが緊急に必要とされている。
残念ながら、これらの対策には時間がかかっている。一方で、この致命的なウイルスによる死亡率を減らすために、薬の適応外使用が検討されている。このコロナウイルスについては、多くのことを学ぶ必要がある。
しかし、遺伝的に類似したコロナウイルスである重症急性呼吸器症候群コロナウイルス(SARS-CoV)の病態生理学的メカニズムを検討することで、いくつかの手がかりが得られるかもしれない。COVID-19の原因となっているコロナウイルスは、遺伝的に非常によく似ているため(約80%の類似度)、SARS-CoV-2と呼ばれている。
キーワード
Mitochondrial antiviral-signaling protein (MAVS)
SARS-CoV-2の違いは?
ヒトや他の動物に感染するコロナウイルスは約30種類ある。ヒトのコロナウイルスは風邪の原因となる。成人の感冒の約15%がコロナウイルスによって引き起こされている(Greenberg 2016)。コロナウイルスが動物宿主からヒトへと波及すると、パンデミック病やパンデミックを引き起こす可能性がある。
なぜなら、動物性コロナウイルスは遺伝的に異なる可能性があり、私たちの免疫システムを回避して急速に増殖・拡散する可能性があるからである。これまでに少なくとも2回は起きている。2002年に中国南部のコウモリから発生したSARS-CoVが約8500人に感染し、約900人が死亡した。その10年後の2012年には、サウジアラビアでコウモリ由来のコロナウイルスが発生し、約2500人が感染し、約850人が死亡した。
このコロナウイルスは重度の肺炎と呼吸不全を引き起こし、中東呼吸器症候群として知られる多臓器不全を合併することが多いである。また、SARS-CoV-2は中国武漢省のコウモリが起源と考えられている。
SARS-CoV-2はなぜ一般的な風邪用コロナウイルスよりも危険なのか?
COVID-19の病因は完全には解明されていない。しかし、ヒトのコロナウイルスとは異なり、SARS-CoV-2は免疫系から長い間隠れる能力を持っていると考えられている。そのため、免疫システムが警報を出した時点で、ウイルスの複製はすでに膨大な規模に達しており、高齢者のような影響を受けやすい人ではなおさらである。
私たちの免疫システムはまだこれに対処することができるが、その代償として大規模な炎症反応(サイトカインストームとも呼ばれる)が起こり、しばしば自己破壊的な状態に陥る。この抑制されていない炎症反応は、肺胞上皮と微小循環にダメージを与え、急性呼吸窮迫症候群と広範囲の肺微小血栓を引き起こし、重度の低酸素症を引き起こし、死に至る可能性がある。
ミトコンドリアがどのようにしてこのような症状を引き起こすのかは現時点では不明であるが、近縁種であるSARS-CoVの発症メカニズムを知ることは、この病気の発症に役立つかもしれない。
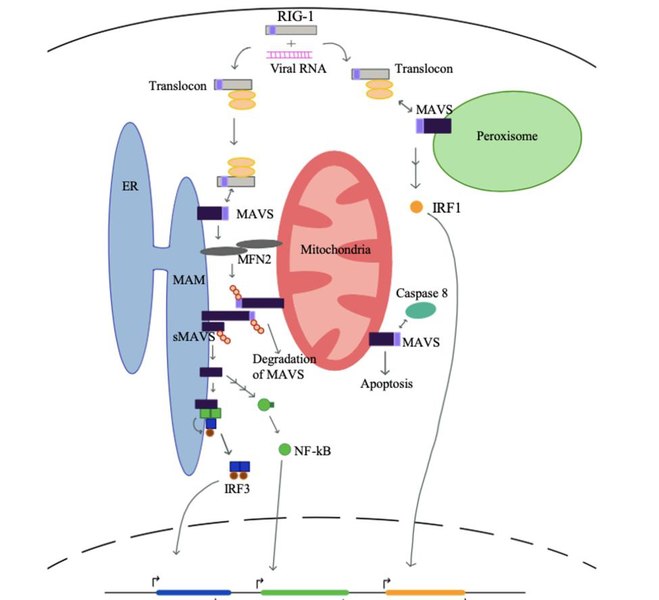
ミトコンドリアは、私たちの細胞のほとんどに数百から数千の数で存在している。ミトコンドリアは、細胞内のエネルギー生産の場であることから、「細胞の動力源」とも呼ばれている。さらに、ミトコンドリアは、細胞に不可欠な他のいくつかの機能を果たしている。その一つが、ウイルスからの防御である。ウイルスが細胞内に侵入すると、細胞内の受容体に認識され、ミトコンドリア上のミトコンドリア抗ウイルスシグナル(MAVS)と呼ばれるタンパク質が活性化される。
MAVSは、I型およびIII型インターフェロン(IFNs)の産生につながる、よく協調した細胞内経路を刺激する(Refolo and others 2020)。IFNは、細胞内でのウイルス複製を阻害するだけでなく、より特異的な抗ウイルス応答をマウントするための準備をするために、隣接する細胞にその抗ウイルス機械を活性化するように警告し、局所免疫細胞も活性化する。
さらに、アポトーシス経路を活性化することで感染細胞の死を誘導する。ミトコンドリアもまた、IFNによって誘導される細胞のアポトーシスにおいて重要な役割を果たしている。このように、ウイルス感染後のミトコンドリアによるオーケストレーションされた応答は、ウイルスに対して非感染細胞に警告を発し、ウイルスの複製を抑制するために感染細胞を自己破壊する。SARS-CoVはこれを回避するメカニズムを開発した。それはORF9bと呼ばれるタンパク質を合成し、MAVSを破壊してIFNの産生を制限する。
さらに、ミトコンドリアの融合を促進することで感染細胞のアポトーシスを抑制し、感染細胞の生存率を高める。したがって、感染細胞は長生きし、SARS-CoVは免疫系から隠れて細胞内で複製することができる(Shi and others 2014)。ORF9bタンパク質もSARS-CoV-2で合成され、同様の機能を持つと予測されている(Srinivasan and others 2020)。ORF9bの機能はSARS-CoV-2の文脈では特徴づけられていないが、COVID-19患者の転写および血清プロファイリングでは、1型(IFN-I)およびIII型IFN応答の減少が、高揚した炎症性サイトカイン応答と相まって示された(Blanco-Melo and others 2020)。
したがって、SARS-CoV-2は、感染細胞のIFN応答およびアポトーシスを阻害することにより、抗ウイルス防御の第一ラインを回避することができるようである。これは、大規模な炎症反応に続くウイルス複製の増強につながる。
ミトコンドリア機能は、加齢とともに、またメタボリックシンドロームや2型糖尿病などの併存疾患とともに低下することが知られている。そのため、高齢者やミトコンドリア機能障害を伴う併存疾患を持つ人では、ウイルスの複製がさらに顕著になる。これらの条件は確かにCOVID-19の高い死亡率と関連している。
ミトコンドリアの抗ウイルス反応を増強することでCOVID-19に対抗できるか?
現在のところ、MAVS応答を直接増強する治療法はない。しかし、IFN療法は同じ目的を達成する可能性がある。IFN-Iは、この薬剤の豊富な経験により、適応外として容易に利用することができる。IFN-Iは試験管内試験(in vitro)でSARS-CoVの複製を阻害することが明らかになった(Stockman et al 2006)。
しかしながら、SARSおよびCOVID-19患者におけるIFN-I療法のデータは限られており、決定的ではない。III型IFN(IFN-λ’s)は、主にII型肺胞上皮細胞などの上皮細胞から分泌され、気道上皮での抗ウイルス防御に非常に重要である。IFN-λはCOVID-19のもう一つの治療法として期待されている。IFN-λの臨床試験が進行中である(https://clinicaltrials.gov/ct2/show/NCT04331899)。
ウイルスの複製および拡散を防止する上でのIFNの役割を考えると、過剰な炎症反応(サイトカインストーム)は、末期ではウイルスそのものよりもダメージが大きいように見えるので、IFN療法は早期に投与すれば効果的である可能性が高い。後期では炎症反応をさらに悪化させるので、有害である可能性さえある。
しかし、リスクの低い個人にIFN注射を使用することは正当化されないかもしれないが、そのほとんどは回復する可能性が高い。IFNは吸入によって送達することができる。COVID-19患者における吸入IFN-1の単独またはリバビリンとの併用投与に関するデータは限られている(Dong et al 2020)。吸入IFN療法は、無症状のハイリスク者に対して、感染後の予防または感染のごく初期段階の治療として有益である可能性が最も高く、臨床試験のために検討されるべきである。