コンテンツ
- Flavonoids Activation of the Transcription Factor Nrf2 as a Hypothesis Approach for the Prevention and Modulation of SARS-CoV-2 Infection Severity
- 要旨
- 1. 序論
- 2. CoVID19 発症機序
- 3. 核内因子エリスロイド由来2関連因子2(Nrf2)
- 4. Nrf2の活性化とCOVID-19感染
- 5. ウイルス感染と酸化ストレス
- 6. Nrf2の活性化はACE2受容体の発現を低下させる
- 7. 酸化ストレスによるハイパーメチル化がACE2受容体の発現を増加させる
- 8. Nrf2 ダウンレギュレーション、酸化ストレス、プロテアーゼ発現
- 9. Nrf2の活性化はウイルス感染の重症化を抑制する
- 10. Nrf2の活性化は自然免疫応答を高める
- 11. Nrf2は酸化ストレスと炎症を抑制する
- 12. 高齢者におけるNrf2の低発現レベル
- 13. Nrf2、炎症、および肥満
- 14. Nrf2は高血糖に伴う酸化ストレスを減少させる
- 15. 抗ウイルス剤およびNrf2アクチベーターとしてのフラボノイドの役割
- 16. 免疫応答を高めるビタミンD3の補給
- 17. 結論
Flavonoids Activation of the Transcription Factor Nrf2 as a Hypothesis Approach for the Prevention and Modulation of SARS-CoV-2 Infection Severity
https://www.mdpi.com/2076-3921/9/8/659/htm
要旨
Nrf2-Keap1-ARE経路は、抗酸化および第二相解毒遺伝子の主要な調節因子である。Nrf2の活性化は、抗酸化タンパク質および細胞保護タンパク質の発現を増加させ、感染症から細胞を保護する。Nrf2は、ウイルス誘発性酸化ストレス、活性酸素の発生、およびウイルスのライフサイクルに不可欠な疾患発症を調節する。
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)のような呼吸器系ウイルス感染症の間、炎症過程や上皮内膜細胞の酸化ストレスが転写因子Nrf2を活性化し、酸化ストレスや炎症から細胞を保護する。Nrf2は、呼吸器上皮細胞におけるアンジオテンシン変換酵素2(ACE2)受容体の発現を低下させる。SARS-CoV2は、コロナウイルス表面スパイク糖タンパク質の受容体として働くACE2に対して高い親和性を有し、ウイルスの侵入を促進する。
疾患の重症度は、免疫応答の低下、肥満、加齢などの既往症によっても調節される可能性があり、Nrf2のレベルの低下は一般的な特徴である。その結果、Nrf2 活性化剤は Nrf2 レベルを上昇させ、抗ウイルスメディエーターの発現を亢進させ、「抗ウイルス状態」を開始させ、ウイルス感染に対する細胞のプライミングを行う可能性がある。
したがって、本仮説論文では、フラボノイドサプリメントとビタミンD3を組み合わせてNrf2を活性化することで、SARS-CoV-2感染症の重症化を予防および/または減少させ、酸化ストレスと炎症を軽減し、自然免疫を高め、ACE2受容体をダウンレギュレーションすることができる可能性があることを述べている。
1. 序論
重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)による新型コロナウイルス感染症(COVID-19)は、2019年12月に中国・武漢で初めて報告され、その後、大パンデミックの兆しを見せている[1,2]。
世界全体の感染者数は14,774,887人、死亡者数は611,599人で、2020年7月20日現在、米国のみの感染者数は3,858,686人、死亡者数は141,426人を提示している。SARS-CoV-2は、ヒト呼吸器疾患を引き起こすことが確認されている7種類のコロナウイルスのうちの1つである。
そのうち4つは全身性の風邪症状を引き起こすことが知られており、残りの2つは重症急性呼吸器症候群コロナウイルス(SARS-CoV)と中東呼吸器症候群コロナウイルス(MERS-CoV)を引き起こし、致死的な呼吸器疾患で数千人が死亡した[3,4]。
抗ウイルス薬、副腎皮質ステロイド療法、マラリアや自己免疫疾患の治療に用いられてきた薬剤、COVID-19から回復した人の抗体、機械的呼吸器サポートなど多くの治療法が用いられてきたとはいえ [5,6,7]、呼吸器ウイルス感染症パンデミックにおけるCOVID-19に対する特異的な治療法はまだ必要とされている。
疾病対策予防センター(CDC)によると、リスクグループには、糖尿病、肥満、慢性腎臓病および肝臓病、高血圧、肺疾患、喘息、および免疫抑制を引き起こす可能性のある任意の疾患などの病状を呈する高齢者および全年齢層の個人が含まれる。感染の重症度は様々な要因によって影響を受けるため、SARS-CoV-2感染症の予防と管理の方法に注目することが不可欠である[8]。治療介入のための新たな分子標的と経路による感受性の高い個体の同定と保護が重要である。
そこで、本仮説論文では、SARS-CoV-2感染を予防し、酸化ストレスや炎症を軽減し、自然免疫を高め、アンジオテンシン変換酵素2(ACE2)受容体をダウンレギュレーションする新たなターゲットとなりうるNrf2転写因子を活性化するためのフラボノイドサプリメントの使用について記述する。
2. CoVID19 発症機序
SARS-CoV-2に感染した患者は、乾いた咳、喉の痛み、筋肉痛、疲労、下痢、息切れなど、重症度の異なる多くの症状を呈している[1,9,10]。
重度の進行を示す患者では、数日以内に急性肺障害(ALI)、急性呼吸窮迫症候群(ARDS)、呼吸不全、心不全、敗血症、および突然の心停止が観察された [1,11]。
軽度のCOVID-19で汚染された肺の病理学的評価では、浮腫、球状の炎症性細胞浸潤を伴う蛋白質性滲出液、および中等度のヒアリン膜の形成が認められた [12]。重症のARDSを呈した患者では、死後の分析で両側のびまん性肺胞損傷が認められ、浮腫、肺細胞の脱落、ヒアライン膜形成が認められた[13]。
SARS-CoV感染時には、プロ炎症性サイトカインの産生と上皮細胞および内皮細胞の死によって顕著な炎症過程が活性化され、血管漏出、異常T細胞、およびマクロファージ反応を引き起こし、ALI/ARDSを刺激するか、あるいは死に至ることさえある[15]。
COVID 19患者はリンパ球減少と肺炎を呈し、重症例ではプロ炎症性サイトカインIL-2、IL-7、IL-10、G-脳脊髄液、IP-10、MCP-1、MIP-1A、およびTNF-αの発現が亢進している[1]。臨床データは、高度な炎症性状態が疾患の進行および重症度において重要な役割を果たしている可能性を示している。サイトカインのレベルの増加は、ARDS、肺炎、呼吸不全、ショック、臓器不全、最終的には死などの多くの合併症につながる炎症過程により、ウイルス性敗血症および肺損傷を誘発する可能性がある[16]。
また、SARS-CoVおよびMERS-CoV感染患者の血清中のプロ炎症性サイトカインの高レベルも観察され、サイトカインストームによる重症化のメカニズムが類似していることが示唆された[17,18]。
ウイルス感染時には、体の自然免疫応答はI型インターフェロンに依存して、ウイルスの複製を制御し、適応免疫応答を成功させる下流のカスケードを活性化する。ヒトの気道に入ると、SARS-CoV-2は肺胞上皮細胞に結合し、免疫系を活性化する[19]。
健康な人では、ウイルス感染は炎症過程を開始し、病原体を排除するために免疫細胞を募り、患者は回復する。しかし、高齢者や医学的な問題を抱えている人では、制御されていない免疫応答は、サイトカインの過剰生産を引き起こし、血管透過性を高め、かなりの数の血液細胞が肺胞に入り込み、肺炎、息切れ、気道の炎症、呼吸困難、さらには死に至る呼吸不全に至る重度の炎症性疾患状態を引き起こす可能性がある[16]。
3. 核内因子エリスロイド由来2関連因子2(Nrf2)
転写因子核内因子赤血球由来2関連因子2(Nrf2、NFE2L2遺伝子によってコードされる)は、抗酸化タンパク質、解毒酵素、薬物輸送体、および多数の細胞保護タンパク質を含む、細胞の恒常性維持に関与する約250の遺伝子を制御している[20]。
Nrf2は、抗酸化酵素(グルタミン酸-システインリガーゼ;GCL)、薬物代謝酵素(チトクロムP450s、グルタチオンSトランスフェラーゼ;GST)、分子シャペロン、DNA修復酵素、プロテアソームサブユニットで構成される抗酸化応答エレメント(ARE)を含む細胞防御に関連する遺伝子を標的としている[21]。
Nrf2が介在する遺伝子の転写は、Nrf2が小さなMafタンパク質(MafG、MafK、MafF)とヘテロ二量化することに依存しており、これはARE/EpRE(抗酸化応答エレメント/親電子応答エレメント)への効率的な結合に必要である[22]。
これらの保護遺伝子の転写により、細胞は酸化還元バランスを維持し、酸化ストレスや外来生物ストレスの条件下で損傷を受けたタンパク質を除去することができるようになる[23]。
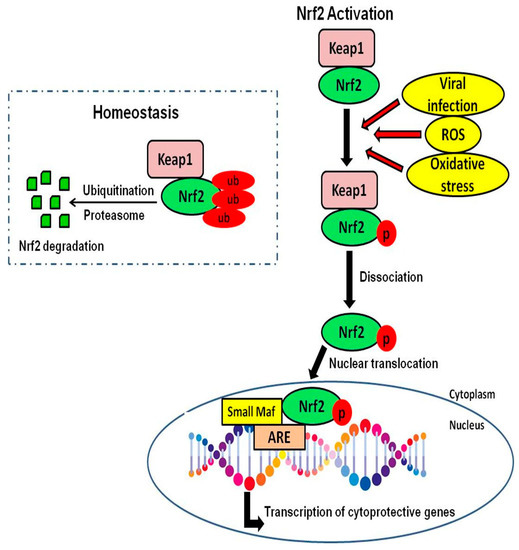
通常の生理学的条件下では、Nrf2は負の調節タンパク質であるKelch-like ECH-associated protein 1(Keap1)と関連して細胞質に存在し、Nrf2と相互作用してアダプタータンパク質として働き、Nrf2を低レベルに維持し[24,25,26]、ユビキチンによって媒介されるプロセスでプロテアソームを介してその連続的な分解を可能にする[27,28]。
ウイルス感染時には、Keap1は酸化ストレスを検出し、酸化ストレスに敏感なシステイン残基(Cys151、Cys273、Cys288)の共役を介して、Nrf2はKeap1を介した抑制から解放される[29,30]。Keap1からの解離により、Nrf2のユビキチン化が阻害され、半減期が15分から180分に増加する [31,32,33]。
Nrf2が核に移動した後、Nrf2はコアアクチベーターと複合体を作り、プロモーター領域(ARES)に結合する。この結合は、細胞保護遺伝子や解毒遺伝子の転写を誘導する[34,35,36,37]。さらに、Nrf2の活性化は、多数の細菌やウイルスの病原体を減衰させたり排除したりする自然免疫系の活性を高める[38](図1)。
図1. Nrf2の活性化。図は、恒常性状態でのNrf2-Keap1阻害複合体とストレス条件下でのNrf2活性化を示し、細胞保護遺伝子の転写につながる。
多数の因子による細胞高分子の過剰な損傷は、細胞死につながるフィードフォワード制御ループを誘導する可能性があることが多くの研究で報告されている[39,40]。Nrf2媒介抗酸化系の応答は、その細胞内制御に関連しており、低用量のNrf2アクチベーターでは、Nrf2/ARE経路のほとんどのエフェクターが細胞保護を提供する[41]。
Zuckerら(2014)は、Nrf2依存性フィードフォワードモデルを介した活性酸素の制御機構を示唆した。低い酸化ストレスレベルを示す条件下では、Nrf2依存性の抗酸化遺伝子が活性化され、細胞の生存に有害でないレベルまで活性酸素を減少させる。
しかし、過剰なレベルの活性化を示す条件下では、Nrf2の継続的な活性化は、核内への蓄積を引き起こし、それに続くクルッペル様因子9(Klf9)プロモーターへの結合を引き起こす。細胞内活性酸素の新規な調節因子であるKlf9転写のアップレギュレーションは、その後、活性酸素レベルの上昇とそれに続く細胞死につながる可能性がある[41,42]。
したがって、研究によれば、Klf9転写を活性化するためには過剰な酸化ストレスが必要であり、これはウイルスが宿主細胞の死を引き起こすことなくウイルスの代謝を維持するためには酸化ストレスを最適なレベルに保つ必要があるため、ウイルス感染では考えにくいと考えられる[43]。
4. Nrf2の活性化とCOVID-19感染
過去数十年の間に、炎症、免疫、レドックス恒常性、老化、神経変性、その他多くの分野におけるNrf2の役割について多くの研究が発表されてきたが、ウイルス感染症におけるNrf2の関与についてはあまり議論されてこなかった。
最近、40人の患者を対象とした研究では、COVID-19感染の重症度が年齢および炎症反応の強さに直接関連し、Nrf2発現とは逆に関連していることが示された[44,45]。McCordら(2020)は、若く健康な個体では、宿主細胞を不可逆的な自傷的損傷から救うNrf2の頑健な酸化ストレス誘発性活性化が存在することを提案した。高齢者または慢性炎症を伴う併存疾患を呈する個体では、Nrf2活性化応答は、事象の連続的なサイクルを断ち切るには不十分であるかもしれない。
Nrf2活性化の誘導により、これらの患者はサイトカイン産生を停止し、炎症プロセス後の回復および修復段階に入ることができるかもしれない[46]。薬理学的なNrf2活性化は、呼吸器ウイルスの感染性および抵抗性、または関連する免疫応答に関連する42の遺伝子を修飾することができた。
Nrf2の活性化は、ある程度の抵抗性を付与し、ウイルス複製率を減衰させ、症状を改善し、COVID-19で特に問題となっているサイトカインストームをうまく通過することを可能にする多くの抗ウイルス効果を提供しているようである[46]。
COVID-19患者の肺生検で行われた試験では、Nrf2経路の抑制が示されたが、一方で、Nrf2薬理学的誘導剤はSARS-CoV2の複製を抑制し、炎症反応のレベルを低下させた[47]。感染細胞における酸化還元恒常性および肺の炎症は呼吸器ウイルスによる感染症の特徴であり、気道に影響を及ぼすウイルスから得られる情報はCOVID-19への外挿に適切であるかもしれないが、より実験的な証拠を有する最近の研究が出現している[48,49]。
フマル酸ジメチルおよび4-オクチルイタコン酸などのNrf2活性化剤[50]は、COVID-19患者の末梢血単核細胞を含むヒト細胞において、SARS-CoV2に対する炎症反応を抑制した[47]。Nrf2は炎症反応を高度に統合的に制御することを提示し、その実行と解決に必要である。さらに、内因性の細胞保護系を制御することにより、Nrf2は、炎症の有益な効果と有害な効果のバランスを達成するために、より生理的な機能を果たす可能性がある[49]。
5. ウイルス感染と酸化ストレス
細胞内でのゲノム複製を促進するために酸化ストレスを誘導するウイルスの役割については、多くの論文で述べられている。ウイルスによって引き起こされる感染誘発性の酸化ストレスは、宿主細胞内のトール様受容体やインターフェロン経路などの重要な抗ウイルスシグナル伝達を活性化させる[51]。
感染中、ウイルスは複製するために宿主細胞内でいくつかのタンパク質を発現させる必要がある。これらのタンパク質は酸化ストレスを誘導する役割を果たしており、これはウイルスのライフサイクルや新しいウイルスの組み立てに不可欠であるだけでなく、ウイルスの病原性にも関与している[52]。
しかし、高レベルの酸化ストレスは宿主細胞に負担をかけることもある。したがって、ウイルスは、酸化ストレスを、その代謝をサポートするために最適なレベルに維持する必要があるが、それが宿主細胞を死滅させるほど高すぎないことが必要である[43]。
宿主細胞による適切な酸化還元バランスの維持に問題があると、酸化ストレスによる細胞死を大量に誘発し、ウイルスの病原性に寄与する可能性がある[53,54]。活性酸素産生と抗酸化防御システムの間のこの不均衡は、一般的な細胞生理の混乱と直接的に関連しているように思われる[52]。
このことから、増加する出版物は、このウイルス誘発性酸化ストレスが、ウイルス感染によって引き起こされる炎症反応および組織傷害の最も重要な病原性メカニズムの一つであることを示している[55,56]。
酸化ストレスの有害な影響を中和するために、哺乳類細胞は、通常の生理学的条件下ではオフになるとされている独自の抗酸化防御システムを持っている。逆に、酸化ストレスに遭遇すると、酸化剤感受性分子であるNrf2が活性化され、細胞保護および解毒を担当する一連の遺伝子を転写的に刺激する。Nrf2は、酸化剤/電解質センサー機能を持つ最もよく知られた抗酸化転写因子の一つである[57]。
6. Nrf2の活性化はACE2受容体の発現を低下させる
SARS-CoV-2は、遺伝的にSARS-CoVと70%以上類似しており、両者とも呼吸器上皮細胞に存在するアンジオテンシン変換酵素2(ACE2)と呼ばれる同じ受容体に対して高い親和性を有している。ACE2は、表面スパイク(S)糖タンパク質の必須の受容体である[19,58]。
コロナウイルスのSタンパク質は宿主受容体に結合し、標的細胞へのウイルスの侵入を促進する。N末端ドメインおよびC末端RBDドメインを介して、Sタンパク質は宿主受容体と直接相互作用する[59]。このようにして、SARS-SはACE2受容体に結合し、膜貫通型プロテアーゼセリン2(TMPRSS2)を用いてSタンパク質のプライミングを行う[60]。
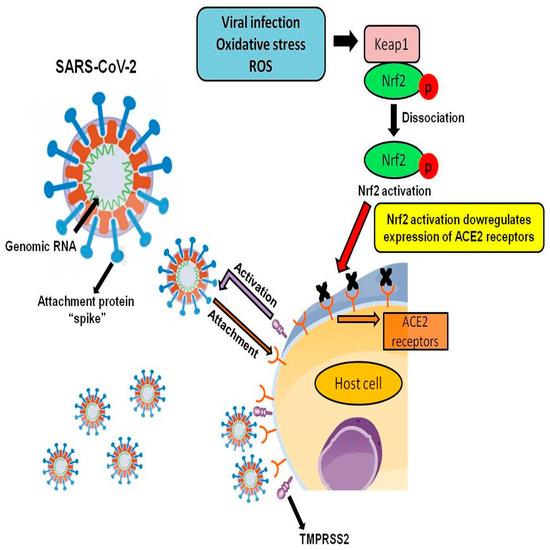
SARS-CoVとSARS-CoV-2は同じACE2受容体に結合するが、SARS-CoV-2の結合親和性はSARS-CoVよりも約10〜20倍高く、個人から別の個人への感染拡大の可能性を高めている[61](図2)。
図2. 重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2感染)中のACE2受容体に対するNrf2ダウンレギュレーター効果。図は、SARS-CoV-2が、その付着タンパク質「スパイク」を介して宿主細胞内のACE2受容体に結合し、それに伴うTMPRSS2の活性化により、感染プロセスを開始することを示している。図はまた、Zhao et al 2018年[62]に記載されているように、Nrf2の活性化およびその後のACE2受容体発現の減少を示す。
最近の研究では、Nrf2の活性化はACE2発現を低下させ、その欠乏はACE2受容体を上昇させることが報告されている[62]。この研究では、Nrf2ノックアウトマウスを用い、Nrf2欠損動物がACE2発現の亢進を示すことを示した。
不死化した腎近位尿細管細胞の培養において、Nrf2 small interfering RNA のトランスフェクションや Nrf2 阻害剤(トリゴネリン)による処理は、高グルコース刺激による Nrf2 核転座の阻害を防ぎ、ACE2 の転写を増加させることを示した [62]。Nrf2の欠乏がACE2遺伝子発現の増加をもたらす正確なメカニズムはまだ明らかにされていないが、これらのデータはACE2受容体の調節およびSARS-CoV-2感染におけるNrf2の潜在的な役割を示唆している(図2)。
7. 酸化ストレスによるハイパーメチル化がACE2受容体の発現を増加させる
ACE2は、SARS-CoV-2の細胞内への侵入を可能にする機能性受容体である。SARS-CoV-2感染では、ACE2受容体の過剰発現により、ウイルス感染症や臓器障害が誘発されることがある。SARS-CoV感染時には、ACE2受容体にも結合するウイルス粒子が末梢血T細胞などの免疫細胞に感染し、ウイルスの拡散を引き起こす[63]。
ACE2遺伝子はX染色体上に位置しており、全ゲノムDNAメチル化データの解析により、脱メチル化したT細胞サブセットにおいてACE2遺伝子の実質的な低メチル化が認められた[64,65]。この低メチル化は、転写開始部位に近いACE2プロモーター領域、5′未翻訳領域、3′未翻訳領域のCpG部位に関与しており、メチル化変化の機能的調節効果を示唆していた[66]。ACE2の発現はDNAメチル化によって制御されており、ループス病ではメチル化欠損がACE2の過剰発現をもたらす可能性があることが示された[66]。
さらに、ループス病状態が増加しているときには、より明らかなDNAメチル化欠損が観察され、これはウイルス感染などの酸化ストレスレベルの増加によって悪化する可能性がある[67]。酸化ストレスはDNAメチル化を阻害し、MEK/ERKシグナルの減衰やDNAメチル化酵素(DNMT1)の発現低下につながることが示されている[67,68]。
さらに、酸化ストレスはNADPHとグルタチオンのレベルを低下させ、DNMT1を阻害することで、mTORを活性化させ、DNAメチル化欠損を増加させることが示唆されている[69]。このように、SARS-CoV-2感染による酸化ストレスは、ループス患者のDNAメチル化欠損を悪化させ、ACE2発現の増加を介してウイルスの侵入をさらに促進する可能性が示唆されている[66]。
SARS-CoV-2感染中、宿主のウイルス侵入に対する反応は、組織の損傷と酸化ストレスを引き起こし、炎症過程を悪化させ、サイトカインストームを引き起こす可能性がある[66]。
このように、SARS-CoV-2感染症の重症度は、エピジェネティックな調節障害によって悪化し、末梢血単核細胞におけるACE2受容体の過剰発現により、本疾患の伝播が亢進する可能性がある[66]。また、ループス病患者はSARS-CoV-2感染症とその合併症に罹患しやすいことが示唆されている[66]。したがって、酸化ストレスがACE2受容体の発現に役割を果たし、SARS-CoV-2感染症の重症度を悪化させる可能性があることが示唆された。
8. Nrf2 ダウンレギュレーション、酸化ストレス、プロテアーゼ発現
SARS-CoVやインフルエンザを含む数多くのヒトウイルスは、ウイルスの拡散/増殖に必要な制御されたプロテアーゼ分解を示している。肺では、プロテアーゼ、TMPRSS2、ヒト気道トリプシン様プロテアーゼ(HAT)、および分泌白血球プロテアーゼインヒビター(SLPI)の発現が、ウイルスのヘマグルチニン表面タンパク質を切断し、ウイルスの融合および宿主細胞への侵入を可能にするために必要である [70,71,72,73,74]。
興味深いことに、SARS-CoV-2ゲノムには、βコロナウイルスに特徴的に見られるヘマグルチニンエステラーゼ遺伝子が欠落している[75]。酸化ストレスと炎症過程との関連が、これらのプロテアーゼ/アンチプロテアーゼの発現の変化を引き起こす可能性があることが、研究により実証されている[76,77]。
インフルエンザ感染症では、ウイルスの侵入とそれに続く複製の増加は、Nrf2の発現/活性の低下と関連しており、細胞宿主における膜貫通型プロテアーゼの活性化によって媒介されている[78]。喘息患者では、HATは炎症の間に気道液中に放出され[76,77]、SLPIの遺伝子発現はNrf2欠損マウスで増加し、炎症を増加させ、酸化ストレスとプロテアーゼ発現の間のバランスを示すことが示された[79]。
Kesicら(2011)は、Nrf2遺伝子発現の低下が酸化ストレスを誘導し、セリンプロテアーゼ活性を刺激し、ヘマグルチニン切断を引き起こし、それ故にウイルスの侵入を増加させることを実証した[78]。データは、Nrf2遺伝子発現の活性化が潜在的にウイルス感染から細胞を保護し、ウイルスの侵入と複製を停止させることを示した。
Nrf2の発現の増加は、酸化ストレスを減少させ、その結果、セリンプロテアーゼ活性を低下させる可能性がある。したがって、研究によれば、転写因子Nrf2は、上皮レベルでのウイルス感染に対する感受性を決定する上で重要な役割を果たしている可能性がある[78]。
9. Nrf2の活性化はウイルス感染の重症化を抑制する
ウイルス感染のメカニズムは非常に複雑であり、ウイルス性呼吸器感染に対する脆弱性に影響を与えうる因子の研究がまだ必要である。既往症、免疫応答の低下、肥満、および年齢などが、他の要因の中で、疾患の重症度に影響を与える可能性がある[22,80,81]。ウイルスゲノムの複製と新しいウイルスの組み立ては、宿主細胞内でのウイルスによる多くのタンパク質の発現によって支えられており、その多くは活性酸素の発生に関与している[82,83]。
ウイルスによる酸化ストレス、活性酸素の発生、および病気の病因は、ウイルスのライフサイクルにおいて重要な役割を果たし、宿主細胞による抗酸化防御機構の活性化を増大させる。酸化ストレスは、活性酸素の産生と反応性中間体を容易に解毒する体の能力との間の不均衡によって引き起こされる。
この点、Nrf2は酸化ストレスに応答して細胞の保護と解毒に重要な役割を果たしており、第II相抗酸化物質に属するヘムオキシゲナーゼ1(HO-1)などの酵素を調節している[43]。
抗酸化酵素を刺激することで、細胞への酸化的ダメージを予防または遅らせることができる。最近の研究では、Nrf2が癌の進行、慢性肺疾患、酸化物質からの保護、および気道に影響を与えるウイルス感染に対する宿主防御に極めて重要な役割を持つことが示されている[84,85,86]。
上皮細胞は、呼吸器ウイルス感染および複製の間、抗酸化酵素の主要な標的であり、主要な供給源である。上皮細胞は、感染に応答して、I型インターフェロン(IFN-αおよびIFN-β)や宿主の自然免疫応答の他の構成要素などのいくつかのサイトカインを産生する[87,88]。ウイルスがその複製過程で産生する二本鎖RNA認識は、I型IFN合成のための主要なシグナルである。
感染した細胞によって放出されるIFN-α/βは、宿主細胞内のウイルス複製の遮断に関与するメディエーターの作用を刺激するだけでなく、まだ感染していない隣接する細胞を保護する。呼吸器ウイルス感染症のさらなる特徴は、IFN誘導性Mx GTPases(MxA)阻害作用に対する感受性であり、これはウイルス複製を有意に廃止する[87,89]。
上皮細胞におけるインターフェロン/抗ウイルス応答の調節におけるNrf2依存性の抗酸化的役割については、まだ調査されていない。しかしながら、いくつかの研究は、Nrf2特異的shRNAが上皮細胞におけるNrf2 mRNAおよびタンパク質発現の両方を効率的に減少させ、ヒト鼻上皮細胞におけるウイルスの侵入および複製の有意な増加を示したことを示している。
さらに、Nrf2発現レベルとウイルス感染感受性との間には逆の関係が観察された。この結果は、上皮レベルでのインフルエンザウイルスに対するNrf2遺伝子発現の保護的役割を実証した[78]。Nrf2発現の遺伝的および薬理学的操作は、インフルエンザウイルスの侵入を調節することが示された。Nrf2発現の抑制はインフルエンザウイルスの侵入を増強し、Nrf2発現の増加はウイルスの侵入を減少させ、したがってウイルス感染から保護した[78]。
10. Nrf2の活性化は自然免疫応答を高める
自然免疫系は、ウイルス、細菌、真菌などの特定の病原体を認識することにより、感染を媒介し予防するメカニズムを提供する [90,91]。自然免疫系は、単球、好中球、好酸球、好酸球、マクロファージ、マスト、ナチュラルキラー(NK)細胞などの多様な細胞型の配列で構成されており、病原体や組織の損傷に反応する [91]。自然免疫では、防御の第一陣は上皮細胞によって提供され、呼吸器系では、様々な気管支上皮細胞が一次抗菌防御において重要な役割を果たしている[92]。
Nrf2などの転写因子は、防御機構の調節に関与している。Nrf2は、いくつかの細菌やウイルスの病原体を抑制または排除することができる自然免疫応答を刺激した[93,94]。肺炎球菌誘発性肺炎のモデルとしてNrf2ヌルマウスと野生型(WT)マウスを用いたNrf2遺伝子特異的ノックダウン研究では、肺炎球菌を投与したWTマウスの肺では53のNrf2特異的遺伝子と経路が同定されたが[95]、Nrf2ヌルマウスでは同定されなかった。Nrf2は、Nrf2ヌルマウスではWTマウスと比較して、ファゴサイトーシス、Fc受容体エフェクター機能、補体活性化、および免疫グロブリン調節のレベルを上昇させ、自然宿主防御を強化した[95]。
インフルエンザウイルス感染中、上気道では上皮細胞が標的とされ、防御反応は自然免疫細胞および適応免疫細胞によって媒介される。感染に応答して、NK細胞は感染した上皮細胞を殺し、抗ウイルスサイトカインIFN-γを産生する [96]。NK細胞は、抗ウイルス応答を構築するために活性化受容体の発現またはアップレギュレーションを行うが、ウイルスに感染した細胞はNK細胞が媒介する認識を回避することができる。さらに、ウイルスはNK細胞活性化受容体リガンドをダウンレギュレートし、関与抑制性受容体を増加させることができる[97]。
Nrf2の活性化は、ウイルス感染に応答して自然防御を媒介するNK細胞のプライミングに関与している。骨髄細胞由来のIL-27シグナル伝達を調べた最近の研究では、IL-27がNK細胞のエフェクター応答の調節を媒介していることが報告されている。インフルエンザ感染後、WTマウスでは肺胞腔や肺組織にCD27+CD11b+エフェクターNK細胞が出現したが、IL-27ra-/-マウスでは観察されなかったことから、このNKサブセットの制御にIL-27が重要な役割を果たしていることが示唆された[98]。
また、NK細胞では、CD27の発現が細胞の移動能力を決定することが報告されており、IL-27がNK細胞のサブセットの感染部位へのトラフィッキングを促進することが示唆されている[99,100]。IL-27ra-/-マウスのNK細胞は、細胞保護遺伝子の転写に関わるNrf2との相互作用部位の一つであるMafFの発現レベルが低下していた [98]。
このことから、IL-27はMafsやNrf2によって制御される転写経路を介してNK細胞の機能に重要な役割を果たしていると考えられ、インフルエンザ感染後の病態を決定する適応免疫応答の制御に役割を果たしている可能性があると考えられる[98]。
11. Nrf2は酸化ストレスと炎症を抑制する
酸化ストレスや親電子性化合物の存在下では、細胞はホメオスタシスを維持するために抗酸化能力を急速に増加させ、活性酸素の産生亢進に対抗しようとしなければならない。Nrf2シグナル伝達の活性化は、重要な保護酵素をコードするNrf2標的遺伝子の発現を増強する。NAD(P)H:キノンオキシドレダクターゼ1(NQO1)、HO-1、GCL、GST、カタラーゼ(CAT)、スーパーオキシドディスムターゼ(SOD)アルドケトレダクターゼ、γ-グルタミルシステインリガーゼ、チオレドキシン、およびチオレドキシン還元酵素[101,102,103,104,105]をコードするNrf2標的遺伝子の発現を増強する。
Nrf2は酸化還元恒常性遺伝子制御ネットワークを制御しており、その活性化は酸化還元恒常性を回復するいくつかの細胞保護酵素の発現を増加させる。Nrf2は、主に抗酸化酵素および解毒酵素、細胞トランスポーター[106,107]、外来生物性代謝物および有毒化合物の侵入を排除する酵素[106]、およびプロテアソーム[108]のいくつかの構成要素と関連している。
Nrf2は、細胞増殖、細胞接着、タンパク質フォールディング、細胞シグナル伝達、細胞周期制御、生存、およびグルコース代謝に関与する遺伝子の発現を誘導する [108,109]。Nrf2はまた、分子シャペロン/ヒートショックプロテインや創傷治癒応答タンパク質の発現を促進する[110]。
Nrf2は酸化ストレスに対する細胞防御機構を制御するだけでなく、その活性化は抗炎症作用を誘導し、炎症の解消に重要な役割を果たしている[50,94,111]。Nrf2とNFƙB経路は共に、ストレスと炎症反応を制御している。多くの実験モデルにおいて、Nrf2がNFƙB駆動の炎症反応を抑制する可能性があることが研究により示されている [112,113,114]。
リポ多糖類によって活性化されると、NFƙBはNrf2を誘導するように刺激され、それによってHO-1の発現がアップレギュレートされ、NFƙBの炎症活性の低下につながる [115,116]。呼吸器同期ウイルスに感染したNrf2-/-マウスを用いた生体内試験(in vivo)での研究では、ウイルス誘発性炎症の上昇、粘液細胞の転化変化の増加、ウイルスクリアランスの減少が見られた;一方、Nrf2-/+マウスまたはNrf2-/-マウスを効果的なNrf2-活性化剤で前処理すると、抗酸化物質のレベルが上昇し、ウイルスクリアランスが向上し、ウイルス関連炎症が減少した [54]。
SARS-CoV-2感染中、一部の患者の悪化は、白血球が活性化して炎症性サイトカインを産生する際に感染によって誘発される全身炎症の一種である、いわゆる「サイトカインストーム」と関連している[117]。炎症は効果的な免疫応答に不可欠であるが、SARS-CoV-2では、サイトカイン応答が過剰かつ長期化すると、ARDSまたは多臓器不全を引き起こし、生理的な悪化および死に至る可能性がある[118]。臨床研究では、COVID-19を有する重症患者のサイトカイン発現量の増加が検出されており、サイトカインの抑制剤が患者の悪化を防ぎ、死亡率を低下させる可能性がある[119]。
Nrf2の機能の分子基盤の研究により、Nrf2は細胞内活性酸素の重要な調節因子としてだけでなく、炎症性サイトカイン発現の調節にも機能していることが示された[111]。Nrf2 は LPS による IL-6 および IL1b 遺伝子の発現を ROS に依存しない転写抑制を介して抑制しており、Nrf2 が IL-6 および IL1b 遺伝子の近傍に結合していることは、Nrf2 が直接 DNA に結合して転写を抑制していることを示唆していた。
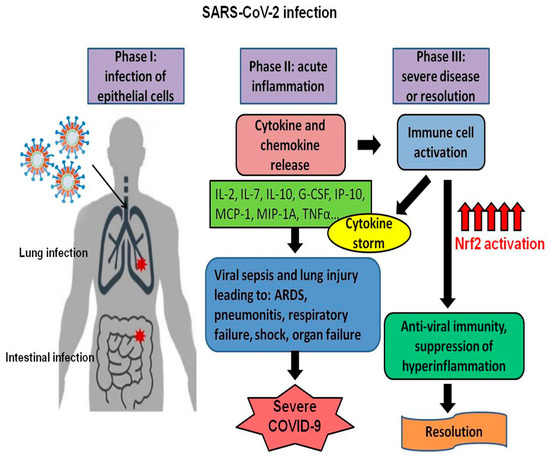
さらに、Nrf2が媒介するM1マクロファージの炎症性サイトカイン遺伝子発現の抑制はARE非依存的であることが示唆されている[111]。Nrf2が炎症性サイトカインをコードする標的遺伝子をどのようにダウンレギュレートするかの正確なメカニズムは完全には解明されていないが、Nrf2のレベルを増加させることで、サイトカインストームにつながるイベントの自己永続的なサイクルを断ち切り、COVID-19患者の早期回復を助けることができる可能性があることは明らかである(図3)。
図3. Nrf2活性化はサイトカイン産生を制限し、SARS-CoV-2感染の重症度を低下させる。図は、SARS-CoV-2感染中の段階を示しており、Nrf2転写因子の活性化により、どのようにして重症化または患者の回復につながるかを示している。
12. 高齢者におけるNrf2の低発現レベル
加齢は、加齢に関連する病態に対する脆弱性を予測する慢性低悪性度炎症ステージとして同定されている[120,121]。加齢に伴い、脳や心臓を含む様々な組織におけるNrf2タンパク質およびmRNA発現の低下が観察される。これは、NFƙB標的遺伝子(ICAM-1(細胞間接着分子1)およびIL-6(インターロイキン-6))の増加と、Nrf2標的遺伝子(NQO1、γ-GCS、HO-1)の減少に関連している[122,123]。
若い個体と比較して、老年期の動物や高齢者(65歳以上)では、核含有量の低下とNrf2活性化の低下が観察された[124,125]。Nrf2が活性化されたままの時間は、誘導体が作り出す刺激に依存し、また動物の年齢にも依存していた [126]。Nrf2ノックアウトマウスを用いたいくつかの生体内試験(in vivo)モデルでは、炎症反応の増加が提示されている。対照的に、Nrf2経路の活性化は、細胞修復を誘導する酸化還元バランスを回復させ、フリーラジカルと腫瘍壊死因子の生成を制限した [79,127,128]。細胞の老化の間には、Nrf2の機能低下があり、そのサイレンシングはヒト胚性線維芽細胞の早期老化を引き起こした[129] [130]。Nrf2はスーパーオキシドジスムターゼ1(SOD1)などの多数の酵素を制御しており、これらの酵素は、いくつかの条件では老化や炎症を防ぐ可能性がある[131,132]。Nrf2の活性化は抗酸化応答を誘導するだけでなく、炎症にも関与しており、細胞の保護や恒常性維持に必須の機能を持っている可能性がある[22]。
さらに、Nrf2発現の低下は、中年期の神経幹/前駆細胞の生存と再生の顕著な低下を媒介しているようであり、加齢がNrf2発現の低下と酸化ストレスに対するNrf2代償応答と関連している可能性を示唆している[133]。したがって、Nrf2レベルの低下は、高齢者におけるSARS-CoV-2感染症疾患の高重症化に関連している可能性がある。
13. Nrf2、炎症、および肥満
CDCによると、肥満はCOVID-19の重症度を増大させる危険因子の一つである。Furukawaら(2017)は、酸化ストレスを肥満に関連した罹患に関与する主要な因子の一つとして記述しており、Nrf2は肥満を治療するための有望な新しいターゲットであるように思われる[134]。
Nfr2は、前脂肪細胞から脂肪細胞への分化誘導に必須の役割を持っているように思われる[135,136,137]。Nrf2の活性化は、成熟分化した脂肪細胞における脂肪形成を低下させたり、総トリグリセリド含量を抑制したりすると考えられている[136]。
脂質およびグルコースの代謝における Nrf2 の機能は、FABP4、CEBPA、CEBPB、SREBF1、PPARG、脂肪酸合成酵素(FASN)およびアセチル-CoA カルボキシラーゼ(ACACA および ACACB)を含む多数の脂肪原性および脂質原性遺伝子の発現の調節、ペントースリン酸経路の機能の変化、および NADPH 産生を介して発生する。Nrf2の欠損は、インスリンに応答してAktタンパク質とグルコーストランスポーター4型(Glut4)活性の活性化を損なう[138]。
脂肪細胞を用いた試験管内試験(in vitro)研究では、肥満におけるNrf2の活性化が有益であり、脂肪細胞と共培養マクロファージの両方で肥満誘発性炎症を改善する可能性があることが示されている[81]。Nrf2 の活性化は、脂肪細胞の機能を修飾し、de novo リポジェネシスのための肝酵素の抑制を介して、脂肪ジストロフィーマウスの代謝異常やインスリン抵抗性を予防する。一方、Nrf2 欠損動物では、このような効果は認められなかった[135]。
さらに、ERK/JNKシグナル伝達経路やp38マイトジェン活性化プロテインキナーゼの活性化、AhRの阻害やエストロゲン受容体の発現上昇は、肥満におけるNrf2媒介の抗炎症性全身作用と関連している[81]。
高脂肪食(HFD)のマウスモデルを使用した研究では、酸化ストレスのレベルの変化、障害されたグルコースの処理、インスリンシグナル伝達、および肥満の発達は、Nrf2活性化剤であるoltiprazによって逆転させることができることを示した[139]。
長期的なHFDの給餌は、HFDは、インスリンシグナル伝達とエネルギー恒常性[139]の障害に役割を果たしている内因性のNrf2抗酸化システムの欠陥につながる可能性があることを示唆し、Nrf2ターゲットタンパク質レベルの低下と脂肪組織におけるNrf2の核コンテンツの減少につながった。
オルティプラズ投与を受けた動物は、HFD誘発性肥満に抵抗性となった。Nrf2 活性化は脂肪細胞の分化を阻害するため、Nrf2 活性化剤投与による HFD 誘発肥満の効果は、脂肪細胞の分化を直接的に阻害することによるものと考えられる[140,141]。
インスリン抵抗性と肥満の予防と発症における内因性Nrf2抗酸化系の必須の役割が示唆された。彼らは、Nrf2依存性抗酸化酵素の誘導が酸化ストレスを減少させ、肥満とそれに伴うインスリン抵抗性と戦うための潜在的なアプローチである可能性を示唆した[139]。
14. Nrf2は高血糖に伴う酸化ストレスを減少させる
最近の研究では、COVID-19重症化の危険因子として糖尿病などの肥満関連の合併症が記載されている。最近の報告やCDCによると、重度の肥満とコロナウイルス死亡率との間には関連性があるとされている。発表された研究はまだ対象者が少ないが、Stefanら(2020)は、肥満患者の85%が機械的換気を必要とし、肥満患者の62%が死亡したのに対し、肥満のない患者では機械的換気を必要とした患者は64%、死亡した患者は36%であったと報告している。
糖尿病(DM)は脂肪組織量の増加と高度に関連していることを考慮すると、この研究では、高BMIがこれらの患者の重篤な疾患状態の重要な危険因子である可能性があることが示された[142]。
糖尿病は、インスリン分泌または活性の障害のメカニズムによる多くの代謝障害から構成され、高血糖やその他の合併症をもたらす。DM1型は、膵β細胞の自己免疫による破壊により、インスリンが不足して糖尿病になることが原因である[143]。
非インスリン依存性糖尿病であるDM2型は、遺伝的素因を持つ個体に発現し、加齢とともに増加する。インスリンに対する抵抗性と高インスリン血症、β細胞障害、およびその後のインスリン欠乏と関連している[144]。DM2型は高血糖、高インスリン血症、および炎症を特徴とし、これは活性酸素の産生の増加および抗酸化酵素の発現の低下を伴う親酸化性環境につながる [145,146,147,148,149,150,151]。
したがって、解毒、抗酸化、および抗炎症性メディエーターをコードする遺伝子のアップレギュレーションは、DMで増強される炎症および酸化ストレスから保護するための潜在的な治療戦略である可能性がある[152]。
Nrf2の活性化は、活性酸素を直接解毒し、細胞の抗酸化防御を高め、ミトコンドリア機能を改善し、ペントースリン酸経路の酵素の発現を誘導し、内皮機能を維持し、血糖値を低下させることにより、プロオキシダント状態に対抗する可能性のあるものの発現を増加させることができる[153,154,155,156]。
Nrf2の活性化はDMの初期段階で高く、後期になると低くなり、Nrf2欠損動物は糖尿病症状の悪化と更なる合併症を示すことが研究で示されている[157]。さらに、肝性インスリン抵抗性の観点から、天然オレアノール酸の誘導体であるバルドキソロンメチル(CDDO-Me)は、Nrf2の活性化を介して糖尿病性慢性腎臓病患者を対象とした臨床試験において有望であることが示されている[158]。
Nrf2は、細胞保護および抗酸化酵素の産生における主要な転写因子であるため、高血糖に伴う酸化ストレスを減衰させるための潜在的なターゲットであると考えられている[159]。
15. 抗ウイルス剤およびNrf2アクチベーターとしてのフラボノイドの役割
フラボノイドは、抗酸化作用、抗炎症作用、抗がん作用、抗菌作用、抗真菌作用、抗ウイルス作用など、さまざまな薬理学的特性に関与する植物に含まれるポリフェノール化合物の一群である[160]。
フラボノイドの抗ウイルス活性は、HSV-1、HSV-2、ヒトサイトメガロウイルス、およびある種のヒトアデノウイルスを含むいくつかのウイルスに対して報告されている[161,162,163]。アピゲニン、ルテオリン、ケルセチン、アメントフラボン、ダイゼイン、プエラリン、エピガロカテキン、エピガロカテキンガレート、およびガロカテキンガレートを含むこれらのポリフェノール化合物の多くは、ウイルスの複製に不可欠なSARS-CoV 3C様プロテアーゼのタンパク質分解活性を阻害することにより抗ウイルス活性を示した[164,165]。
多くのフラボノイドは転写因子Nrf2を活性化する可能性があるが、特に2つのフラボノイドを用いた研究では、Nrf2誘導因子としてだけでなく、強力な抗ウイルス活性を有することから、これら2つの化合物の大きな可能性が示されている。それらはエピガロカテキン-3-ガレートとチモキノンであり、これらはすでに市場に出回っており、毎日のサプリメントとして販売されている。
15.1. エピガロカテキン-3-ガレート
フラボノイドの補給は、Nrf2遺伝子発現を誘導することが示されている[166,167]。緑茶は、いくつかの国で最も消費されている健康増進飲料の一つである[168]。その主な構成成分であるポリフェノール(カテキンとも呼ばれる)は、その抗腫瘍性、抗酸化性、および抗菌性の活性について記載されている[169,170]。
エピガロカテキン-3-ガレート(EGCG)は緑茶の主な活性成分と考えられ、乾燥緑茶葉の全ポリフェノールの約59%を占めている。Xuら(2017)は、DNAウイルス(HBV、ヘルペスウイルス、EBV、アデノウイルス)およびRNAウイルス(HIV、HCV、インフルエンザウイルス、一部のアルボウイルス、ヒトT細胞リンパ球ウイルス-1、ロタウイルスおよびエンテロウイルス、EBOV)に対する抑制効果を含む、緑茶カテキンの抗ウイルス特性に関するいくつかの出版物を挙げている[171]。EGCGは、活性酸素および反応性窒素種の消去、防御酵素の産生、および二価金属のキレート化および結合を介して強力な抗酸化物質である[172]。
Lambertら(2010)は、マウスにEGCGを高用量経口投与した場合の肝毒性を評価した[173]。その結果、毒性を引き起こしたEGCGの用量は、緑茶の約10.5~32杯分に相当し、これは1日の過剰な量であることが示された。したがって、このデータは、お茶の摂取が肝毒性の有意なリスクをもたらす可能性を示すものではないことを示している。
著者らは、濃縮または精製された茶製剤を含む栄養補助食品の高用量摂取で毒性リスクが存在する可能性があると述べている[173]。しかし、これらの用量自体は研究で決定された見かけ上の毒性範囲内ではないが、症例報告で観察されたヒトの肝毒性に関連する緑茶サプリメントの用量と類似しており、推奨用量を超えることで毒性の閾値に到達する可能性は重要ではない[174,175]。
臨床試験では、分割用量(1 日 2 回)で与えられた EGCG の 400 mg を含む緑茶カテキンの投与の安全性と非空腹状態を評価した。EGCGは、研究対象であった前立腺がんのリスクが高い男性において、肝臓またはその他の毒性を引き起こさなかった。この結果は、1日400mgのEGCGを含む標準化された脱カフェイン化カテキン混合物を1日1回、1年間、食事(非絶食)と一緒に2回に分けて投与し、血漿中に蓄積させた場合、忍容性が良好で、治療に関連した副作用は生じなかったという強い証拠を提供した[176]。
感染がない場合、EGCGの補充は、Nrf2依存遺伝子および抗ウイルスメディエーターの発現レベルを高め、鼻上皮細胞におけるウイルスの侵入をブロックすることが研究で実証されている[78]。Nrf2を標的としたshRNAを発現するヒト鼻上皮細胞におけるNrf2発現の遺伝子操作および薬理学的操作により、Nrf2発現の抑制はウイルスの侵入を増大させ、一方でNrf2発現の増加はインフルエンザAウイルスの侵入を減少させることが示された[78]。
感染がない場合、EGCGの補充は、Nrf2タンパク質レベルを増加させ、RIG-I、IFN-β、およびMxAを含む抗ウイルス応答遺伝子のmRNA発現レベルを誘導した[78]。これらの遺伝子の発現は通常、ウイルス感染の間に刺激され、I型IFNの増産は「抗ウイルス状態」を誘導し、ウイルスの複製を制限する抗ウイルス遺伝子の合成を導く[177]。GTPasesの小さなファミリーに属するMxAは、ウイルスの複製を阻害し、インフルエンザAウイルスに対して抗ウイルス活性を有することが記載されている[177]。
細胞質性DExD/Hボックス含有RNAヘリカーゼ(dsRNAと協働する)であるRIG-Iは、ウイルス感染に応答してインターフェロンの産生を増強することが示されている[178,179]。
著者らは、EGCGがこれらの抗ウイルス遺伝子の発現をアップレギュレートし、「抗ウイルス保護状態」を作り出すことで、ウイルス感染前の細胞を積極的に保護しているのではないかと仮説を立てた[78]。Nrf2の結合部位はIFN-β、RIG-I、およびMxA遺伝子のプロモーターには同定されていないが、本研究はこの可能性を示唆しており、したがって、Nrf2の誘導はこれらの抗ウイルス遺伝子の転写を増加させるであろう[78]。
EGCGは強力な抗酸化能力を有し、いくつかの抗酸化酵素の発現を刺激する[180]。試験管内試験(in vitro)および生体内試験(in vivo)での研究は、EGCGがNrf2-EpREシグナル伝達に関連する第II相抗酸化遺伝子の発現を刺激することを実証した[166,181,182,183]。
Wuら(2006)は、Nrf2誘導の活性化機構がセリン/スレオニンのリン酸化と核蓄積の増加およびEpREへの結合を含むことを記述したが[184]、Nrf2依存性遺伝子発現の活性化が、その潜在的な抗ウイルス活性にどのように関与しているかについては、まだ知られていない[78]。
データは、転写因子Nrf2が上皮レベルでのウイルス感染に対する感受性を決定する上で不可欠な鍵であり、EGCG栄養補給はウイルス感染がない場合にNrf2タンパク質レベルを増加させ、抗ウイルスメディエーターの発現を増強することを示している[78]。
15.2. チモキノン(ブラッククミンシード)
ポリフェノールチモキノン(2-イソプロピル-5-メチルベンゾ-1,4-キノン;TQ)は、ブラッククミン(Nigella sativa)の輸入成分であり、数千年にわたり香辛料や食品保存料として使用されてきただけでなく、多数の疾患の保護および治療薬としても使用されており、伝統医学において多くの薬効を有することが知られている[185,186]。
最近のレビューでは、Mollaら(Molla er al)。 (2019)は、マウスサイトメガロウイルス感染症、鳥インフルエンザ(H9N2)などのいくつかのヒト、動物、鳥、植物病原性ウイルスに対するニゲラサティバおよびその成分の抗ウイルス活性を記載した。シストソーマ・マンソニ感染症、PPRウイルス、ブロードビーンモザイクウイルス、HIV、C型肝炎ウイルス、ズッキーニ黄モザイクウイルス、およびパパイヤリングスポットウイルスは、ニゲラ・サティバが抗ウイルス剤の最良の供給源の一つである可能性があることを示唆している[187]。
さらに、N.サティバは安全なハーブ製品として確立されている[188]。ブラックシードとその活性成分であるTQを使用した臨床試験では、それらの投与は肝臓、腎臓、または消化管の副作用を引き起こさないことが明らかにされた[189,190]。また、2型糖尿病患者においても安全であることが示されており、腎臓や肝臓に問題はなかった[191]。さらに、N. Sativa種子の投与は、成人の血清アラニンアミノトランスフェラーゼ(ALT)や血清クレアチニン(Cr)レベルに影響を与えなかった[192]。
TQは酸化ストレスや炎症に対する強力な化合物として報告されており、グルタチオンSトランスフェラーゼ[194,195,196]、グルタチオンペルオキシダーゼ[195]、グルタチオン還元酵素[195]、スーパーオキシドディスムターゼ[196]などの多くの細胞保護酵素の発現を誘導することが報告されている。酸化ストレスを伴う疾患状態の間、細胞は、細胞の抗酸化防御に関与する一連の細胞保護酵素、例えばHO-1を活性化し、酸化性および炎症性の組織損傷を改善することが示されている[197]。
ケラチノサイト細胞において、TQはmRNAとタンパク質の両方のレベルでHO-1の発現を増加させ、Nrf2を介したシグナル伝達経路への影響は、TQ誘導のHO-1発現がNrf2の活性化に依存していることを実証した。これらのデータは、TQ が Nrf2 シグナルを活性化し、HaCaT 角化細胞における HO-1 発現を刺激するプロオキシダントとして働くことを示唆している[198]。TQ が Nrf2 活性化と HO-1 発現を刺激するメカニズムは、MAP キナーゼは関与しておらず、AMPKα と Akt キナーゼのリン酸化と Akt リン酸化の負のレギュレーターである PTEN 発現の低下から成り立っていた [198] [199]。
LPSに曝露したラットのBV-2ミクログリア細胞において、TQはTNF-α、IL-6、IL-1βの放出を阻害し、TNF-α、IL-6、IL-1β、およびプロスタグランジンE2(PGE2)のレベルを低下させた[200]。TQは、iNOSタンパク質レベル、ƙB阻害剤のリン酸化、およびNFƙBのDNAへの結合を減少させたことから、TQは、炎症と活性酸素産生に関与するNFƙB介在性のプロ炎症性メディエーターが関与するNFƙB依存性の神経炎症を阻害することで効果を発揮することが示唆された[201]。
さらに、TQはNrf2の核内蓄積を増加させ、Nrf2のAREへの結合を強化し、転写活性を増加させ、NQO1とHO-1のタンパク質レベルを増加させた。この結果は、NFƙBが介在する神経炎症におけるNrf2/AREシグナル伝達経路に対するTQ活性化効果とTQ阻害効果との間に関連があることを示唆している[200]。
SARS-CoV-1患者を対象とした研究や生体内試験(in vivo)実験により、CoVの神経侵襲性と呼吸器から中枢神経系(中枢神経系)への伝播は、末梢神経からの逆行性軸索輸送または血行性伝播を介して起こりうることが実証された[202]。中枢神経系(中枢神経系)に一旦侵入すると、CoVはマウスの神経細胞死を誘発する可能性があることがデータで示されている[203]。
Liら(2020)は、主に呼吸に関与する髄質構造のSARS-CoV-2神経侵襲電位が、COVID-19で観察された呼吸不全の上昇した発生率を幾分か媒介しているのではないかと推測した[204]。SARS-CoV感染中、ACE2受容体は神経細胞およびグリアでも発現している。
ACE2トランスジェニックマウスにSARS-CoV-1感染を経鼻的に接種した実験研究では、神経細胞の死および神経細胞およびアストロサイトによるプロ炎症性サイトカイン産生の調節の増加が示された[203]。CoV [202] に感染した末梢性骨髄系細胞は、炎症や心理的ストレスによる血液脳関門透過性の亢進により、中枢神経系に勧誘されたり、転移したりする可能性がある。中枢神経系では、ウイルスに感染した単球は、炎症性サイトカインを放出し、ミクログリアの活性化を引き起こすことで神経炎症を広めることができる [205,206]。
証拠は、CoVが白血球に持続的に感染しうることを示唆しており[207,208]、したがって、CoVに感染した免疫細胞が神経炎症の将来の拠点として機能しうる時間経過は、初期の感染および急性症状の状態よりもかなり長い可能性がある[209]。
酸化ストレスの有害な影響およびコロナウイルス感染の神経侵襲性を考慮すると、ここに記載された研究は、TQ治療が、Nrf2を活性化し、HO-1発現を誘導し、さらにプロ炎症性サイトカインの放出を阻害することにより、COVID-19感染の予防または疾患重症度の低下に役立つ可能性があることを示唆している。
16. 免疫応答を高めるビタミンD3の補給
ビタミンDは、免疫系の健康に寄与し、感染症に対する防御力を高める栄養素として同定されている。肺では、酵素1α-ヒドロキシラーゼがビタミンDを活性型の1,25-ジヒドロキシビタミンD3に変換し、ビタミンDの最も強力な代謝物である[210]。ビタミンDは炎症と免疫応答を媒介する上で重要な役割を果たしている。
ビタミンDは、感染症時にNFƙBシグナル伝達とサイトカイン産生を仲介し、気道上皮細胞の免疫応答を制御している[211]。ビタミンDはIƙBαを誘導し、ウイルス感染によるNFƙB依存遺伝子の低刺激化を導き、炎症性ケモカインの放出を減少させる[212]。さらに、ビタミンDはCD14とカテリシジンの発現を増加させ、これはウイルスの認識と排除に役立つ[212,213]。
ビタミンDレベルの低下は、炎症を促進する表現型につながる可能性があり、これが疾患の重症度を増大させる可能性がある。ビタミンDのレベルが低いと感染症に対する脆弱性が高くなり、喘息、慢性閉塞性肺疾患、肺機能の低下などの呼吸器疾患のリスクの増加と関連しており、呼吸器感染症と戦う身体の能力に影響を与えている[211,214]。
研究では、25(OH)D濃度が16ng/mL未満の人は高濃度の人に比べて呼吸器感染症が多いことが示されており[215]、25(OH)D濃度が38ng/mL以上の人は急性呼吸器感染症の発症がかなり減少していることが示されている[216]。また、集中治療室に入院した患者を対象とした研究では、ビタミンDの欠乏は感染症の重症度、治療期間の延長、死亡率の増加と関連していることが示されている[217,218]。
さらに、後天性肺炎患者では、25(OH)D値が12ng/mL未満の患者で死亡率が高くなっていることが観察された[219]。研究では、ビタミンDが免疫応答を増強し、炎症性カスケードを仲介し、感染症の重症化の可能性を減少させる可能性があることが示されている[211]。
さらに、最近の研究では、1,25(OH)2D3処理したWTマウス胚性線維芽細胞ではNrf2発現レベルが顕著に増加したが、ビタミンD受容体(VDR)ノックアウトマウスでは増加しなかったこと、およびVDRがNrf2を結合する能力を提示したことが示された。さらに、1,25(OH)2D3がVDRを介したNrf2の転写制御に抗酸化機能を有していることが示唆された。
また、1,25(OH)2D3の欠損は酸化ストレスを増加させ、Nrf2の転写を阻害し、DNA損傷を促進することが示されている[220]。これらの研究から、ビタミンDの補給は重症感染症、特にSARS-CoV-2のようなウイルス性呼吸器系に影響を及ぼす感染症のリスクを低下させる可能性があることが示されている。
最近の研究では、日当たりの良い場所でもビタミンDの欠乏は予想以上に大きな問題になる可能性があることが示されている。したがって、直線的な緯度勾配がビタミンDレベルの最も重要な決定因子であると仮定することは、もはや適切ではないかもしれない[221]。
以前は、ビタミンD欠乏症は高緯度の国に限定された問題であると考えられていた。しかし、ブラジルのような国では太陽光に恵まれているにもかかわらず、ビタミンD欠乏症は一般的な現象であり、世界的な健康問題となっていることが研究で明らかになっている[222,223]。
したがって、EGCGとTQの摂取は、ウイルス感染に対する免疫機構における必須の役割のために、個人が年間を通じてUVB放射を受ける可能性のある国でも、ビタミンD3の補給と組み合わせるべきであると考えている。
17. 結論
本仮説論文では、Nrf2転写因子の保護的役割とSARS-Cov-2感染重症度との関連について考察した。Nrf2は、上皮レベルでのウイルス感染感受性の調節に重要な役割を果たし、ウイルス感染から細胞を保護し、酸化ストレス、炎症、およびSARS-Cov-2感染時に増強されるACE2受容体の発現を減少させる。
高齢者や既往症のある人、免疫抑制されている人はNrf2のレベルが低く、COVID-19感染症のより重篤な合併症を発症するリスクが高いと考えられている。Nrf2の活性化は、ウイルス感染前にNrf2依存性の抗ウイルスメディエーターを調節し、ウイルスの侵入と複製を制限する可能性がある。
したがって、Nrf2は、SARS-CoV-2感染を予防し、あるいは酸化ストレスの減少、炎症過程の改善(サイトカインストームにつながる可能性がある)、強化された自然免疫、およびACE2受容体のダウンレギュレーションにより、疾患の重症度を軽減するための新たな標的である可能性がある。
さらに、フラボノイド化合物をビタミンD3と併用することで、Nrf2の活性化をターゲットにして促進する新しいアプローチを提案している。EGCGとチモキノンは、すでにサプリメントとして使用されている天然化合物である。これらはNrf2依存性遺伝子を活性化し、宿主の抗ウイルス防御状態を刺激することが報告されている。
さらに、ビタミンD3の摂取は、EGCGやチモキノンのサプリメントの効果を増強する可能性がある。ビタミンDは、感染時にNFƙBシグナルとサイトカイン産生を調節することで、炎症と免疫応答を仲介し、急性気道感染症の発症を大幅に減少させることが示された。また、ビタミンD欠乏は酸化ストレスを増加させ、Nrf2の転写を阻害し、DNA損傷を促進することから、ビタミンD3の摂取はNrf2転写因子の活性化に有益であることが示唆された。
そこで、本仮説論文では、EGCG、TQ、ビタミンD3の組み合わせが、Nrf2依存遺伝子を活性化し、ウイルス感染から細胞を保護する可能性を示唆し、SARS-CoV-2などのウイルス感染症の予防に利用できる可能性を示唆している。
このアプローチの重要なポイントは、これらのサプリメントは、Nrf2の活性化を標的にして促進するような組み合わせで摂取した場合にのみ効果を発揮するということである。現在、これらのサプリメントはすでに市場に出回っており、単品での摂取が可能であるが、ビタミンD3の摂取によりEGCGやチモキノンの効果が増強され、Nrf2依存性の細胞保護遺伝子が活性化され、宿主の抗ウイルス防御状態が促進されるのではないかと考えられている。
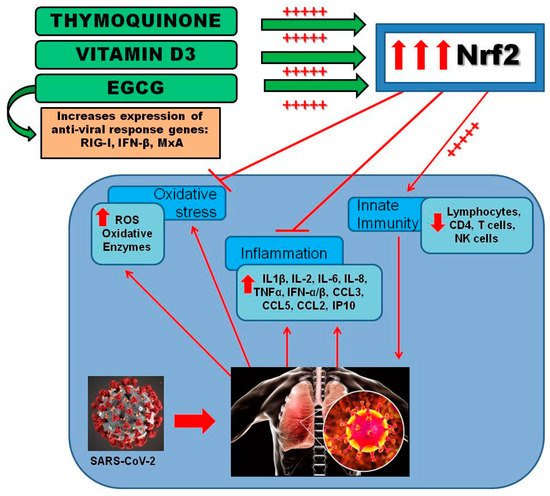
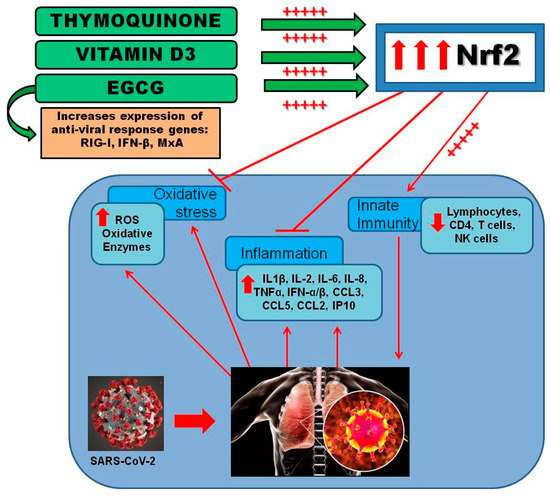
今後、EGCG、TQ、ビタミンD3を組み合わせたNfr2活性化剤の治療効果を確認し、SARS-CoV-2感染症の予防・管理における臨床的有用性を明らかにするためには、今後の研究と臨床試験が必要である(図4)。
図4 EGCG、TQ、ビタミンD3の組み合わせによるNrf2活性化の示唆。図は、SARS-CoV-2感染を予防または変調する方法として、EGCG、TQ、およびビタミンD3を組み合わせて投与することにより、酸化ストレス、炎症を軽減し、自然免疫を刺激することにより、Nrf2が活性化されることを示している。