Contents
Zinc, Vitamin D and Vitamin C: Perspectives for COVID-19 With a Focus on Physical Tissue Barrier Integrity
オンラインで公開2020年12月7日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7750357/
ホセ・ジョアン・ネーム1,1,* アナ・カロリナ・リモンディ・ソウザ1,1 アンドレア・ロドリゲス・ヴァスコンセロス2 ピエトラ・サクラメント・プラド1,1 およびカロリナ・パルガ・マルティンス・ペレイラ1
要旨
一部の栄養素は、免疫系の機能を維持する上で重要な役割を果たしており、免疫応答を決定する段階で相乗効果を発揮している。その中でも特に亜鉛、ビタミンC、Dは免疫調節機能を持ち、組織の物理的バリアを維持する役割を果たしていることから注目されている。COVID-19パンデミックを考えると、免疫システムを最適化して、このウイルス感染の重篤な進行や予後のリスクを予防または低下させることができる栄養素が重要になってくる。
そこで今回のレビューでは、皮膚や粘膜などの物理的な組織バリアの維持におけるこれらの栄養素の相乗作用に焦点を当て、ウイルス感染に対する免疫反応における亜鉛とビタミンCとDの役割を包括的に概観することを目的としている。
文献から明らかになっていることは、これら3つの要素のうち1つ以上が欠乏すると免疫応答が低下し、ウイルス感染に対して脆弱になり、病気の予後が悪くなることを示している。したがって、COVID-19パンデミックでは、ウイルスとの接触や炎症過程の発症時にこれらの栄養素に対する需要が高いため、亜鉛とビタミンCおよびDの十分な摂取が有望な薬理学的手段となる可能性がある。
継続的な臨床試験により、COVID-19の管理におけるこれらの栄養素の役割が明らかになるであろう。
キーワード
ビタミンC、ビタミンD、亜鉛、COVID-19,ジャンクショナルコンプレックス、免疫、栄養素
序論
コロナウイルス病2019(COVID-19)のパンデミックは、必須栄養素、特に、そのウイルス感染または他のウイルス感染の際に生物の自然免疫防御をサポートする免疫調節効果を有する栄養素の使用の重要性を強調している(1-3)。
コロナウイルスに分類されるウイルスは、病原体表面の冠状のトゲに由来する名前であるコロナウイルス科に属し、ヒトの呼吸器系を損なうことを特徴としている(4,5)。2019年末、中国・武漢市では、新たなコロナウイルス:重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)による肺炎と診断された個人が発生した(4,6,7)。世界のあらゆる地域でSARS-CoV-2陽性感染が急増していることから、世界保健機関(WHO)は2020年3月にCOVID-19をパンデミックと宣言した。
この疾患の臨床症状は、無症状の感染、軽度の上気道感染、呼吸不全を伴う重度の肺炎を含む幅広いスペクトルを有し、亜集中治療または集中治療を伴う入院が必要である(8, 9)。
栄養は、免疫機能を含む生体の恒常性の維持と様々な器官や生理学的システムの健康を決定する要因である(10,11)。COVID-19パンデミックの現在の状況では、個人の「栄養状態-免疫反応」の関係がより重要になっている。なぜなら、広く利用可能なワクチンや質の高いエビデンスに裏付けられた治療法がない場合、病気の主な治療/予防手段はウイルスに対する個人の反応にある(2,3,12-16)。不十分な栄養は、免疫系の弱体化に寄与するため、ウイルス感染症の出現に寄与する要因と考えられており、感染率、死亡率、罹患率のリスクを増加させる。さらに、ウイルス感染は、ビタミンA、B、C、D、亜鉛、セレンなどのいくつかの微量栄養素の需要を増加させる(17-20)。
免疫機能における役割が認められている微量栄養素の食事補給は、体の免疫応答の調節を最適化し、感染症のリスクを減少させることができる(19,21-25)。この意味で、亜鉛とビタミンCとDは、免疫調節作用があることが実証されている微量栄養素であり、欠乏すると、たとえわずかでも代謝が悪くなり、結果的に免疫系への作用が低下する可能性がある。
本レビューでは、免疫系の活動に必要な栄養素を十分に摂取することの重要性に鑑み、亜鉛、ビタミンC、ビタミンDとウイルス感染症、特にSARS-CoV-2によるウイルス感染症との関係について、主な医学・科学的知見を物語形式で紹介している。
栄養素とウイルス感染症
亜鉛
亜鉛の免疫調節作用と抗ウイルス作用により、この鉱物とそのイオノフォアはCOVID-19に対する候補物質となっている(31, 32)。亜鉛は免疫系の完全性に不可欠であり(33)、自然免疫反応や適応免疫反応の際の細胞の維持、発達、活性化に重要な役割を果たしている。また、生物の防御や病原体の侵入を防ぐために不可欠な上皮バリアの完全性にも役割を果たしている(34-37)。亜鉛はT細胞の発生と活性を調節することができ、その結果、高レベルの炎症性サイトカインやケモカインを特徴とするサイトカインストームを減少させ、全身の免疫応答の障害を低下させ、急性呼吸窮迫症候群(ARDS)や多臓器不全を減少させる(38-40)。亜鉛欠乏はナチュラルキラー(NK)細胞と細胞溶解性T細胞の活性を低下させ、これらはいずれもウイルス、細菌、腫瘍細胞の破壊に関与している(41,42)。
亜鉛のもう一つの重要な機能は、その直接的な抗ウイルス活性であり、ウイルス感染時の免疫応答に不可欠なものとなっている。このミネラルの細胞内濃度の増加は、様々なRNAウイルスの複製を減少させ(43-48)、ポリタンパク質のウイルスタンパク質分解処理を妨害することができる(49)。重要なことに、Vero-E6細胞培養において、低濃度の亜鉛(2μM)とのインキュベーションは、そのRNAポリメラーゼを阻害することにより、SARSコロナウイルス(SARS-CoV)の複製を抑制した(45)。さらに、亜鉛は、RNAウイルスに対するインターフェロン(IFN)サイトカインシグナル伝達を増強し(50-53)宿主細胞へのSARS-CoV-2の侵入に重要なアンジオテンシン変換酵素2(ACE2)の活性を阻害することができる(54,55)。
亜鉛欠乏は世界の人口の約3分の1に影響を与え(56)世界的な栄養問題と考えられており、先進国と発展途上国の両方の人口グループに影響を与えている。WHOの報告書によると、亜鉛欠乏は世界の年間死亡者数の1.4%(80万人)と健康寿命の2.9%(合計2800万)の損失の原因となっている(56)。また、発展途上国における罹患の主な原因の一つと考えられており(57)、これらの国では年間50万人の女性と子供が亜鉛欠乏により死亡していると推定されている(58-60)。世界的に見ても、下気道感染症の約16%は亜鉛欠乏が原因で発生しており(56)この栄養不足とSARS-CoV-2感染症のリスク上昇や重症化との関連性が示唆されている(61)。
疫学的データによると、COVID-19による死亡のほとんどは、高血圧、糖尿病または肥満などの共通の併存疾患を持つ高齢者に集中している(62-64)。一般的に、このグループの個人は亜鉛欠乏症の有病率が高い(65-69)が、加齢が、食事摂取量の減少、栄養吸収効率の低下、および薬剤の使用を含むいくつかの要因による体内の亜鉛状態の漸進的な低下と関連していることを考えると(70,71)、このグループは、亜鉛欠乏症の有病率が高い。同様に、肥満の人や慢性腎臓病の人は、しばしば亜鉛欠乏症を呈する(65-68,72-74)。
亜鉛欠乏の増加、特に免疫細胞の細胞内亜鉛レベルの低下は、高齢者の体内にある希少な亜鉛貯蔵量を動員することがより困難になることと関連しており、その結果、免疫反応の進行性調節障害(免疫新生)が起こり、結果として感染症にかかりやすくなる(71, 75, 76)。一般的に、慢性疾患を持つ高齢者や入院中の高齢者は、健康な高齢者に比べてミネラルのレベルがさらに低く(71)、これが感染症や加齢に関連した変性疾患の高い発生率の原因となっている可能性がある(70)。
感染症の間、生物は、免疫系に関連する機能などの優先的な機能のために亜鉛の備蓄を動員し、亜鉛レベルの低下をもたらし、おそらく、COVID-19患者ではしばしば影響を受ける嗅覚や味覚の維持など、他のあまり本質的でない機能への亜鉛の欠乏につながる可能性がある。この考え方は、上記で引用したトリアージ理論と一致する(26)。
亜鉛はまた、上皮細胞間の接着を促進し、上皮組織の構造と選択的バリアとしての機能に必要な構造である細胞間接合タンパク質において重要な役割を果たしている(34-36)。亜鉛欠乏状態では、細胞間接合体の破壊が起こり、その結果、組織の完全性が低下し、傍細胞透過性の制御が障害され、病原体の通過を可能にする(34,36,77)。逆に、亜鉛の補給はこれらの細胞接合の機能を改善する(34)。病原体の侵入に対する皮膚および粘膜の物理的バリアの完全性を維持する上での亜鉛の重要な役割を考えると(37)、亜鉛はSARS-CoV-2による汚染のリスクを軽減する役割も果たしていると考えられる。
腸粘膜は病原体の侵入を防ぐ重要な細胞バリアであり、SARS-CoV-2感染後には悪化する。中国湖北省のデータによると、感染者の最大79%が下痢、嘔吐、腹痛、消化管出血などの消化管症状を呈する可能性があることが示されている(78)。文献では、COVID-19症例の2~50%で下痢の発生が報告されている(78,79)。いくつかの患者では、それは提示された唯一の症状であり、それは疾患の予後の悪化と関連しており(80,81)脱水時の悪吸収および損失のために体内の亜鉛レベルを低下させる可能性がある(82)。
亜鉛の補給は、ウイルス感染が原因と考えられる急性下痢症の治療に有効であることが示されている(83)。このアプローチは、WHOによって急性下痢症の子供の治療に推奨されており、2~3ヶ月後の新たなエピソードのリスクに加えて、下痢の持続期間と重症度を軽減することができる(84)。亜鉛源については、アミノ酸キレート亜鉛の補給は、プラセボや硫酸亜鉛と比較して、未就学児において、下痢や急性呼吸器感染症の発生率を減少させる効果が高く、副作用の発生率も低いことが明らかになっている(22)。亜鉛は腸管バリアの機能(77)と病原体に直接作用するいくつかの機序(病原性因子の発現の減少を含む)を介して下痢のリスクを減少させる(85,86)。
亜鉛欠乏者は呼吸器疾患や下痢性疾患の罹患率が高くなりやすい(87,88)。さらに、亜鉛欠乏症の子供への亜鉛補給は、麻疹ウイルスによる下気道感染症に関連した罹患率と死亡率を減少させる可能性があることが明らかにされている(89)。また、亜鉛の投与は、下気道感染症である小児肺炎の有病率の41%の減少と関連している(23)。
臨床研究では、亜鉛の補給はまた、発熱、咳、喉の痛み、筋肉痛、鼻づまりなど、SARS-CoV-2感染後に起こる可能性のある様々な風邪症状の重症度と期間を最大54%減少させることが示されている(90-92)。無作為化二重盲検試験では、風邪をひいた 48 名のボランティアに、症状発症後 24 時間以内に酢酸亜鉛ロゼンジ(元素 Zn 80 mg/日)のサプリメントまたはプラセボを投与した。プラセボと比較して、亜鉛の投与は、風邪症状の持続時間と全症状の総重症度スコアの有意な減少と関連していた(p < 0.002)(90)。
COVID-19患者4人の症例報告シリーズでは、高用量の経口亜鉛(最大207mg/日)の投与は、治療1日後の酸素化の改善と息切れの迅速な解消に関連している可能性があった。副作用は報告されていない(93)。逆に、242人の患者を対象としたプロスペクティブ研究では、亜鉛補充とCOVID-19関連死亡率の減少との間に有意な相関関係は認められなかった(RR = 0.66;95%CI:0,41-1.07;p = 0.09)(94)。この研究のいくつかの限界(単施設レトロスペクティブデザイン、交絡変数の存在の可能性、サンプルサイズ、亜鉛投与を受けた患者の割合の高さ)を考慮して、著者らはCOVID-19治療における亜鉛の可能性を調査するためのランダム化臨床試験の必要性を強調した(94)。
このレビューが完了した時点で、経口亜鉛を単剤または他の化合物と併用した10件以上の臨床試験がclinicaltrialsに登録されている。 govに登録され、被験者の登録が開始されている(NCT04468139,NCT04472585,NCT04342728,NCT04446104,NCT04335084,NCT04370782,NCT04447534,NCT04326725,NCT04334512,NCT04412746)が、そのうちの2件はすでに終了している(NCT04485169,NCT04491994)。これらの試験の結果は、COVID-19における補助療法としての亜鉛の有用性を検証する上で重要となる。
ビタミンC
アスコルビン酸は、抗酸化特性を持つ水溶性微量栄養素であり、病原体の侵入に対する上皮バリアや自然免疫系および適応免疫系の細胞機能をサポートし、免疫系において重要な役割を果たしている(19, 95)。
抗酸化物質として、ビタミンCは、通常の代謝や汚染物質や毒素への曝露によって生じる酸化物質への曝露によって生じる生体分子(核酸、タンパク質、脂質、炭水化物)への損傷を防止する(96)。さらに、このビタミンは、コラーゲンの三次構造の安定化(97)ノルエピネフーリン、カテコールアミン、バソプレシンなどのホルモンの生合成(98)DNAやヒストンのメチル化に関与するいくつかの酵素の補酵素であり、エピジェネティックなイベントの発生に重要である(99)。
体内のビタミンCレベルは、大気汚染などの環境条件や、2型糖尿病などの病態の存在により変動することがある(95)。このグループでは慢性疾患または急性疾患がパンデミックしており、加齢はビタミンCレベルの低下と関連しているため、高齢者集団は特にビタミンC欠乏症の影響を受けている(100-103)。例えば、英国の高齢者集団におけるビタミンCの低レベル(≦17μmol/L)は、心血管系の原因を含むすべての死亡原因と関連していた(104)。また、急性呼吸器感染症で入院した高齢者に200mg/日のビタミンCを補給すると、プラセボ群と比較して重症度指標の低下が認められた(105)。最近、Arvinteら(106)は、重症のCOVID-19患者21人を対象としたパイロット試験を実施し、患者の血清中ビタミンCとビタミンDの低値が観察された。さらに、高齢と低ビタミンCレベルは死亡率の共依存危険因子であるようであり、血清ビタミンCレベルが死亡率の予測因子としての年齢の有意性に寄与していることが示唆された(106)。
1日200mgからのビタミンCの投与量を用いた44の研究のメタアナリシスでは、成人と小児の感冒の期間が短縮したことが報告されている。Johnstonら(21)は、低ビタミンC(≦45μmol/L)の男性における呼吸器感染症の症状に対するビタミンC補給(1g、8週間)の効果を評価した。統計的に有意ではなかったが、サプリメントはプラセボ群と比較して、風邪のエピソードを減少させ、感染期間を59%短縮した(-3.2日;95%CI:-7.0-0.6;p=0.06)(21)。
急性呼吸器感染症に関しては、ビタミンCの投与により、重症患者の肺炎の呼吸器症状のスコアが低下することが明らかになった(109)。また、ARDS患者の2例の報告ではアジュバントとして使用され、肺水腫を効果的に減少させた(110,111)。ARDS患者へのビタミンCの大量投与は、炎症や臓器損傷の軽減、病原体感染や病原性の低下、免疫防御の最適化など、いくつかの有益な結果に関連している(112)。
ARDSでは、液体やタンパク質が肺胞に浸透し、肺水腫を引き起こす。このプロセスは、肺内皮のタイトジャンクションの損傷により発生し、その結果、液体、好中球および赤血球に対する透過性が増加し、肺胞腔内でこれらの成分が過剰になる(113)。急性肺損傷の間の血管内空間および血管外空間における好中球の存在は、しばしば血小板と関連しており、それらの炎症性血栓形成活性のために、炎症性プロセスを導く凝集体を形成する(113)。
敗血症と急性肺機能障害を有するマウスを対象とした研究では、200mg/kgのビタミンCの非経口注入により、肺胞液の除去が増加し、肺胞上皮バリアの構造と機能の改善が促進され、プロ炎症反応が減衰し、肺機能障害における敗血症の影響が軽減されたことが示された(114)。これらの結果は、細胞間接合体の構成タンパク質の正常化と、アスコルビン酸によって促進される細胞骨格の再配列の防止によって得られた(114)。また、ビタミンCの合成を担う酵素を欠損したマウス(Gullo-/-)では、腹膜の炎症過程において、マクロファージによる好中球の認識・貪食が行われないために、好中球がアポトーシスに入ることができず、腹腔内に蓄積してしまい、これらの細胞の除去が抑制されていた(115)。したがって、ビタミンCは、亜鉛について以前に述べたように、損傷した組織における好中球の除去に不可欠であることに加えて、病原体の侵入の防止および上皮組織の再構築に作用し、これらの細胞の蓄積および炎症過程の減少につながる、細胞間接合体のタンパク質構成要素において重要な役割を果たしている。
現在のCOVID-19パンデミックの観点から、この疾患の患者は、胸部CTスキャンの異常な結果を有しており、その結果、肺内の体液の増加に起因するグランドガラスの不透明性を伴う肺の両側浸潤が明らかになり、これは98%の症例で発生している。また、ARDS(29%)や二次感染症(10%)などの合併症を併発することもある(116)。ビタミンCはARDSの補助薬となり、急性肺機能障害に伴う敗血症の劇症的な結果を減少させ、肺炎の発生率を~80%減少させる可能性がある(117)。18の対照臨床試験のメタアナリシスでは、ビタミンCの経口または静脈内投与により、集中治療室(ICU)での滞在期間が7.8~8.6%(p≦0.003)機械換気の持続時間が18.2%(p=0.001)短縮されることが示されている(118)。
さらに、ビタミンCは、プロ炎症性サイトカインであるインターロイキン(IL)-6の高レベルを特徴とするサイトカインストーム(19,38,119,120)を調節する可能性があり、その結果、COVID-19患者において機械的換気を必要とする呼吸不全のリスクが増加する(121)。健康な男性12人を対象とした生体内試験研究によると、ビタミンCの前処理は、血管収縮因子であるエンドセリン-1(ET-1)から放出されるIL-6のレベルを低下させ、血管機能障害を減少させることができる(122)。さらに、ET-1発現の増加は、肺炎、肺高血圧症、間質性肺線維症、ARDSとも関連している(120)。
本レビュー終了時点で、COVID-19患者を対象とした20件以上の臨床試験が進行中であり、そのうち7件はすでに参加者の登録を開始しており、ビタミンCを静脈内治療として用いたものが5件(NCT04323514,NCT04401150,NCT04357782,NCT04264533,NCT02735707)経口治療として用いたものが2件(NCT04468139,NCT04382040)であった。
Hiedraらの研究(123)では、30%以上の酸素を必要とするCOVID-19患者17人に、1gのビタミンCを3日間静脈内投与した(123)。これらの患者は初期治療としてヒドロキシクロロキン、メチルプレドニゾロンまたはトシリズマブを投与されていた。ビタミンC治療後、Dダイマーやフェリチンなどのいくつかの抗炎症マーカーのレベルが有意に低下した。しかし、この研究は参加者数が少なく、期間も短く(わずか3日)ビタミンC単独使用の効果を調査していない。症例報告では、COVID-19の患者がARDSを発症し、機械的換気を必要とした後、11gのビタミンCの静脈内投与を受けた(124)。高用量ビタミンC治療は、ビタミンCを静脈内投与しなかった患者と比較して、ICU滞在期間と機械換気の必要性の両方を減少させ、患者の回復も早かった。重要なことに、この患者はヒドロキシクロロキン、アジスロマイシン、コルヒチン、硫酸亜鉛を使用していた(124)。
COVID-19患者を対象としたこれらの研究の限界にもかかわらず、これらの結果は、この微量栄養素は、SARS-CoV-2などのウイルス感染のリスクおよび重症度に影響を与える因子である免疫応答の発達、維持および発現において重要な役割を果たしているため、本疾患の治療におけるビタミンCの使用について、より詳細に調査することの重要性を強調している。
ビタミンD
伝統的な名前にもかかわらず、ビタミンDは、内因性に生産されることに加えて、それが異なる細胞タイプの200以上の遺伝子の調節に作用することを考えると、実際にはホルモンである(125-127)。必要なビタミンDの〜10%のみが食品から得られ、そのような冷たい深海魚、例えば、マグロやサケ(D3またはcholecalciferol)などの動物、および(ii)そのような食用キノコ(D2またはエルゴステロール)などの植物を含む、その主な供給源。残りの80〜90%は、紫外線(UV)太陽放射への曝露に続いて、表皮の深層で始まるプロセスである内因性に合成され(128)肝臓および腎臓での様々な水酸化プロセスを含む。最終代謝物である 1α,25-ジヒドロキシビタミンD [1,25(OH)2 D またはカルシトリオール] は、代謝活性分子である (127, 128)。
皮膚の色素沈着、老化、日焼け止めの局所適用などの変動は、体内でのビタミンDの合成を低下させる可能性がある(129-131)。重要なことは、ビタミンDのレベルを制御するシステムがあるため、内因性の産生が生体内に毒性を蓄積させることはないということである。UV-B 光線への長時間の暴露の間に、プレコレカルシフェロール(プレビタミン D3)は、ルミステロール、ビタミン D3 生産のバランスを維持する不活性異性体に変換される (132, 133)。
カルシウムの恒常性および骨の健康維持に対する古典的な効果に加えて、ビタミンD3は、身体の免疫機能において重要な役割を果たしている(17,19,134-136)。実際、ビタミンDは(i)すべての免疫細胞に受容体を持ち、(ii)Tリンパ球の産生とBリンパ球の分化に関連し、(iii)IL-10サイトカインレベルを変化させることで抗炎症機能を最適化することを考えると、カルシトリオールは免疫系の強力なモジュレーターとして作用する。(iv) 単球およびマクロファージの成熟および分化を誘導する;(v) 核内因子κB(NF-κB)を介したサイトカインおよびケモカインの産生に関連する;(vi) リソソーム酵素である酸ホスファターゼおよび過酸化水素の分泌を誘導する(134, 136, 137)。ビタミンDのこの免疫調節機能は、ウイルス感染症の間は複雑であると考えられており、病原体の性質および疾患の解決に責任を負う免疫機能のタイプによって異なるようである(136, 137)。
免疫細胞以外にも、ビタミンD受容体(VDR)は肺上皮細胞にも存在する。VDRは活性化されると、直接作用または免疫学的調節を介して抗ウイルス活性を有するペプチドであるディフェンシンとカテリシジンの発現をもたらす(138-140)。ビタミンDが欠乏している間、COVID-19患者における抗ウイルス免疫応答の低下は、カテリシジン由来の抗菌ペプチドであるLL37レベルの低下によるものではないかと推測されている(139)。
ビタミンDはまた、COVID-19関連ARDSの間のサイトカインストームの発生に関与する腫瘍壊死因子(TNF)αやIL-6などの炎症性サイトカインをダウンレギュレートすることにより、悪化した炎症反応を減衰させる可能性がある(136, 140, 141)。実際、5,000人以上のCOVID-19患者を対象とした予備的データでは、ビタミンD欠乏とサイトカインストームの重症度との関係が示唆されており、炎症性マーカーであるC反応性蛋白(CRP)の血清レベルが高いことが示されている(142)。
25件のランダム化比較試験のメタ解析では、ビタミンD3の補充は急性呼吸器感染症の発症リスクの低下と関連しており(OR=0.88,95%CI:0.81-0.96;p<0.001)介入開始時にビタミンD不足(血清レベルが25ng/mL未満)の人では補充のプラスの効果がさらに顕著であったことが示された(143)。
細胞性および体液性免疫におけるその役割に加えて、ビタミンDは、亜鉛およびビタミンCと同様に、肺組織を含む上皮および内皮バリアの形成および維持において重要な役割を果たしている(17,19,144-146)。ビタミンD受容体ノックアウトマウスモデルを用いて、Chenら(146)は、このホルモンシグナリングがない場合、動物は肺炎症および肺機能障害を示し、これは上皮バリアの完全性の障害の結果として生じる肺透過性の増加によって説明することができることを観察した。著者らは、クラウディンなどのタイトジャンクションの維持に不可欠なタンパク質の発現が低下していることを示した。このように、ビタミンD欠乏症の場合、肺は上皮の完全性を失い、炎症過程や喘息、慢性肺炎、癌などの病理学的疾患の影響を受けやすくなる(146)。
内分泌学会によると、25(OH)Dの血清レベルが20ng/mL未満であればビタミンDの欠乏を示し、21~29ng/mLであればビタミンDの不足を示す(147)が、いずれもこのホルモンの免疫調節機能を低下させ、ウイルスや細菌感染症への感受性の増加と関連している(17, 125, 134)。
いくつかの研究では、ビタミンD欠乏とSARS-CoV-2感染症への感受性および疾患の重症度との間に相関関係があることが示唆されている(24, 106, 140, 148-152)。Ilieら(149)は、欧州20カ国の平均血清ビタミンDレベルとCOVID-19の症例数と人口100万人当たりの死亡率との間に負の相関関係を見出した。ビタミンDのレベルが著しく低いことは、特にスイス、イタリア、スペインで高齢者に確認されている(149)。
7件のレトロスペクティブ研究のメタアナリシスでは、COVID-19患者1,368人の平均血清ビタミンD値が22.9 nmol/Lであったことが報告されている(140)。ビタミンDの血清レベルが有意に低い患者は、予後が良好な患者に比べて疾患予後不良と関連しており、標準化平均差(SMD)は-5.12(95%CI:-9.14, -1.10, p = 0.012)であった。また、ビタミンD値の差は、生存している患者と死亡した患者の間でもかなりの差があった(SMD = -14.6,95%CI:-15.3,-13.8)。著者らは、ビタミンD欠乏はCOVID-19の重症度に独立した因果関係を果たしており、リスクのある集団における予防的または治療的な補充は、不良な疾患転帰を予防するのに有用であると結論づけた(140)。
同様に、イスラエルの7,807人のコホートを対象とした研究では、COVID-19陽性者のビタミンD値が陰性者に比べて有意に低いことが明らかになった。ビタミンDの血漿中濃度の低さ(30ng/mL未満)は、COVID-19感染(OR = 1.58;95%CI:1.24-2.01;p < 0.001)および入院(OR = 2.09;95%CI:1.01-4.30,p < 0.05)の独立した危険因子と考えられていた(150)。
前述のように、COVID-19による死亡のほとんどは、併存疾患を有する高齢者に集中しており、これらの個人はまた、ビタミンD欠乏症を有する(24)。研究は、カルシトリオールの低レベルと、癌、糖尿病、高血圧および心臓病などの病態との間の相関関係を実証している(24,106)。同様に、加齢と内因性ビタミンD合成の減少との間には既知の関係があり、これは副甲状腺ホルモン(PTH)のレベルの増加によって説明できる(153)。特に高齢者集団に関しては、疫学研究は、低ビタミンD症も一般的に罹患率および死亡率の増加と関連していることを示している(154)が、メタアナリシス(75,927人の参加者と38の研究)では、ビタミンD3の補充が死亡率を有意に減少させることが示されている(RR = 0.94;95%CI:0.91-0.98;p = 0.002)(155)。
COVID-19のパンデミックを考えると、WHOはウイルスの拡散を抑制するための対策として社会的隔離を提案している。閉じこもりや日光への露出の欠如は、このホルモンの内因性産生を妨げ、COVID-19と闘う身体の能力を低下させるため、この対策は血清ビタミンDレベルの低下にも寄与する可能性がある(156)。薬剤の補充や、脂肪の多い魚、タラ肝油、卵黄などのビタミンDを豊富に含む食品の摂取など、血清ビタミンD欠乏症を予防するための代替手段は、この隔離期間中に検討されるべきである(156)。
最後に、本疾患のもう一つの重要な特徴は、その病態生理である。SARS-CoV-2の感染は、ウイルスが酵素ACE2と相互作用し、その活性を低下させることから始まる。重要なことに、ACE2はARDSおよび急性肺損傷を打ち消す上で重要な役割を持っている。Xuら(157)は、ARDSのモデルとしてリポ多糖に曝露したラットの肺組織において、カルシトリオールがACE2をアップレギュレートし、レニンおよびアンジオテンシンIIをダウンレギュレートすることができることを実証した(157)。このシナリオでは、最近の文献によると、ビタミンDはSARS-CoV-2感染におけるACE2ダウンレギュレーションを標的とすることで作用することが示唆されており、これはCOVID-19および誘導ARDSに対する潜在的な治療アプローチである可能性がある(158-161)。しかしながら、COVID-19に対するACE2調節の影響を理解するためには、さらなる研究が必要である(17, 24, 158-162)。
提示された観察結果を考慮すると、ビタミンD欠乏は高齢者や基礎疾患を有する患者の間で共通の変数であり、COVID-19による合併症や死亡率の影響を受けやすい集団である可能性が示唆される。このことは、ウイルス感染のリスクと重症度を軽減し、本疾患の症状を軽減するために重要な免疫応答の維持と発現の指標として、ビタミンDの補充を使用することを正当化する可能性がある(163-165)。
COVID-19患者におけるビタミンD補給の効果を決定するための臨床研究が必要である。本レビューの執筆時点で、COVID-19患者における経口ビタミンD補充に関する約30件の臨床研究がclinicaltrials.govに登録されている。 gov, NCT04449718, NCT04487951, NCT04407286, NCT04411446, NCT04502667, NCT04459247, NCT04403932, NCT04335084, NCT04344041, NCT04334512, NCT04386850, NCT04482673)のうち12件が患者登録を開始しており、2件は既に終了している(NCT04407572, NCT04435119)。
次に、その完全性がウイルス、細菌およびアレルゲンの侵入に対する重要な障壁である細胞間接合体の構造維持および活性経路の形成に対処する。この特定の文脈では、問題の栄養素は、代謝経路に参加したり、補完されたときにそれらの修復のためだけでなく、欠乏した個人の上皮バリアの選択性の損失を証明するために、両方とも、それらの相互依存性を明らかにする相乗効果またはさえコンフルエント構造を構成している。
物理的障壁上の栄養素の相乗作用
皮膚や粘膜などの生物の外表面と内表面は、侵入を防ぐ物理的障壁を形成しているため、病原体や毒素、その他の異物に対する第一の防御線となる(17)。SARS-CoV-2は、物理的バリアが脆弱な状態にあるときに、物理的バリアを貫通することができる。したがって、それは、感染者との物理的接触があるときに直接、または懸濁液中の液滴(>5μm)およびエアロゾル(<5μm)を介して、または鋼およびプラスチックがこのウイルスがより生存可能な材料である感染媒介物を介して間接的に感染することができる(166)。
SARS-CoV-2を含む液滴は、口腔、気道、腸管粘膜、結膜など、このウイルスの体内への侵入に必要なACE2を発現する組織と接触することで感染する。しかし、SARS-CoV-2で汚染された食品の摂取が消化器系を介した感染を引き起こすかどうかは確認されていない(166-171)。したがって、物理的バリア、特に上皮細胞の物理的および機能的完全性は、SARS-CoV-2感染のリスクを低減するために重要である。
上皮細胞は、タイトジャンクション、アドヒアレンスジャンクション、およびデスモソームによって形成される上皮ジャンクション複合体として知られる、明瞭な細胞間ジャンクションによって接合されている(172,173)(図1)。これらは選択的バリアとして作用するため、この複合体は、病原体や毒素の血流への侵入を防ぐ。
図1
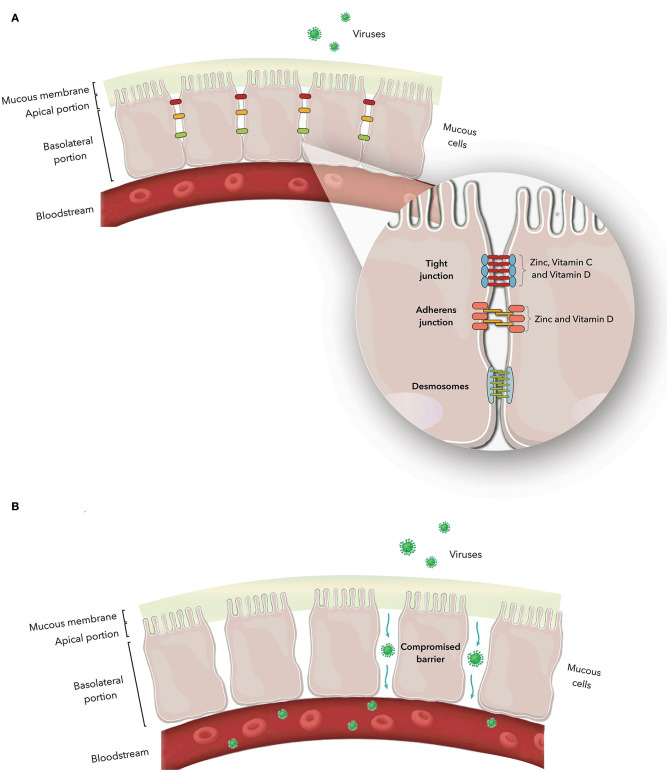
A)上皮細胞における接合体複合体。拡大すると、これらの構造の傍細胞空間での配置と、タイトおよびアドヒデンスジャンクションタンパク質に対する亜鉛およびビタミンCとDの作用を示している。B)ジャンクション複合体の機能不全とその結果
栄養素の欠乏、特定の病態の存在、および病原体との相互作用は、ジャンクショナル複合体の構造的および機能的な機能障害の原因として考えられるいくつかのものである。接合体複合体が障害されると、生物はその選択的バリアを失い、ウイルスのような有害物質の血流への侵入に対して感受性を持つようになる(114, 172, 174-176)。表1に、接合体複合体の構成タンパク質と各接合体の機能を示す。
表1 接合体複合体の機能と構成タンパク質
| ジャンクションコンプレックス | 関数 | 構成タンパク質 | 細胞骨格アダプタータンパク質 |
|---|---|---|---|
| タイトジャンクション | 細胞間スペースを密閉します。選択的傍細胞拡散 | クローディン(この家族の26人のメンバー); MARVELドメインのタンパク質(オクルディン、トリセルリン、MARVELD3) | Zonula occludensタンパク質(ZO):ZO1、ZO2、ZO3; シンギュリン; MAGI; PAR3; PAR6 PALS1 PATJ |
| 接着結合 | 隣接するセル間でアクチンフィラメントの束を接続します | 古典的なカドヘリン(E-カドヘリン)ネクチン | α-カテニン、β-カテニン、プラコグロビン(γ-カテニン)、カテニンp120、ビンキュリン、α-アクチニン、FFA6 |
| デスモソーム | それらは隣接するセル間の中間径フィラメントを接続します | カドヘリン(デスモグレイン、デスモコリン) | プラコグロビン(y-カテニン)、プラコフィリン、デスモプラキン |
MAGI、membrane-associated guanylate kinase inverted;PAR、partitioning defective;PALS1,Lin-1に関連するタンパク質;PATJ、PALS1-associated tight junction(PATJ);AF6,6番染色体タンパク質由来のALL1融合遺伝子;(172,173)からの引用。
タイトジャンクションは、生物の異なるコンパートメント間のバリアの確立に不可欠であり、その主な機能は、サイズおよびイオン電荷に応じて分子の通過を制限する選択的な傍細胞拡散である(172, 173)。密結合によって促進される選択的拡散は、臓器や組織の恒常性維持のための重要なプロセスであると考えられている(172)。
アドヘレンスジャンクションは、細胞間のアクチンフィラメントを接続するアンカー機能を有しており、2つのサブコンプレックス、すなわち、隣接する細胞間の初期接着および先端-下側極性の確立に重要なネクチンベースの接着、および細胞間の結合を強化するカドヘリンベースの接着を有する。証拠は、これら、2つの接合部が相互に連結していることを示しており、それは物理的なものであっても、シグナル伝達を介したものであってもよい(177)。
デスモソームは、接着接合と同様に、細胞間の中間フィラメントを接続するアンカー機能を持っている。この接続は組織の機械的完全性を保証し、これは皮膚や心臓のような機械的ストレスの影響を受けやすい組織には不可欠である(178)。デスモソームはまた、物理的に、そしてシグナル伝達経路を介して、タイトジャンクションおよびアドヒアレンスジャンクションと相互作用する(178)。このように、接合体複合体は、その機能を効果的に実行するために動的に相互作用する。
C型肝炎ウイルス、インフルエンザAウイルス、SARS-CoV、および細菌ヘリコバクター・ピロリのようないくつかのウイルスおよび細菌は、タイトジャンクションタンパク質と相互作用することが知られており、したがって、これらのバリアの完全性および機能を阻害する(172,179,180)。さらに、慢性炎症性疾患や癌などの疾患もタイトジャンクションの機能障害を引き起こす可能性があるが、この調節障害がこれらの病態の原因であるか結果であるかは不明である(172)。
亜鉛とビタミンCとDは相乗効果を発揮し、以下に詳述するように、いくつかの接合部複合タンパク質の完全性と機能を促進する。
亜鉛
亜鉛は腸管バリアの完全性と恒常性に不可欠である(181-183)。ラットの実験的大腸炎モデルでは、電子顕微鏡による解析により、亜鉛の補給はタイトジャンクションに作用して腸管透過性を低下させることが示された(34)。ヒトの腸管癌細胞(Caco-2株)とマウスの大腸では、オクルーディンとクラウディン-3のタンパク質レベルの有意な低下によりタイトジャンクションが障害されたため、亜鉛の細胞内枯渇が腸管バリアの透過性を増加させた(176)。100μMの亜鉛を補充すると、タイトジャンクションの透過性を低下させ、バリアの恒常性を再確立した(176)。
タイトジャンクションの構成タンパク質であるクラウディンは、傍細胞空間を拡散する分子の大きさと電荷を選択的に制御する。2種類のクラウディンは、その性質に基づいて区別することができる:膜を封鎖するもの(クラウディン-1,-3,-4,-5,-6,-8,-12,-18,および-19)と、細孔を形成するもの(クラウディン-2および-15)であり、後者は分子の通過を可能にしている(184)。Caco-2細胞を用いた試験管内試験試験では、亜鉛処理により、タイトジャンクションの完全性に依存する因子である経上皮電気抵抗とマンニトールフラックスが増加することが示された。得られた結果に基づき、クラウディン-2およびクラウディン-7のタンパク質レベルが亜鉛補給後に有意に低下することが明らかになった(77,185-188)。亜鉛補給によるこれらのタンパク質の減少は、電解透過性の低下と関連する上皮バリアの抵抗の増加に影響を与える。ターンでは、非電解質透過性の増加を示すマンニトールフラックスの観察された増加は、亜鉛が電解質の種類に応じて異なる作用をして、接合複合体の中で微調整を行うことを示している(77)。
密結合の構造を変化させることに加えて、亜鉛欠乏は、付着性結合も障害し、E-カドヘリンおよびβ-カテニンタンパク質の非局在化およびCaco-2細胞における細胞骨格の非局在化をもたらした。腸管上皮の組織のこの機能不全は、透過性の増加、その結果として傍細胞空間への好中球の浸潤につながり、炎症反応を誘発した(36)。したがって、亜鉛欠乏性肺上皮細胞では、サイトカインへの暴露は、E-カドヘリンとβ-カテニンのタンパク質分解を伴うアポトーシスとバリア機能不全による細胞死を増加させた(189)。アポトーシスとバリア機能障害は、急性炎症に伴う細胞内亜鉛欠乏のレベルと欠乏にさらされる時間に正比例していた(189)。逆に、亜鉛の補給は接着接合部の障害を逆転させ、細胞の完全性とバリア機能の維持に効果的であった(189)。これらの知見に基づき、著者らは、肺における炎症反応の開始時には、上皮細胞への亜鉛の動員は、免疫機能を高め、炎症による損傷から他の細胞を保護するために不可欠な自然反応であることを示唆している(189)。同様に、亜鉛で処理したCaco-2細胞は好中球浸潤を示さなかったことから、亜鉛レベルの補充が上皮バリアの完全性を回復させ、炎症プロセスを防止したことが示された(36)。
ビタミンC
ビタミンCは、亜鉛と同様に、いくつかのタイトジャンクションタンパク質の発現を変化させる。誘導腹膜腹膜炎およびその後の急性肺組織損傷のマウスモデルにおいて、アスコルビン酸およびデヒドロアスコルビン酸200mg/kgの腹腔内投与は、プロ炎症性ケモカインのダウンレギュレーション、肺における好中球多形核の浸潤の減少、および組織損傷の重症度の低下をもたらした。非補充群では、動物に誘発された腹膜炎は、クラウディン-2および-4の発現の有意な増加、およびクラウディン-18,オクルーディンおよび細胞骨格アダプタータンパク質zonula occludens 1 (ZO1)のレベルの低下を伴い、小溶質に対する肺胞バリア機能の喪失につながった(114)。アスコルビン酸のサプリメントは、細胞骨格とアクチンの再配列を防止することに加えて、これらのタンパク質の発現の変化を防止し、イオンや小分子の傍細胞透過性を維持し、上皮バリアを維持することにより、有意に肺水腫を減少させた(114)。
ビタミンCはまた、オクルーディンの完全性を維持し、内皮バリア機能障害に関連するタイトジャンクションの損傷を防止する(190, 191)。このバリア機能障害には、一酸化窒素(NO)と反応してペルオキシナイトライト(ONOO-)を形成する反応性種のスーパーオキサイドアニオンラジカル(O・2)の産生が関与しており、内皮バリアの損傷やオクルーディンの脱リン酸化を誘発する可能性が高い。ビタミンCはO・2産生の原因となるNADPHオキシダーゼという酵素を阻害し、O・2とONOO-を除去することで、オクルーディンの脱リン酸化とタイトジャンクションの緩みを防いでる(190-192)。
ビタミンD
ビタミンDとその受容体はタイトジャンクションに影響を与え、ZO1,オクルーディン、クラウディンというタンパク質の発現と機能に関与している(19, 175)。藤田ら(193)は、ビタミンD受容体ノックアウトマウスの十二指腸、空腸、回腸および結腸において、クラウディン-2およびクラウディン-12のレベルが低く、腸によるカルシウムの取り込みを阻害することを発見した(193)。さらに、これら、2つのクラウディンの発現は、1α,25-ジヒドロキシビタミンDで処理することにより、Caco-2細胞において用量依存的、時間依存的に誘導され、両者がビタミンDシグナル伝達の標的であることが示された。これらの知見に基づいて、著者らは、クラウディン-2およびクラウディン-12が腸球において傍細胞性Ca2+チャネルを形成し、この陽イオンの恒常性に重要であることを示唆している(193)。ヒト角膜上皮細胞では、代謝産物である1,25(OH)2D3と25(OH)D3がオクルーディンタンパク質の発現を増加させ、バリア機能を増加させた(194)。
ビタミンDのタイトジャンクションとアドヒアレンスジャンクションの完全性における機能の他の証拠は、ヒト結腸癌細胞株で発見されている。1,25(OH)2D3による治療は、ZO1,ZO2,オクルーディン、E-カドヘリン、ビンクーリンなどのこれらの接合体からのいくつかのタンパク質の発現を増加させ、治療中の経上皮電気抵抗によって示されるように、膜透過性の低下をもたらした(195)。E-カドヘリン膜貫通タンパク質は、細胞間の接着のためだけでなく、分極した上皮細胞の表現型を維持するために重要である(196, 197)。その重要性は、腺腫から癌への移行期によく見られるE-カドヘリン発現の喪失が、かなりの上皮形態学的変化と浸潤能力の獲得を促進するという事実によって明らかにされている(198-200)。結腸癌細胞をビタミンDで治療すると、タイトおよびアドヒデンスジャンクションタンパク質の発現が増加するため、損なわれた組織形態が再構築された。
おわりに
いくつかのミネラルやビタミンには抗酸化作用、免疫調節作用、抗菌作用があり、SARS-CoV-2ウイルスに対する免疫応答に役立つ可能性がある。COVID-19に対する広く利用可能な治療法やワクチンがない場合、免疫システムを改善し、重篤な症状の発症を予防するためには、微量栄養素の補給が重要な手段として浮上している。これらの微量栄養素には、ビタミンA、B、C、D、E、およびセレン、マグネシウム、亜鉛などのミネラルがある(17,19)。
このレビューでは、亜鉛、ビタミンC、ビタミンDの免疫への役割を探っているが、それはこれらの微量栄養素が免疫をサポートするための最も強い証拠を示しているからである(17)。このシナリオでは、前述の研究は、亜鉛とビタミンCとビタミンDが免疫システムの不可欠な部分であり、生物学的バリアの完全性の維持や、自然系と適応系を構成する細胞の機能性など、宿主の防御の様々な段階で相乗的な機能を示すことを示していることを示している。したがって、これらの重要な栄養素の欠乏または不足は、タイトおよびアドヒデンスジャンクションタンパク質の相乗効果で作用し、粘膜上皮細胞の障害につながり、おそらくSARS-CoV-2のような病原体の侵入に対してそれらをより感受性にする。
全体的に、亜鉛、ビタミンC、ビタミンDの補給がウイルス性呼吸器感染症を緩和することが医学的に証明されている。したがって、COVID-19パンデミックの文脈において、このような栄養素の補充は、ウイルスとの接触および免疫反応の発症時にこれらの栄養素に対する需要の増加に対処するために有用であり、また、このウイルス感染の重度の進行および予後のリスクを低下させるために有用であり得る、広く利用可能で、安全で、低コストの対策として特徴付けられる可能性がある。
継続中の臨床試験により、COVID-19患者への効果についての詳細な情報が提供される予定である。
