Contents
Would Repurposing Minocycline Alleviate Neurologic Manifestations of COVID-19?
オンラインで2020年9月30日に公開
はじめに
重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)は、COVID-19パンデミックの病因となっている(Zhu er al 2020)。SARS-CoV-2は、無症状から、軽度(発熱、咳、嗅覚・味覚の喪失、脚の痛み、頭痛、下痢、疲労)多臓器不全まで、重症度が異なる全身感染を引き起こす(Chen N. et al, 2020)。急性肺損傷はCOVID-19の特徴であり、一部の患者は肺炎を発症し、ICU入室を必要とする重度の呼吸困難に陥る。重症患者のほとんどは、高齢で、高血圧、心血管疾患(心血管疾患)糖尿病、肥満、および/または慢性肺疾患の既往がある(Chen N. et al 2020; Sharma et al 2020b)。酸素補給にもかかわらず、呼吸困難と飽和度が90%以下であることは、致命的な転帰の主要な危険因子である(Xie er al 2020)。
アンジオテンシン1変換酵素2(ACE2)は、SARS-CoV-2が宿主細胞に侵入する際に利用する受容体である。ACE2は肺に多く発現しているが、広範囲に分布しているため、他の臓器にも感染する可能性がある。ACE2は、心肺系の恒常性維持に重要な役割を果たしているレニン・アンジオテンシン系(RAS)のメンバーである。RASは、アンジオテンシン変換酵素、アンジオテンシンII、アンジオテンシン1型受容体を含む、血管収縮、炎症、線維化を促進する軸で構成されている。この軸の作用は、ACE2,アンジオテンシン-(1-7)、MASを含むRASの血管保護軸とバランスをとっている)。) 心肺疾患に対するACE2の保護作用は20年前から模索されてきた(Sharma et al 2020b)。
SARS-CoV-2と結合した後、ACE2はエンドサイト化され、細胞表面のACE2をダウンレギュレートする。このことは、COVID-19で観察された全身のRASの不均衡と炎症性Ang IIの増加が多臓器障害を強めることを説明している(Liu er al 2020)。同様に、ACE2ノックアウトマウスは重度の急性呼吸困難を発症するが、ACE2を過剰発現させたマウスは、慢性低酸素モデルにおいて肺高血圧症(肺高血圧症)も神経炎症も発症しない。このことから、ACE2は、炎症を誘発するAng IIを有益なAng-(1-7)に変換することで、RASの保護作用と炎症誘発作用のバランスをとる上で極めて重要であることが示された。現在、COVID-19を有するICU患者を対象に、Ang-(1-7)静注と標準治療の有効性、安全性、および臨床的影響を評価する無作為化臨床試験が進行中である(NCT04332666)。COVID-19の全身症状を最小限に抑えるためにRASを標的とすることの理論的根拠については、別の場所で詳しく述べられている(Sharma er al 2020b)。
SARS-CoV-2と中枢神経系
COVID-19は中枢神経系にも影響を及ぼすことが次第に明らかになってきている(Asadi-Pooya and Simani, 2020; Chu et al 2020; Kanberg et al 2020; Li et al 2020; Mao et al 2020; Moriguchi et al 2020; Reichard et al 2020; Sellner et al 2020; Solomon et al 2020; Yashavantha Rao and Jayabaskaran, 2020)。しかし、脳におけるSARS-COV-2の直接的または間接的な影響に関する議論のある結果は、この疾患の複雑さを浮き彫りにしており、まだ識別可能な共通のパターンが明らかにされていない個人における独自の反応を示している可能性がある。In vitroの研究では、SARS-CoV-2は神経細胞に感染するだけでなく、複製も行うことが示されているが、これはSARS-CoVの感染時には見られない現象である(Chu er al)。 ACE2は、神経細胞、グリア細胞、内皮細胞、動脈平滑筋細胞など、中枢神経系全体に発現しており(Xia and Lazartigues, 2008)ウイルスが脳に感染し、細胞間および細胞内のコミュニケーションを損なうことを可能にしている。214名のCOVID-19患者を対象とした観察研究では、78名の患者に3つのカテゴリーの神経学的症状が見られたと報告されている。すなわち、めまい、頭痛、意識障害(傾眠、昏睡、昏睡)意識のある患者の錯乱やせん妄、急性脳血管障害、運動失調、痙攣などの中枢神経系の影響、味覚、嗅覚、視覚障害、神経痛、筋骨格系の損傷などの末梢神経系の影響である(Mao er al 2020)。連続して入院したCOVID-19患者64名のうち、58名が神経学的症状(脳症、興奮、混乱、皮質脊髄路徴候)を示した(Helms et al 2020a)。最近のMRIを用いた3ヶ月間の追跡調査では、COVID-19感染から回復した患者の55%が神経学的症状を呈し、記憶、嗅覚、震えなどに関連する脳領域で有意に高い灰白質面積を示したことが実証されている。(Yiping et al 2020)。これらのデータを総合すると、COVID-19の神経学的症状は、特に重症の患者において比較的頻繁に見られることを示しており、そのメカニズム、慢性的な影響、およびワクチンや特異的な治療法がないための管理について疑問が生じる。SARS-CoV-2の中枢神経系への影響については、多くのルートが支持されている。SARS-CoV-2感染の一般的な徴候は無嗅覚症であり、これは鼻上皮の感染と嗅覚神経の損傷によるものである。ウイルスはこの末梢神経からシナプスを越えて中枢神経系に感染する可能性があり(Li et al 2020)末梢から中枢神経系へのウイルス感染と損傷のルートを示唆している。ある研究では、COVID-19と神経症状が確認された7人の患者の脳脊髄液(cfs)にSARS-CoV-2が存在しないことが示されたが、別の研究では、髄膜炎・脳炎を発症した24歳の男性の脳脊髄液からRT-PCRによりSARS-CoV-2が検出された(Moriguchi er al 2020)。これは、血液から脈絡叢を経由してウイルスが侵入したことを示唆しているが、脳内の損傷した細胞から脳脊髄液に放出されたウイルスが原因である可能性もある。さらに決定的なことは、74歳の男性の死後調査で、前頭葉にウイルスが確認されたことである。ウイルス様粒子は、神経細胞体、内皮細胞の小胞、脳微小血管系全体、神経組織内に存在していた。このことから、脳への経路として血行性ルートが考えられる(Paniz-Mondrfi er al)。 COVID-19の脳への影響を示す証拠が次々と出てくる一方で、この影響の長期的な影響についてはまだ調査中である。
しかし、血漿中の神経細胞の損傷やグリアの活性化を示すバイオマーカーは、COVID-19症状の重症度と正の相関関係があり(Kanberg et al 2020)死後にも確認されている(Reichard et al 2020)。脳内でのウイルス発現にかかわらず、SARS-CoV-2感染患者18名全員の脳に急性低酸素性虚血障害が検出され(Solomon er al 2020)神経炎症を誘発し、炎症性サイトカインを増加させる別のルートを示している可能性がある。このことは、動物モデルにおける低酸素の影響、すなわち、ミクログリアの活性化、神経炎症、自律神経の不均衡、炎症性サイトカインの増加が、時間の経過とともに肺高血圧症につながることに似ている(Savale et al 2009,Oliveira et al 2018,Sharma et al 2020a)。
また、重度の感染症患者では、中枢神経系関連症状を主とする炎症反応が増加しており、炎症性サイトカインが増加した肺疾患を介して、SARS-CoV-2感染症が脳に間接的に影響を与えていることを示している(Mao er al)。 死亡した113人と回復した161人の患者を比較すると、死亡者ではインターロイキン(IL)2受容体、IL-6,IL-8,IL-10,腫瘍壊死因子(TNF)が上昇し、低酸素脳症が20%見られた(Chen T. et al 2020)。また、COVID-19と診断されてICUに入院した140名の患者を対象とした別のコホートでは、脳症に関連するIL-6の上昇と血液髄膜関門の異常伝染性が確認された。84%が神経学的検査の異常および/またはせん妄を示し、せん妄がなく神経学的検査が正常な患者と比較して、予後が著しく悪かった(Helms et al 2020b)。これは、激しい全身性の炎症反応により、血液脳関門の漏れや、神経炎症を悪化させる末梢性サイトカインの伝染性が高くなり、その結果、神経学的損傷が生じることで説明されるかもしれない(Cain er al 2019)。高血圧ラットモデルで実証されたように、骨髄由来の細胞も神経炎症に寄与する可能性がある。これらの細胞は、中枢神経系に移動し、ミクログリア様細胞に分化する(Santisteban er al)。 興味深いことに、ACE2欠損マウスの骨髄細胞は、炎症マーカーの増加を促進し、神経炎症にさらに寄与する(Thatcher er al)。
ミノサイクリン
ミノサイクリンは、抗生物質と抗炎症作用を併せ持つテトラサイクリン系抗生物質の一種である。ミノサイクリンは、40年以上にわたり安全に使用されており、様々な病態において有益な効果をもたらし、血液脳関門を通過する能力を持つことから、神経保護のための有用な薬剤として注目されている(Garrido-Mesa er al)。 ミノサイクリンの作用の正確なメカニズムはまだ解明されていないが、複数の酵素系や経路に作用することで、その多様な作用を説明できると考えられている。ミノサイクリンは、リボソームアクセプターへのアミノアシルtRNAの結合を阻害することで細菌のタンパク質合成を抑制し、nuclear factor-κB経路をダウンレギュレートする。さらに、誘導性一酸化窒素合成酵素、マトリックスメタロプロテアーゼ、ホスホリパーゼA2,プロテインチロシンニトロ化、カスパーゼなどのアポトーシス分子、p38マップキナーゼ、ポリ[ADP]リボースポリメラーゼ1などの主要な酵素に対する阻害作用が、ミノサイクリンの抗炎症作用、免疫調節作用、神経保護作用と関連していると考えられている(Garrido-Mesa er al 2013)。ミノサイクリンは親油性の高い分子で、この特性により半減期が長く、組織への浸透性に優れ、BBBを容易に通過する。最後に、ミノサイクリンは、ミクログリア、マクロファージ、リンパ球におけるHIVの活性化、増殖、複製を阻害する(Garrido-Mesa er al 2013)。
私たちは最近、肺高血圧症の駆動に重要な神経炎症と、肺高血圧症に関連する肺の病理に責任のある脳-肺-腸のコミュニケーションの障害を発見した。活性化したミクログリアの数は、肺高血圧症の重症度と正の相関があった(Oliveira et al 2018,Sharma et al 2018)。これは、ラットやマウスの低酸素症、スゲン低酸素症、モノクロタリン誘発性肺高血圧症など、さまざまな肺高血圧症モデルで生じた。さらに、ミクログリアの活性化を阻害することで神経炎症を標的とすることが、肺高血圧症の新たな治療戦略となり得ることを示した。まず、CX3CR1の発現がないこと、つまりミクログリアが活性化できない状態にすることで、低酸素で誘発される神経炎症と肺高血圧症を防ぐことができた(Oliveira er al)。 次に、ミクログリア阻害剤としても用いられる抗炎症性抗生物質のミノサイクリンは、視床下部の室傍核(PVN)におけるミクログリアの数と活性化を有意に減少させ、IL-1β、IL-6,TNF-αなどのサイトカインの発現を低下させ、モノクロタリン投与ラットの肺の炎症、心肥大、交感神経の駆動を減衰させた(Sharma er al)。 COVID-19の重症患者のかなりの数が、神経炎症が重要な要因となる糖尿病と高血圧を併発している。ミノサイクリンは、げっ歯類において、糖尿病に関連した末梢神経障害および自律神経障害、認知機能障害に有益な結果を示した(Syngle et al 2014,Ismail et al 2019,Mehta and Banerjee 2019)。少数の糖尿病、肥満、高血圧患者を対象とした当グループの研究では、ミノサイクリンを同情ベースで使用し、一貫した体重減少、HbA1cの改善、神経障害性疼痛の改善、血圧の印象的な低下が見られた(Yellowlees Douglas er al)。 現在進行中の試験(NCT02133885)のデータによると、ミノサイクリンは、治療抵抗性の高血圧患者の血圧、活性化したミクログリア、血漿中の炎症性細胞を減少させることがわかっている。これらの観察結果から、私たちは次のような仮説を提案した(図1)。ミノサイクリンは、ミクログリアの活性化を抑制し、神経炎症を停止させることで、正常な神経細胞-ミクログリア間のコミュニケーションを回復させ、特に中等度および重度のCOVID-19患者において、炎症性プロファイルを制御する。これにより、SARS-CoV-2感染による長期的な中枢神経系の影響を受けるリスクが減少する。以下の証拠が我々の仮説を裏付けている。
- ミノサイクリンは安全な抗炎症薬である。
- 抗菌作用に加えて、抗炎症作用、抗酸化作用、イオンチャネルやアポトーシスの阻害作用、ネズミの神経細胞の再生促進作用がある(Miyachi er al)。1986,Rifkin er al)。1994,Tikka er al 2001,Liu er al 2007,Nutile-McMenemy er al 2007)。これらの作用は、ミクログリアを抑制する能力に加えて、炎症性疾患や脳卒中を含む中枢神経系疾患における有益な効果に寄与していると考えられる(O’Dell, 1999; Naderi et al, 2020)
- ミノサイクリンは高い脂溶性を有し、容易にBBBを通過する、
- ミノサイクリンは、主にミクログリアの活性化を阻害することにより、代表的な神経保護テトラサイクリンである(Garrido-Mesa et al, 2018)これらはすべてCOVID-患者で高発現し、神経学的損傷の増加に関連している(Chen N. et al, 2020)
- ミノサイクリン治療は、TNF、IL-1β、IL-6などの炎症性サイトカインを効果的に減少させ(Sharma et al 2018)これらはすべてCOVID患者で高発現しており、神経障害の増加に関連している(Chen N. er al 2020)
- 抗ウイルス剤ではないが、宿主におけるウイルスの生存、浸潤、複製に必要なマトリックスメタロプロテアーゼに亜鉛化合物をキレートすることで、コロナウイルスに直接作用する可能性がある(Sodhi and Etminan, 2020);
- COVID-19患者における糞便微生物叢の変化は、SARS-CoV-2の重症度および糞便レベルと関連しており、腸内細菌叢の異常は回復後も持続した(Zuo er al)。 ミノサイクリンは、腸内細菌叢の組成を調節し、高血圧やうつ病における腸内病理を減衰させることが示されているため、これらもミノサイクリンによって減衰される可能性がある(Schmidtner et al 2019,Sharma et al 2019,Yang et al 2020);
- 肺高血圧症における肺の炎症を軽減する能力や、糖尿病、肥満、高血圧に有益な効果をもたらす可能性があることは、さらなるボーナスである。
最後に、COVID-19は、複数の臓器が関与する複雑な疾患として浮上しており、患者は多様な症状をコントロールするために複数の薬物治療を受けている。したがって、ミノサイクリンを追加する前に、潜在的な薬物相互作用を考慮する必要がある。なぜなら、この抗炎症性抗生物質は、抗ウイルス剤、他の抗生物質、および中枢神経系に作用する薬剤と有害な相互作用を引き起こす可能性があるからである。
図1 COVID-19の神経学的症状の緩和に対するミノサイクリンの作用可能部位
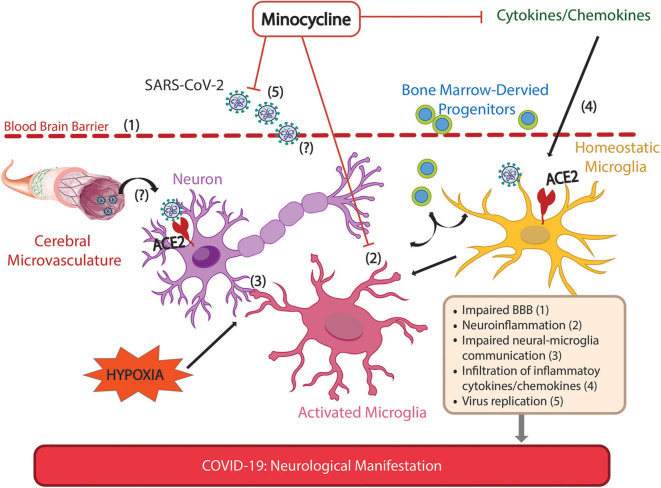
COVID-19の患者さんでは、神経学的症状が広範囲に報告されており、より重篤な症状を伴う。これらの症状は、SARS-CoV-2感染後の直接的または間接的なメカニズムによって生じる可能性がある。SARS-CoV-2の受容体であるACE2は、神経細胞、グリア細胞、内皮細胞に発現しているため、ウイルスが脳に感染して広がり、細胞間のコミュニケーションが阻害される。SARS-CoV-2ウイルスは脳実質に存在することが確認されており、血液脳関門の障害など、SARS-CoV-2の浸潤経路の可能性が示されている。SARS-CoV-2感染症の一般的な症状である嗅覚異常は、嗅覚神経の障害を反映しており、末梢神経を経由して中枢神経系にウイルスが侵入する別の可能性を示していると考えられる。中枢神経系への間接的な影響としては、COVID-19による低酸素症による神経炎症、神経細胞とミクログリアのコミュニケーションの障害、自律神経の不均衡、BBBの障害、炎症性サイトカインの増加、BM由来の前駆細胞の放出の増加などが挙げられる。これは、低酸素による脳の損傷を直接調べたネズミの実験と一致する。ミノサイクリンは、中枢神経系に容易に浸透する抗炎症性の抗生物質であり、神経炎症やウイルスの複製を抑制し、炎症性サイトカインの増加を抑制する。これらの作用により、ミノサイクリンは、低酸素による神経炎症や神経・ミクログリア間の情報伝達の障害を緩和し、神経・グリアの損傷を未然に防ぎ、COVID-19による長期的な神経学的影響を防止することができる。
考察
COVID-19が急速に増加していることから、パンデミックの初期段階では、神経学的症状が当初の予想よりも頻繁に見られ、長期的な神経系の影響は不明であることが認識されている。現在、何百もの登録臨床試験がCOVID-19患者の神経学的症状の拡大を評価しており、その中には脳機能への長期的影響を狙ったものもある(例:ClinicalTrials.ov Identifier:NCT04401449)。SARS-CoV-2感染が、認知障害や認知症などの神経疾患や神経変性疾患の発症を増加させるのか、あるいはその素因となるのかをより深く理解することが必要となるであろう。また、そのリスクが、初感染時に神経症状を呈した患者だけに適用されるのか、それともすべての感染者に適用されるのかを理解する必要がある。というのも、関連するコロナウイルスに感染したラットのうち、神経症状を呈したのはわずか11%であったが、臨床的に認められる神経症状を持たない動物の40%が、感染から8カ月後に病理学的な脳病変を起こしていたからである(Nagashima er al)。1979)。このことから、SARS-CoV-2感染による中枢神経系への影響には細心の注意が必要であり、特に初期感染時には神経症状を伴わない患者でも、長期的な中枢神経系への影響が現れる可能性がある。このような影響を最小限に抑えることができる治療法は非常に貴重である。
結論として、SARS-CoV-2の全身への影響とその炎症性プロファイルを最小限に抑えるだけでなく、長期にわたる可能性のある中枢神経系への影響を軽減するための効果的な治療法が緊急に必要であると考えている。ミノサイクリンは、神経炎症の抑制、サイトカインストームの抑制、腸内細菌叢の調整、ウイルス複製の抑制など、中枢神経系を保護する効果的なメカニズムを持っていると考えられる。この仮説が確認されれば、感染による神経系への影響を防ぎ、COVID-19の管理を改善するための重要な貢献となるであろう。
