Contents
Vitamin D, Cognition and Alzheimer’s Disease: The Therapeutic Benefit is in the D-Tails
www.ncbi.nlm.nih.gov/pmc/articles/PMC4969697/
要旨
ビタミンDは、1920年代初頭のくる病のパンデミック期に発見されて以来、カルシウム・リンの恒常性維持に及ぼす生理的効果が徹底的に研究されていた。骨格疾患への作用の理解や細胞生物学・分子生物学の進歩に伴い、ビタミンDという誤った名前のビタミンは、多くの生理過程や様々な疾患に関与する可能性があるとして注目されていた。
過去25年の間に、ビタミンDは、神経系の発達と機能の深刻な候補と神経病理学的疾患の数の治療ツールとして浮上している。最近では、実験や前臨床のデータから、ビタミンDの状態と認知機能との関連性が示唆されている。ヒトの研究では、循環中の25-ヒドロキシビタミンD(25(OH)D)の低レベルと高齢者の認知機能障害や認知症との間に強い相関関係があることが示されている。
並行して、動物実験では、ビタミンDの補給がアルツハイマー病に関連した生物学的プロセスから保護され、加齢とアルツハイマー病の様々な動物モデルで学習と記憶力を向上させることが示されている。これらの実験的観察は、ビタミンDが神経変性プロセスに対して作用しうる複数のメカニズムを支持するものである。しかし、臨床介入研究は期待外れであり、25(OH)Dレベルの上昇と認知的転帰の改善との関連付けには失敗している。
本レビューでは、動物実験とヒト実験の両方から現在入手可能なデータを収集し、ビタミンDの状態が神経認知機能に及ぼす影響を検討する将来の研究で考慮すべきことを論じている。
キーワード アルツハイマー病、臨床試験、認知機能、ビタミンD
ビタミンDのメタボリズムと作用機序
ビタミンDが初めて発見されたのは、1800年代後半の産業革命の頃で、その頃のイギリスでは、くる病の前例のない大パンデミックに直面していた。1918年、エドワード・メランビー卿は、栄養不足がくる病の原因であることを証明し、その後まもなく、若いくる病患者にタラ肝油を使用した治療に成功した。ビタミンDの活性型である1α,25-ジヒドロキシビタミンD3(1,25(OH)2D3)は、1922年にエルマー・マッコーラムによって初めて単離され、その発見がビタミンA、B、Cの発見に続いたことからビタミンDと名付けられた。歴史的、疫学的な理由から、この代謝物はビタミンと名付けられた。現在では、紫外線下で皮膚で合成され、数回の代謝を経て多くの組織に作用するまでに主要なステロイドホルモンとされている。
人間にとってビタミンDの主な供給源は紫外線(UVB)の太陽光であるが、供給量の約20%は食事から得ることができる。ビタミンDの様々な形態の中で、ビタミンD2(エルゴカルシフェロール)とビタミンD3(コレカルシフェロール)がシーンを支配している。ビタミンD2は植物や真菌によって光化学的に生成され、ビタミンD3は動物の皮膚深層部で合成される(図1)。どちらの形態も、一度摂取されると、同じように代謝される。腸から出たコリミクロンはビタミンDと結合し、血液循環に入る前にリンパ組織に運ばれる。血液循環に達すると、ビタミンDは活性化され、貯蔵されたり、標的組織に分配されたりする。ヒトおよびラットでは、未代謝ビタミンDの主な貯蔵部位は、脂肪組織および骨格筋である[4]。古典的なビタミンD内分泌系は、2つの連続した水酸化反応を特徴としており、1つ目は肝臓でCYP2R1やCYP27A1などの25-水酸化酵素によって25(OH)Dが触媒され、2つ目は腎臓でCYP27B1によって触媒され、最終的に活性型ビタミンDである1,25(OH)2Dが生成される(図1)。このように、ビタミンDの非水酸化型と水酸化型の両方が血中に存在している。他のステロイドホルモンと同様に、血中循環におけるビタミンD代謝物の輸送は、ビタミンD結合タンパク質(VDBP)またはアルブミンなどの血清タンパク質への結合に依存する。VDBPは、ビタミンDと、25(OH)D、1,25(OH)D、24,25(OH)Dなどの他の関連代謝物を高い親和性で結合する。VDBPに結合した25(OH)Dは、循環する25(OH)Dの99.9%を占め、代謝物の半減期を増加させることができる[5]。25(OH)DとVDBPとの関連は、活性型ビタミンD代謝物の内分泌腎合成に不可欠である。実際、VDBPに結合した25(OH)Dの腎近位尿細管細胞への取り込みは、内分泌受容体メガリンに関与することが示されている[6]。この大きな膜貫通型タンパク質はVDBPの細胞表面受容体として作用し、その結果、25(OH)D-VDBP複合体が内部化され、CYP27B1の作用により前駆体25(OH)Dが活性型に変換される。また、腎臓以外の多くの組織では、水酸化酵素と受容体の両方が存在しており、25(OH)Dの代謝をパラクリン/オートクリンで制御できることがわかっている。25(OH)Dがこれらの様々な標的組織に分配されるメカニズムはまだ完全には解明されていない。タンパク質に結合したビタミンD代謝物は、メガリンやキュビリンなどの内分泌受容体が存在しない限り、標的細胞へのアクセスは限られているため、一般的には、25(OH)Dまたは1,25(OH)2Dの残りの遊離画分が拡散によって標的細胞に入ると考えられている[5]。しかし、受動的な拡散に利用できる可能性のある遊離ホルモンの量と、細胞内の標的受容体を効率的に占有するために必要とされるレベルとの間には格差があるため、この「遊離ホルモン仮説」はさらなる調査が必要である。
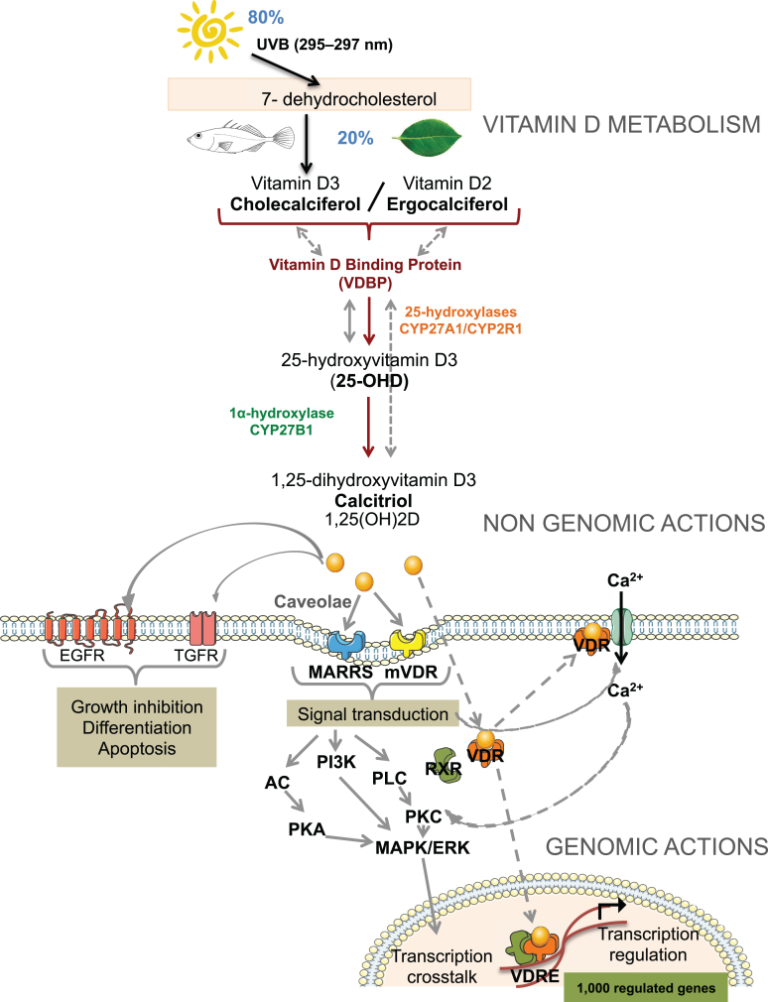
図1 ビタミンDの獲得、代謝、および作用様式
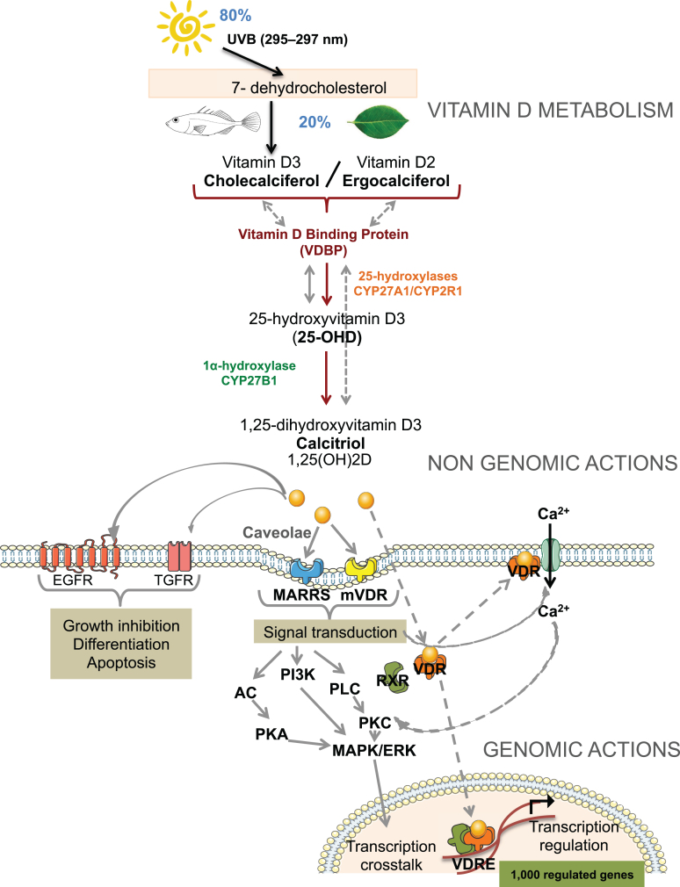
コレカルシフェロールまたはビタミンD3とエルゴカルシフェロールまたはビタミンD2は、同じ代謝経路をたどる。血中代謝物には、肝臓で産生される25(OH)Dが含まれ、これはビタミンD結合タンパク質に結合している。腎および腎外CYP27B1(1α-ヒドロキシラーゼ)は、活性代謝物である1,25(OH)2Dを産生する。25(OH)Dまたは1,25(OH)2Dは、受動的拡散またはメガリン依存性輸送を介して細胞内に入る。細胞内に入ると、1,25(OH)2Dはその核内受容体VDRと結合し、RXRと二量体化した後、ビタミンD応答エレメント(VDRE)を含む標的遺伝子と結合することができる調節複合体を形成する。また、1,25(OH)2Dは、その膜受容体MARRSや膜VDRと結合し、アデニル酸シクラーゼ、PLC、PKCタンパク質の活性を調節することで、迅速な非ゲノム応答を誘導することができる。1,25(OH)2Dはまた、細胞内貯蔵からのカルシウム放出の調節を誘導し、TGFおよびEGF受容体と相互作用して細胞周期プロセスを調節することができる。これらの異なる作用様式とビタミンDシグナル伝達によって作動するクロストークは、最終的には、考慮される細胞タイプに応じて数百もの遺伝子の転写調節につながる。
ビタミンD2とビタミンD3の同等のバイオアベイラビリティについては、いくつかの議論がある。ビタミンD2は25(OH)Dの血清濃度を上昇させたり、活性代謝物である1,25(OH)2Dを産生したりするのに効率が悪いと結論づけている著者もいれば、違いがないと結論づけている著者もいる[7-9]。世界的にビタミンDが不足していることから、食品へのビタミンDの補給や強化は重要な議論の中心となっているため、各形態の有効性を評価することが重要である。いくつかの研究では、ビタミンD2の投与は総25(OH)Dの減少、より具体的には循環25(OH)D3の減少をもたらし、活性型の1,25(OH)2Dの減少につながることが報告されている[10, 11]。これは、活性型ビタミンDを得るために必要な最初のヒドロキシル化ステップである、利用可能な25-ヒドロキシラーゼ活性のための両形態間の競合によるものである可能性があるが、異なる25-ヒドロキシラーゼの生体内試験での調節はまだ完全には理解されていない[10]。さらに、投与経路(ボーラスと毎日の投与)は、血漿中の25(OH)Dを維持する上での両方のビタミンDの形態の比較に影響を与えると思われるが、これは主に各代謝物の半減期の違い、それらの輸送体、水酸化酵素または受容体への親和性の違いに起因するものである。
従来のモデルによれば、ステロイドホルモンは核内受容体に結合し、転写の調節を介してゲノム応答を開始する。同様に、ビタミンD受容体(VDR)は、そのリガンドである1,25(OH)2Dと結合して遺伝子の転写を生理的に制御し、他のステロイドホルモン受容体と同様に、多くの組織にわたって多様な生物学的活性を制御することができる(図1)。転写研究の進歩により、ゲノム効果だけがビタミンD活性の作用機序ではないというデータが得られている[12, 13]。ビタミンDは、VDRとMARRSのような他の膜ベースの受容体の両方を介して作用することができる(図1)。これら 2 つの作用モードの生物学的結果は比較的相互に関連しており、ターゲット組織の多様性に関連付けられている作用機序の多様性は、このステロイド ホルモン複雑な pleitropicmolecule をレンダリングする。
ビタミン D ステータスとビタミン D 欠乏症の有病率
ビタミンDの栄養状態は、現在、25(OH)Dの血清濃度によって反映されている。25(OH)Dの循環レベルの調節は、主に日光への曝露と栄養摂取に依存する。「最適な」ビタミンDレベルにはいくつかの考慮事項がある。測定方法が異なる場合があるが、主に閾値の決定に関する意見の相違によるものであるため、最適なビタミンDの必要量に関するコンセンサスを得ることは、一定の議論の中で行われている。内分泌学会によると、ビタミンD欠乏症とは、25(OH)Dが20ng/mL(50nmol/L)未満であり、ビタミンD不足とは、25(OH)Dが21-29ng/mL(52.5-72.5nmol/L)であると定義されている。医学研究所(IOM)によると、血清中の25(OH)Dレベルは16 ng/mL(40 nmol/L)がカルシウムの最大吸収と骨の健康全般のための人口中央値であり、20 ng/mL(50 nmol/L)のレベルは人口の97.5%のニーズをカバーしている[14]。しかし、25(OH)D値は30ng/mL(75nmol/L)以上が適切であると考える人もいる [15, 16]。さらに、25(OH)Dの血清レベルが150ng/mL(374nmol/L)を超えると、ビタミンD中毒が観察される [15]。ビタミンDの必要量の推奨は、最適な骨の健康に基づいて設定されており、このステロイドホルモンの骨格外機能に基づいて設定されているわけではない。循環水酸化ビタミンDの測定に使用されるアッセイは、一般的に血清中に存在する2つの形態、または遊離代謝物と結合代謝物の画分を区別しない。さらに、適切なレベルを得るための推奨用量についても議論がなされている。例えば、IOMは、内分泌学会が1日50μg [16]を示唆している間に、健康な成人に15から 20μgのビタミンDの1日のサプリメント[14]を推奨している。しかし、年齢、体重、民族の違いにより、適切な25(OH)Dレベルを維持するために必要なビタミンDの補給量には個人差がある[17]。異なるグループ間でビタミンD欠乏症を評価した研究では、黒人アメリカ人の96%が25(OH)D濃度30ng/mL(75nmol/L)の閾値を用いて欠乏症に分類されることがわかった。しかし、これらの参加者は、白人参加者よりも高い骨密度と高いカルシウムレベルを有していた。VDBPの多型は、25(OH)Dの濃度が不足しているにもかかわらず、十分なバイオアベイラビリティが得られることが示唆されている[18]。したがって、最適な25(OH)Dレベルとは何か、また、そのようなレベルが存在するかどうかについては、まだ答えが出ていない。さらに、このレベルがどの程度までVDRの遺伝的多型、代謝酵素や結合タンパク質、あるいは他の環境決定因子などの異なる因子の影響を受けているのか、また、25(OH)Dの血清濃度がその骨格機能以外の領域におけるビタミンDの作用の機能的な結果を真に反映しているのかどうかについても、いまだに解明されていない。
このような定義に基づいて、世界では10億人がビタミンD欠乏症またはビタミンD不足に苦しんでいると推定されているが、この有病率はいまだに不確実で説明が難しい[15]。最近のシステマティックレビューによると、この世界的な公衆衛生問題は、地理的な場所、年齢、性別によって大きく異なり、人口のすべてのサブグループがビタミンD欠乏症のリスクにさらされているようである[19]。44カ国から168,000人以上が参加した195件のビタミンD研究の別の系統的レビューでは、参加者の37%が25(OH)Dの血清濃度が20ng/mL(50nmol/L)未満であり、30ng/mL(75nmol/L)を超えていたのはわずか11.9%であったと報告している[20]。ビタミンD不足の影響を受ける10億人のうち、特に高齢者は、施設や病院に入院している場合にリスクが高いと考えられている。例えば、ヨーロッパと米国では、緯度が40°より高い地域では、欠乏の定義にもよるが、高齢者の40%から90%が低ビタミンD症に罹患している[21]。高齢者社会におけるこの高い有病率は、いくつかの要因によって説明できる:日光への曝露量の減少と表皮内の7-デヒドロコレステロールレベルの低下によるビタミンDの真皮産生量の低下、乳製品やビタミンDの摂取量の低下、腎不全や肝不全によるビタミンD代謝の変化、薬物(免疫抑制剤、グルココルチコイド、抗てんかん薬)による異化作用の増加[22, 23]。ビタミンDの欠乏は、多くの人間の疾患、特にアルツハイマー病(アルツハイマー病癌、心血管疾患、II型糖尿病、多発性硬化症、および様々な炎症性疾患などの加齢に関連した疾患とリンクしている[24]。低ビタミンDは、したがって、最適な骨の健康のためだけでなく、最近のsystematicreview [25]によって指摘されているように、すべての原因による死亡率に関しても、損なわれるべきではない。
ビタミンDとアルツハイマー病
公衆衛生上の大きな問題は、認知症やアルツハイマー病などの非伝染性疾患の進行である。アルツハイマー病は、臨床的には進行性の認知機能の低下、組織学的には老人性プラークと神経原線維のもつれを特徴とする神経変性疾患である。老人斑の主成分は、アミロイドβタンパク質(アミロイドβ)であり、ユビキタス膜貫通タンパク質であるアミロイドβタンパク質前駆体(アミロイドβPP)の連続的なタンパク質分解によって産生される。アミロイドβの蓄積は、脳内の炎症反応の亢進を伴い、現在では神経変性や認知機能低下の直接の原因と考えられている[26, 27]。世界では2500万人以上の人が認知症に苦しんでいると推定され、年間500万人の新規患者が発生すると予測されている[28]。認知症の病因はまだ完全には解明されていない。ビタミンDとアルツハイマー病との関連を示唆した最初の論文は、1992年にさかのぼり、サザーランドらがアルツハイマー病患者の海馬におけるVDR mRNAレベルの低下を報告したときである[29]。現在、アルツハイマー病患者は対照群と比較して循環25(OH)Dの濃度が低いことが比較的よく確立されている。さらに、結果的に多くの遺伝学的研究が認知機能の低下やアルツハイマー病のリスクの増加に関連するVDRやメガリン遺伝子の多型を同定している。VDRとアルツハイマー病の間の可能性のある遺伝的関連を示唆する最初の研究は2007年にさかのぼり、著者はVDR領域の多型がアルツハイマー病のリスクを2.3倍増加させることを示している。さらに、VDR遺伝子の一塩基多型(SNP)がビタミンD-VDR経路の変化のいくつかの原因であるかもしれないと思われる[30, 31]。85歳以上の参加者563人を対象に、VDR遺伝子の5つの異なる多型についてジェノタイピングを行ったところ、遺伝子の多様性と認知機能の加齢に関連した変化との関連が明らかになった。より具体的には、BamIおよびTaqI多型のキャリアは、ApaIバリアントのキャリアとは異なり、認知機能が悪化していた [32]。255人のアルツハイマー病症例と260人の認知的にスクリーニングされた高齢の対照者におけるApaIとTaqI遺伝子多型の検査では、これらのハプロタイプのそれぞれの存在がアルツハイマー病のリスクと関連していることが明らかになった[33]。最近では、下シレジア人口集団コホートの健康な対照者77人に対して108人のアルツハイマー病患者108人でVDR多型TaqI、ApaI、FokIおよびBsmIの頻度が調査された。研究では、TaqI、Fok1またはBsmI多型の頻度については、2つのグループ間で有意差を明らかにしなかった。しかし、ApaIの対立遺伝子Aの頻度は対照群で高く、これは後にポーランドと英国の集団研究でアルツハイマー病の30%低いリスクと関連していた。著者らは、調査した集団に応じて、これらのVDR多型のリスク対立遺伝子の重要な違いに注意してほしい、民族的起源と気候条件への依存性を示唆している[34]。Wangらによる別の研究では、転写因子Cdx-2結合部位内のSNPとアルツハイマー病後期発症との間に強い関連性があることが示された(492人のアルツハイマー病症例対496人の対照者)。著者らは、CDX2のリスク対立遺伝子がVDRプロモーター活性の低下と関連していることを示している[35]。また、「TaubF」ハプロタイプ(それぞれTaqI、ApaI、Tru9I、BsmI、FokIの対立遺伝子)の頻度は、アルツハイマー病患者群では対照群に比べて有意に高く、疾患の危険因子と考えられることが明らかになった[30]。最後に、VDRおよびメガリン遺伝子における性特異的遺伝子変異は、50歳以上の米国成人のコホートにおいて、加齢に伴う認知機能低下を修飾することが示されている[36]。
脳におけるビタミンDの代謝と作用
このステロイドホルモンの内分泌作用についてはよく研究されてきたが、それだけではなく、いくつかの組織や細胞タイプが自己分泌作用や副分泌作用を示すこと、そしてその中には神経系も含まれていることがますます認識されるようになってきている[37, 38]。Stumpfら、Wionら、Eylesらの先駆的な研究は、脳内のビタミンD代謝物、関連酵素、およびそれらの受容体の存在と局在をマッピングし、ビタミンDが特定の脳領域、特に学習と記憶に関連する領域で神経ステロイドとして作用するという仮説を促した[39-41]。VDRは胚および成人の脳全体に存在するが、腸や腎臓などの他の標的臓器と比較して比較的低いレベルである[42]。Stumpfと共同研究者らは、脳内の1,25(OH)2D3の標的部位を最初に記述し、主に神経上皮と増殖領域に存在することを明らかにした[40]。VDRは、側頭葉、眼窩前頭前野、視床の帯状回、後天核、扁桃体、成人脳の嗅覚系全体にも発現している。また、げっ歯類やヒトの脳のCA1,CA2,CA3,CA4層の海馬錐体ニューロンにも発現している[39,40]。さらに、1,25(OH)2D3とその関連代謝物はヒトの脳脊髄液中に存在しており[43]、その合成と分解をコードする遺伝子が脳内で発現している[39, 44-47]。神経系内では、神経細胞[39, 47-50]、グリア細胞[39, 45, 46]、オリゴデンドロサイト[51]、脳内皮細胞[52, 53]を含む多くの細胞タイプでVDRが報告されている。
動物モデルや細胞培養系を用いた実験研究により、1,25(OH)Dを神経保護に結びつける証拠が大きく貢献している。神経系におけるビタミンDの数多くの機能には、神経栄養因子産生の調節、神経伝達物質の放出、カルシウムの恒常性、酸化ストレス機構、免疫系や炎症過程の調節などがある[38, 45, 46, 54-56]。これらの様々なプロセスは、加齢やアルツハイマー病の病態の中で変化することが知られており、ビタミンDは非常に興味深い治療または予防的介入ツールとなっている[57]。重要なことに、これらの生体内試験および試験管内試験の研究は、脳内でのビタミンDの多元的作用と、このニューロステロイドが細胞、時間、文脈に応じた方法で作用する可能性のある多様性をすでに実証している。ビタミンDが脳の発達と機能に影響を与える方法は明らかに数多くあり、最終的には認知機能の低下につながる老化過程や神経変性疾患に対してビタミンDが有益な役割を果たすことが明らかになっている。
動物の研究。ビタミンDと強化された認知能力の神経保護の役割
ビタミンDの作用を老化プロセスにリンクする明確な結果は、早期老化の徴候を提示したVDRノックアウトマウスの生成であった [58]。それ以来、動物または細胞モデルでの実験研究の増加数は、ビタミンDの代謝と作用の混乱がアルツハイマー病で変更されることが知られている経路の摂動につながることを確立するために一致し、ビタミンDの補充はげっ歯類モデルでのアルツハイマー病マーカーの数を救済すること。
老化またはアルツハイマー病様動物の認知機能低下に対する明確な作用
動物モデルのビタミンDの補充で得られたデータは、紛れもなくアルツハイマー病の病理学のいくつかのマーカーの減少と一緒にメモリと認知機能の改善を示している。興味深いことに、利用可能な実験データは、老化やアルツハイマー病様動物に配信されたときにビタミンDのより顕著な効果を指摘している。最近の研究では、ラティマーらは、高ビタミンD3食(10,000 IU / Kg /日)5〜6ヶ月持続することを示した高齢ラットの認知機能の低下を防ぐことができる。具体的には、海馬依存性の学習・記憶課題であるモリス水迷路(MWM)のパフォーマンスを有意に向上させるには、低中食(それぞれ100IU/Kg、1,000IU/Kg)に比べて高食の方が優れていることが報告されている[59]。ほぼ同時期に、BrionesとDarwishは、若齢ラットと高齢ラット(それぞれ6ヵ月と20ヵ月)に1,25(OH)2D3を21日間皮下注射し、高齢動物でのみ認知障害の減少を観察した [60, 61]。これらの研究はいずれも、高齢ラットにおける認知機能の維持にビタミンDの補給が役割を果たしていることを示唆している。アルツハイマー病に関しては、この衰弱性疾患をよりよく理解し、おそらく治療するために、重要な数の動物モデルを理解し、化合物の試験を行うことが可能になった。いくつかのグループがこれらのモデルを使用して、ビタミンDがアルツハイマー病の保護効果を持っているという仮説を検証している。Taghizadehらは、成人ADラットモデルの食事中のビタミンDの欠如は、MWMによって測定された学習と記憶障害を激化させることを実証した[62]。Yuらによる第二の研究では、12IU/gのビタミンDを摂取させた若いアミロイドβPPトランスジェニック(Tg)マウスを用い、離乳期から生後6ヶ月までの間、対照(2.4IU/g)または欠乏(0IU/g)の食事を摂取させたマウスと行動を比較した。その結果、高ビタミンD食を与えた群では、他の群と比較してMWMの成績が改善されていることがわかった。しかし、このグループは、非アルツハイマー病動物におけるビタミンD強化飼料の効果についてのデータを提示していない[63]。我々のグループは、ADマウスモデル(5x家族性ADマウス)で4ヶ月間のビタミンD3補充を行っても、認知障害が存在しない若年期(5ヶ月)では記憶機能に影響を与えないことを観察している(未発表データ)。逆に、ビタミンD3は生後8ヶ月で作業記憶障害を救済するが、この効果はTg動物でのみ観察され、老化野生型(Wt)マウスでは観察されない[64]。同様に、8週齢の動物に1,25(OH)2D3を8週間腹腔内注射すると、ADマウスモデルでは学習と記憶障害が回復するが、Wtマウスでは認知機能には影響しない[65]。我々の知る限りでは、Wt動物におけるビタミンD投与の効果を優先的に示した唯一の研究はBennettらの研究である。著者らは、Wtおよびアルツハイマー病 Tgマウスを用いてビタミンD2を濃縮したボタン茸食に基づく研究を行った。補給7ヶ月後に行動分析を行い、認知機能の微妙な変化を明らかにした。ビタミンD2はTgよりもWtマウスでより確実に認知機能を改善した[66]。他の研究との主な違いは、D3ではなくビタミンD2を使用していることである。動物研究は、したがって、ビタミンDの作用が年齢に依存している可能性が高いという仮説を支持し、アルツハイマー病に似た文脈で認知障害を回復する上でビタミンDの補充の明確な効果を示している。ビタミン D が アルツハイマー病 病理に影響を与えることができるメカニズムはまだ完全に解明されていないが、病理学の発達の間にプレイ中のいくつかのプロセスがビタミン D シグナル システムによってターゲットにされていることが示されている。このステロイドホルモンの作用機序を考えると、アミロイド生成に対する直接的な作用から、神経伝達の回復、炎症の調節、アポトーシス、酸化ストレス、血管系の調節まで、その生物学的機能は多岐にわたると考えられる(図2)。いくつかの研究は、アルツハイマー病様脳におけるビタミンDの作用機序の理解に重要な貢献をしている。
図2 アルツハイマー病におけるビタミンD介在型マルチターゲット効果のメカニズムの提案
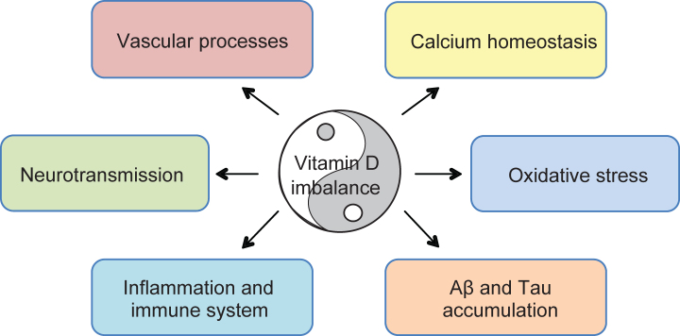
ビタミンDの不均衡は、加齢やアルツハイマー病の発症に関与するメカニズムを変化させることが提案されている。ビタミンDの補給による保護効果は、血管プロセスや酸化ストレスの調節、カルシウムのホメオスタシス、神経伝達、免疫・炎症プロセスの調節、アミロイド生成への直接的な影響、最終的には認知機能の改善などが示唆されている。
ビタミンDとアミロイド生成
ビタミンDの補充が認知機能の改善につながるという観察に加えて、アルツハイマー病に類似した文脈でのすべての研究はまた、ビタミンDの治療が、試験したモデル、投与量、選択した分子、および治療の時間にかかわらず、アミロイド負荷を減少させることを示しており、ビタミンD機能とアミロイド生成との間のリンクを示唆している[60-66]。Yuらの研究で報告された行動変化は、治療したマウスの脳内のアストロサイト反応性、NGFレベルの上昇、およびTNF-αの減少とともに、アミロイドβ負荷の減少を伴っていた。興味深いことに、著者らは、ビタミンDレジメンに応じてアミロイドβPPの最終生成物に変化があり、アミロイドβPPの処理に変化があることを示している[63]。Grimmと共同研究者は最近、マウスと細胞培養物におけるアミロイドβPP処理への比較的低い低ビタミンDの影響を研究した。このデータは、β-セクレターゼのレベルと活性の増加によって引き起こされるアミロイドβの増加を明らかにし、それと同時にネプリリシンレベルの低下が見られた[67]。我々のチームは最近、ビタミンD3を豊富に含む食事を5ヶ月間摂取すると、雌の5x家族性ADマウスの前頭皮質、大脳新皮質、海馬のアミロイド斑の数が減少することを実証した。この減少は、前頭皮質のアストロサイト反応性の低下とミクログリアの活性化の増加を伴う。また、これらの脳領域のトランスクリプトームプロファイリングは、ビタミンD3の補充は、WtとTg動物の両方でアルツハイマー病に関連する遺伝子の多数の発現を調節することが明らかになった[64]。ビタミンDとアミロイド経路との間の直接的な相互作用を示す他の手がかりは、いくつかの研究から生じる。例えば、VDRの過剰発現またはビタミンDの治療は、神経芽腫細胞におけるアミロイドβPPの転写を抑制することが示された[35]。また、アルツハイマー病患者の脳脊髄液中で増加するVDBPは、アルツハイマー病患者と動物モデルの両方の脳内でアミロイドβと直接相互作用することが示された。VDBPとアミロイドβとの結合は、アミロイドペプチドの凝集の減少および試験管内試験での細胞死と関連していた。全体的に、VDBPの存在は、アミロイドβによって誘導されるシナプス損失および記憶障害から動物モデルを救う[68]。あるチームは、ビタミンDとアミロイドβシグナル伝達経路の間に操作されるクロストークに関する広範な研究を提供した。海馬および皮質ニューロンのアミロイドβ治療がVDR抑制を誘導することを実証した後、彼らは試験管内試験でVDRサイレンシングがアミロイドβ治療と同様の効果をもたらすことを示した。彼らの研究はさらに、ビタミンDによる皮質ニューロンの処理は、上記のアミロイドβによって誘導された細胞毒性効果を逆転させるとともに、iNOSのアップレギュレーションを抑制することを示している[48, 49, 69, 70]。さらに、ビタミンDとメマンチンの組み合わせによる皮質軸索変性に対する効果を試験管内試験で検討した。これら2つの化合物は相乗的に作用し、皮質神経細胞培養においてグルタミン酸またはアミロイドβ誘導毒性から保護することが示された[71]。これらの知見は、アルツハイマー病の病理学的特徴の一つであるアミロイド生成の抑制におけるビタミンDシグナル伝達の役割を強く支持している。さらに、アミロイドβ病理とVDRシグナル伝達の間に考えられるクロストークは、認知機能の低下を制限する可能性のあるアミロイドβ誘発毒性に対する神経保護メカニズムを提供しているように思われる。これは、アルツハイマー病の認知機能障害を防止または停止する際のビタミンDの特定の作用を基盤としているが、他のどのようなメカニズムは、 “健康な “老化脳で遊んでいるのですか?
シナプス伝達とカルシウムの恒常性
脳の老化は、細胞レベルでは、神経細胞の死、神経細胞の興奮性の低下、シナプス伝達の障害、カルシウムの恒常性の変化によって部分的に特徴づけられている。アミロイドの処理と沈着を調節し、最終的には神経伝達を調節するとともに、ビタミンDは老化した脳のカルシウムチャネルと神経伝達物質の放出にも作用することが示されている。ビタミンD治療後の電気生理学的記録を分析すると、高齢ラットのCA1海馬ニューロンにおけるL型カルシウムチャネル(L-VGCC)電流と密度の変調が明らかになった[72]が、正常ラットのCA1ニューロンにおける長期増強(LTP)には変化が見られなかった[59, 73]。しかし、加齢ラットでは神経細胞の興奮性が有意に増加し[59]、ADラットモデルのCA3-CA1経路のシナプス増強が記載されている[74]。海馬ニューロンにおけるビタミンD-VDR経路の破壊またはカルシウムチャネルの活性化は、いくつかの研究で報告されている。vitroでのVDRサイレンシングは、L型電圧感受性カルシウムチャネル(LVSCC)とNGFのアップレギュレーションにつながるが、培養ニューロンのビタミンD治療はLVSCCの発現を減少させ、老化神経系の神経保護を付与する一方で、一般的に老化ニューロンで観察されるプロセスである[47-49, 69, 72, 75]。逆に、マウスにおける1,25(OH)2D3の欠失は、8週齢マウスの歯状回におけるLVGCCのアップレギュレーションを誘導し、その結果、細胞増殖および神経新生の増加をもたらす[76]。治療の時期によっては、ビタミンDがカルシウムチャネルの発現を適時に細かく調節することで、神経保護と神経新生の両方を調節する可能性があるように思われる。Latimerらの研究はさらに、ビタミンD3治療が加齢ラットにおけるシナプス小胞輸送と神経伝達物質放出に関与する遺伝子やタンパク質の発現を直接変調することを明らかにしている[59]。ビタミンD3の補充の5ヶ月後にアルツハイマー病の雌マウスで行われたトランスクリプトーム研究によって確認された結果[64]。興味深いことに、発生時のビタミンD欠乏の影響に関する以前の研究では、すでに成人の脳が後でカルシウムの調節、シナプス可塑性と神経伝達に関与する遺伝子やタンパク質の数の変化した発現を表示したことを実証していた[77,78]。このことは、早期のビタミンD欠乏が神経伝達などの神経系プロセスに影響を及ぼし、加齢やアルツハイマー病様の病理に関与しているという仮説をより強固なものにしている。
酸化ストレス、脳のエネルギー代謝、血管系プロセスの制御
アミロイドβクリアランスのもう一つの可能性のあるメカニズムは、血液脳関門(BBB)を通過することによって作動する。この物理的で比較的不浸透性のバリアは、主に内皮細胞、アストロサイト、ペリサイトで構成されている。2011年、伊藤らはマウスに1,25(OH)Dを腹腔内注射した24時間後に、放射性ヒトアミロイドβの排泄量が1.3倍に増加し、脳内アミロイドβの総量が減少することを実証した。この脳から血液への流出には、脳の毛細血管内でのアミロイドβペプチドの内部化が関与している可能性がある[53]。この仮説は、1,25(OH)D3とインキュベートした後、脳の毛細血管と内皮細胞におけるP-糖タンパク質の発現と輸送活性が増加し、これらの細胞内でのヒトアミロイドβの蓄積が減少したことを報告したDurkらの研究によってさらに確認されている[52]。これらのビタミンD関連の活性化は、BBBを構成する細胞に存在する核内受容体VDRの活性化を介して起こると考えられる[52, 53, 79, 80]。さらに、1,25(OH)Dの脳周皮細胞への作用はトランスクリプトームレベルでの抗炎症反応を誘発し、アルツハイマー病に見られるような慢性的な炎症の制約下での脳毛細血管内でのビタミンDの直接的な保護的役割を付加している可能性が高い。これらの結果に沿って、培養された混合ニューロン-グリア細胞や新皮質や海馬などの脳全体の領域のトランスクリプトーム応答は、正常な状態で、またはADマウスにおける1,25(OH)Dに対する、潜在的にアルツハイマー病に特に重点を置いて神経変性疾患の進行を制限することができる遺伝子の制御異常を明らかにする[64, 79]。ビタミンDはまた、一酸化窒素(NO)の合成に必要な酵素である誘導性一酸化窒素合成酵素(iNOS)の産生を阻害することができる。老化またはアルツハイマー病などの神経変性疾患の間、損傷を受けたニューロン、ミクログリアおよびアストロサイトによって産生される反応性窒素および酸素種は、iNOSの発現を増加させることができる。その結果、より高いレベルのNOは、ミトコンドリアおよび神経細胞の呼吸を阻害することにより細胞死を引き起こし、さらに神経細胞の興奮毒性につながる可能性がある[81-83]。低ビタミンD食は、iNOSの転写を介して酸化ストレスを増強することが示されている。より具体的には、ビタミンDの低レベル摂取により、16~17ヶ月齢のラットの脳では、脳タンパク質のチロシンの硝酸化、グルコース代謝の変化、ミトコンドリアの変化が増加することが示されている[84]。逆に、高齢ラットに1,25(OH)2D3を注射すると、脳のエネルギー代謝が増加し、海馬組織の活性酸素のレベルが調節される[61]。大脳皮質ニューロンへのビタミンD投与は、アミロイドβによって誘導される細胞毒性効果を逆転させ、iNOSのアップレギュレーションを防止する [49, 69, 70]。活性化したミクログリアでは、1,25(OH)2D3は用量依存的にNOの産生を抑制し、炎症性メディエーターであるTNF-αとインターロイキン-6(IL-6)の産生を抑制することから、脳におけるビタミンDの直接的な抗炎症的役割が示唆されている[85]。ビタミンDの脳内での局所的な活性型1,25(OH)2D3への変換は、中枢神経系の炎症に対する直接的な神経保護反応である可能性があり、その後、NF-κB関連のiNOS誘導を阻害すると考えられる [86]。
炎症過程の変調
アルツハイマー病のような神経変性疾患のもう一つの非常に重要な要素は、慢性的な炎症過程の確立である。ビタミンDは、現在、効果的な免疫調節因子として知られており、そのようなものとして、アルツハイマー病病理学における炎症状態を調節する可能性を持っている。ビタミンDは
- i)いくつかのニューロトロフィンの発現をアップレギュレートし
- ii)抗炎症性サイトカインIL-4の分泌を増加させ
- iii)プロ炎症性サイトカインTNF-αおよびインターロイキン-1β(IL-1β)の分泌を減少させ
- iv)樹状細胞の分化を阻害することができる[44-46, 87]。
VDRは、ヒトおよびげっ歯類のミクログリア、免疫モニタリングおよび貪食を担当する脳マクロファージで観察されている[88]。ビタミンD3の5ヶ月間の補給は、炎症や免疫遺伝子の発現プロファイルに大きく影響を与え、ADマウスモデルにおける機能的転帰の改善につながっている[64]。1,25(OH)Dを21日間投与すると、高齢ラット(20ヶ月)の炎症状態とアミロイド負荷の変化が誘導されたが、若年ラット(6ヶ月)では有意な効果はなかった。より具体的には、若年ラットに比べて高齢ラットで観察されたプロ炎症性サイトカインIl-1βの増加と抗炎症性サイトカインIl-10の減少は、ビタミンDの皮下注射後に逆転している[89]。Lee at al.は、ビタミンDを注射した12ヶ月齢のマウスは、網膜マクロファージの形態と数に変化が見られ、これは貪食活性の増加を示していることを示した。この過程は、慢性炎症マーカーである補体成分C3の減少を伴っていた。全体的に、これはこれらのマウスの網膜におけるアミロイドβ負荷の減少をもたらし、視覚機能を改善した[90]。アルツハイマー病では、マクロファージによるアミロイドβの貪食が欠損しており、その結果、アミロイドβクリアランスが減少し、アミロイドβの沈着と脳内炎症が増加している。Mizwickiらは、ビタミンD3は、おそらくTLRs、IL-1,IL1R1,およびケモカインの変調された転写を介して炎症状態をリバランスすることによって、アルツハイマー病患者から培養ヒトマクロファージにおけるアミロイドβ貪食の回復を促進することが可能であることを実証した[89,91]。
老化中またはアルツハイマー病に類似した状況下でのビタミンDの神経保護活性に関する上記のメカニズムに加えて(図2一定の数の仮説を検証する必要がある。これらは、アルツハイマー病で変化し、脳や他の場所で1,25(OH)Dの標的となることが知られている共通の経路に基づいている。これらは、miRNA、TLRs、血管新生、糖化、および酸化ストレスへの作用を含み、これらのすべてのプロセスは、老化した脳で、特にアルツハイマー病で変更されている[92]。この誤った名前のビタミンは、組織、時間、個人、用量、病理学的なコンテキスト固有の多元作用を持つ強力なニューロステロイドであることが明らかになったので、老化脳におけるビタミンDの作用機序を解明するための道は長いものである。ビタミンDは核内受容体と膜内受容体の両方と相互作用する能力を持っているため、ビタミンD補給の下流への影響は多様であり、様々なシグナル伝達経路間のクロストークがその研究を複雑なものにしている。したがって、神経系におけるこのステロイドホルモンの完全な可能性を発見し始めたばかりなので、臨床観察で矛盾する結果が出ても不思議ではない。
人間の研究。ビタミンDの状態と認知アウトカムの間の論争的なリンク
血清中ビタミンD濃度の低さとヒトの認知転帰との関連性は、横断的および縦断的な研究によって検討されてきたが、現在までのところ、介入的な研究はほとんど行われていない。ほとんどの研究では、主に高齢者集団を対象に血中ビタミンDの状態を評価しているが、食事摂取量をビタミンD濃度の指標としているものはごくわずかである。これらの研究で観察されたアウトカムは、認知能力、認知症の発症率、またはアルツハイマー病のいずれかである。これらの様々な研究から得られた主な知見を表1に報告する。全体的に観察研究では、ビタミンDの状態と認知アウトカムとの関連性が強調されているが、これは加齢や性別などの多くの要因に依存しているようである。Etgenらによるメタアナリシスでは、ビタミンD欠乏症の患者では認知機能障害のリスクが2倍以上になることが示唆されている[122]。25件の横断的研究と6件の前向き研究を含む別のシステマティックレビューでは、72%の研究において、25(OH)Dの低下はさまざまな認知機能検査において有意に悪い転帰と関連していたり、認知症の発生率の増加と関連していたことが示された[123]。Balionらによるメタ分析では、アルツハイマー病患者はビタミンDの血中濃度が対照群よりも6.2 nmol/L低いことがわかった[124]。この差は、別のメタアナリシス[125]で「臨床的に関連性がある」ことが判明した。さらに、このような関連性は、アルツハイマー病の重度のステージ[126]だけでなく、日常生活活動における機能的自律性に影響を与えない孤立した軽度の神経認知障害に対応する前駆段階(軽度の認知障害、MCIとしても知られている)[101]からのものである。興味深いことに、低ビタミンDは、アルツハイマー病の最初の客観的な兆候よりもはるかに前に発生し、将来の認知機能低下や認知症を予測する兆候である主観的な認知愁訴と関連していることも報告されている[127]。これらの後者の知見は、低ビタミンDは最初のアルツハイマー病症状の発症に伴うものであり、したがって認知症の発症に寄与する可能性があることを強調している。しかし、今日までの介入研究では、ビタミンD補給後の認知機能の改善を示すことはできなかった。ここでは、ビタミンDがヒトの認知機能にどのような特異性で関連しているかを議論する。
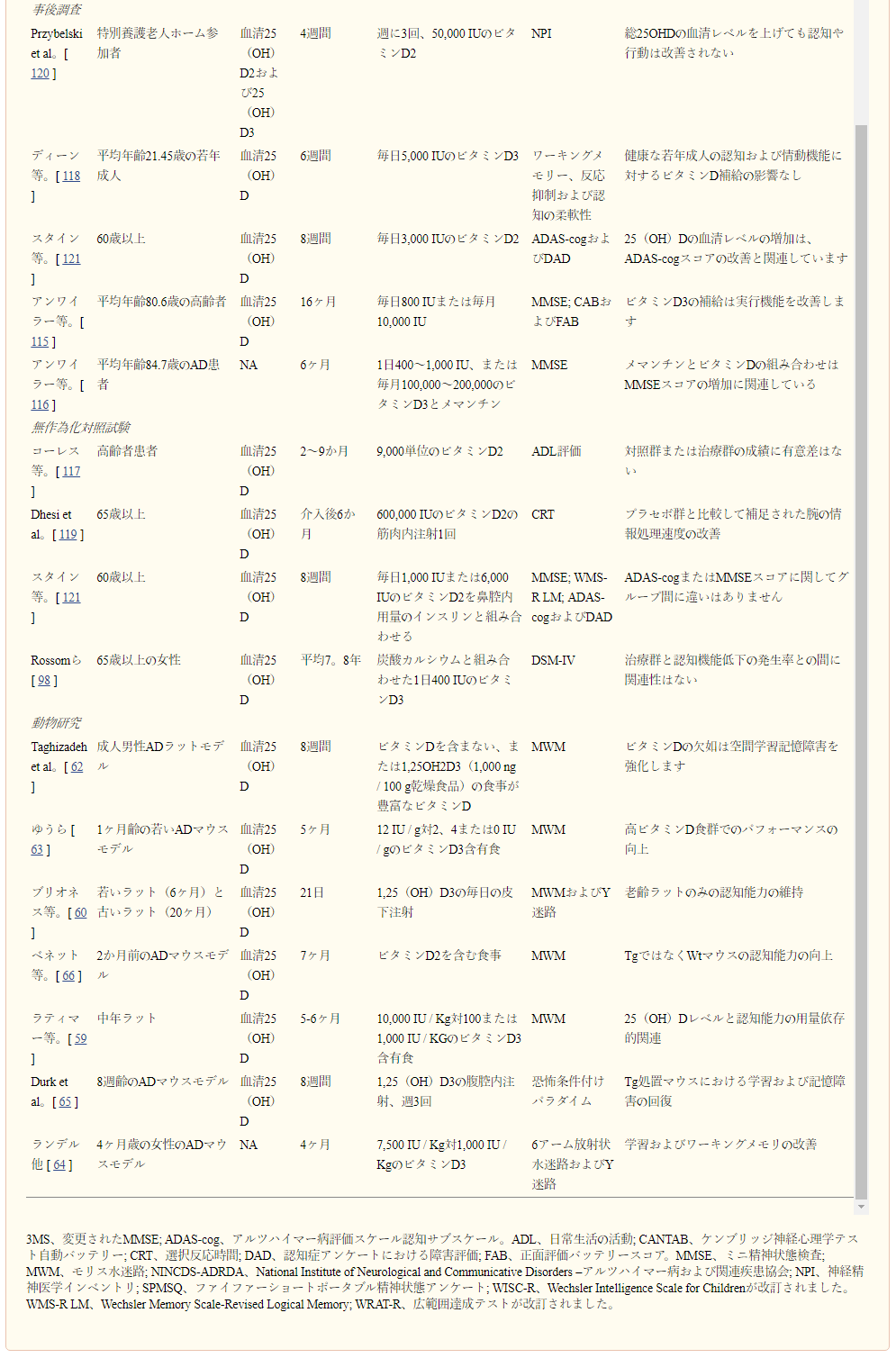
表1 ビタミンDと認知アウトカムとの関連性を検討するヒトおよび動物実験

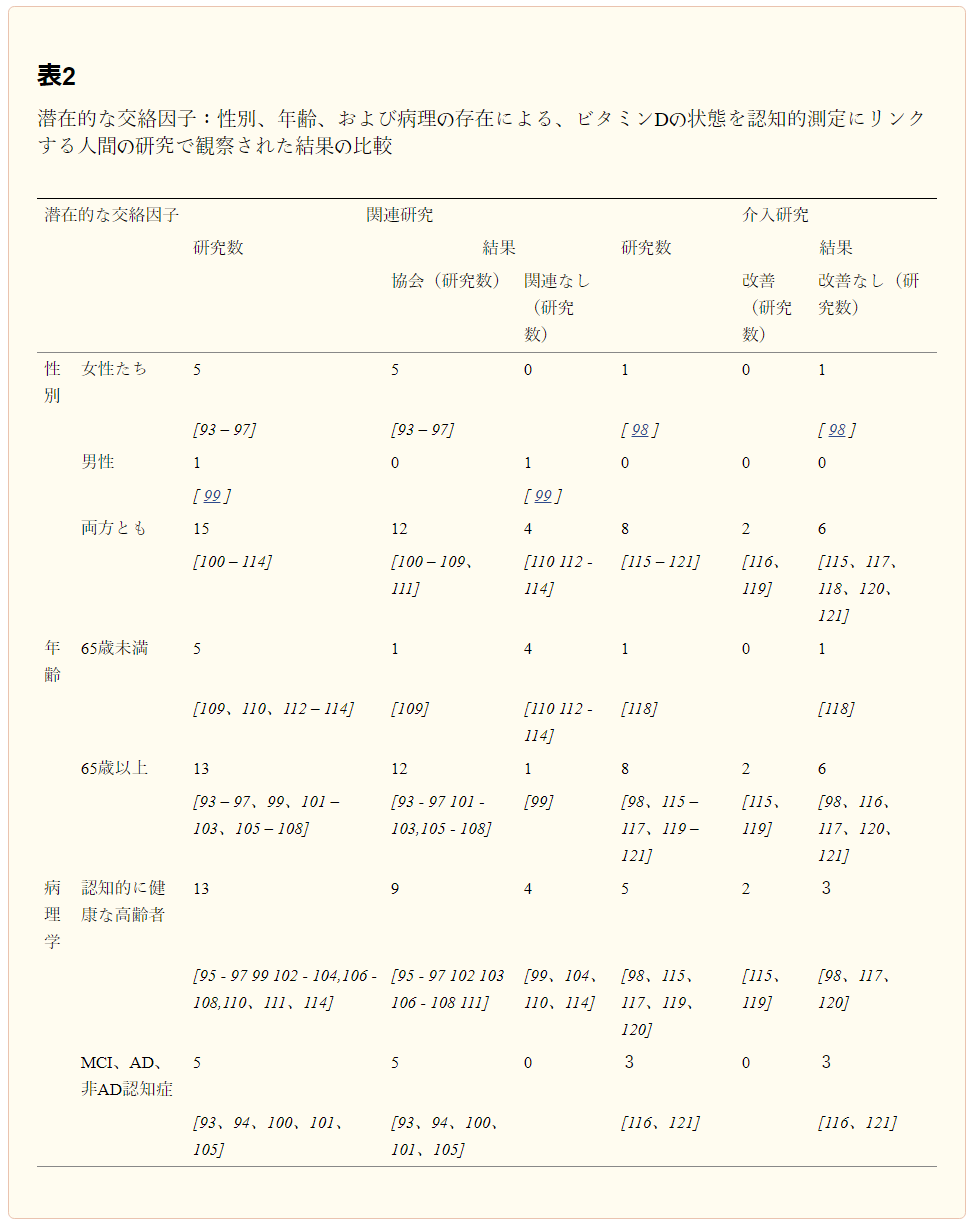
潜在的なジェンダー効果
興味深いことに、女性、男性、または混合集団で実施された研究では、対照的な結果が示されている。女性コホートを対象としたすべての研究では、低ビタミンD症と認知機能障害との間に明確な関連性が報告されているが、男性を対象としたユニークな研究では関連性は報告されておらず、男性と女性の両方の集団からの報告には賛否両論がある(表2)。ある研究では、Annweilerらは、平均年齢80.5歳の女性の大規模コホートにおけるビタミンDの食事摂取量の低さ(週35μ未満、または400IU/年と定義)が、Pfeiffer Short Portable Mental State Questionnaire(SPMSQ)[96]によって測定されたグローバルな認知能力と有意に関連していることを明らかにした。2つ目の横断的研究では、75歳以上の高齢女性ではビタミンD欠乏症(10ng/mL未満(25nmol/L未満)と定義)がSPMSQスコアの低下と関連していることが明らかにされた[95]。逆に、55~87歳の健康な高齢のヨーロッパ人を対象とした研究では、最適と考えられる血清25(OH)D濃度が32.1ng/mL以上(80nmol/L以上)であることが、特に女性の空間的作業記憶のテストにおけるエラーの有意な減少と関連していることが実証された [111]。6,257人の高齢女性を対象とした4年間の縦断的研究では、ベースライン時の25(OH)D血中濃度の低下は、高齢女性におけるMini-Mental State Examination(MMSE)テストで測定されるグローバル認知機能低下の発生率の増加と関連していたと報告されている[97]。重要なことに、これは男性のみを対象に実施された同様の研究では観察されなかった [99]。ベースラインの血清25(OH)D欠乏と認知症やアルツハイマー病の発症との関連性は、75歳以上の女性の2つのコホートでも観察されている[93, 94]。しかし、このトピックに関する最大規模の臨床試験であるWomen’s Health InitiativeのカルシウムとビタミンD試験の事後分析では、65歳以上の女性4,000人以上が含まれており、炭酸カルシウム100mgとビタミンD3 400IUを7.8年間補充しても、認知症、MCI、またはその他の認知機能測定には効果がないことが明らかにされた [98]。重要なことは、この臨床試験中のビタミンDの補充はカルシウムの補充と関連していたことである。カルシウム濃度が高いとヒトや動物の認知機能低下のリスクが高まることが知られているため、結果の解釈がより困難になる[128, 129]。したがって、二重補充は逆効果である可能性がある [130]。男性のみを対象とした介入試験は実施されておらず、混合集団を対象としたポスト前または無作為化対照試験が8件実施されている(表2)。その中で、認知機能の改善は、全体的な認知パフォーマンスについては8週間の補充後[121]、執行機能については4週間[120]~16ヶ月の補充後[115]に認められた。しかし、これらの研究は、患者の小さなコホートで行われたパイロット非ランダム化プリポスト研究であった。この制限にもかかわらず、後者の知見は、6ヶ月後にプラセボ群と比較してサプリメント群の情報処理速度の改善を報告した1つのプラセボ対照無作為化臨床試験の結果と一致していた[119]。それにもかかわらず、メタアナリシスでは、ビタミンD補給を受けている患者では認知が有利に進化しているにもかかわらず(”before and after “アプローチ追跡調査終了時の認知スコアのグループ間比較(”compalative “アプローチ)では、比較群と比較して補給群の方が認知スコアが優れていることは示されていないと結論づけられている[131]。このように、25(OH)Dの血清レベルまたはビタミンDの栄養摂取量に反映されるビタミンDの状態と女性の認知機能との間には明確な関連性があるように思われるが、これらの研究では男女の比較ができず、一般的な集団を代表するものではないかもしれない。さらに、いくつかの研究では、混合集団でこのような関連性が示されているが、他の研究では関連性がないと報告されており(表2他の可能性のある交絡因子を考慮することを余儀なくされている。
表2 ビタミンDの状態と認知指標を関連付けるヒト研究における観察結果の比較:交絡因子の可能性:性別、年齢、病理の有無に応じて
可能な年齢のしきい値
ビタミンDと認知機能低下に関する最新の研究は、The Tromso studyから得られた年齢の異なる個人を対象に行われた。この報告では、65歳以上の個人における血清25(OH)Dと認知機能との間に正の関連があることが強調されている[103]。この研究から得られた興味深い結果は、25(OH)Dのレベルが高齢者の認知転帰を予測するように見えるということである。記憶力と認知能力のテストは、7-13年の間に異なる時点で実施されたが、最新の時点のみがベースラインのビタミンDレベルと有意な相関を示した [103]。そこで我々は、年齢を明確に区別できる研究、すなわち厳密には65歳未満と65歳以上の個人を対象とした研究を比較することにした。表2に報告されているように、この基準により、65歳未満の個人を対象とした6件の研究と、65歳以上の個人のみを対象とした14件の研究を区別することができた。その結果は、65歳未満を対象とした1件を除くすべての研究で25(OH)Dの血清レベルと認知能力との関連性が報告されておらず、逆に高齢者を対象としたほぼすべての研究でビタミンDの状態と認知転帰との関連性が報告されていることから、非常に顕著である(表2)。青年(12-16.9歳)を対象とした横断的研究では、NHANES IIIコホートのデータに基づいて、25(OH)D血清レベルと知能尺度および広域達成度テストの成績との関連は認められなかった [110, 113]。若年成人(20-59歳)を対象に実施された同様の報告では、25(OH)D濃度と認知機能の測定値との間に有意な関連性はないことが再び示された [110, 113]。別の研究では、人生の初期段階における認知機能とビタミンDの関連性を調べた。平均年齢9.8歳における25(OH)D2および25(OH)D3の血清レベルと、13-14歳および15-16歳における学業成績との間には相関関係はないことが示された。この研究には3,171人のコホートが含まれている [112]。我々の知る限りでは、年齢が高くない非認知者における認知能力と血清25(OH)Dレベルとの関連を記述した唯一の研究は、2014年にMaddockらによってライフスパンアプローチで実施されたものである[109]。この研究では、出生から50歳までのいくつかの時点で幼少期の認知能力、教育到達度、ビタミンD関連行動に関する情報が収集された英国のコホートから、6,496人の中年期の個人が含まれていた。45歳で血清ビタミンD濃度を測定し、50歳で言語記憶、言語流暢性、処理速度を測定した。その結果、45歳時の25(OH)D濃度と50歳時の即時単語想起力との間には非線形なU字型の関連が認められた。この結果は、25(OH)D濃度が低い人と高い人の両方で認知タスクのパフォーマンスが低下していたことを示したが [109] 、この結果は、低ビタミンD症の経験のある人への最近の補充が原因である可能性が高い。この対照試験では、ビタミンDの補給はワーキングメモリやうつ病などの認知的および情動的な尺度には効果がないと結論づけられたが、ビタミンD補給群と比較群の両方でワーキングメモリのパフォーマンスの経時的な向上が観察された [118]。補給期間が短く、ベースライン時の血清25(OH)D濃度が比較的高かったことから、ビタミンDの脳内必要量を超えていた可能性があり、ビタミンD補給の認知的効果を覆い隠していた可能性がある。しかし、若年者におけるビタミンDの状態と認知的転帰に関する無効な所見は、25(OH)Dと認知能力との関連性を考慮した時間枠が重要であることを示しており、縦断的研究による追跡期間を長くすれば、若年期の低ビタミンD症と高齢者の認知機能低下との関連性を解読するのに役立つ可能性がある。高齢者集団におけるビタミンDの状態と認知転帰との関連を調査した研究のうち、2つの大規模な集団ベースの報告では、25(OH)Dレベルと認知パフォーマンスとの間に関連はないことが示されている[110, 114]。興味深いことに、これはLlewellynらの研究と大きく対照的であり、上記の研究と同じNHANES IIIコホートを対象とした分析を行っている。2つの大きな違いは、i) Llewellynらは厳密には65歳以上の個人に焦点を当てていたのに対し、McGrathらとTolppannenらは60歳から90歳までのより大きな年齢層を対象としていたこと、そしてii)パフォーマンスの評価に考慮された認知的尺度が異なっていたことである。低ビタミンDの脳機能および認知への影響は、人生の後半になるまで現れないようである。最も重要なことは、ビタミンDの状態が健康な人の認知尺度に影響を与えるのではなく、むしろ加齢に伴う認知機能の低下の発症と関連している可能性があるということである。最後に、分析に用いた認知検査の種類が結果に影響を与える可能性がある。
アルツハイマー病対非病理学的老化
Balionらによる37の研究のレビューにより、著者らはMMSEスコアと25(OH)Dのレベルを比較することができた。彼らは、平均MMSEスコアが高いほど25(OH)D濃度が50nmol/L以上と関連しており、最終的にはビタミンDレベルの低下がアルツハイマー病のリスクを増加させることを見出した [124]。別のメタアナリシスでは、アルツハイマー病のない個人は、マッチした対照群よりも高いビタミンDレベルを有する確率が40%増加していると結論づけている[125]。ビタミンDの低下と認知機能の低下を関連付ける研究が増えているにもかかわらず、低ビタミンDとアルツハイマー病の発生率に特化したデータは乏しい。しかし、すべての研究でビタミンDの状態と認知症との関連が観察されている一方で、非病理学的老化の場合のビタミンD欠乏を調査した研究では、より議論の余地がある(表2)。2つの7年間の追跡調査、1つ目は平均年齢78.4歳の女性40人[93]と75歳以上の女性498人[94]を対象とした7年間の追跡調査で、ビタミンDのレベルとアルツハイマー病のリスクとの関連を研究することを目的としている。最初の報告では、比較的小規模で制限されたコホートで行われ、ベースラインの血清25(OH)D欠乏はアルツハイマー病以外の認知症の発症と関連しているが、アルツハイマー病とは関連していないことが示された[93]。しかし、ビタミンDの食事摂取量に基づいて、より大規模な集団を含む2つ目の研究では、ベースラインでのビタミンDの食事摂取量はアルツハイマー病の発症とは逆に関連しているが、非アルツハイマー病の認知症とは関連していないことが明らかになった [94]。これらの明らかに矛盾する結果は、両研究のコホート規模の違いや、ビタミンDの状態を評価するために用いられた指標の違いに起因する可能性がある。2番目の観察に沿って、最近の2つの縦断的研究では、血清25(OH)Dの低レベルとアルツハイマー病のリスクとの間の関連が提唱されている [100, 105]。1つの研究では平均年齢73.6歳の男女1,658人を5-6年間追跡した[105]が、2つ目の研究では10,168人を30年間追跡した[100]が、どちらも25(OH)Dレベルの低下に伴うアルツハイマー病リスクの増加を報告している。後者の研究は、考慮された期間が長く、コホートの規模が大きいことから、若い年齢でのビタミンD欠乏は、後に認知機能低下、認知症、またはアルツハイマー病のリスクの増加と関連しているという仮説に確固たる根拠を与えている。
我々の知る限りでは、アルツハイマー病患者におけるビタミンD補給の効果を調査したプロスペクティブ研究は3件のみである。Steinらによる最初の研究では、第1相試験として、13人の高齢者を対象に1日3,000IUのビタミンD2を8週間投与した。グループは、25(OH)D の血清レベルの増加がアルツハイマー病評価スケール (ADAS-cog) スコアの有意な改善を伴うことを発見した。しかし、Steinらの研究の第二段階では、8週間にわたりビタミンD2の生理的投与量(1,000IU/日)または超生理的投与量(6,000IU/日)のいずれかを受けた無作為化対照試験で構成され、ADAS-cogスコアまたはMMSEの点で群間の差は認められなかった[121]。しかし、この研究の参加者数が非常に少ないこと、治療期間が短いこと、そしておそらくビタミンD2の使用があったことから、一般的な結論を導き出すのは難しい。2つ目のプレポスト研究では、NMDA受容体モジュレーターであるメマンチンとビタミンDの組み合わせが、アルツハイマー病患者の認知力向上のための効果的な治療法として提案された。このパイロット研究では、ビタミンDまたはメマンチン単独投与と比較してMMSEスコアの増加によって測定された6ヵ月間の両治療法の併用の有効性が実証された[116]。他の臨床試験では、ビタミンDの補給と認知機能の低下を一次的または副次的なアウトカムとして評価したものが、高齢の患者(VITAL-cog、DO HEALTH)や健忘症(D-cog)アルツハイマー病(AD-IDEA)パーキンソン病、II型糖尿病(THINK-D)などの病態を持つ患者を対象に実施されている。詳細はclinicaltrials.govというサイトに掲載されている。
幹部機能にプラスの効果があり、エピソード記憶ではない
上述したように、ビタミンD不足が高齢者の認知機能障害と全体的に関連しているという頑健なエビデンスがある[122]。しかし、ビタミンD不足の場合にどの領域特異的な認知機能が障害され、血清25(OH)D濃度と複合認知スコアとの関連を説明するのかは十分に解明されていない。例えば、先に述べたように、NHANES III調査のコホートに基づくMcGrathetら、Tolppanenら、Llewellynらによる矛盾した研究は、分析に組み込まれた異なる認知指標の代表的なものであるかもしれない。Llewellynらの研究では、著者らは25(OH)Dと複合スコア、すなわち記憶、学習、志向性、注意力の両方を評価する認知能力のグローバルな尺度として計算された認知機能障害との関連を発見した[106]。一方、McGrathらとTolppanenらによる初期の観察では、著者らは「記憶と学習のスコア」のみを用いており、決定的な結果は得られていない[110, 114]。この仮定に沿ったメタ解析では、ビタミンD不足とエピソード記憶との関連性は、臨床的に関連性のない中途半端な結果のために不確かなままであることが示されている[131]。対照的に、このメタアナリシスでは、血清25(OH)D濃度の低下が執行機能障害を予測するという説得力のある証拠が示された [131]。この仮説は、在宅医療サービスを受けている65歳以上の高齢者を調査したBuellらの調査結果によって裏付けられている。著者らは、認知能力、特に実行機能は記憶力ではなく、50~75nmol/Lの循環ビタミンDと関連していることを発見した[102]。Annweilerらによる介入研究でも、高齢者に16ヵ月間ビタミンD3を補給することで執行機能が改善されたことが示されている[115]。幹部機能とは、他の能力や行動を制御したり調節したりする高次のプロセスの不均一なセットを指す [132]。この異質性を克服するために、最近の研究では、ビタミンD不足の場合にどのような執行機能の下位機能が障害されているかを調べることを目的としており、ビタミンD不足の地域居住高齢者では、メンタルシフティングは低下するが、認知抑制も情報更新も低下しないことが明らかになった [133]。メンタルシフティングとは、変化する目標や環境刺激に対応して思考や注意を調整し、適切に行動する能力である[132]。このことは、認知機能の低下や認知症の経過におけるビタミンDの関与をよりよく理解するのに役立つかもしれない。しかし、ビタミンD不足によって影響を受ける認知機能の領域特異性について確固たる結論を出すためには、普遍的な認知指標を用いたさらなる研究が、ビタミンDレベルが認知転帰とどのように関連しているかという微妙な特異性の解明に役立つであろう。
今後の研究への考察
医薬品を臨床試験に導入する際には、ヒト試験に移行する前に前臨床レベルで十分な検討を行うのが通常の流れである。しかし、健康や疾患におけるビタミンDの臨床研究や前臨床研究の数の多さが指摘するように、現在では臨床観察が動物実験よりも速いペースで蓄積されており、脳におけるビタミンDの作用の基本的な神経生物学の理解をやや阻害しているように思われる。したがって、今後の研究では、動物モデルと細胞モデルの両方で、老化とアルツハイマー病病理におけるこのステロイドホルモンの作用モードをよりよく理解するために、いくつかの要因を考慮する必要があるかもしれない。
これまでのところ、非常に少数の動物研究は、より良いヒトで何が起こるかを模倣するためにビタミンD欠乏のモデルに集中している。特に人生の初期段階でのビタミンD欠乏が強く老化の間に脳機能に影響を与えることが示唆されているので[77,78,134]、開発または洗練されたビタミンD欠乏の既存のモデルを異なる時点で、様々な期間、おそらく様々な年齢でビタミンDの補充に続いて、そのような欠乏の影響を明らかにし、いつ認知機能とアルツハイマー病に関連して介入するのに役立つかもしれない。さらに、私たちの知る限りでは、ビタミン D2 とビタミン D3 の認知機能障害のコンテキストでの効果を比較した動物研究はないし、ビタミン D 治療への応答の可能性のある性別の違いを評価していない。アルツハイマー病のような神経変性疾患の複雑な病態のために、ビタミンD欠乏のような単一のイベントが病気の発生に責任があるとは考えにくい。しかし、低ビタミンDは、この文脈では本当の悪化要因を表す可能性があり、この欠乏は容易に修正することができる。最後に、現在進行中の努力と動物または細胞モデルの使用は、間違いなく、この強力な神経ステロイドが老化またはアルツハイマー病様脳に作用するメカニズムに光を当てるのに役立つ。
しかし、ヒトの病理学的および機能的特徴は動物では類似しているように見えるが、数十年ではなく数ヶ月の寿命を持つマウスで、アルツハイマー病のような複雑な疾患の様々な原因、陰湿な発症、および潜在的に長期的な進行をモデル化することは困難である。その結果、動物実験の結果をヒト研究に翻訳することに関連するいくつかの問題は、ヒト研究を通してのみ対処することができる。より個別化された介入医療への移行の必要性を念頭に置きつつ、今後の臨床試験で評価すべき重要なポイントをいくつか挙げておく。
遺伝的背景
動物モデルとヒトの間の1つの大きな違いは、実験室での作業を提供している制御された遺伝と環境である。VDRの多型がアルツハイマー病の潜在的な危険因子として報告されているように、ビタミンD代謝に個人差が存在する可能性を損なうことはない[30, 32, 33]。VDRは、代謝に関与するいくつかの酵素が機能的ビタミンDの結果を駆動する鍵となるため、適切なビタミンDの作用に必要な唯一の代謝産物ではない。これらの酵素の多型または単に活性の低下が特定の個体に存在する場合、ビタミンD治療は効果的ではないかもしれない。さらに、ビタミンD代謝物がどのようにして神経系に入るのか、それが受動的な拡散によるものなのか、あるいはメガリンのようなエネルギー依存性のトランスポーターの利用によるものなのかについては、まだ不明な点が多い。最近の報告では、米国市民の比較的大規模なコホートにおいて、VDRとメガリン受容体の両方における性別特異的な遺伝子変異が、加齢に伴う認知機能の低下と関連していることが示唆されている[36]。このように、ビタミンD代謝物の輸送、代謝、作用に個人差がある場合には、古典的な無作為化対照試験ではなく、おそらくベイズモデルに基づいた適応型臨床試験を実施する際に考慮する必要がある。
性別による影響の可能性の評価
個人間の違い、特に性別間の不一致も考慮に入れるべきである。メガリンのSNPの関連性における性差は、メガリンとエストロゲンおよびビタミンDの両方との相互作用、およびこの共有された内分泌受容体への両方のステロイドホルモンの競合的結合に関連している可能性がある。私たちの研究チームは最近、アルツハイマー病のマウスモデルにおいて、ビタミンD3の投与がオスマウスとメスマウスで、補充の時間枠に応じて行動レベルで異なる影響を与えることを観察した(未発表データ)。さらに、ビタミン D はエストロゲン受容体である Esr1 と相互作用して、アルツハイマー病 の発症に関連する分子経路を制御する可能性が高いことを示している [64]。多くの研究は、閉経時に起こるエストロゲンレベルの低下とアルツハイマー病の発症との間の強い関連性を示唆している[135-137]。動物実験はこの問題を明らかにするのに役立つであろう;しかしながら、将来の臨床試験では、性別を特定した方法で結果を層別化することを検討するかもしれない。
ビタミンDの状態と神経系関連機能に対する応答性の評価
25(OH)D 血清レベルが、特に神経系機能に関連して、ビタミン D 代謝物を利用する個人の能力を適切に反映しているかどうかは、非常に重要である。例えば、肝臓病やネフローゼ症候群などの状態では、VDBPやアルブミンレベルが低下し、これらの代謝物の遊離濃度には必ずしも影響を与えずに総25(OH)Dおよび1,25(OH)Dレベルの低下をもたらす [138]。例として、25(OH)Dレベルの民族差が報告されている。アフリカ系アメリカ人はVDBPレベルが低く、したがって総25(OH)Dレベルが低いが、ビタミンD欠乏の証拠はなく、潜在的に25(OH)Dまたは1,25(OH)Dの遊離画分の安定したレベルの作用によるものである[18]。遊離画分が神経系に入るものであるならば、総25(OH)D血清レベルは脳に入るビタミンD代謝物のレベルを反映していないかもしれない。さらに、メガリンは脈絡叢のBBBに存在することが示されており、ビタミンDやVDBPに結合した25(OH)Dの神経系組織への内細胞的取り込みに役割を果たしている可能性を示唆している。脳内にCYP27B1が存在することで、活性型ビタミンD化合物の代謝のためのオートクリン/パラクリン系を形成し、この組織内で1,25(OH)2D3の局所合成が可能となる。このようなシステムでは、代謝物は血清中の25(OH)Dレベルに影響を与えることなく、局所的に生成、作用、分解される。脳機能との関連でビタミンDに対する個人の反応やニーズをより正確に評価するためには、循環25(OH)Dの測定を補完する別のアプローチが必要となるかもしれない。その一つのアプローチとして、神経系におけるビタミンDの状態を反映するものとして、血清レベルではなく、ビタミンD代謝物の脳脊髄液レベルを考慮することが考えられる。25(OH)D、24,25(OH)Dおよび1,25(OH)Dは、血清中よりも低濃度ではあるが、ヒトの脳脊髄液中に存在することが示されており[43]、アルツハイマー病患者では減少している[139]。ビタミンD代謝物の血清または脳脊髄液レベルを測定する補完的なアプローチとして、標的遺伝子に対するビタミンDのゲノム効果を測定して、個人のビタミンDの状態とサプリメントへの反応能力をプロファイリングすることが考えられる [140]。
ベースラインレベルに応じた適切な補充
ヒトにおける 25(OH)D の最適なレベルに到達するためのコ レカルシフェロールサプリメントの使用に関する推奨事項については議論がなされていないため、神経疾患の文脈では、動物からヒトへの投与量の変換の可能性が検討されるかもしれない。実際、動物実験では、特定の用量のビタミンDを投与することにより、老化やアルツハイマー病の動物モデルで認知機能が改善することが示されている。治療的介入のための種間等価物の導出は通常、体表面積のスケーリングを用いて行われてきたが、これは動物からヒトへの用量変換のための高度なアロメトリックおよび生理学的に基づく薬物動態モデリングほど適切ではないかもしれないと思われる[141]。これは、脳機能に関連して必要とされる「薬理学的に活性な用量」を評価することが非常に必要であるため、ビタミンD補給の場合に特に関連している。
1日800IUの摂取量は、70歳以上の高齢者に対するIOMの現在の推奨量であり、この量は、97.5%の人が25(OH)Dの閾値20ng/mLを生成するか、それ以上の量になるという推定に基づいている[14]。高齢者の老人ホーム入所者を対象とした無作為化二重盲検試験では、ビタミンD3の800IU/日投与を16週間行ったところ、25(OH)Dレベルは33 ng/mLであった。800 IU/日と2,000 IU/日のサプリメントの間には、800 IU/日のレジメンでは20 ng/mLに達しなかった1人の参加者を除いて、ほとんど差がなかったが、一部の人はより高い用量を必要とすることが示された。2,000IU/日では、50ng/ml以上に達した者はいなかった。800IU、2,000IU、4,000IU/日の投与では、ベースラインの25(OH)Dの増加率は、ベースラインが最も低い人ほど一貫して高かった[142]。
補完群と比較群で認知的差を示さなかったほとんどの試験では、実際にはベースライン時の血清25(OH)D濃度が比較的高い参加者が含まれており、おそらくビタミンDに対する脳の必要量(もしあれば)を上回っていることは注目に値する。さらに、いくつかの試験の比較群では、研究の一環として、あるいは日常的なケアの一環として、ビタミンDサプリメントの投与を継続して受けていた[121]。したがって、将来的には、ベースラインでビタミンD不足を示している集団におけるビタミンD補充の認知効果を検討することが重要である。ビタミンD不足の定義は、いわゆる「集団基準値」(すなわち、正常値とは人口の95%を含む基準範囲)ではなく、「健康基準値」(すなわち、正常値とは健康への悪影響を防止する25(OH)D濃度範囲)に基づいていることが合意されている[143]。認知に基づく基準値」の定義はまだ議論の余地がある。
また、送達される分子の性質も考慮する必要がある。ビタミンD2代謝物のVDBPへの結合親和性の違いは、ビタミンD3よりも弱いため、半減期が短くなり、循環からのクリアランス率が高くなると考えられる。VDBPへの25(OH)D2結合の非効率性が明らかになったことは、25(OH)Dの腎外代謝の場合、VDBPへの結合が低下することで標的細胞による25(OH)D2の取り込みが増加する可能性があるため、有利に働く可能性がある。動物モデルを用いた将来の研究は、認知転帰に関する各代謝物の相対的な有効性を評価するのに役立つであろう。並行して、ヒトを対象とした研究では、血清および 脳脊髄液 における 25(OH)D2 と 25(OH)D3 の別々の測定値と、いずれかの代謝物を補給した後の各分子の総 濃度と遊離濃度の測定値を組み入れるべきである。
また、ビタミンDの不足がアルツハイマー病の引き金となるのか(すなわち、アルツハイマー病につながる脳の病理学的機能障害をもたらすのかあるいはアルツハイマー病に対する中枢神経系の保護を取り除くのかを判断することも重要になる。ビタミンDが神経保護剤であればビタミンD不足を是正するためのサプリメントだけで十分であるが、ビタミンDが中枢神経をコントロールし、精神能力を高めることを目的としている場合には、高用量から非常に多量のサプリメントを使用する必要がある。また、ビタミンD不足がアルツハイマー病の病理過程を部分的に説明しているのであれば、標準的な抗認知症治療の有効性を高めたり、これらの治療に対する抵抗性を説明したりする可能性もある。これに関連して、6ヶ月間の対照試験では、メマンチン+ビタミンDの併用は、メマンチン単独やビタミンD単独よりもアルツハイマー病患者の認知機能低下の予防に優れていることが示されている[116]。予備的な結果ではあるが、この結果は、抗認知症治療を開始する前にビタミンDを補充するか、あるいは少なくともビタミンDをこれらの治療の補助薬として使用することを臨床医に促すものであることは確かである。
結論
紫外線刺激下で皮膚から生成されたり、食品から摂取されたりするビタミンDは、現在では人間の健康に欠かせないステロイドホルモンと言われている。さらに最近では、このホルモンが神経ステロイドであり、加齢や加齢に伴う認知機能の低下に重要な役割を果たしている可能性があることが、エビデンスの蓄積によって示されている。より正確には、多くの前臨床研究や臨床研究から、低ビタミンDが原因物質ではなく、アルツハイマー病や認知症の発症リスクの増加と関連している可能性が示唆されている。ゲノムおよび非ゲノム効果を誘導し、ビタミンDは、カルシウムのホメオスタシス、神経伝達、血管化、アミロイドβおよびタウの蓄積、酸化ストレス、炎症、すべてがアルツハイマー病で障害されている上で役割を果たしている。しかし、ビタミンDの多元作用は、細胞、組織、時間、個人、用量、病理学的文脈、そして、おそらく、性別に依存している。その結果、個別化医療の観点から、将来のランダム化試験は、コホートに含まれるすべての個人の D の尾を考慮する必要がある。