Contents
Vitamin C, Aging and Alzheimer’s Disease
www.ncbi.nlm.nih.gov/pmc/articles/PMC5537785/
要旨
加速された老化のマウスモデルの蓄積の証拠は早熟な老化のアスコルビン酸の救助の役割を示する。アスコルビン酸のサプリメントは、細胞の成長、酸化ストレス、テロメアの萎縮、クロマチンの乱れ、炎症性因子の過剰な分泌を停止し、寿命を延ばすように見えた。
興味深いことに、アスコルビン酸(アスコルビン酸)はまた、積極的に炎症老化と免疫老化、生物学的老化の2つの特徴を変調することがわかった。また、アスコルビン酸は、エピジェネティックに健康的な老化にターゲットを絞った栄養の重要な役割を示す、ゲノムの整合性と安定性を調節することが示されている。
ヒトの証拠は、等分な結果をもたらしたが、生体内の証拠の成長は、アルツハイマー病の発病にリンクされている要因を改善する上でのアスコルビン酸の役割をサポートしている。
アスコルビン酸の神経保護的な役割は一般的なフリーラジカルのトラップだけでなく、プロ炎症性遺伝子の抑制、神経炎症の緩和、鉄、銅および亜鉛のキレート、およびアミロイドβペプチド(アミロイドβ)細動発生の抑制に依存しない。
最も重要な生活習慣因子の一つである食事とアルツハイマー病のリスクとの関連を示す疫学的証拠が急速に増加している。したがって、ヒトゲノムをエピジェネティックに修飾する方法としての食事介入は、アルツハイマー病の予防に役割を果たす可能性がある。本レビューでは、老化とアルツハイマー病の過程でアスコルビン酸の補給/バイオアベイラビリティに関連する主な生物学的メカニズムの最新の概要を提供することを目的としている。さらに、新たな研究分野と今後の方向性についても言及する。
キーワード:アスコルビン酸、老化過程、アルツハイマー病
1. アスコルビン酸と老化との関連性
先進国や発展途上国では高齢化が進み、寿命が延びていることから [1]、老化を制御するメカニズムの解明や、成功した老化と病的な老化を区別するメカニズムの解明に関心が高まっている。生涯を通じて抗原に長期間曝露されることで、個人の恒常性が徐々に変化していく [2]。
老化のフリーラジカル理論は、老化プロセスの根底にある分子メカニズムを少なくとも部分的に説明し、動脈硬化、心血管疾患、認知症、糖尿病、骨粗鬆症などの加齢に伴う疾患の発症を説明することを可能にしている[3,4]。生物学的な観点からは、老化の過程は免疫新生によって特徴づけられる:これは、外部の抗原に反応し、自己抗原を許容する能力が低下し、感染症、癌、自己免疫疾患への感受性の増加につながると定義されるかもしれない[5]。免疫産生の最も認められている分子メカニズムには、レドックス媒介およびミトコンドリア依存性の酸化経路が含まれている。高レベルのフリーラジカルとマロンジアルデヒド(MDA)などの脂質膜の過酸化生成物は、腫瘍タンパク質p53,転写タンパク質AP-1,活性化B細胞の核内因子κ-軽鎖-エンハンサー(NF-kB)など、細胞の老化と長寿に関連する核内転写因子の活性化を調節することができる。さらに、これらの同じメカニズムは、T細胞発現の変化および免疫学的サブ集団の表現型の変化にも関与している[6]。
酸化ストレスは老化の主要なエピジェネティック因子であると考えられるようになってきており、2つのプロセスが厳密に絡み合っているため、低悪性度炎症の誘発にも重要な役割を果たしていると考えられている。「炎症老化」と定義されるこのプロ炎症性表現型は、炎症と免疫応答に関連する遺伝子の発現の増加によって特徴づけられる。実際、C反応性タンパク質(CRP)およびインターロイキン-6(IL-6)および腫瘍壊死因子α(TNF-α)などのプロ炎症性サイトカインの血清レベルの上昇は、ミトコンドリアにおけるNF-KB媒介のスーパーオキシド産生の活性化を誘導し、酸素反応性種(ROS)の放出を促進することが知られている[2,6]。
炎症老化はまた、内皮層における一酸化窒素(NO)のバイオアベイラビリティーの低下と関連しており、内皮機能障害を誘発する。炎症老化は、老化過程およびヒトにおける虚弱性の病態生理学的過程の両方の生物学的背景と考えられている可能性がある[7]。
内因性抗酸化酵素防御系スーパーオキシドジスムターゼ(SOD)カタラーゼおよびグルタチオンペルオキシダーゼ(GSH)は、食事からの酸化性外因性物質を打ち消し、老化プロセスに関連して実質的な減少を受ける可能性がある[8]。蓄積された証拠は、栄養が炎症老化の重要な関連因子であり、同様に老化プロセスの重要なモジュレーターであることを示している[9,10,11]。
アスコルビン酸(アスコルビン酸)は、免疫系、炎症老化、内皮の完全性、およびリポ蛋白質代謝におけるレドックス酸化経路およびミトコンドリア経路に対するいくつかの有益な効果を媒介する強力な第一選択の抗酸化物質である[12,13]。アスコルビン酸は6つの炭素原子を持つラクトンであり、哺乳類の多くの種の肝臓でグルコースから合成される。ヒトは、2-ケト-l-グルノラクトン、その直接の前駆体の合成に不可欠なグルノラクトンオキシダーゼ酵素を進化的に失っている。その結果、人々は食事からアスコルビン酸を排他的に吸収する。アスコルビン酸は、ナトリウム依存性ビタミンCトランスポーターSVCT1とSVCT2を介して細胞に入るが、このプロセスは電気化学的ナトリウム勾配によって好まれる。
アスコルビン酸の生理学的および生化学的作用のすべては、(還元剤としての)電子供与能力によるものである。アスコルビン酸は2つの連続した可逆的な酸化を受ける:最初の電子の損失から、それは中間生成物、第2電子の損失後にデヒドロアスコルビン酸(DHA)に変換されるアスコルビン酸フリーラジカル(AFR)を生成する。生理的な濃度では、アスコルビン酸は強力な抗酸化剤であり、血漿や中枢神経系(中枢神経系)[15,16]を含むさまざまな組織のフリーラジカルの捕捉剤である。
アスコルビン酸はまた、NOのバイオアベイラビリティに関連する内皮の完全性にも関与している[17]。内皮機能不全を誘発する分子機構は、Gi-依存性シグナル伝達の障害、eNOSのmRNAの安定性の低下、および細胞質膜からゴルジ膜へのeNOSトランスロケーションの阻害によって、酵素NO合成酵素(eNOS)に影響を与える。また、基質(l-アルギニン)やそのコファクター(テトラヒドロビオプテリン BH4)のバイオアベイラビリティーの低下も観察された[18]。BH4の低レベルは、l-アルギニンの代わりに酸素分子への電子の移動を促進することで、eNOSの機能を低下させる。
2. アスコルビン酸、エピジェネティックモジュレーションとニュートリゲノミクス
過去数十年の間に、アスコルビン酸の特性の理解は、単純な抗酸化物質からエピジェネティックな調節が可能な微量栄養素に至るまで、大きな変革を遂げてきた[20,21]。
エピジェネティクスにおける最近の進歩は、DNAとヒストンのエピジェネティックな修飾を触媒する一連のジオキシゲナーゼFe2+と2オキソグルタル酸(2OG依存性)酵素を同定した。これらの酵素のいくつかは、それらの触媒活性を維持するためにアスコルビン酸を必要とする。そのため、アスコルビン酸の利用可能性はエピゲノムに影響を与え、健康や加齢に伴う疾患に影響を与える可能性がある。シトシン(5-メチルシトシン、5mC)のC5位のメチル化は、哺乳類DNAの最も重要なエピジェネティック・マークであり、転写やゲノムの安定性維持に重要な役割を果たしている。
DNAメチルトランスフェラーゼ(DNMTs)は、ユニバーサルメチル供与体であるS-アデノシル-L-メチオニン(SAM)から、DNA中のシトシン残基の5位へのメチル基の移動を担っている。哺乳類DNA中の5-ヒドロキシメチルシトシン(5hmC)という珍しいヌクレオチドの存在が報告されている。5hmCは全ヌクレオチドの1%未満であるが、小脳プルキンエ細胞や顆粒ニューロンで高レベルの存在が観察されており、エピジェネティックな制御におけるニューロン機能の潜在的な役割が示唆されている。このヌクレオチド(5hmC)は、テン-イレブン転座メチルシトシンジオキシゲナーゼ(TET:TET1,TET2,TET3)という酵素群の活性によって形成され、テン-イレブン転座を触媒し、5mCを酸化して5hmCを生成する。TET酵素は、5hmCをさらに酸化して5-ホルミルシトシン(5fC)および5-カルボキシルシトシン(5caC)にすることが示された。アスコルビン酸は、おそらくTET酵素の触媒部位を再活性化し、Fe3+をFe2+に還元することによって、TET依存的な方法で5hmCの産生を増加させることが知られている。すなわち、アスコルビン酸は5-メチルシトシン(5mC)を5-ヒドロキシメチルシトシン(5hmC)に有意な脱メチル化を誘導した[22,23]。
アスコルビン酸のバイオアベイラビリティーの変動は、DNAおよびヒストンの脱メチル化に影響を与える可能性がある:加えて、アスコルビン酸欠乏は、老化の異なる段階で現れることができ、異なる年齢関連疾患の発症に関与する可能性がある。特に、追加のアスコルビン酸がサプリメントや改善された取り込みによって提供されない場合は、神経変性と関連している可能性がある脳内の進行性のアスコルビン酸の減少があるであろう。これまでのところ、ヒトの脳におけるエピジェネティックな変化については一貫性のないデータがある。今後の研究により、加齢に伴うアスコルビン酸の減少がエピゲノムや神経変性に及ぼす潜在的な影響が解明される可能性がある。
これまでのところ、アスコルビン酸は老化過程や、動脈硬化、心血管疾患、癌、神経変性疾患などの老化関連疾患の予防に有益な効果があると考えられている。
ニュートリゲノミクスは若い研究分野であるが、意義のある研究により、遺伝子発現におけるアスコルビン酸の役割が示唆されている。先行研究では、食事と遺伝子の相互作用は観察されなかったが、SVCT1の遺伝子変異が血清アスコルビン酸濃度に影響を与えうることが明らかになった。さらに、両方のアスコルビン酸トランスポーター遺伝子型は、食事性アスコルビン酸と血清レベルの間の相関の強さを修飾する[24]。
最近、ハプトグロビンの遺伝的変異、アスコルビン酸のトランスポーターの多型、およびグルタチオン-S-トランスフェラーゼの欠失した多型は、可能性のある相対的なアスコルビン酸レベルに関する遺伝情報を提供している[25,26,27]。
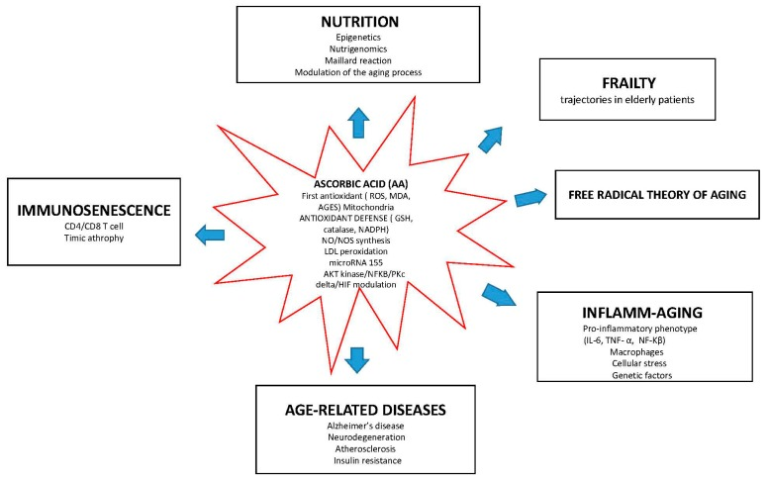
興味深いことに、図1に示すように、アスコルビン酸は老化に関連するさまざまな分子経路の界面で機能している。
図1
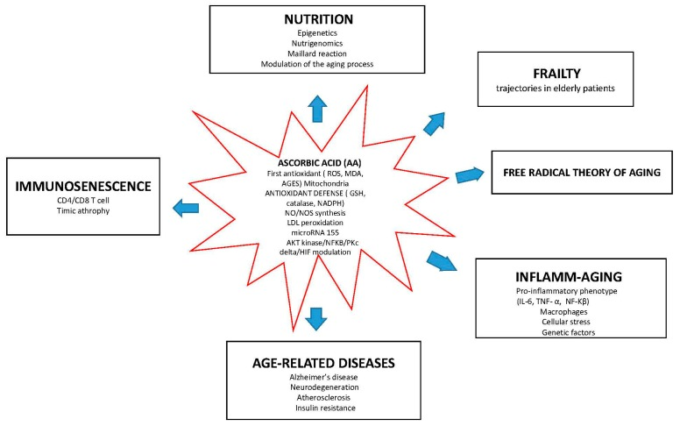
アスコルビン酸は生物学的老化の分岐点にあり、免疫老化、炎症老化、酸化ストレス(老化のフリーラジカル理論)を遮断し、加齢に伴う疾患の発症や虚弱性の軌跡に潜在的な役割を持っている。
3. アスコルビン酸と老化過程。体外モデル
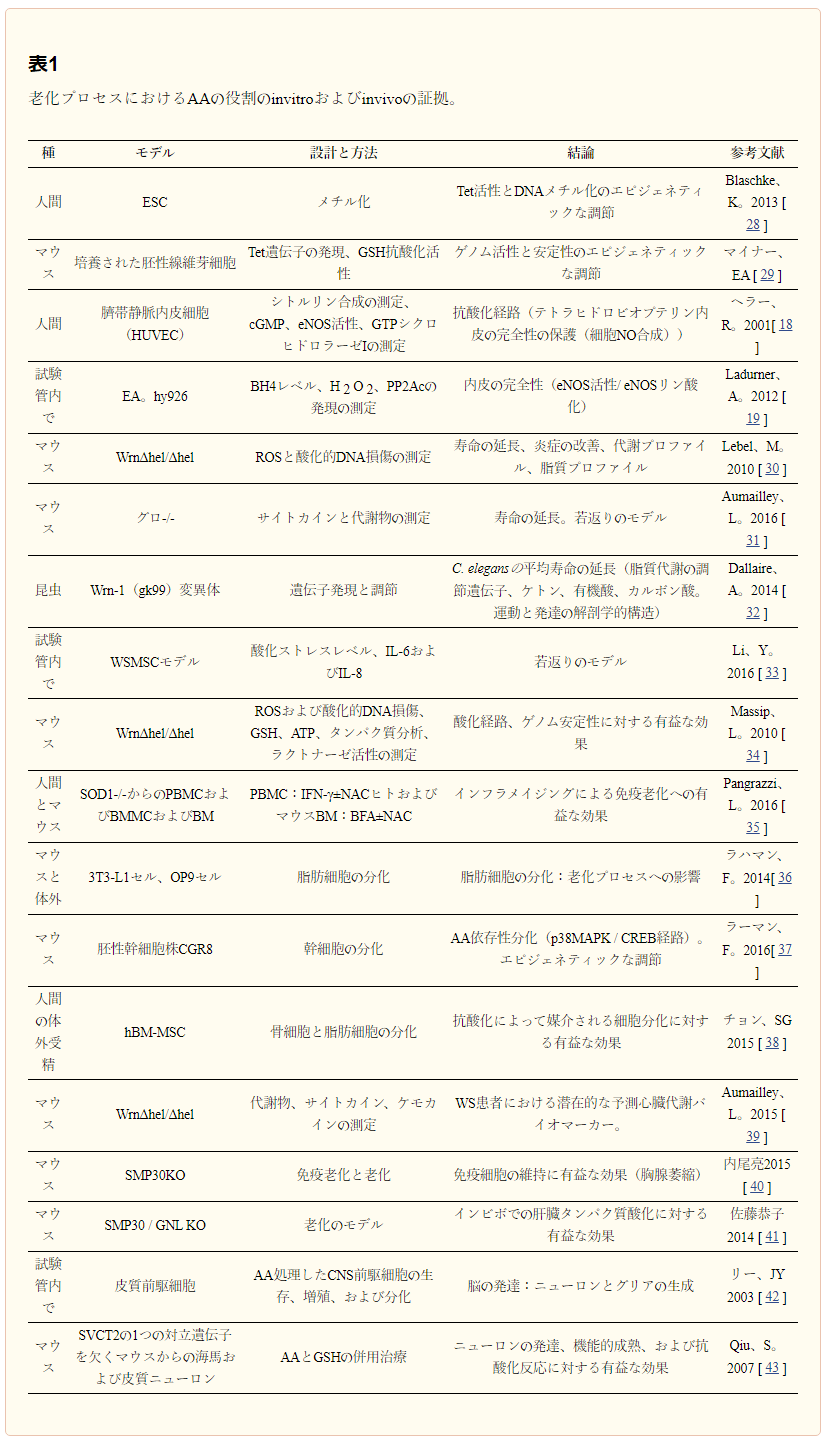
いくつかの研究により、老化プロセスにおける アスコルビン酸 の役割がますます認められるようになってきた。試験管内試験および生体内試験での証拠をここに報告し、表1に示す。
表1 老化過程における アスコルビン酸 の役割についての 試験管内試験 および 生体内試験 でのエビデンス
マウスの老化モデルにおいて、アスコルビン酸が老化マウス由来の骨髄間葉系細胞の増殖を促進することが示された。老化促進マウスprone 6(SAMP6)マウスと老化促進マウスresistant 1(SAMR1)マウスをそれぞれ試験群、対照群とした。SAMP6マウス由来の骨髄間葉系幹細胞(BMMSCs)を高濃度のアスコルビン酸で処理した[44]。この処置は、テロメラーゼ活性およびTERT発現を増加させることにより、BMMSCsの増殖を用量依存的に有意に改善した。アスコルビン酸濃度100μg/mLではSAMP6マウスのBMMSCsの増殖促進効果が最も強く、1.000mg/mLではアスコルビン酸が細胞増殖を抑制した。アスコルビン酸は、細胞テロメラーゼ活性を増加させることで、加齢マウスのBMMSCの増殖を促進する可能性がある。
興味深いことに、骨髄(BM)は、炎症老化を介して、免疫学的な記憶とモニタリングに重要な役割を果たしていることが知られている。IL-15およびIL-6の過剰発現はIFN-yによって刺激され、活性酸素と相関していた。また、血漿細胞生存因子A増殖誘導リガンド(APRIL)も減少した。アスコルビン酸は、老年期の骨髄における炎症性および酸化ストレス関連の変化を打ち消し、老年期の免疫記憶を改善するのに有効であった。この研究は、免疫老化におけるアスコルビン酸の保護的役割を評価する上で重要な関連性がある[35]。
早期細胞イベントに対するアスコルビン酸の正の効果は、ウェルナー症候群タンパク質(WRN欠損)ヒト間葉系幹細胞(MSC)に対するアスコルビン酸の処置によって確認された[33]。このモデルでは、mRNAレベルの解析により、アスコルビン酸がクロマチン縮合、細胞周期の調節、DNA複製・修復に関与する遺伝子の発現を変化させることが示された。アスコルビン酸はヘテロクロマチンのリモデリングを若い状態に促進した(ヘテロクロマチンタンパク質1(HP1α)マーカーとヒストンH3K9me3のウエスタンブロットによるアップレギュレーションから証明された)。アスコルビン酸は間葉系WRN欠損細胞の細胞老化を遅らせ(SA-β-gal)染色で示される間葉系幹細胞の生命力と増殖能を回復させた。アスコルビン酸はテロメア短縮を抑制し、IL-6やIL-8などの炎症性サイトカインの産生を減少させ、サイクリン依存性キナーゼ阻害因子2A、多発性腫瘍抑制因子1 p16Ink4a、ジンクフィンガー転写因子GATA4などの老化マーカーの発現を抑制し、SASP(老化に伴う分泌表現型の上昇)を抑制した。アスコルビン酸は、細胞周期の調節、テロメアの萎縮、ROSバースト、核ラミニンの乱れを減少させることにより、老化障害を緩和するのに有効であった。
また、アスコルビン酸は、p38マイトジェン活性化プロテインキナーゼ/cAMP応答エレメント結合(CREB)核内転写因子活性化(p38 MAPK/CREB経路)やSVCT2トランスポーターの発現増加に関与することにより、中胚葉由来の胚性幹細胞(ES)の分化を刺激/抑制することが報告されている。より正確には、アスコルビン酸はクロマチンドメインのオーバーラップを調節することでESの分化を促進することが明らかになった。これらの試験管内試験モデルは、老化プロセスに重要な意味を持つ。体重の文脈でのアスコルビン酸の効果は、脂肪形成を阻害し、筋遺伝および骨形成に向けた幹細胞の分化に少なくとも部分的に関連している可能性がある。老化はサルコペニアと体重の欠損と関連しているので、今回の観察では、アスコルビン酸を介した幹細胞効果が老化過程で役割を果たしている可能性が示唆されている[36,37]。
さらに、同じ結果を、複製性老化を受けたヒト骨髄間葉系間葉系間葉系間質細胞(hBM-MSCs)で再現し、アスコルビン酸投与後の活性酸素レベルと幹細胞の潜在的な分化との関係を調べた。興味深いことに、アスコルビン酸添加は、リン酸化されたフォックスヘッドボックスOタンパク質1(p-FOXO)とp53に影響を与えることで、過剰な活性酸素を除去し、内因性の抗酸化酵素活性(カタラーゼ、SOD)を回復させた。さらに、脂肪細胞と骨細胞への分化が有意に増加した[38]。
このように、アスコルビン酸は幹細胞の制御と分化に関与していると考えられる。現在、MSC細胞表面のバイオマーカーやMSCの分化の分子機構に関する知見は、Wnt/β-カテニンシグナル、Notchシグナル伝達経路、骨形態形成タンパク質、各種成長因子、MSCの癌遺伝子や免疫抑制活性などの役割が強調されている。したがって、このような細胞分化のターゲティング制御におけるアスコルビン酸の役割を確立するためには、さらなる研究が必要であり、加齢に伴う疾患の予防に重要な臨床的意味を持つ可能性がある[45]。
アスコルビン酸と老化プロセス 生体内試験でのエビデンス
ヴェルナー症候群(WS)のマウスモデル(Wrn Δhel/Δhel変異)は、加速されたヒトの老化に類似した多くの表現型特性を示す。9ヶ月間のアスコルビン酸の補充は、肝細胞および心筋細胞の酸化ストレスを減少させ、高トリグリセリド血症および高血糖を減少させることが明らかになった。また、WrnΔhel/Δhel変異マウスでは、インスリン抵抗性や体脂肪を含む代謝プロファイルの有意な改善が観察された。
同様に、他のウェルナー症候群様の生体内試験モデルでは、アスコルビン酸の補給が短命を救い、脂肪組織、肝臓、ゲノムの完全性における加齢に関連した異常を逆転させることが確認されている。代謝プロファイルでは、炎症状態が改善され、分子レベルでは、AKTキナーゼのリン酸化の正常化、NF-κB、プロテインキナーゼデルタ(PKCデルタペルオキシソーム増殖因子活性化受容体α(PPARα)および低酸素誘導因子-1α(HIF1-α)の転写レベルが観察された[45]。
WrnΔhel/Δhel変異マウスモデルのさらなる研究では、プロオキシダントおよび炎症状態が肝組織の洞状内皮の早期防衛を生じさせ、その結果として肝機能障害および肝リポ蛋白質代謝の障害をもたらすことが示された。アスコルビン酸を長期投与すると、酸化ストレスを鎮めることでGSHの生理的レベルが回復し、洞質内皮が脱落した。注目すべきは、健康なマウスでは、健康と寿命に対するアスコルビン酸の有益な効果は有意ではなく、補充はWrn∆hel/∆helマウスの肝臓でのみ酸化的損傷を有意に減少させたことである[30,34]。
アスコルビン酸は、機能的なウェルナー症候群プロテインヘリカーゼを欠失したマウスの心代謝および炎症プロファイルにプラスの影響を与えた。アスコルビン酸はプラスミノーゲンアクチベーター-1(PAI-1)の発現レベルの変化を逆転させ、転写レベルで脂肪酸分解を改善した。さらに、アスコルビン酸はグルタチオン代謝を増加させ、酸化ストレスを逆転させた。この研究は、アスコルビン酸がWS患者における心代謝バイオマーカーの可能性を示唆した[39]。
非機能的なwrn-1 DNAヘリカーゼオルソログを持つCaenorhabdilis elegansワームモデルは、寿命が短くなっていた。アスコルビン酸の投与により、脂質、ケトン、有機酸、カルボン酸の代謝を制御する遺伝子の発現が変化することで、
逆に、野生型ワームでは、アスコルビン酸はタンパク質分解の生物学的プロセスにしか影響を与えなかった[32]。
ノックアウト(Gulo/-)マウスは、グルノラクトンオキシダーゼ(Gulo)遺伝子を欠いた、ヒトの生理学を模倣した興味深い生体内試験モデルである。この生体内試験モデルからのエビデンスの蓄積により、老化におけるアスコルビン酸の役割に関する追加情報が得られた。ノックアウトマウス(Gulo-/-)では、高い酸化ストレス、感覚運動障害、行動異常がみられた。Gulo-/-マウスの寿命は、小胞体ストレスに反応してIRE1αおよびIF2αのリン酸化レベルと逆相関しているようであった。このモデルでは、アスコルビン酸の補給はIRE1αのリン酸化を減少させ、小胞体ストレスに対する保護効果と寿命の延長を示唆していた。さらに、同じ生体内試験モデルでは、肝損傷後のT細胞を介した急性反応を改善することが示されており、免疫系の調節が示唆されている[31]。
内尾らは、SMP30KOマウスの免疫細胞の数と機能に長期の高用量アスコルビン酸摂取の影響を実証した。末梢血中の白血球、リンパ球、顆粒球、単球の合計数、脾臓細胞、胸腺細胞の数は、すべて治療群で有意に高かった。また、末梢血リンパ球のナイーブT細胞数、脾臓細胞のメモリーT細胞集団数、胸腺細胞の分化したCD4+およびCD8+ T細胞のクラスター数は、いずれも著しく上昇していた。食事によるアスコルビン酸の高摂取は、加齢に伴う胸腺萎縮の改善と関連していた。この研究は、CD4+およびCD8+細胞を標的とした免疫産生におけるアスコルビン酸の役割を示唆している。さらに、アスコルビン酸はSMP30ノックアウトマウスにおいて、免疫細胞のサーベイランスを調節することが明らかになった[40]。
これらのデータに沿って、佐藤らは、SM30/グルコノラクトナーゼノックアウトマウスの肝臓におけるタンパク質の酸化防止にアスコルビン酸が重要な役割を果たしていることを示唆しており、全身の健康と老化に潜在的な意味を持つことが示唆された[41]。
4. アスコルビン酸と老化プロセス。酸化ストレスと抗酸化防御
酸化ストレスは寿命やアスコルビン酸にとって有害であると考えられており、第一線の抗酸化物質として、潜在的に長寿を増加させると考えられてきた。これらの考え方は、最近、突然変異またはプロオキシダント処理によって生成された活性酸素生成の増加が寿命に有益な効果を示すモデル生物での知見によって挑戦されている[46,47]。このような関係は、活性酸素レベルの適度な増加による有益な効果とその用量依存性の毒性の組み合わせから生じると考えられる。興味深いことに、寿命を増加させる活性酸素レベルのわずかな上昇は、ストレスにはならないようであり、酸化ストレスに対する抵抗力の増加を誘発しない。特に、線虫のCaenorhabdilisモデルでは、[48] アスコルビン酸は活性酸素レベルと寿命の間に逆U字型の用量反応関係を示した;活性酸素レベルが高い場合も低い場合も寿命に有害であった。この証拠は、老化におけるアスコルビン酸の役割をさらに複雑にしている。抗酸化剤治療とプロオキシダント治療の両方でこのような異なる挙動が明らかになったという事実は、有益な効果を得るためには、アスコルビン酸の一時的な投与が重要な関連性を持つことを示唆している。さらに、活性酸素レベルは、異なる細胞の寿命に最適化される必要があり、抗酸化剤と酸化剤の防御とそれらの濃度との間の正味のバランスは、老化プロセスに関連する役割を果たしている。
臨床的な観点から見ると、アスコルビン酸は老化、寿命、加齢に伴う疾患の真の接点で機能している。テロメア活性、生体エネルギー、DNA修復、酸化ストレスを調節することができ、老化のプロセスにおいても栄養ゲノム学的な役割があることを示している[49]。
老化の間、アスコルビン酸の抗酸化能力は、デヒドロアスコルビン酸/アスコルビン酸の酸化還元バランスと、デヒドロアスコルビン酸をアスコルビン酸に戻す内因性抗酸化酵素防御システム(グルタチオンとニコチンアミド・アデニン・ジヌクレオチドリン酸;NADPH)の能力によって細かく制御されている。デヒドロアスコルビン酸/アスコルビン酸の比率の増加は、生物学的プロセスを媒介するアスコルビン酸のプロ酸化能力の指標となり、異なる老化の軌跡を遮断して、老化に関連する疾患において役割を果たす可能性がある。
同様に、細胞の抗酸化酵素能力は老化過程で低下し、グルタチオンおよびNADPHの酸化もまた、老化および疾患予防を標的とした研究における異なる結果を説明する可能性がある。最近では、アスコルビン酸や抗酸化能力の低下を含む末梢抗酸化パラメータが低い高齢者は、5年間の追跡調査で臨床的脆弱性、障害、虚弱性、死亡率が高くなりやすいことが示されている[50]。
逆に、健康な高齢者を対象とした2つの研究では、スターフルーツジュース(アスコルビン酸を多く含む果物、Averrhoa Carambola)の毎日の摂取がフリーラジカルのスカベンジャーとして作用し、低レベルの脂質酸化ストレス(MDA)を維持し、GSHレベルを回復させることが示された。関連するアスコルビン酸の抗酸化能力はまた、プロ炎症性サイトカイン、特にTNF-αおよびインターロイキン-2(IL-2)を除くインターロイキン-23(IL-23)の分泌を減少させることにより、抗炎症効果を媒介した[51,52]。
Kimらは、ヒトにおける高用量アスコルビン酸補給(1日1250mg)の効果を調査した。8週間後の血清リポタンパク質の分析では、高度糖化最終生成物(AGEs)の減少が認められた。抗糖酸化作用は、特に非喫煙男性において有意に高く、血漿HDL値の純改善と関連していた。また、LDL画分の定量分析では、LDL脂質組成の改善も認められた。したがって、アスコルビン酸の補給は、酸化LDLとマクロファージの貪食を減少させ、泡細胞への変換を減少させることで、アテローム性動脈硬化および関連する全身性炎症に対する保護効果を発揮する可能性がある[42]。
興味深いことに、本研究では、アスコルビン酸が標的遺伝子の転写後発現をネガティブに調節するいくつかのマイクロRNAの遺伝子発現の変化を誘導することが示された。アスコルビン酸摂取後、miR155レベルは90%減少し、高用量のアスコルビン酸がmiRNAレベルおよび抗炎症反応を有意に修飾する可能性があることを示唆している[42]。このように、アスコルビン酸は、個別化された栄養のエピジェネティックな鍵と考えられるかもしれない。
5. 脳の老化におけるアスコルビン酸のエビデンス
中枢神経系では、アスコルビン酸はまだ部分的にしか確立されていない複雑な役割を果たしている。脳脊髄液(脳脊髄液)のアスコルビン酸濃度(200-400mM)は、脳実質および血漿中の濃度(30-60nM)と比較して高い[43]。
アスコルビン酸は、アスコルビン酸のための活性で可飽和なトランスポーターであるナトリウム依存性ビタミンCトランスポーター2(SVCT2)によって脈絡叢細胞の先端膜を越えて脳脊髄液に分泌される。デヒドロアスコルビン酸は、BBB内皮細胞に存在するGLUT1トランスポーターを介して、より効率的に血液脳関門(BBB)を横断することができる。SVCT2は、GLUT受容体(特にGLUT1およびGLUT3)が中枢神経系細胞からのデヒドロアスコルビン酸吸収を主に担当している間、脳内のニューロンまたはアストロサイトを介してアスコルビン酸の取り込みを仲介する。神経細胞は細胞内のアスコルビン酸を維持するために両方のメカニズムを使用している可能性が高いが、SVCT2輸送はほとんどが脳脊髄液から神経細胞へのアスコルビン酸濃度勾配の維持に寄与している[43]。さらに、アスコルビン酸のリサイクルは、プロオキシダント条件下でGLUT受容体を媒介とした細胞内取り込みによるバイスタンダー効果を介して作用する。これは、デヒドロアスコルビン酸からアスコルビン酸への細胞内変換を促進し、細胞内蓄積を増加させる。このバイスタンダー効果は、ニューロンとアストロサイト間のアスコルビン酸リサイクル活性に関与し、プロ酸化状態と抗酸化状態の絶妙なバランスに役割を果たしている[53]。
最近では、ニューロンを媒介とするアスコルビン酸の放出が、脳内のグルタミン酸代謝および動態と関連していることが示されている。特に、Wilsonら[53]は、アスコルビン酸の細胞外放出がグルタミン酸受容体のナトリウム取り込みの増加によって媒介されるアストロサイトの膨潤の直接的な結果であることを実証した。脳および脳脊髄液におけるアスコルビン酸の細胞外放出の亢進は、グルタミン酸の興奮毒性に対する抗酸化および神経保護のメカニズムに関与していると考えられている[53]。
いくつかの生体内試験研究では、特に虚血性イベントや脳再灌流後にアスコルビン酸が抗酸化的な役割を果たすことが報告されている。アスコルビン酸は、ミリモル濃度で、細胞膜の脂質層内でα-トコフェロールをリサイクルし、スーパーオキシドアニオンをスカベンジすることができた[54]。これは、順番に、脂質過酸化プロセスを阻害した。さらに、中枢神経系では、アスコルビン酸は、ダイオキシゲナーゼ部位でのFe3+およびCu2+の酸化還元活性を含むいくつかの水酸化反応に参加していた。培養幹細胞を用いた試験管内試験研究では、アスコルビン酸は神経細胞の発達成熟と神経伝達にも関与していることが示された。Leeら[55]はさらに、アスコルビン酸(200ミリモル濃度)がニューロンおよびアストロサイト前駆体の分化に効果的であり、シナプスの成熟を促進することを示した。
SVTCノックアウトマウスを用いた生体内試験モデルでは、低用量のアスコルビン酸が樹状突起形成を仲介し、シナプス後の電位を上昇させることが示された[56]。
アスコルビン酸はカテコールアミンの生合成、ペプチドアミノ化、ミエリンの形成、シナプス機能の強化、グルタミン酸毒性に対する神経保護作用に不可欠である[53,57]。特に、アスコルビン酸は、ドーパミンからノルアドレナリンへの変換を触媒するドーパミンβ水酸化酵素の共役者であるため、神経伝達において重要な役割を果たしている。アスコルビン酸は、脳内の神経伝達物質のバランスを調整することによって、脳の可塑性を調節すると考えられている。神経伝達に影響を与える主なアスコルビン酸媒介メカニズムは、NMDA受容体の酸化還元調節活性に関連している可能性があり、グルタミン酸の興奮毒性を打ち消すためのアスコルビン酸の役割を支持している[57,58]。
アスコルビン酸の脳内リサイクルに関連する生理的・分子的メカニズムやSVCT2とGLUT受容体の発現の違いをよりよく理解することで、アルツハイマー病やハンチントン病などの複雑な神経変性疾患の病態解明に貢献できると期待されている。
6. アスコルビン酸とアルツハイマー病との関連性
長年にわたり、l-アスコルビン酸(アスコルビン酸)が神経変性、特にアルツハイマー病に関して、いくつかの有益な効果を促進することがますます明らかになってきている[59]。この生命を脅かす疾患の負担の増加 [60] と、疾患を改善する薬剤の不足により、アルツハイマー病修飾可能な危険因子を標的とした予防戦略に向けた研究が進められてきた [12]。確立された証拠は、アルツハイマー病発症に関連する特定の因子を改善する上でのl-アスコルビン酸の役割を示している[61]。すなわち、アスコルビン酸神経保護に関連する主なメカニズムは、活性酸素に対する消去活性、神経炎症の調節、アミロイドβペプチド(アミロイドβ)のフィブリル化の抑制、および鉄、銅および亜鉛のキレート化に関与している[62]。アミロイドカスケード仮説は、アルツハイマー病発症の主要なイベントと考えられている[63]。βアミロイド前駆体タンパク質(APP)のガンマおよびβセクレターゼ(BACE1)による逐次切断は、神経毒性のあるオリゴマーの蓄積を伴うβアミロイド種の産生をもたらす。脳内にアミロイドβ1-42オリゴマーが蓄積すると、酸化ストレスに対する神経細胞の脆弱性が増大し [64,65] 、シナプス可塑性の障害を伴う神経炎症 [66] 、神経細胞の死に至る。細胞外アミロイドプラークもまた、細胞骨格タウタンパク質の過リン酸化に関与している[67]。さらに、アミロイドβオリゴマーはミトコンドリアの動態を阻害する[68,69]。
銅、亜鉛、および鉄は、金属結合部位の存在によりアミロイドβプラークに存在する[70]。金属はアミロイドβの形態に影響を与え、アミロイドβの線維化および細胞毒性を促進する可能性がある[71]。したがって、アミロイドβに連結された酸化還元活性銅および鉄は、フェントン反応を介してヒドロキシルラジカルを生成し、アルツハイマー病脳内のタンパク質およびDNAの酸化および脂質過酸化(MDA)を増加させることができる。金属の酸化還元活性はまた、チトクロームc酸化酵素活性を低下させ、AGEs、カルボニル、ペルオキシナイトライト、およびヘムオキシゲナーゼ-1(HO-1)の増加レベルの生産を誘導する[61]。AGEsは、高度な糖化最終産物(RAGEs)の受容体との相互作用を介して、IL-6などのプロ炎症性サイトカインの誘導を伴うプロ炎症性経路をさらに活性化する [72]。さらに、蛍光 AGE ペントシジンの低濃度が健常者と比較して アルツハイマー病 患者の 脳脊髄液 で観察され、アルツハイマー病 病因における変化した AGE 代謝の役割を支持した [73]。
酸化ストレスは一般に慢性的な老化と関連しているが、老化はアルツハイマー病の主要なエピジェネティックリスク因子である。最近の証拠は、酸化ストレスが軽度の認知障害を含むアルツハイマー病の前段階で必須の役割を果たしていることを発見した[74]。脳は、酸素消費量の多い神経細胞の分裂後の状態により、活性酸素のダメージを受けやすい状態にある。脂質過酸化生成物、酸化されたタンパク質、DNA損傷に関しては、ペルオキシナイトライトは、頭頂皮質のミトコンドリアDNAと核DNAの酸化と同様に、アルツハイマー病側頭皮皮質でますます検出されている[75]。アルツハイマー病海馬ニューロンとアストロサイトでは、酸化還元不均衡は、ヘムオキシゲナーゼ-1の過剰発現とCu/Znスーパーオキシドジスムターゼの増加レベルで観察されている[76]。チロシン残基の共役芳香環もフリーラジカル攻撃の標的であり、ジチロシンと3-ニトロチロシンの蓄積もアルツハイマー病脳で報告されている[77]。したがって、酸化ストレスは、傷害部位のアストロサイトとミクログリアのプライミングとグリアを直接活性化することができる。その結果、活性化したグリア細胞とニューロンの直接接触は、神経毒である免疫メディエーター(一酸化窒素、活性酸素、プロ炎症性サイトカイン、ケモカイン)を生成し、中枢神経系に炎症を広げる可能性がある[78,79]。このように、広範な酸化的損傷は脳の老化の推進因子として作用する可能性があり、酸化的に修飾された生体分子の早期の蓄積は、アルツハイマー病神経変性の初期段階を構成する可能性がある。
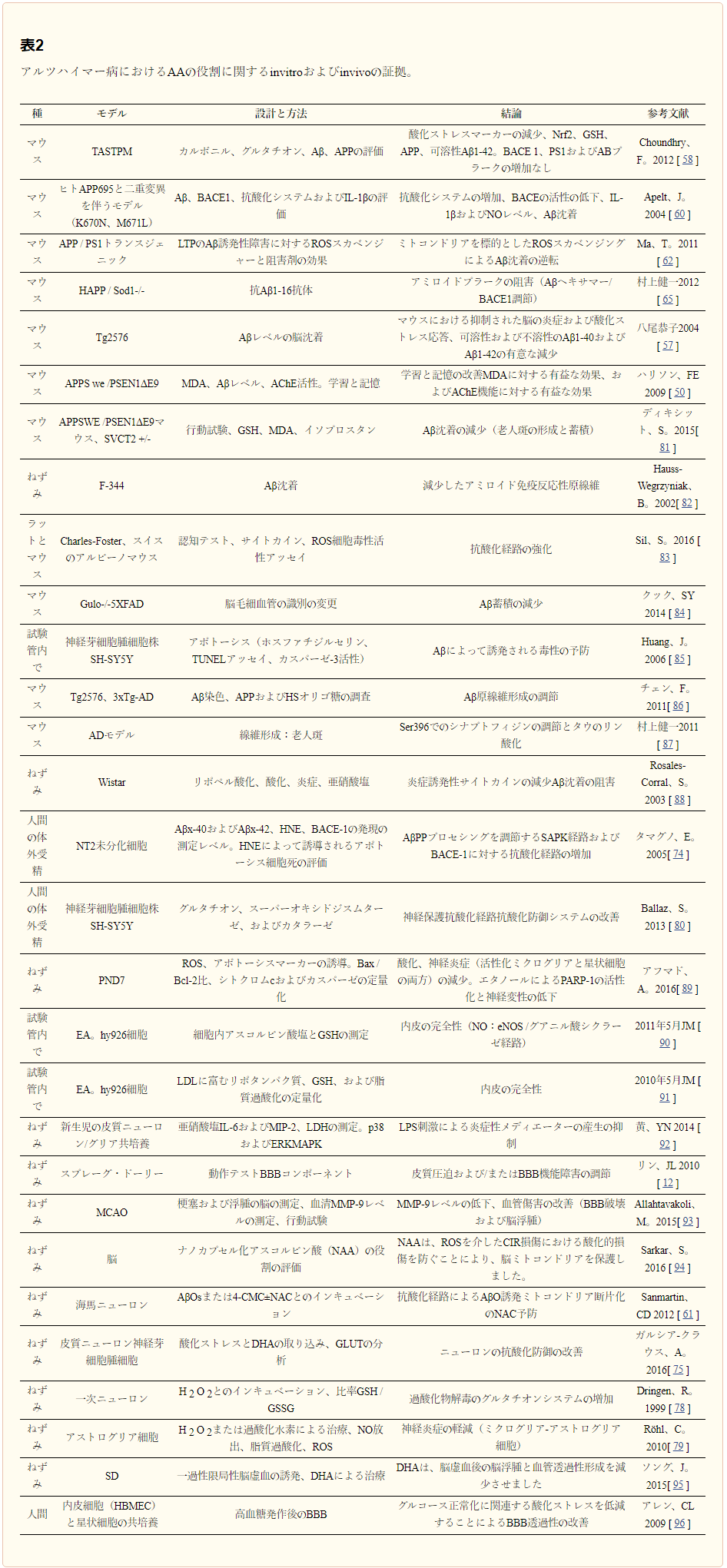
これらの知見はすべて、老化の直接的な影響としての酸化ストレスと、アミロイドβの毒性効果の結果としての酸化ストレスの機序的役割を提供する可能性がある。酸化ストレスは、APP処理、ミトコンドリア機能不全、金属蓄積など、アルツハイマー病発症に関連する複数の特徴と相互作用している[80]。アルツハイマー病発症に対する主なアスコルビン酸媒介の神経保護効果が報告され、表2に示されている。
表2 アルツハイマー病における アスコルビン酸 の役割についての 試験管内試験 および 生体内試験 でのエビデンス
6.1. アルツハイマー病におけるアスコルビン酸と酸化ストレス
アスコルビン酸 は、酸化ストレスに対する直接的な神経保護により、アルツハイマー病 の発症に大きな役割を果たすことが示唆されている。アスコルビン酸のホメオスタシスの不均衡は、神経変性において広範囲に実証されている[58]。アスコルビン酸は中枢神経系の主要な抗酸化物質であり、グリア細胞からシナプス間隙に放出され、ニューロンの代謝とシナプス機能を維持するための抗酸化防御としてニューロンに取り込まれる。アストロサイトとニューロンの相互作用は、アスコルビン酸のリサイクルに不可欠なメカニズムとして機能し、脳の抗酸化防御に関与していることが判明した[97]。
アスコルビン酸は、内因性抗酸化物質(GSH、カタラーゼ、ビタミンE)の再生を促進し、活性酸素反応性を中和するための第一の抗酸化防御であることはよく知られている[98]。
興味深いことに、アスコルビン酸はグルタミン酸によって媒介される酸化ストレスを緩和し、脳の興奮毒性から保護するとも推定されている[56,88]。APP/PSEN 1トランスジェニックマウスを用いた以前の研究では、アスコルビン酸の非経口投与は、プラーク沈着、酸化ストレス、アセチルコリンエステラーゼ活性のアルツハイマー病様の特徴を変化させることなく、向精神性の特性を有することが示された[85]。したがって、いくつかの試験管内試験および生体内試験の研究は、酸化防御を強化し、アルツハイマー病におけるアスコルビン酸の治療的役割を支えている[99]。
ラット海馬脳では、アスコルビン酸の経口投与により、酸化ストレスとアミロイドβフィブリルによって媒介される神経炎症が減少した[100]。さらに、アスコルビン酸はSH-SY5Y神経芽腫細胞をアミロイドβを介したアポトーシスから保護し、内因性アミロイド生成率を低下させることが示された[86]。さらに、アスコルビン酸はマウスのアセチルコリンエステラーゼ活性を低下させ[101]、シナプス前のアセチルコリン放出を積極的に回復させることが報告されている[102]。
さらに最近では、アスコルビン酸の存在下でNO触媒によるアンヒドロマンノースの放出が検出され[103]、有害なアミロイドβオリゴマーの生成が減少することが報告されている。SVCT2トランスポーターを欠いたAPP/PSEN 1マウスは、脳内アスコルビン酸が正常なコントロールマウスと比較して、酸化ストレス経路に関連したアミロイドの発病が加速していた。さらに、アスコルビン酸の経口投与は、ラット脳の海馬のCA1領域でアミロイドβペプチド注射によって誘導される酸化ストレスとプロ炎症性サイトカインを減少させた[99]。
6.2. アルツハイマー病における金属、酸化ストレス、アスコルビン酸。脳内のアスコルビン酸の酸化的バランス
アルツハイマー病脳における酸化ストレス亢進の主な特徴は、フリーラジカル生成、脂質過酸化、反応性窒素種(NRS)放出、およびストレス感受性タンパク質を刺激することができるCuとFeの含有量の増加にも関連している[104]。ターンでは、誤って折り畳まれたアミロイドβ凝集体とオリゴマーとの酸化還元活性銅イオンの相互作用は、アルツハイマー病の病因を支持する可能性がある。
高濃度では、アスコルビン酸は活性酸素種を発生させるか、または鉄の存在下で抗酸化系を阻害することにより、プロオキシダントとして作用し、その結果、脂質の過酸化を誘導することがよく知られている[105]。アスコルビン酸のプロオキシダント効果または抗酸化効果は、主に細胞の濃度勾配および酸化還元状態に依存する [106]。眼のアスコルビン酸トランスポーターSVCT2を選択的に過剰発現させたマウスモデルからの証拠 [107] は、水晶体の結晶性タンパク質の加齢による損傷にアスコルビン酸が関与していることを示唆している。これらの実験データはすべて、フェントン反応を介したアスコルビン酸の潜在的なプロオキシダントとしての役割についての議論の高まりに貢献している。
以前の研究では、認知症におけるアスコルビン酸の保護的役割を否定し、アスコルビン酸と「遊離」触媒活性金属イオンとの相互作用が、ヒドロキシルラジカルやアルコキシルラジカルの産生を介した酸化的損傷に寄与する可能性があることを示唆していた[108]。興味深いことに、いくつかの試験管内試験研究では、アスコルビン酸のプロオキシダント特性が調査されており[109]、その主な原因は、損傷を受けた細胞からの金属イオンの放出であった。アミロイドβ、アミロイドβ(1-42アミロイドβ(1-40およびアミロイドβ(25-35)の神経毒性型はアスコルビン酸の銅介在性酸化を誘導したが、非毒性のアミロイドβ(40-1)は誘導しなかったことが報告されている[110,111]。このことから,有毒なアミロイドβペプチドはアスコルビン酸の銅酸化とヒドロキシルラジカルの生成を媒介しており,アルツハイマー病の病態におけるカップリックアミロイドペプチドのフリーラジカル生成の役割を示唆していると結論づけられた。これらの最後の知見に沿って、アミロイドβはキレート化を介してCu2+/+の酸化還元活性を沈黙させるのではなく、アスコルビン酸とCu2+のフェントン-ヘーバーワイス反応の結果としてヒドロキシルラジカルが生成され、有害なラジカルを急速に鎮静化させることが明らかになった[112]。さらに、アスコルビン酸酸化の反応速度とメカニズムは、活性酸素が細胞膜に近接していることを考えると、Cu(II)を含むアミロイドβオリゴマーとフィブリルの存在下では、より大きな生物学的関連性をもたらす結果となった[104]。さらなる証拠は、酸化還元活性銅イオンと誤って折り畳まれたアミロイドβとアルツハイマー病の発症との相互作用におけるアスコルビン酸のプロ酸化的役割を示しており、特に、特定のアミロイドβ構造ではなく、完全長アミロイドβに存在するCu+の触媒部位に関連していることを示している[82]。
しかしながら、問題を複雑にするために、鉄を含む緩衝系での試験管内試験でのプロオキシダント特性はよく知られているにもかかわらず、鉄の存在下では、アスコルビン酸は生体内試験での酸化的損傷を減少させることが観察された[83]。さらに、最近の報告では、脳の金属キレート、酸化ストレス、および線維形成に対するさまざまな食品成分の試験管内試験効果を評価した[89]。その結果は、現在仮説されているアスコルビン酸の神経保護作用機序を支持するものではなかった。実際、アスコルビン酸は優れた抗酸化物質であるが、金属キレート活性は低いことがわかった。印象的なことに、エピガロカテキンガレート(EGCG)ガリン酸、およびクルクミンの多機能食品能力と比較して、アミロイドβ線維形成に対するアスコルビン酸媒介の阻害効果は示されなかった。したがって、良好なアスコルビン酸の脳への取り込みのために、アルツハイマー病脳における酸化ストレスを打ち消すアスコルビン酸の役割に対処するために、さらなる調査が必要である。
6.3. アルツハイマー病におけるアスコルビン酸と神経炎症
以前の研究では、リポ多糖類とチオルファンを脳に慢性的に注入したアスコルビン酸の慢性投与は、アミロイドβアミロイド斑の沈着の増加とアミロイドβ神経免疫反応性の増加と関連していることが示された[92]。しかしながら、グリア媒介性炎症の抑制にアスコルビン酸が関与していることを示唆する証拠がいくつか存在した。特に、コルキシン誘発性酸化ストレス/神経炎症ADラットモデル[84]では、アスコルビン酸の投与は記憶障害の予防に有効であり、アルツハイマー病ラットの海馬における炎症性マーカー(TNF-α、IL 1β活性酸素、亜硝酸塩レベルを低下させることが示された。また、アスコルビン酸はアミロイドプラーク形成を有意に減少させた。末梢免疫応答(血中WBCと脾臓PMNの貪食活性の増加)もアスコルビン酸投与後に回復し、観察された変化は、脳から末梢循環への炎症性メディエーターのより高い排出と関連していた。同様の結果はまた、より高い用量(600 mgの食事)でアスコルビン酸のプロ酸化的役割に対処し、酸化ストレスに対処するためのアスコルビン酸の二重の役割を支持している。さらに、エタノール誘発性酸化ストレスのラットモデルでは、アスコルビン酸がエタノール誘発性酸化ストレス、神経炎症、アポトーシス神経細胞の損失を打ち消すのに有効であり、エタノールによる脳の発達障害に対して有益な効果があることが示された[87]。このモデルが真のADモデルではないとしても、今回の知見は、脳内の酸化ストレスや神経炎症に対するアスコルビン酸の役割に知見を加えるものである。特に、そのフリーラジカル消去特性により、アスコルビン酸治療は活性酸素の産生を減少させ、活性化したミクログリアとアストロサイトの両方を抑制した。また、アスコルビン酸はBax/Bcl-2比、チトクロームC、カスパーゼ9やカスパーゼ3などの異なるカスパーゼのレベルを低下させることで、アポトーシスや神経毒性の軽減を示した。さらに、アスコルビン酸処理はエタノールによるポリADP-リボースポリメラーゼ1(PARP-1)の活性化と神経変性を減少させた。これらのデータと同様に、アスコルビン酸 は、MAPK および NF-κB シグナル伝達経路を阻害することにより、ニューロン/グリア共培養体のリポ多糖類(LPS)刺激性の炎症性メディエーター産生を抑制することも観察された[113]。
6.4. アルツハイマー病におけるアスコルビン酸とアミロイドプラーク蓄積
蓄積されたエビデンスは、アミロイドβの毒性線維形成におけるアスコルビン酸の役割を示している。高用量のアスコルビン酸補給は、5家族性アルツハイマー病変異(5X家族性アルツハイマー病)ADマウスモデルにおけるアミロイドプラーク負担を減少させた。ADマウスモデルにおけるアスコルビン酸の病原性の重要性をよりよく特定するために、5X家族性ADマウスとgulono-γ-ラクトンオキシダーゼ(Gulo)ノックアウトマウス(KO-Tgマウス)との交配を行った。KO-Tgマウスにおけるアスコルビン酸の高補給は、BBB破壊とミトコンドリアの変質の改善をもたらし、アミロイドプラーク負担の大幅な減少をもたらした[114]。
APP/PSEN1(+)ビジェニックマウスとSVCT2(+/-)ヘテロ接合ノックアウトマウスとの交配によって作成されたアルツハイマー病のAPPSWE/PSEN1deltaE9マウスモデルは、また、興味深い結果を示した[81]。生後14ヶ月までに、野生型コントロールと比較して、総グルタチオンの減少を伴う酸化ストレス(マロンジアルデヒド、プロテインカルボニル、F2-イソプロスタンス)の増加が観察された。また、正常なアスコルビン酸脳を持つAPP/PSEN1(+)マウスと比較して、可溶性と不溶性の両方のアミロイドβ1-42の量が増加し、海馬および皮質アミロイド-βプラーク沈着物の増加を伴うアミロイドβ1-42/1-40比が高くなっていることが観察された。これらのデータは、アスコルビン酸欠損がアミロイド蓄積を促進する上で重要な役割を果たしており、特に疾患の初期段階では、これらの影響は酸化ストレス経路によって調節されている可能性が高いことを示唆している。Huangらは、アスコルビン酸を細胞に事前に添加することで、SH-SY5Y細胞のアポトーシスと死を実質的に防止すると同時に、内因性βアミロイド生成の基底率を低下させることを示した[86]。Chengらは試験管内試験モデルで、アスコルビン酸の供給不足が有毒なアミロイドβオリゴマーの形成増加に寄与することを実証した。アスコルビン酸の非存在下では、アミロイドβドメインとアンヒドロマンノース(anMan)含有オリゴ糖の小分子NO触媒放出との間の一時的な相互作用は、神経毒性のある線維形成の誘導の増加とともに阻止される[103]。村上ら[91]は、APPトランスジェニックマウスにおいて、アスコルビン酸の投与はオリゴマー化を減衰させるが、アミロイドプラークの総量は減少しないことを示した。著者らは、マウスがアスコルビン酸のde novo合成を保持する能力は可能であり、アミロイドプラーク蓄積の有意な変化を理解するためには、より長い試験期間が必要であると結論付けている。これらの最後の知見は独創的なものであり、健康な脳の老化を促進するアスコルビン酸の役割を支持するために、脳脊髄液のアスコルビン酸レベルを系統的に評価することによって「シンク仮説」を検証する必要があることを示している。実際、アミロイドβが血液脳関門を越えて輸送されるように、脳と末梢のアミロイドβには何らかの形での平衡が存在するという仮説が立てられている。末梢のアミロイドβレベルを調節することで、脳のアミロイドβレベルも同時に変化し、アミロイドβ低下戦略の「シンク仮説」の基礎を形成することが予測されている。
6.5. アルツハイマー病に伴う酸アスコルビン酸と血管障害
最近では、アルツハイマー病の病態形成における血管成分の病態生理学的役割が実証されている[115]。ここでも、酸化ストレスは重要な関連メディエーターと考えられており、アルツハイマー病と血管疾患の間の病因的リンクを確認している[116]。酸化ストレスは、アミロイドβ42産生の増加に伴う内皮の完全性を損なうことにより、神経血管ユニットに影響を及ぼす可能性がある。この一連の病理学的事象は、活性酸素の過剰生産と新たな細胞外アミロイドβ42沈着の間のサイクルを自動的に維持する結果となった。アスコルビン酸は、内膜厚、脂質過酸化、内皮機能障害を減少させることにより、脳神経変性に対する一連の保護効果を媒介していることが確認されている[90,116,117,118,119]。これに伴い、血液脳関門の内皮内膜の完全性がアルツハイマー病の発症を予防するために不可欠であることが最近報告されている[120,121,122]。これらの血管リスク因子の各々は、アスコルビン酸の生物学的標的を表し、血管成分に関連したアルツハイマー病発症の予防的役割に寄与する可能性がある。
増加している証拠は、ヒトにおけるより高い四分位の血漿アスコルビン酸濃度によると、心血管関連死亡率および全死亡率を減少させるためのアスコルビン酸の役割を示している[123]。興味深いことに、頸動脈内膜厚が1.2mmを超えるリスクの増加は、血漿中アスコルビン酸濃度が最も低い四分位と排他的に関連していたことに注目すべきである。この同様のリスク上昇は、尿酸、ビタミンA、または酵素的抗酸化負荷(スーパーオキシドジスムターゼおよびグルタチオンオキシダーゼ活性)では観察されなかった。同様に、高齢者を対象とした食事介入では、アスコルビン酸を毎日摂取している被験者でのみ、頸動脈内膜厚の進行が減少したことが示された。
アルツハイマー病または血管性痴呆のリスクは血圧が高い患者で高く、動脈硬化とアテローム性動脈硬化がいかに重要な病原性の役割を果たしているかを示唆している[123]。内皮機能障害は動脈硬化と関連しており、認知機能低下の強い予測因子である[124]。これらのデータはすべて、アルツハイマー型認知症に関連する血管リスク因子を修飾するためのアスコルビン酸の役割を支持するものである。
内皮機能障害はアルツハイマー病の発症に関連する重要な因子である。アミロイドβ凝集体は、輸送がRAGE受容体およびLDL受容体関連タンパク質(LRP-1)によって細かく制御されているため、BBBを越えて脳からクリアされる。アルツハイマー病患者では、BBB全体の脳内皮LRP-1の発現が減少している[125]。これらのデータは、アルツハイマー病の発症および進行における内皮細胞整合性ライニングの本質的な役割を示唆した。大脳皮質圧迫によるBBB破壊に対するアスコルビン酸の有効性が報告された[90]。虚血性再灌流モデル[126]とNOバイオアベイラビリティの低下を伴うBBB破壊は、内皮機能上のアスコルビン酸の多元的役割を理解するためのプロトタイピングモデルと考えられる。アスコルビン酸は酸化経路を介して内皮の完全性を調節する;内皮細胞によって生成されたスーパーオキサイドは、細胞毒性ペルオキシナイトライトを形成するためにNOと反応し、アスコルビン酸はスーパーオキサイドを消去することによってNOの消費を減少させることができる。さらに、アスコルビン酸は、動脈の弾力性と血圧調節に関連するeNOSのコファクターであるテトラヒドロビオプテリンをリサイクルすることで、内皮一酸化窒素合成酵素(eNOS)の機能に役割を果たしていることが明らかになった[18]。アスコルビン酸はまた、血漿中のS-ニトロソチオールからのNO代謝の回復を促進し[127]、亜硝酸塩(NO2)をNOに還元し、組織または血漿中のNOを保存する可能性がある。アスコルビン酸はNOの生成と代謝を逆転させ[94]、LDLの酸化を阻害することで内皮機能障害を予防することが報告されている。酸化した内皮はBBB透過性を高めることが知られており[117]、脂質代謝に関するアスコルビン酸関連の保護機構はBBB内皮機能障害を改善することがわかった。さらに、アスコルビン酸は血管拡張剤アセチルコリン(内皮依存性アゴニスト)に対する応答の障害を防ぎ、好中球が産生する活性酸素(スーパーオキサイドなど)を減少させた[93]。このように、一連の研究は、アスコルビン酸がBBBの完全性を保護することで、アルツハイマー病発症から保護する可能性があることを示唆している。
これまでのところ、抗酸化ビタミンの脳血管軸を介した認知症への効果については、ほとんど調査が行われていない[95]。Kookらの研究[87]は最近、アスコルビン酸の高用量補充は、BBBの破壊とミトコンドリアの変化[96]の減少を介してADマウス(5X家族性アルツハイマー病)のアミロイドーシスを減少させたことを報告した。さらに、アスコルビン酸はまた、タイトジャンクションタンパク質、オクルーディンとクラウディン-5の発現をアップレギュレートすることによってBBBの破壊を防ぐことが報告された。
実質的なBBBの破壊と脳卒中のモデルでは、アスコルビン酸は有意にBBB透過性を減少させた[128]。同様に、脳虚血のマウスモデルでは、アスコルビン酸はタイトジャンクションクラウディン-5を逆転させることによってBBB機能障害を改善し、浮腫と神経細胞の損失を減衰させた[129]。さらに、試験管内試験での研究では、アスコルビン酸が高血糖を介したBBB障害を逆転させるという証拠が得られた[130]。現在までのところ、アスコルビン酸はBBBの完全性を回復することで神経保護を提供しているようである。しかし、さらなる研究では、脳神経保護効果と抗酸化物質のBBB保護効果を同時に試験することに焦点を当てるべきである[95]。アスコルビン酸は両方のタイプの神経保護作用を有するようであり、認知機能の低下を予防するための標的となるデュアルエージェントとしてさらに試験が行われる可能性がある。
いくつかの横断的研究では、対照群と比較してアルツハイマー病患者の脳脊髄液-血漿中アスコルビン酸比が低いことが実証されている。特に、最近の知見 [95] は、高い脳脊髄液-血漿中アスコルビン酸比の維持がアルツハイマー病における認知機能低下の予防に重要であり、BBB障害がこの比に不利に影響することを示唆している。しかし、アスコルビン酸輸送キャリア機能障害(SVCT2)か、BBBの完全性の障害がそれに責任があるかどうかは、まだ議論の余地がある。
実際、認知症の高齢者に見られるBBBの完全性の喪失は、輸送が成功しても中枢神経系のアスコルビン酸を保持する脳の能力を阻害する可能性がある[131,132,133]。脈絡叢やニューロンにおけるSVCT2キャリアの遺伝的変異も重要な役割を果たしている可能性がある。これらのデータに沿って、最近のレビューでは、血漿中のレベルが低いにもかかわらず、アスコルビン酸の正常範囲内の脳脊髄液レベルは脈絡叢機能の維持と脳脊髄液へのアスコルビン酸の輸送を示していると結論づけられている [134]。
7. ベンチからベッドサイドへ
血漿中のアスコルビン酸レベルはアルツハイマー病患者では低下しており[135]、認知機能障害と低抗酸化状態との関連が蓄積されている。実際、食事摂取量の増加がアルツハイマー病発症のリスクを低下させる可能性が示唆されている。これまでのところ、疾患に関連する酸化ストレスが抗酸化物質の減少に関与しているのか、あるいは抗酸化物質の低さが疾患の進行に寄与しているのかは明らかにされていない。
しかし、アスコルビン酸の血漿中濃度は、軽度の認知障害とアルツハイマー病の両方の患者において、対照群と比較して低いことが明らかになった[136]。
栄養不足の認知症患者と抗酸化サプリメントを摂取している患者との間には、さらなる差が存在した。
ベンチからベッドサイドまで、8つの大規模な集団研究[57]では、ヨーロッパ諸国と米国の両方で、アスコルビン酸の摂取とアルツハイマー型認知症との関連性が調査されている。しかし、アスコルビン酸に関連する神経保護はまだ確立されていない。CHAP研究[137]によると、認知症のない高齢者の参加者のうち、縦断的に認知症を発症した者は一人もおらず、アスコルビン酸の補給が原因であった。対照的に、アスコルビン酸とビタミンEの補給は、アルツハイマー病のリスクを低下させるという相乗的な関連性が示された[138]。別の大規模集団研究では、血管性認知症と認知機能に接触した被験者においてアスコルビン酸の保護的役割が示されているが、アルツハイマー病ではアスコルビン酸の保護的役割は示されていない[139]。
ロッテルダム研究では、最大規模の集団研究[140]において、アスコルビン酸の摂取量の増加とアルツハイマー病の相対リスクの減少との間に最も一貫した関連が示されており、アスコルビン酸が最も枯渇している人(例:喫煙者)では関連の大きさが大きくなっていることが示された。同じ研究では、平均9.6年後のフォローアップ時にアルツハイマー病患者のビタミンEのレベルが低いことと関連があることがわかったが、単3形抗酸菌の摂取量には関連がなかった。
さらに、アルツハイマー病を含む11件の研究が血漿アスコルビン酸と認知機能低下との関係を検討しており、そのうち4件は脳脊髄液 アスコルビン酸および脳脊髄液対血漿アスコルビン酸比を検討した。Goodwin [29]の初期の研究では、患者をタータイルに従って血漿アスコルビン酸欠乏症に割り付けた。主な所見は、20μM以下のアスコルビン酸欠乏、軽度の認知障害、および健康な対照群と比較してアルツハイマー病患者との間の有意な関連を示唆した、たとえ共同病的疾患、年齢、および果物/野菜の摂取量を補正した後であっても。
Quinn [141]の研究は、平均脳脊髄液対血漿アスコルビン酸比が対照群と比較してアルツハイマー病患者で有意に低かったことを示した。脳脊髄液 アスコルビン酸、認知機能低下の割合、およびBBBのさらなるプロスペクティブ分析は、最終的な結論を導きないでしたが、より高い脳脊髄液対プラズマアスコルビン酸比は、低下の遅い速度と関連していた[57]。
逆に、いくつかの臨床研究では、アルツハイマー病患者の認知に対するアスコルビン酸の有益な効果は示されなかった。ノースカロライナ州の集団研究では、75歳以上の長老616人とアスコルビン酸の長期サプリメント使用者は、アルツハイマー病発症に対する神経保護を示さなかった[142]。しかし、食事の摂取量の記録は行われず、結果は、より少ない健康的な行動や社会経済的地位がより悪い認知アウトカムに関連付けられていたことを概説した。アスコルビン酸のレベルはグループ間で有意に差がなかったが、ビタミンEのレベルは対照群よりもアルツハイマー病群で有意に低かった。
一連の制限は臨床結果を解釈するためにカウントされるかもしれない。アスコルビン酸の摂取量、血漿中濃度、老化と認知への有益な効果に関する観察研究の間で実質的な矛盾がある。
注目すべきは、多くの臨床研究では通常、高齢者がポリファーマシーや併存疾患を持っている場合には除外されていることである。このような除外基準は、アスコルビン酸欠乏症のリスクが最も高い集団を除外し、結果の妥当性を決定的に損なっている。
高齢者集団の約17%がアスコルビン酸摂取量のRDAを満たしていなかったが、これは大規模な高齢者集団がアスコルビン酸の枯渇レベルを示していることを決定的に示唆している;この決定因子は、異なる臨床研究の不一致した結論にカウントされる可能性がある。特に、Harrison Fら[143]によって正確に要約されているように、アスコルビン酸の状態によるグループの分類は研究間で大きく異なっている。アスコルビン酸の欠乏度は11μmol/L以下で、最適濃度は11〜38μmol/L、28μmol/L以上のアスコルビン酸の適切な形質濃度、最適濃度は50〜60μmol/L(μmol/L:アスコルビン酸のmg/dL濃度からの換算係数56.78)となっている。
さらに、アスコルビン酸サプリメントの範囲は、27〜230〜270mg/日と大きく異なり、変動性の別の要素を導入している。
少なくとも、アスコルビン酸の高い摂取量は、500 mg/日を超えていない場合は、認知に有益な効果に関連付けられていた; アスコルビン酸のより高いplasmatic値(1 g/日)は、より悪い認知パフォーマンスに関連付けられてた。
アスコルビン酸の有益な効果には、繰り返し測定ポイントを用いた信頼性の高い形質値の決定が必要である。また、研究デザインや方法論の精度の欠如も、所見の信頼性に影響を与える可能性がある[57]。さらに、単一栄養摂取またはマルチビタミンの間の標準化の欠如、およびアスコルビン酸の形質レベルの系統的検出の欠如もまた、結果の精度に影響を与える。
さらに、特定のアスコルビン酸代謝の考慮が欠けていること、アスコルビン酸消費量の毎日の不正確な推定値、および適切な結論を導くための重要な決定因子である可飽和アスコルビン酸トランスポーターに起因する腸から血流への誤った吸収[57]。この結果のばらつきは、同等のアスコルビン酸摂取量にもかかわらず、SVCT2とSVCT1の多型による血漿中アスコルビン酸濃度の違いにも起因していると考えられる。この違いは、SVCT1/2遺伝子型がアスコルビン酸摂取量と循環アスコルビン酸濃度の関連において重要な役割を果たしている可能性を示唆している。さらに、食品摂取量と合成サプリメントの違いや、そのバイオアベイラビリティの平均値を明確に定義する必要がある。
また、現在のアスコルビン酸摂取量が被験者の生涯の習慣を正確に反映していない可能性があることにも留意すべきである。このように、臨床的脆弱性、認知予備能、併存疾患、特定のリスクプロファイルに応じて異なる高齢者集団を層別化することは、この分野に知識を加えることになるかもしれない[95]。同様に、老化と認知症を含む加齢に関連した特定の状態の間のプロオキシダントアスコルビン酸ステータスと抗酸化能力の間の変調についての理解を深めることが必要である。
現在のところ、臨床データからは一貫性のない結果が得られている。アスコルビン酸の補給は、栄養不足を回復させたり、ビタミン不足を予防したりする場合に有益な効果を示しており、通常の健康的な食事の上にサプリメントを摂取するよりも、アスコルビン酸不足を回避する方が有益である可能性が高い。
これまでのところ、脳の老化を有益に修正するために必要なアスコルビン酸のレベルはほとんどわかっていない。アスコルビン酸の欠乏と認知症を含む認知機能の低下との因果関係はまだ議論されており、2つの主要な問題が未回答である。すなわち、アスコルビン酸の欠乏対アルツハイマー病神経変性におけるそのepephenomenal役割の共因的役割はまだ確立されていない。しかし、アスコルビン酸の強力なフリーラジカル消去特性、輸送のよく特徴づけられた動態、および中枢神経系での良好なバイオアベイラビリティは、脳機能と健康的な老化を促進するためのその役割をさらに探求するための良好な背景を提供する。
最近の研究では、ニューロイメージングによる検査により、MEGA-PRESS媒介スペクトル(MEGA-PRESS、MEGA-point-resolved spectroscopy)を用いてアスコルビン酸の脳レベルを検出することが可能であることが実証されている[144]。この研究は、脳と血中アスコルビン酸レベルの関係を示唆し、今後の研究のための新しい概念的枠組みを提供し、脳におけるアスコルビン酸の役割をさらに探求する。
8. 結論
結論として、無作為化臨床試験では、アスコルビン酸を介した抗酸化療法活性とアルツハイマー病神経変性の遅延との関連を示すことはできなかった。
しかし、「シンク仮説」を評価することで、脳の健康的な老化を促進するためにアスコルビン酸が重要な役割を果たしていることが実証される可能性がある。血漿中のアスコルビン酸濃度、脳脊髄液中のアスコルビン酸濃度、アスコルビン酸/グルタミン酸の比率、アスコルビン酸関連キャリア(SVCT2 SNP)や脳内輸送障壁(BBB)の役割を解析することで、脳内のアスコルビン酸濃度を直接解析することで、この研究分野に大きな拍車をかけることができると考えられる。
また、脳内でアスコルビン酸が果たす構造的、代謝的、結合的な役割[144]についてのより深い洞察を提供し、全体像の解明に貢献することが期待されている。
さらに、動物モデルをさらに研究する必要があり、特に人間の生理学を模倣したグルノラクトンオキシダーゼノックアウトモデルに焦点を当てる必要があり、脳の健康的な老化を促進するための新しいアスコルビン酸の作用機序を特定するのに役立つかもしれない。
もう一つの興味深い研究分野は、神経変性におけるアスコルビン酸の役割を批判的に評価するために、アスコルビン酸とグルタミン酸輸送/NMDA受容体との間の保護関連に注目することである。
最後に、エピジェネティクスの分野は最近、なぜアスコルビン酸が血漿と比較して脳脊髄液および脳実質に不均衡に集中しているのかという疑問に答えている[28]。栄養はゲノムの最も強力な環境改変の一つである。最近の研究では、アスコルビン酸に特異的なエピジェネティックな役割があると評価されている。すなわち、5-mc(5-メチルシトシン)から5-hmc(5-ヒドロキシメチルシトシン)への酸化は、動的なDNA脱メチル化の一部として、TET(テン-イレブン転座)ジオキシゲナーゼ酵素によって触媒され、この酵素はアスコルビン酸が重要なコファクターである[23,145]。興味深いことに、他の抗酸化物質は、このようなエピジェネティックなメカニズムを表示しなかった。このように、アスコルビン酸は神経細胞の修復に不可欠であると考えられ、脳の老化や神経変性におけるアスコルビン酸の真の神経保護的役割を理解するための新しい分子メカニズムを提供している。
さらに、アスコルビン酸の分解の75%がメイラード分解経路(アミドAGEs)によるものであることが最近明らかにされている[146]。マイラードモデル系のメカニズムを知ることは、アスコルビン酸含有食品の貯蔵および加工中に生じる変化、ならびに生体内試験での修飾を理解するのに役立つ可能性がある。
このように、これらの研究のすべてのラインは、脳の老化におけるアスコルビン酸の役割の理解を向上させ、うまくいけば、近い将来にアルツハイマー病のための新しい概念的枠組みを提供する可能性がある。