Contents
Update on lactose malabsorption and intolerance: pathogenesis, diagnosis and clinical management
www.ncbi.nlm.nih.gov/pmc/articles/PMC6839734/
要旨
乳糖は、牛乳のカロリーの主なソース、不可欠な nutriedigestion、乳児期と成人期にこの二糖類を消化する能力を維持する集団の食事の重要な部分で内臓過敏症を持つ患者である。
ラクターゼ欠乏症(LD)は、小腸でガラクトースとグルコースに乳糖を加水分解する酵素を発現しないことである。成人白人におけるラクターゼの持続性の遺伝的メカニズムは、第2染色体上のLCTbo -13’910遺伝子座における単一のC→Tヌクレオチド多型によって媒介される。
乳糖不吸収(LM)とは、小腸で乳糖を消化および/または吸収できない原因を指す。これには、遺伝的な一次性のものだけでなく、感染症や小腸の粘膜の完全性に影響を与える他の条件による二次性のLDも含まれる。
乳糖不耐症(Lactose Intolerance: LI)とは、小腸炎患者において、乳糖摂取後に腹痛、腹部膨満感、下痢などの腹部症状が出現することと定義されている。LIの発症の可能性は、ラクトースの投与量、ラクターゼの発現、および腸内マイクロバイオームに依存する。ラクトース消化とは無関係に、不安を伴う内臓過敏症や過敏性腸症候群(IBS)の患者では、本症のリスクが高くなる。
LMとLIの診断には、遺伝子検査、内視鏡検査、生理学的検査などがある。自己申告によるLI、客観的所見と食事療法の臨床的転帰との関連性は様々である。LIの治療法としては、低乳糖食、ラクターゼ補充、プレバイオティクスによる大腸適応などがある。ラクトースは、同様のメカニズムで症状を引き起こす多くの吸収不良炭水化物の一つにすぎないため、これらの治療法の臨床的転帰は控えめである。
キーワード:ラクターゼ、吸収不良、機能性腸疾患、食事療法、水素呼吸試験
序論
1-3 乳糖の消化と不耐症のメカニズムを研究することで、腸の機能的な症状を引き起こす食事の原因だけでなく、人類の進化と栄養、文化、ライフスタイルについての洞察が得られている(ボックス1)。
最近のエビデンスでは、乳糖消化がヒトのマイクロバイオータと一般的な健康に与える影響が実証されている。これらの問題を考慮すると、乳製品を使用しない食事の可能性が懸念されている。このレビューでは、この状態の臨床診断と管理における最近の進展を強調する(箱2)。
ボックス1 乳糖異常吸収の病態生理
- 乳糖不吸収は、一般的に乳児期以降のラクターゼのダウンレギュレーションによって引き起こされるが、これは白人ではLCT -13’910:C/C遺伝子型によって媒介される。
- ラクターゼ非持続は遺伝的な野生型であり、病気ではない。ラクターゼの持続性と非持続性の両方は、健康なヒトでは一般的な表現型である。
- ラクターゼ遺伝子領域は、過去1万年の間に人類の進化によって最も強く形成された遺伝子領域の一つであり、ラクターゼの持続は、1世代あたり最大4%~5%の選択的優位性を提供している。
- LCT-13’910は、ヒトゲノムの中で腸内細菌叢との相互作用が最も強い領域である。LCT -13’910:C/C遺伝子型は、乳糖消費におけるより高いビフィズス菌レベルと関連している(ビフィドゲン効果)。
- 遺伝学的および生理学的研究では、ラクターゼ持続性を有する個体では骨密度が高く、身長が大きいことが示唆されている。
ボックス2 乳糖不耐症の臨床的関連性
- 乳糖不耐症は、乳糖不吸収の個人における乳糖曝露時の症状として定義される。
- 乳糖不耐症のほとんどの人は、少なくとも12gの乳糖(牛乳250mLに相当)の用量であれば問題なく耐えられる。これ以上の量は、食物と一緒に摂取するか、または1日にかけて摂取する場合には、許容できるかもしれない。
- 乳糖不耐症の症状は、多くのIBS患者にみられるように、刺激の強さ(すなわち、乳糖の投与量)と内臓過敏症の有無によって異なる。
- 乳糖不耐症の治療法としては、低乳糖食、経口ラクターゼ酵素補充、大腸内で細菌性ラクターゼを産生するプレバイオティクス、および潜在的には大腸微生物叢を適応させるプレバイオティクスがある。
- 低中等度のラクトース用量の不耐性は、しばしばIBSの存在を示す。このような患者は、吸収の悪い発酵性食品(「FODMAP」)に敏感である。このグループの効果的な食事療法は、低乳糖ではなく、低FODMAP食を必要とする。
FODMAP、発酵性オリゴ糖、二糖類および単糖類およびポリオール。
乳糖は牛乳の主な糖質
乳腺による乳生産は哺乳類の特徴であり、乳糖(「乳糖」;β-ガラクトシル-1,4グルコース)は、ヒトの乳および他の哺乳類の乳の主な炭水化物源である。
乳児は乳糖ベースの栄養に特異的に適応している。無作為化比較試験では、母乳または乳糖ベースの粉ミルクを与えられた乳児は、乳糖を含まない粉ミルクを与えられた乳児と比較して、血中のグルコースおよびその他の栄養素(アミノ酸など)のレベルが高かった5 。近年、これらの地域では牛乳の消費量はわずかに減少している。一方、中国や多くの開発途上国では、牛乳の摂取量はエネルギー摂取量に占める割合はわずか 4%に過ぎないが、消費量は急速に増加している3。
牛乳には100mLあたり約5gの乳糖が含まれており、一般的な250mLでは12.5gの乳糖が含まれている。乳糖は、ヨーグルトやチーズなどの培養乳製品(アルコールに次いで2番目に大きな発酵産業)にも含まれている3 。ヨーグルトには未加工乳の約50%の乳糖が含まれているが、チーズには乳糖含有量が低く、特に熟成期間の長い製品を摂取する場合には、乳糖含有量が低くなる3 。さらに、ラクトースパウダーは典型的な加工食品にもよく見られる添加物で、ソーセージ、肉汁、マーガリン、パン、ソース、その他多くの調理済み食品の食感や風味を高める(表1)。
表1 乳製品・食品中の乳糖含有量(代表値を記載している)
| 食物 | 100gあたりの乳糖含有量(g) | 典型的なサービングあたりの乳糖含有量(g) |
| 牛乳(フル) | 4.7 | 15 |
| ミルク(スキム) | 4.8 | 15 |
| 乳糖を含まない牛乳 | <0.1 | <0.1 |
| 山羊乳 | 4.5 | 13 |
| バターミルク | 3.0 | 9.0 |
| バター | 0.5 | 0.1 |
| ヨーグルト(フレッシュ) | 3.0 | 9.3 |
| ヨーグルト(生物学的) | 4.0 4.0 | 9.5 |
| クリームチーズ | 3.0 | 0.9 |
| ソフトチーズ(例、カマンベール) | 0.3 | 0.1 |
| ハードチーズ(例、チェダーチーズ、グリュイエールチーズ) | 0.1 | <0.1 |
| クリーム | 3.6 | 3.2 |
| ソフトクリーム | 6.4 | 5.7 |
| ラテマキアート | 4.3 | 8.6 |
| ラザニア | 1.1 | 2.62.6 |
| チーズバーガー | 0.9 | 1.1 |
| レディソース | 3.6 | 4.5 |
| プリン/カスタード | 3.6 | 4.5 |
| 米、ナッツ、大豆またはオート麦飲料 | 0.0 | 0.0 |
肉類とその代替品には乳糖がほとんど含まれていない。乳糖を含む可能性のある製品は、牛乳や乳製品を使用して調理されたもので、加工肉、ソーセージ、パン粉や衣をつけた肉や魚、市販の卵の代用品、スクランブルエッグ、スフレなどがある。
油脂類には乳糖はほとんど含まれていない。乳糖を含む可能性のある製品は、乳または乳またはホエイパウダーで作られたバターやマーガリン、サラダドレッシング(例:ランチスタイルまたはバターミルク)などの乳または乳製品で調製されたものである。
牛乳または乳製品で作られた惣菜には、乳糖が含まれている場合がある。これには、店で購入したグレービーソースやソースミックス、野菜やチップスのディップ、スープ、チップス、スナッククラッカー(チーズ味など)人工的なホイップのトッピング、粉末状の食事代替サプリメント、クリームベースのリキュールなどが含まれる。
乳糖の消化と吸収
ラクトースの消化吸収は小腸で行われる(図 1)7 8 ラクターゼ-フロリジンヒドロラーゼの主な基質であり、絨毛のブラシ縁に発現し、その発現は結腸中部で最も高い。この酵素は成熟腸球の先端膜にまたがっており、2 本の同一の細胞外 160 kDa ポリペプチド鎖と短い細胞質内部分から構成されている。この酵素のα-グルコシダーゼ活性は、乳糖二糖をグルコースとガラクトースという単糖に切断し、ナトリウム(+)/グルコース(ガラクトース)共輸送体(SGLT1)によって上皮細胞(腸球)に積極的に輸送する。9 腸球からグルコースは、拡散を促進することで周囲の毛細血管
図1 乳糖の吸収不良の生理。SCFA、短鎖脂肪酸
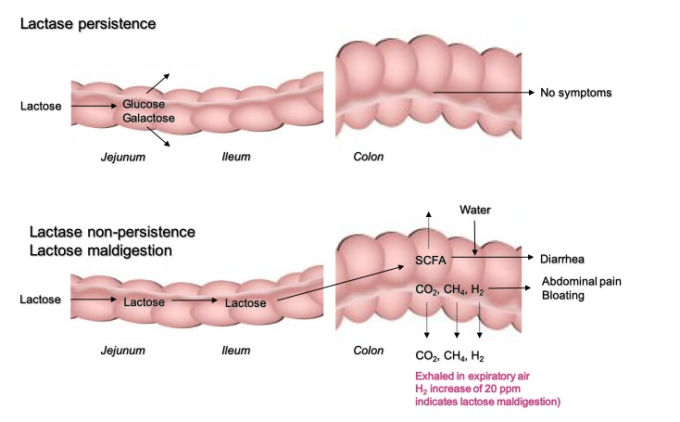
ラクターゼ欠乏症と乳糖悪吸収
乳糖代謝に関連する用語が混同されていることが多く、混乱を招く可能性がある(表2)。
ラクターゼ欠乏症(LD)とは、小腸の筆界にラクターゼが発現していない状態をいいます。
ラクトース不耐症(LM)とは、小腸で乳糖を消化・吸収できない原因のいずれかを指す。
ラクトース不耐症(LI)とは、LM患者において、乳糖摂取後に腹痛、腹部膨満感、下痢などの症状が発現することをいう。
表2 乳糖不耐症 ラクターゼ欠乏症、乳糖異常症、乳糖不耐症に関連する定義付き用語集
| 概念 | 定義 | |
| 先天性ラクターゼ欠損症 | CLD | ラクターゼの発現の欠如と出生直後の重度の症状につながる非常にまれな遺伝性疾患(通常はフレームシフト変異) |
| ラクターゼの非持続性 | LNP | 人生の最初の20年間の腸のラクターゼ発現の減少。世界中のほとんどの個体の表現型(生物学的野生型) |
| ラクターゼ持続性 | LP | 乳児期を超えた腸ラクターゼ発現の継続的な発現; 西洋諸国における優勢な表現型。 |
| ラクターゼ欠乏症 | LD | 小腸でのラクターゼ発現が低いため、大量の乳糖を消化できない |
| 乳糖吸収不良 | LM | LDまたは他の病状(例えば、高速輸送)の結果としての大腸へのラクトースの通過 |
| 一次乳糖吸収不良 | ラクターゼの非持続性による乳糖の吸収不良(世界中で優勢な表現型)。 | |
| 二次乳糖吸収不良 | 通常、腸の炎症の状況でのラクターゼ発現の低下による乳糖吸収不良(可逆的である可能性があります)。 | |
| 乳糖不耐症 | LI | 適切な検査(理想的には盲検検査)によって決定された乳糖摂取後のLM患者における腹痛、腹部膨満、下痢などの典型的な腸症状の出現。 |
| 機能性乳糖不耐症 | 乳糖吸収不良のない個人における乳糖チャレンジに対するLIの症状。 | |
| 自己申告による乳糖不耐症 | SLI | LMまたはLIの正式なテストを行わないLI症状の病歴。 |
先天性ラクターゼ欠乏症は、乳児に重篤な症状と成長不全を引き起こす非常に稀な小児疾患である。小腸のラクターゼ活性は出生時にピークに達するが、ほとんどの集団では小児期に低下し、離乳が促進されると考えられている。しかし、一部の個人では、高いラクターゼ活性が持続し、成人になっても大量の乳糖の消費を可能にしている。強調しておきたいのは、世界的に見て、ほとんどの人がLNPと表現型のLDとLMを持っているということである(図2)。このように、LNP、LD、LM は病気ではなく、ヒトの代謝の正常な変異体である11 。LM の他の原因としては、二次性(後天性)LD、小腸の急速な通過、小腸細菌の過剰増殖などがある。
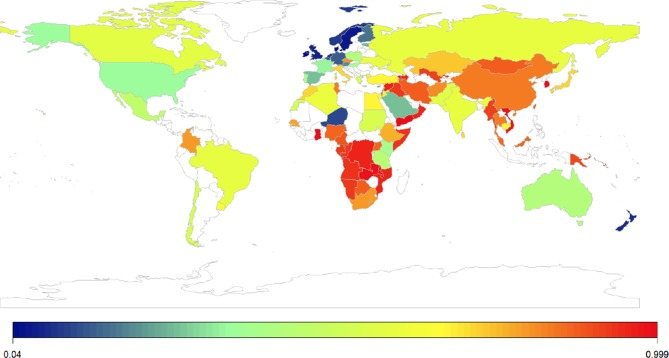
図2 乳糖不吸収の世界的有病率
オンライン補足1では、疫学的情報を得るために使用された調査方法(例えば、遺伝子検査や呼気検査)の観点から証拠ベースを分解している。オンライン 2 には、完全な参考文献リストが掲載されている。
補足データ
原文参照
LM(一次性または二次性)の場合、未消化の乳糖は腸内微生物と接触する。乳糖を細菌が発酵させると、水素(H2)二酸化炭素(CO2)メタン(CH4)短鎖脂肪酸(SCFA)などのガスが発生し、GI機能に影響を与える(図1)。
乳糖不耐症
乳糖不耐症(LI)の前提条件として、乳糖不耐症(LM)がある。しかし、この2つを混同してはならず、症状の原因は別々に考えなければならない。乳糖不耐症の多くの人は、標準的な乳製品を摂取しても症状がないのに対し(表1)乳糖を摂取した後に腹痛、ボルボリーグミ(お腹が鳴る)腹部膨満感などの症状(「不耐症」)が現れる人もいる(図1)。これらの症状の発症は、呼気検査時の水素ガスの出現と強く相関している12。さらに、小腸で未消化の乳糖は、水の浸透圧トラップにつながると大腸の浸透圧負荷は、SCFA.13 14に乳糖のそれぞれの負荷は、発酵のための大腸微生物の容量を超えている場合、下痢が発生するまたはSCFAの負荷は、resorption.15のための結腸の容量を超えている。
乳糖摂取後に症状が発現する可能性は、多因子性である(図3)。
外因性因子には、摂取した乳糖の量や、乳製品が他の食品と一緒に摂取されているかどうかなどが含まれ、腸管通過や大腸への乳糖の送達速度に影響を与える。
内因性因子には、小腸のブラシ境界におけるラクターゼの発現、GI障害または腹部手術の既往、および腸内マイクロバイオームの構成が含まれる。
試験管内試験でラクトースとインキュベートした場合、ラクトース不耐症の被験者の糞便サンプルは、ラクトース不耐症の被験者のサンプルに比べて、より速く、より高いSCFAの産生を媒介した16 17 。さらに、腸管の嫌気性環境では、還元性等価物の生成は急速な水素生成をもたらし、いくつかの臨床研究では、ガス生成量は腸管症状の存在と重症度と相関していた18 19 。これらには、不安障害の存在、高レベルの心理社会的ストレス、IBSのような機能的なGI障害の存在が含まれる(図3および4)。
図3 乳糖不耐症症状の病態モデル
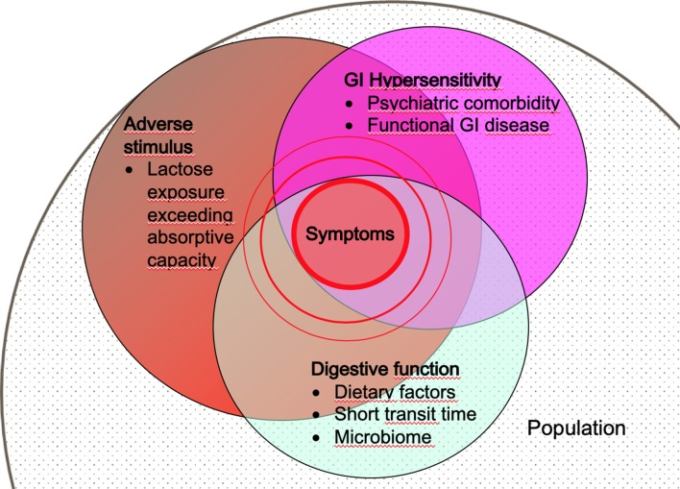
ある集団では、ごく一部の人が乳糖不耐症の原因となる消化機能障害を有する。この集団の中で、不安障害や内臓感度を高めるGI疾患を持つ人は、ラクトースチャレンジに対してより感受性が高い。このモデルでは、症状を発症するリスクは、ラクトースの用量、消化機能障害の重症度(ラクトース不吸収)および内臓感度に応じて増加する。この疾患モデルは乳糖に限定されるものではなく、他のFODMAP、発酵性オリゴ糖、二糖類、単糖類、ポリオールと共通している可能性が高い。
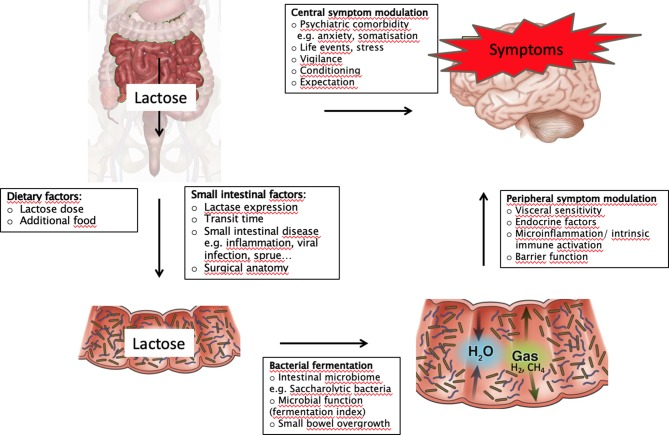
図4 ラクターゼ持続性およびラクターゼ欠乏症患者におけるラクトース消化のメカニズムモデルから、ラクトース悪吸収、内臓過敏症および症状との関係を明らかにした。
乳糖発酵の産物もまた、腸外症状の引き金となる可能性がある。機能性胃腸障害の臨床診断を受けた2000人以上の患者の結果をまとめた最近のレビューでは、乳糖または果糖摂取後に疲労感や頭痛などの神経学的症状が高頻度でみられることが報告されている20。しかし、これらの患者は非特異的な体性不定愁訴の有病率が高く21,プラセボ対照がなく、H2産生と症状の間に統計的な関係がなく、機序的な説明がなされていないことから、神経学的症状の発生がLMによって引き起こされたかどうかは不明である20。
疫学
最近のメタアナリシスでは、LM の有病率は世界全体で 68%と推定され、水素呼吸検査(HBT)よりも遺伝的検査の方が高いと報告されている22 。LM は北欧諸国で最も低く(デンマークでは 5%未満)韓国および漢民族で最も高い(100%に近い)。LMは地域レベルで大きなばらつきがあり(図2)これらの集団における遺伝的遺産と一次性LDの有病率を反映している22。LIの検査はより複雑で、大規模で厳選された集団での標準化された水素呼気検査を必要とするため、LIの有病率は不明である。
遺伝学
白人集団では、ラクターゼ持続性(LP)は、第2染色体上のラクターゼ遺伝子(LCT-13’910:C→T, ”T’ for tolerance”)の13.9kb上流の機能増加変異に起因している。この一塩基多型(SNP)は、無関係な遺伝子のイントロン内のタンパク質形成ユニットのはるか上流に位置している(図5A)23 。
図5 ラクトース不吸収の遺伝学
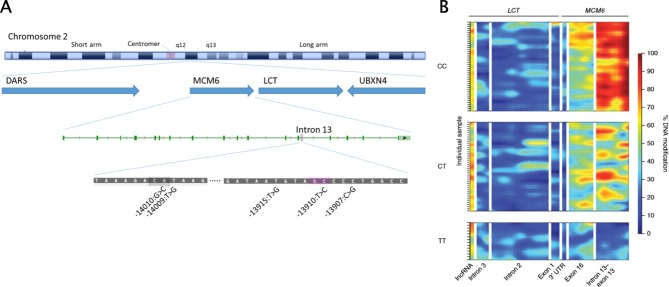
A)第2染色体上のラクターゼ遺伝子座の組織。ラクターゼ遺伝子(LCT)と隣接遺伝子アスパラチルtRNA合成酵素(DARS)ミニ染色体維持複合体コンポーネント6(MCM6)およびUBXドメイン含有タンパク質4(UBXN4)の位置を示す。ラクトース不吸収に関連する多型は、ラクターゼ遺伝子の上流にあるMCM6遺伝子のイントロン13内に位置している。
B)遺伝的乳糖不吸収(LCT -13910:C/C)乳糖耐性(LCT -13910:T/T)および臨床的にサイレントで、生理学的に中間的な遺伝子型LCT -13910:C/Tを有する個体におけるMCM6遺伝子のイントロン13およびLCT遺伝子のメチル化のレベルの差。ハイパーメチル化(赤色)は、それぞれの遺伝子の遺伝子サイレンシングをもたらす。出典:Labrieら26より)。
遺伝的LPは優性遺伝子型と考えられ、2つのLCT-13’910:C対立遺伝子を有する個体のみがLNPを有すると考えられるべきである。しかし、LCT-13’910:CT遺伝子型を持つヘテロ接合体は、LCT-13’910:TT遺伝子型を持つ個体よりもHBT中のH2レベルが高いかもしれない25 。対照的に、ラクターゼ遺伝子のエピジェネティックな制御が重要であるように思われる。小腸腸球におけるLCT-13’910:C/T多型の領域のメチル化パターンは、遺伝子型によって強く異なり、LNP遺伝子型では80%以上の修飾からLP遺伝子型では20%にまで変化している(図5B)。また、LCTプロモーターのメチル化は出生後は低いが、LCT-13’910:Cの存在下では小児期に増加し、LCT-13’910:Tの存在下では増加しないことが示されている26 。このように、LNPは、DNA配列の変化が年齢に依存したメチル化のステージを設定し、それが後に臨床表現型をもたらす、複雑な疾患にも適用可能なメカニズムの良い例です27。
LCT-13’910:T SNPは、ヨーロッパやアジア近辺の多くの地域でLPに関連しており、同じハプロタイプに存在しており、単一の突然変異が急速に広まっていることを示している28。アフリカと中東では、同じ遺伝子領域の異なる突然変異がLP1 29の原因となっており(表3)収束的進化を示している。
表3 ラクターゼの持続性とLM1に影響を与える遺伝的変異
| ラクターゼ持続症に関連する変異 | 地理的地域 | SNP |
| LCT −13’910:T * | 北欧 | rs4988235 |
| LCT −13’915:G | 中東 | rs41380347 |
| LCT −13’907:G | エチオピアとスーダン | rs41525747 |
| LCT -14’009:G | エチオピアとスーダン | rs820486563 |
| LCT -14’010:C | ケニア、タンザニア、南アフリカ | rs145946881 |
*この変異はLCT -22’018-A変異と強い連結不平衡状態にある。ラクターゼの持続性には-13’910変異が関与していることがメカニズム的に証明されている。
LM、ラクトース不吸収;SNP、一塩基多型。
出典。SegurelおよびBon 1からの引用
LPの選択圧力が強いことを示す説得力のある遺伝的証拠がある。これは、最近の人類の進化において観察された遺伝子の中で最大の選択圧力の一つであり、マラリアの抵抗性遺伝子(4%~9%)ヨーロッパ人の皮膚の色素沈着(3%)高地のチベット人集団の低酸素反応に関連する遺伝子と同じ程度の大きさです1。
乳児期以降に乳糖を消化する能力があるため、牛乳は栄養源(カロリー、タンパク質)となり、きれいな水も大人になってから手に入るようになった。これは飢饉の時期には重要な意味を持っていたと思われる。しかし、LM患者の多くは症状を発症することなく250mLの牛乳を摂取することができ、牛乳をヨーグルトやチーズ、バターに加工するとLPの利点がさらに減るため、なぜLPがこれほどまでに体力を向上させたのかは明らかになっていない。さらに、一般的に軽度の腹部症状を伴う LNP の「コスト」は控えめであると思われ、LNP 患者は乳糖の大腸微生物叢に対するプレバイオティクス活性により、牛乳の消費からも恩恵を受ける可能性がある。
これらを総合すると、牧畜化が進んだ後、ラクターゼ遺伝子座で印象的な選択圧力が生じ、世界の多くの地域でLPが好まれたことがわかる。
二次的な乳糖の吸収不良
33 34 ラクターゼは腸絨毛の先端に位置しているため、腸管障害を受けやすく、特に新生未熟な腸球はラクターゼ欠乏症であるため、腸管障害を起こしやすい6 。
感染性胃腸炎による二次性胃腸炎は一過性であることが多く、特にミルクを主食とする乳児においては、二次性胃腸炎の発生率が高く、臨床的にも関連性がある35 。ロタウイルス感染患者 126 人とロタウイルス陰性の対照群 62 人を対象とした小児科研究(平均年齢 12 ヶ月)では、二次性胃腸炎の頻度は前者の方が高かった(60% vs 49%、p=0.002)36。 37 システマティックレビューでは、乳糖を除外することで小児の急性下痢の持続時間を1日まで短縮し、「治療の失敗」(RR:0.5,95%CI:0.4~0.7)を減少させると結論づけられているが、研究では予定外の点滴注射や3日後の持続的な便の重量が30g/kgを超えることが必要とされている。
IBDでも同様の結果が見られるが、より持続的である。メタアナリシスでは、IBD患者における二次性大腸炎の全生存率は1.6(95%CI:1.0~2.6,p=0.048)であり、小腸に影響を及ぼすクローン病(CD)で最も高い値を示している。セリアック病の新規診断を受けた患者ではラクトースHBTが陽性であることが多いが、多くの患者ではグルテンフリーの食事を6~12ヵ月間続けると乳糖の消化能力が回復する。EEDは、酵素欠乏、吸収不良、栄養不良に伴う腸管の萎縮とバイオシスを特徴としている。
乳糖の吸収不良と微生物相
人体には約40兆個の細菌が生息しており、そのうち約99%が大腸内に存在している。LM患者では、糖分解菌(「糖を消化する」菌)による乳糖の発酵が、腹部症状を引き起こす可能性がある(図1および4)。しかし、このプロセスには利点もある。SCFAおよびその他の発酵産物は、大腸の健康に必要であり、そうでなければ難消化性の炭水化物から追加のカロリーを解放する。さらに、腸内細菌叢は乳製品の摂取を容易にするために適応する。その結果、ラクターゼの発現は乳糖の摂取によってアップレギュレートされないが、乳糖の定期的な摂取は呼気水素排泄を減少させ、乳糖不耐症の症状を減少させるようである44。46 健康な日本人を対象とした大規模研究では、ビフィズス菌の豊富さと乳製品の摂取量が正の相関を示した。
最近のデータでは、ヒトの遺伝子と微生物相の相互作用が指摘されている。ヒトの遺伝子変異と微生物相との関連研究では、現在までのところ、最も一貫して記述されているのは、LCT-13’910:C/T SNPとビフィズス菌の豊富さとの関連である48 -50。 -50 乳糖の微生物発酵によって産生されるSCFAは免疫調節、51 グルコースと脂質のホメオスタシス、52 大腸球の分化53 に関与しており、ホメオスタシスと腸・脳の調節に影響を与えることから、このような相互作用は実用的な意味合いを持つかもしれない。
乳糖不耐症とIBS
LI と IBS の関係は、遺伝子検査で 100%に近い LNP を持つ華南の集団で広範囲に研究されている。乳糖不耐症の患者では、呼気中の水素ガスの出現と膨満感、痛み、その他の症状の報告との間に非常に強い相関関係があったが、呼気中の水素ガスの量と症状の重症度との間には非常に弱い相関関係があった。しかし、呼気中の水素ガスの量と症状の重症度との間の相関ははるかに弱かった。ヨーロッパの集団における予備的な知見57 と一致し、IBS患者では、特に通常の食事に含まれる低~中等度の用量で、症状のリスクと重症度が大幅に上昇するということが重要な観察結果であった。機能性胃腸障害の患者の多くは心理的な併存性があり、消化管に影響を与える食事や物理的刺激に対して過敏になっていることはよく知られている。21 58 更なる研究では、不安、内臓過敏症(直腸バロスタットによって定義される)および呼気検査での高レベルのガス産生のすべてが、20gのラクトースを摂取した後の腹部症状の重症度を増加させることが実証されている19。さらに、回腸および結腸からの粘膜生検では、乳糖感受性患者の肥満細胞および上皮内リンパ球の数の増加が示され、乳糖摂取後の炎症性サイトカイン(例えば、腫瘍壊死因子)の放出が対照群よりもこの群で高いことが示された59。
これらの観察結果は、感染後のIBS58と類似しており、食物不耐症だけでなく、より一般的に機能的なGI症状の病態生理学的基礎を明らかにしている。60-62 LIとIBSの患者は似たような症状を訴え、心理的併存率が高く、自然粘膜免疫系が活性化していることを示している。さらに、両者とも同様の食事療法に反応する(下記参照)。これらの証拠を合わせると、敏感な(「過敏性」の)腸を持つ感受性の高い個人が、低用量の乳糖(図3)のような中等度の刺激にさえさらされると症状を発症するという共通の病理学的基盤があることが示唆されている。
乳糖不耐症とQOL
他の機能性胃腸障害と同様に、LIは些細な症状ではなく、生活の質や栄養に悪影響を及す。不安は乳糖摂取後の症状(「不耐症」)のリスクを高めるが、食物が膨満感や痛み、下痢の引き金になるのではないかという恐怖も不安の原因となる。実際の研究では、乳糖症患者だけでなく、乳糖症と診断された患者であっても、乳糖症と診断されていない人は、食物不耐症の心配がない人に比べて、生活の質が低いという結果が出ている61。62 この不安は他の食物にも及んでおり、LI患者はしばしば様々な製品、特に膨満感の原因となることが知られている製品(例:豆類やドライフルーツ)に対する不耐性を述べている。
乳糖の吸収不良と不耐症の検査
乳糖消化の5つの試験が利用可能であり、それぞれがプロセスの異なる側面を調査し、特定の長所と短所を持っている(表4)。
表4 乳糖の吸収不良のために利用可能な診断検査の簡単な特徴
| 水素呼気検査 | 乳糖不耐症試験 | 十二指腸ラクターゼ活性 | 血清ガキシロースまたは尿ガラクトーステスト | 遺伝子検査 | |
| 乳糖チャレンジ | はい | はい | 番号 | はい(ガキシロース) | 番号 |
| 症状とLIの評価 | はい/可能 | はい/可能 | いいえ/不可能 | いいえ/不可能 | いいえ/不可能 |
| テストの原則 | Hの検出2呼気中 | 乳糖チャレンジ後の血漿グルコースの増加 | 十二指腸生検におけるラクターゼ酵素活性 | ラクターゼによる経口投与された4-ガラクトシルキシロース(ガキシロース)の切断後の血清中のD-キシロースまたは尿中のガラクトースの検出 | -13910 C / T多型の検出 |
| 二次LMの検出 | はい | はい | はい | はい | 番号 |
| 費用 | 低 | 最低 | 高(内視鏡検査の費用が含まれている場合) | 中級 | 高い |
| 制限事項 | Hによる偽陰性試験2 -non-プロデューサー。SIBO、高速輸送、腸の解剖学的構造の変化による偽陽性テスト | グルコース代謝の障害、腸の解剖学的構造の変化 | ラクターゼの斑状発現 | 文献における変動するテストパフォーマンス。SIBO、高速輸送、その他の条件による偽陽性テスト | 非定型突然変異の存在下での偽陰性(非白人集団に関連) |
| 最有効使用 | LMと症状(LI)を評価するための最適なテスト | 低リソース設定、LM疫学 | 他の理由で胃内視鏡検査が行われる場合 | 決断される | LD / LNP疫学 |
LD、ラクターゼ欠損症; LI、乳糖不耐症; LM、乳糖吸収不良; LNP、ラクターゼ非持続性; SIBO、小腸細菌
遺伝学的検査は、静脈血または頬布サンプルから抽出したDNAのリアルタイムPCRまたはシークエンスを適用し、疫学研究に最も適している。白人では、LPはLCT-13910:C/T多型によってほぼ一様に媒介されており、遺伝子検査は遺伝的なLNPを検出することができる。しかし、アフリカ系やアジア系の患者では遺伝的状況はより複雑であり(表3)これらの集団では現在のところ臨床目的での遺伝子検査は推奨されていない。重要なことは、二次性LMは遺伝子検査では検出されないということである。
腸管生検のラクターゼ酵素活性検査は、一次性および二次性のLMを検出する。この目的では鎮静下での内視鏡検査は適応外であるが、他の理由で内視鏡検査が必要な場合には、この検査を行うことができる。ラクターゼ活性はパッチ的であり、最適な検査精度を得るためには1回以上の生検が必要となることに留意すべきである。
65 乳糖HBTは、標準量の乳糖を経口投与した後の呼気中の水素の排泄量を測定する。水素は哺乳類の酵素では生成されないため、水素の存在は糖と細菌との接触を示すが、小腸細菌の過剰増殖を除外することはできない。臨床では、20~25 g の乳糖の中間的な投与量が最適であると考えられる。56 ベースラインの H2 値が 20 ppm 未満であることが信頼性の高い検査の要件であり、3 時間以内に 20 ppm 以上の上昇があれば LM の診断となる。66 観察時間の短縮は感度を損なうが、有効な結果を得るためには 4 回の測定(0,90,120,180 分)しか必要としない。67 H2を産生しない微生物群は、偽陰性のHBTを引き起こす可能性がある。これらの個体の中には、メタン原性細菌(例えば、Methanobrevibacter smithii)が4:1の比率で水素をメタン(CH4)に変換し、結果としてH2の排泄量が減少し、陽性検査の割合が低下する。66 メタンの同時評価は、この限界を部分的に克服することができる。したがって、CH4 の増加はしばしば低く(20 ppm未満)症状との相関がないにもかかわらず、H2/CH4 の複合測定を推奨する著者もいる66 68 より信頼性の高いアプローチとしては、13C-ラクトースを使用し、ラクトース消化のマーカーとして 13CO2 を、LM のマーカーとして H2 を同時に呼気測定する方法がある(図 7)。
図6
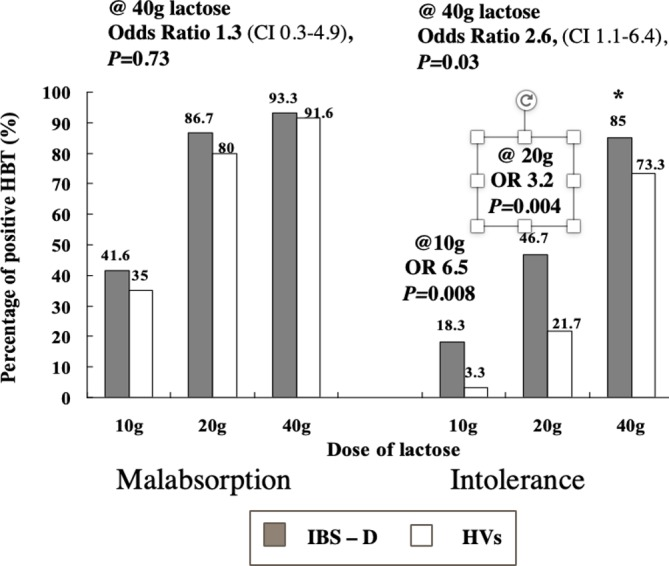
乳糖不吸収を有する個体の症状は、乳糖用量と内臓過敏症に依存する。腹部症状の既往歴のない HV と IBS-D 患者を含む中国人集団(100% 原発性ラクターゼ非持続)を対象に、異なる乳糖用量(10,20,40 g)の乳糖を 3 回、盲検で検査した。臨床的にHBTが陽性となる可能性は、低用量および中間用量の乳糖でIBS-D患者の方が高かった。HBT、水素呼吸試験、HV、健康なボランティア、IBS-D、下痢を主とする過敏性腸症候群。 (出典:Yang er al)。56からの引用)
図7

乳糖不耐症の患者を対象とした水素呼気試験の結果で、同時に評価症状とH2レベルがあり、微生物学的に乳糖が発酵していることが示された。H2値がベースラインより20ppm以上上昇した場合は、乳糖不耐症を示する。13C標識ラクトースが投与された場合、13CO2レベルは、被験者による13C標識ラクトースの吸収および代謝を示す。これらのマーカーの上昇に続く腹部症状の患者の報告は、乳糖不耐症の診断になる。
ラクトース耐性試験では、50gのラクトースを摂取した後、異なる時間(例えば,0分、30分、60分、120分)に血漿中のグルコースを測定する。この検査は複雑で高価な機器を必要としないが、侵襲的な性質(複数の血液サンプル)があるため、その有用性が制限されている。携帯用グルコース測定器を用いた毛細管血液測定を使用することで、この検査の侵襲性は低くなるが、静脈血の測定と同じ診断精度は得られない。
ガキシロース検査では、尿または血液中のD-キシロースの測定とともに、ラクターゼ基質のガキシロース(4-ガラクトシルキシロース)の投与を行う。概念的には、小腸全体の活性が測定されるため、ガキシロース測定は腸内ラクターゼの評価に理想的です71 。メーカー主催の試験では、十二指腸生検と比較して、ガキシロース検査の診断精度(0.93)はHBT(0.85)やラクトース耐性検査(0.79)よりも高かった71 。
乳糖不耐症の検査
遺伝子検査、酵素検査、ガキシロース検査の大きな限界は、LMは健康な人に多く、陽性であっても症状の原因がこの状態にあることを確認できないことである。このため、消化機能や患者さんの症状に関する合理的に信頼できる情報が得られるため、当院ではHBTが選択される方法となっている。
73 米国国立衛生研究所のコンセンサス会議では、LIを「LM患者が盲検化された単回投与で乳糖を摂取した後に、区別のつかないプラセボを摂取した場合には観察されない消化器症状の発症」と定義している74 。臨床研究以外ではほとんど行われていないが、臨床現場では、自己申告したLIの症状と乳糖消化検査の客観的所見との間には相関関係が低いため、盲検化試験は有用であろう。
60 「盲検多回投与チャレンジ」は、乳糖の消化に関してだけでなく、個人が「安全に」摂取できる乳糖の量を明確にすることができるであろう(図6)。 5と25g、それぞれ250mLと500mLの牛乳に対応している)。しかし、我々の知る限りでは、盲検化された家庭での検査は日常臨床では行われていない。食事療法の結果を予測する食物不耐症について、十分に理解され、実用的で費用対効果の高い調査が必要であることは、機能性胃腸障害における重要な臨床上の課題である。食事療法の結果を予測する能力は、適切な症状評価の指標となるだろう。
治療法の選択肢
乳糖不耐症の治療は、患者の症状を改善し、長期的には栄養不良や栄養不良のリスク を回避することを目的としている(図8)。しかし、スプルーや食物アレルギーの管理とは対照的に、乳糖不耐症の患者は、症状がなくても250mLの牛乳(乳糖12g)まで、食物と一緒に摂取した場合はそれ以上の量を許容することが多いため、厳密な乳糖不耐症の食事は必要ない。
図8 乳糖不吸収と乳糖不耐症の管理
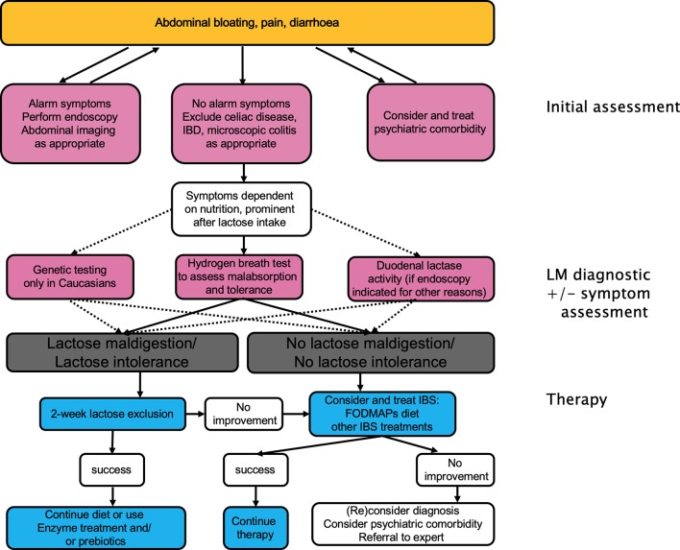
FODMAPs、発酵性オリゴ糖、二糖類、単糖類、ポリオール
大腸微生物叢の操作による乳糖耐性の改善は、プレバイオティクスの摂取によっても達成される可能性がある。76 微生物学的検査では、GOS治療により乳糖発酵を行うビフィズス菌が一過性に増加し、ビフィズス菌レベルと腹痛との間に負の相関関係があることが明らかになり、牛乳の再導入により、Roseburia属の増加を含む細菌組成のさらなる変化が促された。
乳製品にラクターゼを添加したラクトースフリーの乳製品は広く入手可能であり、安全であると考えられているが、アレルギー反応が報告されている78 。乳製品のラクターゼ処理はまた、乳糖の結晶化を減少させ、甘みを増し、ヨーグルトの生産のための発酵を促進する79 。
80 錠剤によるラクターゼ補給は、効果は中程度ではあるが(例えば、18%の症状の全体的な減少82)乳糖の消化(H2 産生の減少)と症状の両方を改善する81 82。別のアプローチとしては、腸内でラクターゼを産生するラクトバチルス属、ビフィドバクテリウム・ロンガム、ビフィドバクテリウム・アニマリスなどのプロバイオティクスを摂取することである。この治療法の最近の系統的レビューでは、全体的に良好な効果が確認されたが、効果の大きさはラクターゼ補充よりも一貫して優れているわけではなく、研究の質も低かった83。
多くの臨床研究では、乳製品の摂取量を減らしたり、ラクターゼを補充したりする治療を行っても、HBTでLIを発症した患者のうち、症状が満足に改善したと報告しているのは少数派にすぎない。多くの臨床研究では、乳製品の摂取量を減らしたり、ラクターゼを補給したりして治療後に満足のいく症状改善を報告している患者は少数派である。改善が見られないのは、調査のために紹介された多くの患者に見られる機能性腸障害の存在が原因である可能性もある。これらの患者は様々な栄養素、機械的および化学的刺激に敏感であるため、乳製品の制限だけではほとんど反応しない。
IBS患者は、吸収の悪い発酵性炭水化物(発酵性オリゴ糖、二糖類、単糖類およびポリオール(FODMAPs))を摂取した後に症状を呈するが、これにはLM患者でも乳糖を含むがこれに限定されない。食事療法の転帰を予測する因子を特定することは、この介入のコンプライアンスと費用対効果を改善するであろう;しかしながら、大規模な臨床研究では、臨床症状もHBTの結果(高用量ラクトース50gまたはフルクトース35g)も低FODMAP食への反応を予測しなかった87。健康状態ではほとんど症状が出ないが、FGID患者ではしばしば鼓脹、腹痛、下痢を誘発する代表的な非吸収性FODMAP(例えば、ラクツロース20g)の中間用量に対する反応は、この食事介入に反応する個体を特定するHBTの能力を向上させるかもしれない。あるいは、糞便サンプル中の糖分解菌および/または発酵能力を識別するバイオアッセイを開発して、患者における乳糖(またはFODMAP)制限の転帰を予測することもできるかもしれない。
乳糖不耐症の長期的合併症
遺伝的 LD が腸内細菌叢に及ぼす客観的な影響と最近のヒトの進化(上記参照)を考慮すると、LM と LI は栄養に関連した影響を与える可能性が高い。乳製品はタンパク質、カルシウム、ビタミン D の貴重な供給源である89 。
90 1 日の牛乳消費量 245 mL は身長の増加(0.39 cm、95% CI:0.29~0.48)と関連している90 。同様に、牛乳の摂取量と LP は、いくつかの研究でより高い肥満度(BMI)と関連している91 。
91 栄養の健康への影響は、長期的な追跡調査が必要であること、費用がかかること、患者のコンプライアンスが限られていることなどから、介入研究で取り上げることは難しい。しかし、白人のLMは単発性疾患(LCT -13’910C遺伝子型)であるため、社会的、環境的、行動的要因による交絡を制限するメンデル無作為化アプローチを適用することで、この問題に対処することができる。この方法を用いた最近の研究では、遺伝子型LPを持つ人の牛乳消費量が高いことが確認されており、これはビタミンDレベルと関連しており、LCT-13’910:CCではLCT-13’910:TTと比較してLCT-13’910:CTでは1.5倍、LCT-13’910:CCでは2.3倍(OR: 1.6-3.4)低くなっている92。ビタミンDは骨のミネラル化に重要であり、別のメタ分析では、TTとCT/CCの間で骨密度が高く、骨折のリスクが低いことが示されている(OR:0.81,95%CI:0.7~0.94,p=0.005)93。
94 スウェーデンの大規模な研究では、非発酵乳やその他の乳製品の消費量が多い人は全死因死亡率が高かった(HR:1.32,95%CI:1.18~1.48)が、メンデル無作為化研究が可能なサブグループでは、これらの結果は頑健ではなかった。いずれにしても、乳糖不使用の牛乳の利用可能性、カルシウム、ビタミンD、飽和脂肪、コ レステロール、タンパク質、カロリーの摂取量など、食生活が複雑であることを考えると、これらの相反する結果は驚くべきものではない。94 牛乳消費量、乳糖不使用率、長期転帰との関係を明らかにするためには、複数の栄養素と複数の遺伝的マーカーを考慮した新たなアプローチによる追加研究が必要である。
展望
原発性遺伝性のLPと非持続性は健康なヒトでは一般的であるが、LDを持つ人が牛乳を摂取するとLMになり、感受性の高い患者では乳糖不耐症の症状を呈することがある。診断は、遺伝子変異、腸管粘膜におけるラクターゼ活性の喪失、または呼気検査による吸収不良の証拠のいずれかの検出に基づいて行われる。しかし、自己申告したラクターゼ不耐症、検査の客観的所見、食事療法の臨床結果との関連性は様々である。最近の研究では、LD、LM、症状発生の複雑な関係についての重要な新しい洞察が得られている。この研究は、IBSおよびその他の機能的GI障害における症状の原因としての食物不耐症という重要な問題に光を当てている。
食事療法の結果を予測する食物不耐症について、十分に理解され、実用的で費用対効果の高い調査を開発することは、機能性胃腸障害の分野における最大の臨床的課題の一つである。食物不耐症の生物学的メカニズムを理解することで、臨床医は確定診断を行い、合理的な食事療法や医学的管理を行うことができるようになる。継続的な研究は、これらの戦略の臨床的転帰、費用対効果、長期的効果を文書化するための質の高いエビデンスを提供する。
