Contents
Understanding the Heart-Brain Axis Response in COVID-19 patients: a Suggestive Perspective for Therapeutic Development
pubmed.ncbi.nlm.nih.gov/33781873/
2021年3月26日
ハイライト
- COVID-19患者における重篤な多臓器不全症候群(MODS)の原因として、情報の双方向の流れである心脳軸(HBA)の調節不全を示唆する新たな証拠が得られた。
- 特筆すべきは、SARS-CoV-2がHBAを阻害する要因として、心血管制御中枢や特定の脳領域を変化させる直接的な向神経性作用や、内皮の直接的な損傷が挙げられることである。
- COVID19患者におけるHBA障害の定義と詳細な特徴を明らかにすることは、個別化されたアプローチを開発するための予想外の薬理学的および非薬理学的治療ターゲットの発見に役立つだろう。
概要
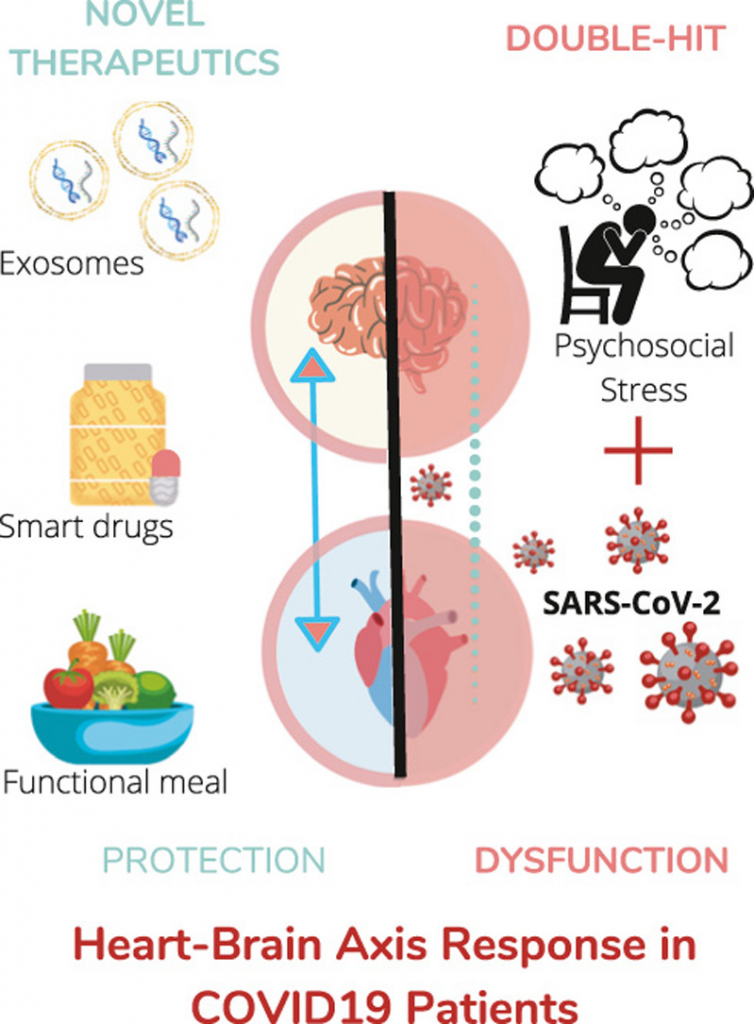
COVID-19(COronaVIrus Disease 19)パンデミックの時代にあって、重症急性呼吸不全患者の集中治療室(ICU)滞在中、およびICUや退院後における心脳コミュニケーションの詳細な特徴を明らかにすることは、大きな関心を集めている。重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)の感染が確認された患者が重症多臓器不全症候群(MODS)に陥る原因として、情報の双方向の流れである心脳軸(HBA)の異常がどのような役割を果たしているのか、新たな知見が得られた。また、HBAの機能障害はCOVID-19患者の予後を悪化させる可能性がある。この総説では、COVID-19におけるMODSの促進と抑制の両方においてHBAが果たす重要な役割について述べている。また、COVID-19における新たな治療戦略のターゲットとしてのHBAの役割を強調し、治療の新たなトランスレーショナル・フロンティアを切り開くことを目指す。以上、イタリア循環器学会によるトランスレーショナルな視点からの報告であった。
図解入り要旨
キーワード
心脳軸対称の多臓器疾患症候群COVID-19
1. はじめに:COVID-19パンデミック時の心血管疾患と脳疾患の罹患率
ストレス下における心血管(CV)系と脳の生理学的・病態生理学的な相互依存関係に関する現在の概念は,COVID-19(COronaVIrus Disease 19)患者の適応反応を理解し,新たな薬理学的標的を発見し,予想外の治療戦略を立案するのに役立つだろう。実際,重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)肺炎が確認された患者では,心臓と脳が同時に傷害されることが,重篤な多臓器疾患の重要なリスク要因として浮上している[1], [2], [3], [4]。そのため,COVID-19パンデミック時代の集中治療室(ICU)滞在中,あるいはICUや退院後の重症急性呼吸不全患者において,SARS-CoV-2の伝播に伴う心脳コミュニケーションの詳細な特徴を明らかにすることが,大きな関心を集めている(3)。
心脳軸(HBA)は、肺を含む他の臓器に対する局所的および全身的な傷害に対する感受性を調節する可能性のある情報の双方向の流れを特徴とする[5]。交感神経と副交感神経を発生させる髄内ニューロンのネットワークは、皮質の神経制御システム(内側前頭前野、島皮質、前帯状皮質)扁桃体、視床下部、海馬などによって細かく制御されている。これらの構造は,主にCV求心性入力による一連の体性・内臓情報を知覚・処理し,それによって,感情に関連した,あるいはストレス性の刺激に対する内分泌・自律神経・行動の統合的な反応パターンを開始する [6], [7]。
社会的支援、失業、孤独、社会的混乱、死別、社会的地位、社会的距離、ロックダウンなどの心理社会的要因が、さまざまな非感染性疾患の病因に大きく関与していることはよく知られている。急性心筋梗塞(AMI)や心不全[8][9]、脳卒中、認知機能障害[10][11]、大うつ病[12][13][14]、慢性閉塞性肺疾患[15]、喘息[16]、肥満[17]、慢性腎臓病[18]、がん[19]などが含まれる。COVID-19パンデミックの状況下では、虚弱体質の被験者は、症状や併存疾患が悪化したと認識したときに、家を出ること、感染すること、病院に行くことを恐れている[20], [21], [22]。このようなストレスの多い環境条件は、COVID-19の重症化のリスクが最も高い感染者や、COVID-19の最初の症状を示す患者において、主にCVおよび神経学的合併症の発症に寄与する。実際、いくつかの報告によると、初期の臨床症状は発熱、疲労、嗅覚・味覚の低下、幸せな低酸素血症(呼吸困難の感覚がなく、血液中の酸素濃度が極端に低い状態)であるにもかかわらず、CV [23]および神経学的合併症 [24]、[25]、[26]、[27]がCOVID-19患者の予後を著しく悪化させることが示されている[28]。
ここでは、SARS-CoV-2がHBAに干渉することで、HBA全体のホメオスタシスが損なわれ、同時に急性呼吸不全を悪化させ、不整脈、AMI、ストレス誘発性心筋症、脳卒中、神経炎症性障害などの主要な多臓器合併症を引き起こす可能性があることを描き出すために、文献を徹底的に評価する(図1)。さらに、性に関連したHBAの変化に関する最初のデータを分析する[29]。最後に、COVID-19患者の臨床転帰を改善するために、サイトカイン、ニューロトロフィン、細胞外小胞(EV)など、心脳クロストークのシグナルメディエーターを調節することで、さまざまなアプローチが可能になることを説明する。
図1 SARS-CoV-2感染症が、心理社会的ストレスにさらされたハイリスクの被験者から重症のCOVID-19患者に至るまでの一連の流れを再現した図
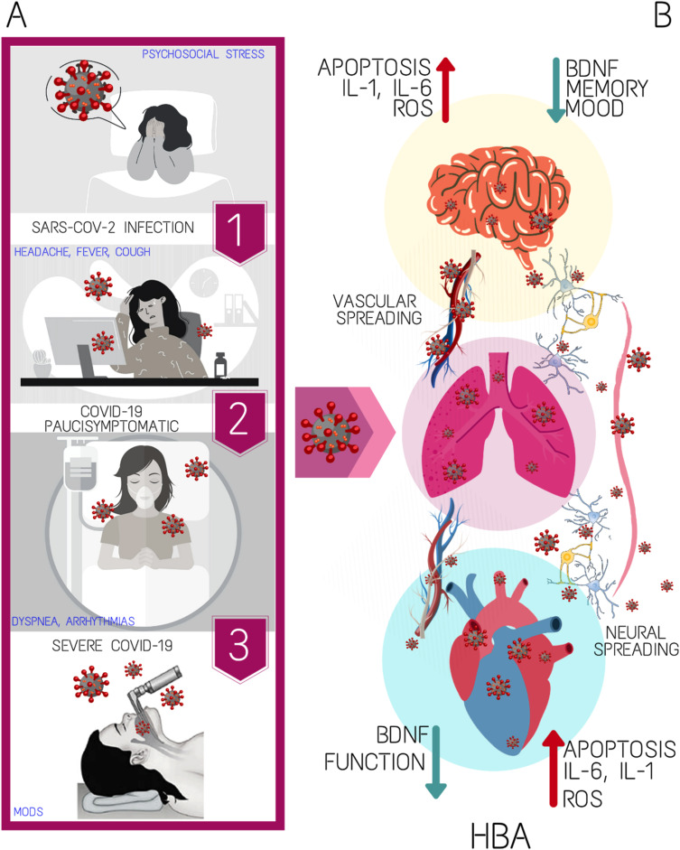
(A);(B)SARS-CoV-2によって引き起こされた間質性肺炎の血管および経神経細胞への拡散に伴う心脳軸機能障害の主な特徴を示した図。BDNF(脳由来向神経性因子)HBA(心脳軸)IL(インターロイキン)MODS(多臓器不全症候群)ROS(ラジカル酸素種)
2. SARS-CoV-2の向神経性状態は、神経循環制御を短絡させる
延髄背側に位置する孤路核(NTS)は、動脈圧受容器、心臓圧受容器、化学受容器、肺ストレッチ受容器など、複数の構造体からの感覚情報を運ぶ内臓求心性線維の最初のシナプスリレーを担っている。NTSに入ってきたさまざまな求心性情報は、脳幹と髄鞘上の部位(内側前頭前野と島皮質)の両方に伝達され、それらの部位からNTSのニューロンに信号が返されることがある。この事象により、刺激に対するCV反応を調整するための最も適切な自律的反応が生じる(すなわち、警戒反応における頻脈や血管収縮・血管拡張)[30]。急性反応は適応的であるが、NTSの障害が長引くと、交感神経が過剰に流出し、不適応な慢性CV疾患(心血管疾患)になる可能性がある。
これまで予想されていなかったSARS-CoV-2の向神経性作用が現れ[31]、そのメカニズムが注目されている。パンデミックの初期から、COVID-19に感染した被験者には、嗅覚障害(嗅覚低下)や味覚障害(味覚低下)頭痛、吐き気、嘔吐、疲労感など、さまざまな神経症状が報告されていた[24]、[32]、[33]。その他の神経学的合併症としては、脳卒中、意識障害、痙攣、脳症などが挙げられる [24]、[25]。さらに,SARS-CoV-2 mRNAは,ドイツでCOVID-19により死亡した22人の患者の脳から検出されている[34]。また,鼻咽頭ぬぐい液ではその存在が確認されなかったものの,脳炎・髄膜炎を発症した患者の脳脊髄液からも検出されている[35]。これらの観察結果と一致するように、SARS-CoV-2の宿主細胞への侵入を促進する主要な受容体であるアンジオテンシン変換酵素2(ACE2)は、さまざまな脳領域の神経細胞に発現している[3], [36], [37]。この向神経性学的性質は,視床下部や皮質の神経細胞の細胞質で確認されているSARS-CoV [38], [39]や,視床や脳幹に感染する可能性のある中東呼吸器症候群コロナウイルス(MERS-CoV) [42]をも特徴づけている。この類似性から,SARS-CoV-2は,末梢神経末端を経由して中枢神経系(SNS)に侵入するか[1],[4],[31],[36],[43],または血行・リンパ行路を経由して侵入する可能性がある.後者の経路については,脳微小血管内皮細胞がACE2を発現しており[43][44],SARS-CoV-2の侵入を受けやすいという考えが支持されている.この仮説と一致するように、COVID-19患者の前頭葉の内皮層では、ウイルスの構造遺伝子と非構造遺伝子が検出されており[45]、また別の独立した研究では、ヒト微小血管脳内皮細胞の95%以上でウイルスのスパイクタンパクが検出されている[46]。このような証拠から、SARS-CoV-2は血液脳関門(BBB)を通過して脳幹ニューロンに感染する可能性を示唆する著者もいた[31]、[43]、[47]。あるいは、SARS-CoV-2は、ヒト免疫不全ウイルス(HIV)で実証されたように、ACE2を発現するマクロファージ[48]を乗っ取ってBBBを通過し、脳にアクセスするか[47][49]、あるいは脈絡叢に感染して[47][51]、血液-脳脊髄液関門を破壊する可能性もある。
SARS-CoV-2が脳幹に到達するもう一つのルートは、嗅覚神経終末である[1], [31]。嗅覚粘膜の上皮細胞にはACE2が多く発現しており[52]、また、嗅神経は、インフルエンザやウエストナイルウイルスなど、いくつかのウイルスが中枢神経系に侵入する際の近道となることが古くから知られている[53]。これらの観察結果と一致するように,嗅覚低下はCOVID-19患者によく見られる症状である[31], [36].そこで、SARS-CoV-2は、鼻腔内に樹状突起を出しているニューロンのある嗅覚神経上皮に感染し、軸索の逆行輸送機構を利用して篩板(しばん)を経由して嗅球に到達すると考えられている。中枢神経系に侵入したSARS-CoV-2は、このシナプス移行様式を利用して、扁桃体、視床下部、大脳辺縁系と前頭前野、梨状皮質、脳幹など、嗅球に接続する他の脳領域に伝播する可能性がある[31]、[36]、[54]。この仮説は,SARS-CoVの向神経性に関する初期の報告[38]で支持されていたが,最近の調査で,SARS-CoV-2は主に嗅覚粘膜に感染し,中枢神経系の嗅覚路に沿った輸送を阻害して嗅球と延髄に到達することが明らかになった[55].ここでは、重度の微小血栓塞栓症イベントも検出され、ウイルスの軸索拡散による局所的な内皮細胞の損傷と関連していた[55]。このような局所的な虚血性梗塞は、脳幹へのウイルス感染によるダメージを悪化させることが予測される。さらに、SARS-CoV-2によって誘発された神経細胞死は、NTSのCV遺伝子座にあるACE2の機能を低下させ、交感神経系の慢性的な活性化(同時に迷走神経活動の低下)を引き起こし、心血管疾患につながる様々な病因メカニズム(例:気圧反射の変化、内圧の変化)を誘発する。これは、脳幹病変の臨床的証拠を超えて、心血管疾患につながるさまざまな病原性メカニズム(圧反射の変化、内皮機能障害、アテローム性動脈硬化プラーク、高血圧、左心室肥大、不整脈など)を引き起こす [56] [57] [58] [59]。注目すべきは、Cantuti-Castelvetriらが、SARS-CoV-2の神経毒性に関してさらなる証拠を示したことである[61]。SARS-CoV-2のスパイクタンパク質にプロテアーゼfurinの切断部位が存在することから、著者らは、このウイルスが、furinで切断された基質を結合する受容体であるニューロピリン-1(NRP1)を、侵入と感染に利用していることを示した[61]。ACE2とは異なり、NRP1は呼吸器や嗅覚上皮に高発現している[62]。したがって、この受容体は、ウイルスとACE2との相互作用を促進することで、SARS-CoV-2の感染力を大幅に増強する可能性があると考えられる。
したがって、SARS-CoV-2は、血行性ルート[63]または脳神経に沿った逆行性輸送のいずれかによって伝播する可能性がある[64]。下部髄質にはACE2受容体が多く発現していることから[65]、ここはβ-コロナウイルスに感染しやすい部位であると考えられる[38]。この特異な神経疾患を証明するものとして、COVID-19患者では自律神経障害に起因するてんかん発作が出現している[66]。さらに、上述したように、脳幹病変の大きさは、全身性炎症、虚血性血栓/塞栓病変、または脳室内の上衣毛細血管炎の組み合わせによって増強される可能性がある[55], [67]。注目すべきは、SARS-CoV-2が寛解期に脳神経節にとどまり、他の神経向性ウイルスと同様に、軸索逆行輸送を介して中枢神経系、心臓、肺に再侵入する可能性を排除できないことである[68]。
2.1. 自律神経の不均衡がストレス誘発性のCV疾患を引き起こす可能性がある
コロナウイルスは脳幹の自律神経中枢に感染し、心血管障害や呼吸器障害を引き起こす可能性があるが、SARS-CoV2が自律神経系に及ぼす直接的な影響についてはまだよくわかっていない。実際、身体的・精神的ストレスによる自律神経系の失調は、しばしば心血管疾患と関連している。感情的ストレスによる心筋症の最も顕著な例は、たこつぼ症候群(TTS)である[69]。過剰な交感神経反応は、内皮機能、血圧、心臓の表現型(左心室肥大および不整脈)およびレニン・アンジオテンシン・アルドステロン系(RAAS)に大きな影響を与え [69] [70]、それによって高血圧、後負荷の増加、最終的にはうっ血性心不全を引き起こす。上述した一連の有害事象は、COVID-19パンデミックによる心理社会的ストレスが引き金となり [71] [72]、さらに中枢神経系の感染や損傷によって悪化する可能性も考えられる。
自律神経失調症は、SARS-CoV-2陽性の無症候性・低症候性患者やCOVID-19生存者のHBAを著しく変化させ、多臓器不全症候群(MODS)を引き起こし、死に至る可能性がある。心的外傷後ストレス障害(PTSD)は、重篤な疾患[73]や、現在のCOVID-19パンデミック[74]を含む大災害の一般的な結果であり、虚血性心疾患[75]につながる可能性がある。実際、COVID-19生存者においてPTSDは、心血管疾患、血栓塞栓性脳卒中を含む神経疾患[76]、[77]、[78]、および気流制限[79]の重大な危険因子である。PTSDのHBAへの影響は、急性冠症候群や主要有害心イベント(MACEs)の発症によってよく裏付けられており、COVID-19患者の脳血管イベントにおいても転帰の悪化に寄与している可能性が高い [80], [81]。さらに、PTSD患者は従来の主要なCV危険因子(喫煙、動脈性高血圧、肥満など)に頻繁にさらされているにもかかわらず、PTSDは冠動脈疾患(CAD)を知らない患者の運動負荷試験における虚血性心電図変化の独立した予測因子であることが判明した[82]。
PTSDは、重症患者と同様に、コルチゾール放出の増加や交感神経系の活性化など、視床下部-下垂体-副腎軸の調節不全を特徴としている[83]。カテコールアミン濃度の上昇は、心拍数、後負荷、心筋収縮力の増加を通じて、心筋の酸素消費量を高め、血管内皮機能、プラークの安定性、血小板機能に悪影響を及ぼす。さらに、PTSDによる自律神経の失調は、血糖値とRAAS活性を上昇させ、その結果、インスリン抵抗性と高血圧を引き起こす[84]。急性腎障害(Na+と水の再吸収)以外にも、脳のRAASの過剰活性化は、脳室周囲の器官(すなわち、角膜下器官と後頭葉領域)ではACEレベルが高く[85][86]、視床下部[87]と脳幹では有意ではあるものの発現が低いことから、神経炎症を悪化させることで高血圧と心不全の発症に寄与している可能性がある[88]。RAASは、炎症、線維化および慢性酸化ストレスに長期的な影響を与えるため [89] 、ACE阻害剤(ACEI)およびアンジオテンシンII受容体拮抗剤(ARB)は、PTDS患者の動脈性高血圧および心臓リモデリングを抑制する。上記の薬剤はACE2の発現を誘導する可能性があるが[90], [91], [92]、SARS-CoV-2はACE2の活性を低下させ、RAASのACE/アンジオテンシンIIアームに有利に働く可能性がある(76)。そのため、科学界では高血圧のCOVID-19患者に対してACEIの休薬を推奨していない[23]、[92]。さらに、皮質ニューロンの感染に伴う感情的/物理的ストレスが、視床下部-下垂体軸を刺激して抗利尿ホルモン(ADH)を放出させることにより、水の再吸収を介して前負荷を増加させる可能性があることも無視できない[93]。このようなPTSDの有害な作用は、CADや高血圧が知られている患者では増強される可能性があり、「サイトカイン・ストーム」にさらされている間はMACEのリスクが高くなることが予想される。
実際、PTSDは動脈硬化性疾患の原因となる全身性の炎症と関連しており[94]、COVID-19で報告された炎症性バーストによってさらに悪化する可能性がある[23]。COVID-19患者のほぼ50%の不整脈は、ウイルス感染、低酸素誘導性アポトーシス、全身性炎症過程による心筋の直接的な損傷によるものである[95]。注目すべきは、全身性炎症による不整脈促進作用は、心拍数をコントロールする間接的な神経機構にも起因する可能性があることである。炎症性サイトカインは、中枢および末梢経路、すなわち、視床下部および左星状神経節の活性化が関与する炎症反射を介して、心臓の交感神経の流出を増加させる[96]。交感神経反射は、おそらく、循環リンパ単球のβ2アドレナリン受容体を介したサイトカイン産生および免疫炎症活性化の上昇を抑制するフィードバックシステムとして機能する。しかし、交感神経の過剰活性化は、視床下部室傍核のアストロサイトなどの非神経細胞集団の活性化によっても、心室性不整脈を引き起こす可能性がある[97]。この交感神経緊張の不均衡を、迷走神経の刺激によって是正することが提案されている[98]が、迷走神経には抗炎症作用もある。実際、「コリン性抗炎症経路」とは、病原体が存在する場合に、神経と免疫のつながりによって生体の全身性反応を調節し、古典的な抗炎症メカニズムよりも早く有益な効果をもたらすことができるとされている(83)。COVID-19によるストレスは、典型的な「闘争か逃走か」という交感神経の活性化を特徴とするが、迷走神経刺激は、心臓血管系にとっても新たな保護戦略となる可能性がある。このように、エンドトキシンに対する全身の炎症反応を調節する脳の能力を利用することで、コービッド症候群によって引き起こされる「サイトカインストーム」中の生物学的毒素の致死的な効果を抑制することができる迅速な内因性メカニズムを活性化することが可能になると考えられる。あるいは、α7ニコチン性アセチルコリン受容体(α7-nAChR)は、炎症性サイトカインの分泌を調節し、「サイトカインストーム」を抑制することに関与している可能性があるため、コービッド症候群の潜在的な治療オプションとして、ニコチン性コリン作動薬を検討する必要がある[99]、[100]。
3. SARS-CoV-2と神経細胞から血管への双方向のコミュニケーション
血管-神経細胞間のコミュニケーション(VNC)の重要性から、ここではCOVID-19が中枢神経系の神経細胞と血管の間のこの重要なクロストークにどのような影響を与えるかを考える。実際、神経細胞の活動(NA)は、神経細胞、アストロサイト、内皮細胞(EC)周皮細胞のネットワークである神経血管ユニット(NVU)内の微小血管の直径を直接調整し、脳血流(CBF)を局所的に制御している可能性がある[101]。したがって、NAが高いと、活性化した脳領域のCBFが上昇する [101]、[102]。CBFの局所的な変化は、隣接するニューロンにシグナルを返し、VNCに応じてNAとシナプス可塑性を調節する可能性がある[103]、[104]。ニューロンによる血管の制御は、毛細血管レベルで始まることが明らかになっている。毛細血管は、発火しているニューロンに細動脈よりも近いため(8~23μm対70~160μm)NAを検出するのに適した位置にある[101]。したがって、毛細血管は、内皮管に沿って走行する周皮細胞の弛緩により、「栄養動脈」よりも先に拡張する可能性がある[101]、[105]。
体性感覚刺激は、内皮のN-メチル-D-アスパラギン酸受容体(NMDAR)を活性化し、Ca2+依存性の一酸化窒素(NO)の放出を促し、神経血管結合(NVC)を誘発する可能性がある[101]、[106]。NAによって誘発された局所的なK+の蓄積は、内皮の内向性K+チャネルを活性化し、筋内皮ギャップ結合を介して上流の動脈を弛緩させる伝搬性過分極を引き起こす可能性がある[107]。その後、内皮が媒介するNAの検出は、メタボトロピック・グルタミン酸受容体によって維持される可能性がある[108]、[109]。続くCBFの増加は、組織の代謝ニーズをはるかに上回り、おそらくNAとシナプス活動を微妙に形成することになる[104]。 実際、CBFの増加は、局所的な介在ニューロンを刺激し[103]、K+ホメオスタシスを調節するシナプス周囲のアストロサイト[103]のTRPV4依存の活性化を通じて、ピラミッド型NAを間接的に阻害する可能性がある[110]。さらに、血行動態シグナルは、シアストレスによって毛細血管ECから放出されるNOを増強し[101]、脳のいくつかの領域で長期増強をサポートしている[111]、[112]。
SARS-CoV-2は、脳毛細血管を含む複数の血管領域[113]のECに感染し[45]、それによってアポトーシスを伴う内皮機能障害を誘発した[55], [113], [114]。SARS-CoV-2は、ECのNA感知能力とNO放出能力を低下させることで、NVCに影響を与えている可能性は否定できない。この影響は、COVID-19による周皮細胞の消失後に悪化する可能性があり、この影響は間接的に(ストレスによるグルココルチコイドシグナルのため)[115]、または直接的に(ACE2を介した周皮細胞へのSARS-CoV-2の侵入のため)[116]に生じる可能性がある。NVCにおける毛細血管のシグナル伝達の新たな役割は、COVID-19患者における脳卒中の高い発生率[23]や重度の神経学的合併症[117]を説明できる可能性がある。注目すべきは、脳リンパ管もCOVID-19による全身性内皮炎にさらされ[113]、SARS-COV-2の脳への侵入を促す可能性があることである[118]。神経炎症と免疫細胞輸送の主要なメディエーターである脳リンパ管[119]が、SARS-COV-2感染時のVNCの錯乱に関与しているかどうかは、まだ明らかになっていない。したがって、SARS-CoV-2感染は、(心理社会的要因に対する感受性を高めることで)全身的にも、(神経細胞と血管の双方向のコミュニケーションを阻害することで)局所的にもHBAを悪化させる可能性がある。VNCの変化は、COVID-19患者の頭痛、錯乱、せん妄の発生を増加させ、脳卒中による死亡率を含む予後不良を引き起こす可能性がある。
4. COVID-19における心脳軸:性別の役割
COVID-19は同様に両性に影響を与えるが、男性の死亡率は若い女性のそれの約2倍である。逆に、既往のCV合併症を持つ高齢者では、男女ともに死亡率が高くなる[120]、[121]。COVID-19の患者では、心筋梗塞を発症したのは男性よりも女性の方が少なかったが、心筋梗塞を発症した女性は全身の炎症マーカーのレベルが高く、男性の炎症表現型を示唆していた[122]。そこで、ここでは、個別化された治療法の開発にも役立つ可能性のある、性に関連したHBAの変化やその他の性/性に関連した問題について簡単に検討する。
女性は、男性よりも心理社会的ストレスに起因する傷害を受けやすい [123], [124]。社会的要因に加えて、多臓器障害に対する感受性の違いは、部分的には、胎児期に開始されるプロセスに由来する。例えば,男性はストレスに対して血管抵抗を増加させ,女性は心拍数を増加させる。男女間で異なる分子経路には、成長因子、神経伝達物質、RAASなど、数多くのメディエーターが関与している。これらの因子は、血圧を制御する視床下部-下垂体-副腎軸領域(すなわち、室傍核)の神経細胞および血管の発達に異なる影響を与える[123]。ストレスは、脳や心臓のRAASに影響を与え、ACE/ACE2比や自律神経の流出のバランスを崩する。RAASによる血圧調節および高血圧の病態生理における性差は、臨床および動物モデルの両方で示されている[125]。前述のように、β-コロナウイルスはACE2を標的とし、MODSはACE/ACE2比の不均衡が特徴である[91]。
ACE2は抗炎症/エストロゲン制御酵素であり、その遺伝子はX染色体上にあるため、ACE/ACE2比および副産物には性別による違いが存在する[126]。さらに、スパイクS1タンパク質をプライミングする酵素である膜貫通型プロテアーゼセリン2(TMPRSS2)は、テストステロン制御遺伝子であり、男性よりも女性の方が発現量が少ない可能性がある[127]。興味深いことに,加齢はホルモン以外にもこれらの酵素の活性を変化させる。女性は男性よりも寿命が長く、80歳以上になると男性よりも女性の方が感染者数が多くなるのは、このためと考えられる[23]。これは、女性と男性の健康-生存のパラドックスの一部である。
ストレスとHBAの間に強い相関関係がある心疾患はTTSで、閉経後の女性に好発する。エストロゲンの剥奪は、TTSの促進役を果たしており、おそらく内皮機能障害が関与していると考えられる[128]。コルチゾールやカテコールアミンの放出が増加し、RAASの調節障害が起こると、心臓の仕事量が増え、TTSの急性期の多くの兆候が見られるようになる。TTSとRAASの間の因果関係は、ACEIおよびARBが左心室先端部、心室中部、または心室基底部のバルーンの再発の可能性を減少させる効果があることによって、逸話的に証明されている[129], [130]。実際、Pubmedで “Takotsubo and COVID-19 “を検索すると89件の結果が得られ、そのうちの1件は50歳の男性の逆(基底)TTSに関するものである[131]。さらに最近では、TTSとCOVID-19に関するミニレビューが発表されており、そこにはさらにいくつかの症例が記載されている[132]。COVID-19におけるTTSは、おそらくこれまで過小評価されてきたが、その基本的なメカニズムを調査することで、COVID-19によって誘発される性別に関連した異なるHBAの変化に光を当てることができるかもしれない。
5. 治療戦略の可能性:医薬品から機能性食品まで
HBAは、COVID-19患者の多臓器の保護とケアのための革新的なアプローチを開発するための、これまで予想されなかったターゲットを提供する。
5.1. 薬物による治療
現在、COVID-19 に対して規制当局が承認している薬剤はない。しかし、他の適応症で承認された多数の薬剤が、その安全性と有効性を再利用するための試験を行っている(https://www.who.int/ictrp/en/)。
最も関連性の高い化合物としては、レムデシビル(治験用抗ウイルス剤)[133]や、SARS-CoV-2 Spike S1タンパク質の受容体結合ドメインとACE2受容体との相互作用を破壊するモノクローナル抗体[134]などが挙げられる。COVID-19における致命的な「サイトカイン・ストーム」を防ぐために、抗炎症剤を試験する根拠となったのが高炎症である。これらには、SARSのような過去の肺炎発生時に一般的に使用されていたコルチコステロイドが含まれ、有効性については議論の余地があるものの、現在COVID-19の患者に使用されている[135]。
デキサメタゾンのようなコルチコステロイドは、短期的には「サイトカイン・ストーム」を抑制するために有用であるが、長期的には防御的T細胞の阻害やB細胞の抗体産生の阻害により有害であると考えられる。実際、デキサメタゾンが死亡率を低下させるのは、重篤なCOVID-19患者に限られているようで[136]、メチルプレドニゾロンはデキサメタゾンの有効な代替手段である[137]。ある症例報告では、メチルプレドニゾロン(200mg/日、4日間)とヒト免疫グロブリン(20g/日、4日間)を共同投与することで、心筋梗塞を回復させ、心筋トロポニン値を低下させる可能性が示されている[138]。
一方、一般的に処方される非ステロイド性抗炎症薬であるイブプロフェンは、COVID-19患者のIL-6レベルを低下させ、トシリズマブのような抗IL-6療法のいくつかの試験が活発に募集されている[139]。最後に、ステロイドや非ステロイド性抗炎症薬は、同様に血管内微小凝集や肺シャントを抑制することで、血小板凝集の用量依存的な抑制効果さえ発揮する。これらの薬剤は、COVID-19,PTSD、HBAの機能障害に共通する炎症促進プロセスや血栓促進因子を標的としているため、これらの薬剤がHBA保護作用を発揮して呼吸器症候群を減弱させるかどうかを評価するには、さらなる研究が必要である。
上述したCOVID-19の潜在的な治療法には、注意を要する重要な毒性があり、心筋トロポニン値のモニタリング(例:クロロキンやヒドロキシクロロキンの治療中)[95]や、薬物相互作用によるせん妄の発症(例:向精神薬との共同投薬中)[140]を無視することはできない。
5.2. 細胞外小胞
細胞外小胞(EV)は、大部分の細胞から放出されるナノサイズの膜結合粒子であり、重症患者の脳と免疫系の間のパラクリンメディエーターとして登場している[141]。EVは,マイクロRNA(miRNA)などの非コードRNA,タンパク質,脂質,その他の代謝物を豊富に含むカーゴを介して,標的細胞を調節することができる。最近、血漿中のEVは、その保護・再生効果(間葉系前駆体の間質EVの場合など)や、高齢の外科患者であっても診断に役立つ可能性があることから、新たな治療ツールとして注目されている[142]。興味深いことに、脳損傷後の内皮細胞や神経細胞は、血液脳関門を越えてEVを分泌し、末梢臓器に到達し、全身の炎症を制御することができる[143]。注目すべきは、EVsから分泌されたmiRNA-126が心機能をサポートし、脳卒中後に変調をきたすことである。実際、miR-126ノックアウトマウスのECから分離されたEVは、肥大化誘導刺激にさらされた培養心筋細胞に対するパラクライン保護効果が低いことを示している[144]。エキソソームとも呼ばれる最も小さなEVは、いくつかの異なる供給源の幹細胞/前駆細胞から分離され、いくつかの前臨床実験モデルにおいて、炎症を鎮めることで神経および/または心臓保護効果を発揮する可能性がある[145], [146], [147], [148], [149], [150], [151]。このように,EVは,ストレス下のHBAのホメオスタシスに関与している可能性がある。
ECs由来のEV(EEV)は、SARS-CoV-2で誘発された内皮傷害時に放出され、COVID-19の致命的な結果の基礎となる炎症性および凝固性の環境に寄与する可能性がある[152], [153]。したがって、COVID-19に罹患した可能性のある人の予後を左右する末梢血マーカーとして、EEVが提唱されている[153]。同様に、循環しているEVは心筋トロポニンに富み、心筋損傷の別の信頼できる予後マーカーとなる可能性がある[154]。一方、COVID-19患者における間葉系前駆体間質細胞(MSC)から分離したEVの治療的使用については活発に議論されている。同種のMSCは、急性呼吸窮迫症候群(ARDS)の重症患者において有益な免疫調節活性を示し[155]、そのEVは親細胞のパラクライン抗炎症能のほとんどを再現している[156]。したがって、MSC-EVは、全身性の「サイトカインストーム」と免疫細胞系の過剰活性化に対処する可能性のある支持療法として、現在検討されている[135]、[157]。中国、イラン、米国では、体細胞または心臓のMSCを使用して、MSC-EVを追加処理するかしないかの試験がいくつか行われているが[135][157]、国際細胞外ベシクル学会(ISEV)と国際細胞・遺伝子治療学会(ISCT)は、ごく最近、EVを使用したCOVID-19療法について特定の懸念を表明する声明を発表した[158]。そうでなければ、確立された抗血小板薬であるチカグレロルは、ヒト心臓由来の前駆細胞からの抗アポトーシス性エクソソームの放出を促進し[159]、それによって血栓イベントのリスクを低下させるだけでなく、両方の重要な器官に直接エクソソームを移植するという別のアプローチを示唆している。
5.3. 機能性食品
HBA保護の最近の重点は、遺伝子発現のエピジェネティックな制御に移っている[160]。DNAの配列を変えずに心臓や脳の細胞の適応反応を高めることで、重篤な患者の予後を改善できる可能性がある[161]。機能性食品成分とその代謝物は、クロマチン構造とマイクロRNAの放出を化学的に調節して遺伝子活性をパターン化することで、臓器不全を予防できる可能性がある[162]。最近の研究では、脳由来向神経性因子(BDNF)が、酸化ストレス下でそのレベルが同時に低下することから、HBA内の重要な神経ホルモンメディエーターとしての役割が強調されている[163]。BDNF/TrkBシグナル伝達経路の破綻は、心臓や海馬の機能障害に関係していることから、その破綻はSARS-CoV-2陽性患者の心臓と脳の両方の障害に対する感受性を高める可能性がある[164]。したがって、エピジェネティックに活性化する食物化合物を用いた機能性食や人工栄養を重症患者に予防的に使用することは、臓器不全の予防/対策や重症患者の転帰の改善に役立つ可能性がある。
前臨床試験の予備的な結果では、クラスIヒストン脱アセチル化酵素(HDAC)の天然阻害剤である大麦ベータグルカンやサフラン、あるいはヒストンアセチル化酵素(HAT)の天然阻害剤であるクルクミンを定期的に摂取することで、心筋や海馬のBDNF/TrkB経路のアップレギュレーションを通じてHBAを維持できる可能性が示されている[160], [165]。
さらに,アブラナ科の野菜に含まれるグルコラファニンの加水分解物であるスルフォラファンは,クラスI HDACを阻害することで,神経細胞のBDNF発現を促進する[166].
さらに,エイコサペンタエン酸(EPA)は,クラスI DNAメチル化酵素(DNMT)の発現を低下させるため,神経炎症時のBDNFのダウンレギュレーションを防ぐことができる[167]。
レスベラトロールは,ブドウ,赤ワイン,ベリー類,エキストラバージンオリーブオイル(EVOO)などに多く含まれる,抗炎症作用を有するよく知られた天然ポリフェノール化合物であり[168],試験管内試験で中東呼吸器症候群コロナウイルス(MERs-CoV)の複製を有意に抑制したことから,SARS-CoV-2への対抗策として提案されている[170]。レスベラトロールは、DNMT、HDAC、およびリジン特異的デメチラーゼを標的としているため[171]、10日間の経口摂取後にBDNF遺伝子の発現をアップレギュレートする[172]。これまでに、200名のCOVID-19患者を対象に、レスベラトロールの安全性と有効性を評価することを目的とした1件の無作為化概念実証臨床試験(NCT04400890)が実施された。両グループ(レスベラトロールとプラセボ)には、レスベラトロールの効果を増強するために、ビタミンD3(100,000 IU)も投与される[173]。興味深いことに、これらの組み合わせは、げっ歯類において、認知機能の低下を防ぎ[174]、心筋損傷後の虚血再灌流過程を改善することによって、HBAにも作用することが示されている[175]。これらの結果は,2016年にScuola Superiore Sant’Anna(イタリア,ピサ)で発表され,機能性食品の組み合わせに基づく機能性食事の開発を目指す新しい科学であるRistoceuticaが目指すように,異なる食物化合物の組み合わせが治療用食品の相乗効果につながる可能性を示唆している[161], [176]。
SARS-CoV-2のHBAへの悪影響を予防/軽減するための特定のスマートな食事はまだ開発されていない。ウイルス感染に対するより優れた予防策は、多様な食事療法によってもたらされると思われる[177]。フラボノイドのケルセチンは,試験管内試験ではプロテアーゼSARS-CoV-2 3CLproを適度に強力に阻害するが[178],小腸でケルセチンに加水分解されて速やかに吸収されるイソケルシトリンを豊富に含む食品(赤タマネギ,レッドラズベリー,黒ブドウ,ブロッコリー,紅茶)は,重症のCOVID-19患者に処方される治療薬の代わりにはならない.また、長期にわたる安静やステロイド治療に伴う副作用を軽減するために、カルシウムやビタミンDを多く含む食品を併用することも有効であると考えられる。また、大麦ベータグルカン、イソクエルシトリン、クルクミン、レスベラトロールなどの機能性食品が、市販の薬剤と相乗的に作用して、ウイルス感染やサイトカインストームを抑制したり、高用量投与に伴う合併症を抑制したりするかどうかを評価するには、薬理学的な研究が有効である。最後に、ステロイド治療を受けているCovid19患者さんは、代謝障害や動脈性高血圧の発症を防ぐために、塩分や糖分の多い食品の摂取を避けるべきである。
6. 結論
SARS-CoV-2陽性またはCOVID-19患者が心臓や脳の機能障害を発症していることに関心が集まっている。SARS-CoV-2は、神経のCVコントロールセンターへの直接的な向神経性作用や、局所的な神経-血管間の双方向のコミュニケーションを阻害することでHBAに影響を与えるか、あるいは精神的ストレスや不安をもたらす心理社会的要因に対する感受性を高めることで、心肥大、不整脈、AMI、TTSを引き起こす可能性がある(図2)。心臓の機能を制御する神経体液性因子の微妙なバランスが崩れると、脳にダメージを与え、脳卒中を引き起こす可能性がある。ウイルスが脳の微小血管に広がり、周皮細胞の減少や内皮機能障害を引き起こし、NVC調節機能の低下や微小血栓症の再発によってCBFが変化することも考えられる。脳の損傷は、SARS-CoV-2感染によって始まった悪循環をさらに強め、全身性の炎症を引き起こし、酸化ストレス、心筋細胞のリモデリング、コラーゲンの沈着、リズムの変化、マクロファージの浸潤など、心機能にさらなる影響を与えることになる[145]。傷害を受けて活性化した常在ミクログリアは、主にIL-6やIL-1βなどのサイトカインを産生し、これらのサイトカインは損傷した血液脳関門を通過する。さらに、死にかけている脳細胞は、損傷関連タンパク質を放出して全身循環に入り、Toll様受容体(TLR)を活性化し、サイトカインやケモカインの産生を促進する[69]。注目すべきは、TLRは心筋細胞にも発現しており、心臓の炎症や心不全の発生に関与していることである[179]。
エストロゲンは、ウイルス感染(ACE/ACE2比とTMPRSS2発現の性差による)とRAAS調節異常(感情的ストレスまたは延髄への直接感染のいずれかによって誘発される)の有害な結果の両方からHBAを保護する可能性がある。
以上のような複雑なシナリオは、予想外のターゲットを特定し、スマートドラッグ、電気自動車、機能性食品などの革新的な非薬理学的個別化アプローチを開発するための新たな道を開くものである。
最後に、COVID-19の患者や生存者にはリハビリテーションが重要だ[180]。また、症状の軽いCOVID-19患者のHBAを保護するためには、最近[181]でレビューされているように、CV機能と精神的健康の両方にプラスの影響を与える身体運動が有効である。運動によって神経心臓のフィットネスを刺激するHBAのシグナル伝達経路を理解することは、SARS-CoV-2感染時に、機能的な運動制限があってもHBAを救済する効果的な薬理学的戦略の特定を早める可能性がある。
図2 COVID19患者の心臓と脳の同時損傷につながる心脳クロストークのルート案の概要
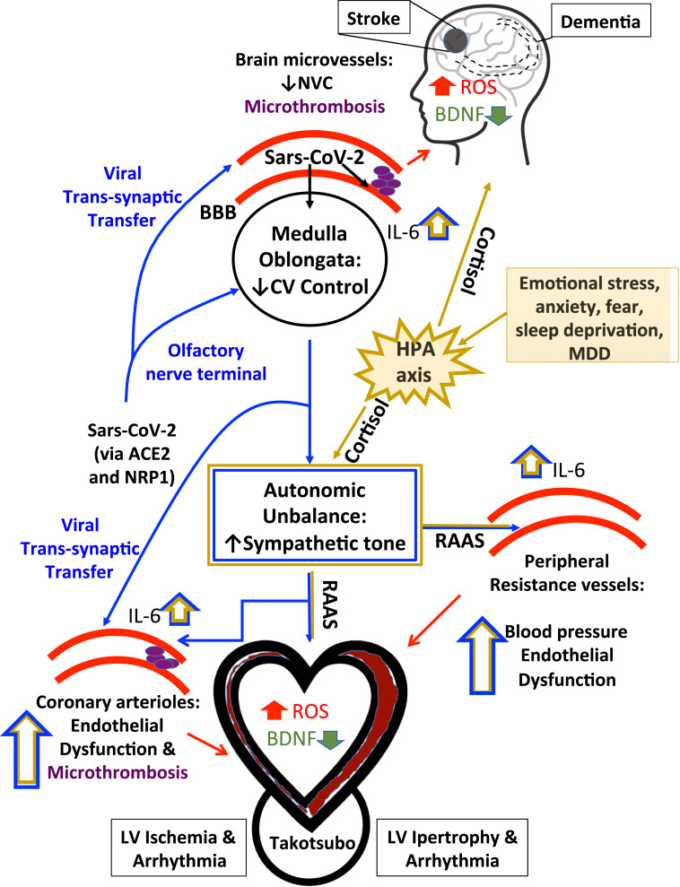
ACE2はアンジオテンシン変換酵素2,BBBは血液脳関門、BDNFは脳由来向神経性因子、CVは心血管、HPAは視床下部-下垂体-副腎(HPA)軸、IL-6はインターロイキン-6。LV、左心室、MDD、大うつ病性障害、NVC、神経血管結合、NRP1,ニューロピリン1,RAAS、レニン-アンジオテンシン-アルドステロン系、ROS、ラジカル酸素種