オートファジー活性剤 トレハロース(認知症・アルツハイマー)
関連記事

概要
自然界に広く存在するトレハロース
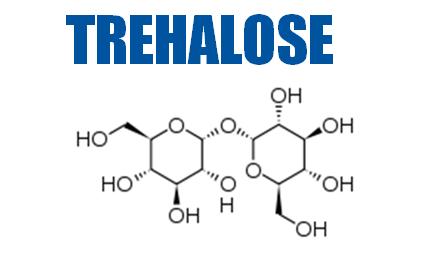
トレハロースとは、植物、昆虫、酵母、真菌、無脊椎動物など、脊椎動物以外の生物の中に広範囲に見出すことができる天然の糖質。
酵母、線虫、ショウジョウバエの体液の主要な糖質でもある。
キノコ、昆虫などの成分としても見出されるが、それ以外の一般的な食材にはトレハロースはほとんど含まれていない。
トレハロースの特性
二糖類
グルコースがグリコシド結合によって結合された二糖類、結合の仕方の違いによりマルトースとはわずかに異なる。
分解酵素トレハラーゼによって分解されるが、トレハラーゼが存在しない場合グルコースへの分解は容易ではない。
www.ncbi.nlm.nih.gov/pubmed/17841031/
非還元性
トレハロースは還元基同士が結合しているため、グルコースと違って還元性をもたない。
グルコースは還元性をもち、タンパク質を糖化させる。これによって生成される生成物(AGEs)は組織の老化にも関わる。
高い水和能力・膜脂質の安定性
水和能力が高く、水分子を周囲に配置することで膜脂質の安定性を向上させることができる。
その他いくつかのメカニズムからタンパク質の変性を防ぐ作用があり、熱、凍結、酸化、乾燥、脱水などのストレスに対して様々な保護効果をもつ。
保湿能力の高さから加工食品、点眼薬や化粧品などの外用として用いられたりする。
www.ncbi.nlm.nih.gov/pubmed/1424716/
トレハロース利用の進化の歴史
トレハロース利用からグルコース利用へ
生態利用におけるトレハロースのデメリットは、エネルギー源として利用する際、トレハラーゼ分解酵素が特異的に必要となること。
グルコースは利用効率がトレハロースよりも高いため、高エネルギーが必要とされる脊椎動物などの大きな脳ほどグルコース利用が高まる。
そのため脊椎動物への進化の段階でトレハロース利用からグルコース利用への転換が起きたものと考えられている。
インスリン機能の進化
しかし、トレハロースが高濃度で保持することが可能であるのに対して、グルコース利用は糖化によってタンパク質に障害を与える可能性がある。
脊椎動物は一般に寿命も長いため、その障害の影響は少なくない。
(昆虫のトレハロース濃度は1~2%、ヒトのグルコース濃度は0.1%)
ヒトでは糖化を防ぐために血中グルコース濃度を狭い範囲の保つ必要性に迫られた。
そのために、その後インスリン機能の進化が始まったものと考えられている。
トレハロースは古代人の主要糖質エネルギー?
トレハロースは現代人の主要なエネルギー補給源ではないが、昆虫や無脊椎動物を食していた古代人では、トレハロースが数千年もの間、大きな糖質補給源であった可能性がある。
www.ncbi.nlm.nih.gov/pubmed/12065209
トレハロース分解酵素トレハラーゼ
脊椎動物はトレハロースを合成、貯蔵しないにもかかわらず、トレハロースを分解する酵素トレハラーゼは、脊椎動物の腸粘膜、腎臓、肝臓など特定の部位に存在する。(小腸が最も活性が高い)
摂取したトレハロースは、腸内においてトレハラーゼによって急速に分解される。
トレハラーゼ不耐症
トレハラーゼ濃度が低いと、乳糖不耐症のように吸収不良、下痢、胃腸症状などを引き起こす。
www.ncbi.nlm.nih.gov/pubmed/12065209/
トレハロース不耐症の患者にプロバイオティクスS.boulardiiを経口投与することで、トレハラーゼ活性が増加し、消化器症状を改善した。
www.ncbi.nlm.nih.gov/pubmed/18777247/
トレハロース不耐症は基本的にまれであり、(1%を遥かに下回る)多くのヒトでは50gのトレハロースを悪影響なくトレハラーゼによって消化する事が可能であることが、これまでの研究で示唆されている。
ただし、日本ではトレハロースの耐性能力がわずかに低いことが報告されており、イヌイットのグループでは10~%がトレハロース不耐症であるという報告もあり、トレハロースの摂取能力には民族によって違いもある。
www.ncbi.nlm.nih.gov/pubmed/6347461
トレハロースを含む食品
- はちみつ 0.1~1.9%
- みりん 1.3~2.2%
- ビール 0.01~5%
- パン酵母 15~20%
- キノコ 8~17%
- エビ、カニ、ロブスターなどの無脊椎動物
トレハロースの甘み
濃度によって異なるトレハロースの相対的甘さ
トレハロースはスクロースの甘みに対して38~45%程度。しかし、トレハロースの知覚的な甘みはトレハロースの溶液濃度に依存し、濃度が下がるほど同濃度のスクロースよりも甘味が相対的に減少する。
www.ncbi.nlm.nih.gov/pubmed/12065209
好まれる甘さ
メーカーの味覚テストでは、85%の参加者でトレハロースの甘味がスクロースの甘味よりも好ましいと評価された。(日本)
www.ncbi.nlm.nih.gov/pubmed/12065209
アルツハッカーシュガー
トレハロースは非還元糖であるためいわゆる白砂糖と比べればその有害性は少ないが、ステビアや羅漢糖のようなカロリーのほとんどない甘味料としての代替にはならない。トレハロースの大量使用はリコード法で推奨されるケトンダイエットでのケトン値上昇を白砂糖同様阻害してしまうため積極的には推奨されない。
一方で、どうしても白砂糖を使ってしまうという家庭では、次善の策としてトレハロースを代替に使うことには多くのメリットがあるだろう。ただ上記で述べたようにトレハロースは白砂糖と比べて甘味が弱く、砂糖代わりにトレハロースをを用いると数倍の量が必要となり、結果ケトンダイエット目的としては不向きな面もある。
そこで、ステビアなどのカロリーレスの甘味料を一定の割合で混合することで使い勝手をよくするという方法を紹介したい。一般家庭での白砂糖の使用量は大さじ一杯に満たないため、通常の使用量の範囲において糖質量の食品計算が行われていれば、以下のアルハカシュガーでケトンダイエット上許容できる量となる。
アルツハッカーシュガー割合
トレハロース1kg:ステビア6~8g(100%)
※ステビア100%の場合
トレハロースの神経保護効果
認知機能の改善
ADマウスへ2%トレハロース溶液を投与、認知機能を有意に改善、(オートファジー、アミロイドβ減少とは独立した経路の可能性)
www.ncbi.nlm.nih.gov/pubmed/28869469
ドーパミン作動性の改善
トレハロースは、オートファジー活性を通じて、パーキンソン病マウス線条体のドーパミン作動性を改善させる。
www.ncbi.nlm.nih.gov/pubmed/20546895/
リン酸化タウの減少
トレハロースは、in vivoで、オートファジーが阻害されてもタンパク質を分解する。
αシヌクレイン、タウタンパク、ハンチントンがトレハロースによって分解されることが示されている。in vitro
examine.com/supplements/trehalose/
www.sciencedirect.com/science/article/pii/S0969996110001658
トレハロース処理によってラットのタウとリン酸化タウレベルが有意に低下
www.ncbi.nlm.nih.gov/pmc/articles/PMC4268232/
トレハロース投与でマウスのタウが劇的に減少
www.ncbi.nlm.nih.gov/pmc/articles/PMC4579591/
アミロイドβからの保護効果
トレハロースはアミロイドβオリゴマーの毒性障害からニューロンを保護する
www.ncbi.nlm.nih.gov/pubmed/27252026
トレハロースはAPPの代謝を変化させ、C末端フラグメントの分解を減少させた。in vitro
www.ncbi.nlm.nih.gov/pubmed/26957541
αシヌクレイン凝集の減少
トレハロースの経口投与はレビー小体型認知症モデルマウスのオートファジー、シャペロンを誘導し、αシヌクレインレベルを抑制することが見出された。
www.ncbi.nlm.nih.gov/pubmed/26299928/
抗プリオン効果
トレハロースがプリオンに感染した神経細胞においてオートファジーが誘導されることが実証されている。
www.ncbi.nlm.nih.gov/pubmed/19182537
血管機能の改善効果
ランダム化比較試験、50~77歳の健常被験者、トレハロース100g/日を摂取。一酸化窒素が増加、微小血管機能を有意に改善。マルトース投与群では改善が見られなかった。
www.ncbi.nlm.nih.gov/pubmed/27208415
血液脳関門の修復
トレハロースは、タイトジャンクションを修復することにより、MPTPによって引き起こされる血液脳関門の損傷を減少させることが実証されている。
www.ncbi.nlm.nih.gov/pubmed/21232572
www.ncbi.nlm.nih.gov/pubmed/17182613
インスリン抵抗性の改善
トレハロースの経口投与は、マウスの脂肪細胞の肥大を防ぎインスリン抵抗性を緩和する。
www.ncbi.nlm.nih.gov/pubmed/21147367
www.physiology.org/doi/full/10.1152/ajpendo.00185.2013
抗アポトーシス
www.ncbi.nlm.nih.gov/pubmed/21053069/
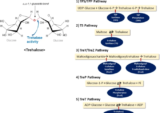
腸への作用を通した神経保護効果
経路1
トレハロースは、腸内細菌への影響による樹状細胞の免疫活性化、神経伝達物質、迷走神経ペプチド分泌などによる迷走神経の調節を介して、脳にシグナルを送り脳機能へ影響をおよぼす。
www.ncbi.nlm.nih.gov/pubmed/24109440/
マウス実験では、腹腔内の注射ではなくトレハロースの経口摂取において脳内のオートファジー誘導が示されている。
www.ncbi.nlm.nih.gov/pubmed/26299928/
経路2
トレハロースが脳へ輸送され、直接脳機能に影響をおよぼす経路。
マウス海馬でトレハロースが検出されており、トレハロースがニューロンの血管形成に必要なことが示されている。
www.ncbi.nlm.nih.gov/pubmed/28692243/

トレハロースとオートファジー
シャペロン特性
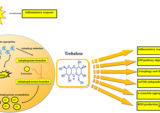
トレハロースはエネルギー源だけでなく、多くの機能をもつ。
とくに低酸素状態、高温、脱水、酸化ストレスなどの際に、タンパク質や細胞膜の変性を防ぐシャペロンの役割があると考えられている。
HSP70の過剰発現に対するトレハロースの抑制効果
www.ncbi.nlm.nih.gov/pubmed/21494875
臓器移植のさいの、臓器保存液の成分のひとつとしても使われる。
mTOR非依存性のオートファジー経路活性
トレハロースはmTOR抑制とは独立した仕組み(FoxO1の活性によるものと思われる。)で細胞内のオートファジーを増加させる。
そのため、ラパマイシンのようなmTOR阻害剤との組み合わせにより、相加的にオートファジーを促進する効果をもつものと思われる。
トレハロースーはそのオートファジー増加させる特徴から、ALSへの治療研究が行われている。
FOXO1
トレハロースは、試験管モデルにおいて筋萎縮側索硬化症(ALS)の異常タンパク(SOD1)を分解することが示されている。
オートファジー活性化に重要な役割を果たすFOXO1の核移行の増強によるメカニズムが示唆されている。
www.ncbi.nlm.nih.gov/pubmed/23851366
プロテアソーム活性
トレハロースは、オートファジー誘導を介さないプロテアソーム活性によって、グルコース欠乏による神経細胞死によって引き起こされるタンパク質凝集を阻害することが示された。
www.ncbi.nlm.nih.gov/pubmed/27771898/
ストレス顆粒
ストレス顆粒の長期的な蓄積は神経変性疾患の病因となりえる。
トレハロースはストレス顆粒の分解を促進することにより、神経保護効果を発揮しうる可能性が示唆される。
www.ncbi.nlm.nih.gov/pubmed/28276506/
グルコーストランスポーターの阻害
トレハロース(レンツトレハロース)は、グルコーストランスポーターの阻害によるグルコース取り込み抑制によりオートファジーを誘導する。
kaken.nii.ac.jp/ja/grant/KAKENHI-PROJECT-15K08013/
高濃度で阻害されるオートファジー
熱ショック後の変性タンパク質は、トレハロースの存在下で効率的に折り畳まれる(リフォールディング)。しかし、トレハロースが持続的に存在する場合は、タンパク質のリフォールディングが妨げられた。
トレハロースは細胞内輸送を変化させ、エンドリソソーム内のAPP C末端断片の分解を減少させる
www.ncbi.nlm.nih.gov/pubmed/26957541/
リソソーム阻害剤
トレハロースは神経細胞へ直接投与された場合、オートファジーフラックスの阻害剤として振る舞う。
www.ncbi.nlm.nih.gov/pubmed/28981090/
www.ncbi.nlm.nih.gov/pmc/articles/PMC6003909/
トレハロースはオートファジーの部分的阻害剤として作用している可能性がある。
トレハロースのその他の効果
運動へのエネルギー源
男性サイクリストにグルコース、ガラクトース、またはトレハロースを運動前に摂取してもらいタイムトライアルに挑戦してもらった。トレハロースを摂取した群ではインスリ反応を低下させ血糖値が低かったにも関わらず、タイムトライアルの成績には差がなかった。
www.ncbi.nlm.nih.gov/pubmed/12527978
ミトコンドリア機能
トレハロースがミトコドリアの乾燥耐性を上昇させる。
www.sciencedirect.com/science/article/pii/S0005273605002816
トレハロースはAGEを形成しない
トレハロースはグルコースによって形成される日還元糖であり、加水分解に対する強い耐性があり、酸性または高温条件下であっても安定である。
en.wikipedia.org/wiki/Reducing_sugar
脂質代謝の調整
トレハロースはオートファジーを介して脂質代謝を調整する可能性がある。
脂質分解とオートファジーには類似性があり、相互に関連する。
オートファジーの阻害は脂質貯蔵が促進される。
www.ncbi.nlm.nih.gov/pmc/articles/PMC2676208/
トレハロースのデメリット
低い生体吸収率
トレハロースはアポトーシス(細胞死プログラム)へ影響を与えることから、さまざまな治療目的で研究されてきた。
しかし、トレハロースを分解するトレハラーゼ分解酵素がヒトの腸壁内に存在しグルコースとへと分解されてしまうため、経口摂取をしてもわずかな量しか吸収されない。
www.ncbi.nlm.nih.gov/pubmed/7714684
一方でヒトや動物へのトレハロース経口投与によって、インスリン抵抗性や血管内皮の改善が見られていることから、そのいくつかは腸を透過し生理的な作用をおよぼしていると考えられる。(経口トレハロースの生理学的影響は腸内での働きによるものという仮説も存在する)
血液脳関門を透過するトレハロース
トレハロースは血液脳関門をよく通過することがマウス研究で実証されており、静注、リポソーム化などによりいったん血中に入り込めば、脳への到達は容易であるものと考えられる。
alzres.biomedcentral.com/track/pdf/10.1186/alzrt57

細菌感染リスク?
トレハロースは細菌クロストリジウム・ディフィシル(Clostridium difficile)感染流行トリガーの原因?
www.nature.com/articles/nature25178
www.bcm.edu/news/molecular-virology-and-microbiology/dietary-sugar-link-to-bacterial-epidemics
病院や長期滞在の介護施設でRT027またはRT078株によるクロストリジウム・ディフィシレのアウトブレイクが起きた場合、患者の食事に含まれるトレハロースの消費を制限するべき。
www.medicalnewstoday.com/articles/320520.php
RT027、RT078株のみが低濃度のトレハロースでも増殖することが可能。
www.ncbi.nlm.nih.gov/pmc/articles/PMC5984069/