Contents
Trace Elements as Immunoregulators in SARS-CoV-2 and Other Viral Infections
www.ncbi.nlm.nih.gov/pmc/articles/PMC7879594/

om.co/2020/05/30/book-review-trace-elements-by-donna-leon/
要旨
栄養不足は免疫力の低下や感染症への感受性の増加と関連している。微量元素と高分子との複雑な相互作用により、ウイルス性疾患に対する効果的な免疫応答が引き起こされる。亜鉛、セレン、鉄、銅などの微量元素は、免疫調節作用を持つため、感染症の発症に影響を与える。
利用可能な電子データベースは、フルテキストが利用可能で、「微量元素」、「COVID-19」、「ウイルス感染症」、「免疫応答」(個別にZn、Se、Fe、Cu、Mn、Mo、Cr、Li、Ni、Co)のキーワードがタイトルと要旨に記載されている論文を網羅的に検索した。利用可能な論文に基づいて、我々はCOVID-19と免疫系との相互作用を特別に参照して、ウイルス感染症における微量元素の役割を探っていた。
亜鉛、セレンおよび他の微量元素は、TH1細胞およびサイトカイン介在性免疫応答を誘発し、炎症性サイトカインの実質的な産生を促進するために不可欠である。いくつかの微量元素の抗ウイルス活性は、ウイルスの侵入、複製、および他の下流プロセスに対するそれらの抑制効果に起因する。抗酸化活性を有する微量元素は、宿主の免疫応答を調節するだけでなく、ウイルスゲノムを改変する。微量元素の十分な食事摂取は、ウイルスの活性化、発生、分化および多くの機能に不可欠である。
キーワード
微量元素、細胞を介した免疫、亜鉛、セレン、銅、マンガン、サイトカイン、活性酸素、COVID-19
序論
ヒトは近年、重症急性呼吸器症候群(SARS-2003)中東呼吸器症候群(MERS-2012)および新規コロナウイルス(n-COV)病などのコロナウイルスによる3つの主要な伝染病を世界中で目撃している[1, 2]。2019年12月に中国・武漢市でCOVID-19が出現した。2020年1月12日に世界保健機関(WHO)により新規コロナウイルスとして命名され、その後2020年2月11日にWHOにより重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)と改名された。
SARS-CoV-2の広がりを抑制するために、どの国も新型コロナウイルス感染症(COVID-19)の広がりを避けるために、検疫、マスクの着用、社会的遠距離、食品関連企業や市場の一時的な閉鎖のようないくつかの措置を実施している。この期間中、個人は世界の倦怠感を感じ、炭水化物、脂肪、タンパク質などの多量の多量栄養素の消費に関連している[3]。多量栄養素の消費量の増加は、微量栄養素の欠乏を伴うこともある。このようなバランスの悪い食生活は、一般的に免疫反応の低下と関連しており、自然免疫と適応免疫の両方に影響を与え、重篤な病気(図1)につながり、ウイルスやその他の感染症にかかりやすくなる[4]。
図1 ウイルス感染症に対する免疫における栄養の役割の模式図
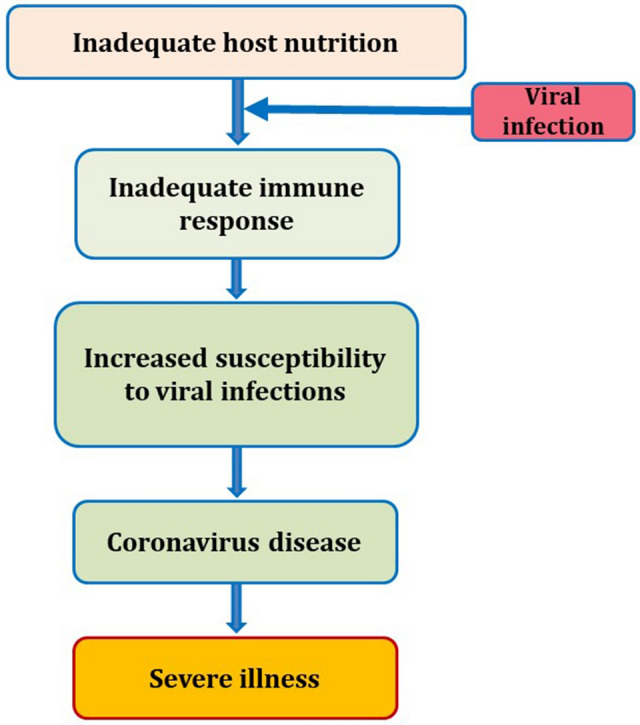
微量栄養素のバランスが適切に保たれていると、宿主の免疫応答が強化され、ウイルス感染症の予防につながる可能性がある[5]。セレン(Se)亜鉛(Zn)銅(Cu)マンガン(Mn)などの必須微量栄養素は免疫調節機能を有しているため、様々なウイルス感染症の経過や結果に対する感受性に影響を与えている[6]。微量元素、コロナウイルスと免疫系の相互作用は、感染症に対する免疫応答を最適化するための宿主の栄養における微量元素の重要性を強調し、ウイルスの病原性を増加させる可能性があるウイルスの変異を防止することにある。Pubmed, Google, Scopus などの電子データベースを用いて、「微量元素」、「COVID-19」、「ウイルス感染」、「免疫応答」(Zn, Se, Fe, Cu, Mn, Mo, Cr, Li, Ni, Co)のキーワードをタイトルと要旨に含むフルテキストの論文を網羅的に検索した。利用可能な論文に基づいて、COVID-19と免疫系との相互作用を特別に参照しながら、ウイルス感染における微量元素の役割を探っている。
微量元素の食事的重要性
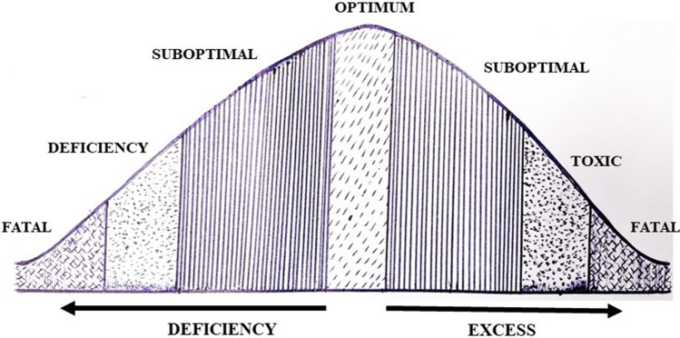
微量元素を定期的に摂取することは、全身の健康を維持する上で非常に重要である。各種微量元素の推奨食事摂取量は、健康的な生活を送るためのバランスのとれた食事として、定期的に摂取するための明確な仕組みを与えている[7](表1)。適切な量の摂取は、重要な機能を実行するために不可欠である。微量元素の欠乏は、機能低下、栄養失調、欠乏性疾患につながり、過剰な摂取は致命的な結果につながる毒性を引き起こす一方で、微量元素の欠乏は、致命的な結果につながる(図2)。微量元素の栄養欠乏は、免疫力の低下や感染症への感受性の増加と関連している[8]。
表1 免疫機能を促進するための必須微量元素の推奨摂取量
| S.いいえ | 微量元素 | 成人男性のサプリメント量/日 | 成人女性のサプリメント量/日 |
|---|---|---|---|
| 1 | 亜鉛 | 11mg | 8mg |
| 2 | セレン | 55μg | 55μg |
| 3 | 鉄 | 8mg | 18mg |
| 4 | 銅 | 900 µg | 900 µg |
| 5 | マグネシウム | 400mg | 310mg |
図2 微量元素の欠乏・過剰摂取による潜在的な悪影響
亜鉛、セレン、鉄、銅、マンガン、モリブデン、コバルト、ヨウ素、フッ化物、クロム、ニッケルなどの11種類の微量元素がある。証拠は、バナジウム、ケイ素、ホウ素が適度な量で有益な生物活性を持っていることを示唆している[9]。微量元素は、細胞膜の受容体部位にある分子と結合したり、膜の構造を交互に変化させて特定の分子の細胞内への侵入を防ぐことで、細胞の重要なプロセスを制御していることが証明されている[10]。微量元素は、グルタチオンペルオキシダーゼ(GPx)スーパーオキシドディスムターゼ(SOD)RNAポリメラーゼなどの多くの酵素の補酵素として作用し、また、多くの酵素やToll様受容体-4のような受容体タンパク質、Nf-kBのような転写因子の構造を安定化させるセンターとしても機能することで、重要な生化学的機能を媒介している[11, 12]。
コロナウイルス感染症に対する免疫力
コロナウイルスは、主に呼吸器疾患の原因となる人獣共通感染症ウイルスである。SARS-CoV-2はβ-コロナウイルス属に属する。全ゲノムの系統解析からSARS-CoVとの類似性が確認されている。一般に、ヒトの免疫システムは、様々な特異的および非特異的なメカニズムを介してウイルス感染と戦っている。いくつかの免疫防御機構は、宿主からウイルスを排除することができる。樹状細胞やマクロファージのような抗原提示細胞は抗原を貪食し、リソソームの助けを借りて断片に分解する。これらの断片は、主要組織適合性複合体のクラスIまたはクラスII分子に装填され、抗原提示のために細胞表面に運ばれる。T細胞上のToll様受容体と共受容体は、表示された抗原に結合する。ヘルパーT細胞はサイトカインを分泌し、細胞傷害性T(TC)細胞やB細胞を活性化させる。TC細胞は細胞媒介免疫(CMI)を介してウイルス感染細胞を死滅させ、B細胞は抗体を分泌して体液性免疫を行う [13]。SARS-CoV-2に感染すると、免疫エフェクター細胞から「サイトカインストーム」と呼ばれる大量の炎症性サイトカインやケモカインが放出される。このサイトカインストームは、激しい全身の炎症反応、敗血症、多臓器不全を引き起こし、重症化すると死に至る。コロナウイルスの免疫回避機構は、主にI型インターフェロン(IFN)産生の阻害によるものである。I型IFNの欠乏は、抗体産生、エフェクターT細胞応答、IFN刺激遺伝子の発現の欠損をもたらし、さらに抗原提示の低下をもたらす[14, 15]。
COVID-19および他のウイルス感染に対する免疫応答における微量元素
亜鉛
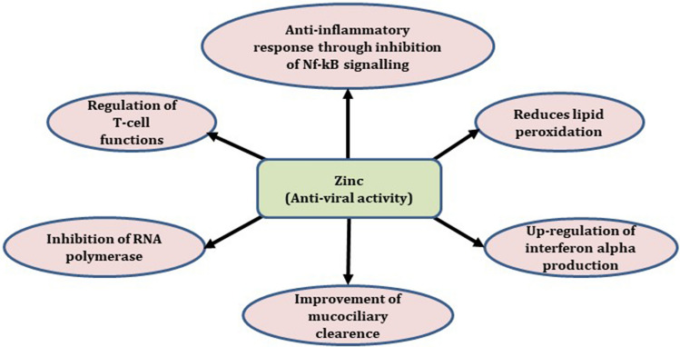
亜鉛(Zn)は、ジンクフィンガーモチーフや転写因子に不可欠な成分である。亜鉛の約20%は生体膜タンパク質の一部であり、50%は細胞小器官と細胞質に存在し、30%は核に存在する[16]。亜鉛の適切な濃度は、Tリンパ球の分裂、分化、成熟、T細胞のマイトジェンへの応答、白血球におけるいくつかの免疫調節遺伝子の転写に不可欠である。重度の Zn 欠乏は、一次および二次免疫応答の両方の障害を引き起こす。亜鉛は転写因子として作用するZnフィンガータンパク質の構成要素である[17]。亜鉛は、特に免疫系において、高度に増殖する細胞に不可欠であり、自然免疫機能と後天的免疫機能の両方に影響を与える[18]。亜鉛は酸化ストレスに対する細胞質防御(SOD活性)に関与し、サイトカインの放出を調節して増殖を誘導するチムリンの必須補因子である。亜鉛は中央ドグマにおいて極めて重要な役割を果たしており、RNAおよびDNAポリメラーゼ、リボヌクレアーゼ、チミジンキナーゼを含む多くの酵素の補酵素として作用している。これらの酵素は、免疫細胞の成長、発生、成熟、細胞分裂に不可欠である(図3)。
図3 亜鉛の生化学的・抗ウイルス機能
酸化ストレスとSARS-CoV感染に対する亜鉛の役割
亜鉛は2価の遷移金属で、抗酸化酵素SODのキーファクターである。SODはスーパーオキシド(O2–)を過酸化水素(H2O2)に変換する。
O⋅−2+O⋅−2+2H+→H2O2+O2
SARS-CoV-2 ウイルスの病態生理学的プロセスは、酸化還元不均衡と酸化ストレスに影響を与える。この現象は、活性酸素種(ROS)を過剰に生成し、抗酸化防御機構を奪います。酸化ストレスマーカーとウイルス性疾患の重症度との間には強い相関関係があり、ウイルスの複製とそれに伴う合併症に重要な役割を果たしている[20]。いくつかの研究では、SARS-CoVによる重度の肺損傷は、酸化ストレスが転写因子NF-kBを介して炎症反応を悪化させることが示唆されている。亜鉛は抗酸化システムに関与する多目的な機能を達成し、炎症反応と改善された抗ウイルスメカニズムを調整し、COVID-19のための保護アジュバント療法を持っている。食事のZnのサプリメントは、健康とSARS-CoV-2パンデミック状況の改善に有益な影響を提供する。微量元素は、ウイルス感染症の抗酸化金属酵素の非特異的活性化剤を果たしている。抗酸化物質は、T細胞サブセットの数を増加させ、インターロイキン-2産生を増加させ、マイトゲンに対するリンパ球応答を強化し、ナチュラルキラー細胞活性を増強し、プラセボと比較してインフルエンザウイルスワクチンへの応答を増加させる[21]。
免疫系における亜鉛の役割
いくつかの研究では、刺激の種類と亜鉛の濃度に応じて、免疫系が刺激されたり抑制されたりすることが示されている。亜鉛の十分な摂取はTH1反応をサポートし、粘膜の完全性を維持するのに役立ち、未結合の亜鉛イオンはライノウイルスの複製に直接的な抗ウイルス効果を発揮する。亜鉛の補給は、自然免疫の細胞成分(マクロファージや好中球による貪食、NK細胞活性、酸化バーストの発生、DTH活性など)抗体反応、細胞傷害性CD8+T細胞の数(TH1反応)を増加させる。亜鉛欠乏は、リンパ球の萎縮と多くのT依存性抗原に反応する能力の低下をもたらす。Znの高レベルは免疫抑制性であり、マイトゲンに対する好中球やT細胞の増殖を減少させ、抗体産生を減少させる。したがって、Znの不均衡は免疫機能に悪影響を及ぼす[22]。胸腺ホルモンの活性は、Zn、Cu、Seの欠乏で低下する。マウスモデルでの亜最適レベルの亜鉛欠乏は胸腺のサイズを減少させ、脾臓のマクロファージとリンパ球を枯渇させた[23]。
コロナウイルスの発病に対する亜鉛の役割
亜鉛は免疫系のブースターであり、免疫能力に重要な役割を果たしている[24]。亜鉛は免疫細胞の発生と成熟、炎症反応に関与している。亜鉛はそれぞれDNAやRNAポリメラーゼなどの複製酵素系や転写酵素系の細胞内機械の補酵素として作用する。C型肝炎やライノウイルスでは、亜鉛はRNA依存性RNAポリメラーゼ(RdRp)などの細胞内補因子を阻害することで抗ウイルス活性を示した[25]。亜鉛はSARS-CoVのRNA合成の伸長期を阻害するが、これはテンプレート結合への影響によるものと考えられる。レプリカーゼポリプロテインのタンパク質分解処理とRdRp活性は亜鉛によって阻害されるようである[26]。コロナウイルス複製の特徴的な特徴は、サブゲノム(sg)mRNAの5′-および3′-共末端ニダスセットの構造タンパク質および付属タンパク質をコードする遺伝子の転写である[27]。無細胞系や感染細胞では、コロナウイルス複製酵素ポリプロテインの処理は、タンパク質分解機構を阻害することにより、Znによって阻害されている[28]。ピコルナウイルス、呼吸器感染症ウイルス、インフルエンザウイルスのようないくつかのRNAウイルスに基づく研究では、ピリチオン、ヒノキトール、ピロリジンジチオカルバメートのような化合物の添加は、複製を阻害する細胞のZn濃度を増加させることが示された[29]。クロロキンの抗ウイルス活性は、Znイオノフォアとしての作用に起因している可能性がある(図4)。
図4 COVID-19に対する亜鉛の様々な作用機序
亜鉛はアポトーシスに必要である。遺伝子の転写はリンパ系と骨髄系の起源に属する[30]。重度の亜鉛欠乏症の人は免疫機能が低下している。クロロキン(クロロキン)またはその代謝物であるヒドロキシクロロキン( ヒドロキシクロロキン)とともに亜鉛を補給することは、クロロキンおよび ヒドロキシクロロキン単剤療法よりもCOVID-19の罹患率および死亡率の低下に効果的である[31]。ヒドロキシクロロキンは抗原の処理と提示を阻害し、エンドソームの酸性度を低下させることでウイルスの細胞質への放出を停止させる[32]。Sattarらは、アジスロマイシンやクロロキンと一緒に亜鉛を摂取することでCOVID-19患者の回復率が向上するという症例報告を発表している[33]。Vero-E6細胞を用いた研究では、亜鉛がテンプレート結合と伸長を介してSARS-CoVのRdRpを阻害することが報告されている。また、亜鉛とケルセチンの相乗作用により、SARS-CoV-1ゲノムの転写中のRdRpの転写が抑制されることが報告されている[34]。SARS-CoV-2のウイルス侵入と生殖周期はSARS-CoVとほぼ同様であったが、アンジオテンシン変換酵素2(ACE-2)はSARS-CoV-2のII型肺炎球への侵入のための受容体として作用した[35]。Zn処理によるACE-2受容体レベルの調節は、COVID-19治療における潜在的な治療戦略と考えられていた[36]。100μMの濃度のZnに曝露することで、ラット肺における組換えヒトACE-2活性が低下することが明らかになった[37]。亜鉛の補給は、白血球によるインターフェロン-α産生を増加させ、自然免疫を促進する[38]。亜鉛の濃度は生理的レベルに近いが、SARS-CoV2-ACE-2相互作用を調節する効果は仮説的なものに過ぎないようである。SARS-CoV感染症では、呼吸器粘膜の毛様体上皮が深刻な損傷を受け、粘液クリアランスの喪失、下気道感染症、肺炎などを引き起こしている[39]。動物モデルでは、亜鉛を投与すると、繊毛の長さ、粘液クリアランス、毛様体拍動の頻度、毛様体上皮の完全性が増加する[40-42]。
セレン
セレン(Se)は、タンパク質の折り畳み、カルシウムフラックス、免疫細胞の活性化、増殖、分化に不可欠である[43]。チオレドキシン還元酵素(TxR)やGPxのようなセレノプロテイン/セレノ酵素の形でのセレン機能は、酸化還元調節や抗酸化機能において重要な役割を果たしている[44]。TrxRは、還元されたチオレドキシンの細胞プールを維持する。還元されたTrxは、DNA生合成、転写因子の活性化、細胞増殖、アポトーシス、遊走、炎症経路における遺伝子発現の調節に関与している[45]。GPxは細胞質酵素であり、還元されたグルタチオンと水素/脂質過酸化物を基質として必要とし、酸化されたグルタチオンと水/酸素に変換される。セレンは免疫細胞のGPxとリン脂質レベルを促進する。
セレンは、自然免疫と後天的免疫の両方を最適化する(図5)。セレンの低用量補給は、呼吸器感染症に対する体液性免疫を低下させる[46]。セレンはT細胞の増殖、IFN-γの増加、サイトカイン産生を介してCMIを増加させる。セレンはまた、ペルフォリン-グランザイム経路を介してNK細胞媒介免疫を促進する[47]。セレン欠乏は免疫系を低下させ、コロナウイルスの病原性を助長することが示されている。宿主細胞でのウイルス複製を阻害する。SARS-CoVの病原性は、主に肺炎球への浸透性に依存している[48]。セレン酸ナトリウムは、コロナウイルスの健康な宿主細胞への侵入を阻止することで、ウイルスの感染性を停止させる[49]。セレン酸ナトリウムの抗ウイルス作用は、ウイルスタンパク質中のチオール基を酸化することで発揮され、宿主細胞膜への浸透を可能にする[50]。ある研究では、湖北省でのセレン欠乏はSARS-CoV-2の病原性を増加させることが示された[51]。血清中のSe濃度の低下はHIV、インフルエンザA、SARSコロナウイルスのゲノムに変異を蓄積させ、病原性の変化には遺伝的構造が関係していることを示唆している[52]。セレン欠乏はウイルスゲノムの突然変異を増加させ、病原性と死亡率の増加につながることが動物モデルで示されている[48, 53]。
図5 セレンの生化学的活性と抗ウイルス活性の様々なメカニズム
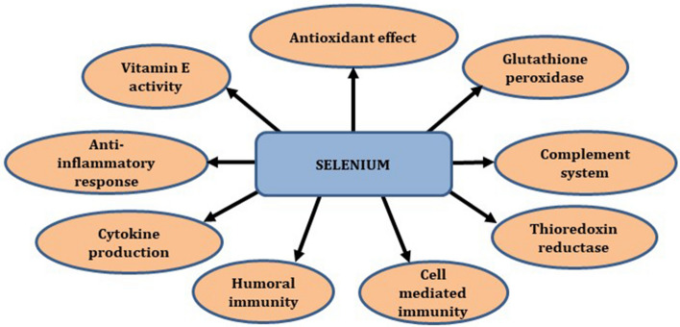
補体系は、C1qAが重要な役割を果たす非特異的免疫系の一部である。インフルエンザウイルスタンパク質M1はC1qAと強固に相互作用し、それによって宿主免疫系から脱出する [54]。コロナウイルスはエラーを起こしやすいポリメラーゼを持っているため、RNAはいくつかの変異を受けやすく、遺伝的多様性を示唆している[55]。セレン不足はウイルスRNAに酸化的損傷を与え、結果として突然変異率を増加させる。ウイルスゲノムにおける突然変異の増加は、病原性のある攻撃的な新株の生成を促進する。セレンは亜鉛とともに多くのウイルス感染症において免疫調節効果を促進する。栄養の十分な摂取は、より良い回復力を示し、COVID-19感染からの病理学的条件を減少させる[48]。セレン欠乏マウスでは、インターロイキン(IL)-4,IL-5,IL-10,IL-13などのサイトカインが上昇したが、IL-2やIFN-γは減少した。このような変化は、コロナウイルスの病原性を高めるTヘルパー細胞の機能パターンを変化させている可能性がある。セレンはビタミンEと相性が良く、数種類の酵素の働きを助けてフリーラジカルの発生を防ぐ。免疫細胞や組織の酸化的損傷を防ぐ。この相乗効果により、ニワトリの二価感染性気管支炎コロナウイルス生ワクチンに対する免疫が誘導された[56]。これらの観察から、適切な量のSeの摂取がSARS-CoV-2感染症の治療に有効な治療法である可能性が示唆された。
鉄
鉄は電子輸送の連鎖反応に欠かせない。酸素はヘモグロビン中の鉄と結合し、様々な組織に運ばれる。細胞の分化や細胞の増殖も鉄によって制御されている。過酸化物や一酸化窒素を生成する酵素も鉄を構造成分・補因子として持っている[57]。サイトカインの産生とその作用機序の制御には鉄が必要である。リン酸化は、免疫細胞の増殖に重要なシグナル分子であるプロテインキナーゼCの活性化を必要とし、その活性化には鉄を必要とする[58]。鉄の欠乏または過負荷は、免疫系に好ましくない機能的コストをもたらした。伝染性のウイルスや微生物が継続的に存在し、増殖するためには、鉄やその他の微量栄養素が必要である。感染因子に対して免疫系が適切に機能するためには、最適な濃度が必要である。鉄欠乏期では、ロゼットを形成するT細胞がわずかに減少し、マイトゲンや抗原に対するリンパ球の増殖が低下する[24]。
鉄の分布は、この微量元素に対する潜在的に有害な微生物の侵入を減少させるために厳密に制御されなければならない。鉄の欠乏は、特にCD4+ TH1亜集団のTリンパ球数の変化をもたらす[59]。小児における鉄欠乏性貧血は、TH細胞の成熟障害と関連しており、鉄の補給により復活する[60]。TH2リンパ球は、TH1リンパ球に比べて鉄の貯蔵量が多く、乏しい。そのため、TH1 リンパ球に対する鉄欠乏の影響は TH2 リンパ球に比べて大きいのである。鉄欠乏はリンパ球の増殖を阻害するが、これはプロテインキナーゼ C の転座の減少または活性化によるものである[61]。
チトクロムa、b、c、NADH、コハク酸脱水素酵素などのエネルギー生産などのハウスキーピングプロセスは、その構造と機能が鉄に依存している金属タンパク質を必要とする。ミエロプロキシダーゼに依存する次亜塩素酸の生成のような微生物殺傷因子は、ヘム鉄を必要とする[61]。胸腺の萎縮は鉄欠乏で起こるのであって、プログラムされた細胞死の増加ではない[62]。また、鉄欠乏は血液中の循環Tリンパ球の減少をもたらす。Tヘルパー細胞およびTサプレッサー細胞は、低鉄濃度に対して非常に感受性が高い。
コロナウイルスの複製には十分な量の細胞内鉄濃度が必要であるが、鉄欠乏はウイルスの転写、翻訳、組み立て、エキソサイトーシスを阻害することでウイルスの複製を妨害する。コロナウイルスはエンベロープを宿主膜と融合させて宿主細胞に侵入し、ウイルスゲノムやヌクレオカプシドを分解して放出する。転写と翻訳を経て、ゲノムRNAと構造タンパク質が産生される。コロナウイルスはさらに処理された後、小胞体やゴルジ体に集合し、新しい子孫を形成する[63]。最後に、ウイルスを含む小胞のエキソサイトーシスが起こる。この過程では、鉄を含む酵素とATPが必要とされる。したがって、コロナウイルスの複製には十分な量の鉄が必要であり、鉄欠乏はこのプロセスを不利にする[64-66]。
銅
銅(Cu)は電子輸送鎖(ETC)を介したエネルギー生産に重要な役割を果たしている。ETCに銅を必要とする酵素は、チトクロムC還元酵素とチトクロムオキシダーゼである。SOD のような特定の酵素は、その調節と酵素の酸化防止剤としての触媒機能のために銅を必要とする。活性酸素を鎮めることができるSOD(Cu, Zn-SOD)の作用には、CuとともにZnも必要である。銅はスーパーオキシドアニオンを酸素とH2O2に変換することで重要な役割を果たしている。その不足分は食事から摂取することで減少させることができる。また、鉄の代謝にも必要である[67]。過剰と欠乏の両方の状態の銅は、免疫応答を変化させる。銅は、免疫系の発達、成熟、および適切な機能において重要な役割を果たしている。銅の欠乏は、抗体形成細胞の反応を低下させ、様々なウイルス感染症への感受性を高める[68]。「好中球減少症」として知られる循環好中球の数の減少は、銅欠乏症で見られる[69]。重度のCu欠乏ラットでは、腹膜マクロファージのカンジダ・アルビカンスに対する細胞のCu状態の低下、活性酸素の増加、殺菌活性を示した。後天的免疫応答の有効性は、銅欠乏症では低下する。銅欠乏動物は脾臓B細胞からの抗体産生の減少を示した[70]。銅欠乏児では免疫グロブリンや貪食が比較的少ない。銅欠乏児では、銅を補給すると貪食指数に有意な改善が見られる。末梢血単核球の増殖はCu欠乏により有意に減少した[71]。
銅は、気管支炎ウイルス、ポリオウイルス、ヒト免疫不全ウイルス1型(HIV-1)などの感染性ウイルスの影響を軽減する説得力を持っている。銅は、エンベロープされたウイルス、エンベロープされていない一本鎖、二本鎖のDNA、RNAウイルスに対して中和効果を示する。過酸化物と銅イオンの混合物は、単純ヘルペスウイルス(HSV)においてグルタルアルデヒドよりもウイルスを殺す相乗効果を示した[72]。ヒト新型コロナウイルス29Eの銅への曝露は、ウイルスの遺伝子やDNAを制御し、エンベロープの溶解や表面スパイクの菲薄化などのウイルスの形態も制御している[73]。その結果、n-COV は銅に対して高い感度を示し、不活性化することが示唆された [74]。Cu2+は、SARS-CoV-1が複製に必要なタンパク質であるパパイン様プロテアーゼ2を阻害することが細胞ベースの研究で示されている[75, 76]。
リチウム
リチウム(Li)はコロナウイルス気管支炎ウイルスに対して抗ウイルス効果を示す [73]。リチウムは、Vero細胞におけるコロナウイルスの複製と細胞内への侵入を抑制し、用量依存的にウイルスタンパク質の転写、翻訳を抑制する[77]。リチウムはCOX-2発現、IL-1β、TNF-αを抑制し、IL-2,IL-10のレベルを上昇させることで抗炎症作用を持つ。このことから、リチウムはCOVID-19の治療に有効であることが明らかになった[78]。
ニッケル
ニッケル(Ni)は、細胞や組織に信頼できるレベルで存在する必須微量栄養素であり、生理的意義を示唆する量のDNAやRNAにも関連している。免疫系の調節に不可欠である。低用量の塩化ニッケルの投与は免疫毒性効果を引き起こす[79]。いくつかの研究で、ニッケルは脾臓のB細胞とT細胞の活性を高め、NK細胞の活性を低下させることが証明されている[79]。ヒトコロナウイルスは、室温(〜21℃)で銅とニッケルからなる合金表面上で、おそらく活性酸素の発生を介して急速に不活化されることが観察されている[80](表(表22))。
表2 健康成人における各種ウイルス性疾患中の微量元素の状態とその基準間隔
| S.いいえ | 微量元素 | 健康な成人の基準範囲 | ウイルス性疾患における微量元素の傾向 |
|---|---|---|---|
| 1 | 亜鉛 | 66〜110 µg / dL [ 85 ] | 減少[ 39 ] |
| 2 | セレン | 5.8〜23.4 µg / dL [ 85 ] | 減少[ 51 ] |
| 3 | 鉄 | 12.5〜26ミリモル/ L [ 86 ] | 減少[ 59 ] |
| 4 | 銅 | 75〜145 µg / dL [ 85 ] | 減少[ 68 ] |
| 5 | リチウム | 0.8〜1.2ミリモル/ L [ 87 ] | 減少[ 78 ] |
| 6 | ニッケル | 0.3〜1.1 µg / L [ 88 ] | 減少[ 80 ] |
| 7 | マンガン | 4.7–18.3 µg / dL [ 85 ] | 減少[ 89 ] |
| 8 | クロム | 2〜3 nmol / L [ 90 ] | 減少[ 91 ] |
| 9 | フッ化物 | 0.29〜1.52 µmol / L [ 92 ] | 減少[ 93 ] |
| 10 | コバルト | 1.9〜7.6 nmol / L [ 90 ] | 減少[ 94 ] |
| 11 | ヨウ素 | 40〜80 µg / L [ 95 ] | メカニズムは不明[ 96 ] |
| 12 | モリブデン | 0.28〜1.17 ng / mL [ 97 ] | 減少[ 98 ] |
全血・血清中の微量元素の推定
微量元素のレベルは、SARS-CoV-2感染患者の血清/全血サンプルから推定することができる。血液サンプルは、リチウムヘパリン抗凝固剤を含む空腸装置を用いて採取した。μg/mLまたはng/mLの濃度範囲にある微量元素の定量には、誘導結合プラズマ質量分析法(ICP-MS)および誘導結合プラズマ光学発光分析法(ICP-OES)を使用することができる[81]。その他の技術としては、イオン選択電極(ISE)測光、発光分光法(ES)中性子放射化分析(NAA)アノードストリッピングボルタンメトリー(ASV)原子吸光光度法(AAS)高速液体クロマトグラフィー(HPLC)全反射蛍光X線分析(TXRF)などがあり、微量元素の定量に使用される。TXRFは微量元素の定量法として最も提案されている手法である。TXRFは費用対効果が高く、信頼性の高い方法であり、多種多様な生体試料中の微量元素とその相互作用を検出することができる。体液中の微量元素の定量には、連続した単一元素の定量法が多く用いられているが、TXRFは多種類の微量元素の定量が可能である。TXRFは多種類の微量元素を定量する技術であり、時間を節約でき、分析に必要な生物学的サンプル数も少なくて済みます。TXRFの主な利点は、検出限界のピコグラムの範囲とより正確な技術である[82]。銅のような微量元素はまた、例えば赤血球スーパーオキシドジスムターゼ、血清セルロプラスミンとシトクロムc酸化酵素アッセイなどの機能試験によって測定することができる。フッ化物レベルは、イオン特異的電位差測定法によっても測定される[83]。
結論
微量元素は、免疫細胞の活性化、発生、分化に不可欠であり、免疫細胞の多くの機能を果たす。亜鉛、セレン、銅などの微量元素の分子機構は、SARS-CoV-2感染症に対してかなり解明されている[49, 84]。また、COVID-19や他のウイルス感染症におけるニッケルやリチウムの役割についての研究はほとんど行われていない。SARS-CoV-2の抗ウイルス免疫における微量元素の分子機構を解明するために、多くの実験研究(生体内試験および試験管内試験の両方)が進行中である。微量元素がインフルエンザウイルス、HSV、HIV、BVDVなどの特定のウイルスに対して抗ウイルス活性を有することは既に実証されている。ヒトの免疫系の機能と発達をサポートする微量元素は、COVID-19のリスクを減少させる可能性がある。微量元素の栄養学的重要性の上記のすべての説明は、COVID-19感染症の平常時および検疫期間に従うべき健康的な生活様式を表している。免疫をサポートする微量栄養素の適切な供給源の摂取、食事の適切な時間と積極的なアプローチは、このCOVID-19パンデミック状況との戦いに役立つ可能性がある。
今後の展望
微量栄養素は、免疫系の発達や成熟には、多量栄養素と同等の可能性を持っている。微量栄養素の不足は、世界的にも大きな問題となっている。これまでの研究により、微量元素には様々な面で免疫調節作用があることが明らかになっていたが、多くの微量元素の分子機構はまだ解明されていない。しかし、自然免疫や後天的免疫に関連する微量元素の分子機構は未だ解明されていないのが現状である。
