Therapeutic potential of trehalose in neurodegenerative diseases: the knowns and unknowns
www.ncbi.nlm.nih.gov/pmc/articles/PMC8343311/
2021年2月19日オンライン公開
Masoomeh Khalifeh, George E. Barreto, and Amirhossein Sahebkar, PharmD, PhD*.
神経変性疾患(ND)は、破壊的かつ長期的な臨床的影響により、高い負担を伴う健康問題の一つとなっている。パーキンソン病(PD)、アルツハイマー病(AD)、タウオパチー、筋萎縮性側索硬化症(ALS)、ハンチントン病(HD)やSCA3などの脊髄小脳失調症(SCA)などのポリグルタミン(ポリQ)増加性疾患など、プロテインパチーと呼ばれる多くの晩発性NDの最も共通した病的特徴として、ミスフォールド蛋白の細胞凝集が挙げられる(Renna et al.、2010年)。ミスフォールドタンパク質は、翻訳後共役(例えば、ADの高リン酸化タウ)、タンパク質内分解(例えば、アミロイドβペプチド)、あるいは特定のタンパク質(HDのHTT、PDのαシヌクレイン、プリオン病のPrPC、ALSのSOD1やTDP-43など)の遺伝子変異によって生成し、オリゴマー形成に至る。
一般に、ミスフォールドしたタンパク質は細胞内に蓄積されず、細胞の品質管理機構によって除去される。しかし、オリゴマーは既知のタンパク質分解経路に対して部分的に抵抗性を示し、線維性封入体に成長する傾向がある(Ciechanover and Kwon, 2015)。さらに、βシートに富む凝集体は、様々な細胞内分子と相互作用し、ユビキチン-プロテアソーム系だけでなく、シャペロンを介したオートファジーも直接的または間接的に損ねる可能性がある。新たな証拠は、オートファジーがNDと密接に関連していることを示唆している(Ciechanover and Kwon, 2015)。生化学的解析により、多くのNDの死後脳サンプルにオートファジー空胞が豊富に存在し、病的タンパク質と共局在していることが示されている(Tan et al.、2014)。したがって、オートファジーの刺激が神経病理学および神経変性を改善するという考え方は大きな注目を集めており、オートファジー経路を標的とする様々な薬剤が潜在的な治療法として実験的に検討されている。
トレハロースもその一つで、PD、AD、HDなどの様々なNDの動物モデルで神経保護効果を示すことが報告されている。トレハロースは、マイコースの名でも知られ、グルコース2分子がα、α-1、1結合した非還元性の2糖類で、微生物、植物、無脊椎動物に多く存在する。トレハロースの物理的および化学的特性は、その非還元性から生じ、化学的安定性、高い親水性、および酸加水分解とグルコシダーゼによる切断の両方に対する強い抵抗性をもたらす(Leeら、2018年)。トレハロースの摂取は、食事の一部として一般的に安全であり、血糖値の急激な上昇を誘発することはない。50gまでの用量では、トレハロースはヒトにとって安全であり、トレハロース欠乏症の人を除く大部分の被験者で症状は報告されていない;胃腸の副作用が発生する可能性がある。動物実験では、散発的に下痢を起こしたが、静脈内投与による死亡例はなかった。トレハロースは、経口または静脈内投与により、グルコースと同様に吸収される。しかし、腸管ブラシボーダーおよび腎臓、肝臓、血液の近位尿細管に存在する酵素トレハラーゼによってグルコースに部分的に加水分解される(Emanuele, 2014)。
トレハロースは、様々な異なるメカニズムを用いて生体高分子や生体システムを保護することができる(図1)。当初は、タンパク質構造に対する安定化活性を持ち、タンパク質の凝集を防ぐ化学シャペロンとして知られてた。トレハロースは、HD、AD、プリオン病の細胞モデルにおいて、部分的にアンフォールドしたハンチンチンタンパク質を安定化し、βアミロイド(Aβ)およびスクレイピープリオンタンパク質(PrPSc)の凝集をそれぞれ阻害することが示された(Lee et al.、2018)。さらに、トレハロースは、酸素フリーラジカルを消去し、誘導性一酸化窒素合成酵素の発現または一酸化窒素の形成を防止することにより、in vivoおよびin vitroの両方で有意な抗酸化および抗炎症効果をそれぞれ発揮し得る(Emanuele, 2014)。
図1 トレハロースによる主に仮説のある神経保護メカニズムの模式図
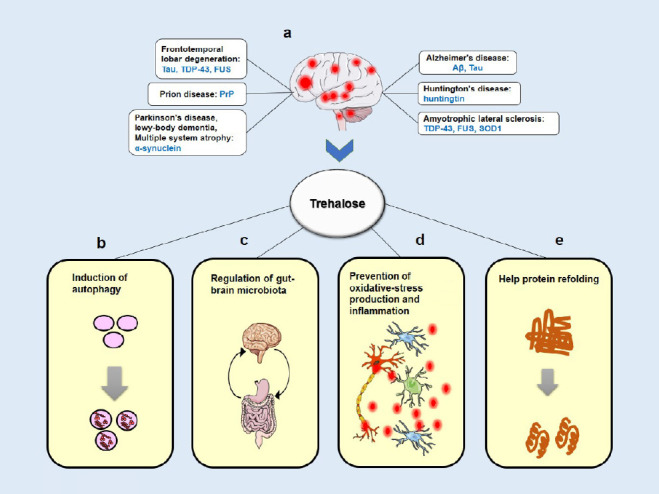
(a) ほとんどの神経変性疾患では、様々なタンパク質がその構造を変化させ、脳内に蓄積される。(b) トレハロースは、オートファジー空胞の形成を増加させることにより、毒性タンパク質のクリアランスを促進した。(c)一つの可能性として、トレハロースは腸内細菌叢に影響を与えることで神経保護作用を発揮することがわかった。(d) トレハロース処理により、活性酸素の量が低下し、炎症反応が抑制された。(e)トレハロースは、化学シャペロンとして作用し、タンパク質の折り畳みや凝集に影響を与えることで、変異タンパク質の病理を減少させる。
近年、タンパク症モデル(in vitroおよびin vivoの両方)におけるトレハロースによる神経保護のメカニズムを説明する主な理論として、オートファジー誘導が提案されている(Hosseinpour-Moghaddam et al.、2018)。細胞培養実験では、トレハロース処理は、様々な哺乳類細胞においてオートファジックフラックスを増加させることにより、変異ハンチンチン、α-シヌクレイン、およびタウタンパク質のクリアランスを向上させた。これらの保護効果は、細胞内のトレハロースによって媒介されることが提案された。動物実験でも同様の観察がなされ、トレハロースの経口および腹腔内投与によりオートファジーが誘導され、タンパク質の凝集が抑制された。さらに、炎症およびグリオシスが減少し、行動および神経生物学的欠陥がトレハロースに応答して部分的に回復した(Leeら、2018)。例えば、トレハロースの経口投与は、ALSマウスの脊髄組織における不溶性SOD1およびユビキチン化タンパク質を有意に減少させた。HDトランスジェニックマウスモデルでは、トレハロースは、グルコース給餌対照マウスと比較して、脳内のポリグルタミン凝集体を減少させ、運動機能障害を改善し、脳萎縮を抑制し、寿命を延長し、神経保護効果は、トレハロース加水分解後のグルコースレベル上昇と関連しないことが示唆された(Yoonら、2017年)。トレハロースは、ADトランスジェニックマウスモデルの海馬における認知機能を改善し、異常なAβ沈着を減少させた。さらに、トレハロースは、認知機能の改善と相関する可能性のあるマウス海馬の成長因子および神経新生マーカーのアップレギュレーションを介して、シナプス活性を促進した。トレハロース処理は、PDのマウスモデルにおける病理学的特徴も減速させた(Khalifehら、2019、2020)。トレハロースの経口溶液は、眼咽頭筋ジストロフィーのトランスジェニックモデルにおいて、筋肉細胞におけるPABPN1の異常凝集を減少させ、筋力低下を改善した(Emanuele, 2014)。
NDのいくつかのモデルにおいて、オートファジー活性化に対するポジティブな方向性が示されているにもかかわらず、トレハロースがオートファジーを駆動するメカニズムについては、正確な解明がなされていない。トレハロースは、mTOR非依存的なオートファジー活性化因子として、SQSTM1/p62やMAP1LC3Bなどのオートファジータンパク質のde novo発現を刺激し、LC3-IからLC3IIへの変換を促すことが明らかにされた。また、HSP90やSigmaR1のような異なる分子シャペロンを調節することによっても作用する。トレハロースは、グルコーストランスポーターSLC2A8/GLUT8の阻害を介して、AMPK依存的に肝細胞のオートファジーを誘導し、グルコース飢餓を生じさせてオートファジーを活性化することが報告されている。とはいえ、オートファジーを引き起こすにはトレハロースを細胞内に取り込む必要があり、トレハロースのインポーターとしても働くSLC2A8を欠損させると、オートファジーを刺激する能力が失われる(Lee et al., 2018; Khalifeh et al., 2020)。
最近の研究では、トレハロースはリソソームの変化を通じて代謝作用を発揮し、その急速な肥大化と一過性の透過化を引き起こすことが指摘されている。このようなリソソームの修飾は、リソソームの浸透圧ストレスが引き金となり、リソソームCa2+の放出とPPP3/カルシニューリンの活性化が引き起こされるのかもしれない。PPP3/calcineurinはリン酸化酵素としてTFEBを特異的に標的化し、核への移行を誘導する。TFEBによるオートファジー活性化は、ATG10、ATG12、BECN1、SQSTM1/p62、MAP1LC3Bといったオートファジー活性化に必要な遺伝子の発現を促進する。さらに、トレハロース耐性の類似体であるメリビオースとラクチュロースも同様の効果を示した(Rusmini et al.、2019)。PD脳ではリソソームの分解とオートファゴソームの蓄積も報告されており、レビー小体ではTFEBとα-シヌクレインの共局在化が検出された(Khalifeh et al.、2019)。オートファゴソームの障害やオートファゴソームとリゾソームの融合不全は、他のNDでも認められていることは注目に値する。いくつかの研究は、トレハロースの神経保護機構が動物において間接的である可能性を示唆した。経口投与した場合、トレハロースは腸内で加水分解される可能性があり、トレハロースの神経保護作用が微生物叢-腸-脳のシグナル伝達を介している可能性が浮上した(Leeら、2018年)。In vitroの研究では、トレハロースがオートファジー誘導剤であるという概念と矛盾するオートファジックフラックスをブロックすることが示された。著者らは、トレハロースがリソソーム膜の完全性を損ない、神経細胞におけるオートファゴソーム-リソソーム融合の防止およびα-シヌクレインの蓄積につながったと報告したが、細胞生存率は変わらなかった(Khalifeh et al.) 驚くべきことに、Martanoら(2017)は、トレハロースが内因性代謝産物としてネズミの海馬に存在することを示した。彼らは、トレハロースが内因性代謝産物として初代アストロサイトで生合成され、それがニューロンによって利用され、樹状突起のアーバーライゼーションを増加させることによってニューロンの成熟に関与することを発見した。その上、マウス脳内のトレハラーゼ酵素は主に神経細胞で検出されるが、アストロサイトでは検出されない(Martano et al., 2017; Halbe and Rami, 2019)。トレハロースとトレハラーゼの相互作用や、神経細胞のアービリゼーションに関与するメカニズムを調べることは興味深いことだ。
トレハロースの治療的可能性は、臨床現場での応用を強く支持する神経変性の異なるモデルにおける有益な効果のために魅力的である。現在までに、黄斑浮腫、うつ病、筋ジストロフィーなどの疾患において、トレハロースを用いたいくつかの臨床試験が実施されている。SCA3患者(脊髄小脳変性症3型)を対象としたプラセボなしのオープンラベル試験において、トレハロース100gを毎日経口投与したところ、疾患の重症度に軽度の改善がみられた。なお、7名の患者において消化器系の副作用が報告され、2名が重度の下痢により中止となった。ヒトでは、経口投与したトレハロースの約99.5%が小腸上皮で酵素的に代謝され、分子そのままでは容易に吸収されないため、十分な血中濃度を得るためにはより大量のトレハロースが必要となり、下痢や鼓腸などの消化器症状を引き起こす可能性があるとされている。そのため、より高い組織濃度を得ることができる静脈内投与が提案されている。最近、SCA3患者を対象とした第II相試験において、トレハロース静脈内投与(週13.5gまたは27g)の安全性、忍容性および有効性が検証され、最大1年間、重篤な有害事象は確認されなかった(Zaltzmanら、2020年)。さらに、トレハロース溶液(90mg/mL)の静脈内投与は、眼咽頭筋ジストロフィー患者において安全かつ忍容性が高く、トレハロース投与により複数の記録されたエンドポイントが改善することが観察されている。
要約すると、NDにおけるトレハロースの治療的可能性についてのエビデンスが蓄積されている。トレハロースは一般に安全な物質として認識されており、非経口製剤を含む医薬製剤に広く使用されているFDA承認成分である。その安全性は、この有望な薬剤の臨床試験をさらに促進することができる。トレハロースは、広範な神経変性が現れる前のNDの症候性の段階で投与することで、より大きな効果を引き出すことができると思われる。また、投与時期だけでなく、トレハロースの適切な投与量や投与経路に関する情報を得ることも必要である。トレハロースの神経保護作用が用量依存的であるかどうかはまだ不明である。また、トレハロースは経口投与に比べ、静脈内投与はバイオアベイラビリティが高いが、腸内細菌叢がトレハロースの神経保護効果に主要な役割を果たすかどうかについては、まだわかっていない。また、脳機能の変化がトレハロースの直接的または間接的な経路で起こるかどうかを探るために、さらなる研究が必要である。
