Contents
The Role of Molecular Chaperones in Virus Infection and Implications for Understanding and Treating COVID-19
要旨
COVID-19パンデミックは、その原因であるコロナウイルスSARS-CoV-2の増殖と拡散を支えるメカニズムの知識を必要とするため、パンデミックを終結させるための手段の探索が必須となった。多くのウイルスは宿主のシャペロンシステムを利用して標的細胞に感染し、複製し、拡散するが、ここではその例を紹介する。残念ながら、SARS-CoV-2サイクルにおけるシャペロンの役割はまだ十分に理解されていない。
本総説では、SARS-CoV-2の今後の研究に役立つ情報を求めて、感染サイクル中の様々なコロナウイルスのシャペロンとの相互作用を検討した。また、自己免疫の発現における分子模倣の可能性のある役割と、COVID-19患者におけるその広範な病原性の影響にも注意を喚起する。ウイルスタンパク質はヒトのシャペロンと高度に抗原性の高いエピトープを共有しており、シャペロンと交差反応する抗ウイルス抗体を誘発する。
ウイルスの感染サイクルにおけるシャペロンの重要な機能と、COVID-19の自己免疫現象におけるこれらの分子の役割の可能性の両方は、分子シャペロンが抗ウイルス戦略の開発のための有望な候補であることを明らかにしているこれらの分子シャペロンは、ウイルスの感染サイクルに必要なシャペロンや、自己免疫反応で自己抗原として作用し、ヒト組織に全般的な破壊的影響を与えるシャペロンを阻害・遮断することで、抗ウイルス戦略の開発が可能となる。
キーワード
ウイルス;分子シャペロン;Coronaviridae;SARS-CoV-2;COVID-19;シャペロノパチー;シャペロノセラピー
1. 序論
ウイルスはその生存と普及のために宿主細胞からの分子を必要とするが、分子シャペロンもその一つである。現在進行中のCOVID-19パンデミックの原因となっているコロナウイルスSARS-CoV-2のサイクルにおける分子シャペロンの役割は、時宜を得た問題である。
コロナウイルス(CoV)は、ニドウイルス目(Nidovirales)およびコロナウイルス科(Coronaviridae)に属する[1]。この亜科は、アルファコロナウイルス、ベータコロナウイルス、ガンマコロナウイルス、デルタコロナウイルス(それぞれα、β、γ、δ-CoVs)の4属を含み、医学および獣医学の分野で関心を集めている。
CoVは、直径約100nm、最大32kbのプラス鎖RNAを持つエンベロープ型ウイルスである[4]。ウイルスゲノムは、標準的な構造タンパク質に対応するメッセンジャーRNA(mRNA)を産生する。E(エンベロープ)M(膜)N(ヌクレオカプシド)S(スパイク)タンパク質に対応するメッセンジャーRNA(mRNA)を産生し、後者はウイルス粒子の特徴的なコロナを形成している[5,6]。
Sタンパク質は、受容体結合ドメイン(RBD)および宿主細胞の血漿細胞膜との融合に関与するドメインを含むため、CoVsの感染性に不可欠である[7]。
CoVsは主に、哺乳類や鳥類を含む幅広い動物種の呼吸器や消化管に感染する。遺伝学的および系統的解析により、CoVは頻繁に種の壁を越え、ヒトにまで到達していることが示されている[8,9]。ヒトへのCoVs感染(HCoVs)は、コウモリCoVs(BtCoVs)に由来すると考えられている。2000年代初頭から今日まで、世界では重症急性呼吸器症候群コロナウイルス(SARS-CoV)中東呼吸器症候群コロナウイルス(MERS-CoV)重症急性呼吸器症候群コロナウイルス2(SARS-CoV-2)の3つの人獣共通感染症が目撃されている。後者は最も新しいもので、個人の隔離やあらゆる人間活動の中断など、世界的に異常な対策を余儀なくされている。SARS-CoV-2は、重篤な呼吸器疾患を引き起こし、腎臓、脳、心臓、肝臓などの様々な臓器に損傷を与え、高い死亡率を示する[10,11,12,13,14,15]。CoVの臨床的重要性やパンデミックを引き起こす可能性については、SARS-CoVやMERS-CoVが登場するまで正当に認識されなかった[16,17]。2019年12月、重症急性呼吸器症候群に関連した新型SARS-CoV-2が武漢市(中国)で急速にパンデミックし、COVID-19(コロナウイルス感染症-19)を引き起こし、本稿執筆時点で世界で4100万人以上が感染し、100万人以上が死亡している(最新のWHOデータは2020年10月24日更新)。これにより、COVID-19は世界的な健康への大きな関心事となった[18]。
これらの出来事は世界の人口に大きな負の影響を与え、科学界は感染を止めて病人を治すための手段の開発を早急に試みることを余儀なくされている[19]。治療のための戦略は、ウイルスが認識して標的細胞に結合するスパイクなどのウイルス構造の同定、またはウイルスが認識する標的細胞内の受容体の同定に焦点を当てることができる。SARS-CoVおよびSARS-CoV-2はいずれも、アンジオテンシン変換酵素2(ACE2)を用いてヒト細胞に侵入し、ジペプチジルペプチダーゼ4(DPP4)はMERS-CoVのアクセス受容体を表す。どちらのタイプの受容体も、ウイルスのスパイクによって認識され結合され、心臓、腎臓、2型肺胞などの多くの組織に存在している[20,21,22]。したがって、Sタンパク質が有望な治療標的であることは明らかである[14]。
ウイルスは、他の感染剤と同様に、宿主に侵入すると、シャペロン(シャペロン)システムを作動させ、一方では感染した生物を防御し、他方では攻撃者を助ける。後者の状況は、間違ってシャペロノパシー[23]と呼ばれ、ウイルスなどの感染因子が感染生物のシャペロニングシステムの1つ以上の構成要素を支配し、その影響を打ち消すのではなく、感染に有利になるようにその活動を再指示した場合に起こる。
シャペローニング系は、機能的ネットワークを形成しうる分子シャペロン、コシャペロン、シャペロンコファクター、シャペロン相互作用体および受容体[23,24]から構成されている[25]。分子シャペロンとは、分子量で分類されたタンパク質のことで、最小のもの(<35 kDa)から非常に大きなもの(200 kDa以上)まで様々なグループに分類されている[23,26]。これらのグループの中には、クリスタリンドメインを持つ小型のHsp、Hsp40(DnaJ)、Hsp70(DnaK)、Hsp90など、系統的に関連するタンパク質のファミリーに属するHsp(Heat Shock Protein)と呼ばれる分子が分類されている。一般にシャペロンは細胞保護作用を持っているが、異常をきたすと病原性を帯びて病気を引き起こすシャペロノパチー[27]。シャペロノパチーには遺伝的なものと後天的なものがあり、前者は影響を受けたシャペロンをコードする遺伝子の遺伝的変異、例えば突然変異の結果であるのに対し、後天的なシャペロノパチーでは、病気のシャペロンをコードする遺伝子は正常であるが、そのタンパク質産物は転写後の変化、例えば、異常な翻訳後修飾(すなわち、脱アセチル化、リン酸化、またはニトロ化)を受けているために正常ではない。これらの後天的な修飾は、シャペロンの性質を劇的に変化させることがあり、ウイルスや癌などがシャペロンを自分たちの利益のために働かせるために使用するメカニズムの一つである可能性がある。このような状況では、シャペロンがいわば「敵」のために働くということで、我々は間違ったシャペロノパシー、または共同作業主義を持っている[28]。例えば、IAV(インフルエンザAウイルス)はHsp90のアセチル化を誘導し、そのポリメラーゼが核内に取り込まれることでウイルスの複製を促進することが実証されている。したがって、Hsp90の脱アセチル化を阻害するHsp90阻害剤は、IVA感染症だけでなく、SARS-CoV-2などの他の感染症の治療にも使用できる可能性がある[29,30]。
本レビューの目的は、文献を調査し、ウイルスとシャペロンとの相互作用の例をまとめ、SARS-CoV-2によって引き起こされる疾患であるCOVID-19に関連する可能性のある情報に焦点を当て、それによって感染を予防すること、および/またはシャペロンに依存する病原メカニズムをブロックすることを目的とした薬剤の攻撃のポイントを明らかにすることである。
2. 分子シャペロンとウイルス感染
ウイルスは、実質的にすべての細胞に侵入することができる義務的な細胞内寄生虫である。一見単純に見えるにもかかわらず、ウイルスは宿主細胞の転写・翻訳・代謝機構とシャペロンシステムを制御し、ライフサイクルを維持し、生産的な感染を継続するためにそれらを利用することができる。
自分自身のシャペロンを持たないウイルスは、感染した宿主のシャペロンを自分自身のために利用しなければならない[31]。しかしながら、ウイルスによって誘発される宿主のシャペロンの過剰発現の多くの側面は未だに不完全に理解されておらず、特にシャペロン活性の増加は細胞保護にもつながる可能性があるため、不可解な点もある。一方では、いくつかのシャペロンの過剰発現は、例えば、ウイルスに対する免疫応答を刺激したり、感染細胞の死を促進したりして、抗ウイルス効果を持つ可能性がある[32,33,34]、表1。他方では、シャペロンの過剰発現は、ウイルスの侵入[35,36,37,38,39]および分解[40]、核内輸入、ウイルスポリメラーゼの組み立ておよび活性化、ならびにウイルスゲノムの核内転座、および複製および転写イベントの活性化[41,42,43,44,45,46,47,48,49,50,51,52]、および構造タンパク質合成、およびウイルス粒子の組み立ておよび放出[53,54,55,56]を含む、ウイルスのライフサイクルを有利にし得る。最後のステップは、特に、細胞質シャペロンだけでなく、グルコース調節タンパク質(GRP)カルネキシンおよびカルレティキュリン[57,58]、表1のような小胞体(ER)で一般的に発現するシャペロンも関与している。ウイルスと宿主細胞の小胞体(ER)との相互作用については、通常、ウイルス感染は、誤って折り畳まれたタンパク質の蓄積と凝集、およびアンフォールドタンパク質応答(UPR)の活性化を伴うERストレスを引き起こす[59]。活性化転写因子6(ATF6)イノシトール要求酵素1(IRE1)およびプロテインキナーゼR(PKR)様ERキナーゼ(PERK)が関与するUPRシグナル伝達は、ERシャペロンや、それらの分解を含む、誤って折り畳まれた/折り畳まれていないタンパク質の蓄積に対抗するために必要な他の分子のアップレギュレーションを誘導する[60,61]。UPRは、ERシャペロンがウイルスタンパク質の折り畳みを促進するため、ウイルス感染に有益であるか、タンパク質分解に関与する因子の発現上昇がウイルスタンパク質を分解する可能性があるため、有害であるかのいずれかである。したがって、ERストレスおよびUPRを生き延び、ERシャペロンを自身の利益のために利用するために、ウイルスは特定のメカニズムを開発してきた[58,62,63,64]。さらに、多くのウイルスは、宿主細胞の早期死を遅らせ、その増殖およびその後の放出を促進するためにアポトーシスを調節するために、宿主のシャペロンシステムを使用することができる[65,66,67,68,69]、表1。
表1. ウイルス感染における分子シャペロンの役割。
| モル。チャップ。 | ウイルス | 役割 | 参照 |
|---|---|---|---|
| Hsp40 | HIV-1 | ウイルス遺伝子の発現と複製のNefを介した強化に参加します | [ 42、46 ] |
| IAV | ウイルスリボ核タンパク質の核移行を支援します | [ 51 ] | |
| Hsp60 | HBV | ポリメラーゼの活性化と複製の開始に参加します。感染細胞のウイルス媒介アポトーシスを促進する | [ 33、41 ] |
| HCV | 感染細胞のアポトーシスを促進します | [ 34 ] | |
| Hsc / Hsp70 | ロタウイルス | 宿主細胞膜受容体の一部であり、ウイルスの侵入と感染性を促進します | [ 35 ] |
| デングウイルス | 宿主細胞膜受容体の一部であり、ウイルスの侵入と感染性を促進します | [ 36 ] | |
| JEV | 宿主細胞膜受容体の一部であり、ウイルスの侵入に寄与します。ウイルス複製を強化します | [ 37、48 ] | |
| ZKV | ウイルスの侵入、複製、および退出を調整します | [ 39 ] | |
| レオウイルス | アウターキャプシド分解に参加 | [ 40 ] | |
| HCV | ウイルスゲノムの翻訳、ビリオンの組み立てと放出を調節します | [ 55 ] | |
| HIV-1 | ウイルスの遺伝子発現を阻害します。Vprが誘導する細胞周期停止と細胞アポトーシスを遅らせる | [ 46、65、66 ] | |
| Hsp90 | デングウイルス | 宿主細胞膜受容体の一部であり、ウイルスの侵入と感染性を促進します | [ 36 ] |
| HCV | ウイルス複製を積極的に調節する | [ 43 ] | |
| インフルエンザウイルス | ゲノムとRNA依存性RNAポリメラーゼの核移行を促進し、ウイルス複製を確実にします | [ 44、72 ] | |
| EBV | DNAポリメラーゼの集合と核移行を仲介します | [ 47 ] | |
| KSHV | 抗アポトーシスシグナル伝達を促進します | [ 69 ] | |
| BiP / GRP78 | CMV | ビリオンアセンブリを規制します | [ 53 ] |
| ロタウイルス | ウイルス粒子の適切な組み立てと成熟を保証します | [ 54 ] | |
| GRP94 | HCV | 感染細胞のアポトーシスをブロックします | [ 68 ] |
| カルネキシン | ロタウイルス | ウイルス粒子の適切な組み立てと成熟を保証します | [ 54 ] |
| カルレティキュリン | ロタウイルス | ウイルス粒子の適切な組み立てと成熟を保証します | [ 54 ] |
| CCT | インフルエンザウイルス | ウイルスの複製と転写を促進する | [ 45 ] |
| 狂犬病ウイルス | ウイルスの複製と転写を促進する | [ 49、50 ] | |
| デングウイルス | ウイルスの複製と転写を促進する | [ 52 ] | |
| レオウイルス | ウイルスタンパク質の折りたたみに参加する | [ 56 ] |
分子シャペロンの抗ウイルス活性とプロ感染活性の両方が、例えばプロ感染活性を持つ分子シャペロンを阻害することによって、またはその免疫活性を利用することによって、抗ウイルス療法を開発する機会を提供している[70,71,72,73,74]。
3. コロナウイルスと分子シャペロン
HCoVs感染の病態に関する現在の理解はまだ限られているが、ヒトからヒトへの感染は主に互いに近接した集団内で起こり、ウイルスが敏感な宿主細胞に侵入するための最初の重要なステップには、特定の受容体が関与していることは明らかである[75,76]。一般に、HCoVsは膜貫通スパイク(S)糖タンパク質を用いて宿主細胞に侵入する。このタンパク質には2つの機能的サブユニットがある。S1は宿主細胞受容体に結合し、S2はウイルスと膜との融合に関与している[77]。したがって、付着後、ヒト膜貫通プロテアーゼセリン2(TMPRSS2)が切断し、スパイクタンパク質を活性化する。S1はその受容体結合ドメイン(RBD)を介して受容体に結合し、S2は宿主の膜とウイルスとを融合させる。SARS-CoVおよびSARS-CoV-2では、受容体ACE2は平滑筋細胞の表面;小腸の上皮;肺胞、気管支および気管支の上皮細胞を含む呼吸器系細胞;さらには肺胞単球およびマクロファージの表面に局在している[76,77,80]。さらに、構造解析の結果、Sタンパク質は細胞表面でERシャペロンであるグルコース制御タンパク質-78(GRP78)にも結合することが明らかになった[81](図1)。代わりに、MERS-CoVについては、DDP4と名付けられた受容体は、腎臓、小腸、肝臓、肺胞などの上皮細胞上に広く発現している表面タンパク質である[21]。
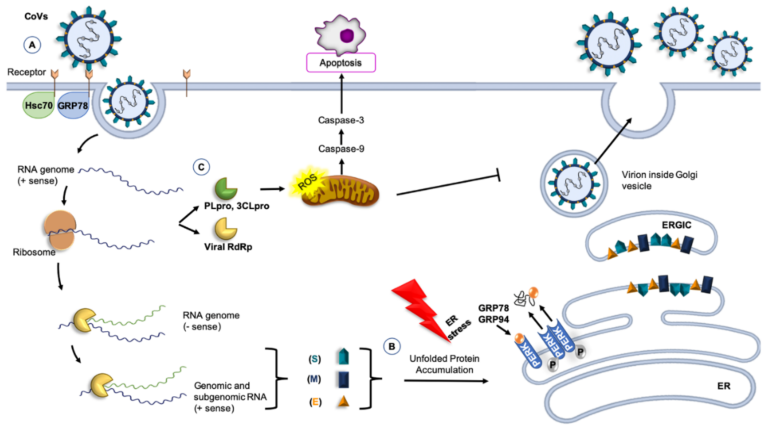
図1. CoVおよび分子シャペロン
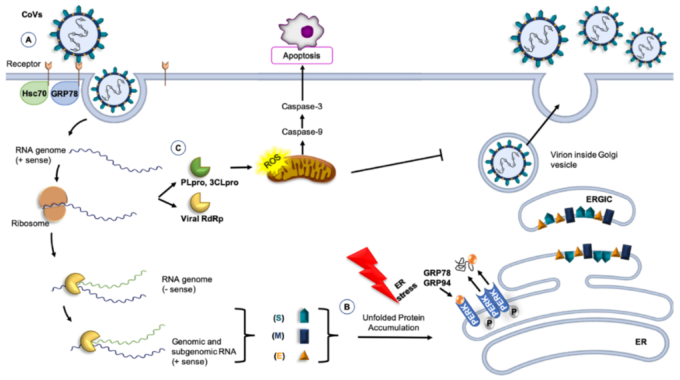
(A) GRP78または74-kDa熱ショック認知タンパク質70(Hsc70)は、CoVsによって認識される受容体複合体の一部であり、ウイルスの侵入を調節することができる[82,83,84]。B)GRP78やGRP94などの分子シャペロンは、CoVタンパク質の折り畳みに関与し、ウイルス感染によって引き起こされる宿主細胞のストレスの影響を打ち消す。折りたたまれていないタンパク質の蓄積は、GRP78やGRP94の転写を誘導する。小胞体(ER)内腔では、PERKからのGRP78とGRP94の放出が保護的な役割を果たし、アンフォールドタンパク質応答を誘導し、タンパク質のフォールディングを制御している。これらの条件下では、ERの恒常性が回復する[85]。C)3C様セリンプロテアーゼ(3CLpro)などの非構造タンパク質は、カスパーゼの経路と考えられるアポトーシスを誘導し、活性酸素種(ROS)の大幅な増加を引き起こす[86]。
その他の略語。RBD、受容体結合ドメイン(Sタンパク質の);PLpro、パパイン様システインプロテアーゼ;RdRp、RNA依存性RNAポリメラーゼ;PERK、PKR様小胞体キナーゼ;ERGIC、小胞体-ゴルジ中間コンパートメント。
S1-RBD複合体は、ウイルスRNAゲノムの細胞質への放出を伴う宿主細胞膜とウイルスの融合を媒介している[82]。細胞内に入ると、RNAは翻訳・転写され、カルネキシンなどのER分子シャペロンと相互作用して正しいタンパク質フォールディングを確保し、ウイルスは複製する[87]。その後、ゲノムRNAとヌクレオカプシドタンパク質が結合して新しいウイルス粒子を形成し、それが形質膜と結合してウイルスを放出する [79,88]。
受容体への結合と膜融合はコロナウイルス感染サイクルの初期かつ重要な段階であるため、成功した治療戦略は、ウイルスの拡散を止めるためにSタンパク質またはRBDを標的とするべきであるという仮説が立てられるかもしれない[89]。この目的のためには、Sタンパク質とRBDの構造を解明することが最初の重要なステップとなる。
利用可能な情報が少ないことから、シャペロンの発現レベルがCoVsウイルス負荷に影響を与える可能性があることが示唆されている(図1)。例えば、74-kDaのヒートショック認知タンパク質70(Hsc70)は、γ-CoVsのメンバーである鳥感染性気管支炎ウイルス(IBV)の受容体複合体の一部である[90]。HCoVsについても同様の状況が生じる可能性がある。また、シャペロンは、CoVsタンパク質の折り畳みや、ウイルス感染が宿主細胞に引き起こすはずのストレスの影響を打ち消すのにも関与していると考えられる。
小胞体は、分泌または膜挿入のためのタンパク質の工場であるが、小胞体腔内の初期および未展開のウイルスタンパク質の蓄積は、急速にその折り畳み能力を超え、小胞体ストレスを引き起こす可能性があり、これは、転写および翻訳レベルの両方で遺伝子発現を調節するための細胞シグナル伝達経路を活性化する[58,83,91]。これにより、オルガネラ内のシャペロンのレベルが上昇する。損傷したタンパク質を修復できない場合、細胞はアポトーシスのメカニズムを活性化するが、遺伝子をコードするシャペロンが活性化され、シャペロンがER内で増加すれば、ウイルスを含むタンパク質の折り畳み、成熟、分解が再開され、ホメオスタシスが回復し、ウイルスの生存が保証される[60,92]。
ウイルスの複製の結果、初期の未展開ウイルスポリペプチドはERに蓄積し、PERKを刺激してミトコンドリアの機能と代謝を促進することでERストレスを引き起こす[85,93]。このメカニズムは、おそらく宿主細胞の応答に対抗し、ウイルスの複製を促進するためのウイルス戦略を表している。Sタンパク質は、PERKを介して、Hsp90βメンバー1(GRP94)や結合免疫グロブリンタンパク質(Bip、別名GRP78)などの腔内ERシャペロンの転写活性化を誘導する。GRP94およびGRP78の発現の増加は、ウイルス複製中に豊富に発現するSARS-CoVタンパク質の折り畳みおよび処理を増強する[93]。さらに、SARS-CoVの前臨床研究では、ERに蓄積されたスパイク糖タンパク質がBiPやGRP94などの分子シャペロンの転写を誘導し、感染細胞のその後のアポトーシスにつながることが示唆されている[92,94]。したがって、CoVによる小胞体の調節は、医薬的介入の新たな機会となる。実際、CMV感染症のように、ERストレスを調節して感染性ウイルスの産生を抑制する薬剤がすでに利用可能である[95]。いくつかの研究では、リガンドであるアンジオテンシン1-7によるACE2の刺激により、ERストレスが抑制されることが示されている[96,97]。
過去10年の間に、GRP78の様々な役割が記述されていたが、それは、タンパク質のフォールディングとアセンブリ、およびERストレスの調節に関与するER常駐シャペロンとしての通常の機能とは異なるものであった[98]。例えば、GRP78は細胞表面にも局在し、シグナル伝達や細胞の恒常性を調節している[99]。このことは、MERS-CoV感受性細胞の表面にGRP78が存在する場合のウイルス侵入におけるGRP78の役割の可能性を示唆している[100]。GRP78は、通常はウイルスに感受性のない細胞でもユビキタスに発現しているが、非感受性細胞をMERS-CoV感染に感受性のある細胞にすることはない[84]。GRP78は、宿主細胞受容体DPP4およびACE2の存在下で、それぞれMERS-CoVおよびSARS-CoV-2の両方の侵入を調節することができる付着因子として補助的な役割を果たしている[81]。さらに、DPP4がGRP78と結合すると、MERS-CoVのスパイク糖タンパク質はDPP4単独よりも強くその受容体を認識し、感染性の向上につながる[84]。GRP78をsiRNAでノックダウンした後にMERS-CoVに感染したHuh7細胞は、ウイルスの侵入と複製の減少を示したが、この減少はDPP4のノックダウンによって引き起こされたものよりも顕著ではなかった[84]。
コロナウイルスゲノムは、構造タンパク質に加えて、CoVの転写および複製に関与する重要な酵素であるRNA依存性RNAポリメラーゼおよびヘリカーゼを産生するためのパパイン様システインプロテアーゼ(PLpro)および3C様セリンプロテアーゼ(3CLpro)などの非構造タンパク質をコードしている[101]。PLproおよび3CLproは、コロナウイルスの複製に必須の機能を持つため、魅力的な抗ウイルス薬の標的となる[102]。さらに、3CLpro は、カスパーゼ-3 およびカスパーゼ-9 経路を介してアポトーシスを誘導し、活性酸素種(ROS)の大幅な増加を引き起こす [102,103]。In vivoでのシグナル伝達経路アッセイでは、3CLproはNF-kB依存性レポーターの活性化を増加させ、プロテオミクス解析ではアポトーシス因子アンタゴニストであるHsc70がダウンレギュレートされていることが示された[86,103]。
ウイルスは宿主のシャペローニングシステムを利用してタンパク質の折り畳みやウイルスの組み立てを行うため、このシステムの適切なメンバーを標的とすることは、HCoVに対する治療法を開発するための有望な戦略である[104]。前述したように、Hsp60とHsp90βはウイルス感染の発生と進行を促進し、ウイルスタンパク質の折り畳みとゲノム複製を支援する。Hsp60およびHsp90の発現または作用の阻害(ネガティブシャペロノセラピー)は、インフルエンザウイルス、ロタウイルス、呼吸器症候群ウイルスなどのウイルスの複製の抑制をもたらす可能性がある[38,72,105,106]。最近の論文では、Hsp60の薬理学的阻害が重症COVID-19患者の不適切な炎症反応を改善する可能性が示唆された[107]。
Hsp70ファミリーのいくつかのメンバー(原著論文では同定されていない)は、ウイルスのライフサイクルのすべての段階に関与しており、ウイルスの増殖を調節する上で重要な役割を果たしている(図1)[108]。したがって、Hsp70ファミリーの阻害剤は、抗ウイルス効果を有する可能性がある。例えば、Bip阻害剤であるケルセチンは、抗ポルシン伝染性下痢ウイルス(PEDV)能力を有する[109]。しかし、ケルセチンは特異的なHsp70阻害剤ではないため、抗PEDVとしての真価はまだ十分に確立されていない[89]。
ウイルス感染症におけるヒートショックプロテイン40-kDaサブファミリーAメンバー1
(DNAJA1)の役割は、Hsp70と協働して作用することが提案されている[110]。
COVID-19における分子模倣の結果として考えられることが議論されている。ウイルスタンパク質はヒト分子を模倣する、すなわち、抗原性エピトープを共有しているため、ヒト分子と交差反応する抗ウイルス抗体を誘発する可能性があり、それによって自己免疫現象を引き起こし、全身性血管炎、血栓症、および多臓器不全を引き起こすメカニズムの中心となるであろう [111,112,113,114,115]。このレビューに最も関連するのは、いくつかのヒト分子シャペロンが特定のSARS-CoV-2タンパク質と抗原性エピトープを共有していることがバイオインフォマティクスによって明らかにされたことである[113]。シャペロンである Hsp60,Hsp90,Hsp70 は SARS-CoV-2 蛋白質と免疫原性ペプチドを共有しており、感染後の分子模倣現象に関与している可能性がある(図 2)。内皮細胞の形質細胞膜上に露出したシャペロンに対する交差反応性抗体は、COVID-19の病理学的症状の一つである内皮炎や心血管系の障害を引き起こす可能性がある[113,114]。この点で、ウイルスとHsp60およびHsp90との間で共有されるペプチドは、ギラン・バレー症候群や多発性硬化症などの他の自己免疫疾患に関連する免疫反応性エピトープに埋め込まれていることに言及しなければならない[115]。これらの知見は、COVID-19で観察される症状や臨床結果の多くを緩和するために、特定の分子シャペロンを標的とした免疫調節療法の開発の可能性を示唆している。
図2. 分子模倣のメカニズム
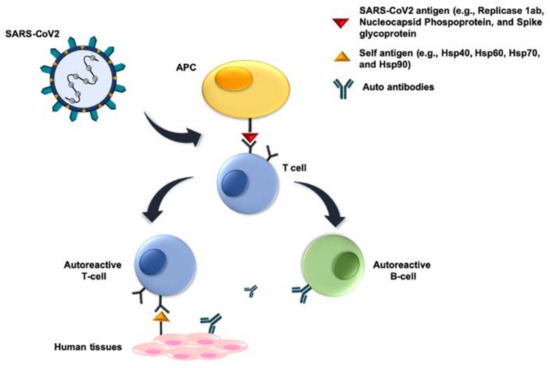
ウイルスタンパク質による宿主タンパク質の分子模倣とは、SARS-Cov-2と宿主タンパク質との間に共有される交差反応性抗原性エピトープ(例えば、分子シャペロン)が存在し、宿主に対する体液性および細胞性免疫反応を誘導することを意味する。関与するSARS-Cov-2抗原は、おそらくレプリカーゼ1ab、ヌクレオカプシドホスホプロテイン、およびスパイク糖タンパク質のペプチドに存在し、それらはB細胞および/またはT細胞を誘導する。前者の細胞は、ウイルスおよび宿主の交差反応性抗原に反応する抗体を産生する。同様に、誘導されたT細胞は、宿主組織と反応する。いずれの場合も、自己免疫が起こり、宿主の組織や臓器にダメージを与える。
略語。APC、抗原提示細胞。
4. 結論と展望
コロナウイルスは、他のウイルスと同様に、宿主のシャペロンシステムを利用して、タンパク質の折り畳み、ウイルスの組み立て、核への移動、その他の重要なステップを行っている。宿主のシャペロンとそのチームとネットワークは、ウイルスの感染、生存、拡散に必要なものである。したがって、いくつかのウイルス性疾患を誤ってシャペロノパチーの中に分類することは適切である[28]。
これらの疾患は、正常なシャペロン(少なくとも現在の技術で決定できる範囲では正常であるが、その特性を変える翻訳後修飾を受けたことを排除することはできない)が、病原性因子であり、その疾患から生体を保護するのではなく、その疾患を有利にする疾患である。このことは、シャペロノセラピー、特にネガティブシャペロノセラピー、つまり病原性シャペロンを除去または遮断することからなる治療法の可能性を開くことになる[81,92,116]。
したがって、SARS-CoV-2感染サイクルにおけるシャペロンの役割を解明し、シャペロン阻害剤が標的としうるシャペロン依存性のステップ、およびネガティブシャペロノセラピーによって除去または阻害すべきシャペロンをピンポイントで特定することは、非常に興味深いことである。
例えば、タウロウルソデオキシコール酸(TUDCA)や4-フェニル酪酸(PBA)などの化学シャペロンは、CoVs感染によって誘導されるERストレスに対する治療薬としての使用が提案されている[92,117,118]。
しかし、シャペロン系の知識の進歩に伴い、シャペロンとウイルスの分野を、いわば新しいメガネで見る必要が出ていた。シャペロンは、ウイルスがライフサイクルを通して必要とするタンパク質の恒常性維持や品質管理などの通常の機能を発揮しても、単独では機能しない。
したがって、ウイルス生物学におけるシャペロンの役割を解明しようとする研究では、シャペロンがチーム(ホモオリゴマーやヘテロオリゴマーなど)やネットワークを形成し、様々なクラスのシャペロン、コ・シャペロン、シャペロンコ・ファクターを含むネットワークを形成して、それぞれのカノニカルな機能を発揮していることを考慮しなければならない。さらに、シャペロンは、タンパク質の恒常性や品質管理とはほとんど関係のない非カノニカルな機能も持っているが、これらの非カノニカルな機能がウイルス生物学において何らかの役割を果たしているかどうかは、まだ不明である。病原性ウイルスがどのようにして細胞に感染し、患者を殺すのか、また、シャペロン系の構成要素を中心とした方法や薬剤を用いてどのようにしてウイルスを退治するのか、ということを完全に理解するためには、まさにこの点にも大きな関心が集まっている。
また、COVID-19の自己免疫や多臓器不全につながる方程式に、ウイルスタンパク質によるヒトシャペロンの分子模倣を組み込んだ最近の作業仮説も注目すべき点である。ウイルス感染などの外的要因は、分子模倣のメカニズムによって自己免疫を誘導し、外来ペプチドと自己ペプチドの類似性によって自己反応性T細胞やB細胞の活性化を引き起こす可能性がある。例えば、エプスタインバーウイルスやヘルペスウイルスなどのいくつかのウイルスは、多発性硬化症、自己免疫性脳炎、およびその他の自己免疫疾患の発症に関与していることが示唆されている[119,120]。3,781個のヒトタンパク質(うち17個は分子シャペロン)がSARS-CoV-2タンパク質と少なくとも6アミノ酸のペプチドを共有していることが示されている[114]。