Contents
The Role of Magnesium in Neurological Disorders
www.ncbi.nlm.nih.gov/pmc/articles/PMC6024559/
オンラインで公開2018年6月6日
要旨
マグネシウムは、人体内での多様な作用を持つことがよく知られている。神経学的な観点から見ると、マグネシウムは神経伝達と神経筋伝導に不可欠な役割を果たしている。また、神経細胞死(興奮毒性)につながる過度の興奮から保護する役割も果たしており、複数の神経疾患に関与している。神経系におけるこれらの重要な機能のために、マグネシウムは、神経疾患の潜在的な予防と治療のために強い関心を持っているミネラルである。
現在の文献は、片頭痛、慢性疼痛、てんかん、アルツハイマー病、パーキンソン病、脳卒中だけでなく、不安とうつ病の一般的な併存条件のためにレビューされている。以前のレビューやメタアナリシスは、神経学的疾患にまたがるマグネシウム研究の舞台を設定するために使用され、現在の研究は、文献を更新し、この分野での進歩(または不足)を示すために、より詳細にレビューされている。
片頭痛やうつ病におけるマグネシウムの役割を示唆する強力なデータがあり、慢性疼痛、不安、脳卒中に対するマグネシウムの保護効果を示唆するデータも出てきている。てんかんの補助治療としてのマグネシウムについては、さらに研究が必要であり、アルツハイマー病やパーキンソン病におけるマグネシウムの役割をさらに明らかにするためにも、さらなる研究が必要である。
以上のことから、神経疾患におけるマグネシウムの機序的特性は、神経疾患の予防と治療のための潜在的なターゲットとしてのマクロミネラルの存在を示唆している。
キーワード
マグネシウム、興奮毒性、グルタミン酸、片頭痛、慢性疼痛、てんかん、アルツハイマー病、パーキンソン病、脳卒中
1. はじめに
マグネシウムは、300以上の酵素反応における補酵素としての役割を含め、人体において多くの役割を持つ、食生活において非常に重要なマクロミネラルである。マグネシウムは、筋肉の収縮(心臓を含む血圧、インスリン代謝の調節に不可欠であり、DNA、RNA、およびタンパク質の合成に必要である[1]。神経系では、マグネシウムは最適な神経伝達と神経筋の協調のために重要であり、興奮毒性(細胞死につながる過剰な興奮)から保護する役割を果たしている[1,2]。
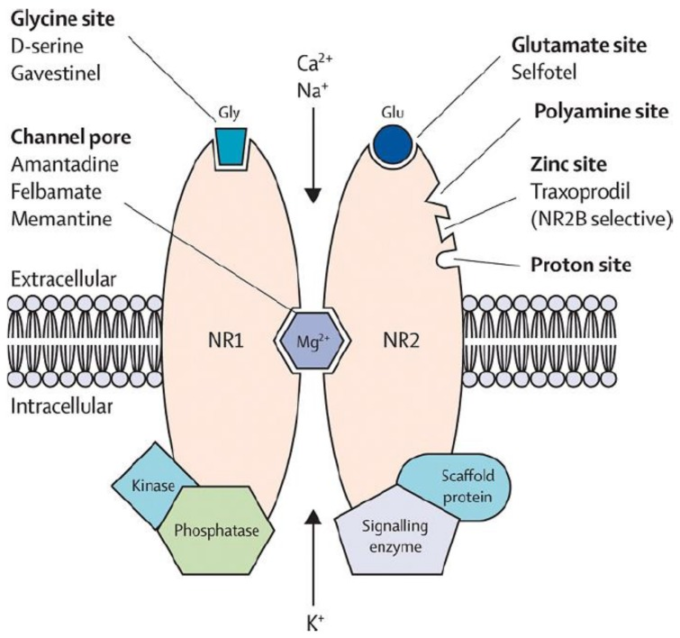
マグネシウムの主な神経学的機能の一つは、マグネシウムとN-メチル-D-アスパラギン酸(NMDA)受容体との相互作用によるものである。マグネシウムはNMDA受容体のカルシウムチャネルを遮断する役割を果たし(図1)グルタミン酸興奮性シグナル伝達が起こるためには除去されなければならない[3]。マグネシウム濃度が低いと、理論的にはグルタミン酸神経伝達が増強される可能性があり、酸化ストレスと神経細胞死を引き起こす可能性のある興奮毒性をサポートする環境につながる可能性がある[4]。グルタミン酸神経伝達の異常は、片頭痛、慢性疼痛、てんかん、アルツハイマー病、パーキンソン病、脳卒中に加えて、これらの神経疾患と一般的に併存するうつ病や不安症を含む多くの神経学的および精神疾患[5]に関与している。分子研究[6]と動物実験[7]では、マグネシウムを用いた前処理による神経細胞の保護が示されており、このミネラルがヒトにおける潜在的な神経保護的役割を果たすことに強い関心が寄せられている。したがって、マグネシウムは、上記の状態の予防および/または治療において、重要な食事因子である可能性がある。
図1 カルシウムチャネルのマグネシウムブロックを持つグルタミン酸N-メチル-D-アスパラギン酸受容体。
米国の人口の約半数がマグネシウムを十分に摂取していないと推定されている[9]。マグネシウムの広範な機能のために、不適切な摂取量は、神経学的条件に関連するものを含む複数の健康問題に個人を素因づける可能性がある。このレビューは、マグネシウムと以下の神経疾患について知られていることについての最近のヒトの文献を要約することを目的としている:片頭痛、慢性疼痛、てんかん、アルツハイマー病、パーキンソン病、脳卒中、および不安とうつ病。また、今後の研究の方向性についても提言がなされる。
2. 材料と方法
検索はPubMed, MEDLINE, PsychINFO, Wiley-Blackwell Cochrane Libraryを用いて行った。要旨は利用可能なすべての文献について引き出され、その後、3人の著者全員によるレビューが行われ、どの論文が包含基準を満たしているかについてのコンセンサス決定が行われた。英語で書かれた成人のヒト集団を対象とした研究は、どの年のものであっても、英語で書かれたものであれば対象とした。片頭痛、慢性疼痛、不安、うつ病、てんかん、アルツハイマー病、パーキンソン病、脳卒中を有するヒト集団におけるマグネシウムレベル(血中血清、脳脊髄液など)またはマグネシウム治療を含む、レビュー基準を満たすすべての論文がレビューされた。検索文字列には、神経学的疾患または一般的に併存する疾患と「マグネシウム」、「静脈内マグネシウム」、「経口マグネシウム」、または「マグネシウム治療」が含まれている。レビューおよびメタアナリシスを使用して、神経疾患全体のマグネシウム研究における現在の文献の位置づけを理解した。重複を減らし、以前にレビューされた文献の広い範囲を提供するために、最新のレビューとメタアナリシスを論じている。新しい研究については、文献の最新情報を提供するために詳細に記述されている。パーキンソン病の場合のようにレビューやメタアナリシスがない場合は、利用可能な研究をまとめてレビューした。図2は、検索戦略を要約したもので、最も研究されているもの(すなわち片頭痛)から最も研究されていないもの(すなわちパーキンソン病)まで、マグネシウム研究の数に格差があることを示している。
図2 神経疾患の文献に掲載されているマグネシウムのフローチャート。新規論文とは、以前に発表されたレビューやメタアナリシスに含まれていない発表された研究を指す。

アルツハイマー病=アルツハイマー病、PD=パーキンソン病。
3. 結果
3.1. 偏頭痛
片頭痛は、有病率が16.2%である米国で最も一般的な神経疾患である [10]。片頭痛は、前兆の有無にかかわらず、しばしば4~27時間持続し、吐き気、嘔吐、およびさまざまな環境刺激に対する過敏性を含む多くの関連症状を伴う中等度~重度の頭痛を繰り返すことで分類される [11,12]。正確なメカニズムはまだ完全には解明されていないが、中枢神経系の興奮性の変化、自発的な神経細胞の脱分極、およびミトコンドリアの異常な機能が片頭痛と関連している。グルタミン酸は最も豊富な興奮性神経伝達物質であるため、片頭痛に関する病因論、予防、治療の議論にしばしば関連している[13]。マグネシウムは、グルタミン酸N-メチル-D-アスパラギン酸(NMDA)受容体を遮断するため、片頭痛の治療オプションとして提案されてきた。マグネシウムはまた、ミトコンドリア機能における重要な代謝因子であることが知られており、膜透過性を低下させることで、過興奮による神経細胞の自発的な抑うつの可能性を低減させる [15]。過去の研究では、片頭痛発作の間や発作中に片頭痛患者の血清、唾液、脳脊髄液中のマグネシウム濃度が有意に低いことが報告されており[12,16,17,18]、さらにMR分光法に基づくマグネシウムの脳内濃度の低下を示唆する証拠があることが示されている[18]。
マグネシウムの経口および静脈内投与は、1980年代後半から片頭痛の治療オプションとして提案されており、その結果は過去30年間にいくつかのメタアナリシスおよびレビューによって分析されてきた。2014年にChoiとParmerは、2000年から 2005年の間に発表された5つの無作為化比較試験を対象にオッズ比(OR)を用いたメタアナリシスを完了した[19,20,21,22,23]が、マグネシウムが有効な治療法であるという強いエビデンスは得られなかった。その結果、マグネシウムの点滴投与は、投与30分後の緩和率が対照群に比べて7%低く(OR = -0.07副作用反応率が37%高く(OR = 0.37点滴、プラセボ、または他の片頭痛治療薬の使用に有意差はなかったと結論づけられた。しかし、メタアナリシスに含まれた1件の研究では、前兆のある片頭痛とない片頭痛の間に差が認められた;前兆のある人の片頭痛緩和には、投与後60分時点でプラセボよりも静脈内マグネシウムの方が有意に効果的であった(p < 0.05)[24]。2016年のChiuらによるより最近のメタアナリシスでは、より大規模なサンプルのランダム化臨床試験をレビューし、急性片頭痛に対する静脈内マグネシウムの効果を調査した11件の研究[19,20,21,25,26,27,28,29,30]と、片頭痛予防に対する経口マグネシウムの効果を調査した10件の研究[16,31,32,33,34,35,36,37,38,39]が報告されている。オッズ比を用いて、急性片頭痛に対するマグネシウムの経口投与は、マグネシウム投与後15~45分(OR = 0.23120分(OR = 0.2024時間(OR = 0.27)の間に有意な緩和をもたらしたと結論づけた。同様に、マグネシウムの経口投与により、片頭痛発作の頻度(OR = 0.20)と発作の強度(OR = 0.27)が有意に減少した。全体として、このメタアナリシスは、片頭痛の治療におけるマグネシウムの静脈内投与または経口投与の有用性を示す証拠を提示している[40]。また、このメタアナリシスでは、英語と中国語で発表されたマグネシウムの静脈内投与または経口投与によるマグネシウム治療を調査したランダム化臨床試験が含まれているため、前回のメタアナリシスを拡張したものとなっている。これにより、研究の範囲、サンプル数、外部妥当性が拡大された。
最新のレビュー以降、2つの病院で片頭痛を呈した患者を対象に、硫酸マグネシウム静注2gとクエン酸カフェイン60mgを比較した疑似実験研究が発表されている。両群とも1時間の間に疼痛スコアの改善がみられたが、カフェインを投与された群と比較すると、マグネシウム投与群では有意に大きな改善がみられた(p<0.001)[41]。
片頭痛の予防およびQOLの改善におけるマグネシウムの有益な使用は、現在のデータに基づいて有効な治療法である可能性があることを意味するグレードCのエビデンス分類を有している。この分類は、1990年から 2016年までに検討された5つの臨床試験で片頭痛の日数が22~43%減少したことに基づいている。1日600mgのマグネシウムは片頭痛ケアの安全かつ費用対効果の高い構成要素である可能性が示唆されている[42]。グレードCのエビデンスは理想的ではないが、経口または静脈内投与のマグネシウムを用いた片頭痛の予防および治療の有効性に関するエビデンスは、介入研究や前向きコホート研究の発表が増えれば、時間の経過とともにより強固なものになるであろう。全体的には、最近のエビデンスは点滴静注や経口マグネシウムが有効な治療法としての可能性を示唆しているが、片頭痛に対するマグネシウム治療の有効性をより確信し、片頭痛の予防と治療に使用されている現在の医薬品とマグネシウムがどのように比較されているかをよりよく理解するためには、より大きなサンプルサイズと標準化された実験デザインを用いた無作為化比較臨床試験を実施する必要がある。
3.2. 慢性疼痛
痛みは、急性から慢性に至るまで、いくつかの異なる形態で提示することができる普遍的な感覚である。慢性疼痛とは、痛みの正確なメカニズムは様々であるが(侵害受容性、神経障害性、中枢性など時には不明な場合もあるが、少なくとも3ヵ月間持続する持続的な痛みと広く定義されている[43]。慢性的な局所性疼痛は人口の20~25%に存在し、慢性的な広汎性疼痛は人口の10%に存在すると推定されている[44]。前述したように、マグネシウムはNMDA受容体チャネルを遮断してカルシウムの流入を制限する。したがって、マグネシウムの中等度の用量は、興奮毒性のリスクを低減することができるかもしれない[45]。マグネシウムの疼痛緩和効果は、脊髄のNMDA受容体の遮断に依存しているのではないかと提案されている[46]。マグネシウムは慢性疼痛患者において抗侵害受容体および鎮痛効果をもたらすと考えられており、いくつかの形態の慢性疼痛の治療標的として研究されている[45]。
慢性疼痛障害におけるマグネシウムの鎮痛使用を探求する研究は、評価される慢性疼痛の種類と重症度によって制限されている。慢性疼痛の代替治療としてのマグネシウムの使用に関するレビューが最近発表された [47]。慢性疼痛は、慢性複合性局所疼痛症候群、慢性腰痛、線維筋痛症、神経障害、または血管性疼痛を含む、任意の身体部位で3ヵ月以上持続する疼痛と定義された。慢性複合性局所疼痛症候群(CRPS)に関する2件の二重盲検ランダム化臨床試験 [48,49] と慢性腰痛に関する1件の二重盲検ランダム化臨床試験 [50] がレビューされた。これらの試験では、プラセボと比較して、マグネシウムの静脈内投与、皮内投与、および経口投与が行われた。2件のCRPS無作為化臨床試験では相反する結果が得られた;Fischerらは、いくつかのアウトカム指標を用いて、マグネシウムを静脈内投与した患者とプラセボを投与した患者との間でCRPSの疼痛に差はなかったと報告している[48]。しかし、van de Plasは、数値評価スケール(NRS)の疼痛評価スコアにおいて、筋肉内マグネシウム投与とプラセボ投与の間に有意差があることを報告したが、McGill Pain Questionnaire [49]では有意差がないことを報告した。両研究とも、マグネシウムを投与した群ではプラセボよりも多くの副作用が報告されている。YousefとAl-deebは、NRSの疼痛評価スコアを用いて、6ヵ月間の慢性腰痛に対するプラセボと比較して、マグネシウムの静脈内投与と経口投与を検討した。マグネシウム投与群では、2週間後から6ヶ月間の追跡調査で、ベースラインからのスコアが有意に改善された。さらに、マグネシウム治療群はプラセボ群に比べて6ヵ月間の疼痛スコアが有意に低かった [50]。これらの研究のレビューに基づいて、マグネシウムはある種の慢性疼痛に対して実行可能な治療オプションである可能性がある。2015年には、末梢動脈閉塞性疾患患者におけるマグネシウム経口投与の効果を調査中の臨床試験を記述したプロトコルが発表された[51]。この試験は、慢性疼痛の治療薬として経口マグネシウムを使用することの潜在的な有効性について、大いに必要とされる証拠を追加するものである。
線維筋痛症は当初、リウマチ性疾患と考えられていたが、現在では神経学的疾患であることが知られており、激しい広範囲の痛みと圧痛が、重度の疲労、認知機能障害、記憶喪失、頭痛、睡眠障害などの他の不快な症状と結びついている[52,53]。他の慢性的な広汎性疼痛状態と同様に、痛みの神経伝達はNMDA受容体に対するグルタミン酸の作用によって起こると考えられている[54];したがって、マグネシウムは保護的な役割を果たしている可能性が高い。また、線維筋痛症は、酸素、マグネシウム、ADP、無機リン酸塩などのATP合成に必要な物質の不十分なレベルの結果ではないかと提案されている。マグネシウムは、好気性と嫌気性の両方の解糖に必要とされるように、このプロセス内の重要なコンポーネントである。また、ミトコンドリア内でのATP合成の阻害を制限するために細胞質カルシウムを低く維持するのに役立ち、最終的にはミトコンドリアの石灰化によって引き起こされる細胞死の可能性を減少させる[55]。症状とマグネシウムの機序的作用が重複しているため、研究者は線維筋痛症患者のマグネシウムレベルを研究してきたが、その結果、マグネシウムの検出モード間で相反する所見が得られた。線維筋痛症患者では赤血球 [56,57,58,59] および細胞内筋マグネシウムレベル [60] が低下しているが、血漿および血清レベルは正常範囲にとどまっているという証拠がある [57,58,59,61]。しかしながら、他の研究では、対照群と比較して、線維筋痛症患者のマグネシウム血清レベルが有意に低下していることが示されている[53,62,63]。これらの知見に基づき、最近の研究では、線維筋痛症の女性60人と年齢と性別をマッチさせた対照者20人を対象に、クエン酸マグネシウム300mgとアミトリプチリン10mgの単独および併用の効果を8週間にわたって検討した。赤血球値と血清マグネシウム値はともに線維筋痛症群で有意に低下した。さらに、マグネシウムとアミトリプチリンの併用投与群では、さまざまな疼痛・圧痛指数のスコアにおいて疼痛が有意に減少したが、マグネシウム単独投与群では圧痛点の数と線維筋痛症の疼痛の強さが改善したと報告されている[53]。別の研究では、経皮吸収型塩化マグネシウム溶液を8週間使用した後、線維筋痛症影響質問票改訂版(Fibromyalgia Impact Questionnaire-Revised: FIQR)のスコアが改善したと報告している[64]。
マグネシウムが慢性疼痛の一般的または特定の形態に対する実行可能な治療オプションであるかどうかを結論づけるには時期尚早である。しかし、線維筋痛症やその他の慢性疼痛に対する様々なレベルの全身マグネシウムと経口、経皮、静脈内でのマグネシウムの補給に関する予備的なデータは、マグネシウムが慢性疼痛の治療と予防において重要な役割を果たす可能性を示唆している。
3.3. 不安と抑うつ
不安および抑うつはともに神経学的疾患[65]との共通の併存疾患であり、特に片頭痛[67]を含む慢性疼痛疾患[66]との併存疾患である。不安およびうつ病も同様にグルタミン酸神経伝達の変化によって媒介されており、これがこの併存症を説明している可能性がある[68,69]。マグネシウムはN-メチル-D-アスパラート(NMDA)受容体での作用を通じてグルタミン酸神経伝達を調節する能力を有するので[70]、低マグネシウム血症が精神症状だけでなく神経学的症状の両方に寄与している可能性がある。
一般集団における生涯有病率は15%であり、不安は最も広まっている精神科性情動障害と考えられている[71]。マグネシウムは精神神経内分泌系のいくつかの生理学的プロセスに関与しており、視床下部下垂体副腎(HPA)軸を調節するとともに、NMDAグルタミン酸受容体のカルシウム流入を遮断し、これらはすべてストレスおよび不安感を防ぐのに役立つ [72]。マグネシウムの血清および脳脊髄液レベルに関するデータは限られているが、これらの濃度は、個人をさまざまな種類のストレスにさらすことで変化することが示されており、その結果、腎臓で排泄されることで血清マグネシウムが減少し[73]、マグネシウムを投与すると血清レベルが上昇して抗不安作用に似た効果が得られることが示されている[74]。マグネシウムの食事摂取はまた、大規模なコミュニティベースのサンプルにおいて、主観的不安スコアとわずかに逆相関があることが明らかにされた[75]。しかし、ある研究では、全身性不安障害患者の血清マグネシウム濃度が対照群と比較しても差がないことが明らかになった[76]。
2017年、BoyleとDyeは、成人集団における主観的不安またはストレス(すなわち、軽度の不安、月経前症候群、出産後の状態、高血圧)の経験に対するマグネシウムの単独または併用の効果を調査している利用可能な研究のレビューを発表した[72]。軽度の不安の治療に焦点を当てた8件の研究がレビューされ、マグネシウム単独 [77]、マグネシウムとビタミンB6の併用 [78,79,80,81]、マグネシウムとタンパク質加水分解物を含む発酵牛飲料 [82]、またはマグネシウムとサンザシ抽出物およびカリフォルニアポピー [83] の併用に焦点を当てている。軽度から中等度の不安の治療に様々な形態のマグネシウムを有益に使用したことの中等度の証拠が見出された。しかし、有意なプラセボ効果の発生や、複数の化合物を組み合わせて研究した場合のマグネシウムの正確な効果を知ることができないなどの制限があった。PMSに関連した不安について検討された7件の研究のうち、5件はマグネシウムの経口または静脈内投与の単独投与の効果を検討しており[84,85,86,87]、2件はビタミンB6との併用によるマグネシウムの効果を検討している[88,89]。BoyleとDyeが提示した方法論とサンプル選択の問題にもかかわらず、著者らはマグネシウム単独で、ビタミンB6との併用ではPMSにポジティブな効果がある可能性があると結論づけている。1件の研究では、産後うつに関連した不安に対する経口マグネシウム64.4mgの効果について検討されたが、有意な効果は報告されなかった[90]。全体的に要約された所見では、PMSに伴う軽度の不安と不安の治療法としてのマグネシウムの支持はわずかであり、レビューされたいくつかの研究では、マグネシウムを単独または補助的な治療法として投与した場合の肯定的な結果が報告されている。
2010年に行われたLakhanとVieiraによる先のレビューでも、同様の結論が出ている:マグネシウムの投与は多発性不安障害の治療にプラスの影響を与える可能性がある。著者らはまた、実施された多くの研究や臨床試験ではマグネシウム単独の効果を調べていないことにも注意している。我々の知る限りでは、2017年のレビュー以降、不安障害に対するマグネシウムの効果を検討した新しいマグネシウム研究は発表されていない。現在、不安障害を治療するための現行の薬物による否定的な副作用を排除しつつ、不安障害を持つ人々の生活を改善できる可能性があるため、この治療法の選択肢を探索する方法論的に健全な臨床試験の必要性が強く求められている。
うつ病は世界中で何億人もの人が罹患している精神疾患であり、大うつ病性障害(MDD)は米国の神経精神疾患の40%を占めている[92]。うつ病は、重度の障害を伴う生活の質の低下と関連しており、前述したように、しばしば他の併存障害を伴う。うつ病には有益な生物医学的および臨床的治療法があるが、食事によるマグネシウムの摂取は重要な補助治療となりうる [93,94]。
うつ病患者におけるマグネシウムのバランスを回復させることは、興奮毒性によって引き起こされる細胞死のカスケードを減少させることにより、うつ病に関連する脳構造を保護することにより、抗うつ効果をもたらすことが提案されている [95,96,97]。マグネシウムはまた、不安障害で議論されているように、HPA系と相互作用することで抑うつ症状に影響を与える可能性がある[97,98]。他のいくつかの神経学的障害に見られるように、マグネシウムレベルの低下はうつ病と関連している。最近の研究では、マグネシウムの食事摂取とうつ病との間に負の相関があることが報告されている [93]。また、うつ病と診断された患者では、対照群と比較して脳脊髄液(脳脊髄液)および血清マグネシウムレベルが低いことが観察されており [94] 、大うつ病患者では赤血球マグネシウムレベルが中程度に低下していることが報告されている [99]。さらに、うつ病患者の血漿中マグネシウム濃度は健康な対照群と比較して有意に低いことが観察され、治療効果の成功[100]および抑うつ症状の重症度[101,102]とも相関していた。しかし、別の研究では、脳脊髄液、血液、血清マグネシウムレベルに群間の差はなかったと報告されている[103]。後者の所見は、ヒトの体内のマグネシウムの99%が細胞内に存在するため、不正確な評価技術によるものである可能性がある[103]。
うつ病の治療法としてマグネシウム補給を支持する神経生物学的証拠はあるが、限られた数の無作為化比較試験(RCT)の結果からは明確な切り口はない。2016年にRechenbergは、うつ病の集団におけるマグネシウムの使用を検討したRCTをレビューした。しかし、マグネシウムを治療薬として使用する可能性についての洞察が限られている3つの研究のみが、このテーマに関する文献が不足しているために論じられている[94]。Bhudiらは心臓手術を受けた患者を対象に、神経保護剤としてマグネシウムを3ヵ月間プラセボと比較した。ベースライン時と術後3ヵ月間に、測定されたアウトカムの1つとして抑うつ症状が報告された。抑うつ症状は減少したが、マグネシウム群とプラセボ群の間には有意差は認められなかった [104]。2007年に2型糖尿病で新たにうつ病になった高齢者の治療薬としての経口マグネシウムの有用性を検討するRCTが実施された。低マグネシウム血症の存在を確認した後、患者をマグネシウム治療群またはイミプラミン治療群に無作為に割り付け、12週間の治療を行った。追跡調査では,マグネシウム治療群とイミプラミン治療群の間に有意差は認められず,両群とも同様の改善が認められた。このように、マグネシウムは抗うつ薬であるイミプラミンと同等の効果を示した[101]。最後に、Walkerらは、二重盲検プラセボ対照クロスオーバー試験において、月経周期2回にわたりマグネシウム200mgを毎日投与しても、報告された抑うつ症状に有意差がないことを示した[85]。
食事中のマグネシウム摂取とうつ病のリスクとの関係を検討した11件の研究のメタアナリシスが最近発表された。相対リスク(RR)のプール測定と用量反応分析を用いて、著者らは、レビューされた研究の半数以上が、2つの因子間に明確な非線形関係(p = 0.0038)があり、うつ病のリスク低下(プールされたRR = 0.81)と関連して、食事性マグネシウム摂取の有意な効果を支持していると結論づけた。さらに、最大のリスク低下は、320mg/日のマグネシウム摂取で観察された [93]。このメタアナリシスは、食事からの摂取または他の投与経路によるマグネシウム補給は、うつ病治療の潜在的標的として引き続き研究されるべきであるという理論に、より多くの証拠を与えている。
Rechenbergによるレビュー[94]およびLiらによるメタアナリシス[93]以降、新たに発表された研究が3件見つかった。1件の臨床試験では、治療抵抗性のある成人のうつ病患者を対象に、ブドウ糖単独と比較してマグネシウムの静脈内投与とブドウ糖の併用をクロスオーバー試験で検討した。著者らは、ベースラインと8日目(投与最終日2日目と8日目の2つの時点で測定した血清マグネシウム値に有意な差が認められた。しかし、うつ病評価尺度の結果は、ベースラインから7日目までのPatient Health Questionnaire-9の減少のみであり、実質的な差は認められなかった[105]。この研究は治療期間が短いために制限されていた。Tarletonらは成人126人を対象に、248mgのマグネシウムとプラセボを6週間にわたって比較した非盲検ランダム化試験を実施したが、その結果、マグネシウム群ではうつ病のスコアが有意に改善した。実際、治療開始から2週間以内に改善が認められた[106]。最後に、うつ病と検査で低マグネシウム血症が確認された60人の患者を対象とした研究では、250mgのマグネシウムまたはプラセボのいずれかを8週間投与するように無作為に割り付けられた。結果の指標としてBeck Depression Inventory-IIを用いたところ、マグネシウム群ではプラセボ群と比較してマグネシウムレベルとBeckスコアが有意に改善した[107]。これらの後者の研究で補充されたマグネシウムの量は、成人の推奨食事摂取量(RDA)である310~420mg/日よりも少なかったことに注意することが重要である。
残念ながら、うつ病の治療オプションとしてマグネシウムを実施している現在の研究では、一貫して有意な結果は得られていないが、これは有効な治療オプションではないということを意味するものではない[103,108]。うつ病に対するマグネシウムの効果を十分に理解するためには、よりよく計画された無作為化臨床試験や、十分なパワーのあるサンプルサイズでより長期間のプロスペクティブ研究が必要である。
3.4. てんかん
てんかんは、世界中で5,000万人が罹患していると考えられている発作の発生状況によって分類される疾患である[109,110,111]。この疾患の広範で衰弱的な影響により、抗てんかん薬(AED)による古典的な治療法以外の治療法の調査が行われているが、特に新しいAEDは古いAEDに比べて発作を有意に減少させたり、予後を改善したりする効果がないことが研究で示唆されている場合には [112,113,114]。代替治療の可能性を模索する中で、マグネシウムに注目が集まっている。マグネシウムは多くの身体プロセスに関与する必須元素であり、先に述べたように、現代の西洋食生活では不足していることが判明している[114,115,116]。さらに、発作活動は過剰なグルタミン酸神経伝達と強く関連しているため、マグネシウムはてんかんに関連した興奮毒性を調節する可能性がある[117]。細胞外マグネシウムは、NMDA受容体を介して発作活動の自発的スパイクを減少させると同時に、神経細胞表面の興奮性を減少させることが報告されている[114,118,119]。実際、低マグネシウム血症自体が、より重度の欠乏で発作活動を引き起こす可能性があることはよく知られている[120]。
最近の2つのレビュー[114,121]では、マグネシウムとてんかんに関する文献を検討している。どちらのレビューも、一般的なてんかんだけでなく、より具体的には難治性てんかんの治療薬としてのマグネシウムの潜在的な役割についての洞察を得るために不可欠な、大規模な無作為化比較試験の欠如を強調している。難治性てんかんは、AEDに反応しないことから特に注目されており、通常、発作やその他の症状が治療されないままになることが多い。
ヒトでは、マグネシウムの欠乏が発作を引き起こすことが明らかになっており、健常対照者と比較しててんかん患者ではマグネシウムのレベルが低いことが観察されている[114,121,122,123,124,125,126,127,128]。60件の研究(てんかんに関する40件と熱性発作に関する25件)を含む最近のメタアナリシスでは、てんかん患者と対照群、または熱性発作患者と対照群でマグネシウムレベルに有意な差はないことが明らかになった。しかし、同じ研究では、治療を受けていないてんかん患者と治療を受けたてんかん患者の両方で、毛髪マグネシウム濃度が対照群と比較して有意に低いことが明らかになった[129]。別の研究では、中等度および軽度のてんかん患者と比較して、重症度の高いてんかん患者および状態てんかん患者ではマグネシウム濃度が低いことが報告されている[124]。疾患の重症度とマグネシウム濃度との関係は、これまで詳しく調査されてきた分野ではないため、この潜在的な関連性に焦点を当てた研究が進めば、貴重な情報が得られる可能性がある。
治療法としてのマグネシウムに関しては、乳児および成人の発作の危険因子として知られている低マグネシウム血症に対して、マグネシウムの補給が有益であることがわかっている[130,131]。子癇前症や子癇症などの症状性発作に関連する他の状態も、マグネシウム補充の結果として改善がみられることが示されている [132,133,134]。さらに、TRPM6遺伝子変異[135,136,137]、若年発症のアルパー症候群[138]、およびMRIが正常な被験者の難治性てんかんの症例を調査した研究でも、マグネシウム補給の投与による治療上の有益性が報告されている[114,121,139]。
これらの研究から裏付けとなるエビデンスが得られているにもかかわらず、てんかんに対するマグネシウム治療については、乳児期の痙攣に焦点を当てた1件のランダム化比較試験しか実施されていない。この研究では、副腎皮質刺激ホルモン(ACTH)の静脈内投与とマグネシウムの補充を3週間行ったところ、ACTH単独投与と比較して発作が有意に減少したことが明らかになった。投与8週間後の時点で、マグネシウムサプリメントを投与された群では、ACTHのみの群では53%しか発作がなかったのに対し、79%の無発作率が得られた[140]。この研究は有望な結果を提供しているが、2015年の最後のレビュー以降、他の無作為化比較試験は終了していない。最近の研究では、薬剤耐性てんかん患者104人の発作間総血清マグネシウム濃度を血清イオン化マグネシウム濃度とともに調査した。データはベースライン時と14年後に収集され、その結果、サンプルの60.6%(OR = 29.19)が口唇間イオン化マグネシウムおよび血清総マグネシウム比が低値であったことが示された[141]。
てんかんの治療オプションとしてのマグネシウムの可能性をよりよく理解するためには、より多くのランダム化比較試験が必要である。このような試験では、マグネシウムレベルをより正確に測定することで、様々なタイプのてんかんの治療(または補助治療)としてのマグネシウムの潜在的な役割について、より具体的な洞察を得ることができるであろう。
3.5. パーキンソン病
パーキンソン病(PD)は、大脳基底核におけるドーパミンの選択的な消失によって引き起こされる、バランス感覚の喪失、筋肉の緊張、体の動きの鈍化、安静時の四肢の振戦、および認知機能障害などの症状を伴う神経障害である [142]。パーキンソン病に影響を与える他の因子には、ミトコンドリア機能障害、酸化ストレス、およびタンパク質機能障害がある[143]。過度のグルタミン酸神経伝達による興奮毒性がパーキンソン病でみられるドーパミン細胞の喪失を媒介している可能性が示唆されており、興奮毒性の調節因子は研究の関心が高まっている分野である[144]。パーキンソン病におけるマグネシウムの潜在的な役割を調査したヒトの研究は少ない [145]。我々の知る限りでは、ヒトにおけるマグネシウムとパーキンソン病に焦点を当てた詳細なレビュー論文は存在しない。最近発表された最も新しい研究は、日本で行われた多施設病院ベースの症例対照研究で、パーキンソン病の発症から6年以内であることが判明した患者における金属の食事摂取量を調査したものである。この研究の結果、マグネシウム濃度の上昇はパーキンソン病のリスク低下と関連していることが明らかになった [146]。
パーキンソン病患者のマグネシウム濃度を調査した研究では、さまざまな結果が得られている。1960年代の古い研究では、パーキンソン病患者の血清マグネシウム濃度は対照群と比較して差がないことが報告されている[147]が、この研究は当時利用可能なマグネシウム検査の種類によって制限されていた可能性が高い。さらに最近の研究でも同様の結果が得られており、パーキンソン病患者とそうでない患者の間で毛髪のマグネシウムレベルに有意差は認められなかった。さらに、マグネシウムレベルと疾患の持続期間または重症度との間には関連性は認められなかった [142]。対照的に、対照群18人とパーキンソン病患者91人の脳脊髄液(脳脊髄液血液、血清、尿、毛髪のマグネシウムレベルを調べた研究では、脳脊髄液のマグネシウムレベルは疾患の持続期間および重症度と逆に関連していることが明らかになった。また、同じ研究では、発症1年未満のパーキンソン病患者の方が、発症8年以上のパーキンソン病患者よりもマグネシウムレベルが高いと結論づけている[148]。最後に、パーキンソン病患者の脳領域のマグネシウムレベルを対照群と比較したより古い研究では、パーキンソン病患者は対照群と比較して大脳皮質、白質、基底核、尾状核、脳幹のマグネシウムレベルが低いことが明らかになっている[149,150]。これらの研究では、マグネシウム濃度の測定方法が異なっており、これが矛盾した結果の一因となっている可能性があることに注意することが重要である。パーキンソン病におけるマグネシウムの役割を検討する今後の研究では、末梢のみではなく、脳脊髄液(脳脊髄液)中のマグネシウム濃度(中枢神経系のマグネシウムの指標として)の測定を含めるべきである。この測定技術は、他の神経疾患にも応用できる可能性がある。
要するに、動物実験でマグネシウムを示唆する証拠が増えているにもかかわらず、パーキンソン病におけるマグネシウム濃度のヒト研究は非常に不足している。マグネシウムとパーキンソン病の関係についてより良いコンセンサスを得るためには、パーキンソン病患者を対象としたマグネシウム濃度に焦点を当てたより多くの研究が必要である。これらの少数の研究は、パーキンソン病の治療法としてのマグネシウムの役割についてのわずかな洞察を提供している;しかしながら、結論を導き出すまでには、さらに多くの研究が必要である。
3.6. アルツハイマー病
アルツハイマー病は、シナプスの喪失と学習と記憶の悪化を含む認知障害を特徴とする変性神経疾患である[1]。アルツハイマー病は、炎症や萎縮とともに、βアミロイドとタウのもつれの蓄積を呈する [151]。興奮毒性、神経炎症、ミトコンドリア機能不全はすべてアルツハイマー病に関与しており[152]、低マグネシウム血症は神経細胞の機能をさらに損なう可能性がある。栄養不良や貧弱な栄養摂取など、マグネシウムの利用可能性の低下に関連する因子は、アルツハイマー病患者にも存在しており[153,154]、マグネシウム欠乏症の可能性が高くなっている。研究は、イオン化マグネシウム[155]、脳脊髄液(脳脊髄液)マグネシウム、毛髪マグネシウム、血漿マグネシウム、および赤血球マグネシウムの濃度が、健康な対照者および医学的対照者と比較してアルツハイマー病患者で有意に低下することを示唆している[154]。さらに、アルツハイマー病脳の死後の脳の検査では、健康な対照群と比較してマグネシウム濃度が低下していることがわかった[154,156,157]。マグネシウムの枯渇はアルツハイマー病患者の海馬で発見されており、マグネシウムが治療の標的である可能性があるというより多くの証拠を提供している [156]。
システマティックレビューでは、アルツハイマー病患者と健常対照および/または医学的対照を含む13の横断的研究が分析された[154]。その結果、アルツハイマー病患者は脳脊髄液 [158,159]および毛髪サンプル[160,161]中のマグネシウム濃度が有意に低いことが示されたが、対照群と比較して血清[161,162,163,164]、血漿[158,165,166]、またはイオン化/血球マグネシウム濃度[165]にはそのような差は認められなかった。医学的コントロールと比較して、アルツハイマー病患者は血漿[167]とイオン化・血球マグネシウム濃度[168]が低下していたが、血清[155,169]、または脳脊髄液濃度[168]には差がなかった。一方、他の研究では、アルツハイマー病患者の毛髪と血清マグネシウム濃度の間には、対照群と比較して差がないことが明らかにされている[170]。したがって、現在の研究では、マグネシウム濃度レベルに関して矛盾する結果が得られており、したがって、さらなる調査とマグネシウムレベルを測定する標準化された方法が必要である。注目に値する1つの具体的な研究では、アルツハイマー病患者と年齢をマッチさせた対照群を比較した場合、イオン化されたマグネシウムレベルは認知機能と有意に関連していたが、身体機能とは関連していなかったことが報告されている[155]。パーキンソン病と同様に、今後のアルツハイマー病研究では、磁気共鳴分光法の使用と同様に、脳脊髄液測定からの中枢神経系のマグネシウム濃度にもっと焦点を当てるべきである。上記の所見は、アルツハイマー病患者は一般的にマグネシウムが不足している可能性があることを示唆している。
以前のレビューでは、マグネシウム欠乏とヒトにおけるアルツハイマー病との関連性が示されているが、ヒトにおけるアルツハイマー病の治療薬としてのマグネシウムを検討した研究は明らかに不足している。これまでの研究は、特にアルツハイマー病とは対照的に主に認知症に焦点を当てており、様々な結果が出ている。ある研究では、軽度認知障害患者とアルツハイマー病患者では対照群と比較してマグネシウム濃度が低いことが観察された[171]。しかし、別の研究では、マグネシウム濃度が低い場合と高い場合の両方が、全原因性認知症のリスクの増加と関連していることが明らかになった[172]。これは、マグネシウム濃度の高低の両方が認知症発症のリスクと関連しているという証拠を示した唯一の研究である。この研究が主張するように、これらの知見をよりよく理解するためには、大規模な集団ベースの研究から得られた知見の再現が不可欠である。認知症については、食事によるマグネシウム治療に重点を置くことで記憶力が向上することが示されている[173]。PATH through Life Projectでは、マグネシウムの摂取量を増やすことが、軽度認知障害や軽度認知障害の発症リスクの低下と関連していることが明らかになった[173]。同様に、日本のある研究では、マグネシウムの摂取量が多いほど、全原因性認知症や血管性認知症の発症率が低いことが明らかになった。しかし、アルツハイマー病患者では同じ関係はなかった[174]。認知症には血管性認知症を含む複数の原因があることを覚えておくことが重要である。マグネシウムは神経細胞機能に加えて血管機能にも影響を与えるというユニークな性質を持っている[1]。したがって、マグネシウムは複数の異なる方法で認知機能に影響を与えている可能性がある。マグネシウムがアルツハイマー病および/または他のタイプの認知症において補助的な治療オプションとなるべきかどうかを検討する上で、文献を追加するために、この分野での将来の臨床試験研究が必要である。
3.7. 脳卒中
脳卒中は、言葉が出ない、麻痺・しびれ、歩行困難などの症状を呈する脳血管障害である。脳卒中は、虚血性(血流が阻害される、通常は血栓によって)と出血性(血管が破裂して脳内の血流が障害される)の2つのタイプに分けることができる[175]。誘発された低酸素は、興奮毒性とその結果としての細胞死を引き起こす[176]。マグネシウムは、血管機能に影響を与える能力[177]とNMDA受容体[176]によって媒介される興奮毒性から保護する能力という二重の役割を果たしているため、脳卒中の研究コミュニティの中で関心の高い要素となっている。脳卒中のリスクとマグネシウムレベルを検討した研究では、さまざまな結果が得られている。16年間の追跡調査で虚血性脳卒中症例に基づいた研究では、血清イオン化マグネシウムレベルと脳卒中リスクとの間には関係がないことが明らかにされている [178]。同様に、別の研究では、血漿マグネシウムレベルは女性の虚血性脳卒中のリスクとは関連していないが、イオン化マグネシウムレベルが低い人(0.82mmol/L未満)では、潜在的な交絡因子をコントロールした後、虚血性脳卒中のリスクが57%高いことが報告された [179]。しかし、最近の研究では、入院時の血清マグネシウム濃度の高さが、急性自然脳内出血患者における血腫量の減少および脳内出血スコアの低下と独立して関連していることが明らかになっている[180]。米国の成人を対象としたより一般的な研究では、血清マグネシウム濃度が非常に低いことが脳卒中死亡リスクの増加と有意に関連していた [181]。マグネシウム濃度と脳卒中リスクは相反する結果をもたらしているが、マグネシウムが脳卒中に対して保護的であるという明確な示唆がある。
脳卒中リスクとマグネシウムとの関連について行われた研究のほとんどは、アメリカ、ヨーロッパ、アジアの前向きコホート研究で見られる [182,183]。脳卒中に関する最近の出版物では、複数のメタアナリシスをレビューし、マグネシウムの脳卒中に対する用量依存的な保護効果が報告されている [182]。レビューされたほとんどのメタアナリシスでは、食事からのマグネシウム摂取量が1日100mg増加するごとに、脳卒中全体に対して2%から13%の保護効果が得られることが明らかになった [183,184,185,186]。Fangらによる最近更新されたメタアナリシスには40件の前向きコホート研究が含まれており、食事性マグネシウムの摂取量が最も多いカテゴリーと最も少ないカテゴリーの人を比較した場合、脳卒中のリスクに対する保護率が22%であることが示された [183]。これらのメタアナリシスは、高い同質性を示し、出版バイアスが低く、潜在的な交絡因子を慎重に調整したとレビュー論文で指摘されている[182]。したがって、これらの研究は信頼性が高く、食事性マグネシウム摂取量と脳卒中のリスクとの間に逆用量依存性の関係があるという考えを支持している。これらのメタアナリシスは、マグネシウム摂取量の増加および血清マグネシウム濃度の上昇が、脳卒中全リスクの低下に有益であるように思われることを示唆している。
脳卒中には多くのタイプがあり、すべての脳卒中のサブタイプがマグネシウムと普遍的な関係を示しているわけではないことに注意することが重要である。例えば、あるメタアナリシス [184] では、7件の前向き研究が含まれており、マグネシウムの摂取量は虚血性脳卒中のリスクと逆相関があることが示されている [178,187,188,189];しかしながら、この逆相関は脳内出血またはくも膜下出血では認められなかった [184,187,188]。動脈瘤性くも膜下出血患者における遅発性脳虚血のリスクをマグネシウムが低下させるかどうかを調査した後の研究でも、マグネシウムは有益ではなく、リスクを低下させなかったことが明らかになった[190]。このような証拠は、脳卒中の種類によってマグネシウムとの関係が異なる可能性を示唆しており、これは脳卒中発症リスクにおけるマグネシウムの役割を理解する上で重要な区別である。
脳卒中患者のマグネシウムレベルに関する研究では、マグネシウムレベルの低さと脳卒中後の予後の悪さとの関連が示唆されている。最近の研究はこの考えを裏付けるもので、入院時の血清マグネシウム濃度の低さが急性虚血性脳卒中患者の院内死亡率と独立して関連しているという証拠を提供している [191]。以前の研究では、虚血性脳卒中患者では対照群と比較して脳脊髄液マグネシウム値の低下が観察され、7日後の死亡率と脳脊髄液マグネシウム値の低さとの間に正の関連が存在することが報告されている [192]。虚血性脳卒中に加えて、脳内出血を呈した患者を対象とした観察的コホート研究では、観察の3ヵ月後に、年齢および疾患の重症度の尺度を調整した後でも、入院時のマグネシウムレベルの低さと機能的転帰の不良が関連していることが明らかになった。さらに、初期および最終的な血腫量、および血腫の成長はすべて、入院時の血清マグネシウムレベルの低さと独立して、また逆に相関していた [193]。脳卒中患者における低マグネシウム血症を研究する際には、診断後に測定されるため、因果関係を仮定することができず、その結果、マグネシウム値の低下は脳卒中の結果であって脳卒中の原因ではない可能性があるという大きな問題に対処することが重要である [182]。
脳卒中に対するマグネシウムレベルの保護効果があるように見えるにもかかわらず、脳卒中の治療法としてのマグネシウムはあまり明確な結果が得られていない。急性期脳卒中を調査した試験では、脳卒中発症から12時間以内にマグネシウムを静脈内投与しても死亡または障害の転帰は改善しないことが明らかにされている [194]。同様に、メタアナリシスでは、動脈瘤性くも膜下出血後早期に投与を開始した場合、遅延性脳虚血に対するマグネシウムの有益な効果は5件の試験で報告されていないと報告している [195,196,197,198,199,200]。
いくつかの研究では、硫酸マグネシウムが脳卒中後の転帰を管理するのに有益であることがわかっている[201,202]。ChenとCarterによるメタアナリシス[203]では、8つの対照臨床試験を調査し、そのうち4つの試験では、硫酸マグネシウムが動脈瘤性くも膜下出血の3~6ヵ月後の転帰不良のリスクを対照群と比較して低下させるという証拠が示された[198,199,201,204]。他の研究では、硫酸マグネシウムは動脈瘤性くも膜下出血の治療に有益ではなかったと報告されている[199,205,206]。メタアナリシスの全体的な所見から、硫酸マグネシウムはくも膜下出血の機能的転帰不良のリスクを低下させることができる可能性が示唆された。
脳卒中全般に関しては、Panahiらは、硫酸マグネシウムがさまざまな測定指標[196,201,207]、神経保護特性[208,209]、入院期間[207,210]、および回復転帰[206,207]のスコアを改善することが明らかになっている研究をレビューした。脳卒中の潜在的な治療法として研究されている追加化合物は、マグネシウムとカリウムの組み合わせからなる濃縮塩である。二重盲検ランダム化比較試験では、この化合物を6ヵ月間投与すると、脳卒中後の神経障害が改善されることが明らかになった [211]。
まとめると、脳卒中後の転帰を改善するためにマグネシウムを使用することを示唆する研究がある。脳卒中の発生予防におけるマグネシウムレベルを適切に維持することの潜在的な保護的役割を理解するためには、さらなる研究が必要である。
4. 結論
結論として、マグネシウムと様々な神経疾患との関連性に関する質の高いデータの量には大きな差がある。片頭痛やうつ病におけるマグネシウムの役割については強いデータがある。また、慢性的な痛みの状態や、不安やうつ病などの一般的に併存する精神疾患にもマグネシウムが効果を発揮する可能性は十分にある。てんかんに対するマグネシウムの効果については、補助治療としてのマグネシウムの使用を評価する臨床試験を含め、さらに多くの研究が必要である。パーキンソン病やアルツハイマー病のような神経疾患は、中枢神経系のマグネシウムレベルの測定(脳脊髄液測定やMRSを介して)を含む追加の研究から大いに恩恵を受けるであろう。最後に、マグネシウムが脳卒中後の転帰を改善し、脳卒中を予防するための重要な食事戦略としてプラスの効果があることを示唆する研究もあるが、この点ではより多くの前向きな研究が必要である。
