Contents
The role of extracellular DNA in COVID-19: clues from inflamm-aging
pubmed.ncbi.nlm.nih.gov/33321254/
ハイライト
- 炎症老化の概念は、COVID-19によって生成された強力な炎症反応をよりよく理解するのに役立つ。
- 誤って配置された細胞外炎症性DNA配列(mtDNAなど)と抗炎症性DNA(テロメアなど)の間の年齢に関連した不均衡は、炎症老化の異常を引き起こす。
- 細胞外 mtDNA 濃度は増加し,多臓器障害または敗血症の患者における障害の程度,臨床経過,多臓器不全の発症と相関している.
要旨
疫学的データから、加齢性疾患に罹患した高齢男性におけるCOVID-19の厳しい予後と高い死亡率が報告されている。これらの被験者は局所および全身性の炎症亢進を呈し、血栓性合併症や多臓器不全と関連している。したがって、高齢男性におけるSARS-CoV-2誘発性高炎症の理解は喫緊の課題である。
ここでは、細胞外DNA、主にミトコンドリアDNA(mtDNA)とテロメリックDNA(telDNA)が、これらの被験者における全身炎症の調節に果たす役割に注目している。特に、細胞外mtDNAは炎症反応の強力な引き金になると考えられている。一方、細胞外telDNAプールは、様々な炎症経路を抑制することが可能であると推定されている。その結果、細胞外telDNAプールは加齢とともに徐々に枯渇し、男性では女性よりも不足していることが明らかになった。
我々は、細胞外mtDNAの増加が、抗炎症性telDNAリザーバーの減少と同時に、COVID-19の影響を受けた高齢男性の炎症亢進を説明する可能性を提案する。このシナリオは、加齢や老化に関連する疾患がいかに炎症と密接に関連しているかを描いたポートマンテーの言葉である inflamm-aging(加齢に伴う炎症) を彷彿とさせる。
キーワード
インフラマエイジング-aging,misplaced DNA,COVID-19,DNAセンシングレセプター,テロメア
1. 序論
SARS-CoV-2コロナウイルスによる進行中のCOVID-19パンデミックは、世界的な健康緊急事態を引き起こしている(Callaway et al 2020)。SARS-CoV-2の急速な感染性およびかなりの割合の患者における重篤で致死的な呼吸器合併症の出現は、世界中のすべての医療システムにとって前例のない脅威を表している。
かなりの割合の患者における感染の極端な毒性(致死率約6~12%、https://coronavirus.jhu.edu/map.html)は、その印象的な感染性(季節性インフルエンザの1.4と比較して、推定再生産数R0は2/3まで)と相まって、前例のない世界的な広がり(2020年11月30日の感染者数は約60.000.000人、https://coronavirus.jhu.edu/map.html)は、COVID-19病の最も重篤な症状の分子基盤を理解することの緊急の必要性を強調している。
COVID-19パンデミックに関するデータは、SARS-CoV-2感染の臨床転帰が、民族性に関係なく、患者の年齢と性別にリンクしていることを示している(Ruan et al 2020; Remuzzi and Remuzzi, 2020)。イタリアでは11月30日に約1.600.000人が感染し、死亡年齢中央値は80歳で、感染者(49歳)より31歳も高齢である。COVID-19の犠牲者のうち50歳未満はわずか1.1%。彼らのほとんど(約60%)は、少なくとも3.3の年齢関連疾患(例:心機能障害、高血圧、糖尿病、https://www.epicentro.iss.it/)に罹患していた。イタリアで入手可能なデータによると、致死率は女性よりも男性の方が50~70歳の年齢層で実質的に高く、男性の死亡率は75%対女性の死亡率は25%であることが示されている(https://www.epicentro.iss.it/coronavirus/sars-cov-2-decessi-italia)。
最も重篤なCOVID-19患者における臨床症状は、異常な高炎症性反応を特徴とし、その中で、老年学者(Ershler 1993)のためのいわゆるサイトカインであるインターロイキン-6(IL-6)が主要なプレーヤーとして際立っている(Chen et al 2020; Zhou et al 2020)。この証拠のおかげで、いくつかの臨床試験は、SARS-CoV-2患者が、サイトカイン放出症候群を緩和するIL-6/IL-6受容体に対するモノクローナル抗体の投与の恩恵を受けることを示唆した(Xu et al 2020;Luo et al 2020;Zhang et al 2020)。それにもかかわらず、IL-6経路阻害の臨床的意義についての議論はまだ開かれている(Salvarani et al 2020)。
重要なことに、局所(肺)および全身性の高炎症性状態は、COVID-19患者における虚血性損傷および多臓器不全をもたらす広範な血栓現象に関与している(Wu et al 2020;Connors et al 2020;Zuo et al 2020)。したがって、特に男性高齢者におけるSARS-CoV-2誘導性炎症に作用する生物学的事象の理解は急務である。
2. COVID-19と炎症老化
今日では、高齢者が炎症老化と呼ばれる進行性の慢性炎症の状態に苦しむことが認められている(Franceschi er al)。 炎症老化は、原因、すなわち疾患の発症に関与していると考えられているか、あるいはその結果と考えられているかにかかわらず、加齢に伴う疾患と密接に関連している(Fulop er al)。
自己および非自己分子、栄養素およびマイクロバイオータなどの生物学的刺激の茄多は、自然免疫系の年齢に依存した活性化を誘発することによって炎症老化を育む(Franceschi et al 2018)。炎症老化は、加齢や加齢に伴う免疫代謝リモデリング(メタ炎症)と密接に関連している(Franceschi et al 2018; Storci et al 2018; Storci et al 2020)。言い換えれば、炎症老化を加齢に伴う炎症性ドリフトと考えるならば、COVID-19のような特定の疾患は、高齢者の免疫代謝異常を加速させる可能性のある炎症のスパイクまたはバウトと考えられるかもしれない。
我々は最近、老化に関連する少なくとも4つのメカニズム
- 炎症老化の速度
- 免疫老化の速度
- ACE2受容体の抗炎症活性の喪失
- 老化細胞の発生およびテロメアの短縮
が、COVID-19の重症度に影響を与える可能性があることを提案した(Bonafè et al 2020a)。注目すべきことに、これらのメカニズムのほとんどは、女性よりも男性においてあからさまに発生するため、性別に偏っている(Bonafe et al 2019; Márquez et al 2020)。ここでは、高齢者(すなわち、炎症老化中)およびCOVID-19患者における全身炎症のモジュレーターとしての循環性無細胞DNAによるギャンブルされた役割に焦点を当てる。
この点に関して、最近の2つの研究では、炎症老化の重要な因子として産生細胞から放出される細胞外mtDNAが同定され(Iske et al 2020年)COVID-19重症度の予測因子として循環mtDNAのレベルが同定された(Scozzi et al 2020)。また、加齢とともに枯渇する細胞外抗炎症性DNAの重要な供給源としての細胞外テロメリックDNA(telDNA)にも注目している(Storci et al 2018; Bonafè et al 2020b)。
豊富な文献は、telDNAの短縮が細胞および全身の老化の特徴であり、それが細胞および全身の炎症と関連していることを示している(Aguado et al 2019)。実際、多量の加齢関連疾患を含む老化に関連する多くの現象は、テロメア短縮と関連している(Aguado et al 2019; Armanios et al 2013; Herrmann et al 2018)。一貫して、最近の論文は、短いテロメアがCOVID-19患者における好ましくない転帰のマーカーであることを示唆している(Aviv, 2020)。
しかしながら、多くのデータは、細胞外telDNAが炎症の強力な鎮静剤として作用し得ることを示しており、最近、炎症老化におけるその可能性のある役割を報告した(Storci et al 2018; Bonafè et al 2020b; Kaminsky et al 2013)。さらに、最近の文献は、細胞外telDNAが染色体テロメア末端から積極的に流され、細胞外小胞に存在することを示している(Bonafè et al 2020b; Mazzucco et al 2020; Bruno et al 2020)。
この観点から、テロメアの年齢に依存した短縮は、高齢者における細胞外抗炎症性DNAリザーバーの枯渇のメカニズムを表している。この推論に従うと、テロメア短縮および高レベルの細胞外mtDNAが、炎症性病態を伴う多数の加齢関連疾患と関連していることは驚くべきことではない(Storci et al 2018; Bonafè et al 2020a; Iske et al 2020; Aguado et al 2019; Bruno et al 2020)。
したがって、高齢者の細胞外DNAは、細胞外mtDNAの増加と細胞外telDNAの減少とが同時に起こるため、炎症を刺激する可能性が高くなる。その結果、COVID-19期間中に悪化した高齢者の炎症促進性mtDNAの放出と、年齢に依存した抗炎症性の細胞外telDNAリザーバーの減少は、全身性の炎症亢進のバランスを崩し、特に加齢性疾患に罹患した高齢男性では生命を脅かすようになる可能性がある。したがって、我々は、炎症加齢のプロ炎症性ベースラインが、高齢男性におけるSARS-CoV-2病の重篤で有害な進行を促進するという仮説を立てた。
3. 細胞外mtDNA放出:ウイルス感染に対する有益な反応であるが、全身炎症の有害なブースターに変化する
mtDNAの放出は、細胞損傷に対する先祖応答機構であり、今日では炎症の主要な局所的および全身的トリガーと考えられている(Bruno et al 2020)。プロ炎症トリガーとしての細胞外mtDNAの支配的な役割は、異なる臨床病理学的設定で報告されている(Zhang er al)。
この現象は、この後者が「良好な状態」にあり、その機能が維持されるまで、mtDNAはオルガネラの中に保持されなければならないという概念を想起させる(Bruno et al 2020)。損傷が生じると、mtDNAは、細胞質および細胞外空間に漏出し、そこで炎症を誘発し、またタイプ1インターフェロン(IFN-1)抗ウイルス応答を誘発する(Barnes et al 2020)。その活性は、主にCpG部位のメチル化の欠如によるものであり、これは、細菌のDNAを模倣したToll-Like-Receptor-9(TLR-9)受容体の活性化を誘発する(Riley et al 2020)。MtDNAはまた、Absent in Melanoma-2(AIM2)およびcGASなどの細胞質DNA検出器にも関与する(Bruno et al 2020; Barnes et al 2020; Dalpke et al 2006; Bae et al 2019; Itagaki et al 2015; Puyo et al 2019)。
抗ウイルス応答におけるミトコンドリア損傷は、多くのウイルス感染症で報告されている:単純ヘルペス、B型肝炎、HIV、血小板減少症候群を伴う重症熱、デングウイルス(一本鎖陽性RNAウイルス)など(Lai et al 2018; Saffran et al 2007; Cao et al 2020; Pinti et al 2012; Li et al 2020)。これらのウイルスの多くは、mtDNAの放出によって媒介される強力な炎症反応を引き起こす(Lai et al 2018; Singh et al 2020; Burtscher et al 2020)。
注目すべきは、放出されたmtDNAの大部分が酸化され、それゆえに細胞質DNAseIII/TREX酵素に対してより耐性があり、その結果、より高い安定性に恵まれているという事実のために、mtDNAのプロ炎症性能力は、高齢者において増加すると予想される(Gehrke et al 2013)。
興味深いことに、多くの研究は、mtDNAが細胞外小胞(EV)に含まれる血漿を含む体液中で検出可能であることを示している(Guescini et al 2010; Meddeb et al 2019; Thurairajah et al 2018)。これらの後者は、mtDNAの安定性を維持し、その全身的なプロ炎症活性を促進する可能性が高い。現在のデータは、mtDNAレベルが増加し、多臓器損傷、敗血症および急性呼吸窮迫症候群に罹患した患者における組織損傷の程度、臨床的進展および多臓器不全の発症と相関することを示している(板垣 et al 2015;Puyo et al 2019;Simmons et al 2013;中平 et al 2013)。
注目すべきことに、循環中のmtDNAの増加したレベルは、あからさまな全身性炎症が存在しない場合でも、高齢者において見出されている(Dalpke, A., et al 2006; Pinti et al 2014)。TLR-9,AIM2およびcGASを活性化する能力に基づいて、循環中のmtDNAは、COVID-19患者、特に高齢者における主要な炎症促進刺激とみなされ得る(Zhang et al 2010; Riley and Tait, 2020; Dalpke et al 2006; Bae et al 2019; Itagaki et al 2015; Nakahira et al 2013)。
この観点に従うと、(mt)DNAの細胞外への積極的な放出は、NET(Neutrophil Extracellular Trap)の形成中に起こり得ることに注目する価値がある。この頭字語は、細胞、特にミエロイドのものが、バイタル状態および死の間の両方で、ミトコンドリアおよび核に含まれるゲノム物質を押し出す能力を指す(この後者はNET-osisと呼ばれている)(Zuo er al)。 NET機構は、好中球において研究されており、COVID-19のものを含む重症患者において発生する生命を脅かす現象である急性肺組織傷害における主要な病原性ステップを構成している(Zuo et al 2020; Barnes et al 2020; Schonrich et al 2016)。血液凝固を促進するNETの能力は、COVID-19関連血栓症における病的現象と考えられてきた(Barnes et al 2020)。現在、NETは、COVID-19合併症を治療するための抗血栓戦略の治療標的を表している(Zuo et al 2020;Barnes et al 2020)(図1)。
図1 SARS-CoV-2感染によって誘導されるmtDNA依存性の炎症亢進
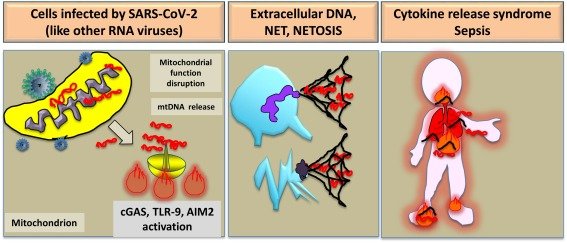
SARS-CoV-2(RNA)ウイルス感染は、ミトコンドリアの機能を阻害し、DNA受容体AIM2, cGAS, TLR-9と結合するmtDNAの放出を介して、強い局所的・全身的な炎症反応を引き起こす。
4. 抗炎症性細胞外telDNAリザーバーの漸進的な減衰の基礎となるテロメア短縮
細胞死に続く、またはNETの結果としての核外へのゲノム(g)DNAの漏出は、炎症性応答の主要なトリガーである(Storci et al 2018)。しかし、gDNAはTLR-9を介して炎症を誘導する能力が限られているが、この活性はテロメア末端の切断後に大きく増加することが実証されているので、すべての実験設定においてgDNAはプロ炎症性ではない(Storci et al 2018; Goldfarb et al 2018)。この知見は、細胞外gDNAのプロ炎症性能力が、そのtelDNA含有量に依存しており、それは順番に、起源の細胞および個人の年齢に応じて変化する可能性があることをピンポイントで示している(Bonafè et al 2020b、; Goldfarb et al 2018)。実際、豊富な文献は、telDNA断片が、TLR-9,cGASおよびAIM2を阻害することが可能であり、抗炎症活性に恵まれていることを示している(Kaminski et al 2013; Goldfarb et al 2018; Storci et al 2019; Gursel et al 2003)。
テロメアは、染色体の開放端を保護する二本鎖DNA配列としてよく認識されている(Palm and De Lange 2008)。さらに、テロメアの短縮は、長い間、細胞老化の特徴として認識されてきた(Aguado et al 2019;HayflickおよびMoorhead 1961)。注目すべきことに、テロメアの長さは、細胞老化の間だけでなく、老化した被験者からの細胞、特に加齢性疾患に罹患した被験者からの細胞においても減少する(Aguado et al 2019;Armanios et al 2013;Herrmann et al 2018;Campisi 2001;HayflickおよびMoorhead 1961)。
テロメアが短縮されると、結果として生じる細胞の老化を伴う複製停止状態が、Senescence Associated Secretory Phenotype, SASPと呼ばれる一連の炎症性メディエーターおよびサイトカインの放出に続いて生じる(Armanios et al 2013; Herrmann et al 2018)。現在では、細胞の老化とSASPは炎症老化の寄与因子と考えられている(Franceschi and Campisi 2014)。重要なことに、テロメア短縮は、細胞がウイルス感染を含む様々なストレス因子にさらされたときにも起こる(Dowd et al 2017)。
注目すべきは、テロメア短縮の現象は、細胞の増殖がない場合にも発生することである(Wang et al 2017)。テロメアの短縮は、特定の酵素的機械によって染色体末端が切り取られる結果として提案されている(Bonafè et al 2020b; Mazzucco et al 2020; Bruno et al 2020)。切除されたテロメアDNAは、核から蹴り出され、細胞質中、血漿EVを含む細胞外液中で発見され得る(Byrd et al 2016; Wang et al 2015)。
染色体末端から切り離されたテロメアDNA断片の生成とその生物学的意義は、テロメア生物学の最先端である。興味深いことに、抗原提示細胞(すなわち樹状細胞)が、相互作用するTリンパ球の寿命を維持するEVを含むtelDNAを放出することが最近報告されている(Bruno et al 2020)。遊離telDNA分子は、cGAS、AIM2,TLR-9などのDNA受容体と係合することにより、その内在性抗炎症機能を発揮する可能性がある(Gursel et al 2008)。注目すべきことに、これはmtDNA認識によって関与する分子の同じセットである(Guescini et al 2010; Simmons et al 2018; Nakahira et al 2013; Pinti et al 2014)。したがって、遊離telDNAフラグメントが、ssRNAウイルス感染中にmtDNA/TLR-9/NF-kappaB軸を有利にスイッチオフすることができることは、驚くべきことではない(Kindler et al 2014)。さらに、遊離telDNA分子は、呼吸器系においてmtDNA/TLR-9/NF-kappaB軸の活性化を減衰させ、ここでは、内気管挿管後のmtDNAの大量放出が記載されている(Itagaki et al 2015)。
上記の推論に従うと、加齢に伴う抗炎症性telDNAリザーバーの漸進的な損失は、循環するtelDNAプールを枯渇させ、COVID-19患者、特に高齢者における全身性高炎症の発症を促進するメカニズムである可能性がある(Froidure et al 2020)。したがって、我々は、若い被験者が、特にテロメアの短縮に関連する併存疾患に悩まされている高齢者において、平均して摩耗してしまうであろう豊富な抗炎症性telDNAリザーバーを備えていると予想する(Armanios et al 2013;Herrmann et al 2018;Zhao et al 2013)。
一方で、このシナリオでは、環境的な理由(例えば、座り仕事やストレスの多いライフスタイル)や遺伝的な理由によりテロメアが短い若年者は、SARS-CoV-2感染症の重篤な転帰を受ける可能性が高くなることも想定している。一方、テロメアが長い人は、SARS-CoV-2感染症に直面したときに有利になる可能性がある(Lapham er al)。 我々は、予想以上に長いテロメアを持ち(Storci et al 2019; Marcon et al 2020)SARS-CoV-2感染に対してより可塑的で適応的な反応を示すことが報告されているセンテナリアンのような超高齢者を参照している(Balk et al 2013)。上記の図は、テロメアの短縮がテロメア繰り返し含有RNA(TERRA)という名のmRNAの転写を誘発することを考慮に入れることによって、さらに複雑になるかもしれない(Balk et al 2013)。TERRA mRNAがテロメア末端に結合すると、DNA:RNAハイブリッド領域を形成する(Balk et a., 2013)。注目すべきことに、DNA:RNAハイブリッドは、その配列にかかわらず、TLR-9および細胞質DNAセンサーを介して、炎症の強力な活性化剤である(Rigby et al 2014; Makan et al 2014)。
これらの知見は、短縮されたテロメアに富む細胞外gDNAが、その内在性の抗炎症性リザーバーを欠いているだけでなく、増加したレベルのプロ炎症性telDNA:RNAハイブリッドを含んでいることを示唆している。このシナリオは、高齢者や、テロメア短縮の遺伝的/環境的原因の影響を受けた個体でより起こりやすくなっている(図2)。注目すべきことに、TERRAとそのcogniate telDNA配列を含むEVは、かなりの量のDNA:RNAハイブリッドを運ぶ可能性が高く、強力なプロ炎症活性を発揮することが実証されている。
図2. 抗炎症性細胞外telDNAリザーバーの漸進的な減衰の基礎となるテロメア短縮。
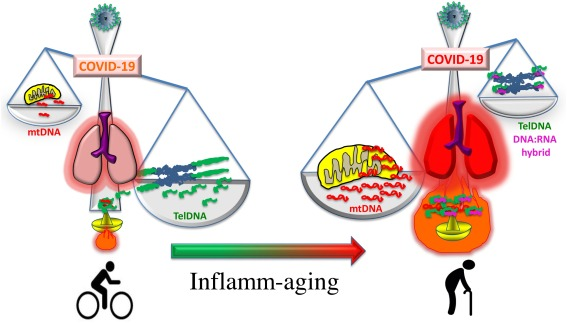
若い人では、テロメアの抗炎症性telDNAリザーバーがmtDNAの抗炎症活性を弱めているが、高齢者では、テロメアの萎縮により、細胞外telDNAの量が減少し、部分的に抗炎症性DNA:RNAハイブリッドによって補充される。この年齢に依存したアンバランスは、高齢者における高炎症の発症に有利である。
5. COVID-19病因における細胞外DNAミトコンドリア/テロメア含量のジェンダーバイアス
ここに提案された解釈モデルは、COVID-19の致死率における上記の報告されたジェンダーバイアスを解釈する機会を提供する。実際、高齢の男性、特に加齢に伴う疾患に罹患した男性は、高齢にマッチした女性と比較して、短縮されたテロメアに恵まれている(Axson et al 2018)。さらに、メカニズムはまだ解明されていないが、男性のテロメア短縮率は女性よりも急であり、特に50歳以上、すなわちSARS-CoV-2感染が人口死亡率に影響を与え始める年齢である(Marcon et al 2020)(https://www.epicentro.iss.it/coronavirus/sars-cov-2-decessi-italia)。さらに、極端に高齢の女性は、男性の年齢にマッチした被験者と比較して、予想以上に長いテロメアを有している(Lapham et al 2015)。このような再現性のあるジェンダーバイアスの基礎となる分子メカニズムはまだ明らかにされていない(Ly et al 2019; Di Florio et al 2020)。
mtDNAに関しては、男性がRNAウイルス感染時に女性よりも多くのmtDNAを放出することを示唆するヒントがある(Klein and Flanagan 2016)。したがって、男性のmtDNAがDNAセンサーと係合する機会が多いほど、いくつかの炎症現象における性別の偏りを説明できるかもしれない(Anker and Arima, 2011)。ウイルス感染への応答における性差は、長い間報告されており、すべての年齢および進化において保持されている(Gebhard et al 2020; Griesbeck et al 2015)。
特筆すべきは、女性は、ウイルスおよびワクチン接種に対してより高い抗体応答を行うことが長い間報告されてきたことである(Ankerおよび有馬 2011)。さらに、特異的免疫の発現(抗体産生)および特異的抗ウイルス応答を誘導する能力は、男性よりも女性の方が顕著である(Anker and Arima, 2011)(図3)。この性別の偏りは、形質細胞様樹状細胞のIFN-1産生能力が女性の方が高いことに起因しており、この性別の偏りは、自己免疫疾患の発症の主要な病原性メカニズムと考えられてきた(Smits et al 2010)。
特筆すべきは、この性差は高齢者ではより広いことである(Smits et al 2010)。逆に男性の方が女性よりも特異的な免疫のセットオフよりも自然な炎症反応が促進されている。この点に関して、ミエロイドのプロ炎症性コンパートメントの活性化に起因する炎症老化は、男性被験者において強い優勢を特徴とすることが最近報告されている(Márquez er al)。
少なくとも、ウイルス感染の初期段階では、炎症とIFN-1抗ウイルス応答は相乗的である:IFN-1抗ウイルス応答は、ウイルス剤の拡散を防止する局所的なメカニズムを促進することを目的とし、一方、炎症応答は、炎症性細胞の局所的なリクルートを促進し、全身的な応答を促進する。したがって、炎症よりもIFN-1応答の優勢は、炎症の関与なしにウイルスのクリアランスが起こる可能性が高い女性に起こりやすい。したがって、好中球浸潤、NETs産生、全身性炎症反応などの炎症現象は、男性よりも女性の方が起こりにくい。つまり、女性の方がIFN-1経路の活性化を介して炎症を抑制する能力が高いため、SARS-CoV-2感染症の転帰はより良好であると考えられる(Anker and Arima, 2011)。
実際、IFN-1抗ウイルス応答と炎症との間の相互抑制効果が広範囲に報告されている(Banerjee et al 2017;Menachery et al 2014;Chan et al 2013;Lau et al 2013;Zielecki et al 2013;Aman et al 1996;Ganster et al 2005;Pauli et al 2008;Wei et al 2006;Nagata et al 2008;Hadjadj et al 2020)。特筆すべきことに、IFN-1媒介抗ウイルス性自然免疫と炎症との間のアンバランスは、SARS-CoV-1感染マカクにおいて報告された:IFN-1抗ウイルス応答は、大規模なプロ炎症応答を発現する高齢動物において妨げられ、感染の好ましくない経過を逆転させるIFN-1の投与によって減衰された(Banerjee et al 2017)。さらに、IFN-I応答の遺伝的に決定されたまたは免疫介在性の抑制が、COVID-19の不良転帰のリスクであることが明らかにされている(Bastard et al 2020;Thoms et al 2020)。
この観点から、IFN-1媒介抗ウイルス応答を阻害するSARS-CoV-2タンパク質(すなわちNsp1)の能力は、IFN-Iの障害が重度のCOVID-19転帰を有利にする条件であることを示唆している(Burtscher et al 2020;Bayik et al 2016)。実際、いくつかのデータは、SARS-CoV-2コード化されたタンパク質が、ミトコンドリアの機能およびミトコンドリアによって媒介される自然免疫応答に影響を与えることが可能であることを示している(Burtscher et al 2020)。
さらに、ミトコンドリアの完全性は、COVID-19の結果に影響を与える極めて重要な因子である(Burtscher et al 2020)。全体的に、上記で説明した性差は、女性がIFN-1媒介経路によってウイルス感染を排除する能力が高く、炎症を制御下に保つことができるというシナリオを描くことを可能にする。考えられるのは、炎症による老化の存在下では、SARS-CoV-2の反応は、制御不能な局所的・全身的炎症へと移行しやすく、それが有害で致死的になる可能性があるということである(図4)。
図3 COVID-19病因における細胞外mtDNA/telDNA含有量の性差
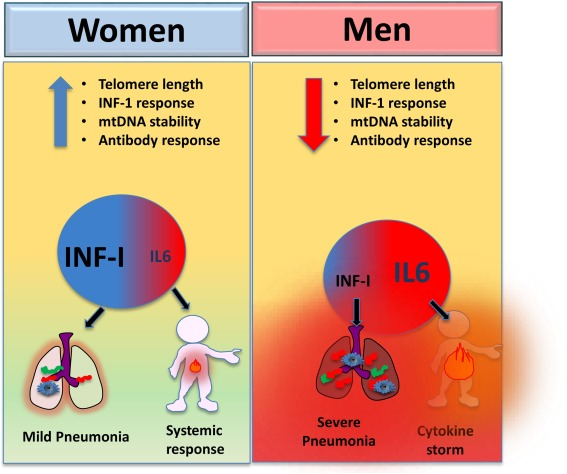
女性は男性に比べて、IFN-1応答の増強、抗体応答の増加、mtDNAの不安定性の減少、およびテロメア長の増加に恵まれている。
図4. 抗炎症性細胞外telDNAリザーバーは加齢に伴って減衰する
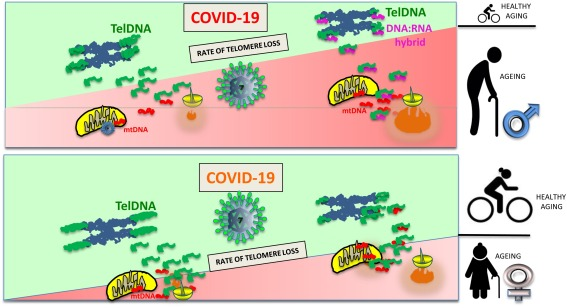
抗炎症性細胞外telDNAの年齢依存的な減少は、高齢の女性に比べて高齢の男性の方が急である。このアンバランスは、我々の仮説によれば、COVID-19に関連する合併症への対処において、高齢の男性よりも高齢の女性の方が有利な状態を作り出している。
6. 結論
高齢者では、細胞外炎症性プロ炎症性mtDNAの蓄積と抗炎症性細胞外telDNAの減少によって引き起こされる高炎症状態へのアンバランスが、COVID-19の不良な転帰に重要な役割を果たしているという仮説が立てられている。この理論的根拠に基づいて、SARS-CoV-2によって誘発された炎症を緩和する可能性のある外因性telDNAリピートを試験管内試験および動物モデルで試験することは価値があると思われる。
telDNAは-TTAGGG-リピートからなるので、それは抗炎症活性を発揮するポリグアノシンリッチ(Gリッチ)DNAオリゴヌクレオチドの大家族に属する(Ohto et al 2015; Römmler et al 2015; Lenert 2010)。したがって、この「潜在的な」DNA薬物は、COVID-19の合併症の治療のために考慮に入れる価値があるかもしれない。
結論として、上記のシナリオは、細胞外DNA(mtDNAやtelDNAなど)の研究が、炎症による老化とCOVID-19の発症との関連性を理解するのにどのように役立つかを示している。うまくいけば、このアプローチは 2020年に世界的に広がっている前例のないパンデミックとの現在進行中の闘いに役立つだろう。