Contents
The progress of gut microbiome research related to brain disorders
www.ncbi.nlm.nih.gov/pmc/articles/PMC6969442/
要旨
腸内細菌叢のダイナミックな変化が脳の生理や行動を変化させることを示す証拠が増えてきている。認知はもともと中枢神経系のみによって制御されていると考えられてた。しかし、現在では、消化管の腸内細菌を含む多くの非神経系要因が、認知機能障害だけでなく、神経変性や脳血管疾患のプロセスを調節し、影響を与えていることが明らかになりつつある。
食生活を含む外因性因子と内因性因子は、微生物叢の構成を調節することができる。微生物は代謝物や微生物叢由来の分子を放出し、宿主由来のサイトカインや中枢神経系の炎症をさらに誘発し、痛み、うつ病、不安、自閉症、アルツハイマー病、パーキンソン病、脳卒中などの宿主脳疾患の発症に大きく寄与している。
血液脳関門透過性の変化、脳血管生理、脳構造の変化は、下流の神経機能障害を引き起こす最も重要な原因の一つである。本総説では、以下の部分について考察する。
- 腸内マイクロバイオーム研究に用いられる技術的アプローチの概要
- 微生物相と免疫
- 腸内細菌叢と代謝物
- 微生物学的に誘発される血液脳関門機能障害
- 精神神経疾患
- ストレスとうつ病
- 痛みと偏頭痛
- 自閉症スペクトラム障害
- 神経変性疾患
- パーキンソン病
- アルツハイマー病
- 筋萎縮性側索硬化症
- 多発性硬化症
- 脳血管疾患
- 動脈硬化症
- ストローク
- 動静脈奇形
- 結論と展望
キーワード
腸内マイクロバイオーム、代謝物、精神神経疾患、神経変性疾患、脳血管疾患
序論
ロベル・コッホが実験室で初めて細菌培養法を開発して以来[1]、テオドール・エシェリヒが一般的な腸内細菌Escherichia coliを同定して以来[2]、エリー・メチニコフが長寿と乳製品由来の微生物との関連を発見して以来[3]、食品の消化、発酵、代謝、ビタミン産生などを通じて、人間の健康や行動に多大な影響を及ぼしているとされる常在菌や病原菌が発見され、特徴づけられるようになっていた。
過去5年間で腸内細菌叢研究は研究の “ホットスポット “となっており、これまでに25,000本以上の腸内細菌叢関連論文が発表されている(2019年9月1日現在)。次世代シーケンシング(NGS)アプローチを用いて、Human Microbiome Project(HMP)やMetagenomics of the Human Intestinal Tract(MetaHIT)プロジェクトなどの大規模研究により、ヒトの体内のマイクロバイオータ組成に関する必須の文献が提供されている[4, 5]。腸内のバイオマーカーは、代謝障害 [6, 7]、炎症性腸疾患(IBD) [8, 9]、様々な癌 [10]、さらには中枢神経系の障害など、様々な疾患に関連している。
研究者たちは、痛み、認知機能障害、自閉症[11,12]、神経変性疾患、脳血管疾患[13]など、いくつかの症状や疾患に関連する腸内細菌叢の構成の変化を特定してきた。異なる生息環境の微生物相は、体液性、神経性、免疫学的な病原性経路を介した双方向の脳-腸シグナル伝達に寄与している[14]。
中枢神経系(中枢神経系)は、神経-グリア-上皮軸と内臓神経を介した粘膜免疫だけでなく、腸の運動性と分泌を調節することで、腸の微小環境を変化させる [15-19]。腸内細菌叢の構成は、遺伝的背景、代謝物、免疫、ホルモンなどの内在的要因だけでなく、食習慣、生活習慣、感染症、初期の微生物叢曝露などの外因的要因によっても調節されている。
一方、細菌は、腸内で神経伝達物質または神経調節物質を産生して宿主の中枢神経系に影響を与えることにより、これらの変化に反応する。これらの調節物質には、細菌由来のコリン、トリプトファン、短鎖脂肪酸(SCFA)およびグレリンまたはレプチンなどの腸内放出ホルモンが含まれる(図11)。
図1 脳障害における腸内細菌叢の異常
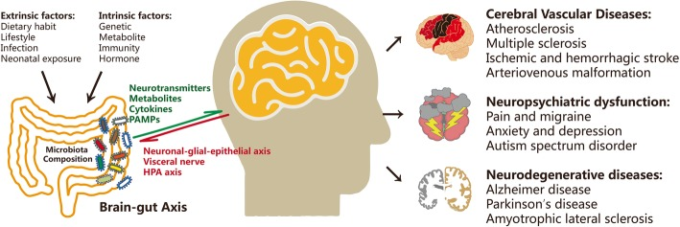
外因性因子と内因性因子が腸内細菌叢の構成を形成し、認知機能障害、神経変性、脳血管障害などの脳障害にさらに寄与する
ここでは、腸-脳軸研究の進歩を振り返り、腸内微生物叢の変化が認知機能、脳血管生理、神経疾患や精神疾患の発症にどのように変化するかを説明する。
腸内マイクロバイオーム研究の技術的アプローチ
現在の技術では、腸から分離されたすべての細菌を培養することはできない。マイクロバイオームを効果的に定量化し、特徴づけるために、広く採用されている2つの無培養アプローチが考案されてきた。標的配列決定は、16SリボソームRNA(rRNA)内部転写スペーサー(ITS)および18S rRNA配列決定を含むマーカー遺伝子配列決定とも呼ばれている[20]。1977年、Woeseらは、rRNAスモールサブユニット(SSU)遺伝子を用いて原核生物間の系統関係を推定した。WilsonとBlitchingtonは、定量培養細胞とヒト糞便検体からの直接PCR増幅バクテリアとの間で、多様性と16S rRNA配列がよく一致していることを示した[23]。
研究者は現在、この強力なツールを使用して16S rRNAの配列を決定し、様々なヒト検体から微生物の分類と多様性を評価することができる。
しかし、16S rRNAの配列決定は、属レベルでは80%程度の精度しか達成できず、種レベルや株レベルでの分類学的プロファイルを完全に解決することはできない。そこで、微生物相からのDNAの包括的なプロファイリングのためにショットガンシーケンシングが開発された。1998年、Handelsmanらは、土壌由来のバイオサンプルからのDNA断片を細菌の人工染色体ベクターにクローニングした際に、「メタゲノム」という言葉を初めて造語した[26]。2002,ショットガンシークエンシング法を用いて、Breitbartらは、rDNAを持たないウイルスのメタゲノムをシークエンシングし、同定した種の65%以上がこれまでに報告されていないものであったことを明らかにした[27]。同年、Gillespieらは制限酵素法を用いて土壌微生物DNAのメタゲノムライブラリーから抗生物質Turbomycin AとBを分離した[28]。2004,Tysonらは、ランダムショットガンシークエンシングを用いてバイオフィルムをシークエンシングし、菌株レベルでの一塩基多型を決定した。現在では、メタゲノムは環境からのDNAの集合体であることが理解されており、ショットガンシークエンシングはメタゲノムシークエンシングに広く採用されている[29]。
メタトランスクリプトミクス [30, 31]、メタプロテオミクス [32]、メタボロミクス [33, 34] などの他の技術も、メタゲノムワイドアソシエーション研究(MWAS)におけるRNA、タンパク質、代謝物の調査に適用することができる。MWASアプローチは、マイクロバイオーム分類の同定だけでなく、機能、経路、代謝のアノテーションにも大きな可能性を示している。
腸内マイクロバイオームと宿主免疫
ヒトの腸内細菌叢は、宿主の腸内免疫系と相互に作用し、宿主の抗原を許容することで相互適応と免疫恒常性を維持している[35]。腸内細菌叢の乱れは、自己免疫やアレルギーの発症率の増加につながる可能性がある[36]。ヒト消化管における自然免疫と適応免疫は、病原体と宿主の恒常性を維持する守護者として重要な役割を果たしている。自然免疫に関しては、病原体関連分子パターン(PAMP)は、宿主自然免疫系からのパターン認識受容体(PRR)によって認識される病原体標的を記述するために最初に提案された[37, 38]。PAMPは、リポ多糖類(LPS)リポ酸(LTA)CpG、またはdsRNAからなる高度に保存された微生物構造など、病原体クラスの「分子シグネチャー」を表すものである。腸内微生物およびその誘導体は、腸管上皮細胞、末梢血の免疫細胞、さらには中枢神経系の細胞のPRRと絶えず相互作用している。腸内微生物叢の異常は、タイトジャンクション、粘液層の変化、免疫グロブリンAおよび上皮内リンパ球の分泌などの腸管バリア機能の異常を誘発することが報告されている[39,40]。げっ歯類モデルでは、海馬の神経新生は、トール様受容体(TLR)の刺激によって制御されていることが証明されている。TLR2は神経新生に関与しているが、TLR4は逆の機能を示す [41, 42]。LPSの結合により、TLR4はMyD88依存性およびNF-κBシグナル伝達経路を介して網膜の神経新生および分化を阻害する[43]。また、TLR2の活性化は、胚性神経前駆細胞の増殖を阻害する[44]。下流の炎症性サイトカインTNF-αは、神経新生をさらに抑制し、アストロサイトの増殖を誘導する [45]。また、TLR4が学習および記憶の発達に関連しているという証拠もある[46,47]。
一方で、適応免疫は日常的に、抗感染機能と、無害な抗原に対する過剰反応を防ぐための微生物-宿主恒常性の維持の両方において重要な役割を果たしている。このバランスは、主に調節性T細胞とTH17腸ラミナプロプラとの間の相互調節によって達成される[48]。調節性T細胞(Tregs)は、免疫恒常性の維持に極めて重要である。保護免疫抑制シグナルは、調節性T細胞におけるGATA3,Foxp3,およびIL-33の発現を介して送達される。食物繊維からのSCFAは、特にClostridia種によって産生され、CD4+Foxp3+ Treg細胞の活性化および拡大に寄与する[49, 50]。樹状細胞によってエンドサイト化された多糖は、ナイーブT細胞のTh1および調節性T細胞サブセットへの拡張および分化を促進する可能性がある[51]。IL-17A、IL-17F、およびIL-22の分泌を特徴とする腸内細菌活性化TH17細胞は、高親和性IgAの分泌、メモリーCD4+ T細胞の分化、および抗黄色ブドウ球菌機能を担っている[52-55]。しかし、腸内細菌の生理不順はT細胞やB細胞を活性化させ、B細胞のIgAの分泌やクラス切り替え、TH17細胞の分化、樹状細胞、第3群自然リンパ球細胞(ILC3)顆粒球のさらなるリクルートに影響を与える[48]。TH17細胞がIL-23の過剰発現などの炎症性シグナルによって誘導されると、これらの細胞はぶどう膜炎や脳脊髄炎などの自己免疫疾患と関連している可能性が高い[56-59]。視床下部-下垂体-副腎軸(HPA)における脳の病変は、腸管免疫を変化させる可能性がある。マウスの脳卒中モデルでは、脳卒中の24時間後にパイエルパッチのT細胞とB細胞の有意な減少が観察されている[60]。さらに、脳卒中後の血液脳関門(BBB)の障害は、微生物相の変化と免疫異常によって引き起こされ、さらに中枢神経系組織に反応する免疫細胞の脳内浸潤を可能にしている[61]。
微生物相が変化した血液脳関門と脳の構造
BBBは微小血管系の特殊な内皮細胞で構成される半透膜性のバリアである [62]。BBBは中枢神経系と末梢血を隔てている[63]。微生物によって誘発されるBBB機能障害に関連した様々な障害があり、不安、うつ病、自閉症スペクトラム障害(自閉症スペクトラム障害)パーキンソン病、アルツハイマー病、さらには統合失調症を引き起こす可能性がある [61, 64-66]。微生物相がBBB生理に影響を与える正確なメカニズムは不明のままである。考えられるメカニズムには、腸由来の神経伝達物質および細菌の代謝物によるBBBの調節が含まれる。げっ歯類モデルは、病原体のない腸内細菌叢がBBB機能を回復させる一方で、正常な腸内細菌叢の喪失はBBBの透過性の増加につながることを示している[67]。糖尿病などの代謝性疾患は、BBBの透過性の増加をもたらし、潜在的には、アミロイドβペプチド沈着を伴うアルツハイマー病へのさらなる進行をもたらす可能性がある[64]。微生物相の異常は、タイトジャンクション発現[68]またはさらなる行動変化[69]を介した透過性の調節[67]を含むBBBの保護機能を変化させることが判明している。
微生物相の組成はまた、脳の形態と相関している。細菌を含まないマウスモデルでは、海馬および微小グリアの形態の正常な発達に微生物叢が必要であることが実証されている[70]。構造磁気共鳴画像法(MRI)により、患者の皮質の厚さがクローン病の持続期間と負の相関があることが明らかになった[71]。思春期の患者では、後領域と中前頭回が減少していることも明らかにされている[72]。アクチノバクテリアの相対的な豊富さは、MRIによると扁桃体、視床下部、視床下部の微細構造のより良い組織と相関している。構造の変化は、運動速度、注意力、認知テストのスコアの改善と関連している[73]。
食品および食品由来の代謝物
ヒトの体内で2番目に大きい代謝器官である腸は、約1.5kgのコロニー化した微生物叢と食物からの代謝量を保有している[74]。食事パターンは腸内微生物叢の構成に不可欠な役割を果たし、うつ病や不安症などの精神疾患に影響を与える[75,76]。
果物、全粒穀物、野菜、魚を豊富に含む食事は、腸内炎症や神経変性を減少させて認知症のリスクを低下させるなど、脳機能に有益であることが証明されている[77]。これまでに、いくつかのよく知られた「地中海的」な食事パターンが神経保護効果を示している。すなわち、地中海ダイエット(MeDi)高血圧を止めるための食事療法(DASH)および神経変性遅延のための地中海-DASH介入(MIND)ダイエット[77, 78]。アルツハイマー病や動脈硬化の患者は、これらの「地中海的」な食事から恩恵を受ける[79]。
一方、飽和脂肪酸、動物性タンパク質、糖質を多く含む食事は、脳機能障害のリスクを高めることが示されている。高脂肪食(高脂肪食)すなわち “西洋 “ダイエットは、通常、脳に有害であると考えられている[80]。高脂肪食の過剰な摂取は、FirmicutesとProteobacteriaの増加とBacteroidetesの減少に関連付けられている[81]。
高脂肪食はまた、アセテートの血漿と糞便レベルを誘導し、インスリンとグレリンの過剰生産を誘発し、さらに過食を促進する[82]。高脂肪食によって引き起こされる肥満誘発効果と炎症は、A. muciniphilaの増加を伴う果物からのポリフェノールの取り込みによって減少させることができる。
食品は、腸内のマイクロバイオータ組成を迅速に変化させることができる。低脂肪または植物繊維が豊富な食事パターンから高脂肪または高糖質の食事パターンに変更すると、1日以内であってもマイクロバイオームがシフトする可能性がある[83]。犬の実験では、炭水化物とタンパク質の割合が変化の原因であることが明らかになった[84]。バクテロイデスの豊富さは動物由来のタンパク質と飽和脂肪に関連していることが報告され、プレボテラは炭水化物と単純な糖質に関連していることが報告された[85]。
野菜ベースの食事はSCFAsを増加させ、Prevotellaといくつかの繊維分解性Firmicutesの上昇を伴うことがある[86]。フルクトースを与えた場合、マウスモデルではバクテロイデテスが有意に減少し、一方でプロテオバクテリア、Firmicutes、および病原性ヘリコバクターが有意に増加した[87]。
食べ物のパターンや食生活は、結果として脳の生理の変化をもたらし、これは食べ物由来の代謝物によって説明できる(図2)。食品由来の代謝物は、脳関連疾患の発症に重要な役割を果たしている。最近の知見では、食品由来の代謝物にはSCFAだけでなく、ホスファチジルコリン、トリメチルアミンオキサイド(TMAO)L-カルニチン、グルタミン酸、胆汁酸、脂質、ビタミンなどが含まれていることが明らかになっていた。これらの食品誘導体や微生物が発酵した低分子代謝物は、腸内微生物が宿主と相互作用して血液中に放出され、脳疾患をはじめとする様々な障害にさらに寄与している。
図2 食事代謝と腸内細菌叢の役割
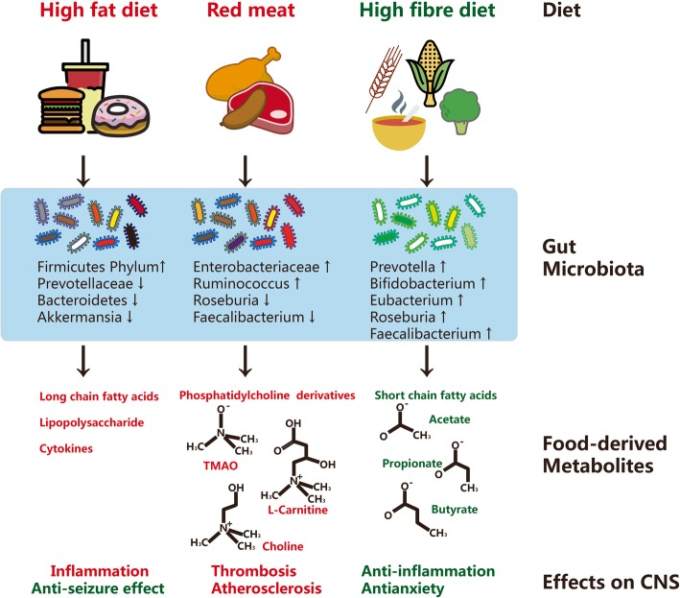
食習慣や食事パターンは腸内細菌叢の形成に影響を与え、その結果、宿主の炎症や血栓症を調節し、脳障害を誘発する。
家禽、卵、特に赤肉に豊富に含まれるホスファチジルコリンの代謝には、腸内微生物と宿主の間の重要な生物学的相互作用が関与していることが報告されている[88]。この経路には、赤身肉由来のL-カルニチンの代謝中に生成されるトリメチルアミン(TMA)の酸化産物であるTMAOが含まれる[89]。
TMAO、ベタイン、およびコリンのレベルは、心血管疾患の診断および予後の予測因子として機能することが示されている[90-92]。これらの腸内細菌由来の代謝物は、マクロファージにおけるコレステロールの蓄積を介して発泡細胞の形成を誘導し、促進する。最近の研究では、Clostridiales、Lachnospiraceae、Ruminococcusが動脈硬化性病変の面積や血漿中のTMAOレベルと高い相関性を持つことが明らかになっている。
興味深いことに、コリンのアナログである3,3-ジメチル-1-ブタノール(DMB)は、微生物におけるTMAOの形成を阻害することが示されている[93]。腸内細菌科およびルミノコッカス属の増加した豊富さは、コントロールと比較して動脈硬化性心血管系疾患患者で見られるが、RoseburiaおよびFaecalibacteriumを含む酪酸産生細菌は、これらの患者では比較的枯渇している[94]。
高脂肪、適切なタンパク質、低炭水化物組成の高度にケトジェニックな食事は、抗痙攣効果を発揮することが示されている[95]。この高脂肪、低炭水化物のパターンは、AkkermansiaとParabacteroidesに関連しており、血清γ-グルタミン酸レベルを低下させ、脳のGABA/グルタミン酸レベルを上昇させることで、より高い発作閾値をもたらすことが示されている[95]。一方、高脂肪・高コレステロール食(HFHC)は脂質異常症を誘発し、小腸粘膜免疫系を誘発し、炎症をさらに促進し、腸内細菌叢を変化させる[96]。Firmicutes属は炭水化物酸化と正の相関があるが、Bacteroidetes属は負の相関を示する。Rhizoma Coptidisのアルカロイドなどのハーブ栄養補助食品は、腸内細菌叢と胆汁酸経路を調節することにより、マウスモデルの高脂血症を緩和することが示されている[97]。
高繊維質の食事は、複数のエフェクターを介して脳の健康を改善することが報告されている[98]。哺乳類の腸内では、食物繊維は細菌によって分解され、代謝物として長鎖脂肪酸(LCFAs)およびSCFAsを産生する[99]。ラウリン酸を含むLCFAsは、TH17細胞の分化を促進する。LCFAsは自己免疫性脳脊髄炎モデルの成立のトリガー因子として知られている[100]。対照的に、SCFAsは通常、上皮細胞のエネルギー源として機能するだけでなく、調節性T細胞をリクルートして拡張し、調節性サイトカインを放出することが知られている[101]。SCFAは主にアセテート(40〜60%)プロピオン酸(20〜25%)および酪酸塩(15〜20%)から構成されている[102,103]。アセテートおよびプロピオン酸は特にバクテロイデテス属によって産生され、一方、ファーミキュテス属の種は優先的に多量の酪酸を産生する [104]。SCFAs、特にアセテートの全身的な損失は、細菌のいないマウスで炎症反応を悪化させる可能性が高いのに対し、アセテートの直接飲用は、炎症性メディエーターであるミエロペルオキシダーゼのレベルを低下させることによって疾患を改善するのに有用である[105]。プロピオン酸は、Treg細胞の誘導を介して他のSCFAsよりも優れた自己免疫性大腸炎からマウスモデルを保護する[50,100]。酪酸産生を誘導する高繊維食は、脳をよく保護し、神経発生モデルにおけるニューロンの可塑性を高めることができる[98]。それは、SCFAがアセチル化およびメチル化状態を操作し、さらに宿主の遺伝子発現と代謝プロセスを制御することができることに注目する価値がある[106]。例えば、SCFAsの低い豊富さは、クロマチンのアセチル化の低い程度に関連付けられて示されている[107]。
食事中のトリプトファンは、アストロサイトとミクログリアの両方の病原性活動と実験的自己免疫性脳脊髄炎(EAE)の発症を減少させることにより、中枢神経系の炎症を制限するアリール炭化水素受容体(AHR)アゴニストの必須の供給源である [108, 109]。トリプトファンは通常、腸内微生物からの細菌性トリプトファナーゼ(TnAse)によって代謝され、インドール、インドール-3-プロピオン酸(IPA)およびインドール-3-アルデヒド(IAld)を生成する。インドールはAhRアゴニストであるインドキシル-3-硫酸(I3S)の前駆体である[110]。最近、食事性トリプトファンがマウスを多発性硬化症から保護することが報告された[108]。しかし、ラットモデルで高レベルのインドールを摂取すると、不安や気分障害などの脳機能障害を発症する可能性が高まることも示されている[111]。
Szczesniakらは、Faecalibacterium、Alistipes、Ruminococcusなどの細菌が、揮発性脂肪酸(VFA)の一種であるイソ吉草酸のレベルと同様に、うつ病と相関していることを発見した[112]。腸由来のVFAはBBBを通過し、さらにシナプス神経伝達物質と相互作用することができるため、これらの関連付けはおそらく発生する。興味深いことに、Wuらは、菜食主義者の血漿メタボロームは雑食主義者の血漿メタボロームとは有意に異なるが、これらのグループの微生物組成は類似していることを明らかにした[113]。
食事性チロシン代謝物の1つである4-エチルフェニル硫酸(4-EPS)は、自閉症スペクトラム障害(自閉症スペクトラム障害)様行動を誘発することができる。しかし、Bacteroides fragilisを注射すると、腸内微生物は4-EPS、血清グリコール酸、イミダゾールプロピオン酸などの神経毒性代謝物のレベルを低下させ、腸の透過性を是正し、不安に似た行動を改善する[114]。
精神神経機能障害
気分、記憶、認知はもともと、ホルモン変動などのさまざまな外因性因子のために、中枢神経系によって排他的に制御されていると考えられていた[115]。現在では、免疫系や消化管の常在菌を含む多くの非神経系要因が、私たちの感情や記憶の形成、処理、保存方法だけでなく、認知機能に関連する微細構造や形態も制御していることが明らかになってきている。レジリエンス、楽観主義、マインドフルネス、自己調節とマスタリーを調節する微生物群を分析するために、消化管心理学的研究が行われてきた[116]。腸内微生物叢の変化は、代謝物の合成だけでなく、メラトニン、γ-アミノ酪酸(GABA)セロトニン、ヒスタミン、アセチルコリンなどの異なる神経活性分子や中枢神経伝達物質も調節する[117]。無菌・抗生物質を用いたげっ歯類モデルでは、微生物曝露がうつ病、不安やストレス、社会的コミュニケーションの低下、探索活動の増加、記憶力の低下を誘発することが示されている(表(表11))。
表1 気分障害の齧歯類モデルと認知機能研究
| 動物 | モデルタイプ | 表現型と効果(対対照) |
|---|---|---|
| NMRIマウス | 無菌 | 運動活動の増加と不安の軽減[ 61 ] |
| ウィスターラット |
プロバイオティクスの応用: Lactobacillus helveticusR0052およびBifidobacteriumlongum R0175 |
ストレス誘発性の胃腸の不快感と抗不安作用の減少[ 118 ] |
| Balb / cマウス |
プロバイオティクスの応用: ラクトバチルスラムノサス(JB-1) |
コルチコステロン、GABA受容体、N-アセチルアスパラギン酸およびグルタメートの増加; 減少ストレス誘発性コルチコステロンおよび不安およびうつ病関連行動[ 119、120 ] |
| Balb / cマウス | 無菌、SPFおよびB.infantisマウス | GFマウスはSPFマウスと比較して誇張されたHPAストレス反応とBDNFの減少を示しましたが、B.infantisで逆転させることができます[ 121 ]。 |
| スイスのウェブスターマウス | 無菌 | GFマウスは、海馬の歯状回において、抗不安作用、BDNFの増加、およびセロトニン1A受容体の減少を示します[ 122 ]。 |
| Balb / cマウスとAKHマウス | T.ムリス感染とプロバイオティクスの応用B.ロンガムNCC3001 | T. murisの感染は、不安様行動を誘発し、BNDFのレベルを低下させました。B. longumによる治療は効果を逆転させ、BDNFレベルを正常化します[ 123 ]。 |
| Balb / cマウスとNIHマウス | 無菌で抗生物質を含むSPF | 海馬におけるBDNFの探索行動と海馬発現の増加[ 124 ] |
| ストレスに敏感なF344ラット | 無菌およびSPF | GFマウスにおける社会的相互作用の減少[ 125 ] |
| スイスのウェブスターマウス | 無菌 | GFマウスにおける重大な社会的障害および社会的嗜好の低下[ 126 ] |
| ウィスターラット | 抗生物質の適用 | 抗生物質が概念的に適用された場合の子孫の社会的相互作用の減少[ 127 ] |
| スイスのウェブスターマウス | 無菌 | GFマウスにおける探索的増加[ 122 ] |
| スイスのウェブスターマウス | 抗生物質の適用 | 抗生物質治療マウスにおける探索行動の増加[ 126 ] |
| C57BL / 6マウス | 抗生物質の適用 | 抗生物質で治療したSPFマウスの作業記憶の低下; 空間記憶への影響なし[ 128 ] |
| スイスのウェブスターマウス | 無菌 | GFマウスの作業記憶の減少[ 129 ] |
| C57BL / 6マウス | SPF | 抗生物質で治療されたSPFマウスの作業記憶の減少[ 130 ] |
| C57BL / 6マウスとCF1マウス | シトロバクター・ロデンティダム感染症 | 増加不安及び記憶障害[ 129、131 ] |
生後間もない時期は、宿主の神経系の発達において重要な時期である。微生物相は生後すぐに数週間以内に宿主をコロニー化し、器官特異的なニッチを形成する[132, 133]。初期の同種微生物群集は、その後2~3年の間に徐々に成体で同様の群集を形成する[134]。しかし、この段階では炎症の影響を受けることがある。神経新生の重要なモジュレーターとして、ミクログリアは、LPSによって活性化されると、神経発達において炎症性および有害な役割を果たす可能性がある。このような影響は、成人期以降の異常な宿主行動および学習障害につながる[135]。微生物相は宿主の神経学的機能(すなわち、認知機能および記憶の発達)の発達を促進することができる。マウスモデルでは、西洋式の食事への長期暴露は、肥満を引き起こすだけでなく、LPSへの全身性の炎症反応を誘発し、さらにそのような貧しい空間記憶などの認知障害を誘発することが示されている[136]。Magnussonらは、高エネルギー食品が微生物相の組成を変化させ、ワーキングメモリと認知柔軟性に影響を与え、その結果、長期記憶の形成が低下することを示した[137]。そのようなCなどの細菌による感染rodentiumは、げっ歯類モデル[129]でストレス誘発性のメモリ機能不全を生成する可能性がある別のトリガーである。
ストレスとうつ病
腸内細菌叢は、うつ病および不安様行動の病態形成において重要な役割を果たすことが示されている[138, 139]。ストレスに反応する異常なHPAの多動性は、うつ病エピソードと関連している。Sudoらは、生殖細胞を持たないマウスではHPAストレス応答が亢進するが、この亢進はビフィズス菌(Bifidobacterium infantis)によって逆転させることができることを発見した[121]。血漿ACTHおよびコルチコステロンレベルは、ストレスに応答するとき、GFマウスではSPFマウスよりも高いことが観察されている。
しかしながら、Diazらは、GFマウスがSPFマウスと比較してトリプトファンおよびセロトニンの血漿レベルの増加を示すことを明らかにした[61]が、これは運動活性の増加および不安の減少と相関している。Neufeldらの結果はまた、GFマウスが脳由来神経栄養因子(BDNF)の発現増加と海馬のセロトニン1A受容体レベルの低下を介して抗不安行動を示すことも示している[122]。不安および抑うつは、過敏性腸症候群(IBS)患者における典型的な合併症であり、これらの状態の有病率は健常対照者よりも高いことが示されている[140]。
不安と抑うつに加えて、IBD患者は軽度の言語記憶機能障害を示す。VFAのイソ吉草酸は、うつ病の重要なメディエーターと考えられている[112]。腸由来のイソ吉草酸はBBBを越えてシナプス神経伝達物質の放出を妨害する。イソ吉草酸は唾液コルチゾールと正の相関があり、これは男の子のうつ病と強く関連している[141]。
Bravoらは、異なる脳領域におけるGABA受容体の発現が、乳酸菌ラムノサスによる慢性的な治療によって変化することを示している。この治療は、ストレス誘発性コルチコステロンレベルおよびうつ病様行動をさらに減少させる[119]。海馬神経新生のストレス誘発性低下は、ラクトバチルス・ヘルベティカス株R0052とビフィドバクテリウム・ロンガム株R0175のプロバイオティクスの組み合わせによっても防ぐことができる[142]。
De Theijeらは、プロバイオティクスの効果が非常に株特異的であることを示した。カンピロバクター・ジェジュニの投与は抑うつ的またはストレス様行動を促進するが、ビフィズス菌株はこれらの行動に対して減少する効果を示す[143]。
自閉症スペクトラム障害
自閉症スペクトラム障害は、幼児期の神経発達から始まるコミュニケーションや社会的行動の異常が特徴である。腸の問題または感染症などの消化管摂食障害の既往歴、および幼児期の抗生物質または抗生物質の摂取が疾患の発症に寄与している[144-146]。自閉症スペクトラム障害患者における胃腸不快感は、通常、胃腸に原因があるというよりも神経学的原因があると考えられている[147,148]。
しかし、最近の研究では、腸内細菌叢の変化に関連した胃腸症状が粘膜炎症と関連していることが明らかにされている[148,149]。自閉症スペクトラム障害患者では、Faecalibacterium種などの抗炎症種やSCFA合成種が対照群と比較して減少している[150]。Bacteroides fragilis(常在菌)の経口投与は、腸内菌共生バランス失調に起因する腸管上皮の透過性を是正し、いくつかの代謝物の調節につながり、自閉症スペクトラム障害の症状を改善することができる[114]。Firmicutes/Bacteroidesの比率およびFusobacteriaまたはVerrucomicrobiaの組成は自閉症スペクトラム障害と関連している。ビフィズス菌種、粘菌、およびAkkermansia muciniphilaは自閉症スペクトラム障害の小児では低レベルであるが、ラクトバチルス、バクテロイデス、プレボテラ、およびアリスティペスは高レベルで存在する[145, 151, 152]。しかし、Desulfovibrio種、Bacteroides vulgatus、およびClostridiaは、同じような消化器症状を持つ健常者と比較して、消化器症状を持つ自閉症スペクトラム障害の小児では過剰に発現している[153,154]。
バンコマイシンの経口投与後の自閉症スペクトラム障害症状の再発に関する1つの仮説は、クロストリジア菌が根絶を避けるために胞子形成を受けるというものである [145]。微生物相が自閉症スペクトラム障害を治すことができるという直接的な因果関係の証拠はほとんどないが、ラクトバチルス種およびビフィドバクテリウム種のプロバイオティクス株の使用は、自閉症スペクトラム障害を持つ小児の胃腸症状を改善することが示されている[119,155]。
Hsiaoらの研究では、マウスモデルにおけるBacteroides fragilisの経口投与により、微生物組成が変化し、腸管透過性が改善され、コミュニケーションや不安に似た行動の欠陥が減少したことが示唆されている[114]。
痛みと片頭痛
痛みは一般的な集団では一般的であり、微生物相はIBSにおける脊髄内臓痛[138,156]および小腸細菌過剰増殖(SIBO)[157]、さらに片頭痛[158]および場合によっては頭痛[159]など、いくつかのタイプの痛みに影響を与えることが示されている。抗生物質の投与は腸内環境異常を誘発し、宿主と細菌の相互作用を変化させ、マウスモデルでは大腸の感覚および運動の変化を引き起こす可能性がある。これらの影響は、CB2やTLR7などの侵害受容性マーカーによって反映されることがある[160]。Amaralらは、LPS、TNF-α、IL-1beta、およびケモカインCXCL1によって誘導される炎症性侵害亢進が、胚芽のないマウスでは減少することを示した。この効果は、プロスタグランジンやドーパミンによる誘導と同様であった[161]。ヘリコバクター・ピロリ感染が片頭痛と関連していることがメタアナリシスによって明らかにされている[162]。Farajiらは無作為化盲検臨床試験を行い、ヘリコバクター・ピロリ除菌に伴う片頭痛の改善を示した[158]。最近の研究では、腸内細菌叢異常症が慢性片頭痛様疼痛を誘発することは、TNF-αレベルのアップレギュレーションによって達成されることが明らかになった[163]。
一方、内臓痛は、動物モデルにおけるプロバイオティクス治療によって効果的に緩和され得る。Rousseauxらは、特定の乳酸菌株を経口摂取することで鎮痛機能が得られることを発見した。結果として生じるモルヒネ様効果は、腸管上皮μ-オピオイドおよびカンナビノイド受容体の発現亢進によって媒介されることが示された[164]。
プロバイオティクスB. infantis 35624およびLactobacillus farciminisは、ラットモデルにおいて中枢性感作を変化させることにより、内臓抗侵害受容体効果を発揮することが示された[165, 166]。
L. farciminisはまた、このプロバイオティクスの抗壊死効果を説明する脊椎のストレス誘発性Fos発現を減衰させることができる。臨床初歩的な研究では、O’Mahonyらが患者をプロバイオティクスで治療し、Lactobacillus salivarius UCC4331が1週間の投与段階で痛みと不快感を有意に減少させたのに対し、B. infantis 35624は投与段階とウォッシュアウト段階の両方で痛みと不快感のスコアを減少させたことを明らかにした[167]。
神経変性疾患
神経変性疾患は、アルツハイマー病、パーキンソン病(PD)筋萎縮性側索硬化症(ALS)および多発性硬化症(MS)を含む、進行性の神経細胞の喪失を特徴とする神経疾患の集合体である[168]。
神経変性疾患のそれぞれは、固有の病態および臨床的特徴を有することが報告されている。それにもかかわらず、神経炎症とより高い腸管透過性は、それらの共通の特徴である[169]。TNF-α、iNOS、IL-6などの末梢炎症因子のいくつかは、中枢神経系の神経変性の病態において有効であることが確認されている[170, 171]。本章では、機能性胃腸障害がこれらの神経変性症とどのように決定的に関連しているかを考察する。
パーキンソン病
パーキンソン病は、65歳以上の人口の1%以上に影響を及ぼす典型的な神経変性疾患である[172]。パーキンソン病は、環境リスク因子と遺伝的リスク因子の相互作用によって引き起こされると考えられている。この神経病理は運動障害と非運動症状(NMS)を特徴とし、最終的には生活の質に影響を及ぼす[173]。
最近では、腸内細菌叢がパーキンソン病にどのように関与しているかという点で注目が高まっている[173]。SIBO、栄養失調、H.ピロリ菌感染、便秘など、さまざまな腸管機能障害がパーキンソン病と関連している[174]。パーキンソン病における消化管病理の役割については、多くの研究から、患者では対照群よりもα-シヌクレイン検出頻度が高いことが明らかにされている[175]。迷走神経の切除により、消化管から中枢神経系へのα-シヌクレインの伝達が停止することが動物実験で検証されている[66, 176]。腸の炎症はまた、神経炎症を誘発して、げっ歯類の黒質組織におけるドーパミン作動性神経細胞の喪失を促進することができる[177]。Forsythらは、「リーキーガット」と腸の炎症がパーキンソン病の進行に影響を与えることを発見した[178]。大腸透過性の増加は、パーキンソン病患者のシグモイドにおけるα-シヌクレインおよび大腸菌の蓄積の増加と相関していることが判明した[179]。
酪酸産生および抗炎症性細菌属(Blautia、Coprococcus、Roseburiaなど)の数は、パーキンソン病患者では有意に低いが、LPS産生細菌属(OscillospiraおよびBacteroides)の数は有意に高い [180]。プロ炎症性属Ralstoniaはパーキンソン病患者の粘膜に有意に多く、炎症性腸管バリアが病原性であることを示唆している。Scheperjansらは、変化した腸内細菌叢と関連する運動表現型がパーキンソン病の診断に応用できることを明らかにした[181]。プレボテラセア科の相対的な存在量は、パーキンソン病において有意に減少し、PD診断のための非常に感度の高いバイオマーカーとして検証されている。複数の細菌科と便秘の状態に基づくモデルは、PD診断において90.3%の特異度を示すことが示された。発酵乳を4週間摂取することは、便秘などのPD合併症の改善に有効であることが証明された[182]。2つの研究では、抗TNF療法と免疫抑制剤がPDリスクを低下させることが示されている[183,184]。しかし、パーキンソン病の治療におけるプロバイオティクスの有益な効果についての臨床的証拠は非常に限られており、さらなるエビデンスが必要とされている。
アルツハイマー病
最も一般的な変性疾患であるアルツハイマー病は、記憶、言語、問題解決などの認知能力の低下を特徴とし、最終的には認知症に至る[185]。アルツハイマー病は、神経炎症、βアミロイド(アミロイドβ)プラークの蓄積、および脳内の神経原線維性タウのもつれによって病理学的に特徴づけられる。アミロイドβ(アミロイドβ40またはアミロイドβ42)は、アミロイド前駆体タンパク質(APP)からの切断産物である。アミロイドβは自己凝集により中枢神経系でフィブリルに重合し、炎症や神経毒性をさらに誘発する。最近の研究では、アルツハイマー病の病因、特に神経炎症の活性化とアミロイドの形成に対する微生物の機能不全と感染の役割と影響が実証されている。
IL-1beta、IL-6,およびTNF-αを含む神経炎症因子は、アルツハイマー病患者において観察されている[186,187]。Gareauらの研究は、急性ストレスへの曝露下での感染によって記憶喪失および機能不全が悪化することを暗示している[129]。放出されたLPSは炎症を誘発し、脳内でアミロイド線維形成を促進する[188]。ミクログリアはTLR4とTLR2によってアミロイド分子を認識してクリアランスすることができる。興味深いことに、ミクログリアのTLR2からのミエロイド分化一次応答88(MyD88)のシグナル伝達は、TNF-αおよび核内因子κB(NF-κB)の活性化に関与しており、これはまた、それぞれα-セクレターゼおよびβ-セクレターゼを促進することによってアミロイドβの形成を誘導する[189]。
一般的な用語として、アミロイドは、炭水化物デンプンに類似した任意の不溶性、凝集性、およびリポタンパク質に富んだ沈殿物を指す[190]。細菌代謝物およびその生成物は最近、アルツハイマー病を悪化させることが示されている。アルツハイマー病患者では、細菌由来のアミロイド(キュリ、タウ、アミロイドβ、α-シン、およびプリオン)は、宿主アミロイドをクロスシードして凝集させる開始剤として機能しうる[191]。CsgAやアミロイドβ42などのアミロイドは、配列の非類似性にもかかわらず、脳沈着を示し、アルツハイマー病関連の病理学的イベントのカスケードを引き起こす可能性がある[192]。それは慢性的なH.ピロリ菌がアルツハイマー病患者における炎症性メディエーターとアミロイドの両方の放出を引き起こす可能性があることが報告されている[193,194]。H. pylori 濾液は、細胞モデルにおいてタウタンパク質の過リン酸化を誘導する能力を有することが示された[195]。大腸菌は、CsgAの主要なサブユニットであるCurli fibresとして知られる細胞外アミロイドを産生することが報告されている。
微生物によって産生される他のアミロイドには、サルモネラ菌によって産生されるCsgA、シュードモナス・フルオレッセンスによって産生されるFapC、肺炎クレブシエラによって産生されるMccE492,黄色ブドウ球菌によって産生されるフェノール可溶性モデュリン、バチルス・サブチルによって産生されるTasA、およびストレプトミセス・コエリコロールによって産生されるチャップリンが含まれる[190, 196, 197]。Harachらは、APPトランスジェニックマウスの糞便サンプルにおいて、腸内細菌叢の顕著な変化を発見し、この腸内細菌叢がこの神経変性疾患の発症に寄与していることを報告した。腸内細菌を含まないAPPトランスジェニックマウスでは、対照マウスに比べて脳アミロイド病理が減少していることが明らかになった[198]。
さらに最近では、アストロサイトにおけるクラミジア肺炎菌感染が、アルツハイマー病を促進するβアミロイドの生成に関与していることが実証されている[199]。プロバイオティクスの摂取はアルツハイマー病に有益であることが報告されている。
Azm Sらは、βアミロイドを注射したげっ歯類モデルにおいて、乳酸菌とビフィズス菌が記憶障害と学習障害の改善に有効であることを実証した[200]。WangとLiangらは、Lactobacillus fermentum NS9とLactobacillus helveticus NS8がアンピシリン誘発の空間記憶障害を緩和し、慢性拘束ストレスの空間記憶を改善することを明らかにした[201, 202]。
60人のアルツハイマー病患者で実施されたプロバイオティクス治療の無作為化臨床試験では、Akbariらは、発酵乳を介して乳酸菌とビフィズス菌種を12週間投与した後、ミニメンタル状態検査(MMSE)のスコアが有意に改善したことを示した。
また、グルコース代謝や脂質代謝の改善も観察され、認知評価スコアの向上につながると考えられた[203]。
三重除菌療法によるヘリコバクター・ピロリの除菌は、アルツハイマー病患者の認知パラメータの改善につながる[204]。
プロバイオティクスや抗生物質の使用が将来的にアルツハイマー病の治療薬になる可能性があることは有望である。最近の研究では、運動とプロバイオティクスが海馬のアミロイドβプラークを減少させ、認知パフォーマンスを改善し、最終的にはマウスモデルでアルツハイマー病の発症を減衰させることが実証されている[205]。
筋萎縮性側索硬化症
ALSは、脳と脊髄の神経細胞に影響を与え、典型的には死に至る致死的な神経変性疾患である。ALS患者のほとんどは呼吸麻痺により3年から5年以内に死亡する [206]。ALSの病因は遺伝と環境の相互作用の結果であると提案されている。
自然免疫応答とLPSとの相互作用に関する研究は、ALSの発症に不可欠な証拠を提供してきた [207-209]。10年以上前に、破傷風やクロストリジア種によって産生されるボツリヌス毒素を含む腸由来の神経毒素がALSを引き起こすことが提案された[210, 211]。
「リーキーガット」もALSの原因である可能性が高い[212]。さらに最近、WuのALSマウスモデルでは、タイトジャンクション構造が損傷し、腸の透過性が亢進していることが明らかになった。腸内環境の異常はALSマウスでも見られ、特に酪酸産生細菌(Butyrivibrio fibrisolvensおよび大腸菌を含む)のレベルの低下という点で見られる[213]。
ALS患者の腸内では、酪酸産生菌であるOscillibacter、Anererostipes、Lachnospiraの数が減少し、一方でグルコース代謝を行うDoreaの数は有意に増加していることが明らかになった[214]。
Brennerらは、ALS群では対照群に比べてOTUの豊富さが有意に高いことを発見した。しかし、Bacteroidetes/Firmicutesの相対比率は、ALS患者と対照群の間で有意な差を示した[215]。
ALSマウスモデルにおいて、飲料水に2%の酪酸塩を添加した食事を補給すると、腸の完全性と生存率が改善された[216]。
Mazziniらは、対照群と比較してALS患者のユニークな細菌プロファイルを明らかにした。大腸菌と腸内細菌の量が多く、クロストリジウムの量が少なかった[217]。これらの結果は、腸内細菌叢が産生する抗炎症性SCFAがALSの進行に影響を与える可能性のある治療薬であることを示唆している。Mazziniらはさらに、乳酸菌株の効果を理解することを目的とした細菌療法の臨床試験を行った[217]。しかし、腸内細菌叢がALSをどのように改善または悪化させるかを明らかにするには、より直接的な証拠と結果が必要である。
多発性硬化症
MSは、脊柱および中枢神経系の自己免疫誘発性神経変性疾患の一種である。環境因子は、肥満、喫煙、ウイルス、ビタミンDなど、この脱髄性疾患の病因に深く寄与している[218]。
マイクロバイオームの変化と「リーキーガット」の有病率は、MS患者と実験的自己免疫性脳脊髄炎(EAE)動物で発見されており、最も一般的に使用されている炎症性脱髄疾患モデルである [219, 220]。
EAEにおける免疫学的変化は、前炎症性細胞浸潤の増加とTreg機能の障害によって特徴づけられる[221]。好ましい腸内細菌叢はBBBの透過性を調節し、アストロサイトの病原性を制限し、ミクログリアを活性化することができる[222]。EAEモデルでは、ビフィズス菌やラクトバチルスなどの乳酸産生菌がEAE症状の重症度を軽減することができる[223, 224]。
MSではアルキア菌が多いのに対し、FirmicutesやBacteroidetesは少ないか、枯渇していることさえある[218]。バクテロイデス属とクロストリジア属は、炎症の抑制におけるFoxP3+トレッグの誘導に特に関与している[222]。1つの小規模な縦断的研究では、腸内細菌叢のプロファイル、特にフソバクテリアがMSにおける将来の再発リスクと関連していることがわかった[225]。Psuedomonas、Haemophilus、Blautia、およびDoreaa属は、Parabacteroides、AdlercreutziaとPrevotellaa属ははるかに低かったが、MS患者で増加することが検出された[219]。Clostridiales の順序は、Bacteroidaceae、Faecalibacterium、Ruminococcus、Lactobacillaceae、および Clostridium [226] を含む glatiramer 酢酸塩と MS 治療後に復元された。
Ochoa-Reparazらは、抗生物質の経口投与がEAEの発症を遅らせる可能性があることを明らかにした。しかし、腹腔内注射は転帰に有意な影響を与えなかった[227]。これは、腸内マイクロバイオータ生態系の変化がMSの発症と関連していることを示唆している。他の研究では、プロバイオティクス治療や糞便微生物移植でも同様の効果が得られることが検証されている[228, 229]。
脳血管疾患
脳血管障害とは、脳の循環に影響を及ぼす様々な循環器疾患であり、その結果、脳に障害をもたらす。脳血管疾患の最も一般的な病態は、虚血性脳卒中、出血性脳卒中、頭蓋内動静脈奇形(AVM)である。GIマイクロフローラと感染は、宿主免疫系と虚血性脳卒中のプロセスに影響を与えることが示唆されている。腸内細菌叢によるカルニチン、コレステロール、脂肪代謝のアンバランスに加えて、プラーク病変部での感染や炎症が動脈硬化の原因となっている。
動脈硬化
Fernandesらは、経口ストレプトコッカス・ミュータンスが血管疾患患者の動脈硬化性プラークにユビキタスであることを明らかにした[230]。Apfalterらは、ネステッドPCRベースのアプローチを用いて、頸動脈の動脈硬化における肺炎クラミジアの痕跡を同定した[231]。Mitraらによる頸動脈動脈動脈硬化症プラークのメタゲノム研究では、プラーク組織からのシークエンシングリードの2~16%が、Lactobacillus rhamnosusおよびNeisseria polysacchareaを含む細菌由来であることが示された。虚血症状のある患者では細菌の含有率が高い。Acidovorax spp.およびH. pylori細胞もまた、動脈硬化組織において蛍光in situハイブリダイゼーション(FISH)によって検出された[232]。Karlssonらは、症候性動脈硬化症患者と健常者の腸内メタゲノムの配列決定を行った。
腸内細菌叢は、食餌性コリン、レシチン、カルニチンをTMAOに変換し、脂質とホルモンのホメオスタシスに影響を与えて血管性動脈硬化を引き起こすことが示唆されている[89, 234]。カルニチン-ブチロベタイン-トリメチルアミン-N-オキシド経路は、頸動脈アテローム性動脈硬化症と関連していることがわかっている[235]。LPSによる単球の刺激は、炎症を誘発するか、LDLの取り込みを誘発するかのいずれかによって、動脈硬化性プラークにおける泡沫細胞の形成の重要なステップとなり得る[236, 237]。
一連のプロバイオティクスに基づく治療の試みが進行中であり、HDL/LDL比を回復させるためにL. acidophilus 145,B. longum 913 [238]、L. acidophilusおよびB. bifidum [239]を用いたヒト試験、およびTMAOに対するL. plantarum ZDY04を用いたマウス実験[240]などがある。
脳卒中
Benakisらは、梗塞誘発性虚血性脳損傷が抗生物質投与により減少することを示した。抗生物質による腸内細菌叢の変化は、脳梗塞後のエフェクターT細胞のトラフィッキングを抑制する調節性T細胞を増加させ、IL-17+γδT細胞を減少させる可能性があることを示した。興味深いことに、腸内細菌叢関連梗塞モデルは、糞便移植によって感染し、再現することができる[241]。Porphyromonas gingivalisへの全身曝露は、虚血性脳卒中のリスク増加と関連している[242]。Kawatoらは、グラム陰性菌の継続的な静脈注射がSHRSP(自然発症性高血圧性脳卒中発症ラット)で脳卒中を加速させることを明らかにしたが、これはおそらくLPSによる酸化ストレス応答によるものである[243]。Zhuらは、TMAOが血小板の多動性および血栓症リスクと関連していることを発見した [90]。彼らの次の研究では、雑食の食事は菜食で誘導されるよりも血中のTMAO含量が高く、血栓の形成を促進する可能性が高いことが短期コホートで検証された。
彼らの研究では、低用量のアスピリンの使用が、TMAOによる血小板凝集を緩和するのに有用であることが示唆された[244]。Yinらは、脳卒中や一過性脳虚血発作を経験した患者では、Enterobacter、Megasphaera、Oscillibacter、Desulfovibrioなどの日和見腸由来の病原体が豊富であることを明らかにしたが、Bacteroides、Prevotella、Faecalibacteriumなどの有益な病原体はあまり多くないことを明らかにした。逆説的なことに、YinらはTMAOレベルが対照群よりも患者群の方が低かったことを示した[245]。
動静脈奇形
ヒトにおけるAVM発症と腸内細菌叢との直接的な因果関係は明らかにされていないが、動物モデルではAVMの病態生理と発症における腸内細菌叢の重要な役割が示唆されている。Shikataらは、動脈瘤マウスモデルにおいて、抗生物質を用いて腸内細菌叢を枯渇させたところ、マクロファージの浸潤とサイトカインの分泌が減少したため、動脈瘤の誘導が劇的に減少した[246]。脳海綿体奇形(CCM)は、出血性脳卒中や発作を引き起こす一般的な血管奇形である[247]。Tangらは、細菌またはLPSによるTLR4の刺激がCCM形成を促進することを示したが、細菌を使用しないマウスの使用およびマウスへの抗生物質の使用はCCMを予防することができる。腸内マイクロバイオームおよび内皮TLR4は、重要な刺激剤として作用し、CCM治療における新規戦略としての使用の可能性を示唆している[248]。興味深いことに、Winekらの逆説的な結果は、広範な抗生物質で処理された腸内細菌叢が、マウスモデルで炎症と脳卒中を悪化させることを示している[249]。しかし、Evangelo Boumisらは、Lactobacillus rhamnosusのようなプロバイオティクスの摂取は、特別な感受性因子を持つ患者の感染の重大なリスクを課す可能性があり、抗生物質による予防を考慮すべきであることを発見した[250]。これらの知見は、特定のマイクロバイオータと抗生物質の使用が異なる転帰をもたらすことを示唆している。
結論と展望
腸内細菌叢は、腸内フローラの維持と脳生理学の両方に重要であることが徐々に認められてきている。腸内細菌叢は、免疫系、内分泌系、細菌代謝物を介して、神経伝達や血管バリアを調節し、宿主の神経心理学的機能、認知、脳血管生理学を変化させている。また、治療標的となる可能性のある疾患の研究開発も進められている。脳疾患、腸内細菌叢の変化、証明されたメカニズム、プロバイオティクスをベースとした潜在的な治療薬は、表2.2にまとめられている。しかし、メタボロミクス研究で用いられる実験デザイン、被験者、モデル、分析アプローチ、パイプライン、品質管理プロトコルなどの面で課題が残っている。
表2 脳疾患、腸内細菌叢の変化、病理学的および分子シグネチャー、および潜在的なプロバイオティクスベースの治療法
| 脳障害 | 微生物叢の腸内毒素症 | 病理学的および分子的特徴 | 潜在的なプロバイオティクスベースの治療法 |
|---|---|---|---|
| ストレスとうつ病 | Faecalibacterium、Alistipes、Ruminococcus [ 112 ]、Campylobacter jejuni [ 143 ]およびFirmicutesの増加; バクテロイデス門の減少[ 251 ] | 活性化およびHPA【の解放121 ]、VFA [ 112、141 ]、セロトニン1A受容体[ 122 ]。BDNF [ 122 ]、GABA受容体[ 119 ]の発現低下 | ビフィズス菌インファンティス[121], Lactobacillus rhamnosus [119], Lactobacillus helveticus, Bifidobacterium longum [142], and other Bifidobacterium strains [143] |
| 痛みと片頭痛 | H.pyloriの増加[ 162 ]; 腸内毒素症[ 163 ] | CB2およびTLR7の機能不全[ 160 ]; 炎症性痛覚過敏[ 161 ]; TNF-αは慢性片頭痛eを誘発しました[ 163 ] | ラクトバチルス、B.がティス35624及びラクトバチルスはfarciminis [ 165、166 ]、ラクトバチルス・サリバリウスUCC433 1 [ 167 ] |
| 自閉症スペクトラム障害 | Faecalibacterium種[ 150 ]、Bifidobacteria種、Akkermansiamuciniphilaの減少; 増加ラクトバチルス、バクテロイデス、プレボテラ、及びAlistipes [ 145、151、152 ]。変更Fusobacteria、ウェルコミクロビウム門とFirmicutes/Bacteroides ratio [11] | 破壊腸上皮透過性[ 114 ]、粘膜の炎症[ 148、149 ]、SCFA合成の減少[ 150], mucosal inflammation [148, 149] | バクテロイデス・フラジリス[ 114 ]、ラクトバチルス種およびビフィドバクテリウム種[ 119、155 ] |
| パーキンソン病 | H.pylori [ 174 ]、E.coli [ 179 ]、Ralstonia、Oscillospira、Bacteroides [ 180 ]の増加。減少Prevotellaceae [ 181 ]、Blautia、Coprococcus、及びRoseburia [ 180 ] | αシヌクレインの検出のより高い周波数[ 175 ]、ドーパミン作動性ニューロンの損失[ 177 ]、腸炎症および透過性の変化[ 178、180 ] | 複数のプロバイオティクス株(ストレプトコッカス・サリバリウス亜種サーモ、エンテロコッカスフェシウム、ラクトバチルス・ラムノサスGG、ラクトバチルス・アシドフィルス、ラクトバチルス・プランタラム、ラクトバチルス・パラカゼイ、ラクトバチルスデルブリッキー亜種ブルガリクス、およびビフィドバクテリウム)[ 182 ] |
| アルツハイマー病 | 慢性ヘリコバクターピロリ感染症[ 193、194 ]。増加大腸菌、サルモネラ属、シュードモナス・フルオレッセンス、肺炎桿菌、黄色ブドウ球菌、枯草菌、ストレプトミセスセリカラー[ 190、196、197 ]。クラミジア肺炎感染症[ 199 ] | 増加したIL-1βのレベルは、IL-6、およびTNF-α[ 186、187 ]。そのようなCsgA、Aβ42、FAPC、MccE492、フェノール可溶性Modulins、TASA、チャップリンズ、及びβアミロイドの展示大脳沈着のような細胞外アミロイド[ 190、192、196、197、199 ] | 乳酸菌とビフィズス菌[ 200、203 ]。ラクトバチルス・ファーメンタムNS9及びラクトバチルス・ヘルベティカスNS8 [ 201、202 ] |
| 筋萎縮性側索硬化症 | 含むブチレート産生細菌のレベル低下、Butyrivibrio fibrisolvensの、大腸菌(Escherichia coli) 、Oscillibacter、Anaerostipes、及びLachnospira [ 213 ]。ブドウ糖代謝ドレアの増加[ 214 ] | 破傷風およびボツリヌス毒素[ 210、211]; “leaky gut” [212]; higher richness of OTUs [215]; reduction of butyrate [216] | ラクトバチルス菌株[ 217 ] |
| 多発性硬化症 | 古細菌、プセドモナス、ヘモフィルス、ブラウティア、ドレア[ 219 ]、およびフソバクテリウム[ 225 ]の増加。減少バクテロイデス門、ファーミキューテス門、 [218] Parabacteroides, Adlercreutzia, Prevotella [219], Bacteroides and Clostridia [218, 222] | BBBの完全性の崩壊と星状細胞の病原性[ 222 ]; 炎症誘発性細胞浸潤の増加とTreg機能の障害[ 221 ]; 「漏出性腸」[ 219、220 ] | ビフィズス菌と乳酸産生細菌[ 223、224 ]。Bacteroidaceae、Faecalibacterium、Ruminococcus、Lactobacillaceae、およびClostridium [ 226 ] |
| アテローム性動脈硬化症 | LactobacillusrhamnosusおよびNeisseriapolysaccharea、Acidovoraxspp。およびH.ピロリ細胞[ 232 ]; コリンセラ[ 233 ]; ローズブリアとユーバクテリウム[ 233 ] | カルニチン-ブチロベタイン-トリメチルアミン-N-オキシド経路[ 235 ]; 脂質やホルモンの恒常性に影響を与えることによって、血管アテローム性動脈硬化症を引き起こす[ 82、222 ]; 炎症による泡沫細胞の形成[ 236、237 ] | L.アシドフィルス145、B。ロングム91 3 [ 238 ]、L。アシドフィルスおよびB.ビフィダム[ 239 ]、TMAOに対するL.プランタルムZDY04 [ 240 ] |
| 脳卒中 | 増加ポルフィロモナス・ジンジバリス[ 242 ]、グラム陰性菌[ 243 ]、エンテロバクター、メガスフェラ、Oscillibacter。減少バクテロイデス、プレボテラとFaecalibacterium [ 245 ] | 血栓の形成と血小板凝集[ 244 ]; 制御性T細胞の減少[ 241 ] | 抗生物質投与[ 241 ] |
| 動静脈奇形 | グラム陰性菌[ 248 ] | マクロファージ浸潤とサイトカイン分泌[ 246 ]; TLR4をアクティブにする[ 248 ] | 抗生物質およびプロバイオティクス治療は議論されている[ 248 – 250 ] |
これまでのところ、因果関係を示すものではなく、微生物相と宿主生理との間に明確な関連性があることが明らかにされている。ヒトの糞便実験には複数の交絡変数が存在するため、メタゲノムバイオマーカーのスクリーニングにはより大規模なサンプルサイズの研究が必要である。このような研究は、曝露、人口統計、食生活、社会経済的要因を考慮すれば、より信頼性の高いものとなる。しかし、集団ベースのメタゲノム解析においても、結果変数は不可解な変数や交絡因子の影響を大きく受け、一方で、マイクロバイオームの構成は限られた影響(10-20%)で説明できる[252-254]。現在のマイクロバイオータに基づくトランスレーショナル医学におけるもう一つの障害は、認知機能または心理機能の観点から観察される効果が軽度で長期的であることである。プロバイオティクスやマイクロバイオータベースの治療薬が神経精神疾患に影響を与えるには数ヶ月から数年かかるかもしれないが、宿主の凝固に対するマイクロバイオータの効果ははるかに迅速に観察できる。
ヒトのコホートおよび横断的研究に加えて、動物モデルは、特定の微生物が宿主にどのように影響を与えるかを説明するために不可欠な証拠を提供する。動物モデル、特にマウスモデルは、特定の微生物種の機能を検証するために、前臨床実験で広く採用されてきた。初期の動物研究は、宿主の生理と微生物相の影響との間の関連を明らかにするために、細菌を含まない動物を用いて確立された[255]。特定の微生物の無菌動物へのコロニー化、プロバイオティクスの使用、および糞便性マイクロバイオータ移植(FMT)アプローチは、マイクロバイオータの特定の形質および機能を解明するために広く使用されている。抗生物質で処理した動物モデルは、成熟した免疫を持つ野生型動物の微生物枯渇効果を研究するための代替手段である[20]。
しかし、動物モデルからのマイクロバイオームに関する結論を用いたトランスレーショナルメディシンの実践には、ゲノム背景、腸の違い、食生活、その他の生活暴露に関連する問題を含む多くの障害がまだ存在している。例えば、ヒトゲノムはマウスゲノムと85%以上のゲノム配列を共有しているが、これらの種の発現パターンおよびタンパク質機能は全く同じではない[256-259]。
腸の構造に関しては、マウスはヒトよりも比較的大きな盲腸と小腸を呈している。一方、ヒトの小腸には、表面積を増加させる円形のひだ(すなわち、plicae circularis)がより多く存在するのに対し、マウスの粘膜表面の外観は滑らかである[259,260]。
生活経験は、ヒトと動物が異なる生活歴、運動レジーム、サーカディアンサイクル、社会的圧力、特に食物内容を経験しているため、データ分析の際に生じるもう一つの問題である。
通常、動物実験における食事と咀嚼は栄養的に制御された単調なものであるが、ヒトの食事の構成は毎日変化する。これらの食事に関連した交絡因子は、モデルの複製や臨床試験への翻訳の際に課題を引き起こす可能性がある。
しかし、定量的コホート研究では、ヒトの研究ではレトロスペクティブな質問紙よりも強力な証拠が得られており、サンプルサイズが小さいことで仮説を検証するのに十分な場合もある[244, 261]。
マイクロバイオーム解析アプローチの選択とその技術的安定性は、さらなる大きな課題である。採用されているDNA抽出法、ライブラリ調製プロトコル、シーケンサ、分析パイプラインは、特定の検体内でも観察される生物学的変動に寄与する[262]。最近の大規模な比較研究では、データ処理におけるサンプルの均質化、分注、分析パイプラインの重要性が明らかにされている[263, 264]。また、16Sシーケンシングは可変領域の選択に大きく依存しているのに対し、WMSはサンプル中のすべての生物のゲノム全体から断片を同定し定量するため、16SおよびWMS分析の結果は完全に再現可能ではないことも注目に値する。したがって、各プロトコルは、さらなる誤解を引き起こす可能性がある特定の分類学的割り当てのための優先順位を示している[265-268]。さらに、ほとんどの16Sシーケンシングプロトコルは、分類群の属または属レベルの分解能を得るのに対し、WMSプロトコルは、種または株レベルの情報さえも提供することができる[24, 269]。
完全なものには程遠いが、腸内細菌叢に基づく治療法は、将来の脳疾患の治療に使用される可能性のある有望なアプローチである。医師や科学者は、ヒポクラテス(紀元前400)の「食物を汝の薬とし、薬を汝の食物としよう」という提言に沿って、ピルボックスの外で考える準備ができている[270]。科学者たちはまた、脳疾患の診断、治療、および予後における微生物叢の応用のフロンティアを押し進めている。MWAS、メタボロミクス、マルチオミクスから生み出される堅牢なデータは、うまくいけば、心理ケア、脳血管ケア、消化器ケアを治療に統合できる枠組みを形成している。
略語
4-EPS 4-エチルフェニル硫酸
アルツハイマー病 アルツハイマー病
AHR アリール炭化水素受容体
ALS 筋萎縮性側索硬化症
APP アミロイドβ前駆体タンパク質
自閉症スペクトラム障害s 自閉症スペクトラム障害
AVM 動静脈奇形
アミロイドβ βアミロイド
BBB 血液脳関門
CCM 脳海綿体奇形
中枢神経系 中枢神経系
DASH ダイエットで高血圧を止めるアプローチ
DMB 3-ジメチル-1-ブタノール
EAE 実験的自己免疫性脳脊髄炎
FISH 蛍光in situハイブリダイゼーション
FMT 糞便マイクロバイオータ移植術
GABA ガンマ-アミノ酪酸
高脂肪食 高脂肪ダイエット
HFHC 高脂肪・高コレステロールダイエット
HMPヒトマイクロバイオームプロジェクト
HPA 視床下部-下垂体-副腎軸
I3S インドキシル-3-硫酸塩
IAld インドール-3-アルデヒド
IBD 炎症性腸疾患
IBS 過敏性腸症候群
ILC3 グループ 3 自然リンパ球
IPA インドール-3-プロピオン酸
ITS 内部転写スペーサー
LCFAs 長鎖脂肪酸
LPS リポ多糖類
LTA リポテチン酸
メダイ地中海式ダイエット
MetaHIT ヒト腸管メタゲノミクス
神経変性遅延に対するMIND地中海-DASH治療法
MMSE ミニ精神状態検査
MRI 磁気共鳴イメージング
MS 多発性硬化症
MWAS メタゲノムワイド関連研究
NGS 次世代シーケンシング
NMRS 核磁気共鳴分光法
NMS 非運動症状
PAMPs 病原体関連分子パターン
PDパーキンソン病
PRRs パターン認識受容体
rRNA リボソームRNA
SCFAs 短鎖脂肪酸
SHRSP 自然発症高血圧型脳卒中患者
SIBO 小腸内細菌の過剰増殖
SSU スモールサブユニット
TLR Toll様受容体
TMA トリメチルアミン
TMAO トリメチルアミンオキシド
TnAse トリプトファナーゼ
Tregs 調節性T細胞
VFA 揮発性脂肪酸
