The Potential Therapeutic Effect of RNA Interference and Natural Products on COVID-19: A Review of the Coronaviruses Infection
概要
SARS-CoV-2ウイルスは,中国湖北省武漢市で初めて報告された呼吸器感染症の原因ウイルスである.このパンデミック肺炎により 2020年11月27日までに61,308,161症例のうち、約1,437,835人が死亡した。この病気の主な臨床的合併症は、発熱、反復する咳、息切れ、急性呼吸器症候群、重要な器官の不全などで、死に至ることもある。コロナウイルス感染症の予防・治療には、抗酸化作用、抗がん作用、抗ウイルス作用を有する天然化合物やRNA干渉剤が、重要なウイルス遺伝子の発現を抑制することで、重要な役割を果たすことが明らかになっている。本研究では、コロナウイルスの遺伝的・形態的構造の概要を紹介するとともに、SARS-CoV-2の複製・感染に不可欠なウイルスの構造的・非構造的遺伝子を、miRNA、siRNA、化学薬品、天然化合物が免疫系を刺激したり、阻害したりする役割を明らかにすることを目的としている。
キーワード
コロナウイルス、miRNA、siRNA、天然物、フィトケミカル、SARS-CoV-2
はじめに
過去50年以上にわたり、コロナウイルス(CoV)を原因とするヒトや動物の病気は多岐にわたっている。2003年に重症急性呼吸器症候群(SARS-CoV)コロナウイルスが出現して以来、かなりの数の新しいヒトコロナウイルス(H-CoV)が同定されている(Ding er al 2012年に中東呼吸器症候群(MERS-CoV)コロナウイルスが出現し、ヒトの感染例が続出したことで、これらのウイルスをさまざまな角度から研究することの重要性がさらに注目されるようになった(Centers for Disease Control and Prevention, 2012)。新たな変異や組み換えに耐性を持つことで、このグループのウイルスは進化し、種間を伝播する能力を持つようになった。ほとんどの場合、CoVの感染は自己限定的であり、適切な期間を終えると、体は病気から回復する(Enjuanes er al)。 しかし、このファミリーの一部の株は重度の感染症を引き起こし、過去20年間に広く普及したパンデミックの原因となっている(Mahase, 2020)。
SARS-CoV-2ウイルスは、中国の湖北省武漢で初めて報告された、呼吸器系の感染症を引き起こすウイルスである。WHOの統計によると 2020年11月27日、新型コロナウイルス感染症(COVID-19)は、61,308,161casesのうち、約1,437,835人が死亡し、死亡者数と感染者数が最も多かったのはアメリカ大陸であった(Chen er al)。 近年、H-COVに苦しむ患者の治療には、抗生物質の処方、抗ウイルス剤(Human Immunodeficiency Virus 1(HIV-1)プロテアーゼ阻害剤、オセルタミビル、リバビリンなど)の適用、さまざまな副腎皮質ホルモン、インターフェロン、自然人免疫グロブリンなど、多くの治療戦略が用いられている。最近では、MERS-CoV、SARS-CoV、および重症急性呼吸器症候群コロナウイルス-2(SARS-CoV-2)などのCoVの治療戦略のほとんどは、複製、感染に関与するウイルス剤の阻害、またはウイルス感染に対抗するための宿主の免疫系薬剤の誘導に基づいている(Li and De Clercq, 2020; Prajapat er al)。 今日では、RNA干渉(RNAi)融合阻害剤、中和抗体、植物、または微生物の代謝物を含む様々な生体分子の抗ウイルス化合物としての役割を証明するために、数多くの研究が行われている(Prajapat er al)2020)。
この総説では、コロナウイルスの生物学、複製、注入、および病因に関するいくつかの情報を提示しようとしている。また、コロナウイルス感染症、特にSARS-CoV-2に対抗するために使用できる、化学薬品、天然化合物、低分子干渉RNA(siRNA)マイクロRNA(miRNA)に基づく既存の治療戦略を説明することにした。この目的のために 2020年8月までの天然物、フラボノイド、ポリフェノール、フィトケミカル、マイクロRNA、siRNA、Coronavirus、COVID-19を含むキーワードを、Scopus、PubMed、WOS、Google Scholarのデータベースを用いて検索し、評価した。
コロナウイルスの分類・用語解説
ゲノムの構成、ゲノムの相同性、宿主での繁殖戦略、ビリオンの構造的形質などが、国際ウイルス分類委員会(ICTV)によるCoVの分類基準となっている(Casals er al)。 系統学的には、CoVはニドウイルスのクラスとしてCoronaviridaeに属する。Coronaviridaeファミリーには2つのサブファミリーがある。OrthocoronavirinaeとTorovirinaeである。Orthocoronavirinaeの亜科は、4つの属からなる。コロナウイルスは、アルファ、ベータ、ガンマ、デルタの4つの属からなり、哺乳類から鳥類まで幅広い宿主に感染する(King et al 2012)。CoVのヒトへの感染は、1965年に初めて報告された(Hamre and Procknow, 1966)。H-CoV 229EとCoV-NL63はα-CoV属のヒト病原体で、感冒を引き起こす(Mcintosh et al 1970;Monto、1974)。重症急性呼吸器症候群コロナウイルス1(SARS-CoV-1)MERS-CoV、およびSARS-CoV-2は、系統的にはβ-CoVs属に分類され、過去20年間にヒト集団において高い割合で死亡率を引き起こしている(Zhou er al)2020)。系統研究に用いられるCoVs遺伝子は、nsp12(RNA依存性RNAポリメラーゼ)nsp5(キモトリプシン様プロテアーゼ)nsp13(ヘリカーゼ)ヌクレオカプシド(N)スパイクタンパク(S)が代表的である(ICTV, 2009)。
ゲノム構造
CoVは、32-46%のG + Cを含む正の一本鎖RNAである。既知のRNAウイルスの中では最大のゲノムサイズ(約26.4~31.7kb)を持つ(Lai and Cavanagh, 1997; Enjuanes et al, 2000)。CoVのゲノムには、株によって異なる数のオープンリーディングフレーム(ORF)が含まれている。それにもかかわらず、ORF1a、ORFb1,エンベロープ(E)プロテインS、プロテインN、および膜タンパク質(M)は、すべてのHuman-CoV株に存在する(Cavanagh、1995;Enjuanes et al 2000)。SARS-CoV-2のゲノムサイズは29.8〜29.9kbで、9,860アミノ酸をコードしている。SARS-CoV-2のORF1abは21kb以上の長さがあり、ゲノム全体の3分の2を占めている(Cascella er al)2020)。最近の報告によると、SARS-CoV-2のゲノムのORF部分は、他のコロナウイルスに比べてCGジヌクレオチドの割合が低いため、ORFのRNA翻訳は高効率であるとされている(Wang Y. et al 2020)。
コロナウイルスの複製過程
CoVの複製サイクルは、いくつかの段階を経て行われる(図1)。最初の段階では、ウイルス結合タンパク質が宿主細胞の表面にある適切な受容体に結合する。その後、膜融合が起こり、最終的にウイルスゲノムが宿主細胞内に挿入される。第2段階では、RNAポリメラーゼ依存性のRNA遺伝子が活性化され、ウイルスゲノムが構造タンパク質に翻訳される(Ziebuhr, 2005)。これらのステップでは、ウイルス因子に加えて、いくつかの宿主細胞因子もこのプロセスを促進または抑制する。
図1 コロナウイルスの転写と複製
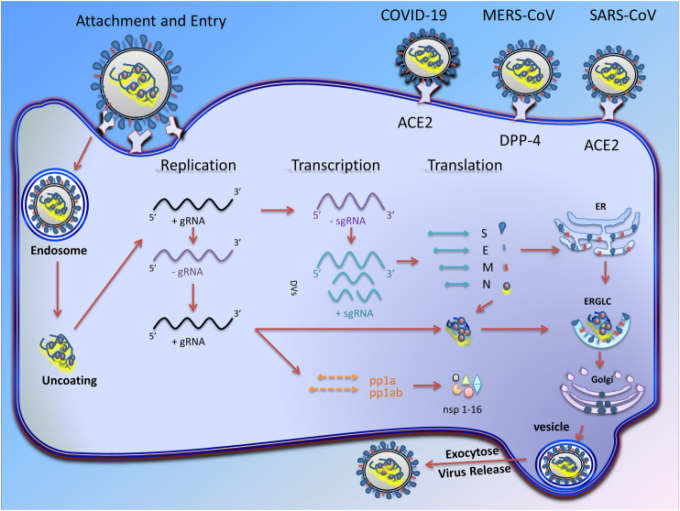
コロナウイルスの感染は、ウイルスのSタンパク質が宿主細胞の受容体に付着することで始まることを示す模式図。融合に成功すると、リボヌクレオカプシドが細胞質に入り、被膜を失ってmRNAが放出される。CoVのRNA依存性RNA合成には、ゲノムRNA(gRNA)の複数コピーを達成するための2つの異なるゲノム複製プロセスと、構造タンパク質や付属タンパク質をコードするサブゲノムRNA(sg mRNA)の転写が含まれる。gRNAは最終的に、ウイルスの複製に関わる16の非構造タンパク質(nsp-16)を作り出す。組み立てと出芽の後、完全なウイルス粒子は細胞質膜に移動し、最終的にはエキソサイトーシスのプロセスを経て放出される。
ウイルスの付着、侵入と細胞因子の関与
ウイルスの侵入の第一段階は、Sタンパク質が宿主のリガンドに付着することから始まる。ほとんどのHCOVはその侵入にエンドサイトーシス経路を用いるが、他のものは直接膜融合を用いることができる(Gallagher and Buchmeier, 2001)。エクトドメインを持つSタンパク質は、受容体結合サブユニット(S1)と膜サブユニット(S2)から構成されている。宿主細胞表面の受容体に結合した後、S1サブユニットはS2の構造変化を引き起こす。S2のタンパク質分解ドメインは、ウイルスの膜を宿主の膜に融合させ、ウイルスゲノムが宿主細胞に侵入するきっかけとなる。Sタンパク質の部分的な変異でアミノ酸配列が変化すると、ウイルスの病原性や組織・細胞の感染しやすさに大きく影響する(Li, 2016)。
HCoV-NL63,SARS-CoV、およびSARS-CoV-2は、アンジオテンシン変換酵素2(ACE2)を用いて細胞を汚染する(Moore et al 2004;Zhang et al 2020a)。肺胞細胞(I型、II型)と内皮細胞の両方がACE2を発現している。MERS-CoVは、様々な組織の内皮細胞に広く発現しているアデノシンデアミナーゼの生理的リガンドであるDipeptidyl peptidase 4 (DPP4)を利用することが明らかになっている(Raj et al 2013)。しかし、多くの宿主因子がウイルスの侵入を制限する。細胞培養のメカニズムによると、インターフェロン誘導性膜貫通タンパク質(IFITM)のファミリーは、HCOV-229EおよびHCOV-NL63のSタンパク質依存性のアクセスを制限することができ、これはSARS-CoVおよびMERS-CoVの感染を強烈に減少させることにもつながる(Huang et al 2011; Wrensch et al 2014)。IFITMは、ウイルスの細胞膜やエンドソーム膜への融合を阻止したり、膜の流動性を介して膜融合を阻害していると考えられる。さらに、ヒトコロナウイルスHCOV-OC43は、IFITM2とIFITM3を受容体として利用し、細胞への侵入を促していることが示されている(Zhao er al)。
転写とレプリケーション
CoVでは、RNA依存性RNAポリメラーゼがウイルスゲノムを2つの方法で増幅し、最終的にゲノムRNA(gRNA)とサブゲノムRNA(sg mRNA)の複数のコピーを生成する(Ziebuhr, 2005)。一般的に、CoVの複製はORF1aの翻訳によって開始され、4,382個のアミノ酸を持つポリプロテイン1a(pp1a)と7,073個のアミノ酸を持つポリプロテイン1ab(pp1ab)が生成される。その後、ORF1bがリボソームのフレームシフティング機構により翻訳される(Lai, 1990; Ziebuhr, 2005)。最終的に、これらのポリプロテインはそれぞれ切断され、ウイルスの複製サイクルに関与する16の非構造タンパク質(nsp-16)が生成される(Mcintosh and Peiris, 2009)。ウイルスのライフサイクルに重要な役割を果たす非構造タンパク質(表1)には、ヘリカーゼ(nsp13)RNA依存性RNAポリメラーゼ(RdRP)(nsp12ポリメラーゼ)3-チモトリプシン様プロテアーゼ(3CLpro)(nsp5プロテアーゼ)パパイン様プロテアーゼ(PLpro)(nsp3プロテアーゼ)などがある(Lai, 1990; Sawicki er al)。
表1 コロナウイルスの非構造タンパク質の生物学的活性
| タンパク質 | ウイルス粒子の生物学的機能 | 宿主細胞応答への影響 | 参照。 |
|---|---|---|---|
| Nsp1 | 病原性因子。 | リボソームの40Sサブユニットと相互作用して、宿主のmRNAの翻訳を防ぎます。 | Woo etal。(2010) |
| 属固有のマーカー。 | |||
| CoV間で大きく異なる | |||
| Nsp2 | 報告されていません。 | 2つの宿主タンパク質、PHB1およびPHB2との相互作用、および細胞内宿主細胞の生存シグナル伝達経路の破壊。 | Cornillez-Ty etal。(2009) |
| Nsp3 | レプリカーゼポリタンパク質のN末端でのシステイン型エンドペプチダーゼ活性。 | 宿主膜の再配列において役割を果たす。CCL5やCXCL10などの炎症誘発性サイトカインのmRNAレベルをダウンレギュレートします。 | Lei etal。(2018) |
| Nタンパク質との相互作用による核酸結合、RNA指向5′-3’RNA指向5′-3’RNAポリメラーゼ活性。 | IFN誘導の抑制を担当します。IFN産生に拮抗する | ||
| Nsp4 | コロナウイルスによって誘発されたDMVのマーカー。 | 報告されていません。 | アンジェリーニら (2013) |
| nsp3およびnsp6と相互作用して、複製複合体を形成します。 | |||
| Nsp5 | 11部位でレプリカーゼポリタンパク質のC末端を切断します | ADRPに結合し、ホストATP6V1G1を切断し、ホスト液胞の細胞内pHを変更する可能性があります | リンら。(2005) |
| Nsp6 | ウイルス複製に必要です。 | 宿主の小胞体からのオートファゴソームの初期誘導において役割を果たす。 | アンジェリーニら (2014) |
| ホスト膜の再配列によってDMV形成を仲介します。 | ウイルス成分をリソソームに送達できなくなったこれらのファゴソームの拡大を制限します。 | ||
| Nsp7 | ヘテロヘキサデカマーdsRNAの形のプライマーゼ-リング構造として取り囲んでいます。 | 報告されていません。 | Te Velthuis etal。(2012) |
| Nsp8 | RdRPのプロセッシビティファクター。 | ||
| Nsp9 | ssRNA結合タンパク質として作用することによりウイルス複製に関与する可能性があります。 | 報告されていません。 | Miknis etal。(2009) |
| Nsp10 | nsp1、nsp7、nsp14、およびnsp16と対話します。 | 報告されていません。 | Bouvet etal。(2012) |
| ポリプロテインプロセシングの調節に関与しています。nsp14 3′-5 ‘エキソリボヌクレアーゼとnsp162’- O-メチルトランスフェラーゼ活性の両方を刺激することにより、ウイルス転写において極めて重要な役割を果たします | |||
| Nsp12 | ウイルスRNAゲノムの複製と転写を担当します。 | 報告されていません。 | アンら。(2012) |
| Nsp13 | マグネシウム依存性ヘリカーゼ活性。 | 報告されていません。 | タナー等。(2003) |
| 5 ‘から3’の極性でRNAおよびDNAの二重巻き戻し活性を表示します。 | |||
| Nsp14 | ssRNAとdsRNAの両方に3 ‘から5’方向に作用するエキソリボヌクレアーゼ。 | N末端を介してDDX1と相互作用します。 | デニソン等。(2011) |
| RNA複製の校正用エキソリボヌクレアーゼとして機能します。 | 自然免疫応答の調節。 | ||
| Nsp15 | Mn 2+依存性のウリジル酸特異的酵素で、切断された結合の5 ‘側に2′-3’-環状リン酸を残します。 | dsRNAセンサーを回避するために不可欠です。 | Ricagno et al。、2006) |
| Nsp16 | mRNAキャップ2′-O-リボースのメチル化をウイルスmRNAの5′-キャップ構造に仲介します。 | MDA5認識を回避するために不可欠です。 | Bouvet etal。(2010) |
| 自然免疫を負に調節する。 | |||
| IFN拮抗作用。 |
ウイルスのアセンブリーとエグレス
構造タンパク質(表2)といくつかの膜付属タンパク質は、ERに結合したリボソーム内で翻訳されるが、Nタンパク質は細胞質内の遊離リボソームを介して翻訳される(Nal er al)。 CoVの特徴の一つは、小胞体の内部でビリオンが凝集し、ゴルジ装置に向かって出芽することである(Cawood er al)。 さらに、E、S、およびNタンパク質のビリオンへの挿入は、出芽遺伝子座におけるMタンパク質のヘテロタイプの相互作用によって調節される(Opstelten et al 1995)。組み立てと出芽の後、完全なウイルス粒子は細胞質膜に移動し、最終的にはエキソサイトーシスのプロセスを経て放出される(図1)。
表2 SARSおよびSARS-CoV 2の構造タンパク質の生物学的機能を示す
| タンパク質 | 翻訳後修飾 | ウイルス粒子の生物学的機能 | 宿主細胞応答への影響 | 参照。 |
|---|---|---|---|---|
| S | ジスルフィド架橋、パルミトイル化、N-グリコシル化 | 病原性因子。 | eIF3Fとの物理的な相互作用。 | ボッシュ他 (2003)およびNal etal。(2005) |
| 細胞受容体の認識を担当します。 | 感染後期における炎症誘発性サイトカインIL6および8の発現の調節。 | |||
| ウイルス膜と宿主エンドソーム膜の融合。 | ||||
| M | O-グリコシル化、N-グリコシル化 | ウイルスの形態形成において中心的な役割を果たします。3aや7aなどの他のウイルスタンパク質との相互作用を介して構造とアセンブリを維持し、HEおよびSタンパク質と複合体を形成します。 | アポトーシス促進性を介したカスパーゼ8および9の活性化。 | Nal etal。(2005)およびSiu etal。(2009) |
| 膜の湾曲を促進し、ヌクレオカプシドに結合し、ウイルスへのRNAパッケージングに参加します | RIG-Iによって媒介されるIFNI産生を抑制し、IRF3の核への移行、IFN拮抗作用を阻害する | |||
| E | パルミトイル化、グリコシル化 | ウイルスの形態形成と集合において中心的な役割を果たします。 | 細胞ストレス応答とミトコンドリアを介したアポトーシスの誘導。肺上皮の破壊、潜在的なB細胞拮抗作用。 | 等。(1999)およびLiu etal。(2007) |
| ウイルスエンベロープの湾曲に関与します。 | ||||
| 感染した細胞内での病原性因子の輸送とビリオンの出芽。 | ||||
| N | O-グリコシル化、ADP-リボシル化、SUMO化、リン酸化 | RNAシャペロンは、らせん状のヌクレオカプシドのウイルスゲノムと結合します。 | ホストsmad3に結合することにより、トランスフォーミング成長因子ベータシグナル伝達を調節します。 | 趙ら (2006)およびWu etal。(2009) |
| ウイルスゲノムおよび膜タンパク質M、E、nsp3との相互作用を通じて、ビリオンの組み立て中に基本的な役割を果たします。 | IRF3の機能を妨害します。 | |||
| sgRNAの転写とウイルス複製の効率を高める上で重要な役割を果たします。 | IFNI応答の阻害。アポトーシスの誘導。 |
コロナウイルスの病因
臨床的には、コロナウイルスの病因は3つの段階に分けられる。ウイルス血症の段階では、肺に感染した後、ウイルスは末梢血に入る。このため、ウイルスは血流を介して心臓、腎臓、消化管などの標的組織に到達することができる。第2段階は肺炎期である。そして、この段階で免疫系がウイルスの攻撃に打ち勝つことができれば、患者は回復期に入る。しかし、免疫不全、高血圧、糖尿病、高齢者などの患者では、免疫システムが効果的に感染を管理できず、臨界期が発生する(Peiris et al 2003,Guan et al 2020)。
治療方法
ワクチン接種はCOVID-19のパンデミックを抑制する最善の方法であり、その製造には多くの努力が払われている。とはいえ、その製造には、まず免疫原性と有効性を証明しなければならないため、時間がかかる。そのため、現在は予防が最善の治療法となっている。この病気の治療には2つの重要な戦略がある。まず、患者の症状や臨床的な合併症を軽減する一般的な治療、そして2つ目は薬物治療である。
一般的な治療
これらの患者に利用可能な治療法は、心機能、腎臓、肝臓、呼吸数などのバイタルサインの測定とモニタリング、必要に応じて酸素療法を行うことである。さらに、十分な水分、カロリー、電解質のバランスをとり、アセトアミノフェンやイブプロフェンなどの解熱剤を使用する必要がある(Wang J. er al)2020,Zimmermann and Curtis 2020)。SARS-CoVパンデミック時にメチルプレドニゾロンなどの副腎皮質ホルモンを使用すると、一部の臨床症状が改善することがわかっているが、COVID-19では一般的ではない。とはいえ、呼吸困難やARDS(Acute Respiratory Distress Syndrome)などの重症患者には一時的にしか使用できなかった(Huang et al 2020,Russell et al 2020,Zhang et al 2020b)。漢方薬は、COVID-19の呼吸器症状などを緩和・軽減するための栄養補助食品として使用できる性質を持っている。それらは、軽度の病気の重症度を持つ患者の一般的な状態を改善することができる。Althaea officinalis L. (Malvaceae), Commiphora myrrha (T.Nees) Engl. (Burseraceae), Glycyrrhiza glabra L. (Fabaceae), Hedera helix L. (Araliaceae), Sambucus nigra L. (Viburnaceae)などの生薬は、軽度のCOVID-19の補助療法として使用することができる(Silveira et al 2020)。
コロナウイルスの薬物治療
SARS-CoV-2は、コロナウイルス科の新種のウイルスで、SARS-CoVと79%、MERS-CoVと51.8%のゲノム類似性がある。したがって、SARS-CoV-2の垂直感染のリスクはこれら、2種類のウイルスと同じであるため、その治療法も似通ったものになる。その結果、これまでSARS-CoVやMERS-CoVの治療に有効だった薬剤が、COVID-19の治療にも治療効果を発揮する可能性がある(Ren et al 2020)。この新しいウイルスに対する決定的な治療法はまだ発見されていないが、これまでの研究では、西洋薬や天然物などの薬剤がCOVID-19に対して潜在的な効率性を持ち、病気の重症度を軽減するために使用できる可能性が示唆されている。
インターフェロン
インターフェロンI型は、ウイルス感染に反応して産生・分泌される自然免疫系のメンバーであり、αおよびβインターフェロンを含む。インターフェロンは、2つの方法で抗ウイルス活性を発揮する。1)細胞障害性Tリンパ球とマクロファージは、ナチュラルキラー細胞を増加または刺激することによってウイルスを殺すように免疫系を刺激する、2)または宿主細胞でのウイルス複製を阻害する(Samuel, 2001; Sadler and Williams, 2008; Fensterl and Sen, 2009)。これまでの研究で、インターフェロン-α、特にその組換え型(INF- α2b)は、ウイルスの複製を阻害し、ウイルス量を減少させることにより、初期段階の呼吸器系ウイルス感染症(インフルエンザ、SARS-CoV、MERS-CoVによる)の症状を緩和し、病気の経過を短縮することがわかっている。したがって、これらの分子は、COVID-19の治療に有用であると考えられる(Zheng et al 2004,Danesh et al 2011,Falzarano et al 2013,Khalid et al 2015)。しかし、COVID-19治療ガイドラインパネルの最新更新版(3.2020)によると、COVID-19の治療効果に関するコメントはない(COVID-19治療ガイドラインパネル)。
ロピナビル/リトナビル
Lopinavir/Ritonavirはプロテアーゼ阻害剤であり、その抗ウイルス作用により、これまでHIVに対して使用されていた。それにもかかわらず、その後のSARS-CoV(2003年に発生したパンデミック)では、3CLpro阻害作用によるロピナビル/リトナビルがコロナウイルス治療に有用であることが発見された(Chu et al 2004,Su et al 2019)。SARS-CoV2とSARS-CoVにおける3CLproの構造的類似性から、これまでの研究では、この薬剤がSARS-CoV2の治療に有用である可能性が示唆されていた(Uzunova er al)2020)。とはいえ、後にこの感染症の治療にはこれらの薬剤が期待される効果を発揮しないことが判明し、コロナウイルス感染症2019年治療ガイドライン(最終更新日:2020年11月3日)では、臨床試験以外での使用は推奨されないことが発表されている(COVID-19治療ガイドラインパネル 2019)。
リバビリン
リバビリンは、抗ウイルス活性を有するヌクレオシドアナログである。ロピナビル/リトナビルの併用は、SARS-CoVに対して大きな治療効果があり、ARDSリスクを低減する可能性がある(Chu er al)2004)。しかし、COVID-19治療ガイドラインパネルの最新更新(2020年11月3日)によると、COVID-19に対する治療効果についてのコメントはない(COVID-19治療ガイドラインパネル)。
クロロキン(Chloroquine)
クロロキンは、マラリアに対して使用される抗寄生虫薬であるが、最近ではウイルスの感染を遮断する抗ウイルス活性があることが示されており、試験管内試験でSARS-CoV-2の感染を抑えることができた(Wang M. et al 2020,Colson et al 2020)。多くの医師や専門家が当初、COVID-19の治療にこの薬剤を検討していたが、現在ではその使用は推奨されていない(COVID-19治療ガイドラインパネル)。
ファビピラビル(Favipiravir)
COVID-19の治療において期待されている薬剤の1つがファビピラビルである。この薬剤はRNAポリメラーゼの阻害作用があり、初期の臨床試験では、ロピナビル/リトナビルよりも抗ウイルス活性が顕著であるだけでなく、副作用も少ないことが示されていた(Cai er al)。2020)。しかし、COVID-19治療ガイドラインパネルの最新の更新情報(2020年11月3日)によると、COVID-19の治療効果についてのコメントはない(COVID-19治療ガイドラインパネル)。
レムデシビル
Remdesivirは、SARS-CoV/MERS-CoVなどのRNAウイルスに対して使用可能な薬剤の一つである。RdRPを阻害することによるこのアデノシンアナログは、COVID-19に対して治療効果があることが生体内試験および試験管内試験の研究で示されており、この新しいパンデミック感染症を治療するための選択肢となり得る(Holshue et al 2020; Wang M. et al 2020)とされている。本剤は現在、COVID-19治療ガイドラインパネル(COVID-19治療ガイドラインパネル)の最新更新(2020年11月3日)によれば、COVID-19の治療に推奨されている。
アルビドール
Arbidolは、インフルエンザの予防および治療のための抗ウイルス化合物である。試験管内試験では、アルビドールがSARS-CoVの複製に対して直接的な抗ウイルス活性を有することが証明されている(Wang X. et al 2020)。また、SARS-CoV-2を対象とした臨床試験では、高流量鼻腔カテーテル(HFNC)による酸素療法を軽減し、ウイルスクリアランスのプロセスを促進し、放射線画像上の焦点吸収を改善することが示された(Xu er al)2020a)。アルビドールは、宿主細胞の接着およびSARS-CoV-2スパイク糖タンパク質の三量体化を阻害することができた。さらに、ロピナビル/リトナビルによるアルビドールの同時使用は、ロピナビル/リトナビル群よりも顕著な治療効果があるとされている(Deng et al 2020)。ただし、COVID-19治療ガイドラインパネルの最新の更新情報(2020年11月3日)によると、COVID-19の治療効果についてのコメントはない(COVID-19治療ガイドラインパネル)。
抗血栓療法について
ヘパリンなどの抗凝固剤は、心臓不整脈の患者さんの動脈血栓塞栓症の予防に重要な役割を果たしている。COVID-19患者の主要な死因の1つは、原因不明の心筋梗塞および脳梗塞である。したがって、血友病や類似の疾患によるCOVID-19の入院患者に抗凝固剤の禁忌がない場合、予防的に投与することは、血液凝固の症状(アンチトロンビンの低値、フィブリノーゲンやジダイマーの増加など)を持つ患者のCOVID-19の合併症を減らすために重要な役割を果たす(Godino et al 2020)。
抗ウイルス剤としての天然物
天然物は、自然界の生物によって生産された生化学的混合物である 古代医学における天然化合物の有効性は、数千年前に紹介された(Ji et al 2009)。様々な薬理学的特徴を持つこれらの化合物は、抗酸化作用、抗がん作用、抗炎症作用、抗ウイルス作用を有する。今日、医療で使用されている化学薬品の多くは、天然化合物に由来するものである(Frabasile er al)。 天然物や化学医薬品の治療戦略は、ウイルスのライフサイクルの各段階に必要なタンパク質分子を標的とすることである(Dias er al)2012)。このセクションでは、コロナウイルスの感染抑制における天然化合物の役割について説明する(表3;図2;図3;図4)。なお、表3に示した化合物のうち、COVID-19感染症に対する臨床第2相試験が行われているのは、エピガロカテキン-3-ガレート(NCT04446065)とレスベラトロールとピコリン酸亜鉛の併用療法(NCT04542993)のみであることを強調しておきたい。
表3 コロナウイルス感染症における由来と機能別のフィトケミカルの種類
| 化合物名 | 植物化学物質のクラス | ソース | 関数 | 臨床試験段階 | 参考文献 |
|---|---|---|---|---|---|
| バイカレイン | フラボノイド | Scutellaria baicalensis Georgi、Scutellaria lateriflora L.(シソ科) | SARS-CoV-1の3CLプロを阻害する | — | Su etal。(2020) |
| SARS-CoV-2感染時の血清中のIL-1βおよびTNF-αのレベルの低下 | — | Song etal。(2020) | |||
| Broussochalcone B | ポリフェノール | Broussonetia papyrifera(L.)L’Hér。元ベント。(クワ科) | SARS-CoV-1およびMERS-CoVのPLプロを阻害する | — | Park etal。(2017) |
| クルクミン | ポリフェノール | Curcuma longa L.(ショウガ科) | SARS-CoV-2のACE2受容体とスパイク糖タンパク質を阻害する | — | マウリヤら。(2020)。 |
| エモジン | アントラキノン | ダイオウL.(タデ科) | SARS-CoV-1Sタンパク質とACE2の相互作用を阻害する | — | Ho etal。(2007) |
| SARS-CoV-1の3aタンパク質チャネルを阻害する | — | Schwarz etal。(2011) | |||
| エピガロカテキン-3-ガレート | ポリフェノール | Camellia sinensis(L.)Kuntze(ツバキ科) | SARS-CoV-1およびSARS-CoV-2の3CLプロを阻害する | フェーズ2(SARS-CoV-2) | Jang et al。、(2020)およびNguyen etal。(2012) |
| ガロカテキンガレート | ポリフェノール | Camellia sinensis(L.)Kuntze(ツバキ科) | SARS-CoV-2の3CLプロを禁止する | — | チャンら (2020) |
| SARS-CoV-1のPLプロおよびCLプロを阻害する | — | グエンら。(2012)およびPark etal。(2016) | |||
| ヘルバセチン | フラボノイド | Linum usitatissimum L.(アマ科) | SARS-CoV-23CLプロのタンパク質分解活性をブロックする | — | Jo etal。(2020a) |
| ヒルスタノノール | フェノール | Alnus glutinosa(L.)Gaertn。(カバノキ科) | SARS-CoV-1のPLプロおよび3CLプロを阻害する | — | Park et al。、2012a |
| ヒルステノン | フェノール | Alnus japonica(Thunb。)スチュード。(カバノキ科) | SARS-CoV-1のPLプロ活性を阻害します | — | Park etal。(2012a)およびPark etal。(2012b) |
| ヨードバナナ | オリゴ-オキサ-アダマンタン | 天然物誘導体 | SARS-CoV-1のNTPase /ヘリカーゼを阻害する | — | タナー等。(2005) |
| イソババカルコン | フラボノイド | カレンコリリフォリウム(L.)メディク。(syn。Psoraleacorylifolia)(マメ科) | SAR-CoV-1のPLプロを阻害する | — | キムら (2014) |
| ケンペロール3,7-ジグルコシド | グリコシルオキシフラボン | Asplenium ruta-muraria L.、Asplenium scolopendrium L.(同義語Asplenium altajense)(チャセンシダ科) | SARS-CoV-1のウイルスイオンチャネルを遮断する | — | Schwarz etal。(2014) |
| ターゲットSARS-CoV2-Sスパイクタンパク質 | — | パンら。(2020) | |||
| カジノールF | ポリフェノール | Broussonetia papyrifera(L.)L’Hér。元ベント。(クワ科) | SARS-CoV-1およびMERS-CoVのPLプロを阻害する | — | Park etal。(2017) |
| ミリセチン | ポリフェノール | Myristica fragransHoutt。(ニクズク科) | SARS-CoV-1のヘリカーゼとnsP13を阻害する | — | Yu etal。(2012) |
| ナリンギン | フラボノイド | Citrus x aurantium L。、(ミカン科) | SARS-CoV-1の3CLプロを阻害する | — | グエンら。(2012) |
| ナリンゲニン | フラボノイド | 柑橘系の果物(ミカン科) | 2孔チャネル(TPC)阻害剤MERS-CoV | — | パフミら (2017) |
| SARS-CoV-1の3CLプロの酵素活性をブロックする | — | Jo etal。(2020b) | |||
| ペクトリナリン | フラボノイド | Cirsium chanroenicum(中井)中井(キク科) | SARS-CoV-13CLプロの酵素活性をブロックする | — | Jo etal。(2020b) |
| パピリフラボノールA | フラボノイド | Broussonetia papyrifera(L.)L’Hér。元ベント。(クワ科) | SARS-CoV-1およびMERS-CoVのPLプロを阻害する | — | Park etal。(2017) |
| ケルセチン | グリコシルオキシフラボン | Allium cepa L.(ヒガンバナ科) | ターゲットSARS-CoV2-Sスパイクタンパク質 | — | Pan et al。、2020 |
| ケルセチン3-β-Dグルコシド | フラボノイド | Passiflora subpeltata Ortega(トケイソウ科) | MERS-CoVの3CLプロを禁止する | — | Jo etal。(2019) |
| レスベラトロール | ポリフェノール | Vitis vinifera L.(ブドウ科) | ヌクレオカプシドタンパク質の翻訳を阻害し、MERS-CoVを介したアポトーシスを減少させる | フェーズ2(SARS-CoV-2) a | リンら。(2017) |
| ロイフォリン | フラボノイド | Toxicodendron succedaneum(L.)Kuntze(syn。Rhussuccedanea)(ウルシ科) | 3CLプロ SARS-CoV-1を阻害する | — | グエンら。(2012) |
| ルブラノシドA | ジアリールヘプタノイド | Alnus hirsuta(Spach)Rupr。(syn。Alnussibirica)(カバノキ科) | 3CLプロ およびPLプロSARS-CoV-1を阻害する | — | Park etal。(2016) |
| ルブラノシドB | ジアリールヘプタノイド | Alnus japonica(Thunb。)スチュード。(カバノキ科) | 3CLプロ およびPLプロSARS-CoV-1を阻害する | — | Park etal。(2016) |
| スクテラレイン | フラボノイド | Scutellaria lateriflora L.(シソ科) | ヘリカーゼを阻害する、nsP13 SARS-CoV-1 | — | Yu etal。(2012) |
| バニリンバナニン | オリゴ-オキサ-アダマンタン | 天然物誘導体 | SARS-CoV-1のNTPase /ヘリカーゼを阻害する | — | タナー等。(2005) |
aレスベラトロールとピコリン酸亜鉛の併用療法
図 2 本研究で紹介したいくつかの天然物の化学構造
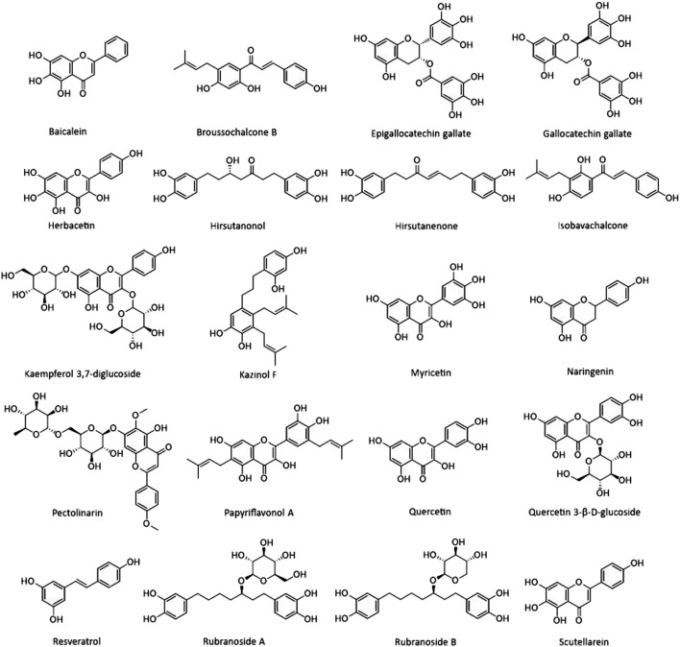
図3 SARS-CoVの感染と複製に対する天然化合物の採用の利点
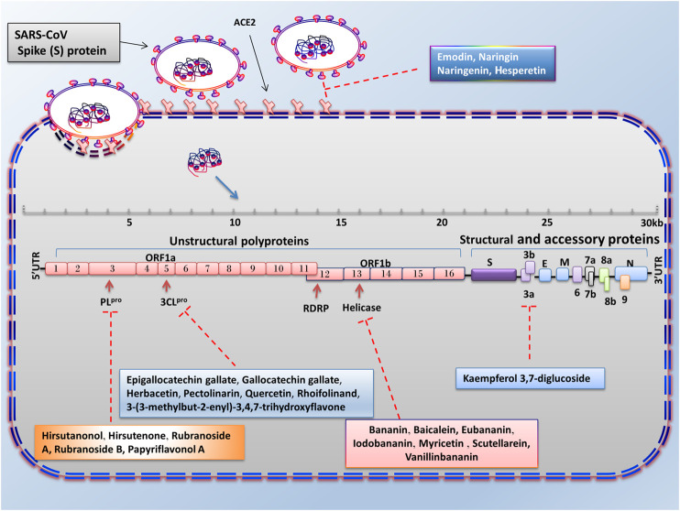
天然化合物の中には、3CLpro、PLpro、ヘリカーゼ、3a遺伝子の発現を低下させることで、SARS-CoVの感染を抑制する治療的な役割を果たすものがある。
図4 MERS-CoVの感染と複製に対する天然化合物の採用の利点
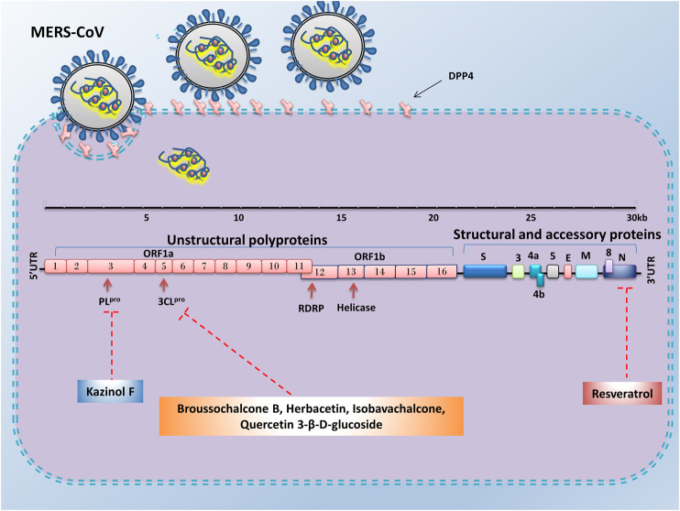
天然化合物の中には、ヌクレオカプシド、3CLpro、PLpro遺伝子の発現を低下させることで、MERS-CoVの感染を抑制する治療的な役割を果たすものがある。
Sタンパク質、ACE2,TMPRSS2を標的とした細胞の付着と侵入の抑制
コロナウイルスが宿主細胞に侵入する際には、まずSタンパク質を介して宿主細胞の表面にある特定の受容体に結合する必要がある。SARS-CoVとSARS-CoV-2の特定の受容体は、ACE2タンパク質である。ウイルスの侵入強度を低下させるには、ウイルスのSタンパク質の発現を抑制するか、天然物によって宿主細胞におけるACE2の発現を低下させることができる。研究の結果、SARS-CoV Spikeタンパク質のアミノ酸配列は約76.47%で、SARS-CoV-2と類似していることがわかっている(Xu er al)。 ウイルスのSタンパク質は高度にグリコシル化されているため、グリコシル化されたタンパク質に結合しやすい植物由来のレクチンを使用することで、ウイルスが細胞表面の受容体に結合するのを防ぐことができる。これまでの研究で、ハーブ化合物がヒト免疫不全ウイルスやSARS-CoVのネコに対する阻害剤として使用できることが示されている(Pyrc er al)。 エモジンはアントラキノン系化合物(天然化合物の一群)に属し、抗炎症作用、抗がん作用、抗酸化作用を有する(Izhaki, 2002)。エモジンは、用量依存的に、ビオチン化Enzyme-Linked Immunosorbent Assay(ELISA)法およびVero E6細胞株において、ACE2とSタンパク質の相互作用を有意に阻害することができた。したがって、この化合物をSARS-CoVの治療における抗ウイルス治療薬として考えることができる(Ho et al 2007)。いくつかの薬剤や物質は、ACE2受容体の発現を低下させる可能性がある。見られるように、インターロイキン-4およびインターフェロン-γは、Vero E6細胞におけるこの受容体を減少させた(De Lang et al 2006)。分子ドッキングと構造に基づくドラッグデザインの研究により、ベルベリン、テバイン、マンギフェリン、ピペリン、ニンビン、およびクルクミンが、ACE2受容体とSARS-CoV-2のスパイク糖タンパク質に対して阻害効果を持つことが明らかになった。これらのうち、クルクミンとニンビンは、他の天然化合物やヒドロキシクロロキン、ナファモスタット、カプトプリルなどの化学薬品よりも、ACE2受容体やスパイク糖タンパク質との高い相互作用を示した(Maurya et al 2020)。
柑橘類の皮には、フラボノイドやアルカロイド化合物(ナリンギン、ナリンゲニン、ヘスペレチン、ヘスペリジンなど)が豊富に含まれており、胃腸の健康維持や免疫力向上に欠かせない役割を果たしている。ナリンギンは、LPS誘導RAW 264.7マクロファージやLPS処理ラットの炎症作用を低下させる抗炎症物質である。そのため、LPS処理によって誘発されるIL-6,IL-1β、iNOS、COX-2などの炎症性サイトカインの増加を抑制することができる。分子ドッキングの調査では、ナリンギン、ナリンジェニン、ヘスペレチンがクロロキンなどのACE2に結合することが示された。さらに、これらの化合物は、クロロキンよりも低い結合エネルギーレベルでACE2に結合することができた(ドッキングエネルギーは5.7kcal/mol)。しかし、これらの化合物がクロロキンよりも効果的であるかどうかを判断するには、より多くの試験管内試験および生体内試験の実験が必要である(da Silva Antonio er al)2020)。ただし、重要な生理活性(血圧のホメオスタシス、肺細胞の破壊からの保護、電解質の保持、水など)によるACE2の阻害は、患者の生活に悪影響を及ぼす可能性があることに留意する必要がある。ACE2に加えて、Transmembrane Protein Serine 2 (TMPRSS2)もSARS-CoV-1およびSARS-CoV-2の感染に必須のタンパク質である。TMPRSS2は、ウイルスのSタンパク質の不可逆的な構造変化を通じて、ウイルスと宿主細胞膜との融合を誘導する(Hoffmann et al 2020)。その結果、動物モデルの気道におけるTMPRSS2の阻害は、SARS-CoVおよびMERS-CoVによる感染後の肺の損傷の重症度を減少させる(Chikhale er al)2020)。したがって、SARS-CoV-2の侵入を阻止し、病態を制限する戦略の1つとして、TMPRSS2の阻害が考えられる。計算生物学と分子ドッキングを用いた2つの独立した研究の結果、ネオヘスペリジン、ミリシトリン、クエルシトリン、ナリンジン、イカリイン、シチコリン、ビアンスラキノン、イソゲミカルコンB、(-)-エピガロカテキン-(3-O-メチル)ガレートなどのいくつかの天然化合物がTMPRSS阻害剤として使用できることが示された(Chikhale et al 2020;Rahman et al 2020)。
ヘリカーゼを標的にしてウイルスの複製を阻害する
SARS-CoV-2のヘリカーゼタンパク質は、RdRPの下流に位置する遺伝子であるnsp 13によってコードされている。このタンパク質を阻害することで、ウイルスの複製を抑えることができる(Ivanov er al)。 ヘリカーゼは、ヌクレオシド三リン酸(NTP)の加水分解から得られる自由エネルギーを利用して、二本鎖の核酸(NA)を分離することができる。そのため、このタンパク質は抗ウイルス剤開発のターゲットとして期待されている。これまでの研究で、さまざまな天然物がヘリカーゼ(巻き戻しまたはATPase)の活性を抑制することが明らかになっている。2005,Tannerらはアダマンタン由来のバナニン類がSARS-CoVのヘリカーゼに及ぼす影響を調べた。
その結果、ヨードバナニン、バニリンバナニン、バナニン、ユーバニンはヘリカーゼタンパク質のATPase活性を阻害する効果があり、IC50率は0.5~2.8μMの範囲であった。さらに、蛍光共鳴エネルギー移動法(FRET)を用いて、これら4つの化合物が巻き戻しヘリカーゼ活性も阻害することがわかった。また、これらの化合物は大腸菌のヘリカーゼには効果がなく、SARSのヘリカーゼにのみ作用することから、一般的なヘリカーゼ阻害活性を持たないことも確認された。最後に、アカゲザル胎児腎臓-4細胞(FRhK-4)での細胞質効果とRT-PCRの結果から、これらの化合物は細胞に毒性を示すことなくウイルスの複製を抑えることができることが示された(Tanner et al 2005)。2012,Yuらの研究結果によると、64種類の天然化合物(フラボノイド)のうち、ミリセチンとスクテラレインだけがSARS-CoVのヘリカーゼ活性を低下させることができたという。このイベントでは、この2つの化合物が健康な乳房細胞(MCF10A)に毒性作用を及ぼすことなく、10μMの投与量でヘリカーゼATPase活性を最大90%低下させることができた。さらに、さらなる分析により、これらの化合物はヘリカーゼの巻き戻し活性を変化させないことが示されている(Yu er al)。 バイカレインは、SARS-CoV(nsp13)のヘリカーゼ活性を阻害する効果を持つもうひとつの天然物である。研究によると、この化合物はnsP13のdsDNA巻き戻し活性に対して阻害効果はないが、IC50値0.47μMでヘリカーゼATPase活性を最大60%低下させることができる(Keum et al 2013)。
3CLPRO、PLPROプロテアーゼを標的とし、ウイルスのタンパク質処理を阻害する
もう1つの重要な抗ウイルス戦略は、3CLproやPLproなどのウイルスプロテアーゼに対する特異的な阻害剤を使用することである。これらのプロテアーゼは、タンパク質の処理や成熟、ウイルスの複製に不可欠な役割を果たしている。SARS-CoV-2のゲノム(正の一本鎖RNA)は、翻訳された後、pp1aとpp1abという2つのポリペプチドを生成することができる。最後に、これらの2つのポリペプチドは、3CLproまたはPLpro活性によって切断され、16種類の非構造タンパク質を生成する(Thiel et al 2003,Muramatsu et al 2016)。フラボノイドは、植物に含まれるフェノール化合物の一群で、抗炎症作用、抗ウイルス作用、抗酸化作用、抗がん作用などがある。これらの化合物により、コロナウイルスの感染が減少したという報告が多くある(Tapas er al)2008)。Pichia pastoris GS115を用いた試験管内試験では,エピガロカテキン-3-ガレート,ケルセチン,ガロカテキンガレートがSARS-CoV 3CLproの発現を抑制することが示された。また、モレキュラー・ドッキング実験とキネティック・エンザイム研究により、IC50レートが47〜73μMの範囲にあるこれら3つの化合物が、プロテアーゼ活性を最大80%低下させることが明らかになった。その中で、ガロカテキンガレートの効果は他の化合物よりも顕著であった(Nguyen er al)。 Rhoifolinand,herbacetin,pectolinarinは,3CLproに悪影響を及ぼす他のフラボノイド化合物である。FRETプロテアーゼアッセイや吸収分光法を用いた研究では,これらの化合物が3CLproに結合し,そのプロテアーゼ活性を著しく阻害することが示されている(IC50で薬剤濃度が40μM以下)(Jo er al)。,2020b)。別の研究では、Joらは、いくつかのフラボノイド化合物のMERS-CoV 3CLproに対する阻害効果を調べた。その結果、isobavachalcone、quercetin 3-β-D-glucoside、herbacetinが顕著な阻害作用を示し、IC50値はそれぞれ35.85,37.03,40.59μMであった(Jo et al 2019)。SARS-CoV-2の3CLproは、すべてのCoVの間で高度に保存されており、SARS-CoV-1と約96%の類似性を有している。ウイルスの複製に不可欠な役割を果たすことから、COVID-19の治療標的となる可能性がある(Xu er al)2020c)。微生物由来の天然物は、植物由来のものに比べてユニークな化学的多様性を持っているため、FDAに承認された天然化合物ベースの医薬品の50%以上が微生物化合物由来のものである。Sayedらによる仮想スクリーニングと分子結合により、シトリキノクロマン、ホリリンB、プロキシミシンC、および他のいくつかの微生物化合物がSARS-CoV-2の3CLproを阻害することが示された(Sayed et al 2020)。微生物化合物に加えて、分子ドッキングやMDシミュレーションの研究により、ヒドロキシペンタフハロール、ペンタフレソールB、ルテオリン-7-ルチノシド(ΔG約-14.6〜-10.7kcal/mol)を含むいくつかの海洋天然物もSARS-CoV-2の3CLproを阻害できることが示されている(Gentile et al, 2020)。
パパイン様プロテアーゼ(PLpro)は、SARS-CoV-2の増殖を制御する別のプロテアーゼであり、このウイルスを治療するための潜在的な標的として知られている。これまでの研究では、Alnus japonica (Thunb.) Steud. (Betulaceae)には、抗がん作用、抗炎症作用、および抗インフルエンザ作用があることが示されている。Kimらの研究では、この植物から調製した天然フェノール化合物(ジアリルヘプタノイド)がPLproのタンパク質分解活性を変化させることが示された。蛍光測定の結果、抽出された9つの物質のうち、hirsutenone、hirsutanonol、rubranoside B、およびrubranoside Aが、PLproに対して用量依存的な阻害効果を示した。これらの化合物のうち、hirsutenoneはSARS-CoVのPLpro(IC50 = 4.1 µM)および3CLpro(IC50 = 36.2 µM)の酵素活性に対して顕著な阻害効果を示した。さらに研究を進めると、この物質は、カテコール部位を持つα, β-不飽和カルボニル基を骨格に持ち、この構造の存在が阻害作用に本質的な役割を果たしていることがわかった(Park er al)2012a)。また,Broussonetia papyrifera (L.) L’Hér. ex Vent.(モクセイ科)の根に由来するポリフェノールも,抑制効果があることが示されている。(Moraceae)の根に由来するポリフェノールは、SARS-CoVおよびMERS-CoVのプロテアーゼに対して良好な阻害作用を有することが示されている。Parkらは、この植物に由来する10種類の天然化合物のSARS-CoVおよびMERS-CoVプロテアーゼに対する阻害効果を調べた。これらの化合物のSARS-CoVプロテアーゼに対する効果を調べたところ、パピリフラボノールA(ブルッソノールE)がPLproの最も有効な阻害剤(IC50値3.7μM)であり、3-(3-メチルブト-2-エニル)-3,4,7-トリヒドロキシフラボンが3CLproの最も有用な阻害剤(IC50値30.2μM)であった。さらに、濃度27.9μM(IC50)のブルソカルコンB(Bavachalcone)と濃度39.5μM(IC50)のカジノールFは、MERS-CoV 3CLproとMERS-CoV PLproの活性をそれぞれ低下させることができた(Park er al)。
ヌクレオカプシド(N)タンパク質を標的にしてウイルスの感染と複製を阻害する
レスベラトロールは、抗炎症作用、抗酸化作用、抗がん作用を有する天然化合物である(Yeung er al)。2019; Filardo er al)。2020)。これまでの研究では、この化合物が抗ウイルス活性を有し、単純ヘルペスウイルス(HSV)呼吸器シンチアルウイルス(RSV)エプスタインバーウイルス(EBV)によるウイルス感染を抑制できることが示されている(Faith et al 2006;Zang et al 2011;De Leo et al 2012)。また、レスベラトロールは、Vero E6細胞株におけるMERS-CoV Nタンパク質の発現を抑制することで、MERS-CoVのRNA発現、ウイルス収量、複製を減少させることができた。さらに、カスパーゼ3の切断を抑制することで、ウイルスの感染を著しく減少させ、感染した細胞の生存率を高めることができた(Lin er al)。 コロナウイルスの感染リスクを低減する他の天然化合物には、アルカロイドのファンキノリン、セファランチン、テトランドリンがある。Kimらの研究結果によると、これらの化合物は、MRC-5細胞株において、ヒトコロナウイルスOC43の感染によって引き起こされる炎症性サイトカイン(IFN-α1,IL-6,IFN-β1,IL-8,IL-1)の発現を抑制できることが示された。また、これらの3つの天然化合物は、Nタンパク質の発現を阻害することでOC43の複製を減少させ、MRC-5細胞株におけるこのウイルスの細胞毒性効果を減少させ、MRC-5ヒト肺細胞の増殖および生存を増加させることができる(Kim er al)2019)。
3Aタンパク質を標的とし、ウイルスの放出を抑制する
ウイルスの産生と放出には、宿主細胞膜にあるいくつかのイオンチャネルが必要である。そのため、これらのイオンチャネルの阻害は、ウイルス感染の抑制に重要な役割を果たしており、抗ウイルス戦略の1つとして、これらのチャネルを抑制できる化合物を使用することが挙げられる(Liang and Li, 2010)。これらのイオンチャネルの1つは、SARS-CoVゲノムのORF3aによって生成されたカチオン選択チャネル(3aタンパク質)である。ケンフェロール配糖体は、さまざまな植物に含まれる天然のフラボノールである。これまでの研究で、この化合物には抗ウイルス作用(IC50値2.3μM)があり、モデル系であるXenopus oocyteにおいて、3aタンパク質SARS CoV(イオンチャネル)の発現を阻害できることが明らかになっている(Schwarz er al)。2014)。
RNA干渉
RNA干渉(RNAi)は、多くの真核生物に見られるRNA分子で、mRNA分子の3UTRを標的として遺伝子の発現を抑制する。今日では、siRNAとmiRNAが遺伝子サイレンシングに使用される最も一般的なRNAiのタイプである。RNAiの起源には、内因性(細胞内で発生するもの)と外因性(ウイルスや実験器具から発生するもの)がある。外因性のRNAiは、エレクトロポレーション、ウイルスベクター、リポソーム、リン酸カルシウムを用いて細胞に伝達することができる(Sohrab er al)2018)。細胞内に挿入されると、合成siRNAは細胞質内のDicerによって切断される。RNA-Induced Silencing Complex(RISC)とAgo2に配置された後、RNAi分子(図5)は一本鎖のRNAとなり、標的のmRNAを破壊したり、その翻訳を阻害したりする(Ding et al 2018)。
図5 RNA干渉(miRNAとsiRNA)のバイオジェネレーションと機能
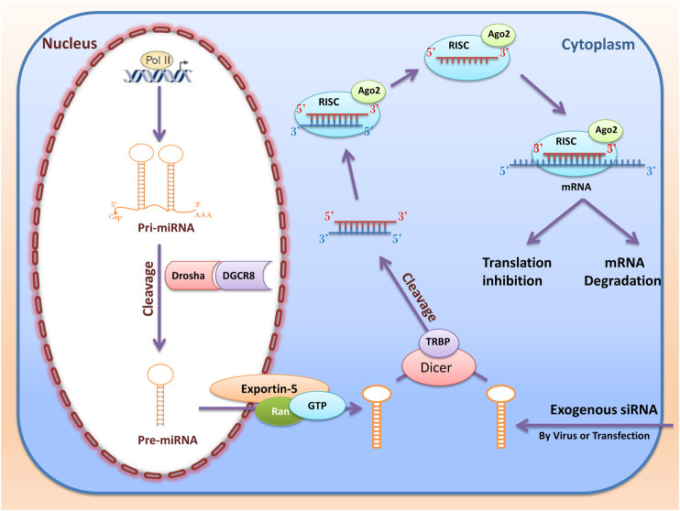
miRNAは、まずpri-miRNAとして核のゲノムから転写される。その後、pri-miRNAはDroshaとDGCRで切断され、pre-miRNAに変換される。その後、RanGTPとexportin 5によってpre-miRNAは核から細胞質へと運ばれ、DicerとTRBPによって切断される。最終的に、RISC複合体に入った後、成熟したmiRNAは標的mRNAに結合し、mRNAを破壊したり、翻訳を阻害したりして機能を発揮する。合成siRNAは、細胞内に挿入されると、細胞質内のDicerによって切断される。このdsRNAはRISCに入り、コールドが標的mRNAを見つけると、RISCとAgo2によってmRNAが切断される。
コロナウイルスに対するsiRNAの治療効果
合成siRNAは、約21~23bpの長さを持ち、転写後のレベルで遺伝子の発現を阻害することでその役割を果たす。miRNAとは異なり、各siRNAは特定の遺伝子に対して設計されているため、その遺伝子の発現を阻害することしかできない(Taxman er al)。2006)。siRNAは、まず長い二本鎖RNAとして細胞内に挿入された後、細胞質内でRNase III(Dicer)によって切断され、約21塩基対の小さなdsRNAとなる。このdsRNAは後にRISCに入り、一本鎖RNA(ssRNA)に変換される。RISCとsiRNAの複合体がmRNA上の特定の標的部位を見つけることができれば、mRNAを切断し、細胞内のエキソヌクレアーゼが侵入して標的mRNAを破壊することができる(Wu and Chan, 2006)。この種のRNAiは、HIV、Flock House Virus(FHV)C型肝炎ウイルス(HCV)B型肝炎ウイルス(HBV)などの多くのウイルスの複製や感染を抑える抗ウイルス剤として作用する可能性があることが研究で示されている(Hamasaki et al 2003,Liu et al 2017,Shahid et al 2017,Taning et al 2018)。これまでの研究で、siRNAがウイルスゲノムのさまざまな部分を標的にして、SARS-CoVの複製と感染を減少させることが示されている(図6A)。例えば、siRNAによってnsp1遺伝子(ヌクレオチド250~786まで)を標的にすることは、SARS-CoVを制御する最良の方法の1つである。なぜなら、ゲノムのこの領域を標的にすると、ウイルスの増殖、病原性、Vero E6細胞での複製が阻害されるからである(Ni er al)2005)。SARS-CoVの感染と複製を抑制するのに役立つもう1つの戦略は、ウイルスのSタンパク質やその特異的な受容体であるACE2を阻害することである。
図 6 miRNAと合成低分子干渉RNA(siRNA)を用いたSARSコロナウイルスの遺伝子発現の抑制
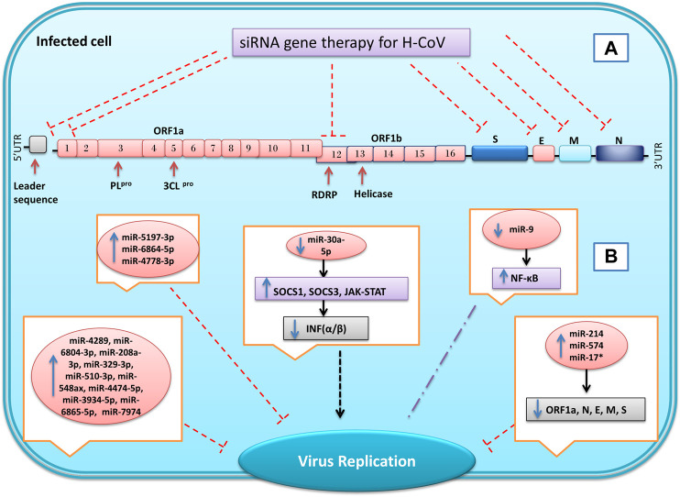
特定のsiRNAを設計することで、ウイルスの構造遺伝子や非構造遺伝子の発現を抑制し、ウイルスの複製や侵入を抑えることができる(A)。コロナウイルスの感染では、感染に応じて宿主細胞のマイクロRNAの発現が変化する。この変化には、感染に対する細胞の反応もあれば、ウイルスによって引き起こされるものもあり、最終的にはウイルスの複製や感染を減少または増加させることができる(B) 抑制
SARS-CoVのスパイクタンパク質は、標的細胞を識別し、ACE2宿主細胞受容体と相互作用するために必須のウイルス表面糖タンパク質である(Gallagher and Buchmeier, 2001)。Zhangらの研究によると、特異的なsiRNAを用いてSタンパク質の発現を阻害すると、Vero E6細胞および293T細胞におけるSARS-CoVのウイルス力価、感染、および複製を低下させることができることが明らかになった(Zhang et al 2004)。また、RNAi技術は、SARS-CoVの感染に対抗するために、宿主細胞表面でのACE2の発現を抑制する有用な手段である。ACE2は、肺のほか、気管支、腎臓、十二指腸、大腸、胃腸、心血管の細胞表面に発現している(Donoghue er al)。 Vero E6細胞株でsiRNAを用いてACE2タンパク質を阻害すると、重症急性呼吸器症候群関連コロナウイルスの複製、コピー数、感染を減少させることができた(Lu er al)2008)。Liらは,SARS-CoVに対するsiSC5(nsp12領域)およびsiSC2(スパイクタンパク)の効果を試験管内試験および生体内試験モデルで検討した。その結果、これらの2つのsiRNAは、FRHK-4細胞におけるウイルスの複製を阻害することで、アカゲザルに対する毒性作用を持たずに、ウイルス感染の影響や症状を軽減することができた(投与量は10-40mg/kg)(Li et al 2005a)。
スパイクタンパク質の構造は、ウイルスに感染しうる宿主細胞の種類を決定する。しかし、コロナウイルスの様々な株の間では、Sタンパク質のバリエーションが見られる。したがって、ウイルス感染を制御するための重要な戦略の1つは、様々なコロナウイルス間で保存されたゲノム領域を標的とすることである(Kuo et al 2000)。Wangらは、SARS-CoVの保存された配列に対して2つの特異的なsiRNAを使用することを試みた。その結果、RNAポリメラーゼをコードする2つの領域(14,450-14,468および15,877-15,895)を標的にすることで、RNAポリメラーゼ、Nタンパク質、3CLproの発現を抑制し、さらにウイルスの複製および細胞毒性効果を低下させることができた(Wang et al 2004)。2つのCOVID-19プロテアーゼのうち、パパイン様プロテアーゼをコードするnsp3配列はあまり保存されていないが、3CLproをコードするnsp5配列は高度に保存されており、COVID-19治療のためのsiRNAの潜在的な標的として選択することができる(Liu et al 2020)。
RdRP遺伝子は、ウイルスの複製に重要な酵素をコードしている。SARS-CoV-2では、この遺伝子はORF1bに645bpの長さで配置されており、高度に保存されていることが報告されているため、複数のsiRNAを標的とする可能性がある。また、RdRPの配列を調査した結果、この遺伝子は、ヒトの遺伝子や他のコロナウイルスとは遺伝的な類似性がないことがわかっている(Wu er al)。 Luらの研究では、特異的なsiRNAを用いることで、HeLaおよび239T細胞株におけるSARS-CoV RdRPの発現を90%以上低下させることができ、Vero E6細胞におけるプラーク形成の阻害につながることが示されている。したがって、その抑制はCOVID-19患者における適切な治療ターゲットと考えられる(Lu et al 2004)。このsiRNAは、他のコロナウイルスの必須遺伝子を標的とすることも可能である。例えば、Shiらは、3種類の異なるsiRNAを設計することにより、Vero E6細胞におけるSARS-CoVのN、E、およびM遺伝子の発現を低下させることができた(Yi et al 2005)。さらに、Vero E6細胞において、特異的なsiRNAを用いてリーダー配列を標的とすることにより、SARS-CoVの複製を阻害することができた(Li er al)。
これまでの研究で、RNAiには抗ウイルス作用があることが示されていたが、ウイルスがこの分子を利用することもできるようである。MERS-CoVは、ヒトとコウモリの両方の細胞株に感染することができた。しかし、その病原力と複製は、コウモリ(Eptesicus fuscus)細胞とヒト(A549,MRC5,Huh7)細胞株の間で異なっていた。ヒト細胞では、MERS-CoVはIRF3(INF β発現の重要な活性化因子)を阻害することで、コウモリ細胞とは異なり、自然免疫系のインターフェロン抗ウイルス応答をシャットダウンする(Banerjee er al)。
相補性回文小分子RNA(cpsRNA)は、哺乳類および無脊椎動物のウイルスが産生する小分子RNAの一群である。SARS-CoV(ORF3b)のゲノムには、SARS-CoV-cpsR-19と呼ばれるcpsRNAの起源となる配列が存在する。アポトーシスアッセイの事象から、SARS-CoV-cpsR-19は、カスパーゼ3およびBAX/BCL2比を増加させることにより、HeLa細胞のアポトーシスを誘導することができ、SARS-CoVの病原性において本質的な役割を果たしている可能性があることが示されている(Liu er al)。 一部のウイルス(エボラウイルスやA型インフルエンザなど)は、RNAサイレンシングのViral Suppressors(VSR)を利用することで、RNAiベースの免疫システムから自身を保存し、複製を促進できることが示されている。Cuiらの研究では、SARS-CoVのヌクレオカプシドタンパク質配列に、RNAiによる抑制を打ち消すショートヘアピンRNA(新規VSR)が存在することが示されている(Cui et al 2015)。さらに、Neuro-2a細胞でNタンパク質を過剰発現させると、Dicerを介したdsRNAの切断が効率的に阻害され、MHV-A59(Coronaviridae科のSARS-CoVの近縁種)ウイルスの複製と滴下を増加させる可能性がある。また、SARS-CoV-2(N)ヌクレオカプシドタンパク質は、免疫系からの逃避手段として機能し、その病原性に寄与する可能性がある。Nタンパク質は、コロナウイルスの中でもアミノ酸配列の相同性が高い(94%)。最近の研究では、SARS-CoV-2のNタンパク質がVSR活性を持ち、エフェクター(DicerによるウイルスdsRNAの認識と切断)とイニシエーション(siRNAの生合成)の両ステップでRNAiに拮抗することが示されている(Mu er al)。
マイクロRNA
miRNAは、22個のヌクレオチドの長さを持つ小さなノンコーディングRNAのグループである。これらの分子は、まず核のゲノム(エクソン、イントロン、遺伝子間領域)から 200ヌクレオチドから数千ヌクレオチドの長さを持つpri-miRNAとして転写される(Booton and Lindsay, 2014)。注目すべきは、それぞれのpri-miRNAが、複数の成熟miRNAの前駆体となりうることだ。次に、pri-miRNAの最初の処理は、RNase III(Drosha)とその補因子(DGCR)によって始まり、約60ヌクレオチドの長さを持つヘアピンであるpre-miRNAが形成される。次のステップでは、RanGTPとエキスポーティン5によって、核から細胞質へとpre-miRNAが輸送される。細胞質ではダイサーとTRBPが2回目の処理を行い、約22ヌクレオチドの長さの二本鎖RNA分子が作られる(Bartel, 2004)。最終的には、RISC複合体に入った後、片方のストリング(パッセンジャーストランド)が破壊され、成熟したmiRNA(ガイドストランド)が標的mRNAに結合できるようになる。miRNAは、mRNAを破壊したり、翻訳を阻害したりすることで、その機能を発揮する(Vazquez, 2006)。これまでの研究で、1つのmiRNAだけでも、その機能によって複数の異なる遺伝子の発現を制御できることがわかっている。一方、さまざまなmiRNAが同時に1つのmRNAの発現を制御することも可能である。しかし、これらの分子によって制御できるのは、ヒトの遺伝子の約60%である(Kalhori et al 2020)。Lecellier et al 2005)は、細胞内のmiR-32が、ウイルスのRNAゲノムを標的にすることで、霊長類フォアミーウイルス(PFV-1)のウイルス複製を減少させることができると初めて報告した(Lecellier er al)。
マイクロRNAによるコロナウイルスの自然免疫系、ウイルス複製、病原性の制御
自然免疫系は、ウイルスや細菌に対する身体の最初の防御システムである。このシステムの主要な細胞には、マクロファージ、樹状細胞、ナチュラルキラー細胞、単球、顆粒球などがある(Leon-Icaza er al)。 ウイルスは、複製を増やすために、INFα/βの産生を減らすことで宿主の自然免疫系を抑制する。例えば、日本脳炎ウイルス(JEV)デングウイルス(デングウイルス)エンテロウイルス71(EV71)は、感染細胞におけるmiR-146aの発現を高めることで、ウイルス感染に伴うINFα/βの過剰発現を抑制することができる(Wu et al 2013,Ho et al 2014,Sharma et al 2015)。また、ウイルスは、いくつかのmiRNAの発現や機能を阻害することで、自然免疫系を低下させることがある。例えば、オリゴデンドログリオーマ細胞において、ボルナ病ウイルス(BDV)は、その特異的なリン酸化タンパク質によってmiR-155の発現を阻害することができるため、ウイルス感染に応じたINF α/βの過剰発現を抑制し、自然免疫系を低下させることができる(Zhai et al 2013)。したがって、内在性免疫系の主要な抗ウイルス成分の一つは、1型インターフェロン(INF α/β)である。
コロナウイルスは、さまざまな戦略でウイルス感染に応じた免疫系の誘導を防ぐことができる。Maらは、α-コロナウイルスファミリーの一員である伝達性胃腸炎ウイルス(TGEV)に関する生体内試験および試験管内試験の研究で、このウイルスがmiR-30a-5pの発現をダウンレギュレートできることを示した。さらに、miR-30a-5pのINF負の調節因子(SOCS1,SOCS3,JAK-STATなど)に対する抑制効果を除去することで、IFN-Iシグナルカスケードを減少させ、ウイルスの複製が促進されることを見出した(Ma er al)。2018)。したがって、感染細胞におけるmiRNAの過剰発現は、自然免疫系を高める可能性があり、治療のためのアプローチとして考えられる。
miRNAが真核生物の遺伝子の制御に重要な役割を果たしていることは以前に報告されているが、その後の研究により、これらのナノ分子がウイルスの複製を変化させて感染を増減させることも明らかになった(図6B)。例えば、miR-122は、C型肝炎ウイルスの発症と複製に不可欠な役割を果たしている。このmiR-122は、ウイルスの安定性と複製を高めるために、ウイルスの5′非翻訳領域(NTR)に結合し、エキソヌクレアーゼによるRNAの分解を抑制する。そのため、Huh-7細胞でこのmiRNAをノックアウトすると、HCVの複製を抑えることができた(Jopling et al 2005)。一方、miR-32は、ヒトHEK-293T細胞株においてウイルスの遺伝子を標的とすることで、PFV-1の複製を負に変化させることができた(Lecellier er al)2005)。
ウイルスの中には、ゲノム中にmiRNAと類似した配列(ヘアピン)を持ち、宿主細胞やウイルスの遺伝子発現を制御するものがある(Grundhoff and Sullivan, 2011; Kincaid and Sullivan, 2012)。Hassanらの計算機的アプローチによる研究では、MERSのゲノムには、13種類のmiRNAの前駆体として機能する可能性のあるいくつかのヘアピンが存在することが示されており、これらはヒトのmiRNAと著しく類似していた。彼らの研究では、これらのうち10種類のmiRNA(miR-4289,miR-6804-3p、miR-208a-3p、miR-329-3p、miR-510-3p、miR-548ax、miR-4474-5p、miR-3934-5p、miR-6865-5p、miR-7974)は、ヒトや動物において特定の生物学的機能を持つことが全く知られていない。それでも、miR-18a、miR-628,miR-342-3pは、それぞれ皮膚の基底細胞がん(BCC)悪性神経膠芽腫、後期プリオン病に関連して、ヒトで生物学的役割を果たしていた(Hasan er al)2014)。数多くの研究や報告が、いくつかのmiRNAが抗ウイルス活性を持ち、インフルエンザ、HIV、HBV、ポリオウイルス(PV)に対して使用できることを示唆している(Sanghvi and Steel, 2012; Zhang et al 2013; Shim et al 2016; Hamada-Tsutsumi et al 2019)。一方で、ウイルスは宿主細胞内の遺伝子やmiRNAの発現プロファイルを変化させる可能性がある。例えば、PBMC細胞では、ヒトT細胞白血病ウイルス(HTLV-1)によってmiR-146aとmiR-130bがアップレギュレートされる(Bouzar and Willems, 2008)。
ヌクレオカプシド(N)タンパク質は、すべてのコロナウイルスで同じ機能を持つ構造タンパク質である。ヒトコロナウイルスCoV-OC43は、そのNタンパク質によってmiR-9の機能を阻害し、253T細胞のNF-κBの発現を増加させることができた。しかし、NF-κBのアップレギュレーションが、ウイルスの複製に適した反応なのか、ウイルスの複製に対する二次的な阻害要因なのかは不明である(Lai er al)。 SARS-CoVを気管支肺胞幹細胞(BASICs)に感染させると、このウイルスがmiR-574-5p、miR-214,miRNAs-17*の発現を2~4倍にアップレギュレートできることが明らかになった。さらに、これらのmiRNAを過剰発現させると、4つのウイルス構造タンパク質(E、S、M、N)とorf1aを標的として、SARS-CoVの複製を抑制することができた(Mallick er al)。 残念ながら、現在までに、COVID-19を阻害するRNAiの役割について、生体内試験および試験管内試験での研究はあまり行われておらず、ほとんどの研究はバイオインフォマティクスやin silico研究に基づいて行われている。Qingfei Paidu decoction(QFPD)には 2020年2月7日からCOVID-19の治療に使用されている21種類の漢方薬が含まれている。Chenらの分子ドッキング研究により、QFPDがCOVID-19の構造タンパク質および非構造タンパク質に結合できることが明らかになった。また、miR-183およびmiR-130A/B/301がQFPDの標的を予測しており、これらのマイクロRNAによるQFPDが抗SARS-CoV-2活性を発揮する可能性を見出した(Chen et al 2020a)。Khanらが行ったバイオインフォマティクスアプローチの研究では、SARS-CoV-1およびSARS-CoV-2による感染症において、いくつかのmiRNAが抗ウイルス性を持つ可能性があることがわかった。例えば、SARS-CoV-1ではmiR-323a-5p、miR-622,miR-198,miR-654-5p、SARS-CoV-2ではmiR-323a-5p、miR-20b-5p、miR-17-5pがORF1abとS領域を標的にして抗ウイルス作用を持つことが示されている(Khan er al)。
そのため、副作用の少ないmiRNAをCOVID-19の治療薬として使用できる可能性が高いと考えられる。COVID-19がある人には死をもたらし、ある人には短い症状しかもたらさない理由の1つは、miRNAの発現プロファイルの個人差にあると考えられる。その結果、マイクロRNAは最近、ウイルス感染の可能性を高めたり抑制したりする重要な因子として注目されている。私たちは、臨床研究や前臨床研究が、早く抗ウイルス剤として遺伝子治療に使えるようになることを願っている」。
おわりに
今日、全世界はCOVID-19と呼ばれるパンデミック疾患に悩まされており、多くの先進国や発展途上国で死亡者が出ている。人間の医学が進歩しているにもかかわらず、このウイルス性疾患に適した治療法はまだ見つかっていない。感染やウイルスの複製を制御するために分子や薬理学的手法を用いるには、ウイルスの感染や複製に関わる必須遺伝子を特定する必要がある。この病気の治療には2つの戦略が提案されている。最初のステップは、ウイルスがその特異的な受容体に付着するのを防ぐことで、ウイルスの感染を減らすことである。次のステップは、ウイルスの構造的および非構造的な遺伝子を阻害することで、ウイルスの複製を抑えることである。薬用植物や天然物は、化学薬品に比べて低コスト、低副作用、天然由来であることから、ウイルス感染症、特にCOVID-19の予防・治療に適した選択肢となる。これらの化合物は、その固有の特性により、多くの感染症や病気に対する効率を高め、宿主の免疫システムを強化することができる。COVID-19の治療において、これらの化合物は、ウイルスの宿主細胞の受容体への結合を抑制したり、構造遺伝子や非構造遺伝子の発現を阻害することで、ウイルスの感染や複製を抑えることができる。さらに、RNAi(siRNAおよびmiRNA)は、ウイルスの必須遺伝子を抑制したり、宿主の免疫系を誘導したりすることで、ウイルス感染、特にCOVID-19を抑制することができる。したがって、天然化合物とRNAiの同時使用は、SARS-CoV-2の治療とこのパンデミック肺炎の抑制に重要な役割を果たすと考えられる。
