Contents
The potential danger of suboptimal antibody responses in COVID-19
発行:2020年4月21日
COVID-19における最適ではない抗体反応の潜在的な危険性
岩崎亜希子、Yexin Yang
Nature Reviews Immunology volume 20, pages339-341 (2020)Cite this article
社会的ロックダウンから続く経済危機の拡大を緩和するために、SARS-CoV-2に対する有効な治療法とワクチンが切実に求められている。ワクチンはかつてないスピードで開発されており、安全性や有効性に関する前臨床試験を経ずに、すでに臨床試験が行われている。しかし、候補となるワクチンの安全性評価は見過ごせない。
SARS-CoV-2とSARS-CoVは、79.6%の配列同一性を持ち、同じ進入受容体(ACE2)を使用し、同様の急性呼吸器症候群を引き起こす。そのため、SARS-CoV-2のワクチンを開発する際には、SARS-CoVに対する免疫反応の研究から得られた重要な知見を考慮する必要がある。重要なのは、一般的に抗体価は防御の相関関係として用いられるが、SARS1患者では、高い抗体価と早期のセロコンバージョンが病気の重症度と相関関係にあることが報告されていることである。
抗体反応の質と量は、機能的な結果を決定する。高親和性の抗体は、特定のウイルスエピトープを認識することで、中和を引き起こすことができる(図1a)。中和抗体は、試験管内試験では、ウイルスの侵入、融合、脱出を阻止する能力によって定義される。生体内では、中和抗体は追加のメディエーターなしで機能するが、インフルエンザウイルスの中和にはFc領域が必要である2。SARS-CoVの場合、中和抗体がスパイク(S)タンパク質上の受容体結合ドメイン(RBD)を認識するなどして、宿主細胞上のACE2へのウイルスのドッキングが阻止される3。また、Sタンパク質を介したウイルスの融合は、ヘプタッドリピート2(HR2)ドメインを標的とした中和抗体によって阻止される3。さらに、中和抗体は、補体、食細胞、ナチュラルキラー細胞などの他の免疫成分と相互作用する。これらのエフェクター反応は、病原体の排除を助けることができ、食細胞の関与がSARS-CoVの抗体を介した排除を促進することが示されている4。しかし、まれに病原体特異的な抗体が病態を促進することがあり、これは抗体依存性増強(ADE)と呼ばれる現象である。
図1:コロナウイルスに対する抗体反応がもたらす可能性のある結果
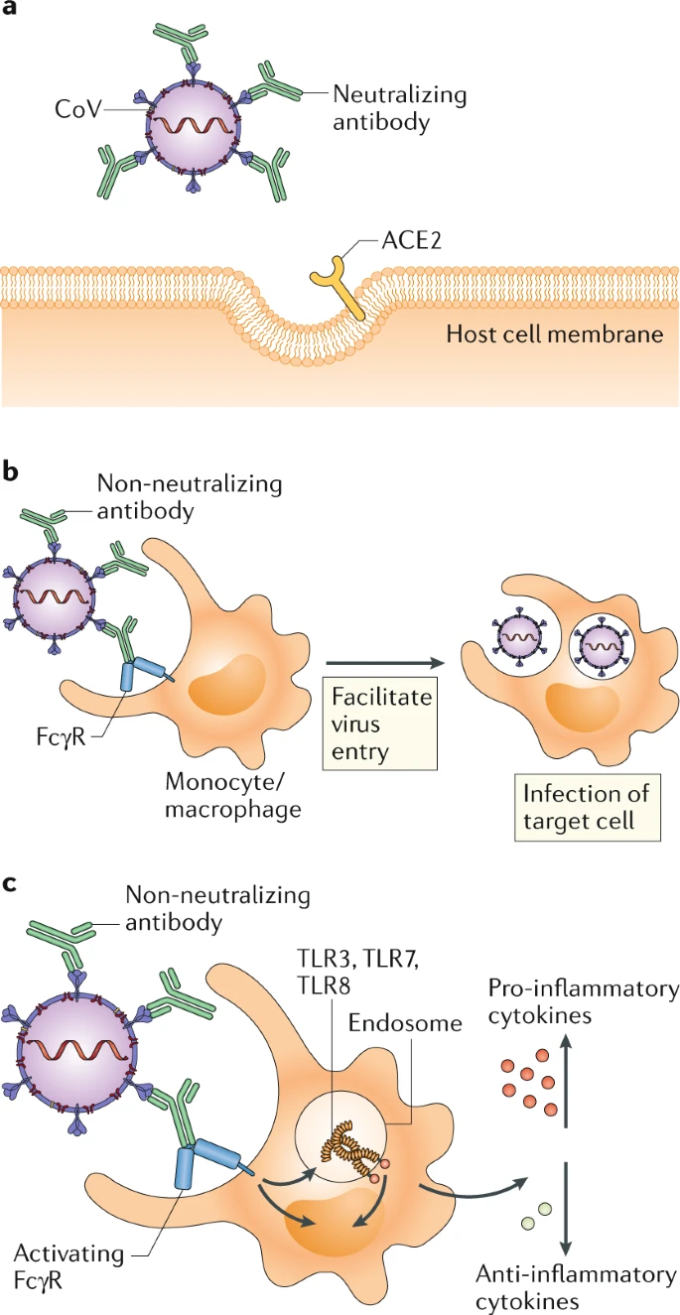
a|抗体を介したウイルスの中和では、ウイルスのスパイクタンパク質の受容体結合ドメイン(RBD)やその他のドメインに結合した中和抗体が、ウイルスが侵入受容体であるACE2にドッキングするのを阻止する。 b|抗体依存性の感染促進では、低質・低量の非中和抗体が、Fabドメインを介してウイルス粒子に結合する。単球やマクロファージに発現するFc受容体(FcR)は、抗体のFcドメインと結合し、ウイルスの侵入や感染を促進する。 c|抗体介在性免疫増強では、低品質で低容量の非中和抗体がウイルス粒子と結合する。抗体のFcドメインが結合すると、ITAMを持つ活性化FcRが炎症性サイトカインをアップレギュレートし、抗炎症性サイトカインをダウンレギュレートするシグナル伝達を開始する。エンドソーム内の免疫複合体やウイルスRNAは、Toll様受容体3(TLR3)TLR7,TLR8を介してシグナルを発し、宿主細胞を活性化し、免疫病理を引き起こす。
抗体依存性の増強
一般的に抗体は保護的で有益なものであるが、デングウイルスなどではADE現象が記録されている。SARS-CoV感染では、ADEは、単球、マクロファージ、B細胞などのさまざまな免疫細胞に発現するFc受容体(FcR)の関与によって媒介される5,6。そのため、既存のSARS-CoV特異的抗体は、FcRを発現する細胞へのウイルス侵入を促進すると考えられる(図1b)。このプロセスは、ACE2の発現、エンドソームのpHやプロテアーゼとは無関係であり、ACE2を介したウイルス侵入とFcRを介したウイルス侵入の細胞内経路が異なることを示唆している6。ADEが感染した宿主におけるSARS-CoVの拡散を促進するという証拠はない。実際、ADEを介してマクロファージに感染しても、ウイルスの生産的な複製や排出は起こらない7。むしろ、ウイルスと抗体の免疫複合体が体内に取り込まれると、FcRs5を介して骨髄系細胞が活性化され、炎症や組織傷害が促進される。この経路でエンドソームに導入されたウイルスは、RNAを感知するToll様受容体(TLR)のTLR3,TLR7,TLR8と結合すると考えられる(図1c)。SARS-CoVがADEを介してマクロファージに取り込まれると、TNFとIL-6の産生が上昇する(参考文献5)。SARS-CoVを感染させたマウスでは、ADEは、抗炎症性サイトカインであるIL-10とTGFβのレベルを低下させ、炎症性ケモカインであるCCL2とCCL3のレベルを上昇させた(参考文献8)。さらに、SARS-CoVの完全長のSタンパク質をコードする改変ワクシニア・アンカラ(MVA)ウイルスを非ヒト霊長類に免疫すると、肺胞マクロファージの活性化が促進され、急性肺傷害を引き起こした9。
保護抗体と病原体抗体
抗体がウイルスを中和して宿主を保護するのか、それともADEや急性炎症を引き起こすのかは、複数の要因によって決まる。その要因とは、抗体の特異性、濃度、親和性、アイソタイプなどである。SARS-CoVのSタンパク質とヌクレオカプシド(N)タンパク質をコードするウイルスベクターワクチンは、免疫したマウスにそれぞれ抗Sおよび抗N IgGを同程度に誘発する。しかし、再チャレンジ時には、Nタンパク質を免疫したマウスでは、炎症性サイトカインの分泌が著しく増加し、好中球や好酸球の肺浸潤が増加し、肺の病態が重篤化する8。同様に、Sタンパク質の異なるエピトープを標的とする抗体は、中和やADEを誘発する可能性が異なる場合がある。例えば、Sタンパク質のRBDドメインやHR2ドメインに反応する抗体は、非ヒト霊長類においてより優れた防御抗体反応を誘導するが、他のSタンパク質エピトープに特異的な抗体はADEを誘導する可能性がある10。In vitroのデータでは、FcRを発現している細胞では、抗体が低濃度で存在するとADEが発生し、高濃度域では減衰することが示唆されている。一方、抗体濃度を高めると、ウイルスの宿主細胞への侵入を阻止することで、SARS-CoVの中和が促進される6。他のウイルスでは、受容体の結合を阻害できる高親和性の抗体は、ADEを誘発しない傾向にある。
中和の「マルチプルヒット」モデルでは、ウイルス遮断効果は、ウイルスをコーティングしている抗体の数と相関しており、これは抗体の濃度と親和性によって総合的に影響を受ける11。ウエストナイルウイルス(WNV)のエンベロープ(E)タンパク質に対する親和性が高いモノクローナル抗体は、致死量のWNVを投与されたマウスに対して、より優れた防御効果を示した11。一定濃度の抗体と特定のターゲティングドメインを用いた場合、抗体がウイルスに結合する量は、抗体と抗原の相互作用の強さに依存する。この化学量論が中和の閾値を下回ると、ADEが誘発される。そのため、親和性の高い抗体は、低濃度で中和の閾値に達することができ、優れた防御効果を発揮する11。
抗体のアイソタイプは、そのエフェクター機能を制御する。IgMは補体を効率的に活性化するため、より炎症を起こしやすいと考えられている。IgGのサブクラスは、異なるFcRの関与によって免疫応答を調節する。ほとんどのFcγRはITAMを介してシグナルを送るが、FcγRIIbはその細胞質尾部にITIMを持ち、抗炎症反応を媒介する。FcγRIやFcγRIIIaではなく、FcγRIIaおよびFcγRIIbを異所性に発現させると、SARS-CoV感染時のADEが誘導される6。FcγRIIaの対立遺伝子多型はSARSの病態と関連しており、IgG1とIgG2の両方に結合するFcγRIIaアイソフォームを持つ人は、IgG2にしか結合しないFcγRIIaを持つ人よりも重篤な疾患を発症することがわかっている(参考文献12)。
ワクチンのアプローチ
どのようなワクチンやアジュバントがSARS-CoV-2に対する保護抗体反応を引き起こすことができるのかを見極めることは非常に重要である。これまでの研究では、不活化した全SARS-CoVをマウスに免疫した場合13,MVAにコードされたSタンパク質をアカゲザルに免疫した場合9,完全長のSタンパク質をコードしたDNAワクチンをマウスに免疫した場合14では、抗体産生の質と量が低いためか、ADEや好酸球を介した免疫病理がある程度誘発されることがわかっている。さらに、あるワクチンが高齢の宿主に対して安全かつ有効であるかどうかを考慮する必要がある。例えば、二重不活化SARS-CoVワクチンは、高齢マウスで中和抗体反応を誘導できなかった13。さらに、ミョウバンを添加した二重不活化SARS-CoVワクチンは、高齢マウスで高い抗体価を示したものの、IgGサブクラスがIgG2ではなくIgG1に偏り、Tヘルパー2(TH2)型の免疫反応、好酸球増多、肺病理と関連していた13。一方、マウスを用いた研究では、Sタンパク質のRBD内の特定のエピトープに抗体反応を集中させるサブユニットワクチンやペプチドワクチンが、防御的な抗体反応をもたらすことが示された3。また、弱毒化したSARS-CoVの生ワクチンは、高齢のマウスで防御的な免疫反応を引き起こした15。ワクチンの投与経路は、ワクチンの有効性にさらに影響を与える。SARS-CoVのRBDをコードする遺伝子組み換えアデノ随伴ウイルスワクチンを筋肉内に投与した場合と比較して、鼻腔内に投与した場合、肺の粘膜IgAの値が有意に高くなり、SARS-CoVにチャレンジした際の肺の病態が軽減された3。
おわりに
SARS-CoV-2ワクチンの開発を加速するために、世界中の研究者や研究機関が結集し、現在、複数のワクチン候補(核酸ワクチン、ウイルスベクターワクチン、サブユニットワクチンを含む)が前臨床試験や臨床試験の段階にある。COVID-19患者の抗体反応に関する最近の研究では、発症後のすべての時点で抗N IgMおよびIgGの力価が高いほど、病気の転帰が悪くなるとされている16。さらに、抗S、抗N IgGおよびIgMの高い力価は、臨床経過の悪化や高齢と相関しており17,一部の患者では抗体が有害な影響を及ぼす可能性が示唆されている。しかし、軽度のCOVID-19から回復した患者の70%は、測定可能な中和抗体を持っており、再来院時にも持続していた18。このように、病気の悪化ではなく回復に相関する抗体の特徴を研究することで得られた知見は、ワクチン研究で評価すべき抗体の種類に反映される。我々は、SARS-CoV-2に対する新たなワクチン候補の安全性評価において、ADEを十分に考慮すべきであると主張する。SARS-CoV-2に対処するためには、ワクチンに加えて、モノクローナル抗体を用いることも考えられる。ワクチンで作られた抗体とは異なり、モノクローナル抗体は分子レベルで正確に設計することができる。安全で効果的な中和抗体を大量に生産し、今後数ヶ月のうちに世界中の人々に届けることができるであろう」と述べている。
