Contents
The Pharmabiotic Approach to Treat Hyperammonemia
要旨
アンモニアは、哺乳類ではアミノ酸の異化から代謝廃棄物として常に生成されている。有害廃棄物代謝物であるアンモニアは、遊離アンモニアを尿素サイクルが尿素に変換する肝臓で分解される。肝臓の機能不全は高アンモニア血症を引き起こし、脳浮腫、痙攣、昏睡などの中枢神経系(中枢神経系)の機能不全を引き起こす。
現在の高アンモニア血症の治療法は、抗生物質やラクツロースなど、腸内でのアンモニアの産生や体内への吸収を減少させることを目的としたものであるが、副作用を伴うことが多い上に、効果がない。
近年、腸内細菌叢の改変が高アンモニア血症の治療に用いられる可能性があることを示すエビデンスが増加している。腸内マイクロバイオータの役割と腸の生理的特性を考慮すると、腸内マイクロバイオータの改変による腸内アンモニアの除去は、高アンモニア血症の治療に理想的なアプローチであると考えられる。
本総説では、高アンモニア血症とその関連疾患の意義と、現在の高アンモニア血症の管理法の有効性について考察し、人体におけるアンモニア輸送のメカニズムを理解することを目的としている。また、高アンモニア血症とその関連疾患の治療に腸内細菌叢をファーマバイオティクスとして利用する可能性についても検討した。
キーワード
高アンモニア血症、ファーマバイオティクス、アンモニア、腸内細菌叢
1. 高アンモニア血症とその関連疾患
ヒトの体内のアンモニアは、ほとんどが腸内でのタンパク質消化や細菌代謝の副産物として生成される[1]。腎臓と筋肉もまた、かなりの量のアンモニアを生成する。腎臓内では、アンモニウムは近位尿細管内のグルタミンから産生され、髄間層に濃縮され、血液循環系に放出されたり、尿中に排泄されたりして、プロトンの分泌を促進する[2]。飢餓状態や激しい運動によってブドウ糖濃度が低下すると、骨格筋はアミノ酸の異化作用によってアンモニアを生成することもある[3]。アンモニアの大部分はアミノ酸などの窒素化合物の生合成に再利用されるか、尿素サイクルによって尿素に変換され、残りのアンモニアは少量しか血中に放出されない。遊離アンモニアは、特に神経細胞に対して非常に毒性が強いため、アンモニアは肝臓の尿素サイクルによって急速に非毒性の尿素に変換され、最終的には尿中に排泄される。これにより、健康な成人では血中アンモニアは50μM以下の安全な濃度に維持されている[4]。遺伝性の尿素サイクル障害や肝臓疾患の場合、血中アンモニア濃度は上昇し、最終的には神経障害、肝性脳症、レイ症候群、および一部の中毒性脳症などの後続疾患を引き起こす[5]。
高アンモニア血症の直接的な結果は、気分および人格の変化、認知障害、運動失調、痙攣および昏睡を含む神経学的障害によって表される [6]。神経学的機能障害の重症度は、高アンモニア血症の慢性型または急性型、高アンモニア血症の程度、および患者の年齢に依存する。神経病理学的研究では、成人の高アンモニア血症患者ではアルツハイマー型II型アストロサイトーシスが認められたのに対し、先天性尿素サイクル関連遺伝子欠損児やReye症候群の高アンモニア血症では、常に脳萎縮、神経細胞喪失、脳浮腫を伴うことが明らかになった[6]。急速に進行する脳症であるReye症候群は、まれではあるが重篤な小児疾患である[7]。アスピリンが一般的に処方されていた頃は、小児やティーンエイジャーの間でははるかに一般的であったが、小児やティーンエイジャーへのアスピリンの処方に関する警告が出されてからは事実上消滅した[7]。米国では、医師の助言がない限り、19歳未満の人にはアスピリンを含むいかなる薬物も投与してはならないと勧告されている[8]。同様に、英国では、医師の助言がない限り、16歳未満の人にはアスピリンを投与してはならない[9]。
高アンモニア血症では、血液中のアンモニアが血液脳関門を通って脳に運ばれる。脳内に移動するフラックスは、気体のNH3の拡散と、チャネルやトランスポーターによるNH4+の媒介輸送の両方による可能性が高いが、これは血漿膜の交差を介してpHに直接影響を与えるだろう。さらに、NH4+はK+トランスポーター上でK+と競合し、膜電位に影響を与える。脳へのアンモニア濃度上昇の直接的な影響から、副次的な影響と脳症のカスケードが生じる [10]。
肝性脳症(HE)は、後天的な肝機能障害に続発する高アンモニア血症関連の合併症である。急性肝不全または慢性肝疾患、特に肝硬変に起因する重篤な合併症である。急性肝不全(ALF)患者では、肝硬変を発症し、その後、脳ヘルニアを伴う症候性脳浮腫(CE)を発症する。慢性肝疾患の患者では、MRIで脳水分量のわずかな増加が認められるものの、肝硬変を発症することはあっても、症状のあるCEはまれである[11]。
高アンモニア血症状態では、腎アンモニア産生が低下し、尿中への排泄量が増加する[12]。また、筋肉や脳は余分なアンモニアをグルタミンに変換する。正常な生理学的条件下では、グルタミンは神経細胞で脱アミノ化されてグルタミン酸になり、小胞に貯蔵された後、シナプス裂け目に放出され、N-メチル-d-アスパラギン酸(NMDA)受容体と結合して興奮性信号を開始する。グルタミン酸はその後、興奮性アミノ酸トランスポーター-2(EAAT-2)によってシナプス裂け目から除去され、アストロサイトによってグルタミンにリサイクルされ、その結果、グルタミン酸とグルタミンの機能的コンパートメント化が行われる[13](図1)。
図1 アストロサイトにおけるグルタミン合成酵素(GS)によるアンモニア除去と「グルタミン酸-グルタミンサイクル」の重要なステップ
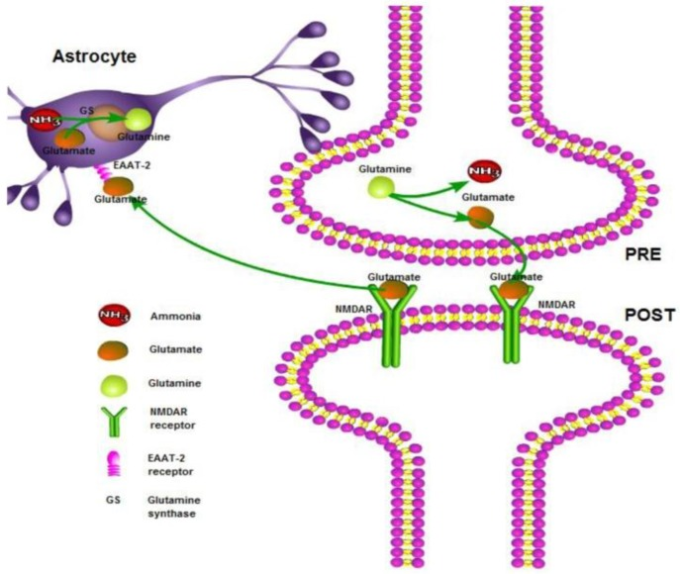
グルタミン酸はシナプス前ニューロン(PRE)からシナプス裂け目に放出され、シナプス後(POST)のNMDAR受容体に作用する。過剰なグルタミン酸は、グルタミン酸受容体EAAT-2を介してアストロサイトによって取り込まれる。
脳内のアンモニア濃度が急速に上昇すると、アストロサイトにあるグルタミン合成酵素がアンモニアからグルタミンを急速に合成し、脳内のグルタミン産生の過剰を引き起こして、ニューロンとアストロサイトの間の共生関係を混乱させる可能性がある[14]。このような変化は、アストロサイトの体積の変化をもたらし、興奮性物質と抑制性物質の細胞外濃度の上昇をもたらす。その後の細胞内浸透圧の上昇はまた、アストロサイトの腫脹と損失を引き起こす可能性がある[15]。アストロサイトの形態学的変化に加えて、脳アンモニア濃度の上昇は、グリア線維性酸性タンパク質、グルタミン酸、グリシン輸送体、および「末梢型」ベンゾジアゼピン受容体などのアストロサイトタンパク質の発現レベルをも変化させる[16]。その結果、腫瘍壊死因子α、インターロイキン-1,インターロイキン-6,インターフェロンなどの炎症性サイトカインがアストロサイトから放出される[16]。また、アンモニアはアストロサイトにおけるエネルギー産生機構にも影響を与える。アンモニアはα-ケトグルタル酸デヒドロゲナーゼまたはオキソグルタル酸デヒドロゲナーゼを阻害し、グルタミン合成に使用されるカルボン酸の枯渇はクレブスサイクルを麻痺させる。クレブスサイクルにおけるアデノシン5′-三リン酸およびニコチンアミド・アデニンジヌクレオチド(還元型)の産生が減少し、ピルビン酸の乳酸への変換が増加する[17]。アストロサイトにおける乳酸値の上昇は、脳浮腫の発症に関連していた。アストロサイトにおけるグルタミン酸受容体の発現低下は、グルタミン酸の増加を引き起こし、場合によっては発作を引き起こす。さらに、脳血流が増加し、脳の自己調節機能が失われ、脳浮腫や頭蓋内高血圧症(ICH)を発症する可能性がある[18]。
2. 高アンモニア血症の現在の治療法
高アンモニア血症を治療するための現在の治療選択肢は、アンモニア産生とその消化管(GI)での吸収を減少させるか、N-カルバミルグルタミン酸による治療または尿素サイクル中間体とグルタミン合成の補充による尿素産生のアップレギュレーションによるアンモニア除去の活性化のいずれかを目標としている(図2)[19]。まず、肝疾患と先天性尿素サイクル障害の両方に起因する高アンモニア血症の現在の標準的な治療法を取り上げる。さらに、臨床試験で有望視された治療法や、試したが効果がなかった治療法についても簡潔に述べる(表1)。
図2 アンモニアは肝臓と腸の間を移動する。

肝臓では、アンモニアは尿素サイクルを経て無害化され、尿素を生成し、腎臓で排泄されたり、腸に運ばれたりする。消化管内に存在する細菌はウレアーゼを産生し、尿素を加水分解して二酸化炭素とアンモニアに変換する。また、小腸や大腸の腸球もグルタミナーゼによるグルタミンの脱アミノ化によりアンモニアを生成する。その後、腸由来のアンモニアは、(i)腸内細菌によってタンパク質合成に利用され、(ii)門脈の主な供給源である腸管血管に再吸収され、肝臓にプールされて内因性解毒され、(iii)糞便中に排泄される。
表1 高アンモニア血症の現在の治療法
| 薬の名前 | 薬名 | 作用機序 | 欠点 | Ref。 |
|---|---|---|---|---|
| ラクツロースA | Enulose | 結腸内容物の酸性化、浸透圧の増加、カタルシス効果 | カスタマイズされた薬の投与量、腹部のけいれん、膨満、鼓腸、電解質の不均衡 | [ 20、21 ] |
| リファキシミンa | Xifaxan | 腸内細菌におけるRNA合成の阻害 | 高コスト、吐き気、膨満感、下痢、抗生物質耐性 | [ 22、23 ] |
| 安息香酸ナトリウムA | アンモヌル | グリシン分解を減らし、グリシン除去を増やします | 頭痛、吐き気、精神状態の障害 | [ 24、25 ] |
| ナトリウムフェニル酢酸/フェニルA | ブペニル | グルタミン分解を減らし、グルタミン除去を増やします | 高血圧症の患者のための合併症。 | [ 26、27、28 ] |
| l-アルギニンa / l-シトルリンa | l-アルギニン/ l-シトルリン | 尿素サイクルの活性化 | 胃腸障害、血漿シトルリンの増加、下痢 | [ 29、30 ] |
| カルグルミン酸a | カルバグラム酸 | N-アセチルグルタミン酸の回復による尿素サイクルの活性化 | 悪寒、体の痛み、インフルエンザの症状、口や喉の痛み | [ 31、32、33 ] |
| アルブミンベースの透析 | プロメテウス®、ヘパウォッシュ®、MARS | アルブミン結合物質の除去 | 軽度の血小板減少症 | [ 34 ] |
| 腹膜透析A | 血管系から腹腔にアンモニアを輸送することによる血中アンモニアの減少 | 軽度から中等度の吐き気と嘔吐 | [ 35、36 ] | |
| ネオマイシンb | ネオマイシン | 腸内細菌におけるタンパク質合成の阻害 | 耳毒性、神経毒性、腎毒性 | [ 37 ] |
| メトロニダゾールb | メトロニダゾール | 腸内細菌における核酸合成の阻害 | 耳毒性、神経毒性、腎毒性 | [ 38、39 ] |
| グリセロールフェニルブチレートb | ラヴィッチ | グルタミン分解を減らし、グルタミン除去を増やします | 下痢、鼓腸、頭痛 | [ 40、41 ] |
| l-オルニチンフェニル酢酸b | l-オルニチンフェニル酢酸 | 尿素サイクルの活性化、グリシンとグルタミン合成の活性化は、グリシンとグルタミンの除去を増加させます | 重度の胃のけいれんと下痢 | [ 42、43 ] |
| l-オルニチン/ l-アスパラギン酸b | l-オルニチン/ l-アスパラギン酸 | 尿素サイクルの活性化 | 重度の胃のけいれんと下痢 | [ 44、45、46 ] |
| l-カルニチンb | l-カルニチン | 尿素サイクルの活性化 | 吐き気、胃の不快感 | [ 47、48 ] |
| 分枝鎖アミノ酸(BCAA)b | グルタミン分解を減らし、グルタミン除去を増やします | 血中アンモニアの増加 | [ 49、50 ] | |
| バイオ人工肝臓サポートシステムc | AMCバイオ人工肝臓®、Excorp ®、HepatAssist ® | 肝臓の代謝活動のサポート | 動脈のアンモニアのわずかな減少、出血 | [ 51、52 ] |
| 肝細胞移植c | 尿素サイクルの活性化 | 門脈血栓症、体循環への肝細胞のシャント、ドナー臓器の不足 | [ 53、54、55 ] | |
| 幹細胞移植c | HepaStem ® | 尿素サイクルの活性化 | 短時間の効率、自己免疫反応 | [ 56、57、58 ] |
| アデノウイルス関連遺伝子送達c | オルニチントランスカルバモイラーゼ/アルギナーゼ1遺伝子送達 | 尿素サイクルの活性化 | ウイルスデリバリーシステムの安全性の問題、短時間の効率 | [ 59、60 ] |
尿素サイクル:尿素サイクル;a 標準治療薬;b 代替治療薬;c 研究中の治療薬。
2.1. 高アンモニア血症の標準治療薬
非吸収性二糖類は、高アンモニア血症患者の第一選択療法である[20]。最良の例は、フルクトースとガラクトースの単糖からなるラクチュロースである。ラクトースは大腸内で大腸菌の ß-ガラクトシダーゼによって乳酸、ギ酸、酢酸に完全に代謝され、大腸内の酸性化と浸透圧の上昇を引き起こす。ラクトロース代謝による大腸の酸性環境は、ウレアーゼ活性菌の増殖を抑制する一方で、耐酸性のある非ウレアーゼ菌の増殖をサポートしている[61]。浸透圧の上昇はカタルシス効果をもたらし、体内に吸収される前にアンモニアを体外に引き出す[20,21]。しかし、ラクチュロースは、腹部けいれん、鼓腸、膨満感、電解質アンバランスなどの重篤な副作用が認められており、臨床治療での投与量を決めるのは困難である。

リファキシミンは、その安全性、有効性、忍容性から高アンモニア血症の治療に最も有効な抗生物質として選択されるようになった[62]。リファキシミンは、非吸収性のピリドイミダゾール環が付加された結果、非全身性のGI部位特異的な抗生物質である。しかし、それはグラム陰性菌の細胞壁を横断する可能性を保持し、細菌のDNA依存性RNAポリメラーゼ酵素のβサブユニットに結合することによってRNA合成を阻害する[63] 高アンモニア血症治療におけるリファキシミンの有益な効果は、いくつかの臨床試験によって示されている[22,23,64]。しかし、肝硬変を有する高アンモニア血症患者では、リファキシミンのごく一部しか肝臓で排泄されないため、蓄積のリスクが高まっていた。リファキシミンの最も一般的な副作用は、吐き気、腹部膨満感、下痢である[65]。
安息香酸ナトリウムは、肝臓、腎臓、脳のグリシン代謝を減少させることにより、血中アンモニウム濃度を減少させる。安息香酸はコエンザイムA(CoA)と統合し、肝細胞のミトコンドリアでベンゾイル-CoAを形成する。その後、ベンゾイル-CoAはCoAエステルのベンゾイル部位をグリシンに転移させ、ヒプール酸を生成する。このプロセスは、肝臓、腎臓、および脳におけるアンモニア形成代謝経路によるグリシンの分解を阻害する[24,25,66]。

フェニルアセテート/フェニル酪酸ナトリウムは、肝臓でグルタミンと共役し、腎臓でフェニルアセチルグルタミンとして排泄されるフェニルアセテートに急速に酸化される。フェニルアセテートはフェニルアセチルグルタミンの尿中産生を有意に増加させるが、グルタミン刺激によるアンモニア生成を阻害する[67,26]。最近の研究では、フェニルアセテートがグリシン由来のアンモニアを排除するグリシンと共役する新規な経路を示唆している[27]。フェニル酢酸ナトリウムやフェニル酪酸ナトリウムの経口投与は、1日のナトリウム摂取量を超えて高血圧患者に合併症を引き起こす可能性がある[28]。
安息香酸ナトリウムとフェニル酢酸ナトリウムの併用療法は、血漿アンモニア濃度を低下させ、急性高アンモニア血症を有する尿素サイクル障害(UCD)患者の高い生存率に寄与し、頭痛、吐き気、および精神状態の悪化からなる許容可能な副作用プロファイルを有する[68]。
l-アルギニンとl-シトルリンは、それぞれ尿素サイクル(尿素サイクル)の主生成物と中間生成物であり、l-アルギニンは、l-シトルリンとアルギニノスクシネートの産生を増加させることによってアンモニアの除去を増加させる[29,30]。l-シトルリン投与は、N-アセチルグルタミン酸合成酵素およびカルバモイルリン酸合成酵素-1欠損症におけるl-アルギニンレベルを回復させ、尿素サイクルをサポートする[30]。尿素サイクルを再活性化し、血中アンモニウムレベルを低下させるために、l-アルギニンまたはl-シトルリン投与はUCDに不可欠である;しかし、主な欠点は、肝硬変患者における急性GI出血である[69]。

カルグルミン酸はN-アセチルグルタミン酸(NAG)の合成構造類似体であり、アンモニアの除去を担う尿素サイクルにおけるカルバモイルリン酸合成酵素1(CPS-1)を活性化する。NAG合成酵素が先天的に欠損している患者では、その投与が不可欠である[31,32,33]。CPS-1の重要な補酵素として、N-カルバミルグルタミン酸(NCG)は、残存するCPS-1を刺激するために、部分的なCPS-1欠乏症患者に使用することができる[70]。プロピオン酸血症やメチルマロン酸血症などの先天的な代謝障害に起因する新生児高アンモニア血症に対するNCG投与は、症例研究でアンモニアの減少に有効であることが示されている[71,32]。プロピオン酸やメチルマロン酸はNAG合成を阻害し、尿素サイクルの最初の酵素であるCPS-1欠損症を引き起こす[72]。しかし、NCGの投与により尿素合成が活性化され、血中アンモニアとグルタミンが減少した[73]。
アルブミンベース透析(ABD)は、集中治療医学、特に急性肝不全の治療の常用部位と考えられている[34]。アルブミンベースの透析システムには、膜技術と吸着技術の両方があり、アルブミンコーティングされた膜に対して血液透析を行い、次にアルブミンが豊富な溶液に対して血液透析を行い、次いでカラムに吸着して水溶性およびアルブミン結合性の有害物質を除去することで構成されている[74]。透析に基づく治療のモダリティは、急性肝不全患者の血清アンモニア値を有意に改善した[75,76,77]。
腹膜透析は、腹膜をフィルターとして使用する体腔内透析法である。半透膜性の腹膜により、溶質や水が血管系から腹膜腔内に輸送されるようになる[35]。体外透析は腹膜透析よりも効果的であるが、迅速な介入が重要な場合には迅速かつ簡単に設定できるため、先天的な尿素サイクルエラーによる高アンモニア血症の治療には依然として有効な治療法である[36,78,79]。
2.2. 代替治療薬
高アンモニア血症の治療には多くの薬剤が使用されてきたが、その使用を裏付けるデータは限られている。しかし、これらの薬物のほとんどは、証明された有効性が限られているにもかかわらず、安全に使用することができる。
ネオマイシンおよびメトロニダゾールは、肝臓疾患に起因する高アンモニア血症の設定で歴史的に使用されてきた[80]。抗生物質の投与は、腸内のウレアーゼ産生細菌の増殖を阻害することが示唆されており、その結果、アンモニア産生を減少させ、GI管を介した吸収を防止する。ネオマイシンは30Sリボソームサブユニットに結合し、細菌の増殖に不可欠なタンパク質の合成を阻害するアミノグリコシド系抗生物質である[37]。しかし、その臨床使用は、全身曝露後のオト、神経、および腎毒性を含む重篤な副作用のために衰退している[81]。メトロニダゾールは嫌気性細菌のための選択的抗菌薬であり、DNAに結合して細菌の核酸合成を阻害し、細菌の細胞死をもたらす能力があるため、ネオマイシンと同様に有効であることがわかっている。しかし、メトロニダゾールの長期使用は、その副作用のために制限されている[38,39]。
グリセリンフェニル酪酸は、膵リパーゼによって徐々に加水分解され、その結果、GI管内でフェニル酪酸(PBA)の遅延放出をもたらすプロドラッグである。PBAはフェニル酢酸(PAA)へのβ酸化を受け、肝臓および腎臓で酵素フェニルアセチル-CoA:l-グルタミン-N-アセチルトランスフェラーゼを介してグルタミンと共役してフェニルアセチルグルタミン(PAGN)を形成し、腎臓によって放出される[67]。グリセロールフェニル酪酸はHE患者において血漿アンモニアの低下に成功しており、高血圧患者にはより適していることが約束されている[40,41]。
l-オルニチンフェニル酢酸塩は、肝臓における尿素サイクル(尿素サイクル)を活性化する塩の形でl-オルニチンとフェニル酢酸塩の両方を含んでいる[42,43]。正常な状態では、l-オルニチンはグルタミン合成酵素の基質として作用し、それによってアンモニアをグルタミンに無害化する。その後、フェニルアセテートは過剰なグルタミンと結合してフェニルアセテートグルタミンとなり、腎臓から分泌される。しかし、l-オルニチンまたはフェニル酢酸単独ではHEを効果的に治療することはできないが、フェニル酢酸-l-オルニチンはグルタミンの腸内合成を改善することにより、腸管グルタミナーゼ活性およびその発現を効果的に低下させ、それにより動物モデルにおいて脳動脈アンモニアレベルおよび細胞外アンモニアを低下させることができる[82,83]。肝硬変患者におけるl-オルニチン-フェニルアセテートの静脈内投与は、尿中のフェニルアセチルグルタミンの漸増を伴う血漿アンモニアおよびグルタミンレベルの低下を誘導した[84]。
l-オルニチン-l-アスパラギン酸は、残存肝細胞におけるアンモニア解毒代謝経路を燃料とする。残存肝細胞は、肝臓の機能的能力を高めるために生理的要求に応じて新世代の肝細胞を生成することができる前駆体肝細胞であり、l-オルニチンはオルニチンアミノトランスフェラーゼによってグルタミン酸セミアアルデヒドに変換され、その後グルタミン酸に変換される。最後に、グルタミン酸はグルタミンに変換され、これはグルタミン合成酵素によってアンモニア1分子を無害化する[85,44]。l-オルニチン-l-アスパラギン酸塩の静脈内投与および経口投与は、HE患者における静脈アンモニア値および認知能力の改善に成功した[45,46]。しかし、急性肝不全患者を対象とした臨床試験では、標準治療と比較して動脈アンモニア値の改善は認められなかった[86]。
アミノ酸の代謝産物であるl-カルニチンは、ペルオキシソーム膜やミトコンドリア膜を介した短鎖脂肪酸の輸送に関与することで、尿素サイクル酵素を活性化し、フリーラジカルの除去を増加させる[47]。l-カルニチンによる治療では、血中アンモニアが有意に減少し、患者の精神状態が改善された[48,87]。

バリン、ロイシン、イソロイシンなどのBCAAs(分岐鎖アミノ酸)は、分岐鎖アミノトランスフェラーゼを介してα-ケトグルタル酸と相互作用し、グルタミン酸と分岐鎖α-ケト酸を形成する。グルタミン酸は、グルタミン合成酵素を介してアンモニア分子を取り込むことでグルタミンに変換する[49]。しかし、BCAAを投与すると、筋肉のアンモニア代謝が活性化されるため、健常者でも肝硬変患者でも血中アンモニアが増加した[50]。
2.3. 検討中の治療薬
バイオ人工肝臓サポートシステムは、肝臓の代謝活動を再現したモデルシステムである。それらは、VTL C3A細胞株のような肝細胞機能を持つ細胞を含む複数の中空糸カートリッジを介してろ過を追加した従来の血液透析に類似している[51]。コントロールされた臨床試験では、バイオ人工肝システムは急性肝不全患者に有効性を示したが、動脈アンモニアは対照群と比較して有意な変化を示すことができなかった[52]。
UCDにおける肝細胞移植を介して不足している酵素を移植するためには、細胞治療が適切な戦略であるかもしれない[53]。ドナーの肝実質細胞画分から肝細胞を培養し、オルニチン・トランスカルバミラーゼ欠損症(OTCD)と診断された新生児に移植した。移植後、タンパク質不耐症は改善され、代謝危機は観察されなかった。別の同様の試験では、おそらく免疫抑制が不十分なために移植された細胞が拒絶反応を起こしたために、臨床検査パラメータはわずかにしか改善されなかったことが示されている[54,55]。しかし、肝細胞の利用可能性は、利用可能な肝臓の希少性によって制限されているため、幹細胞の利用が検討されている。造血幹細胞、脂肪由来幹細胞、羊膜上皮細胞、臍帯血細胞などは、生体内で増殖・分化して肝細胞様細胞へと分化する能力があることから、肝幹細胞移植に適した候補として検討されている[56]。しかし、患者の臨床表現型を改善するのに十分な量の細胞をどのように送達するか、また送達方法はまだ明らかになっていない[57,58]。
機能的な酵素をコードする遺伝子を導入した遺伝子治療は、原発性UCD患者の尿素サイクル活性の回復を約束する。アデノ随伴ウイルスベクターを介したオルニチントランスカルバモイルラーゼおよびアルギナーゼ1遺伝子の送達は、マウスモデルにおいて表現型の補正に成功したが、遺伝子送達システムの安全性およびヒト臨床試験における長期的な有効性は困難であった[59,60,88]。
3. 高アンモニア血症を管理するための今後の方向性 薬物学的アプローチ
消化器系は、腸-肝臓軸と呼ばれる肝臓と密接な関係を持っている。腸内微生物の代謝産物は門脈で腸壁を通って吸収され、ろ過と解毒のために肝臓に運ばれる。一方、肝臓は胆嚢に貯蔵・濃縮された胆汁酸を分泌し、その活動を調節して腸内に分泌する。腸、特に大腸には多くの微生物が生息している。微生物の細胞数は宿主の細胞数とほぼ同等かそれ以上である[89,90]。腸内には300~500種類近くの微生物が存在している。Neishの研究によると、終末回腸と大腸には10^9個のコロニー形成単位(CFU)/mLと10^12個のCFU/mLの細菌が存在するとされている[91]。腸内細菌は、必須栄養素の供給、ビタミンKの合成、セルロースの消化補助、血管新生や腸管神経機能の促進など、人間の健康に重要な役割を果たしている[92]。
微生物の種類と量の大幅な変化は、アンモニアの産生と腸管免疫系の機能に影響を与える。アンモニアは腸管腔および体液中を移動することができるので、乳酸菌種のような腸内微生物種による腸内アンモニアの除去は、血中アンモニア濃度を低下させ、健康を改善する可能性がある。現在のファーマバイオティクスによるアプローチを(表2)に示す。
表2 高アンモニア血症治療のためのファルマバイオティクスによるアプローチの検討
| 細菌種 | 作用機序 | 承認された適応症 | Ref。 | |
|---|---|---|---|---|
| プロバイオティクス | ラクトバチルスプランタルム | 腸内の直接アンモニア消費 | 急性または慢性肝不全におけるマウスの生存率の増加と血中および糞便中のアンモニア濃度の低下、急性肝不全マウスモデルにおける大脳皮質の星状細胞の腫れの減少 | [ 93 ] |
| Lactobacillus helveticus NS8 | 5-HT神経系を調節し、免疫系の恒常性を維持します | 認知機能低下と不安様行動を改善する | [ 94 ] | |
| ラクトバチルスアシドフィルス | 腸内細菌叢を変更します | 肝硬変および認知能力の改善におけるMHEの治療 | [ 95 ] | |
| エンテロコッカスフェシウムSF68 | タンパク質負荷に対する耐性を高め、アンモニアレベルを下げ、神経学的症状を改善します | 肝硬変およびグレード1〜2の肝脳症の患者の長期治療、および精神状態と精神測定能力の改善 | [ 96 ] | |
| ラクトバチルスラムノサスGG(LGG) | LGGは、腸粘膜に付着し、病原体に対する上皮機能を促進し、他の有益な微生物叢を促進し、可溶性分子のクロストークを通じて宿主の免疫系を刺激する能力を持っています。 | 改善された腸内マイクロバイオーム-メタボローム結合による内毒素血症の減少および腸内毒素症の減少 | [ 97 ] | |
| ラクトバチルスプランタルムNCU116 | 脂質生成のダウンレギュレーションと脂肪分解および脂肪酸酸化関連遺伝子発現のアップレギュレーション | 肝機能、酸化ストレス、脂質代謝の改善 | [ 98 ] | |
| プロバイオティクス混合物 | VSL#3(Bifidobacteriumsp。Lactobacillussp。Streptococcusthermophilus) | VSL#3は、腸内細菌叢-短鎖脂肪酸(SCFA)酪酸ホルモン軸を調節することができます。 | 動脈のアンモニアレベルをわずかに低下させ、臨床症状を改善し、HEエピソードのリスクを低下させます | [ 99 ] |
| シンバイオティック | Pediacoccus pentoseceus Leuconostoc mesenteroides Lactobacillus paracasei subspecies paracasei 19 Lactobacillus plantarum2592発酵性繊維 | 病原体の腸外転座に影響を与え、病原体の発生率を低下させ、ウレアーゼを産生しないラクトバチルス属菌。増加する | 血中アンモニアレベルの大幅な低下とMHE患者の50%の逆転 | [ 100 ] |
MHE:最小肝性脳症。
3.1. プロバイオティクスとシンバイオティクスのアプローチ
プロバイオティクスは、宿主の健康に有益な影響を与えることを目的としている。プロバイオティクスの最も一般的な菌株は、乳酸菌、ラクトコッカス・ラクティス、ストレプトコッカス、ビフィズス菌などの乳酸菌、またはサッカロミセス・セレビシエなどの酵母である。また、プロバイオティクスの菌株としては、エンテロコッカス属、ペディオコッカス属、ロイコノストック属、バチルス属、大腸菌などを用いることができる。プロバイオティクスは、多くの機能性発酵食品の生物学的成分として一般的に使用されており、すべてのプロバイオティクス種の最も重要な相乗効果は、未吸収糖の発酵であるように見える。プロバイオティクスはまた、バクテリオシンやナイシンのような抗菌性化合物の産生により病原体を抑制するため、抗菌活性を有している。さらに、プロバイオティクスは乳酸による細菌のウレアーゼ活性を阻害するため、門脈血中のアンモニアの総量を減少させる役割もある[100,101]。また、プロバイオティクスは腸管透過性や細菌ウレアーゼの分泌を低下させ、アンモニアの排泄を増加させ、腸管上皮細胞の栄養状態を改善する。ほとんどのプロバイオティクスは腸内のpHを低下させる酸を産生するため、アンモニアの吸収も低下する。さらに、プロバイオティクスは肝細胞の炎症や酸化ストレスを軽減するため、アンモニアの肝クリアランスが増加し、他の毒素の取り込みが減少する。特定のプロバイオティクスを経口摂取することで、肝硬変患者の非ウレアーゼ産生菌の増殖を促進し、肝硬変で見られる大腸菌のアンバランスを逆転させることが報告されている[102]。プロバイオティクスは3ヶ月後、特に長期治療でHE患者の血漿アンモニア濃度を平均7μmol/L低下させるように思われた[103]。しかし、臨床では、回復率、死亡率、患者の入院期間の長さに関する改善の正確なエビデンスが不足している[103]。
Charles NicaiseとDeborah Prozziの研究では、スパースファーマウスを構成性高アンモニア血症モデルとして用い、慢性肝不全マウスモデルでは、ラクトバチルス・プランタルムの投与によりアンモニアを効率的に減少させた[93]。マウスのチオアセトアミド誘発性急性肝不全モデルでは、プロバイオティクスはマウスの生存率を有意に増加させ、血中および糞中アンモニア濃度を低下させた[93]。乳酸脱水素酵素(LDH)の不活化とアラニン脱水素酵素(AlaD)遺伝子のノックインにより、アンモニアを過剰消費する株が構築された [93,104]。この過消費株は、ピルビン酸をアラニンに変換するAlaDを介してアンモニアを利用することができ、LDHの不活化はピルビン酸の乳酸への変換を防ぐことができた。この高アンモニア消費株は、高アンモニア血症の治療において、低用量で野生型と比較して高い有効性を示した[104]。急性肝不全マウスモデルでは,血中アンモニア濃度の低下により生存率が改善され,大脳皮質のアストロサイトの腫脹が減少した。また、アンモニアの調節は、アンモニウムトランスポーターAmtBを欠損した株を投与した後に廃止された[93,105]。この研究は、プロバイオティクス株L. plantarumが腸内環境の変化ではなく、アンモニアを直接消費することでアンモニアの減少に寄与していることを示している[93]。
先行研究では、ラクトバチルス・アシドフィルスの投与が腸内フローラを修飾することで肝性脳症の治療に利用できることが示されている[95]。
また、Enterococcus faecium SF68は、肝硬変およびグレード1-2の肝性脳症患者の長期治療に使用された[96]。プロバイオティクスは腸内マイクロバイオータの組成を変化させるだけでなく、炎症の特定のマーカーも変化させる [97]が、これはおそらくプロバイオティクスが腸組織に付着して宿主と相互作用し、それによって病原体への感染を抑制するためであろう [106]。
最近発見された別のゴルバッハ-ゴルディン株、すなわちラクトバチルス・ラムノサスと呼ばれるGGのプロバイオティクス株は、第I相試験で低悪性度HE患者に対して安全であったが、自己制限的な下痢が報告されている[97]。また、非アルコール性脂肪性肝疾患(NAFLD)ラットモデルにおいて、Lactobacillus plantarum NCU116が肝機能を回復させ、酸化ストレスを減少させ、肝脂肪蓄積レベルを低下させることが報告されている[98]。
また、Lactobacillus acidophius JBD401を含む多くの腸内菌株が、脳だけでなく血液中のアンモニアを迅速に除去することが確認されており、動物モデルでは生体内で神経保護効果を有することが確認されている(未発表データ)。
また、複数のプロバイオティクス株が高アンモニア血症に関連する疾患に対する治療能力を有していることから、高濃度のプロバイオティクス株を組み合わせた方がHE患者の治療効果が高いことも報告されている[107]。
VSL #3処方(Sigma-Tau Pharmaceuticals, Pomezia, Italy)は、炎症を減少させ、腸管透過性を減少させる能力のために特別に選択された8つの乳酸菌(Lactobacillus, Bifidobacterium, Streptococcus thermophilus)を含んでいる。VSL #3の各ヒドロキシプロピルメチルセルロースカプセルには、健康なヒトの正常な消化管内細菌叢の構成要素である多数の生きた凍結乾燥プロバイオティクス細菌(1100億個)が含まれている[108]。VSL #3の細菌成分のかなりの割合は、大腸に到達するまでの間、GI管を通過する間に生存可能なままであるようである[109]。2つの第II/III相無作為化比較試験では、VSL #3はプラセボと比較して動脈血中アンモニア濃度を有意に低下させ、臨床症状を改善し、HEのリスクを低下させたことが示された[99]。さらに、VSL #3は現在、臨床エンドポイント試験(ステージIV;認知、転倒リスク、生活の質の向上;NCT01686698)を実施中である。また、門脈血栓症による門脈高血圧症による低悪性度HE児にもVSL #3が使用されている(第III相、NCT01798329)。
凍結乾燥した非ウレアーゼ産生菌Pediococcus pentosaceus、Leuconostoc mesenteroides、Lactobacillus plantarum 2592,Lactobacillus paracasei subsp. paracasei 19は、イヌリン、ペクチン、β-グルカンおよび耐性デンプンからなる生物学的に活性な発酵性繊維10グラムとともに、それぞれ1袋あたり10^10 CFUの用量で、最小限のHEを有する肝硬変患者を治療するために使用することができ、大腸菌、ブドウ球菌などのウレアーゼ産生菌の数の大幅な減少につながる。一方、ウレアーゼを産生しないラクトバチルス属菌は大幅に増加し、便中の優勢な生物となっていた[100]。シンバイオティック処理は、腸内細菌叢を大幅に改変し、消化管pHを低下させることができ、これは細菌叢、ビタミンや電解質の吸収、消化酵素活性に大きな影響を与える[110]。腸内細菌叢の調節は血中アンモニア濃度を効果的に低下させ、最小肝性脳症(MHE)患者の50%を逆転させる。エンドトキシン血症の有意な減少もまた、シンバイオティクス治療と関連している[100]。さらに、シンバイオティクスは、肝硬変患者の腸内細菌叢における病原体の非経口転座に影響を与えることにより、病原体の発生率を低下させる可能性がある[111]。
3.2. 腸内細菌叢に基づくアプローチ
リファキシミン、ラクツロース、およびプロバイオティクスを含む高アンモニア血症治療の現在の治療法は、腸内生態系に焦点を当てており、実際には腸内マイクロバイオータの構成および機能に変化に富んだ効果がある[112]。したがって、現在の標準的な治療法では、高アンモニア血症の基本的な治療法に腸内マイクロバイオータの調節がすでに組み込まれている。腸内マイクロバイオータが宿主に利益をもたらすために、あるいは疾患状態を予防するために改変され得ることを示す証拠が増えてきている。このように、腸内細菌叢を工学的に改変することで宿主の代謝を改変することは、高アンモニア血症の新しい治療アプローチを提供している[113]。
アンモニアは、尿素を二酸化炭素とアンモニアに加水分解するウレアーゼによって生成され得る[114]。周知のように、哺乳類のゲノムにはウレアーゼ遺伝子がコードされていないため、ウレアーゼ産生菌に起因するアンモニア産生は宿主系に作用する。ウレアーゼ産生菌はグラム陰性のEnterobacteriaceaeであることが多いが、嫌気性菌やグラム陽性菌である可能性もある。健康な状態では、ウレアーゼ産生細菌からのウレアーゼの活性は、通常、宿主にとって有益である。しかし、肝臓病の存在下では、宿主にとって非常に病原性が高い。廃棄物として肝臓で生成された尿素は、腎臓で尿中に排泄され、大腸に運ばれる[115]。肝障害、慢性肝疾患、または尿素サイクルの欠陥を有する不健康な宿主では、肝障害のためにGI管から肝臓に送達されたアンモニアが正常に処理できないため、アンモニアレベルが上昇する。したがって、HEの治療法のほとんどは、これらの大腸ウレアーゼ産生菌を標的としている[116]。また、循環アンモニア濃度は、慢性肝疾患患者や先天的な代謝異常により肝性脳症(HE)を発症した患者の中枢神経系の損傷と相関している[117]。
肝疾患ではマイクロバイオームが変化していることが観察されており(表3)これは糞便移植療法の可能性を示唆している[102]。しかし、肝硬変による肝硬変患者の微生物集団は、健常者と比較して、フザリウム科や腸内細菌科の豊富な科や、ルミノコッカス科、ラクノスピレース科、クロストリジア属の一次分類群が豊富であることが示されている。最近の研究では,対照群,代償性肝硬変患者,分解性肝硬変患者の糞便細菌数を定量化した結果,肝硬変との正の相関があることが明らかになってきた。CDRが低いほど腸内微生物組成の多様性が低いことを示し、末期肝疾患モデル(MELD)のスコアの上昇と腸管透過性の上昇と関連している[118]。肝性脳症を有する肝硬変患者は、肝硬変患者と比較して腸内微生物の多様性がより低下していた[119]。
表3 高アンモニア血症関連疾患に関連した腸内細菌叢の変化
高アンモニア血症関連疾患に関連する腸内細菌叢の変化。
| 比較a | マイクロバイオータ | サンプル | 方法論 | Ref。 | ||
|---|---|---|---|---|---|---|
| 門 | 家族 | 属/種 | ||||
| HEと健康なコントロールを伴う肝硬変 | レンサ球菌↑ ネガティウィク科↑ |
ストレプトコッカス↑ ストレプトコッカスサリバリウス↑ |
スツール | 16SrRNA遺伝子パイロシーケンス | [ 120 ] | |
| 肝硬変と健康管理 | バクテロイデス 門↓プロテオバクテリア↑ フソバクテリア↑ |
ラクノスピラ 科↓腸内細菌科↑ ネガティウィク科↑レンサ球菌科 ↑ |
スツール | 16SrRNA遺伝子パイロシーケンス | [ 121 ] | |
| 肝硬変と健康管理 | バクテロイデス 門↓プロテオバクテリア↑ フソバクテリア↑ |
バクテロイデス↓ ベイロネラ↑ 連鎖球菌↑ クロストリジウム↑ プレボテラ↑ |
スツール | 16SrRNA遺伝子パイロシーケンス | [ 122 ] | |
| 肝硬変と健康管理 | ルミノコッカス科↓ Alcaligeneceae↑ 腸内細菌科↑ Fusobacteriaceae↑ラクノスピラ科 ↓ |
スツール | マルチタグパイロシーケンス | [ 123 ] | ||
| HEを伴う肝硬変とHEを伴わない肝硬変 | ルミノコッカス科↓ Veillonellaceae↑ Porphyromonadaceae↑ Alcaligeneceae↑ Enterobacteriaceae↑ Fusobacteriaceae↑ |
スツール | マルチタグパイロシーケンス | [ 123 ] | ||
| HEと健康なコントロールを伴う肝硬変 | Lachnospiraceae↓ Ruminococcaceae↓ Alcaligeneceae↑ 腸内細菌↑ Fusobacteriaceae↑ |
スツール | マルチタグパイロシーケンス | [ 123 ] | ||
| HEを伴う肝硬変とHEを伴わない肝硬変 | ラクノスピラ科↓ Veillonellaceae↑ Burkholderiaceae↑ Fusobacteriaceae↑ Bifidobacteriaceae↑ Enterococcaceae↑ |
Roseburia↓ Veillonella↑ Megasphaera↑ Burkholderia↑ Fecalibacterium↑ Bifidobacterium↑ Enterococcus↑ |
粘膜サンプル | マルチタグパイロシーケンス | [ 123 ] | |
| HEと健康なコントロールを伴う肝硬変 | Burkholderiaceae↑ Streptomycetaceae↑ IncertaeSedisXIV↓ ラクノスピラ科↓ ルミノコッカス科↓ ルミノコッカス科↓ |
バークホルデリア↑ ストレプトマイセス↑ ブラウティア↓ ローズブリア↓ フィーカリバクテリウム↓ サブドリグラニュラム↓ |
粘膜サンプル | マルチタグパイロシーケンス | [ 123 ] | |
HE、hepatoencepalophaty;a 状態A対状態Bの比較;↑、状態Bに関連した状態Aの増加;↓、状態Bに関連した状態Aの減少。
エビデンスは、糞便移植は、微生物をその正常な組成に近づけるように変化させることによって、疾患の治療効果を有する可能性があることを示唆している。Ting-Chin David Shen氏の研究では、糞便移植を介してウレアーゼ遺伝子活性の低い細菌スラリーを接種したマウスを用いて、糞便中のアンモニア濃度が有意に減少した[124]。変質したシャードラー叢(ASF)は、8種の細菌からなる群集である。Parabacteroides(株ASF519)Lachnospiraceae(株ASF502)Ruminococcaceae(株ASF500)Eubacterium(株ASF492)Mucispirillum(株ASF457)L. salivarius(株ASF361)L. acidophilus(株ASF360)およびClostridium(株ASF356)の8種である。これらの細菌は、マウスの正常な微生物叢に優勢で持続性があること、およびこの8つの細菌のコンソーシアムが最小のウレアーゼ遺伝子含有量を有することから選択された[125]。動物は抗生物質を使用して既存の腸内細菌叢を枯渇させた後、ASFを接種した。ASF移入後数ヶ月以内に、かなりの数のASF以外の分類群が増加した。ウレアーゼ活性の復帰は見られず、このプロトコルを使用して持続的な新しいコミュニティを確立し、糞便ウレアーゼ活性およびアンモニア産生の長期的な低下を有することができることを実証した。さらに、肝損傷マウスモデルでは、ASF移植はまた、罹患率および死亡率を減少させた[124]。これらの結果は、宿主を抗生物質で治療した後、定義された腸内細菌叢を接種して持続的な代謝効果を得るという新しい治療法の可能性を提供するものである[114]。
4. 結論と展望
高アンモニア血症は、血液中のアンモニアが過剰になることで生じる代謝障害の疾患である。高アンモニア血症の即時的な結果は脳症や死に至るが、長期化した低度高アンモニア血症はアルツハイマー病やパーキンソン病などの神経変性疾患と関連している可能性がある[126]。[126]. したがって、血中アンモニア濃度を低く維持することは、高アンモニア血症の治療のみならず、神経変性疾患の発症を予防または遅らせるためにも重要であると考えられる。
血中アンモニア濃度を低下させるための現在の薬学的アプローチは、有効性および副作用の点で満足のいく解決策を提供していない。しかし、最近のエビデンスは、プロバイオティクスを用いたファーマバイオティクスのアプローチ、または腸内微生物叢を直接修飾することが、高アンモニア血症の画期的な治療法の開発に光を当てることを示唆している[113,120]。
我々は、高アンモニア血症およびその関連疾患を治療するためのファーマバイオティクスとして腸内細菌叢を開発することは、高アンモニア血症の理想的な医薬的解決策を提供するために積極的に検討されるべきであると確信している。
