Contents
The multitargeted drug ivermectin: from an antiparasitic agent to a repositioned cancer drug
2018年2月1日にオンライン
www.ncbi.nlm.nih.gov/pmc/articles/PMC5835698/
マンディ・フアレス、1 アレハンドロ・シュコルニク=カブレラ、1 アルフォンソ・ドゥエニャス=ゴンザレス2
要旨
薬物リポジショニングは、抗がん剤の発見と開発のための高度に研究された代替戦略である。この薬物開発アプローチは、既存の化合物の新しい適応症を特定するものである。イベルメクチンは、1967年に発見された16員環大環状ラクトン化合物の系列であるアベルメクチン(AVM)に属し、1987年にFDAからヒトへの使用が承認された。その安全性は広く,世界中で数百万人に使用されている。
本レビューでは、イベルメクチンが様々な種類の癌に対して抗腫瘍効果を示すことを示す試験管内試験および生体内試験のエビデンスをまとめた。イベルメクチンは、多剤耐性タンパク質(MDR)Akt/mTOR、WNT-TCF経路、プリンナリン受容体、PAK-1タンパク質、SIN3A、SIN3B、RNAヘリカーゼ、塩化物チャネル受容体などの癌関連エピジェネティック調節因子を含むいくつかの標的と相互作用し、癌幹細胞様集団を優先的に標的とする。
重要なことに、イベルメクチンの試験管内試験および生体内試験での抗腫瘍活性は、健康な患者および寄生された患者で行われたヒト薬物動態試験に基づいて、臨床的に到達可能な濃度で達成されている。このように、イベルメクチンに関する既存の情報は、がん患者を対象とした臨床試験への迅速な移行を可能にする可能性がある。
キーワード
イベルメクチン、がん、薬剤の再利用
序論
抗寄生虫薬であるイベルメクチンは、熱帯地域、主に西および中央アフリカの貧困層に生息するクロバエ媒介寄生虫オンコッカ・ボルブルス(Onchocerca volvulus)によって引き起こされるオンコセルカ症(河川盲目症としても知られる)を経口的に治療するために、1987年にヒトで最初に承認された [1,2]。ヒトでは、オンコセルカ症の治療に初めて使用されて以来、その使用により、世界中の何十億人もの人々の栄養、一般的な健康、および幸福が改善されてきた。それだけでなく、獣医学の分野でも、イベルメクチンは世界中の数十億頭の家畜やペットの治療に使用されており、食料や皮革製品の生産量を増やし、数十億頭のコンパニオンアニマル、特に犬や馬を健康に保つのに役立っている。現在、イベルメクチンは単独で過去20年間に年間10億ドル以上の売上を上げており[3]、年間2億5000万人近くの人々に飲まれている[1]。
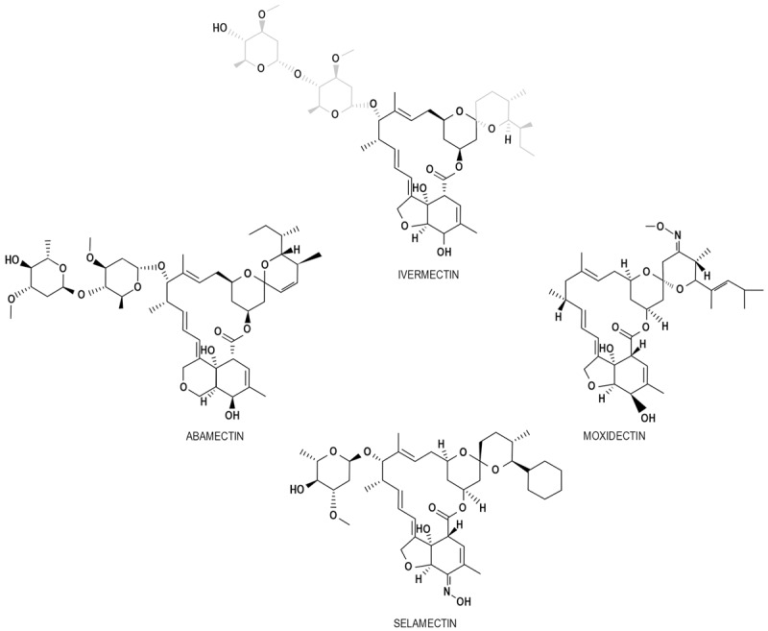
イベルメクチンは、1967年に日本の北里研究所で発見された16員環状大環状ラクトン化合物のグループであるアベルメクチン(AVM)に属している[1,3]。AVMファミリーにはセラメクチン、アバメクチン、モノオキシクチン、イベルメクチン(図1)などがあり、いずれもC13にビスオレアンドロキシ置換基を持つことで抗菌・抗真菌性の16員大環状ラクトンとは異なる[3]。イベルメクチンは、AVMグループから最も一般的に採用されている化合物であり、それぞれ4:1の理由で、2つのAVMの22,23-ジヒドロアベルメクチン-B1aとジヒドロアベルメクチン-B1bのより強力で安全な半合成混合物である[1]。1981年以降,イベルメクチンは農業,獣医学,水産学の分野で使用されている[1]が,殺線虫性,殺虫性,殺虫性が認められている[3,7]。イベルメクチンの抗寄生虫効果はオンコセルカ症に限らず,Wuchereria bancrofti,Brugia malayi,Loa loa,Mansonella perstans,Mansonella ozzardiなどのフィラリア感染症にも有効である[7]。また,Ascaris lumbricoides,Strongyloides stercoralis,Enterobius vermicularis,Trichuris trichiuria,Ancylostoma duodenaleなどの消化管寄生虫を駆除する [7].また,トリパノソーマ症,マラリア,リーシュマニア症,疥癬,頭ジラミなどの治療にも用いられる [1].寄生虫や蠕虫類では、イベルメクチンは他のAVMと同様に、γ-アミノ酪酸(GABA)受容体やグルタミン酸イオンチャネル(Glu-Cl)の活性を高め、神経細胞と筋肉の間の信号を遮断する [3,4,6] [3]。
図1 アベルメクチン科に属する化合物
AVMファミリーに属する化合物の一部を写真に示する。それらのすべては、C13にビスオレアンドロシロキシ置換基を持つ16炭素の大環状ラクトンコアによって認識される。イベルメクチンの特徴的な置換基は灰色で示されている。
哺乳類では、GABA感受性ニューロンは、中枢神経系(CNS)内の血液脳関門(BBB)によって保護されており、AVMの潜在的な有害な影響から脊椎動物を保護している[3,6]。この記述を裏付けるように、BBBの不可欠な部分でありBBB内の薬物輸送ポンプとして機能する多剤耐性(MDR)タンパク質(一般的には停止コドンを生成するmdr-1遺伝子の4塩基対欠失)の機能に欠陥を持つコリー犬の亜集団は、イベルメクチンに対する神経毒性を増加させている[8]。一方、無脊椎動物はGlu-Clチャネルが広く分布しているため、用量依存的に感受性が高く、イベルメクチンはGABAで制御されたClチャネルの開通を誘導し、Cl-の流入を発生させる [1,7]。結果として生じる過分極化は、PAK1によるミオシンIIの調節軽鎖のリン酸化を阻害し[9]、協調性のない運動を伴う体性筋の麻痺、咽頭ポンピングの阻害による飢餓、および死を促進する[1,3,5,7]。確かに、寄生虫に対するイベルメクチンの親和性は、哺乳類の脳に対する親和性の100倍以上であるが、少なくともオンコセルカ症では、イベルメクチンの作用は、マクロフィラリアの形態が生存するために咽頭ポンピングを必要としないため、ほとんどがオンコセルカ火山のミクロフィラリアの段階に制限されている[7]。イベルメクチンをわずか 2 週間投与するだけで、ミクロフィラリア性ワームの減少率は 98% 近くに達し、この効果はその後 12 ヶ月間も維持される [1]。
抗寄生虫薬としての現在の用法・用量
イベルメクチンはヒトでは、オンコセルカ症、ストロンギロイジダ症、腸管感染症に最も多く使用されている用量は150~200μg/kgであるが[10-12]、リンパ系フィラリア症には400μg/kgの高用量で使用されている[13]。脊髄損傷と筋痙攣を有する患者にイベルメクチンを1.6mg/kgまで週2回皮下投与し、12週間投与した臨床試験の報告は注目に値する[14]。
毒性
この化合物は、反芻動物、豚、馬、およびほとんどの犬種で安全性の広いマージンを持っている[15,16]。イベルメクチンの急性毒性は、様々な動物種で調査されている。ラットおよびマウスでは経口投与および腹腔内投与後の毒性の徴候は類似しており,その影響は失調,震え,活動性の低下であった[17]。発育初期において、マウスでは0.4~0.8 mg/kg、ラットでは10 mg/kg、ウサギでは3~6 mg/kgの用量でイベルメクチンを投与すると、口蓋裂の発生率が増加するが、異常の発生頻度は非常に低いため、胚毒性はないと考えられていた[18]。毒性効果は、中枢神経系へのアクセスを制限するP-糖タンパク質との相互作用に関連している。このタンパク質を発現しないトランスジェニックマウスの脳内でのイベルメクチンの蓄積は、このタンパク質の欠如によって決定される。最後に、1.2 mg/kgで16日間毎日摂取した成体アカゲザルでは、望ましくない影響は検出されなかった[18]。
異なる種におけるイベルメクチンの毒性学的報告がいくつかある。マウスで報告されている致死量50(LD50)は経口投与で25 mg/kgであり、ヒト当量(HED)は2.02 mg/kgである。マウスに腹腔内投与した場合、LD50は30 mg/kgまで上昇する(HED 2.43 mg/kg)。ラットの場合、平均致死量は経口で50mg/kg(HED 8.01mg/kg)腹腔内で55mg/kg(HED 8.91mg/kg)である。ウサギでは外用で 406 mg/kg、イヌでは経口投与で 80 mg/kg(HED 43.24 mg/kg)[20]。明らかに系統規模が大きいほどイベルメクチンによる毒性は低いようである。これらのデータは、アベルメクチン中毒に関するレビュー論文(自殺未遂に関する14)の知見と一致している。このレトロスペクティブレビューでは、アバメクチンに曝露された18人とイベルメクチンに曝露された1人の患者のうち、15人が経口摂取により中毒を起こした。そのうち4名は無症状で,8名は軽度の症状を示し,平均摂取量は23 mg/kg(4.2-67 mg/kgの範囲)であった。アベルメクチン100.7mg/kg(イベルメクチン15.4mg/kg、アバメクチン114.9mg/kg)を平均100.7mg/kg摂取した後、7名の患者に昏睡(7名)呼吸不全を伴う誤嚥(4名)低血圧(3名)などの重篤な症状が認められた。7 名の患者 7 名全員が集中的な支持療法を受けた;1 名の患者は多臓器不全の結果、18 日後に死亡した [21]。
イベルメクチンの標的は中枢神経系内に限定されているため、ヒトでは毒性は低いと考えられている。実際、イベルメクチンで治療されたほとんどの患者には、発熱、そう痒症、皮膚発疹、倦怠感などの寄生虫に対する免疫反応および炎症反応以外の副作用はなく[7,22]、副作用が現れた場合には治療後24~48時間以内に現れる[23]。確かに、関節痛、めまい、発熱、皮膚浮腫、呼吸困難、血圧低下などの中等度の症状は、イベルメクチンの内在性毒性というよりも、患者のミクロフィラリア負荷との関連性が高いかもしれない[24]。イベルメクチン投与48時間後にオンコセルカ症とリンパ系フィラリア症を併発した患者で脳症を発症した症例が文献に報告されているが[25]、この副作用は死滅または麻痺した寄生虫の蓄積により脳の微小循環が閉塞し、脳塞栓症を引き起こすことが原因であると考えられている[26]。
結論として、イベルメクチンは安全で忍容性の高い薬剤であることが、膨大な数の患者に投与されていることが示されている。死滅する寄生虫または死滅する寄生虫によって誘発される免疫学的および炎症反応に起因する副作用のほかに、イベルメクチン中毒に関連した交感神経症状として、振戦、散瞳、シアロラ、運動失調および昏睡がある[27]。
薬物動態
イベルメクチンの薬物動態は、ヒトを含む様々な哺乳類で広く研究されており、脂溶性化合物であり、分布容積は46.9Lである;平均血漿中濃度のピークは経口投与後4時間後であり、腸肝リサイクルにより6~12時間後に第2のピークを持つ[1]。血漿中の蛋白質結合率は93%であり[7],生体内での生物変換は少ない[4-6]。経口投与後4~5時間で血漿中最高濃度に達し、半減期は約19時間で、肝臓ではチトクロームCYP1A及びCYP3A4複合体により代謝され、10種類の代謝物が生成され、その多くは脱メチル化及び水酸化されている。排泄は主に糞便であり、尿中に排泄されるのは1%のみである[28]。表1
に寄生虫に感染したヒトおよび健康なヒトにイベルメクチンを投与した場合のイベルメクチンの薬物動態データを示す [28,29]。表1によれば、曲線下面積(全身曝露)で測定した本剤の全曝露量を考慮したモル濃度は、健常者又は寄生虫疾患の治療を受けた患者において達成されたものである。
表1 健常者および寄生者におけるイベルメクチンの薬物動態
| 状態 | 用量(mg / kg) | ルート | C max(ng / mL) | T max(h) | AUC(µg / h / mL) |
|---|---|---|---|---|---|
| Parasitic infection | 0.1-0.2 | オーラル | 52.0 | 5.2 | 2.852 |
| 健常者 | 0.35-0.6 | オーラル | 87.0 | 4.2 | 1.444 |
| 健常者 | 0.7-1.1 | オーラル | 165.2 | 3.6 | 2.099 |
| 健常者 | 1.4-2.0 | オーラル | 247.8 | 4.2 | 4.547 |
寄生した患者では0.1~0.2mg/kgで3.25μM/h、健常者では0.35~0.6mg/kgで1.64μM、健常者では0.7~1.1mg/kgで2.4μM/h、健常者では2mg/kgで5.2μM/hとなっている。
がんにおける薬物の再利用
薬物再利用、薬物リダイレクトまたは薬物再充填とは、既存の医薬品の新規用途を特定することと定義されている。このような医薬品は、製剤開発、試験管内試験および生体内試験スクリーニング、薬物動態および薬力学的プロファイルがよく知られているため、開発リスクとコスト、安全性に関連した失敗の両方が低減される。また、多くの医薬品の第一相臨床試験は終了しており、開発期間を数年短縮するためにバイパスすることが可能である。したがって、薬剤の再利用は、プロセス全体を3~12年まで短縮できる可能性があり、その結果、新しい適応症に向けて化合物を再利用できる可能性は、必要としている患者にとって魅力的な機会となる[30]。研究における医薬品のリポジショニングの関連性は 2004年にこのテーマが最初に発表されて以来、少なくともPubMedでは2013年までに500以上の論文があるという事実によって証明されている[31]。しかし、リポジショニングされた薬剤の大部分は、追加的な使用の可能性のある薬剤を特定するための体系的な努力を2006年に開始する前に発見されており、セレンディピタス検出を示唆している[30,32,33]。現在、リポジショニングの可能性を有する化合物を同定する他の方法は、インフォームドインサイトおよびin silicoでのリポジショニングの機会を同定するために確立されたプラットフォームである[32,34]。さらに、最近では、既存のデータベースから臨床試験済みの化合物のコレクションを体系的に分類したオンラインのリポージングライブラリーである「Drug Repurposing Hub」が構築され、臨床状態、適応症、作用機序などに応じて薬剤を簡単に検索・閲覧できるようになったため、さらなる評価のための薬剤を迅速に見つけることができるようになった[35]。
がんにおける薬剤のリポジショニングについては、重要な取り組みがなされてきた。Pantziarkaらは最近、このトピックについてまとめている。彼らは、試験管内試験または生体内試験で抗腫瘍活性が証明されている少なくとも235の非癌性薬剤を報告しており、これらのうち67(29%)が世界保健機関(WHO)の必須医薬品リストに含まれており、176(75%)が特許外であると報告している[36]。133例(57%)ががん患者でのヒトデータを有していた[36]。臨床ガイドラインには、サリドマイド、オールトランスレチノイン酸、ゾレドロン酸、非ステロイド性抗炎症薬(NSAID)の4つがリストアップされていた[36]。注目すべきは、少なくとも3つの薬剤がランダム化試験で生存効果を示していることである:シメチジン(大腸がん)プロゲステロン(乳がん)イトラコナゾール(肺がん)[36]。薬物標的ネットワーク解析では、シンバスタチンとケトコナゾールの両方が乳がんでは抗増殖性化合物であることを示す例は少なく[32]、遺伝子発現プロファイルからは、トピラマートが小細胞肺がんの治療に使用できることや、シロリムスがグルココルチコイド抵抗性の急性リンパ性白血病に有用であることが示唆されている[35]。一方で、最初に癌を治療するために製剤化された薬剤が、非癌性疾患の治療にも有用である可能性がある。それは、T細胞リンパ腫に承認されているヒストン脱アセチル化酵素阻害剤がそうであるが、マラリア、リーシュマニア症、トリパノソーマ症の治療標的として有望視されていることである[37]。
イベルメクチンの抗腫瘍効果の分子機構
イベルメクチンが癌のリポジショニングの薬として研究されてきた期間が比較的短いにもかかわらず、多くの分子作用機序が発見されている(図2および表2)。これらの中には、以下のようなものがある。
図2 イベルメクチンの抗腫瘍機序
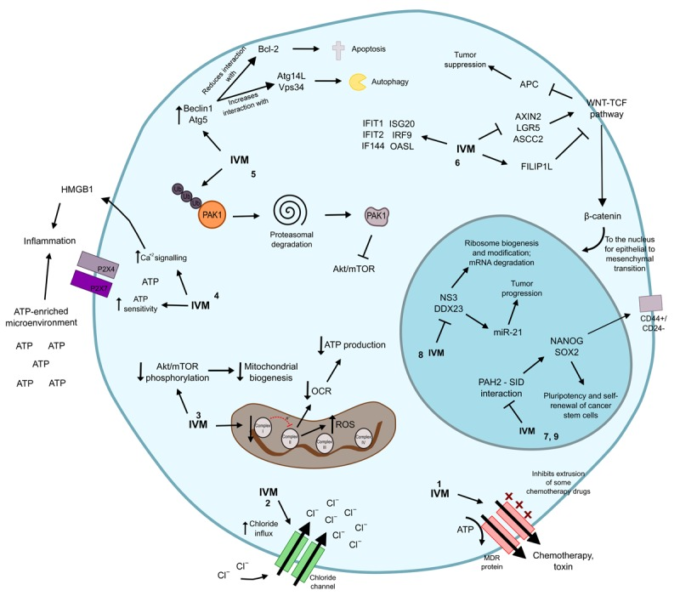
- イベルメクチンはP-糖タンパク質ポンプを阻害し、癌細胞に多剤併用表現型を誘導する。
- イベルメクチンは、イオノフォアとして作用し、塩化物チャネルをアップレギュレートしてアポトーシスや浸透圧細胞死を引き起こす。
- イベルメクチンはミトコンドリア複合体Iの機能を低下させることで、細胞のATPを生成するための酸素消費率を刺激する酸化的リン酸化経路の電子的な動きを制限する。同時に、Aktのリン酸化レベルも低下し、ミトコンドリアの生合成プロセスに影響を与える。さらに、ミトコンドリアの機械系の変化は、DNAを損傷する活性酸素の増加と関連している。
- イベルメクチンは、炎症を促進するATPおよびHMGB1に富む微小環境の刺激を介してICDを誘導する。この薬剤はまた、P2X膜受容体、特にP2X4およびP2X7におけるATP感受性およびカルシウムシグナルを増加させ、ATP依存性の免疫応答を誘導する。
- イベルメクチンは、キナーゼPAK1のポリユビキチン化を促進し、プロテアソームでの分解を誘導する。欠損したPAK1は、順番に、Akt/mTOR経路を阻害する。同時に、イベルメクチンは、オートファジーの誘導に関連するBeclin1とAtg5の発現を刺激し、アポトーシスの負のレギュレータBcl-2の機能を低下させる。共に、これはオートファジーとアポトーシスを発生させる。
- イベルメクチンは、WNTシグナル伝達物質FILIP1Lのリプレッサーを促進する一方で、AXIN2,LGR5およびASCL2,それらのすべてがWNT-TCFの正のレギュレーターであることを抑制する。それと同時に、イベルメクチンは、IFIT1,IFIT2,IF144,ISG20,IRF9およびOASLなどのいくつかのIFN関連遺伝子の発現を促進する。
- イベルメクチンは、癌関連調節因子SIN3AおよびSIN3BのPAH2モチーフに結合するSIN3相互作用を模倣する能力により、悪性細胞におけるエピジェネティックシグネチャおよび自己複製活性を改変する。SIN3Aは、幹細胞の多能性を刺激するNANOGとSOX2を自然に誘導する。
- イベルメクチンはRNAヘリカーゼNS3とDDX23の機能を制限するが、これらはいずれもリボソームの生合成や転写後の修飾、mRNAの分解に関連している。DDX23はmiR-21のプロモーターとして機能しており、これは腫瘍の進行を刺激することで知られている。
- イベルメクチン阻害は、CSC集団を優先的に阻害し、多能性および自己複製遺伝子NANOG、SOX2,OCT4をアップレギュレートする。
IVM:イベルメクチン;ATP:アデノシン三リン酸;OCR:酸素消費率;ROS:活性酸素種。
表2 イベルメクチンの抗腫瘍ターゲットのまとめ
| 目標 | 効果 | 参考文献 |
|---|---|---|
| MDRタンパク質 | 阻害 | [ 39 ] |
| 塩化物チャネル | 活動の増加 | [ 44 ] |
| Akt / mTOR経路 | 阻害 | [ 47 ] |
| P2X7 / P2X7受容体 | アクティベーション | [ 50、51 ] |
| PAK1タンパク質 | 阻害 | [ 9、54 ] |
| WNT-TCF経路 | 阻害 | [ 57、58 ] |
| SIN3ドメイン | 阻害 | [ 59 ] |
| NS3DDX23ヘリカーゼ | 阻害 | [ 64 ] |
| Nanog / Sox2 / Oct4遺伝子 | ダウンレギュレーション | [ 67 ] |
多剤耐性(MDR)表現型の阻害剤としてのイベルメクチン
イベルメクチンの潜在的な抗腫瘍活性についての最初の報告は約20年前に登場したが、これらは当時発見されたMDR表現型の最近の基礎と何らかの形で結びついていた。1986年のGros Pらは、MDR遺伝子の細胞内メッセンジャーRNA転写物に相補的なDNAクローンの単離を報告し、薬剤感受性のある細胞で完全長の相補的DNAクローンを高レベルで発現させると、完全なMDR表現型が得られることを示した[38]。その後、Didier と Loor は、MDR 細胞内の 2 つの P 糖タンパク質プローブの保持が親細胞に戻るかどうかを測定する P 糖タンパク質機能阻害を短期アッセイで証明し、イベルメクチンは P 糖タンパク質の基質であり阻害剤でもあると結論づけた [39]。
イベルメクチンという名称ではないが、アベルメクチンIB1は、エールリッヒ癌の固形癌を有するSHK雄性マウスにおいて、1 mg/kg(HED 81 μg/kg)の用量で5日目に生体内試験で腫瘍の増殖を50%減少させる能力を示した。また、同量でがん細胞株755(C57/BL6雄性マウス)の増殖を阻害し、腫瘍接種後3日目にアベルメクチンB1を投与したところ、腫瘍増殖阻害値が最大となった。イベルメクチンが腫瘍の多剤耐性を阻害することを踏まえ、エールリッヒ癌を対象にアベルメクチンIB1をビンクリスチンと併用して試験を行ったところ、ビンクリスチンの抗腫瘍効果はビンクリスチンの後にアベルメクチン1B1を投与することで大幅に増加することが示された[40]。イベルメクチンの抗MDR効果を利用した更なる研究はない。それにもかかわらず、MDR阻害薬の新規戦略および/またはスケジュールの最適化の探索は続いており[41]、MDR表現型の発症を逆転させたり予防したりする上でのイベルメクチンの役割を研究する余地がまだあることを示唆している。
イオノフォア医薬品としてのイベルメクチン
「イオノフォア」という用語は、有機分子が金属カチオンを結合し、細胞膜を越えた金属イオンの輸送を容易にする脂質可溶性複合体を形成する能力に関連して、1967年に初めて使用された。このように、イオノフォアは細胞外空間と細胞内空間の間を行ったり来たりして拡散するか、あるいは細胞内空間と細胞外空間の間で金属イオンを輸送するために形質膜に留まることがある[42]。
イオノフォア抗生物質は、生物学的膜に細孔を発生させることで作用し、細胞のイオンの家庭を劇的に変化させる。サリノマイシンは、K+に対して強い選択性を示すイオンチャネルのような構造を生成するイオノフォア抗生物質の一例であるが、他の一価カチオン(例えば、Na+およびH+)も伝導される[43]。
伝統的に、イオノフォア抗生物質の細胞殺傷活性は、生化学的景観の変化による直接的な細胞毒性効果だけでなく、浸透圧の大幅な調節緩和に由来すると考えられてきた。悪性細胞は塩化物チャネルをアップレギュレートする傾向があることが知られており、これは塩化物流束の変化に対してより敏感な細胞であることを示す可能性があり、細胞内の塩化物濃度のアンバランスは細胞内のCa2+レベル、pHおよび細胞容積に影響を与え、影響を受けた細胞のアポトーシスを引き起こす可能性があることが知られている[44]。
Sharmeenらは、これらの記述に沿って、抗白血病化合物を同定するために抗生物質と代謝調節物質の小さな化学ライブラリのスクリーニングでは、HL60,KG1a、およびOCI-AML2急性骨髄性白血病細胞株、および一次患者サンプルにおいて、イベルメクチンが低マイクロモル濃度(10μMのIC50)で細胞死を誘導することを発見した。
細胞死はカスパーゼ依存性であり、興味深いことに、正常な造血細胞はイベルメクチンに対して、20μMまでの濃度ではアポトーシスを誘導しなかったため、はるかに感度が低かった。白血病細胞と正常細胞のクローン原性を調べたところ、同様の効果が認められた。また、塩化物の流入量の増加は、細胞死、細胞サイズおよび細胞の過分極化の両方の変化と相関していることも示された。
興味深いことに、イベルメクチンとシタラビンまたはダウノルビシンを併用した場合、OCI-AML2とU937では相乗的または相加的相互作用が認められたが、正常細胞では認められなかった[44]。
ミトコンドリア機能障害および酸化損傷の誘導剤としてのイベルメクチン
駆虫薬または抗生物質が哺乳類細胞のミトコンドリアを標的とする可能性があることに基づいて [45,46]、イベルメクチンの抗腫瘍効果がミトコンドリアの生合成または機能の阻害を介して起こるかどうかを確認するために、神経膠芽腫細胞株を用いて試験を行った。予想通り、イベルメクチンは用量依存的に基底および最大酸素消費率(OCR)を阻害し、呼吸器複合体Iの酵素活性を低下させたが、II、IV、Vは阻害しなかった。
さらに、ミトコンドリア呼吸を欠損した U87 細胞株のサブラインを確立することで、これらの条件下では、イベルメクチンは細胞死を誘導することができないことが証明された。これらの効果は、ミトコンドリアの生合成と機能を少なくとも部分的に制御するAkt/mTOR経路を研究することによって追跡された。
結果は、イベルメクチンがU87,T98GおよびHBMEC細胞において、Akt(S473)mTOR(S2481)およびリボソームS6タンパク質(rS6)のリン酸化を減少させることを示しており、イベルメクチンがAkt/mTOR経路を阻害していることを示している[47]。イベルメクチンのミトコンドリアおよび酸化損傷に対する効果は、最近、腎癌細胞株を対象とした研究で裏付けられた。Liuらの研究と同様に、このモデルでもイベルメクチンはミトコンドリア膜電位だけでなく、基底および最大呼吸能力も低下させた。
特筆すべきは、イベルメクチンは細胞内の活性酸素と8-OHdGレベルを有意に増加させたことであり、イベルメクチンの抗腫瘍効果は酸化ストレスとDNA損傷に関連していることを示唆している。このことは、ミトコンドリア生合成促進剤であるアセチル-L-カルニチン(ALCAR)または抗酸化剤であるN-アセチル-L-システイン(NAC)との併用により、これらの腎癌細胞株におけるイベルメクチンの抑制効果が消失したことからも確認されている[48]。
免疫原性細胞死(ICD)の誘導剤としてのイベルメクチン
免疫原性細胞死(ICD)は、カルレティキュリンの細胞膜露出やATPおよび高可動性グループボックス1(HMGB1)の細胞外空間への放出などの損傷関連分子パターン(DAMP)の存在によって特徴づけられる。外因性ATPは、P1,P2XおよびP2Yプリンナー受容体を介して防御を調節する[50]。
しかし、最近では、P2X7の過剰発現は、腫瘍の増殖および転移の両方の促進と相関している[50]。腫瘍の微小環境内では、CD39やCD73などのATPaseがATPを免疫抑制剤であるアデノシンに分解するが、イベルメクチンはHMGB1とATPの両方を強力に誘導することで、その効果を上回ることができ、炎症を誘導する[50]。
確かに、イベルメクチンはATPを富化させた腫瘍微小環境の刺激により、P2X4/P2X7-およびカスパーゼ1を介したICDをアロステリックに増強し、悪性細胞におけるプリンナージックシグナル伝達の生存と細胞毒性の役割のバランスを崩し、オートファジーも誘導することがトリプルネガティブ乳癌細胞(TNCB)で報告されている[50]。
ヒト単球由来マクロファージを用いた研究では、イベルメクチンとPX24およびP2X7受容体との関連性が確認されている。そのような研究では、イベルメクチンはPX24受容体においてATP感受性を増加させ、ATPウォッシュアウト後の電流の不活性化を遅らせることが示されており、P2X7受容体におけるATP誘導電流およびCa2+シグナルの増大と相まって、イベルメクチンがATP依存性の免疫応答を刺激する可能性を示唆している[51]。
以上のことから、イベルメクチンは腫瘍微小環境でのICDを促進し、増強する可能性があることが文献から示唆されている。
オートファジー誘導剤としてのイベルメクチン
オートファジーは自己分解的異化経路であり、二重膜オートファゴソームの形成によって特徴づけられる。オートファゴソームは、過剰または欠陥のある小器官を隔離し、リソソームと融合してリソソーム内に封入された物質を分解し、飢餓、発生遷移、低酸素、酸化ストレスなどの特定の細胞刺激下でエネルギーと栄養素を動員する [52,53]。
卵巣癌および膠芽腫癌細胞株におけるイベルメクチンは、すべてのヒト癌の70%以上で腫瘍成長のための細胞骨格再編成および核内シグナル伝達に重要なタンパク質である発癌性キナーゼPAK1 [1,47]のユビキチン化を介した分解を促進する[1]。
PAK1のダウンレギュレーションはオートファジーであるAkt/mTORの抑制を阻害し、Akt、mTOR、p70S6K、4EBP1のリン酸化が減少することで証明されている。実際、イベルメクチンで処理した複数の乳癌細胞株を用いたある研究では、酸性小胞小器官の形成、透過型電子顕微鏡による二重膜オートファゴソーム、および用量依存的にオートファジー関連タンパク質であるBeclin 1とAtg5の発現レベルを促進することにより、オートファジー促進因子としての役割が示されている。
イベルメクチンは、ベクリン1とオートファジーの正の調節因子、具体的にはAtg14LとVps34との相互作用を増加させ、一方でBcl-2などの負の調節因子との相互作用を減少させる [54]。以上のことから、このモデルにおけるイベルメクチンのオートファジー効果は、PAK1/Akt/mTOR経路の阻害に起因することが実証された。
WNT-TCF経路の阻害剤としてのイベルメクチン
イベルメクチンの抗増殖機能は広く知られている。いくつかの散発性ヒト癌において、腫瘍抑制因子APCを不活性化し、新生物形質転換の際にβ-カテニンの構成的活性化と核内への転座を刺激するWNT-TCFシグナルを遮断する能力を持つリポジショニングの薬剤候補を見つけることを目的とした研究[55,56]では、低マイクロモル濃度のイベルメクチンが癌細胞において抗WNT-TCF応答を示すことが明らかにされた[57]。
著者らは、大腸がん、膠芽腫、メラノーマ細胞株において、イベルメクチンがBrdUの取り込みを抑制することを示し、細胞増殖を抑制することを示している[57]。さらに、イベルメクチンが活性化カスパーゼ3のアップレギュレーションや、WNT-TCF陽性標的であるAXIN2,LGR5,ASCL2を抑制することも明らかにしており[57]、乳がん、皮膚がん、肺がん、腸がんなどのWNT-TCF依存性がんのブロックにイベルメクチンを利用できる可能性を示している[1,57]。さらに、スフェロイド形成を解析してイベルメクチンの抗クローン形成活性を調べたところ、イベルメクチンで前処理した細胞株では、クローン性の浮遊スフェロイドが最大73%減少することが示された。
実際、イベルメクチンのWNT-TCF阻害剤としての役割は、植物や微生物の天然化合物のライブラリーをスクリーニングしたある研究では、イベルメクチンの抑制活性をトランスクリプトーム解析で確認し、この化合物の使用により、WNTシグナル伝達物質FILIP1Lのリプレッサーが10倍にまで上昇することを示した[58]。このような研究はまた、大腸がん細胞において、インターフェロン応答性遺伝子ISG20,IFIT1,OASL、IRF9,IF144,IFIT2の増加を明らかにした[58]。興味深いことに、WNT-TCF経路を阻害するためのインターフェロンの採用が示唆されている[58]。
エピジェネティックモジュレーターとしてのイベルメクチン
イベルメクチンの癌に対する作用が認められている他の分野には、エピジェネティックな制御が含まれている。乳癌細胞株MDA-MB-231を用いて行われたある研究では、2,000種類のFDA承認低分子医薬品のin silico・スクリーニングの結果、イベルメクチンの機能的効果が報告されている。
著者らは、乳がんに関連するエピジェネティック調節因子SIN3AおよびSIN3Bに属するPAH2モチーフに自然に結合するSIN3-相互作用ドメイン(SID)を模倣するイベルメクチンの能力を評価した[59]。彼らは核磁気共鳴により、イベルメクチンがPAH2とSIDの相互作用を実際にブロックすることを実証した[59]。さらに、SIN3A は幹細胞と自己再生マーカーである NANOG と SOX2 を正に制御する複合体の一部であることから、著者らはこれらの遺伝子を抑制するためのイベルメクチンの役割を分析し、D3H2LN 細胞において 0.5 µM の投与量で NANOG と SOX2 遺伝子の発現を 80%減少させ、クローン形成性腫瘍球の成長を 90~100%減少させることを証明した [59]。
ヘリカーゼ阻害剤としてのイベルメクチン
RNAヘリカーゼは、リボソームバイオジェネシス、スプライシング、翻訳、mRNA分解など、多くの生物学的プロセスに関与するタンパク質の大規模なファミリーである[60]。RNAヘリカーゼのDEAD-boxファミリーのメンバーは、転写、スプライスソームの生合成、リボソームの生合成、スプライシング、核細胞質輸送、翻訳、崩壊などのRNA処理の様々な側面で重要な役割を果たしている[61,62]。
これらのファミリーメンバーは、アミノ酸配列D-E-A-D(アスパラギン酸-グルタミン酸-アラニン-アスパラギン酸)を含む保存コアを共有している。それらは、二本鎖RNAをほどくためにATP加水分解から受け取ったエネルギーを使用し、一般的に多タンパク質複合体の構成要素として作用し、それらの相互作用するパートナーに依存する多様な機能を持っている。いくつかのDEAD-box RNAヘリカーゼは、様々なタイプの癌で異常に発現しており、癌の発生および/または進行において重要な役割を果たしている可能性がある[61,62]。
2012,Mastrangeloらは、イベルメクチンがKunjinウイルス(オーストラリアの黄熱病ウイルスの亜種)のNS3ヘリカーゼ活性をin silico試験で有効に阻害することを明らかにし、試験管内試験ヘリカーゼ酵素アッセイでそれを確認した[63]。一方、神経膠腫細胞株を用いた最近の研究では、RNAヘリカーゼDDX23が転写後レベルで発がん性miR-21の生合成を制御しており[64]、正常脳と比較して神経膠腫組織で過剰に発現しており、神経膠腫患者の生存率の低下と関連していることが明らかになった。
著者らは、ウイルスヘリカーゼを阻害することが知られているいくつかの薬剤をアッセイした後、イベルメクチンは、DDX23を介したpri-miR-21処理の増強を阻害し、その結果、がんの予後不良マーカーとしてよく知られている前駆体および成熟miR-21の両方のレベルを低下させることを発見した[65]。イベルメクチンを試験管内試験および生体内試験でグリオーマ細胞株に投与したところ、抗腫瘍効果を誘導することができたが、これはイベルメクチンの抗ヘリカーゼ的役割が抗がん作用の別のメカニズムとして考えられることを示唆している。
幹細胞がん抑制剤としてのイベルメクチン
2009,Guptaらは、がん幹細胞(CSC)の選択的阻害剤を発見するためにハイスループットスクリーニングを行い、サリノマイシンがパクリタキセルと比較してCSCの割合を100倍以上減少させることを見出した。さらに、サリノマイシンは生体内試験で乳腺腫瘍の増殖を阻害し、乳房CSC遺伝子の発現低下を伴う腫瘍細胞の上皮分化の増加を誘導することを示した[66]。サリノマイシンは動物用の抗寄生虫薬であるため、我々のグループは、ヒト用にもCSCの選択的阻害剤として作用する類似化合物を探索した。
その結果、イベルメクチンはサリノマイシンと高い類似性(類似度0.78)を示したことから、抗寄生虫薬イベルメクチンもサリノマイシンと同様の生物学的性質を有するのではないかとの仮説を立てた[67]。本研究の結果、イベルメクチンはMDA-MB-231細胞に対して0.2~8μMの範囲で増殖抑制効果を有し、予測通り、イベルメクチンはバルク細胞集団と比較して、CSCに富む集団(CD44+/CD24-)およびスフェロイド状に増殖する細胞の生存率を優先的に抑制することが示された。
反対のパターンがパクリタキセルで観察され、ナノモル濃度では非CSCs(CD44+/CD24+)がパクリタキセルに対して感受性を示したが、幹細胞サブ集団の阻害はより高い薬剤濃度でのみ観察された。これによると、イベルメクチンは多能性および自己複製マーカーであるNanog、Oct4およびSox2の発現をmRNAおよびタンパク質の両方のレベルで減少させる[67]。イベルメクチンの抗腫瘍効果の分子機構の概要を表2および図2に示す。
イベルメクチンの抗腫瘍効果、試験管内試験および生体内試験
イベルメクチンは、固形がんや血液学的悪性腫瘍を含む広範囲の悪性疾患に対して有効性を示す多くの試験管内試験および生体内試験の前臨床試験がある。乳がんでは、MDA-MB-435,MDA-MB-231,MDA-MB-468,MDA-MB-361,MCF-7,HS578T、SKBR3 細胞株でイベルメクチンの研究が行われ、細胞増殖抑制、アポトーシス誘導、オートファジー、タモキシフェン抵抗性の 回復などの効果が示されている[51,55,60,67]。
これらの効果は、メラノーマだけでなく、卵巣癌、前立腺癌、頭頸部癌、結腸癌、膵臓癌の細胞株でも報告されている [9,45,51]。同様の結果は、乳がん、メラノーマ、大腸がんを含む多くのマウスがん細胞株でも観察されている [51,60]。膠芽腫細胞株を対象とした 2 つの研究では、イベルメクチンが増殖停止とアポトーシスを誘導するだけでなく、抗血管新生作用を誘導することが示されている [48,58] が、さらに 2 つの研究では骨髄芽細胞性急性白血病細胞株を対象とした観察結果が示されている [41,51]。
興味深いことに、表 3 に示したすべての研究で 試験管内試験 治療に使用された濃度の中央値は 5 µM (0.01-100 µM)であり、表1 に示したヒトにおける薬物動態データに基づいて臨床的に達成可能であった。
イベルメクチンの生体内試験評価(表4)については、ヒト急性骨髄芽球性白血病、膠芽腫、乳癌、結腸癌、およびマウスリンパ肉腫細胞株MDAY-D2を用いた免疫不全マウスを用いた試験が行われており、これらの試験では50%以上の減少が認められている。これらの研究では、イベルメクチン投与後に腫瘍体積が 50%以上減少したことが示されており、経口投与、腹腔内投与、体腔内投与(より一般的には腹腔内投与)のいずれかの方法で 10 日間から 42 日間の投与期間で変化した。使用された用量の中央値は 5 mg/kg(2.4~40 mg/kg)であり、これはヒトでは 0.40 mg/kg に相当する用量であり、これまでにヒトで安全に使用された最高用量(2 mg/kg)よりも低い用量であった(表1)。このように、イベルメクチンの試験管内試験及び生体内試験での結果は、癌患者に対する抗腫瘍効果が可能な用量で得られることを強く示唆している。
表3 イベルメクチンの試験管内試験での抗腫瘍効果
| 腫瘍タイプ | 細胞株 | [µM] | 効果 | 参照 |
|---|---|---|---|---|
| ヒト白血病 | OCI-AML2 | 5、 | ROSのアップレギュレーションを通じて細胞死を誘導します。 | [ 44 ] |
| HL60 | 10、 | |||
| U937 | 15、 | |||
| K61a | 20 | |||
| 前立腺がん | DU145 | |||
| PPC-1 | ||||
| ヒト神経膠芽腫 | U87 | 1、 | 成長阻害、アポトーシスおよび抗血管新生を誘導します。 | [ 47 ] |
| T98G | 5、 | |||
| 10 | ||||
| 卵巣がん | TYK-nu | 0.1、 | 細胞増殖の阻害。 | [ 9 ] |
| KOC7C | 1、 | |||
| SKOV3 | 10、 | |||
| RMUG-S | 100 | |||
| HEI-193 | ||||
| 乳癌 | MDA-MB-435、 | 5、 | オートファジーと細胞増殖の抑制を刺激します。 | [ 54 ] |
| MDA-MB-231 | 10、 | |||
| MDA-MB-468 | 15、 | |||
| MDA-MB-361 | 20 | |||
| MCF-7 | ||||
| HS578T | ||||
| マウス乳がん | 4T1.2 | 1、 | アポトーシスと壊死を誘発します。オートファジーを誘発します。 | [ 50 ] |
| DDHer2 | 4、 | |||
| 8、 | ||||
| マウス黒色腫 | C57BL / 6 | 16 | 細胞増殖およびクローン原性能力の阻害。 | |
| マウス結腸腺癌 | CT.26 | ROSの量を増やします。 | ||
| ヒト乳がん | MDA-MB-231 | |||
| MCF7 | ||||
| SKBR3 | ||||
| ヒト黒色腫 | A2058 | |||
| A375 | ||||
| ヒト膵臓がん | PANC1 | |||
| MiaPaca2 | ||||
| ヒト前立腺がん | DU145 | |||
| 人間の頭頸部がん | A253 | |||
| ヒト白血病 | MV411 | |||
| 人間の結腸癌 | CC14 | 0.1、 | 細胞増殖を阻害し、アポトーシスを誘導します。 | [ 57 ] |
| CC36 | 1、 | |||
| Ls174T | 5、 | |||
| HT29 | 10 | |||
| ヒト神経膠芽腫 | DLD1 | |||
| U251 | ||||
| ヒト黒色腫 | SKMe12 | |||
| マウス乳がん | 4T1 | 0.01、 | 侵襲性の抑制とタモキシフェン感受性の回復。 | [ 59 ] |
| MMTV-Myc | 0.1、 | |||
| ヒト乳がん | MDA-MB-231 | 1 | 細胞増殖および転移の阻害。 | |
| D3H2LN | ||||
| ヒト乳がん | MDA-MB-231 | 0.2、 | 幹細胞集団の細胞生存率とクローン原性を優先的に阻害します。 | [ 67] |
| 0.4、 | ||||
| 0.8、 | ||||
| 1、 | ||||
| 5、 | ||||
| 8 |
表4 イベルメクチンの生体内抗腫瘍効果
| 腫瘍タイプ | 腫瘍細胞株 | 御馳走の日。 | 用量mg / kg | マウス | イベルメクチンの効果 | 参照。 |
|---|---|---|---|---|---|---|
| マウス白血病 | MDAY-D2 | 10 | 3、 | NOD / SCIDマウス | すべてのモデルで腫瘍体積を最大70%削減します | [ 44 ] |
| 5、 | ||||||
| 6 | ||||||
| ip | ||||||
| ヒト白血病 | K562 | 3経口 | ||||
| OCI-AML2 | ||||||
| ヒト神経膠芽腫 | U87 | 21 | 40 | SCIDマウス | 腫瘍の体積を最大50%削減します | [ 47 ] |
| T98G | ip | |||||
| 乳癌 | MDA-MB-231-GFP | 10 | 2.4 | NOD / SCIDマウス | 腫瘍の体積を最大60%削減します | [ 54 ] |
| ip | ||||||
| ヒト神経膠腫 | U87MG | 42 | 3、 | Balb / cヌードマウス | 3mg / kgで腫瘍体積を最大50%減少させます。 | [ 64 ] |
| 10 | 10mg / kgでは腫瘍は検出されなかった | |||||
| それ | ||||||
| 人間の結腸癌 | LDL1 | 21 | 10 | NMRIヌードマウス | 腫瘍の体積を最大85%減少させます(LDL1細胞株)。腫瘍TCF非依存性細胞株(CC14)では影響は観察されません | [ 57 ] |
| CC14 | ip | |||||
| HT29 |
結論
薬物のリポジショニングは、抗がん剤の開発を加速させるための巧妙な機会であるという認識が高まっている。これまでのところ、少なくとも235種類の臨床的に承認された非がん治療薬が、試験管内試験、生体内試験、あるいは臨床的に抗腫瘍活性を証明している。その中でも、獣医学的にもヒト医学的にも広く使用されている抗寄生虫薬であるイベルメクチンは、
①感染者の寄生虫に対する免疫反応や炎症反応以外の副作用がほとんどなく、安全性が高いこと、
②前臨床試験で抗腫瘍活性が証明されていることなどから、リポジショニングの有力な候補であることは明らかである。一方で、非常に選択的な「ユニットターゲティング」薬剤の使用は、癌細胞による抵抗性の早期発現と一般的に関連していることが明らかになっており、したがって、「ダーティ」または「マルチターゲティング」薬剤の使用を探求することが重要である。
この意味で、イベルメクチンは、多剤耐性タンパク質(MDR)Akt/mTORおよびWNT-TCF経路、プリン体受容体、PAK-1タンパク質、SIN3AおよびSIN3Bのような特定の癌関連エピジェネティックディレグレーター、RNAヘリカーゼ活性などのいくつかの標的を調節し、一方で、細胞の過分極化を導く塩化物チャネル受容体を刺激し、少なくとも乳癌において癌幹細胞のような集団を優先的に標的とするために幹細胞遺伝子をダウンレギュレートするので、このような可能性を持っている。
重要なことに、イベルメクチンの試験管内試験および生体内試験での抗腫瘍活性は、健康な患者や寄生された患者を対象としたヒト薬物動態試験に基づいて、臨床的に到達可能な濃度で達成されている。このように、イベルメクチンに関する既存の情報は、がん患者を対象とした臨床試験への迅速な移行を可能にする可能性がある。