The ketogenic diet as a potential treatment and prevention strategy for Alzheimer’s disease
pubmed.ncbi.nlm.nih.gov/30554068/
Gina M. Broom , Ian C. Shaw , Julia J. Rucklidge
改訂日:2018年4月18日
キーワード
アルツハイマー病、ケトジェニックダイエット、低炭水化物ダイエット、ケトン体、アミロイドβ;食事による介入
見どころ
- アルツハイマー病では、脳内の糖代謝障害とアミロイドβ斑が重要な役割を果たしている。
- ケトン体は、脳内でグルコースに代わる代謝前駆体となる。
- ケトジェニック食はアミロイド斑を減少させ、その神経毒性を回復させる可能性がある。
- 炭水化物を多く含む現代の食生活は、アルツハイマー病の発症率を高める原因となっている可能性がある。
- ケトジェニックダイエット(糖質制限を含む)は、アルツハイマー病の管理に有用であるかもしれない。
概要
慢性神経変性疾患であるアルツハイマー病の罹患率は増加しており、効果的な治療法や予防法の必要性が高まっている。アルツハイマー病の根本的な病態はまだ完全には解明されていないため、既存の研究では、アルツハイマー病の顕著な特徴を理解することに重点が置かれている。アルツハイマー病の特徴としては、脳内に蓄積するアミロイド斑、糖代謝の低下、神経細胞の死などが挙げられる。低炭水化物・高脂肪のケトジェニックダイエットは、これらの病態に伴うダメージを軽減する可能性があることを示す新たな証拠がある。ケトジェニックダイエットは、ケトン体を補助的なエネルギー源として供給することで、糖代謝障害の影響を軽減することができる。さらに、ケトジェニック食は、アミロイド斑の蓄積を抑え、アミロイドβの毒性を回復させることができる。アルツハイマー病の初期の基礎的なメカニズムを特定する研究が始まっており、新たな予防戦略の対象となりうる。ApoEタンパク質の糖化は、コレステロールを含む重要な脂質の脳への輸送に障害をもたらし、その結果、脂質の欠乏が生じ、アルツハイマー病の後期病理への進行を説明できる可能性がある。我々は、ケトジェニックダイエットがADの治療と予防に有効であると考えているが、そのためにはケトン生成と糖質制限の両方が必要であるかもしれない。
はじめに
アルツハイマー病(AD)は、認知症の主要な原因であり、世界中で2,400万人が罹患していると推定され、その数は20年ごとに倍増すると予想されている1。ADの発症メカニズムについてはまだ十分に解明されていないが、ADの脳には有害なアミロイドβ(Aβ)の斑点やもつれが過剰に蓄積し、細胞死が促進されることが剖検例から明らかになっており、ADの進行の原因になっていると考えられている2。このため、脳内のプラークやタングルを減少させることに重点を置いた研究が行われてきたが、プラークやタングル、そして最終的なADの進行の原因として、神経代謝の問題が指摘されるようになってきた3,4。これらの代謝問題を解決するために、高脂肪・低炭水化物のケトジェニックダイエット(KD)5,6などの食事療法が研究されている。KDは、このような代謝の問題を解決すると同時に、ADに伴うAβプラークを防ぐことができる可能性がある。ADの早期発症には、遺伝的リスクと現代の食生活が複合的に関与していることがますます明らかになってきている。この総説では、KDがADの治療法や予防法の開発に役立つ可能性があるさまざまなメカニズムを探る。
ADにおけるグルコースとケトン体
ADの遺伝的リスクが高い若年成人を対象とした研究では、このような代謝障害が、認知症発症の数十年前である若年成人期には存在する可能性があることが分かっている7。このため、フルオロ-2-デオキシ-D-グルコース・ポジトロン・エミッション・トモグラフィー(FDG-PET)画像による脳内グルコース代謝低下の検出は、ADの効果的な早期診断ツールとして提案されており、ADの識別に90%の感度を示した研究もある8。このような早期のグルコース代謝障害は、代謝に関する介入がADの予防や少なくとも発症の抑制に有効であることを示唆している。KDに付着した際に生成されるケトン体(KB)を利用して、脳に補助的なエネルギー供給を行い、ミトコンドリアの効率を高め、認知機能を向上させることが提案されている5,6。この代謝経路では、β-ヒドロキシ酪酸(β-HB)とアセト酢酸(ACAC)という2つのケトン体が、解糖系をバイパスしてアセチル-CoAを生成し、このアセチル-CoAをクレブのサイクルに送り込むことで、脳内のエネルギー利用率を高めることができる(図1)。ADでは、脳内のケトン体の取り込みが、グルコースの取り込みのように損なわれないことが明らかになっており5,ケトン体は代替エネルギーの前駆体として有望である。このような脳内代謝の補完は、KDがADの治療や予防に役立つと提案されている最初のメカニズムである。
図1 通常の酸化的グルコース代謝と比較したケトジェニック代謝の概要
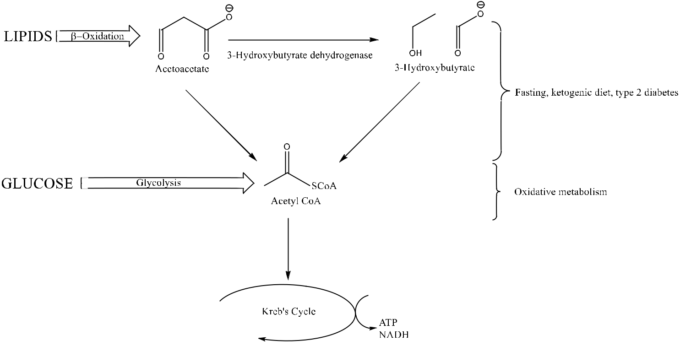
ケトジェニック代謝では、空腹時や2型糖尿病では、脂質がβ酸化によりアセトアセテート(ジケトン)に代謝され、3-ヒドロキシ酪酸塩デヒドロゲナーゼにより3-ヒドロキシ酪酸塩(ケトン)に変換される。アセトアセテートと3-ヒドロキシ酪酸塩は、多段階の経路を経てアセチルCoAを生成する(この図では簡略化してある)。通常の酸化的代謝では、グルコースは解糖系を経由してアセチルCoAに変換される。アセチルCoAはクレブのサイクルに入り、細胞の代謝を促すエネルギー豊富な分子(ATP、NADHなど)を生成する。ケトジェニック経路は、代謝ストレス時に解糖系を回避するための独創的な方法である。
アミロイドβ斑に対するケトジェニック食の効果
細胞の代謝を修正することに加えて、KBは、ADに関連する毒性のあるAβプラークの生成を防ぐ治療法であることがわかっている。Van der Auweraら9は、ADモデルのトランスジェニックマウスにKDを与え、ヒトのADに似たAβプラークの蓄積を確認した。その結果、血清中のケトン体であるβ-HBの濃度が上昇し、対照群と比較して総Aβ濃度が有意に低下した。さらに、KDはAβの蓄積を抑制するだけでなく、生成されたKBがAβの神経毒性から保護する可能性も示唆されている。Kashiwayaら10は,培養したラット海馬細胞をAβ,β-HB,またはAβとβ-HBの組み合わせで処理した。Aβのみで処理した場合、コントロールに比べて有意に高いレベルの細胞死が認められ、神経突起の数や長さも減少したことから、海馬神経細胞のAβ毒性が確認された。しかし、β-HBを添加すると、Aβの毒性が逆転し、生き残った細胞の数を倍増させる成長因子として作用した。これは、β-HBが既存の損傷を修復する可能性を示している。したがって、Aβに対する神経保護作用は、KDがADの予防と治療に役立つもう一つのメカニズムであると考えられる。
ヒトにおけるケトン体介入の有効性
KDがADの治療法として期待されていることを受けて、Hendersonら11は、ケトン体化合物であるAC-1202が軽度から中等度のアルツハイマー病患者の認知機能に及ぼす影響を検証するために、無作為化二重盲検プラセボ対照試験を実施した。AC-1202は、ケト化作用の高いMCTを摂取することで、被験者の食生活を変えることなく軽度のケトーシス状態を誘導することができるという理論に基づいて、中鎖脂肪酸(MCT)の摂取可能な形態として開発された。KDではないが、AC-1202の投与により血清β-HBが有意に上昇したため、Hendersonら11は、ケトン体の上昇が認知機能に及ぼす影響を測定することができた。認知機能の改善は、AD Assessment Scale – Cognitive subscale (ADAS-Cog)11(p4),12のベースラインからの平均変化として測定された。AC-1202を投与された被験者は、プラセボと比較してADAS-Cogスコアが有意に改善したが、アポリポタンパクE遺伝子のイプシロン4アリルを持たない(すなわちApoE4(-))場合に限られた。ApoE4(-)の遺伝子変異を持つ被験者(ApoE4(+))は、プラセボとの有意差はなかった11。これらの結果は、ケトン体がADの治療に有用なのはApoE4(-)の人だけであることを示唆しているが、これらの知見をより詳細に検討することで、ADの病理の根本的なメカニズムを明らかにすることができるだろう。
Hendersonらの研究11の大きな限界は、参加者の食事管理ができていないことである。著者らは、参加者が「通常の食事」をしていたと述べており、MCT治療と並行して特に炭水化物を制限していないことを示している。てんかんの治療において、古典的なKDの代替として中鎖脂肪酸ケトジェニックダイエット(MCTKD)が用いられているが13,MCTKDでも多少の糖質制限は行われている14。今回の研究では糖質制限を行わなかったため、さまざまな点で結果に影響が出たと考えられる。グルコースの摂取量が多いと、ケトン体の産生が阻害されるため15,参加者の食事による炭水化物の摂取量が、本研究で達成できるKBのレベルを制限する可能性がある。さらに、本研究の著者らは、ApoE4(-)の参加者で治療効果が得られなかったのは、ミトコンドリアの酵素機能が低下しているか、インスリン感受性に問題があるためではないかと推測している。インスリン感受性が根本的な問題であれば、炭水化物の摂取量が結果に影響を与えた可能性がある。2型糖尿病は、ADのリスクを約2倍に高めることが知られており1,この2つの疾患の病態が類似していることから、ADを「3型糖尿病」と呼ぶ人もいる16,17。Van der Auweraら9は、KD飼料を与えたマウスでAβが減少したという研究で、炭水化物の摂取量を減らさずに脂肪の摂取量を増やした他の研究では、Aβレベルの上昇が観察されたため、逆の効果があったと述べている。さらに、Bredesonら18,19が開発した治療プログラムでは、炭水化物摂取量の減少を含む幅広い代謝介入が行われており、この介入は初期の認知機能低下を回復させる有望な結果を示している。これらの知見は、糖質がADの病態に重要な役割を果たしている可能性を推測させるものである。結局のところ、Hendersonら11の研究結果は、ADの病態における炭水化物の役割について、特にApoE遺伝子の異なる対立遺伝子を持つ人について、さらなる調査が必要であることを示している。
食事による炭水化物制限の役割
Seneff et al 20は、ADの発症におけるApoE遺伝子と炭水化物摂取の役割を結びつけるカスケード効果を提唱している(図2)。この仮説は、これまでに述べた知見を裏付けるものである。
図2 高炭水化物食とADの関連性を示す模式図。
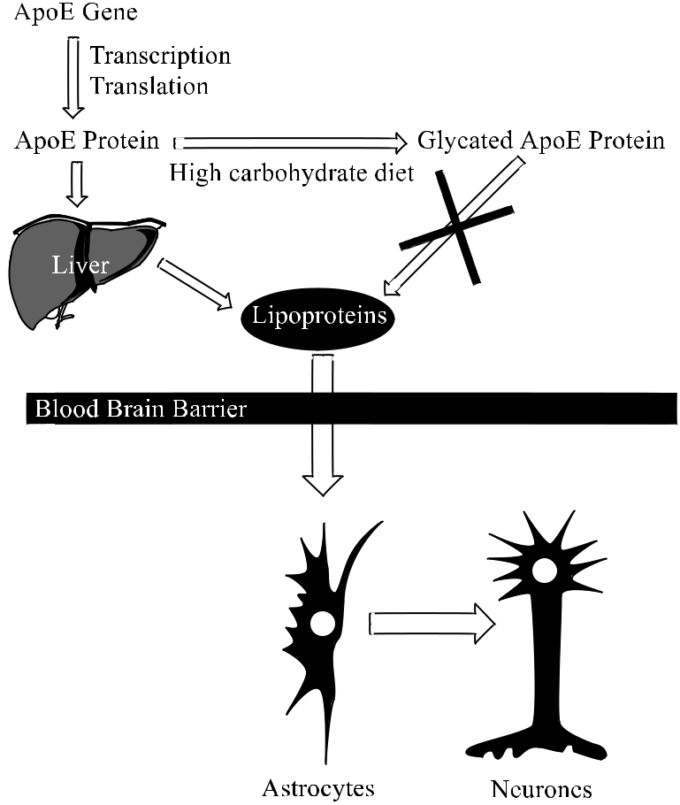
ApoE遺伝子は、対応するmRNAに転写され、それがApoEタンパク質に翻訳される。ApoEタンパク質は、肝臓でのリポタンパク質(コレステロール結合タンパク質を含む)の生合成を調節する。これらのリポタンパク質は、血液脳関門を通過し、アストロサイトに取り込まれて神経細胞に移行し、神経細胞の代謝に重要な役割を果たす。高炭水化物食(特にショ糖などの果糖や果糖を含む炭水化物を多く含む食事)は、肝臓でのリポタンパク質の生成を阻害し、その結果、神経細胞にこれらの必須生化学物質が行き渡らなくなり、アルツハイマー病で見られる神経変性を引き起こす可能性がある(Seneff er al)。17より引用)。
Seneffらは、炭水化物が多く、脂肪が少ない現代の食生活では、食後の血糖値が過剰になり、これがApoEタンパク質を含む重要なタンパク質を損傷するという仮説20を提唱している。ApoEタンパク質は、特に糖化の影響を受けやすく、AGEs(advanced glycation end-products)に変化する。AGEは、アルツハイマー病患者の脳脊髄液や脳に大量に含まれている21。このApoEの糖化損傷により、脂質をアストロサイトに輸送する能力が損なわれ、最終的には神経細胞内のコレステロールを含む重要な脂質が不足することになる。ここから、神経細胞の機能低下、酸化ストレス、ミトコンドリア機能不全のカスケード効果が生じ、最終的には神経細胞が死滅する20。
ADの病態をカスケードで説明すること20は、上述した研究成果の多くを支える可能性がある。例えば、糖尿病とADの関連性は、インスリン抵抗性と血糖値の上昇がApoEタンパク質の糖化を促進することに起因すると考えられる。さらに、E4変異株の遺伝子から転写・翻訳されたApoEタンパク質は、他のApoE遺伝子変異株のタンパク質に比べて、3倍ものAGE結合性を持つ22。このことから、ApoE4(+)の人は、Seneff et al 20が提唱したカスケード効果の影響を受けやすく、AD発症のリスクが高いことが示唆されている。また、Hendersonらの研究で、ApoE4(-)の人には有意な改善が見られたが、ApoE4(+)の人には見られなかったのは、この研究の参加者がまだ炭水化物を摂取していたからだと考えられる。最後に、Aβレベルは脂質化ApoEのレベルに依存して増減する。つまり、脂質化ApoEの欠損はAβの増加につながり、一方、脂質化ApoEが豊富であればAβのクリアランスが促進される可能性がある23,24。このことは、Van der Auweraら9がKDを摂取したマウスでAβの減少を観察した理由を説明することができる。KDは血糖値を低下させることで糖化を抑制すると同時に、脂質の利用可能性を高め、その両方の効果によって脂質化ApoEが増加すると考えられるからである。この脂質化ApoEの増加は、神経細胞の成長と機能に重要な脂質をアストロサイトに供給し、Seneff et al 20が提唱したカスケード効果を防ぐ可能性がある(図2)。これらの証拠から、ApoEタンパク質の糖化とその結果として生じる下流の影響が、ADの病理の要素を説明している可能性があり、KDは血糖値の安定化と重要な脂肪(コレステロールを含む)の利用可能性を高めることで障害を軽減する可能性があると考えられる。
今後の研究…
今後の研究では、MCTによるケトン体の上昇のみに焦点を当てるのではなく、完全なKDのAD治療としての可能性を探る必要がある。KDには、クラシックKD、MCTKD、修正アトキンスダイエット、低血糖治療(LGIT)の4つのバリエーションがある14,25(p308-310),26。これらはいずれもてんかん13,26-28の治療に有効であり、KBを増加させ、特にクラシックKD、MCTKD、LGITは低血糖療法とされ、安定した血糖値を得ることができるため、ADの治療にも有用である可能性がある14(p11)。もし、KDがADの治療に有望であることがわかった場合、これらのバリエーションによる有効性の違いは、ケトン体と糖化制御の相対的な重要性を示すことにもなる。例えば、クラシックKDとMCTKDは、LGITよりも高いレベルのKBsを生成する14(p10),28。もしクラシックKDとMCTKDがより効果的であれば、ADの治療にはより高いレベルのKBsが重要であることを示していると考えられる。一方、LGITが同等の効果を示した場合には、血糖値がコントロールされていれば、KBsのレベルは低くても十分であることを示している可能性があり、糖化が病気の発症に顕著な要因であることを示唆していると考えられる。
また、予防策の効果の可能性についても評価する必要がある。ADの根本的な原因が食生活などの生活習慣にあり、遺伝的な要因がこれを悪化させるケースもあるとすれば、現代の食生活の規範を変えることで、将来的にADの有病率を下げることができるかもしれない。例えば、果糖はグルコースによる量の最大10倍のAGEsを生成する29。興味深いことに、果糖は、食品業界で高果糖コーンシロップが広く使用されているため、多くの人気のある甘味飲料や加工食品に含まれている30,31。アルツハイマー病患者には甘いものを欲する傾向があり32,33,もしこのような食の嗜好が早期に発現するならば、これらの人々が選択する食事はAD発症のリスクに寄与する可能性がある。
これまでの研究では、ADの治療および予防戦略としてのKDの効果を評価するには限界があった。今後の研究では、ADの病理がApoEの糖化につながる初期の代謝の問題にどの程度支えられているか、また、早期の食事介入がADの予防にどの程度有効かを調べる必要があるだろう。これは、遺伝的危険因子や主な生活習慣の危険因子1を持つ人や、脳のグルコース代謝の初期障害を示す人を対象にした研究が重要かもしれない。
仮説
我々は、これらの食事や代謝の影響が、ADの基礎的な病理に重要な役割を果たしているのではないかと考えている。したがって、ケトン体レベルの上昇と炭水化物の減少を伴うケトジェニックな食事は、ADの効果的な治療法および予防法となる可能性がある。ケトン体の上昇は、脳の代謝を改善し、Aβプラークの蓄積を抑え、Aβの毒性を逆転させて、神経細胞の死ではなく神経新生をサポートする可能性がある。炭水化物の摂取量を減らすことで、KBsのレベルを上げることができる。また、糖化を防ぐことでAGEsのレベルを下げ、最終的には脂質化したApoEの利用率を上げることで、KDの有益な効果に貢献することができる。その結果、コレステロールなどの重要な脂質が脳内で欠乏するのを防ぎ、Seneffらが提唱したカスケード効果を抑制することができるかもしれない(図2)20。以上のことから、高脂肪・低炭水化物のKDは、ますます普及し、衰弱していく神経変性疾患の効果的な予防・治療戦略になると考えられる。
