Contents
The intracellular renin-angiotensin system: Friend or foe. Some light from the dopaminergic neurons
www.ncbi.nlm.nih.gov/pmc/articles/PMC7543790/
要旨
レニン-アンジオテンシン系(RAS)は、脊椎動物の系統において最も古いホルモン系の一つである。RASは当初、血圧の調節、ナトリウムと水の恒常性の調節に関連していたが、その後、多くの組織で局在性またはパラクライン性のRASが同定された。
しかし、その後、脳を含む多くの組織に局在するRASやパラクリンRASが同定され、その生理・病態生理に大きな役割を果たしていることが明らかになっていた。さらに、主要成分であるACE2は、SARS-CoV-2の侵入受容体である。組織RASの過剰活性化は、老化に関連した変性変化に関与するいくつかの酸化ストレスおよび炎症性プロセスを導く。さらに、第三のレベルのRAS、細胞内または頭蓋内RAS(iRAS)が観察されているが、その機能はまだ不明である。
細胞内RASと細胞外RASの相互作用の可能性、特にiRASの活性化がもたらす悪影響や有益な効果については議論の余地がある。ドーパミンとRASの間の重要な機能的相互作用が脳やいくつかの末梢組織で観察されていることから、ドーパミン作動系は特にRASを研究する上で興味深いものである。
ドパミン作動性ニューロンのミトコンドリアや核での最近の観察から、iRASの役割が明らかになるかもしれない。これは、細胞外および細胞内RASの両方への影響を考慮に入れなければならず、おそらくCOVID-19細胞のメカニズムをよりよく理解しなければならないので、新しい治療戦略の開発に重要であるかもしれない。
略語
ACE、アンジオテンシン変換酵素;Ang II、アンジオテンシンII;ARES、抗酸化応答エレメント;AT1,ang II型受容体;AT2,ang II型受容体;中枢神経系、中枢神経系;ER、小胞体;GCPR、Gタンパク質共役型受容体;IGF-1,インスリン様成長因子1;mitoKATP、ミトコンドリアATP感受性カリウムチャネル;NAC、N-アセチルシステイン。NFE2,L2,核内因子-エリスロイド2関連因子2;NO、ミトコンドリア一酸化窒素;NOS、一酸化窒素合成酵素;NOX、NADPH-オキシダーゼ複合体;OS、酸化ストレス。PGC-1α、ペルオキシソーム増殖因子活性化受容体γ共活性化因子1α;PRR、プロレニン受容体;RAS、レニン・アンジオテンシン系;ROS、活性酸素種;SHRs、自然発症高血圧ラット;SIRT1,サーチュイン1
サブジェクトコード ACE/アンジオテンシン受容体/レニンアンジオテンシン系, 細胞生物学/構造生物学, 細胞シグナル伝達/シグナル伝達, 酸化ストレス
キーワード アンジオテンシン、COVID-19,頭蓋内、ミトコンドリア、核、酸化ストレス
1. はじめに
レニン-アンジオテンシン系(RAS)は、100年以上前にTigerstedtとBergman(1898)によってウサギの腎臓の抽出物を用いて最初に記述された。RASは脊椎動物の系統において最も古いホルモン系の一つであり、ウナギなどの脊椎動物ではすでに観察されており、水生から陸生への適応の過程で重要な役割を果たしていた可能性がある(西村 2017; Wong and Takei 2018)。これと一致するように、RASは当初、血圧やナトリウム・水の恒常性の調節に大きな役割を果たす循環ホルモン系と考えられていた。しかし、その後、脳組織を含む多くの組織において、局所的またはパラクリンRASが同定され、それらの組織の生理・病態生理に大きな役割を果たしていることが明らかになった。末梢組織では、ホルモンRASと組織パラクリンRASの両方が一緒に作用している可能性がある。しかしながら、いくつかの研究は、循環中のRASが組織の活性にとってパラクリンRASよりも有意に重要ではないことを示唆している(Ganong, 1994)。これと一致して、心臓の局所または組織アンジオテンシンは、心臓組織アンジオテンシン全体の75%である可能性がある(Danser et al 1994;De MelloおよびFrohlich 2014)。しかしながら、循環からのRAS成分は、アンジオテンシンペプチドを生成するRAS成分の局所合成と共に局所アンジオテンシン合成に参加することができる(Danser et al 1994)。
アンジオテンシン II (Ang II) は、システムの主要なエフェクターペプチドであり、前駆体の糖タンパク質であるアンジオテンシノーゲン上で、レニンとアンジオテンシン変換酵素 (ACE) という 2 つの酵素の逐次的な作用によって生成される。Ang IIは2つの主要なGタンパク質共役受容体(GCPR)に作用する。Ang IIタイプ1および2(AT1およびAT2)受容体である。AT2受容体の作用は、通常、AT1受容体によって発揮されるものとは対照的である(McCarthy et al 2013)。AT1受容体を介した組織RASの過剰活性化は、いくつかの酸化ストレスおよび炎症性プロセスをもたらし、これらは、多くの組織における老化に関連した変性変化に関与しているようである(Benigni et al 2009; de Cavanagh et al 2015)。スーパーオキシドおよびスーパーオキシド由来の活性酸素(活性酸素種)の細胞内生成をもたらす、細胞膜NADPH-オキシダーゼ複合体2(Nox2)の活性化は、AT1活性の親酸化性および親炎症性効果において主要な役割を果たす(Grammatopulos et al 2007;Labandandeira-Garcia et al 2013;Rodriges-Pallares et al 2008)。
より最近では、いくつかの新しいペプチドおよび受容体がRASの機能に関与している。Ang(1〜7)AngIIIIおよびAngIVなどの追加のアンジオテンシンペプチドは、機能的効果を誘導する。Ang IVは、膜貫通酵素であるインスリン調節膜アミノペプチダーゼ(IRAP)を介して作用する(Albiston et al 2001; Chai et al 2004)。Ang(1-7)およびアラマンジンは、Gタンパク質共役型受容体Mas(Kostenis et al 2005; Santos et al 2003,2018)およびMrgDなどのMas関連GPCRメンバー(Mrg)を介して作用することにより、親酸化性Ang II/AT1軸の活性化の影響を打ち消す(Hrenak et al 2016)。アラマンジンは、アンジオテンシン-(1-7)のAsp残基の脱炭酸によって形成され、N末端アミノ酸としてのAlaの形成をもたらし、「劇症的」アンジオテンシン1-7だけでなく、「保護的」アンジオテンシン1-7からも生成され得る(Hrenak et al 2016)。レニンおよびその前駆体であるプロレニンのための新しい受容体も観察され、この前駆体にレニンと同様の触媒特性を与えるプロレニンに結合する。さらに、プロレニン受容体(PRR)は、AT1受容体の活性化によって誘導されるものと同様のプロオキシダント効果をもたらす独自のシグナル伝達経路を引き金としている(Nguyen and Contrepas, 2008)。
これらのデータは、RASには2つの主要な軸があることを示唆している。プロ酸化性および抗炎症性のアームは、Ang II/AT1軸を構成し、保護的な抗酸化性および抗炎症性のアームは、Ang II/AT2,Ang (1-7)/Mas、およびアラマンジン/Mas関連の受容体を含む;プロレニン/PRR、Ang A、Ang III、Ang IVなどの他のRASコンポーネントの役割は、より議論の余地があり、おそらく組織依存性であった(レビューのためにChappell 2016を参照してほしい; Hrenak er al)。 , 2016; Li et al 2017; Paz Ocaranza et al 2020)。) この分野では、ほとんどの研究分野と同様に、文献を分析する際に注意して考慮すべき論争のある結果がある。ほとんどの論争は、おそらく方法論の違いに関連していると思われる。第一の方法論的問題は、異なる結論を導く可能性のある異なる実験用量の使用である。RAS成分の濃度は、異なる組織、細胞および細胞下区画によって異なる(詳細なレビューについてはChappell, 2016を参照のこと)。第二の混乱を招く要因は、市販の非選択性抗体の使用、特にGPCRの場合(Benicky et al 2012; Chappell 2016)抗体の特異性の確認なしに、および/またはRT-PCR、結合実験または受容体アゴニストおよびアンタゴニストを用いた機能的アッセイのような異なる方法論的アプローチによる結果の同時確認なしに使用されることであるかもしれない。我々は通常、いくつかの並行した方法を用いて抗体の特異性を確認するとともに、例えば、融合尾DDK(すなわち、C末端DDKエピトープタグDYKDDK)またはGFP(緑色蛍光タンパク質)にタグ付けされた対応するGPCRをトランスフェクトした細胞からのライセートのウエスタンブロット分析、または対応する合成ペプチド抗原(Valenzuela et al 2016)を用いたプレアゾレーションなどの方法を用いて抗体の特異性を確認する。
循環型RASとパラクリンRASまたはチスラーRASに加えて、最近の多くの研究では、RASの複雑性をさらに高める細胞内RASの存在が示唆されている。Ang IIおよび他のRAS成分の細胞内合成、ならびに異なるRAS受容体が、線維芽細胞、血管平滑筋細胞、心臓細胞、腎臓細胞、およびニューロンを含む多くの細胞において観察された(Escobales et al 2019; Li et al 2018; Re 2018; ReおよびCook 2015)。レニンは、古典的には、腎臓によって産生され、貯蔵され、そして放出される分泌性糖タンパク質として知られている。しかしながら、腎臓が分泌性レニンをコードする転写物を発現するのに対し、他の組織および細胞は、分泌されることができず、細胞内アンジオテンシノーゲンに作用し得る細胞質レニンタンパク質をコードする転写物を追加的にまたは排他的に発現する。いくつかの研究は、細胞質レニンが細胞保護性であるように見えるので、細胞質レニンが循環レニンとは反対の効果を及ぼすことを示している(中川 et al 2020;Wanka et al 2018,2020)。これは、細胞内RASの細胞保護効果についての我々の観察と一致する(下記参照)。しかし、細胞内RASの機能的役割はまだ不明であり、論争の的となっている。
2. 脳内RASについて。ドーパミンとRAS
脳では、RASの作用は、通常の生理学的条件ではAng IIが血液脳関門を通過しないため、当初、血圧およびナトリウム・水の恒常性を調節するニューロンに関連していた(Phillips and de Oliveira, 2008)。しかし、現在、パラクリンで独立した脳内RASが示されている。Ang IIの脳内レベルは、循環レベルよりも高く(Hermann et al 1984)他のRAS成分がいくつかの脳領域で示された。パラクリン系の前駆体タンパク質(アンジオテンシノーゲン)は、主にアストロサイトによって産生され(Hermann et al 1984; Milsted et al 1990; Stornetta et al 1988)ニューロンなどの他の細胞が小さな寄与をすることがある(Kumar et al 1988; Thomas et al 1992)。レニンは脳内で低レベルに位置しているため、一部の著者はそれを検出することができず、脳内Ang IIが血液から取り込まれる可能性があることを示唆し、循環RASとは独立した脳内RASを疑問視していた(van Thiel et al 2017)。しかしながら、レニンの低レベルは、他の多くの研究で観察され(Bader and Ganten, 2002; Lavoie et al 2004)さらに重要なことに、脳は、プロレニンおよびプロレニン受容体の高レベルを有しており、プロレニン受容体に結合したプロレニンは、レニンと同様の触媒特性を提供する(Nguyen and Contrepas, 2008; Valenzuela et al 2010)。この点については、Sigmund et al 2017により詳細に議論されている。
過去10年にわたり、我々は、ヒトを含むげっ歯類および霊長類の黒質および線条体(Joglar et al 2009;Rodriguez-Pallares et al 2008;Valenzuela et al 2010)において、局所的またはパラクリンRASを示してきた(Garrido-Gil et al 2017,2013)。その生理機能に加えて、AT1受容体を介した黒質RASの過剰活性化は、神経炎症、酸化ストレスおよびドーパミン作動性変性を増強する(Grammatopoulos et al 2007; Labandeira-Garcia et al 2013; Rodriguez-Pallares et al 2008)。これと一致するように、我々は、高齢動物および更年期動物のようなドーパミン神経ニューロン脆弱性が増加した動物モデルにおいて、Ang II/AT1プロ酸化/抗炎症軸の過剰活性を観察した(Rodriguez-Perez et al 2012;Villar-Cheda et al 2012)。神経炎症性/ミクログリア応答の調節は、神経変性疾患、脳卒中、外傷性脳損傷を含む多くの脳疾患の進行に脳RASが関与する主要なメカニズムである。しかしながら、これについては、すでに以前の論文で詳細にレビューされている(Hammer et al 2017; Labandeira-Garcia et al 2017; Rodriguez-Perez et al 2020; Saavedra 2012)。
ドーパミンとRASとの間の重要な機能的相互作用がいくつかの組織で観察されているので、ドーパミン作動系はRASを調査するのに特に興味深い。中枢神経系では、ドーパミンは運動や行動を調節する神経伝達物質である。しかしながら、ドーパミンはまた、心血管系、腎系、内分泌系、胃腸系および免疫系の機能にも関与している(Mackie et al 2018;Missale et al 1998;VidalおよびPacheco 2019)。ドーパミンD1様およびD2様受容体サブタイプは、脳だけでなく、腎臓、心臓、血管、副腎、後神経交感神経末端、胃腸管、およびほぼすべての免疫細胞亜集団などの末梢器官においても発現する(Mackie et al 2018;Missale et al 1998;VidalおよびPacheco 2019)。これらの器官のほとんどにおいて、ドーパミンと局所RASとの間の重要な機能的相互作用が実証されている。この相互作用は、ドーパミンおよびアンジオテンシン系が直接的に互いにカウンターレギュレーションする腎臓ナトリウム排泄および心血管機能の調節において特に研究されてきた(Gildea, 2009; Gildea et al 2019)。さらに、Ang IIおよびドーパミン受容体の二量体化が、腎細胞において観察されている(Durdagi et al 2019)。これと矛盾しないように、いくつかの研究は、ドーパミンおよびアンジオテンシン受容体発現の変化(Chugh et al 2012)またはドーパミンまたはアンジオテンシンレベルの変化(Yang et al 2012)のような、DAとRASの間の相互作用の調節障害が、腎変性疾患および高血圧において主要な役割を果たすことを示している。
脳において、Ang IIとドーパミンの相互作用は、当初、Ang IIの急性線条体灌流が線条体ドーパミン放出をもたらし、それがAT1アンタゴニストによって阻害されることを観察したマイクロダイアリシス研究によって示唆された(Brown et al 1996; Mendelsohn et al 1993)。より最近、Ang IIは、カテコールアミン生合成のための2つの重要な酵素であるチロシンヒドロキシラーゼおよびドーパミンβ-ヒドロキシラーゼの牽引および発現を調節することによって、ノルエピネフリンおよびドーパミンの軸索合成を調節することが観察された(Aschrafi et al 2019)。我々は、黒質系におけるドーパミン受容体とアンジオテンシン受容体との間のカウンターレギュレーション(Villar-Cheda et al 2014,2010)および線条体ニューロンにおけるAT1受容体とD2受容体との間の二量体化(Martinez-Pinilla et al 2015)を示している。腎系および心血管系で観察されたものと同様に、RAS/ドパミン相互作用の調節異常が神経炎症の悪化およびドパミン神経ニューロン変性をもたらすことを示している(Dominguez-Meijide et al 2017;Villar-Cheda et al 2014)。
3. 細胞内RAS
循環・ホルモン性RASとパラクリン・組織RASでは、細胞膜上に位置する異なるアンジオテンシン受容体に作用するアンジオテンシン関連ペプチドによって機能的な作用が誘導され、細胞内の変化をもたらす。しかしながら、心筋細胞、腎臓細胞、線維芽細胞、血管平滑筋、神経細胞などの様々な細胞において、核、ミトコンドリア、小胞体などの細胞内小器官に異なるRAS成分が存在することが多くの研究で示されている。また、細胞内注射やウイルスベクターを用いて細胞内レベルでアンジオテンシンを導入して細胞内Ang IIを産生すると、細胞膜受容体の活性化に由来するものとは無関係に、遺伝子発現の変化を含む一連の機能的効果が得られた(Baker et al 2004; Deliu and Tica 2011)。これに基づいて、第3レベルのRAS(すなわち、細胞内または頭蓋内RAS;iRAS)の存在が示唆されている(Abadir et al 2011;AlzayadnehおよびChappell 2015;Coock et al 2001;da Silva Novaes et al 2018;Eggena et al 1993年;Gwathmey et al 2012;Kumar et al 2012a;ReおよびCoock et al 2010)。さらに、細胞内RASのいくつかの効果は、細胞外アンジオテンシン受容体アンタゴニストの投与に依存しないことが示されており、細胞内アンジオテンシンによって誘導される変化が細胞膜受容体に依存しないことをさらに確認している(De MelloおよびMonterrubio 2004;Tadevosyan et al 2017)。これは、プリン体受容体、5-ヒドロキシトリプタミン(5-HT4)受容体、メラトニンMT1受容体またはカンナビノイドCB1受容体などの他の細胞内GPCRの細胞機能における重要な役割を示す最近の研究と一致する(レビューのためにJong et al 2018を参照のこと)。
いくつかの研究は、iRASが、イオンチャネル活性、Ca2+ホメオスタシスの調節、または細胞外マトリックス成分の分泌を含む重要な細胞プロセスに関与していることを示している(Deliu et al 2014; Jong et al 2018; Kamal et al 2017; Zhuo et al 2006)。ミトコンドリアおよび核(以下を参照)におけるiRASの効果に加えて、AT1およびAT2受容体が小胞体(ER)で観察されている。ERはCa2+貯蔵を調節する異なるタンパク質を発現しており、Ang IIはCa2+動員に大きな役割を果たすsarco(endo)小胞体カルシウムATPase(SERCA)活性を刺激する可能性がある(Ferrao et al 2017, 2012)。しかしながら、細胞内および細胞外RASの間の可能な相互作用、特にiRAS活性化の可能な劇症的または有益な効果については、特に論争の的となっている(Baker et al 2004; Cook et al 2001; Re, 2018; Tadevosyan et al 2017)。これは、主要な心血管系疾患、腎疾患、および場合によっては脳疾患のためのRAS成分の操作に基づく新しい治療法の設計にとって極めて重要である。心筋細胞、線維芽細胞、および腎臓細胞などの末梢細胞における多くの研究は、糖尿病性高血糖症によって誘導されるような高レベルの細胞内Ang IIが、酸化ストレスおよび細胞および組織の損傷につながることを示してきた(Kumar et al 2012b; Redding et al 2010; Singh et al 2008)。これと矛盾しないように、通常、iRASが細胞外RASの親酸化性Ang II/AT1軸の効果を増幅している可能性があり、細胞内RASの阻害がRAS誘発性の親酸化性炎症効果に対して臨床的利益を誘導する可能性があると想定されてきた(Carey, 2012; Cook and Re, 2012)。しかしながら、脳のミトコンドリアおよびドーパミン作動性ニューロンからの核に対するiRASの影響に関する最近の研究の結果(Costa-Besada et al 2018;Valenzuela et al 2016;Villar-Cheda et al 2017)は、この問題がより複雑である可能性を示している。細胞内RASは、AngII/AT1/NADPH-オキシダーゼ活性化のプロ酸化作用を生理的に緩衝している可能性がある。しかしながら、iRASの緩衝能力は、Ang II/AT1活性の過剰、および/またはAng II/AT1複合体の過剰な内部化に関連した細胞内Ang IIの過剰によって圧倒されるかもしれない。異なる細胞タイプにおける細胞内受容体タイプ間の分布またはバランスの違い、または老化または病理学のような状況は、iRAS活性の効果を変更する可能性がある。これと一致して、ミトコンドリアAT1/AT2比の増加が糖尿病性腎症の腎細胞で観察され、ミトコンドリアAT2受容体を過剰発現させたラットは、糖尿病誘発性腎変質の減少を示した(Friederich-Persson and Persson, 2020; Micakovic et al 2018)。ドーパミン作動性ニューロンのミトコンドリアおよび核に対するiRASの効果に関する最近の観察は、この問題を明らかにするために特に興味深いように思われる。
4. ミトコンドリアのRAS
4.1. ミトコンドリアにおけるRAS成分の存在
ミトコンドリアRASの存在の可能性は、副腎、腎臓、または小脳皮質からの細胞におけるレニン、ACE、およびAng IIのような異なるRAS成分を観察した後、特に電子顕微鏡またはラベルされたAng II研究の取り込みを使用して示唆された(Erdmann et al 1996; Peters et al 1996; van Kats et al 2001)。より最近になって、Ang I、Ang II、およびAng 1-7のような多数のRAS成分の存在が、腎臓皮質から単離されたミトコンドリアにおいて確認された(Wilson et al 2016,2017)。ミトコンドリアのアンジオテンシンは細胞質から輸入されている可能性がある。ミトコンドリア外膜は、ミトコンドリア内でのタンパク質の認識およびトランスロケーションを担当するマルチサブユニット複合体を含んでいることが知られている(Model et al 2002)。しかし、異なるRAS成分の取り込みの可能性については、現時点では明らかにされていない。興味深いことに、ミトコンドリアのアンジオテンシノーゲンが腎臓細胞の細胞質から取り込まれ得ることが示されている(Wilson et al 2017).cytosolicレニンもまた、ミトコンドリア内に局在化されている(Clausmeyer et al 1999; Wanka et al 2018, 2020)。Altogetherは、Ang 1-7を含むアンジオテンシンもミトコンドリア内で生産される可能性があることを示唆している。これと一致するように、我々は、ミトコンドリア内で高レベルのACE2を観察しており、これは、ミトコンドリアのAng IIの分解および保護Ang 1-7の生成を媒介している可能性がある(下記参照)。
AT1およびAT2受容体は、いくつかのタイプの細胞のミトコンドリアにおいて観察され(Abadir et al 2011,2012)ミトコンドリア中のGタンパク質の存在も示されている(Lyssand and Bajjalieh 2007; Suofu et al 2017)。現在のデータは、これらの受容体がミトコンドリアのDNAによってコードされていないことを示しているので(Calvo et al 2016)、これらの受容体は、トランスロケーションプロセスを経てミトコンドリアに到達するようである。細胞質において、AT1受容体は、Ang II/AT1複合体の内部化からのもの、またはde novo合成されたAT1受容体からのものの両方が利用可能である(Hunyady, 1999; Thekkumkara and Linas, 2002)。通常、AT2受容体は、Ang IIを結合した後に内部化されず、細胞質プールはde novo合成されたAT2受容体に由来すると考えられている(Gwathmey et al 2011; Tadevosyan et al 2010)。シグナルペプチドまたはグリコシル化の組み込みを含む転写後の変化は、ミトコンドリアを含む異なる細胞小器官へのAT1およびAT2受容体のトラフィッキングにつながる可能性がある(Helenius and Aebi, 2004; Singh et al 2008)。また、細胞外Ang IIがAT1およびAT2受容体のヘテロ二量化を誘導することで、AT2受容体がヘテロ二量体として内部化される可能性も示唆されている(Ferrao et al 2012, 2017)。
4.2. ミトコンドリアアンジオテンシン受容体の機能的効果
我々は、培養されたドーパミン作動性ニューロンのミトコンドリアおよびげっ歯類黒質のニューロンのミトコンドリア、ならびにこれらの供給源から単離されたミトコンドリアにおけるAT1,AT2およびMas受容体の位置を示した(Costa-Besada et al 2018; Garrido-Gil et al 2017; Valenzuela et al 2016)。さらに、非ミトコンドリアのアンジオテンシン受容体、特に形質膜受容体に由来する可能性のある影響を防ぐために、単離されたミトコンドリアにおける機能的研究を含む、アンジオテンシンミトコンドリア受容体の可能性のある役割を明らかにするための機能的研究を行った。我々は、AT2受容体が細胞膜レベルに位置していたが、ミトコンドリアレベルで特に豊富であったことを観察し、一方、AT1受容体は細胞膜および核でより豊富であったが、Mas受容体も同定されたミトコンドリアではAT2よりも少ないことを観察した(Costa-Besada et al 2018; Valenzuela et al 2016; Villar-Cheda et al 2017)。ドーパミン作動性ニューロンから分離されたミトコンドリアにおいて、AT1およびAT2受容体が呼吸機能の制御に役割を果たすことを示した。以前に形質膜AT1およびAT2受容体の機能について観察されたように(McCarthy et al 2013; Rodriguez-Perez et al 2020)ミトコンドリアのAT1およびAT2受容体は、ミトコンドリアの呼吸速度に対して反対の効果を誘導する。通常、ミトコンドリアにおいてAT1よりもはるかに多く存在するAT2受容体は、中程度ではあるが有意な呼吸の減少を誘導する。しかしながら、AT1の活性化は、ミトコンドリアの呼吸を増加させる(Abadir et al 2011;Valenzuela et al 2016)。これと一致するように、AT2受容体またはAT1受容体を欠損したマウスから単離されたミトコンドリアは、それぞれ呼吸速度の増加または減少を示した(Valenzuela et al 2016)。単離されたミトコンドリアにおいて、AT2受容体の活性化が、ミトコンドリアの一酸化窒素合成酵素(NOS)活性化を促進し、ミトコンドリア膜電位の有意な変化なしにミトコンドリア呼吸を調節するミトコンドリアの一酸化窒素(NO)レベルの増加につながることを観察したが、これは、ミトコンドリアの生体エネルギー特性が変化しないことを意味する。ミトコンドリアAT1の活性化は、ミトコンドリアNox4を介してスーパーオキシドの産生につながり、ミトコンドリア呼吸を増加させた(Valenzuela et al 2016)(図1)。
図1 ミトコンドリアのアンジオテンシン受容体による酸化的リン酸化の調節
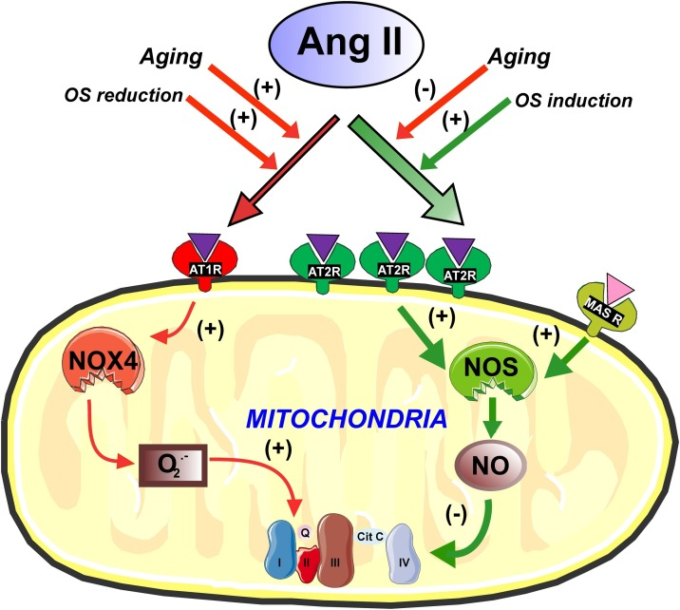
ミトコンドリアAT1受容体は、Nox4を介して、スーパーオキシド産生を誘導し、呼吸を増加させる。AT2受容体はミトコンドリアにおいてAT1よりも多く存在する。AT2受容体とMas受容体は、一酸化窒素を介してミトコンドリア呼吸の減少を誘導し、ミトコンドリア膜電位に大きな変化を与えることなく酸化的リン酸化を調節することから、ミトコンドリアの生体エネルギー特性は変化していないことが示唆される。細胞を酸化ストレス(OS)誘発剤で処理すると、ミトコンドリアAT2受容体のレベルが代償的に増加し、抗酸化剤で処理するとAT1受容体のレベルが増加する。ミトコンドリアAT2およびMas受容体は、呼吸を調節し、正常な細胞機能の間、低レベルのOSの影響を相殺する可能性がある。老化は、AT2およびMas受容体の減少およびAT1ミトコンドリア受容体の増加をもたらし、これはミトコンドリア機能不全および細胞死に寄与する可能性がある。
ドーパミン細胞では、Ang 1-7はミトコンドリアレベルに豊富に存在していた。Ang 1-7(下記参照)は、ミトコンドリアレベルの一酸化窒素を増加させ、Ang II誘導によるスーパーオキシドレベルの増加およびミトコンドリア呼吸の変化を抑制した(Costa-Besada et al 2018)。これは、Ang II/AT1/Nox2/スーパーオキサイド軸のプロ酸化性の炎症性効果がAng 1-7/MasRおよびAng II/AT2および保護軸によって打ち消されることを示す以前の研究と一致している(Paz Ocaranza et al 2020; Santos et al 2018)。ドーパミン細胞における我々の観察は、Ang II/AT2およびAng 1-7保護軸による活性酸素レベルの調節のための主要な部位としてのミトコンドリアレベルを示唆している。
ドーパミン作動性ニューロンにおける我々のデータは、ミトコンドリアのアンジオテンシン受容体がミトコンドリア呼吸に影響を与える他の因子の影響を緩衝する可能性を示唆している。ドーパミン作動性神経毒であるMPP+を極低用量で投与すると、神経細胞の酸化ストレスが増加し、ミトコンドリアAT2受容体のレベルが上昇することが観察された。逆に、N-アセチルシステイン(NAC)などの抗酸化物質をニューロンに投与すると、ミトコンドリアAT1受容体のレベルが上昇した。細胞の酸化ストレスの増加は、ミトコンドリアに次ぐ細胞内のスーパーオキシドの第二の主要な供給源である細胞膜NADPH-オキシダーゼ複合体(Nox2)の活性化を誘導するパラクリンAng IIによる細胞膜AT1受容体の活性化の結果であると考えられる(Babior, 2004)。異なる細胞タイプでは、細胞膜Nox2とミトコンドリアとの間の活性酸素媒介性相互作用(すなわち、クロストークシグナル伝達)が観察され、Nox2放出スーパーオキシドに由来する活性酸素は、ミトコンドリアATP感受性カリウムチャネル(mitoKATP)の開通をもたらし、ミトコンドリア活性酸素の生成を増強する(Daiber 2010;Ou et al 2016;Wosniak et al 2009;Zhangら、Gutterman 2007)。我々は、ドーパミン神経ニューロンの培養物においてこれを確認しており、ミトKATPチャネルのブロッカーは、ドーパミン神経ニューロンにおけるAng II誘発性のスーパーオキシド産生の増加を阻害することを確認している(Rodriguez-Pallares et al 2009,2012)。活性酸素産生の亢進は、ミトコンドリアDNA損傷およびミトコンドリアタンパク質の酸化を引き起こし、ミトコンドリア機能不全を引き起こす可能性がある。活性酸素産生の亢進は、細胞質にも影響を与え、細胞機能不全を引き起こす。細胞内スーパーオキサイドは、主にNAPH-オキシダーゼによるNADPHの酸化、またはミトコンドリアの好気性呼吸からの電子漏洩によって生成されることが知られている。スーパーオキシドは、コンパートメント特異的スーパーオキシドジスムターゼ(SOD)によって、急速に過酸化水素(H2O2)に変換される。H2O2は、酸化還元プロセスを開始するためにタンパク質上のシステイン残基を酸化することができる。あるいは、H2O2は、細胞抗酸化タンパク質によってH2O2に変換されてもよい。細胞の抗酸化機構が不十分であり、H2O2レベルが制御不能に増加すると、金属カチオン(Fe2+)との反応を介してヒドロキシルラジカル(OH-)が生成され、細胞の高分子を不可逆的に損傷する(レビューのためにSchieberおよびChandel 2014を参照のこと)。上記のように、ミトコンドリアに作用するパラクリンAng IIまたは他の活性酸素源による細胞膜AT1/NADPH-オキシダーゼ軸の活性化によって誘導される酸化ストレスは、AT2受容体およびAng 1-7受容体などのミトコンドリアRAS抗酸化成分によって打ち消され、おそらく中等度または生理学的レベルの酸化ストレスの範囲内で、相殺され得る。
4.3. 老化と疾患におけるミトコンドリアRAS
ミトコンドリアのAng II AT2およびAng 1-7受容体の緩衝能が、異なる種類の細胞または異なる条件で変化する可能性がある。興味深いことに、加齢がミトコンドリアAT1/AT2受容体比および細胞酸化ストレスに対する上述のミトコンドリア受容体応答に影響を与えることが明らかにされた(Abadir et al 2011;Valenzuela et al 2016)。血漿膜Ang II/AT1/NADPH-オキシダーゼ軸の過剰活性化および酸化ストレスのレベルの増加が、老化した動物からのドーパミン作動性ニューロンにおいて観察された(Villar-Cheda et al 2014,2012)。しかし、高齢ラットから分離されたミトコンドリアは、若いラットと比較して、ミトコンドリアAT1受容体レベルの増加およびミトコンドリアAT2およびAng 1-7/MAS保護軸の減少を示した(Costa-Besada et al 2018; Valenzuela et al 2016)。これは、正常な老化の間に観察されるミトコンドリアの機能不全に寄与し、老化したドーパミン作動性ニューロンおよびパーキンソン病などの老化関連神経変性疾患のより高い脆弱性につながる可能性がある(Hauser and Hastings, 2013; Rodriguez et al 2015)。同様の変化は、疾患条件下でも起こりうる。腎皮質のミトコンドリアを対象とした最近の研究では、ミトコンドリアAT1受容体を介したAng IIが糖尿病動物のミトコンドリアリーク呼吸を増加させ、AT2ミトコンドリア活性化がミトコンドリア呼吸を減少させることが明らかになっている(Friederich-Persson and Persson, 2020)。
4.4. SARS-CoV-2およびCOVID-19疾患の細胞作用におけるミトコンドリアACE2の役割の可能性
上述のように、ACE2は、劇症的なAng IIの分解と保護的なAng 1-7の生成を媒介するため、抗炎症性抗酸化RAS軸の重要な構成要素である。しかし、ACE2は、SARS-CoVウイルスが細胞に侵入するための侵入受容体でもある(Kuba et al 2005;Yan et al 2020)。これら2つの相反する作用により、ACE2はCOVID-19病の諸刃の剣と考えられるようになった。いくつかの臓器がウイルスによって影響を受け、特に肺病変が危険である。中枢神経系も影響を受け(Baig et al 2020;Saavedra 2020年)COVID-19患者の約36%(重症例の45%)が神経学的症状を示した(Mao et al 2020)。通常、ウイルス誘発性の組織ACE2の減少およびそれに続くAng II/AT1プロ炎症性およびプロオキシダント軸に対する組織RAS機能の調節障害が、異なる臓器におけるCOVID-19疾患で観察される炎症過程において主要な役割を果たしていると考えられている。しかしながら、ウイルスに関連したACE2のダウンレギュレーションと細胞の親酸化性および親炎症性応答とを結びつける正確なメカニズムは明らかにされていない。通常、細胞膜Mas受容体に対するACE2由来のAng1-7の作用が細胞内有益な抗酸化作用に関与しており、これは細胞膜ACE2に対するウイルスの作用によってダウンレギュレートされるであろうと想定されている。
最近、非ヒト霊長類の脳から単離されたミトコンドリアで確認されたラット脳からの単離ミトコンドリア(Costa-Besada et al 2018)では、ACE2とAng1-7の両方が全細胞ホモジネートよりもミトコンドリア画分にはるかに高濃度であり、ミトコンドリア画分におけるAng1-7のレベルはAngIIのレベルの約3倍であることが観察された。このことは、ミトコンドリアの機能において、ミトコンドリアACE2とその生成物であるAng1-7が重要な役割を果たしていることを示唆している。これまでのいくつかの研究で、SARS-CoVウイルスを含むウイルスがミトコンドリアプロセスを修飾することによって細胞機能を修飾することが示されており(Boya et al 2004;Yuan et al 2006)SARS-CoV-2の内部化および複製の影響の結果としてのミトコンドリアACE2/Ang1-7軸の調節障害が、COVID-19病における細胞変化に大きな役割を果たしている可能性がある。SARS-CoVウイルスゲノムから生成されたいくつかのタンパク質は、ミトコンドリア標的化配列を有する(Singh et al 2020;Yuan et al 2020)。コロナウイルススパイクタンパク質は、スパイクタンパク質を小胞体に回収することができる小胞体回収シグナルを含む(Lontok et al 2004;Sadasivan et al 2017)。ウイルススパイクタンパク質とミトコンドリアとの直接的な相互作用は現時点では実証されていないが、ミトコンドリアACE2との相互作用は、MAMs(ミトコンドリア関連膜コンパートメント)を介したものである可能性がある(Williamson and Colberg-Poley, 2009)またはメカニズムは解明されていない。
5. 核内のRAS
5.1. 核内のRAS成分の存在
アンジオテンシン受容体は、異なるタイプの腎細胞および心血管系細胞からの核において観察されている(AlzayadnehおよびChappell 2015;Eggena et al 1993;Gwathmey et al 2012;Tadevosyan et al 2017)。クロマチン上のAng II結合部位も示唆されている(Re et al 1984)が、クロマチン結合の性質は不明であるが。レセプターの核への輸送のメカニズムは完全には解明されていない。いくつかの研究では、AT1受容体の細胞膜から核へのトランスロケーション(すなわち、受容体媒介エンドサイトーシスを介したAT1受容体複合体の内部化)が示されているが、新規に合成されたAT1受容体も核膜に取り込まれる可能性がある(Bkaily et al 2003; Cook et al 2006; Hunyady、1999; ThekkumkaraおよびLinas 2002; Villar-Cheda et al 2017)。AT2受容体の核への輸送は、それらが共通の核輸送ドメインを有していない(すなわち、AT2は、AT1受容体が有するような正準核局在化配列を欠いている)ので、より議論の余地がある(da Silva Novaes et al 2018; Zhou et al 2014)。Ang IIに結合した後のAT2受容体の細胞膜から核への転座は観察されていない(Gwathmey et al 2012; Tadevosyan et al 2017)。AT2受容体は、インポートイン/エクスポートイン系を用いた活性輸送によって核に輸送される可能性が示唆されている(Matsushima-Otsuka et al 2018)。脳幹ニューロンの最近の試験管内試験研究では、Ang 1-7刺激後、Mas受容体は、クラスリンでコーティングされたピットおよびカベオラを介して初期エンドソームに内包され、ゆっくりと形質膜にリサイクルされること、および自然発症高血圧ラット(SHR)のニューロンにおいて、Ang 1-7は、そのリガンドであるAng 1-7とともに核へのMas受容体の転座を誘導することが示されている(Cerniello et al 2019)。
我々は、Ang II、Ang 1-7,AT1,AT2,MAS受容体の核内位置、およびドーパミン作動性ニューロンの核へのAT1/Ang IIの転座を示している(Costa-Besada et al 2018; Villar-Cheda et al 2017)。核内アンジオテンシン受容体の機能は明らかにされていない。いくつかの研究では、iRASが形質膜受容体に作用するパラクリンRASの効果の増幅につながる可能性が示唆されている(Carey, 2012; Cook and Re, 2012)。しかしながら、ドーパミン神経細胞のiRASに関する我々の最近の研究は、少なくとも生理学的条件下では、核RASが細胞保護システムであり、正常な細胞機能の間に細胞膜Ang II/AT1プロオキシダント軸の活性化による側副的な欠失効果を打ち消すことに寄与する可能性があることを示唆している。細胞外Ang IIはAT1/Nox2軸を活性化し、細胞内スーパーオキサイドのレベルを上昇させることが知られている。しかし、Ang II/AT1複合体が同時に核に移動することで、以下のような酸化ストレスに対する防御機構が活性化される(図2)。
図2 核内アンジオテンシン受容体による形質膜AT1-Nox2軸の活性化によるプロオキシダント効果の調節
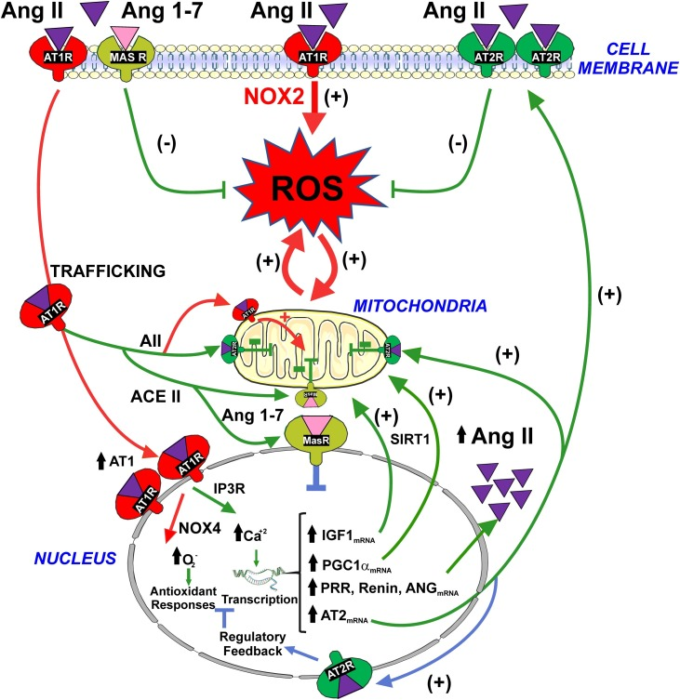
表面AT1の活性化は、細胞内スーパーオキシド/H2O2の生成と酸化ストレスをもたらす(赤矢印)。しかしながら、AT1の活性化はまた、核へのAng II-AT1受容体複合体の内部化を誘導する(赤矢印)。核内のAT1受容体の活性化は、NOX4/スーパーオキシド/H2O2およびIP3/Ca2+レベルの上昇をもたらし、それは遺伝子発現の調節を介して、酸化ストレスから細胞を保護する可能性のあるいくつかのメカニズムの引き金となる(緑矢印)。(i)ミトコンドリアと細胞膜にトラフィックする保護AT2受容体のレベルの増加は、RAS保護アームの代償的なアップレギュレーションにつながる(すなわち、AII/AT2)。(ii) 細胞内AT2受容体およびAng1-7を介して細胞内Mas受容体に作用する細胞内アンジオテンシノーゲン/AngIIの合成量の増加、(iii) PGC-1αおよびIGF-1のmRNA発現のアップレギュレーション、これらはおそらくSIRT1と相互作用してミトコンドリアの保護を強化し、酸化的損傷を減少させる。核内AT2およびMas受容体は、NOの核内レベルを増加させることにより、核内AT1受容体の効果を調節する(青矢印)。
略語。ANG、アンジオテンシノーゲン;Ang II、アンジオテンシンII;Ang 1-7,アンジオテンシン1-7;AT1,アンジオテンシン1型;AT2,アンジオテンシン2型;IGF-1,インスリン様成長因子1;IP3R、イノシトール1,4,5-三リン酸受容体。MAS、MAS受容体;PGC-1α、ペルオキシソーム増殖因子活性化受容体γ活性化1-α;PRR、プロレニン/レニン受容体;ROS、活性酸素種;SIRT1,サーチュイン1。
多くの最近のデータがこの保護見解を支持している(Nunez et al 2014,2017,2018;Wanka et al 2020;Wilson et al 2016)。いくつかの研究はまた、高レベルの細胞内Ang IIが細胞および組織の損傷をもたらしたことを示している(Redding et al 2010; Singh et al 2008)。病理的条件下では、細胞膜レベルでの過剰なAng II/AT1刺激は、過剰なNox由来のスーパーオキシドおよび細胞内AT1およびAng IIレベルにつながり、以下に説明するiRAS緩衝能を圧倒し、最終的には細胞損傷を増幅させる可能性がある。興味深いことに、これは老化した脳の場合にも当てはまる可能性があり、我々はiRAS保護応答が変化していることを観察した(下記参照)。しかしながら、アンジオテンシンの生理学的な細胞内レベルは、通常、培養細胞において推定されてきたものであり、培養条件や細胞外RASおよび他の可能性のある生理学的な調節因子の影響を受けないことから、組織または循環レベルよりも推定が困難である。細胞内アンジオテンシンのレベルは、細胞の種類や実験条件によって変化した。しかし、それらは、Ang IIでは150〜200fmol/mgタンパク質、Ang 1〜7では250〜400fmol/mgタンパク質程度であり、高グルコース条件下などの病理学的条件下では、それぞれ3〜5倍に増減する可能性がある(Alzayadneh and Chappell, 2014; Lavrentyev et al 2007; 詳細なレビューはChappell, 2016を参照)。
5.2. Ang II/AT1複合体の核内転座後の核内RAS成分の活性化
ドーパミン作動性ニューロンから分離された核において、Ang IIによる核内AT1受容体の活性化は、AT2受容体mRNAの発現の増加を誘導した。異なる細胞構造へのAT2受容体のトラフィックの増加は、細胞膜AT1活性化の効果を打ち消す可能性がある。異なるタイプの細胞において、細胞膜AT2受容体は、AT1活性化の効果を打ち消すことが示されている(PadiaおよびCarey 2013;Rodriguez-Perez et al 2020;Wang et al 2012)。責任あるメカニズムには、Nox2由来のフリーラジカルの利用可能性を調節する一酸化窒素の産生(Wang et al 2012)AT1 mRNA発現のダウンレギュレーション(PadiaおよびCarey 2013;Rodriguez-Perez et al 2020;Steckelings et al 2005)または細胞質膜レベルでAT2-AT1ヘテロマーを形成することによる(AbdAlla et al 2001;PatelおよびHussain 2018)などがある。さらに、AT2受容体は、ミトコンドリアに輸送され、そこで、NO生成を介して、ミトコンドリア呼吸および細胞酸化ストレスをダウンレギュレートする(Valenzuela et al 2016)(上記参照)。
興味深いことに、単離された核のAT1受容体の活性化はまた、アンジオテンシノーゲン、レニンおよびレニン・プロレニン受容体のためのmRNAの発現を増加させた。このことは、iRAS成分、特に細胞内Ang IIおよびAng 1-7の平行増加が、アップレギュレーションされた抗酸化AT2およびMas受容体に作用する可能性を示唆している。しかしながら、加齢または疾患で観察されるような、細胞内および/または内部化されたAng IIの過剰な産生、または細胞内AT1受容体の速度の変化が、直接的または他の因子と相互作用して、劇症的な効果をもたらす可能性がある。
単離された神経細胞核において、AT2アゴニストによるAT2受容体の活性化、またはAng1-7によるMas受容体の活性化は、核内NOレベルの増加をもたらし、これは核内AT1刺激の効果を打ち消す。同様の結果は、AT2およびAT1 KOマウスからの単離核を用いて観察され(Costa-Besada et al 2018;Villar-Cheda et al 2017)核内のMasおよびAT2受容体は、細胞の欠失性および保護RASアーム間の適切な平衡を維持するために、核内AT1受容体の活性化によって誘導される保護応答を調節する可能性があることを示唆している。さらに、単離された核をAng 1-7で処理すると、AT2 mRNAの発現が有意に減少し、MasおよびAT1受容体mRNAの発現の変化は生じなかった。このことは、核内AT2とMas受容体効果の間の代償的な調節を示唆している。
5.3. 核内Ang II/AT1活性化によって誘導される他の可能性のある保護機構
単離されたドーパミン神経細胞核におけるAT1受容体の活性化は、PGC-1α(ペルオキシソーム増殖因子活性化受容体γ共活性化因子1α)のmRNA発現の増加をもたらした。PGC-1ファミリーのメンバーは、ミトコンドリア機能のマスター転写調節因子であり、細胞の生存を促進するためにミトコンドリア機能不全に対するいくつかのメカニズムを誘発する(Finley and Haigis, 2009; Scarpulla, 2008)。これおよび単離されたドーパミン作動性ニューロン核における我々の観察と一致して、条件付きPGC-1αKOマウスは、ドーパミン作動性ニューロンの有意な損失を示した(Ciron et al 2015; Jiang et al 2016)一方、PGC-1αの過剰発現はドーパミン作動性ニューロンの保護を示した(Borniquel et al 2006; Mudo et al 2012)。したがって、核内AT1受容体の活性化によって誘導されるPGC-1αの発現増加は、形質膜AT1受容体の活性化によるプロオキシダント効果をも補っている可能性がある。
黒質体において、一連の先行研究により、Ang IIは、IGF-1(インスリン様成長因子1)またはSIRT1(サーチュイン1)などのミトコンドリア機能を調節する他の化合物を調節することが示されている(Diaz-Ruiz et al 2015;Rodriguez-Perez et al 2016)。IGF-1は、ドーパミン作動性ニューロンの生存を増加させることが明らかにされており(Kao, 2009; Offen et al 2001)これは、フリーラジカル産生、酸化的損傷およびアポトーシスの減少につながるミトコンドリア機能に対する保護効果と関連している(Puche et al 2008; Sadaba et al 2016; Tang, 2016)。SIRT1は、細胞の生存、代謝およびストレス応答に関与するいくつかのタンパク質の脱アセチル化により、酸化ストレスに対する細胞の抵抗力を増加させる(Tanno et al 2010; Yuan et al 2016)。実際、IGF-1は、酸化ストレス誘発細胞死を抑制するためにSIRT1の発現を増加させ(Vinciguerra et al 2009)SIRT1がPGC-1α活性を調節することにより、少なくとも一部でミトコンドリア機能を制御することが示されている(Finley and Haigis 2009;Tang 2016;Yuan et al 2016)。これに基づいて、核AT1受容体の活性化がこれらの化合物に及ぼす可能性のある影響を調べた。神経細胞の単離核において、AT1受容体の活性化は、IGF-1 mRNAおよびPGC-1α mRNAの発現を増加させた。しかしながら、AT1受容体の活性化は、ドーパミン作動性ニューロンからの単離核において、SIRT1 mRNAの有意な増加をもたらさなかった(Villar-Cheda et al 2017)。ドーパミン作動性ニューロンの培養物において、形質膜AT1受容体の活性化によって誘導されるSIRT1の発現の増加を観察したように(Diaz-Ruiz et al 2015)、細胞質に位置する成分が必要であろう。IGF-1の発現の観察された増加は、IGF-1が他の細胞型においてSIRT1発現を増加させたので、これらの構成要素の一つである可能性がある(Vinciguerra et al 2009)。これと矛盾しないように、我々は、SIRT1を過剰発現させたトランスジェニックマウスの脳から分離された核が、核AT1受容体の発現の減少を示したことを観察したが、これは、上述のメカニズムの可能性のあるフィードバック制御(すなわち、核AT1受容体の活性化によるSIRT1の間接的なアップレギュレーション)を支持するものである。これはまた、SIRT1の過剰発現がPGC-1αをダウンレギュレーションすることを示す筋肉細胞における観察によっても支持される(Gurd et al 2009)。結論として、細胞内Ang IIによる核内AT1受容体の活性化、または形質膜Ang II/AT1複合体の核内転座による核内AT1受容体の活性化は、IGF-1,PGC-1α、およびSIRT1レベルを増加させることによって代償メカニズムを誘発する可能性がある。
5.4. 核内AT1受容体の活性化は、核内Ca2+およびスーパーオキサイド/H2O2レベルの増加を誘導する
核内Ca2+シグナル伝達は、遺伝子転写の重要な調節因子であり(Bezin et al 2008)IP3受容体はCa2+シグナル伝達に関与することが示されている(Kusnier et al 2006)。カルシウムは、DREAMなどの転写因子に直接結合し(Carrrion et al 1999年)遺伝子発現を調節する核内CaMキナーゼ経路を活性化する。Chawla, 2002)。我々は、核内AT1受容体の活性化が核内Ca2+レベルを増加させ、IP3受容体の阻害が上述のAng II誘発のAT2およびPGC-1α mRNAの増加を阻害することを観察しており、これはCa2+シグナル伝達が上述の転写変化に関与していることを示している(Villar-Cheda et al 2017)。
また、核AT1受容体の活性化は、Nox4活性化を介して核スーパーオキシド/H2O2レベルの上昇を誘導する(Pendergrass et al 2009;Villar-Cheda et al 2017)。これは、Nox4が、抗酸化応答の一部を構成する調節DNA配列Maf-recognition element(MARE)に依存する方法で遺伝子発現を調節することができることから、上記の保護機構の原因となっている可能性がある(Hoshino et al 2000)。しかし、単離された核をAng IIと抗酸化剤NACまたはNox阻害剤DPIで処理しても、Ang IIによって誘導されるAT2またはPGC-1αのmRNA発現はブロックされなかった。核内AT1/Nox4活性化に由来するスーパーオキシドは、抗酸化応答の他の構成要素の転写に関与している可能性がある。核AT1活性化に由来する低レベルのスーパーオキシド/H2O2は、ミトコンドリアレベルで記載されているものと同様に、酸化ストレスに対する有益なホルモン適応をもたらす可能性がある(YunおよびFinkel 2014)。しかしながら、過剰なスーパーオキシドの産生は、高レベルの細胞内Ang IIを用いた研究で報告されているように、核成分の酸化的損傷および細胞および組織の損傷につながる可能性がある(Kumar et al 2012a; Micakovic et al 2018; Singh et al 2008)(図3)。
図3
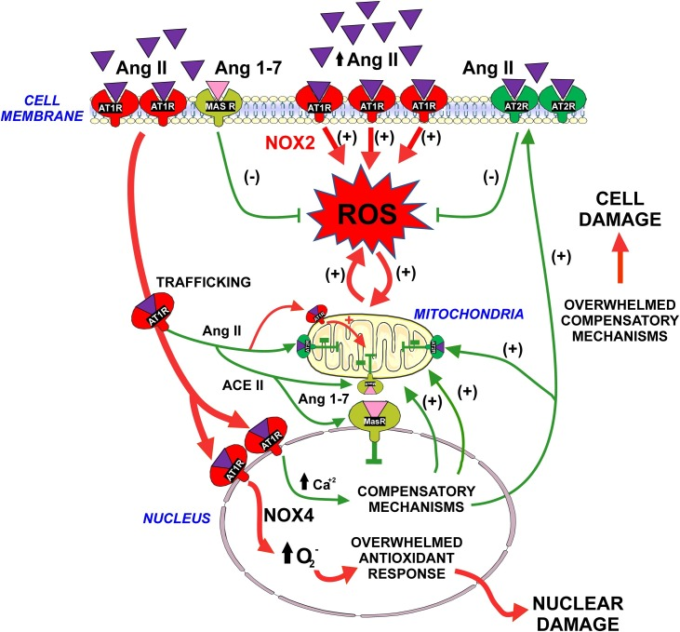
生理的代償メカニズムが圧倒される可能性がある。細胞内RASは、細胞外Ang IIによる細胞膜AT1受容体の活性化のプロ酸化作用を緩衝する可能性がある。Ang II-AT1複合体の核への内部化、および細胞内Ang IIによる核内AT1受容体の活性化は、正常な細胞機能の間、酸化ストレスから細胞を保護する可能性のある多くのメカニズムを誘発する(図1,図2参照)。しかし、疾患に関連するメカニズムや老化の結果として、過剰なAng II /AT1活性化またはAT1/AT2比の増加は、代償メカニズムを圧倒し、細胞の損傷および疾患の進行につながる可能性がある。
略語。Ang II、アンジオテンシンII;Ang 1-7,アンジオテンシン1-7;AT1,アンジオテンシン1型;AT2,アンジオテンシン2型;MAS、MAS受容体;ROS、活性酸素種。
5.5. 老化と疾患における核内RAS
加齢は、心血管系組織や腎組織などの末梢組織の変性変化に関与する主要な因子であり、アルツハイマー病やPDなどの神経変性疾患の主要な危険因子である。いくつかの末梢組織において、Ang II/AT1/Nox2プロ酸化性炎症軸の過活動が老化と関連している(Benigni et al 2009,2013; ElkahlounおよびSaavedra 2019)。老化したラットおよびマウスの神経領域からの組織ホモジネートにおいて、我々はまた、酸化ストレスおよび神経炎症のマーカーの増加とともに、Ang II/AT1/Nox2軸の過活動およびAT2受容体の発現の著しい減少を観察した(Rodriguez-Pallares et al 2012;Villar-Cheda et al 2014,2012)。Ang 1-7/MAS受容体軸もまた、老化黒子においてダウンレギュレートされている(Costa-Besada et al 2018)。上でコメントしたように、高齢ラットから分離されたミトコンドリアもまた、AT1受容体の増加とAT2受容体の減少を示しており、これは酸化ストレスに対するミトコンドリアの保護に影響を及ぼす可能性がある。興味深いことに、高齢ラットはまた、経皮領域におけるIGF-1およびSIRT1のレベルの低下を示した(Diaz-Ruiz et al 2015; Rodriguez-Perez et al 2016)。
高齢ラットからの単離された核では、核内AT1およびAT2受容体の両方のレベルの有意な減少が観察された(Villar-Cheda et al 2017)。若いラットから単離された核の場合に観察されたのとは対照的に、同様の用量のAng IIで処理された高齢動物からの核は、AT2,アンジオテンシノーゲン、IGF-1またはPGC-1α mRNAの発現の有意な増加をもたらさなかった。Ang IIの細胞内レベルの上昇に対する有意な核補償応答の欠如は、老化動物の黒膜で観察されるAT2,IGF-1およびSIRT1発現の減少(Diaz-Ruiz et al 2015;Rodriguez-Perez et al 2016;Villar-Cheda et al 2014,2012年)および老化動物で起こるパラクリンAng II/AT1レベルの上昇に対する細胞の脆弱性の増加を説明し得る。
上述のように、細胞内RASの異なる成分は、細胞酸化ストレスの過剰または高グルコース条件下などの病理学的条件下で調節を解除され得る(Kumar et al 2012b; Micakovic et al 2018; Singh et al 2008; Valenzuela et al 2016; Villar-Cheda et al 2017)。
6. 追加の細胞内メカニズムは、パラクリンAng II/AT1軸のプロ酸化的効果を打ち消す
上述のメカニズムに加えて、他の細胞保護メカニズムが、プロオキシダントであるAng II/AT1アームの活性化の可能性のある劇症的な影響を補う。ドーパミン作動性ニューロンにおいて、我々は最近、Ang IIが、単独で、または他のプロ酸化因子と組み合わせて、転写因子NRF2(すなわち、NFE2L2,核因子-エリスロイド2関連因子2)経路を活性化することを観察した(Parga et al 2018)。NRF2は、細胞の抗酸化機構および酸化還元恒常性の重要な調節因子である。NRF2および他の転写因子は、抗酸化応答エレメント(ARE)のプロモーター領域に結合した後、第II相抗酸化酵素を促進する(Zhang et al 2013)。これと矛盾しないように、NRF2経路の活性化は、抗酸化酵素および他の転写因子、例えばKLF9のような、試験管内試験および生体内試験の両方で酸化ストレスを減少させるような発現の調節によって、ドーパミン神経細胞において神経保護特性を示している。AT1/Nox2経路からのスーパーオキシドの放出は、NRF2活性化を誘導する(Parga et al 2018)。しかしながら、AT1受容体の活性化は、これらのキナーゼによるNRF2のリン酸化が阻害剤KEAP1からの解離およびNRF2の核局在化を促進するので、ERK1/2(Huang et al 1996)およびPKC(Huang et al 2000)のような代替機序を介してNRF2経路を促進する可能性がある(Xu et al 2006)。
7. 結論と今後の展望
これまでの研究では、細胞内RASは、細胞膜受容体に作用するパラクリンRASまたは循環RASの効果の増幅につながる可能性が示唆されている。これに基づいて、細胞内Ang IIは、RASプロオキシダントアームの過剰活性化によって誘導される疾患の進行や組織・細胞の機能不全に寄与するのではないかと推測されていた。しかし、細胞内RASは、細胞外(パラクリン)Ang IIによる細胞膜AT1受容体の活性化によるプロ酸化作用を緩衝している可能性がある。Ang II-AT1複合体の核への内部化、および細胞内Ang IIによる核内AT1受容体の活性化は、酸化ストレスから細胞を保護する多くのメカニズムを誘発する。最近の研究では、iRASが細胞の正常な機能に重要な役割を果たしている可能性が示唆されている。特に、iRASは、細胞外RASのプロ酸化性アームの活性化や他のプロ酸化性刺激の潜在的な悪影響を緩衝している可能性がある。しかしながら、過剰なAng II /AT1活性化の後、または疾患に関連した条件や老化によって誘導されるプロオキシダント/抗酸化受容体(AT1/T2-MasR)比の変化の後には、iRASが圧倒され、細胞損傷を増強する可能性さえある。このことは、細胞外およびiRASの両方への影響を考慮しなければならないので、新しい治療戦略の開発にとって重要であるかもしれない。例えば、細胞外受容体および細胞内受容体を阻害するための異なるAT1受容体遮断剤の効力の違いが観察されている(Cook et al 2001;Filipeanu et al 2001)。高レベルのミトコンドリアACE2の存在は、SARS-CoVウイルスの細胞内効果に関する研究に新たな道を開く。
