The Influence of Nicotinamide on Health and Disease in the Central Nervous System
要旨
ビタミンB3(ナイアシン)のアミド形態であるニコチンアミドは、長い間、中枢神経系(中枢神経系)の神経細胞の発達、生存、機能に関連しており、神経細胞の死と神経保護の両方に関与している。
ここでは、神経保護効果を示す研究を中心に、中枢神経系の神経細胞の健康におけるニコチンアミドの役割を調査した研究をまとめた。ニコチンアミドは、外傷、虚血、脳卒中からニューロンを保護する役割を果たしていると考えられ、3つの主要な神経変性疾患に関与していると考えられている。
アルツハイマー病、パーキンソン病、ハンチントン病。重要な要因はニコチンアミドのバイオアベイラビリティーであり、低濃度では神経障害や認知症につながり、高濃度では神経毒性を引き起こす可能性がある。最後に、ニコチンアミドの潜在的な作用機序について、細胞のエネルギーレベルの一般的な維持や、ニコチンアミド・アデニン・ジヌクレオチド依存性脱アセチル化酵素であるサーチュイン1(SIRT1)などの分子のより特異的な阻害を含めて論じている。
キーワード
ニコチンアミド、ビタミンB3,神経細胞死、アルツハイマー病、パーキンソン病、ハンチントン病、ミトコンドリア、神経変性、神経保護、ナイアシン
序論
食事と栄養が神経細胞の健康維持に直接的な役割を果たしていることを示す証拠が増えてきている。特に、食事因子はパーキンソン病(パーキンソン病)の発症と進行、そして潜在的にはその改善に影響を与える可能性がある1,2 。この研究で明らかになってきたパターンは、食事因子のアンバランスが成熟したニューロンの産生と維持に明確な影響を及ぼすということである。
私たちの研究と他の研究では、ビタミンがニューロンの形成とその生存に不可欠であることを示唆している。ここでは、ニコチンアミドと関連する活性代謝物をレビューする。我々は、成熟した中枢神経系(中枢神経系)のニューロンの維持におけるニコチンアミドの役割を議論し、老化、損傷、および疾患時のニューロンの健康と生存への影響、および神経変性疾患の治療法としての可能性。
健康におけるビタミンとその役割
前世紀の間に、栄養補助食品の新しいクラスが特定された。これらの “ビタミン “は、正常な健康と成長のために不可欠な生物学的に活性な有機化合物として定義されていたが、人体によって合成することはできない、または唯一の部分的に、合成することができる。その生物学的および化学的活性によってグループ化された、ビタミンの13クラス(表1)は、そのような代謝における補酵素として作用し、細胞や組織の成長、ミネラル代謝の調節などの多様な生化学的機能を有し、現在認識されており、細胞分化.3を指示する、このように、ビタミンは、ペラグラ、壊血病、くる病、出血性疾患、感染症.4への脆弱性など、複数のシステムに影響を与える条件につながる欠乏と、身体の発達と維持のために不可欠である未治療の場合、ビタミンの欠乏は、重大な病気や潜在的な死につながる可能性がある。
表1 ビタミンの13の認識されたクラスとその役割
| ビタミン | 他の名前 | 生理機能の例 |
|---|---|---|
| ビタミンA | レチノール、レチノイン酸、レチナール、カロテノイド | 成長、皮膚の維持、骨の発達、ミエリンの維持、視力の維持 |
| ビタミンB 1 | チアミン | 成長、食欲、消化、神経活動、エネルギー生産 |
| ビタミンB 2 | リボフラビン | 胎児、酸化還元システム、および呼吸酵素の成長と発達; 粘膜、上皮、および眼の組織の維持 |
| ビタミンB 3 | ニコチンアミド、ナイアシンアミド、ニコチン酸、ナイアシン | NADとNADPの維持、脂質異化作用における補酵素、酸化的脱アミノ化 |
| ビタミンB 5 | パントテン酸 | 脂質代謝、タンパク質代謝、炭水化物代謝における補酵素Aの一部 |
| ビタミンB 6 | ピリドキシン、ピリドキソール、アデルミン | 成長; タンパク質、CHO、および脂質代謝; アミノ酸代謝における補酵素 |
| ビタミンB 7 | ビオチン、保護因子X | 成長; 皮膚、髪、骨髄、性腺の維持; アスパラギン酸と不飽和脂肪酸の生合成 |
| ビタミンB 9 | 葉酸、フォラシン、フォリン酸 | 核酸の合成、胚性神経系の分化 |
| ビタミンB 12 | コバラミン | 核酸、タンパク質、脂質合成における補酵素; 上皮細胞と神経系の維持 |
| ビタミンC | アスコルビン酸 | 鉄の吸収、抗酸化、成長、創傷治癒、軟骨、象牙質、骨と歯の形成、毛細血管の維持 |
| ビタミンD | ビタミンD 3、コレカルシフェロール、カルシトリオール | 正常な成長、CaおよびP吸収、骨のアルカリホスファターゼの維持および活性化、血清カルシウムおよびリンレベルの維持 |
| ビタミンE | トコフェロール、トコファーム、トコトリエノール | 抗酸化物質、成長維持、不飽和脂肪酸の吸収を助け、筋肉の代謝と血管系と中枢神経系の完全性を維持します |
| ビタミンK | プロトロンビン因子、メナキノン | 血液凝固メカニズム、電子伝達メカニズム、成長、肝臓でのプロトロンビン合成 |
ニコチンアミド、ニコチンアミドアデニンジヌクレオチド、神経細胞の健康
ビタミンB3の水溶性アミド形態であるニコチンアミドは、ニコチンアミド・アデニン・ジヌクレオチド(NAD+)の産生に関わる代謝経路の重要な構成要素である。ニコチンアミドの1つの供給源は、卵、肉、魚、キノコ類の摂取を介して、食事である。ニコチンアミドの第二の供給源は、必須アミノ酸である内因性トリプトファンの代謝である。ニコチンアミドは、NAD+の形成を介してナイアシンからも生成することができる。
ニコチンアミドは肝臓に少量しか貯蔵されず、ほとんどが排泄されるか、異化されて他の重要な代謝産物を提供する。薬理学的に高用量であっても過剰摂取による副作用は起こりにくいが、過剰摂取はまれに肝障害を引き起こす可能性がある。
ニコチンアミドホスホリボシルトランスフェラーゼ(NAMPT)という酵素は、ニコチンアミドからニコチンアミドモノヌクレオチド(NMN)の合成を触媒する(図1)。NAD(酸化型NAD+、還元型NADH)の生合成の代謝経路におけるその役割は、神経細胞などのNADレベルの低下に敏感な細胞での重要性を示唆している6 。
図1 NAD+の産生におけるニコチンアミド、ナイアシン、トリプトファンの代謝のための主要な経路の簡略化された模式図
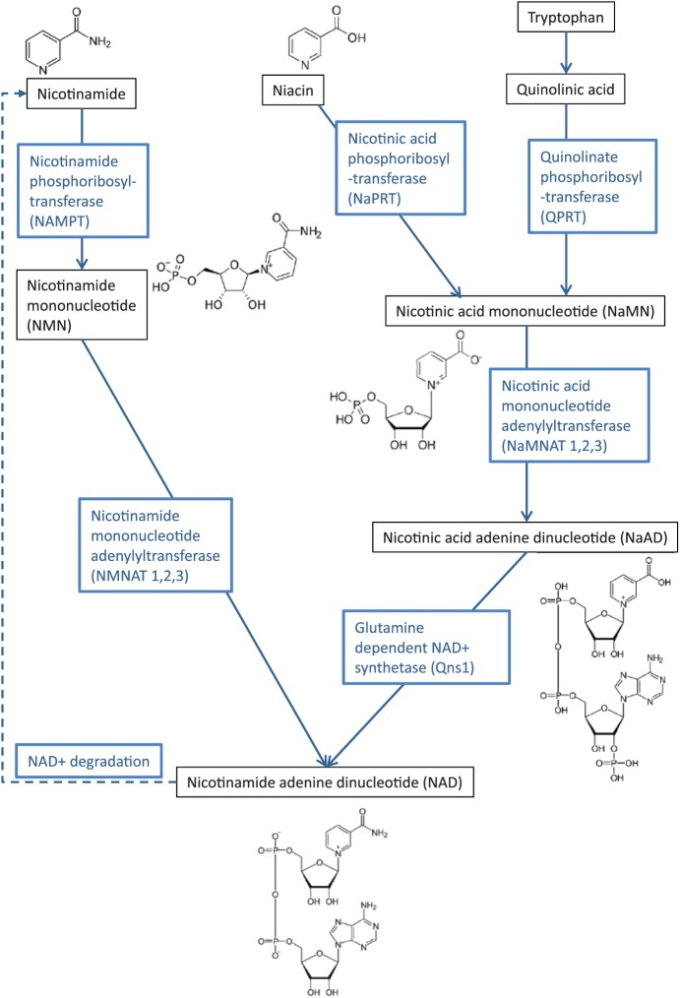
酵素NMNアデニル転移酵素(NMNAT)はNMNをNAD+に変換する(図1)。NMNAT1,2,3の3つのアイソザイムは、それぞれ核、細胞質、ミトコンドリアに局在している11 NMNAT活性の増加は、ワレリアン変性を受けた培養ニューロンの軸索保護につながることが示されている。
ヒトでは、ニコチンアミドは、主にニコチンアミドN-メチル転移酵素(NNMT)の活性を介してN-メチルニコチンアミドへのN-メチル化を介して、ある程度のレベルの分解を受ける。上記のように、ニコチンアミドの残りの代謝は、アデノシン三リン酸(ATP)を生成するためにミトコンドリア呼吸に不可欠であるニコチンアミドアデニンヌクレオチドリン酸に加えて、酸化型と還元型の両方でNAD補酵素(NAD+とNADH)を生成するだけでなく、細胞の保護と抗酸化の役割を与えるものを含む200以上の酵素反応に関与している(図1)14-16
NAD+はまた、肝臓と腎臓内のトリプトファンの代謝を介して生成することができる17 また、食事のニコチン酸とナイアシンからも生成することができる。トリプトファンは少量のニコチン酸モノヌクレオチド(NAMN)に代謝され、NAD+に変換される。しかし、1mgのナイアシンから生成される当量のNAMNを得るためには、60mgのトリプトファンが必要とされる18。トリプトファンの代謝は9段階のプロセスであり、キヌレニン経路として知られるこの最初の部分17は、パーキンソン病、ハンチントン病、アルツハイマー病20,21を含む多くの神経変性疾患や他の神経疾患で変化している22 この混乱は、神経毒21-23の生産を増加させると同時に、NAD+レベルを低下させ、ニューロンが損傷を受けやすくなる可能性がある。このように、ニコチンアミドとNAD+の間の微妙なバランスのとれた関係は、神経細胞の健康に大きな影響を与える可能性がある。
末梢神経系のニコチンアミド
ニコチンアミドはワレリアン変性、すなわち末梢神経系の軸索内の損傷や切断の遠位で起こる軸索変性と関連している。最近の研究では、NMNATが分子シャペロンとして作用して蛋白質のミスフォールディングを防ぎ、ニューロン内の重要なプロセスを保護していることが示唆されている。軸索変性におけるニコチンアミドの役割を示唆するもう一つの証拠は、神経損傷後にはNMNが蓄積するが、末梢性軸索変性には先立って蓄積するという観察結果である。
ニコチンアミドは、眼内の末梢神経障害の鍵を握っていると提案されている。28 高齢化したマウスの生体内試験モデルでは、ニコチンアミドの経口投与やNmnat1遺伝子の発現亢進により、網膜神経節細胞のソーマ喪失と網膜神経線維層の菲薄化の両方が抑制された。29 同様に、糖尿病誘発性神経障害のマウスモデルでは、ニコチンアミドリボシドの投与により角膜内の感覚神経終末が保護された30 。
網膜色素上皮(RPE)ひいては間接的に視神経に感覚情報を伝達する視細胞に影響を及ぼすもう一つの疾患が、加齢黄斑変性(AMD)である。最近の研究では、ニコチンアミドがAMD患者由来の多能性幹細胞株から作製したRPE細胞において、疾患表現型を改善することが示されており、ニコチンアミドとその関連経路がAMD治療のターゲットとして提案されている31。
中枢神経系におけるニコチンアミド
多くの研究では、ニコチンアミドは、それぞれ神経細胞の分化と神経細胞の生存を促進するために作用し、中枢神経系の成長と維持に不可欠であることが示されている。例えば、ニコチンアミドは、強化し、神経前駆細胞32,33と前駆体34からの神経細胞の分化を促進するように見える。
NAD+の代謝が中枢神経系における神経細胞の生存に直接影響を及ぼすことを示唆する豊富な証拠がある35,36 。NAD+は、サーチュインファミリー(SIRT)ポリADP-リボースポリメラーゼ(PARP)および関連するアデノシン二リン酸(ADP)-リボーストランスフェラーゼ(ART)環状ADP-リボース(cADPR)合成酵素であるCD38およびCD157の3つの主要なクラスの酵素に作用する重要な基質である。SIRT、PARP、およびART活性の副産物はニコチンアミドである。ニコチンアミドは、NAD+と結合することにより、これらの酵素の活性を阻害することができる。さらに、神経細胞には、ニコチンアミドのNAD+への変換の第一段階に必要なNAMPTという酵素のレベルが低いだけで、これらの細胞でのNAD+の利用可能性が低下する可能性がある。
NAD+のレベルは加齢とともに低下し10,これはNAMPTのレベルの低下と関連している可能性がある(優れたレビューはVerdin35の研究を参照)。このことを裏付ける更なる証拠は、アミノプロピルカルバゾール化学物質P7C3がNAMPTの活性化を介してパーキンソン病、脳卒中37,38,筋萎縮性側索硬化症39のモデルにおいて神経保護効果を発揮することが明らかにされた研究から得られている40。
興味深いことに、ある研究では、ニコチンアミドが血液脳関門を双方向に自由に横断できることが示唆されている41 。NNMTメッセンジャーRNA(mRNA)は、脊髄、側頭葉、髄質、小脳を含む複数の中枢神経系領域で発現しており、特にパーキンソン病との関連性が高い視床下核、尾状核、黒質のドーパミンニューロンの基底核内で発現している43。
神経損傷、虚血、および脳卒中におけるニコチンアミドの役割
世紀の変わり目以来、ニコチンアミドは、虚血の動物モデルにおける神経保護と神経回復の重要な役割を果たしていると認識されてきた44,45 。虚血性脳梗塞の初期段階では、神経細胞のアポトーシスに先行してNAD+のレベルが低下している。虚血後2時間までに500mg/kgのニコチンアミドを腹腔内注射すると、ラットの梗塞容積が減少し、無処置動物と比較して感覚と運動行動の両方が改善されたという研究結果がある46。
神経組織の再酸素化(再灌流)に続く長時間の低酸素状態は、NAD+/NADHリサイクルの障害を引き起こし、過酸化と呼ばれる。ニコチンアミドによる前処理は、神経細胞の機能を改善し、NADHレベルを低下させ、ATPレベルを回復させることができる47 。ニコチンアミドは PARP 活性を阻害し、その結果、NAD 産生を高めることができ、これが神経保護のメカニズムの一つであると考えられる(後述)。ナイアシンの代謝は、損傷したニューロンへの血液と酸素供給の長期的な回復につながる可能性がある。実験的に脳卒中を誘発したラットにナイアシンを24時間投与したところ、高密度リポ蛋白コレステロールのレベルが有意に上昇した。この結果、血管新生、動脈新生、局所脳血流が促進され、機能障害が軽減された。
外傷性脳損傷(外傷性脳損傷)は、ニコチンアミドが治療薬としての役割を果たす可能性のある領域である。外傷の原因となる最初の衝撃は非常に損傷を与えるが、二次的な後遺症は、炎症、フリーラジカルの生成、および興奮性細胞死などのメカニズムを介して、永続的な損傷の多くを作成する。ニコチンアミドは様々な細胞プロセスに広範囲に影響を及ぼすため、外傷性脳損傷では研究する価値のある分子となっている。Vonder Haarらは、制御された皮質衝撃傷害の30分後に、浸透圧ミニポンプを介してニコチンアミドを注入すると、病変の大きさが有意に減少することを示した。この神経保護は、感覚、運動、認知能力の向上と相関しており、動物は両側触覚接着剤除去課題、locomotor puting課題、Morris水迷路の参照記憶パラダイムでそれぞれスコアが向上していた48。その結果、キャビテーション、退化ニューロン、反応性アストロサイトが有意に減少することが示された。転写プロファイリングにより、炎症経路と免疫経路の両方の遺伝子の減少が示唆された。プロゲステロンとニコチンアミドを併用した動物は、接着剤除去と前肢配置の課題で、どちらかの治療を単独で受けた群と比較して高いスコアを示した49。
神経変性疾患におけるニコチンアミドの役割
アルツハイマー病
アルツハイマー病は最も一般的な神経変性疾患の一つであり、全世界で約 3,000 万人が罹患しており50 、ゆっくりとした認知機能の低下に悩まされている。アルツハイマー病の正確な原因は不明であるが、遺伝的、環境的、発達的要因が関与していると考えられている52 。先進国では症例数が最も多く、今後も増加が見込まれており、発展途上国での増加が最も大きい53 。しかし、いくつかの証拠は、ニコチンアミドや関連分子がアルツハイマー病患者に治療上の利点を提供する可能性を示唆している。
例えば、重度のトリプトファン/ナイアシン欠乏は、患者が認知症として顕在化した神経学的欠損を開発することができ、 “早期老化 “として記述された症候群ペラグラにつながる62.症状は、アルツハイマー病に似ており、精神病、見当識障害、記憶喪失、および混乱を含み、すべてナイアシンの補充によって解決することができる。ペラグラは、食生活が主にトウモロコシ(例えば、アフリカやインド)に基づいている地域の若者に主に見られるが、それはまた、欧米社会では成人期に発生するが、例えば、通常、多数のビタミンが不足しているか、またはそのような神経性無食欲症14ナイアシン欠乏症などの摂食障害の結果として、アルコール依存症で発生している高齢者人口におけるナイアシン欠乏は、認知症とリンクされている。シカゴのコミュニティで1993年から 2002年にかけて行われた研究では、ナイアシンの食事レベルは、少なくとも2つの臨床的な認知評価を通して測定されたアルツハイマー病の発症と逆に関連していることが示された。
ニコチンアミドとナイアシンは、アルツハイマー病に関連している可能性のある細胞および分子効果を産生する。44 ニューロンのコレステロールはアミロイドβの形成と蓄積に寄与し、膜コレステロールの増加は海馬ニューロンをタウ毒性などの障害に対してより敏感にすることが示唆されている。ナイアシンは、ペルオキシソーム増殖活性化受容体γ(PPARG)mRNAの発現をアップレギュレートし、コレステロールの排出を促進し、細胞レベルを低下させる。ナイアシンはまた、肝臓X受容体をアップレギュレートすることが示されており、その刺激はアミロイドβ42,44のクリアランスを促進し、ADマウスモデルでは記憶力を向上させる可能性がある。
神経細胞内では、NAD+は、シナプス可塑性に重要なカルシウムシグナル伝達に使用されるcADPRの合成の基質として機能する。これは、学習と記憶に重要な構造である海馬において特に重要である。このように、ニコチンアミドはNAD+のレベルを維持することで、海馬の加齢に伴う神経細胞の変性を防ぐことができる。しかし、興味深いことに、YoungとKirklandは、ナイアシンの摂取量とcADPRのレベルが減少すると、実際に成人男性ラットの空間学習能力の向上につながることを示した。このことは、ニコチンアミドと海馬ニューロン、学習・記憶との関係が予測よりも複雑である可能性を示唆している。興味深いことに、ニコチンアミドのNAD+への変換に関与する酵素Nmnat2は、認知症のマウスモデルにおいて、タウオパシーに対する神経保護に関連している。Nmnat2の転写は、前頭側頭型認知症に関連する突然変異を持つトランスジェニックマウスモデルにおいて、神経変性に先立ってダウンレギュレーションされていることが確認された。Nmnat2 を過剰発現させたアデノ随伴ウイルスを生後 6 週齢からこれらのマウスの海馬に注入すると、5 ヶ月後に観察された神経変性の程度が減少した68 。これは微小管安定性関連タンパク質のレベルを増加させ、認知障害を減少させたが、アミロイドβ病理には影響を与えなかった。
ミトコンドリアの機能不全と生体エネルギーの欠損はシナプス可塑性を中断させ、学習と記憶を損なう。56 神経細胞のミトコンドリア機能は、NAD+の増加とSIRT1とSIRT3の活性を介して改善することができる。
上記で概説された証拠は、ニコチンアミドまたはNADHを使用して、アルツハイマー病のためのいくつかの臨床試験を裏付けている。1996年、NADHはアルツハイマー病患者のミニ精神状態検査のスコアを改善すると報告されたが、これは8~12週間の非盲検試験で、被験者は17人のみで対照群はなかった71。2004,アルツハイマー病患者を対象にNADHを用いた無作為化二重盲検臨床試験では、認知機能の低下の停止と優れた流暢な発話が報告された(プラセボと比較して、治療群ではn=12)73。2017年のニコチンアミド臨床試験(Safety Study of Nicotinamide to Treat Alzheimer’s Disease; NCT00580931)では、有害事象の増加は報告されておらず、ニコチンアミド高用量(1500mg、1日2回)の相対的な安全性を裏付けている74。74 患者数が少なく(n = 15)時間経過が比較的短い(24週間)ため、モニターされた認知機能の改善は認められなかった(Nicotinamide as an Early Alzheimer’s Disease Treatment [NEAT]; NCT03061474)。
パーキンソン病
食事と栄養の影響を受ける可能性のある特定の神経変性疾患の一つがパーキンソン病である。この障害の重要な特徴は、脳の奥深くにある大脳基底核回路内の活動のアンバランスにつながる、黒質内の中脳ドーパミンニューロンの死であり、運動の低下(アキネジア)硬直、および振戦に現れる。現在のところ、パーキンソン病の約95%の症例は遺伝的欠陥に起因するものではないため、科学的研究では成熟した黒質ドーパミンニューロンの健康に影響を与える環境因子に焦点を当てている。
パーキンソン病は、α-シヌクレイン凝集体からなる神経細胞の介在物が特徴である。パーキンソン病の原因は現在のところ不明であるが、一つの仮説として、ドーパミンニューロンが酸化ストレスによって障害されているというものがあり、最近では、この酸化ストレスは消化管から発生し、ニューロンの損傷につながるのではないかということが示唆されている。パーキンソン病患者では、腸管透過性の亢進、α-シヌクレイン凝集体の増加、および消化管内の酸化ストレスの高レベルが示されている。食事とパーキンソン病との間に直接的な関連性を示す証拠は限られているが、これらのデータは、動物由来の飽和脂肪を多く含む食事が神経細胞の健康に悪影響を及ぼす可能性があるのに対し、不飽和脂肪や抗酸化物質を含む食品は炎症や酸化を抑えることで神経細胞を保護する可能性があることを示唆している75。
ビタミンB3の摂取は、パーキンソン病において保護的役割と有害な役割の両方を果たすことが示唆されている。14 NAD+レベルはパーキンソン病患者で減少することが明らかになっており76 、パーキンソン病のリスクの低下はナイアシンを含む食品の摂取量の増加と関連している。
NADHは、1-メチル-4-フェニル-1,2,3,6-テトラヒドロピリジン(MPTP)誘発性パーキンソン病81や特発性パーキンソン病では欠損していることが確認されているミトコンドリア複合体1の正常な機能に不可欠である82,83。15,85 したがって、ニコチンアミドがNADHまたはATPのレベルを増加させる能力は、障害を受けた中脳ドーパミンニューロンの治療法となる可能性がある。パーキンソン病の2つのマウスモデルにおいて、ニコチンアミドは、線条体のドーパミン枯渇を減衰させ、急性MPTP投与マウスでは黒質パーコンパクトaニューロンを保護することで、神経保護作用を示した16。
ニコチンアミド-NNMTのレベルは、パーキンソン病患者の脳脊髄液および中脳ドーパミンニューロンを含む特定のニューロン集団内で増加することが示されており、病態形成における役割を示唆している43,86。NNMTのレベルが高いと、ニコチンアミドからN-メチルニコチンアミドへの変換が増加することが提案されており、これは、ドーパミンニューロンを選択的に破壊する活性MPTP誘導体である毒素N-メチル-4-フェニルピリジニウム(MPP+)と構造的に関連している85 。このことから、肉類を多く含む食事から得られる高濃度のニコチンアミドは、過剰に摂取するとドーパミンニューロンにミトコンドリアストレスを与え、ニューロンのアポトーシスを誘発してパーキンソン病を引き起こす栄養因子であると提案されている62,88。この理論を支持するために、我々の研究では、培養幹細胞由来のニューロンは試験管内試験で5~10mMの用量範囲でニコチンアミドを補給すると良好な反応を示すが、20mMの用量ではすべてのニューロンに強い毒性を示すことが示されている32。
食事によってパーキンソン病の経過を変えることは困難であり、この調節が影響を及ぼすかどうかを判断するにはさらなる実験が必要である;しかしながら、プレバイオティクスなどのサプリメントが腸内環境を有益に変化させ、パーキンソン病患者の便秘を軽減する可能性はある。有害因子への曝露における消化管バリアの潜在的な役割のため、全食、食事パターン、およびサプリメント(プロバイオティクス、プレバイオティクス、およびシンバイオティクス)による治療的介入は、腸内環境にポジティブな影響を与え、炎症と酸化を減少させ、パーキンソン病のリスクを減少させる結果となる可能性がある。
ハンチントン病
パーキンソン病と同様に、ハンチントン病の神経変性はミトコンドリア機能の低下と関連している。線条体のGABA作動性中棘突起ニューロンの消失は、ハンチンチンというタンパク質の変異型が呼吸やエネルギー代謝などの正常な細胞プロセスを阻害し、ニューロンの機能障害を引き起こすことで起こると考えられている。神経細胞への影響としては、タンパク質の輸送やシナプス伝達の変化、興奮性グルタミン酸受容体の過剰刺激による興奮毒性、カルシウムレベルの変化、フリーラジカルの発生、神経細胞のアポトーシスなどが考えられている。20年以上前から、マロン酸や3-ニトロプロピオン酸(3-NP)などのミトコンドリア毒素が線条体ニューロン変性を誘発することが知られている89-91。ニコチンアミドの投与は、マロン酸によって生じた線条体病変の程度を減衰させることができ、この効果は、継続的放出パラダイム(7日間のポンプ注入による)でも、病変手術の直前と直後にニコチンアミドを腹腔内投与した場合でも認められている92。電子輸送鎖の必須成分であり、フリーラジカル消去剤でもあるコエンザイムQ10とニコチンアミドを併用して投与した場合、神経保護に相加的な効果が認められた。
マロン酸塩などの代謝毒素は、中棘条神経細胞に粗悪な障害を与える。さらに最近の研究では、ハンチントン病のトランスジェニックモデル(ヒトハンチントン病遺伝子の変異体を発現するB6.ハンチントン病R6/1マウスモデルで、エクソン1には約125回のCAGリピートが含まれている)を用いてニコチンアミドの効果を評価しており、この疾患のプロセスをより忠実に再現していると考えられている。ニコチンアミドを浸透圧ミニポンプまたは飲料水から投与すると、脳由来神経栄養因子(BDNF)とPPARG(PGC-1α)の脳レベルが上昇し、同時に運動制御が改善された。興味深いことに、行動改善はハンチントン蛋白質の異常凝集の減少とは関連しておらず、後期体重減少の予防にもならなかった93。94 後者の研究では、ニコチンアミドをレスベラトロールと直接比較し、それぞれSirT1阻害剤または活性化剤としての効果を調べた。ニコチンアミドとは対照的に、レスベラトロールは運動能力を改善した。興味深いことに、両分子はYAC128マウス由来の培養線条体ニューロンおよび皮質ニューロンにプラスの効果を示し、SirT1に対する相反する作用が同様に生存率を向上させる可能性を示唆している。
ニコチンアミドによる神経保護のメカニズム
ニコチンアミドは単なる栄養因子というよりも、神経細胞や内皮細胞の損傷を予防したり、逆行させたりすることが示されている。ニコチンアミドは、DNAの安定性をサポートすることができ、細胞傷害、貪食、アポトーシス、血管血栓形成を防止し、膜の完全性を維持することができる。
ニコチンアミドが作用する可能性があることによる1つのメカニズムは、単にニューロン内のATPレベルを復元することである。例えば、MPTPは、パーキンソン病のモデルを作成するために使用され、最終的に細胞死につながる、ATP枯渇と活性酸素種(ROS)の形成につながる、ドーパミン作動性ニューロン内のミトコンドリア複合体1を選択的に阻害する。アンダーソンら16は、ニューロンのエネルギー危機につながる亜急性MPTP暴露は、細胞内のNAD+とATPレベルの回復を介して、ニコチンアミドによって改善することができることを提案している。
ニコチンアミドの神経保護能力は、PARP、過剰になると、NAD+とATPの両方の枯渇を引き起こす、DNA修復と細胞死に関与する酵素にリンクされている。PARPは、それがADP-リボースとニコチンアミドにNAD+を触媒する場所、おそらく酸素フリーラジカルを介して、DNA損傷に応答して活性化される。PARPの過剰活性化は、NAD+枯渇につながり、ATP levels.62を低下させるニコチンアミドは、それによって酸化ストレス、アポトーシス、細胞死の壊死形態から細胞を保護し、PARPの活性を抑制することができる。
NAD+レベルの補充におけるニコチンアミドの重要性はまた、膜貫通型糖タンパク質CD38とリンクしている。NAD+の消費を通じて、CD38はcADPRとADP-リボース96を合成し、加水分解し、NADレベルを調節する役割を持っている可能性がある。CD38を過剰発現させた細胞はNADレベルが低下するだけでなく、抗酸化防御に関連するタンパク質が減少し、酸化ストレスの影響を受けやすくなる。NADの枯渇に関与するもう一つのタンパク質は、Sterile alpha and TIR motif containing 1 (SARM1)である。軸索損傷後、SARM1の発現はNAD+を枯渇させながら軸索の変性を媒介するが、NMNAT1やNamptの発現によって変性を阻止することができる100,101。
ニコチンアミドの別の作用機序は、NAD依存性脱アセチル化酵素SIRT1の阻害である。SIRT1は、主にニューロンの核内で中枢神経系全体に発現しており、加齢に伴う神経変性の影響を受けやすい脳領域に存在している102 。SIRT1 レベルの変化は、神経細胞の老化や神経変性にも関与している12,105 。SIRT1 レベルの増加は、アミロイドβとタウの両方のタンパク質を標的とすることで、アルツハイマー病 の神経保護と関連している。パーキンソン病では、SIRT1はドーパミンニューロンの熱ショック因子1(HSF1)レベルを活性化することでドーパミンニューロンを保護し、ハンチントン病ではCREB制御転写活性化因子1(TORC1)とその後のBDNFレベルを活性化することでドーパミンニューロンを保護すると考えられている105。
ニコチンアミドはまた、プロテインキナーゼB(Akt)を活性化し、フォークヘッド転写因子(FKHRL1)をリン酸化してアポトーシスを抑制するなど、多くの細胞経路を介してDNA分解に影響を与えることが示されている。45 ニコチンアミドはまた、細胞傷害時にカスパーゼ1,カスパーゼ3,カスパーゼ8の阻害剤として作用し、チトクロムCの放出を防ぎ、アポトーシスを抑制する。
ニコチンアミドは、カルシウムシグナル伝達を変化させることで神経変性を防ぐ作用もある。カルシウムシグナル伝達は、軸索の伸長や外部刺激への応答など、多くの神経細胞のプロセスで重要な役割を果たしている。しかし、ワレリアン変性や神経変性疾患に関する研究から、軸索の変性はカルシウムレベルの制御ができなくなり、軸索内のカルシウムの上昇は神経毒性を生じ、神経細胞の死を引き起こすという証拠がある107。また、異常なカルシウムシグナル伝達は、神経炎症が神経変性を引き起こすメカニズムにも関与しており、カルシウム受容体が神経保護療法のターゲットとなる可能性が示唆されている108 。ニコチンアミドは、細胞内シグナル分子であるβ-NAD+、サイクリックGMP、一酸化窒素(cADPR合成の調節因子)の動員活性を阻害することで、ウニの卵のcADPRを阻害することが示されている109 。
ニコチンアミドとNADは免疫細胞の調節にも関与しており110 、神経変性部位では活性化したミクログリアが見られるため111 、これらの分子は抗炎症作用を介して作用する可能性がある。マクロファージに存在する抗炎症性Gタンパク質受容体であるGPR109Aは、パーキンソン病76の患者で高レベルの発現が認められているが、ナイアシンによる治療はこれらの発現レベルを低下させる。
ニコチンアミドが神経保護を与えるメカニズムについてのより多くの証拠は、血管系の研究から得られている。112 活性酸素のレベルを下げることは、例えば食事制限によるカロリー制限により、SIRT1に関与するものなどの活性酸素依存性の保護経路を刺激し、内皮細胞に抗炎症効果をもたらす可能性があることを示唆している。ニコチンアミドの食事摂取量を増やすと、母犬と子犬の両方の健康が改善され、血圧と内皮症が低下することが示された。著者らは、ニコチンアミドの作用モードは、主にcADPR.114の阻害を介して可能性が高い、胎児のATP合成の回復を介していたことを示唆している
明らかに、エネルギー生成と細胞の保護と修復を与える非常に多くの細胞プロセスでその活性のために、神経変性や神経保護におけるニコチンアミドの役割のために暗示されたメカニズムの数があり、多くの体のシステムだけでなく、中枢神経系から証明されている。ニコチンアミドの活性の下流への具体的な影響を明らかにすることは、まだ課題であるが、研究する価値のある課題である。
概要
ニコチンアミドが神経細胞の分化と健康、神経細胞の損傷、および中枢神経系の神経変性に関与していることを示す証拠が増えている。ニコチンアミドレベルの変化は、アルツハイマー病、パーキンソン病、およびハンチントン病とリンクされており、動物モデルでのニコチンアミド治療は、神経変性と関連する行動の回復の改善を示している。同様に、神経損傷や虚血の動物モデルで修復剤として使用されているニコチンアミドの証拠がある。
ニコチンアミドのレベルによって影響を受ける細胞内システムの多さは、この食物代謝物による作用の正確なメカニズムを決定することが困難になる。しかし、それは成熟したニューロン内のニコチンアミドが少なすぎるか多すぎるかのいずれかによって引き起こされる神経後遺症を避けるために、ニコチンアミドは、中枢神経系でバランスのとれたレベルに滴定されるべきであることが明らかになってきている。
このことを念頭に置いて、適切な栄養補給とニコチンアミドのような低生物活性分子の管理を通じて神経細胞の健康をサポートすることは、エキサイティングで達成可能な見通しであると思われる。
