Contents
The Immunopathology of COVID-19 and the Cannabis Paradigm
www.ncbi.nlm.nih.gov/pmc/articles/PMC7904902/
オンラインで公開 2021年2月11日
要旨
新規RNAベータコロナウイルス属SARS-CoV2によるコロナウイルス症19は 2019年12月に中国の武漢で初めて出現し、それ以来、2021年1月24日の時点で、>9900万人が罹患し、>210万人が死亡する世界的なパンデミックに発展した。SARS-CoV2は下気道系を標的とし、発熱、咳、呼吸困難を伴う肺炎を引き起こす。ほとんどの患者は軽度の症状を呈するが、一定の割合で重度の症状を呈する。しかし、一定の割合で呼吸困難、低酸素症、肺病変を伴う重篤な症状が発現し、さらに呼吸不全による呼吸支援が必要な重篤な段階にまで進行することがある。COVID-19の症状の大部分は、サイトカイン放出症候群に見られるような高炎症に関連しており、死亡例はCOVID-19に関連したサイトカインストームによるものと考えられている。抗炎症薬や抗ウイルス薬による治療は、まだ臨床試験中であるか、死亡率を低下させることができなかった。このため、新規の抗炎症療法の開発が必要とされている。最近では、大麻植物に特有の活性化合物であるフィトカンナビノイドの治療効果が免疫学の分野で発見されている。フィトカンナビノイドは、ヒトのエンドカンナビノイド系との相互作用によって生物学的機能が伝達されるテルペノフェノール化合物群である。ここでは、重症COVID-19感染症で起こる炎症イベントとの関連でカンナビノイドの抗炎症機能を探り、カンナビノイドが軽症から重症への進行をどのように予防するのかを明らかにする。
キーワード
SARS-CoV2,COVID-19,サイトカイン放出症候群、サイトカインストーム、炎症、カンナビス、カンナビノイド、カンナビノイド受容体
序論
新型重症急性呼吸器症候群-新型コロナウイルス(SARS-CoV2)によるコロナウイルス疾患19(COVID-19)は 2019年12月に中国の武漢で初めて出現し、その後、世界的なパンデミックへと発展している(1)。これは、細胞宿主の表面にあるアンジオテンシン変換酵素2(ACE2)にスパイク表面タンパク質(Sタンパク質)とともに結合する新規エンベロープ型RNAベータコロナウイルス属である。エンドサイトーシスによる宿主細胞へのウイルスの侵入は、宿主細胞膜貫通プロテアーゼセリン-2(TMPRSS-2)によるSタンパク質の切断を必要とする(2)。ACE2は、上気道系、中枢神経系および血管系の細胞、ならびに眼、肺、肝臓、心臓、腎臓および腸の細胞を含む多様な配列の細胞で発現し、COVID-19の消化管への関与を含むCOVID-19の多様な臨床的な肺および肺外症状に寄与している[(3-5); 図1]。
図1 ヒトの体内におけるACE2の分布
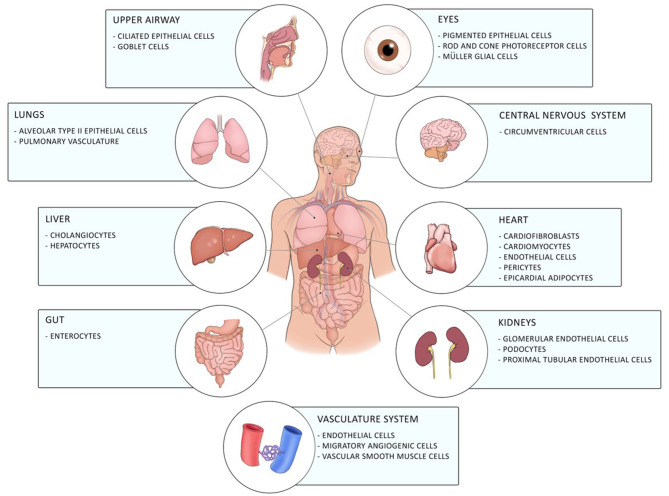
ACE2 は、目、上気道、肺、肝臓、腸、中枢神経系、心臓、血管系、腎臓のさまざまな細胞で発現している。
SARS-CoV2は、他のコロナウイルス感染症であるSARS-CoV1や中東呼吸器症候群(MERS)と同様に下気道系を標的とし、発熱、咳、呼吸困難を伴う肺炎を引き起こす(6)。ほとんどの患者(80%)は軽症(肺炎がない、または軽度の肺炎)のみを示するが、一部の患者(14%)は呼吸困難や低酸素症などの画像検査で50%以上の肺症状を示す重症の症状を呈する。ごく一部(5%)は呼吸不全、多臓器不全、全身性ショックを伴う重篤な疾患を発症する。入院患者の約10~30%が呼吸器サポートのための集中治療を必要とする重症期に入る。全患者の約1%が致死的転帰を起こす(7,8)。急性呼吸窮迫症候群(ARDS)を発症し、機械換気を必要とした患者の死亡率は 2020年3月にニューヨーク市地域で88.1%と報告されている(9)。興味深いことに、高齢者だけでなく、高血圧、糖尿病、肥満などの軽度の併存疾患のみを持つ若年患者でも呼吸不全を発症していた(10)。
疫学的データは、COVID-19の感受性と重症度の違いが生物学的および社会経済的要因に大きく依存していることを示している。重症化率が低いのは、白人系の女性であった(11,12)。これは、女性の方がマクロファージや好中球の活性が高く、抗体産生の増加とサイトカイン産生の低下により、ウイルス感染症にかかりにくいという事実に起因していると考えられる(12)。一方、少数民族の方がSARS-CoV2感染症に感染しやすいようである(11, 12)。少数民族は通常、機能的な医療制度へのアクセスが少なく、医療合併症が多く、社会経済的地位が低いために細胞を介した免疫力が弱い(11, 12)。
重症化は2段階で進行する。最初は軽度の症状であったが、初期症状の発症から 10日後に呼吸器症状が悪化する。この症状の悪化は、胸部画像上でのグランドグラス肺開口、リンパ球減少、高Dダイマー、高プロトロンビンの臨床症状を伴う(1)。中等症の患者では、炎症反応の漸進的な低下が回復期に起こるが、重症の患者では、これらのレベルは高いままであり、おそらく欠陥のあるI型インターフェロン応答に起因する追加の炎症のクラスターが現れる(13) [(14); 図2]。COVID-19患者におけるこれらの全身性高炎症パターンは、サイトカイン放出症候群(CRS)のパターンと類似しており、重症患者におけるCRSの発生が示唆された(15)。
図2 COVID-19患者における炎症反応
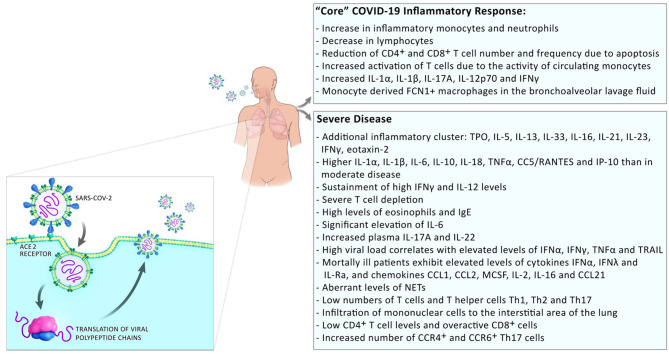
SARS-CoV2に対する炎症性反応は、すべてのCOVID-19患者が経験する「コア」炎症性反応を構成する。軽症の患者では、炎症反応は回復に向かう途中で消失する。重症化すると、追加の炎症性クラスターの出現が観察される。これには、より多くの全身性の炎症性サイトカインの放出、数は少ないが過剰反応性のT細胞、感染部位への単球/マクロファージの浸潤が含まれる。
重度のCOVID-19を発症しやすいパターンは認識されているが(13, 16)、感染者の炎症反応と免疫動態はまだ完全には解明されていない。このため、SARS-CoV2感染の正確な経過および特定の臨床症状との相関関係は非常に予測不可能である。SARS-CoV2に対する効果的で特異的な抗ウイルス薬はまだ利用できない。利用可能な再利用可能な抗炎症薬(17)およびウイルスクリアランスを標的とした抗体ベースの免疫療法薬(18,19)の使用は、まだ実験的であり、重症患者および重症患者の治療にのみ適用されている(20-22)。疾患の進行を早期に食い止める可能性のある安全で効率的な治療法の選択肢が必要とされている。よく知られている抗炎症作用を持つ大麻とカンナビノイドは、この可能性を秘めているかもしれない。
大麻には、カンナビス・サティバ、カンナビス・ルデラルリス、カンナビス・インディカと呼ばれる様々な系統がある。彼らは3つの異なる種であるかどうか、またはruderalisとindicaはC. sativaの亜種であるかどうかは不明である。人類の歴史の中で、大麻は織物の生産、食用、娯楽用、薬用など様々な用途で栽培されていた。医学的に有用な物質は、植物の葉や芽にあるトリコームで生産されている(23)。
大麻植物には550以上の異なる成分が含まれているが、そのうち約150はC21またはC22テルペノフェノール系の光化学物質で、大麻植物で主に発現しているためカンナビノイドと呼ばれている。他の400の成分は、テルペンおよびフェノール化合物である(24)。カンナビノイド成分は、精神活性[9-テトラヒドロカンナビノール酸(THCA)として]と非精神活性[カンナビジル酸(CBDA)として]の両方の物質を含んでいる(24)。カンナビノイドの生物学的特性は、Gタンパク質結合受容体および過渡受容体電位シャネル(TRP)を含むエンドカンナビノイド系との相互作用に依存している(25)。
最も興味深いことに、特に非鎮痛性カンナビオールの抗炎症特性は、最近、抗ウイルス剤として探索された。これらの効果は、HIV(26)、ウイルス性肝炎(27)、インフルエンザ(28,29)やオルソポックスウイルス、ボルナ病ウイルス、ワクシニアウイルス(30)の治療に示されている。
ここでは、植物性カンナビノイドの抗炎症性資質を探り、COVID-19患者の治療オプションとしてカンナビノイドを適用する可能性について議論する。最近の文献を探り、軽度または重度のCOVID-19感染症におけるサイトカイン放出症候群(CRS)中に生じる事象との関連で抗炎症性を強調する。
COVID-19患者におけるサイトカイン放出症候群
SARS-CoV2 の各感染は、単球/マクロファージおよび T 細胞が特別な役割を果たす過剰な炎症性イベントと密接に関連している(31)。単球および骨髄組織を中心に発生するびまん性肺胞障害、肺血栓および血管炎、リンパ節、脾臓および肺での血漿細胞の過剰が観察された(15,32)。これにより白血球が著しく増加し、同時にCD4+およびCD8+リンパ球が減少して好中球対リンパ球比が低下する(33)。炎症性細胞は、SARS-CoV2感染の初期段階で感染部位に浸潤し、IL-6,IL-17A、TNF-α、IFNγ、IL-1α/βなどの炎症性サイトカイン、およびCC-ケモカインリガンド2(CCL2)やCXC-ケモカインリガンド10(CXCL10)などのケモカインストームのような放出を引き起こす(13)。循環単球によるIL-6の血流中への放出は、T細胞の活性化を増加させ、それに伴いT細胞の総数を減少させる。気管支肺胞液(BALF)には単球由来のFNC1+マクロファージが認められており(13, 34)、これが炎症亢進現象に寄与していると考えられている(35)。CRSは、ウイルスが宿主に侵入して自然免疫応答および適応免疫応答を引き起こすことに始まり、感染のあらゆる段階で発症する可能性がある。
SARS-CoV2-ACE2相互作用によるCRSの誘導
ウイルスが ACE2 に結合すると、ACE2 が内包され、アンジオテンシン II が活性化され、核内因子κB(NF-κB)が活性化される。その後、サイトカイン IL-6,TNF-α、IL-1β、IL-10 が産生され、これが血圧上昇を含む局所的な肺機能障害を引き起こし、ARDS で起こるような肺障害や肺機能の低下に寄与する可能性がある(36, 37)。
自然免疫細胞によるCRSの誘導
ACE2はCOVID-19患者のリンパ節と脾臓のCD169+マクロファージに認められ、重度のリンパ球アポトーシスが観察された。CD169+細胞はI型インターフェロンを介してウイルスの複製を制御し、ウイルス抗原を適応免疫細胞に認識させる(39)。CD169+マクロファージの感染は、脾臓およびリンパ節へのウイルスの転座を可能にし、その結果、感染部位および感染に隣接する部位における炎症性単球およびマクロファージの蓄積をもたらすウイルスの体全体への分布に寄与する(40)。
ARDS患者のBALFでは、炎症性サイトカインやケモカインを産生する単球由来のFCN1+マクロファージが発見された(34)。これはT細胞のアポトーシスの誘導に寄与している可能性があり、肺炎やARDSへの病勢進行につながる可能性がある(41)。さらに、脾臓およびリンパ節におけるIL-6の産生、ならびに肺胞マクロファージによるIL-6,TNF-α、IL-10およびPD-1の産生は、リンパ球壊死を誘導し、肺におけるリンパ球減少症およびサイトカインストームの発生にさらに寄与する(38)。
末梢血やBALFでは単球や単核細胞が活性化され、IL-6,IL-10,TNF-αを分泌し、マクロファージのIFN誘導性プロテイン10(IP-10)やMCP-1のケモアクトラクターを分泌する(42)。末梢血単核細胞(PBMC)およびBALFでは、高レベルの好中球引き付けケモカインCXCL2およびCXCL8が好中球を炎症部位に引き付ける(43)。好中球は、ARDS患者で異常に発見されているNETと呼ばれる感染性粒子に対するDNAとヒストンの細胞外網を分泌する(44)。好中球は、サイトカイン放出の調節に影響を与えるため、重症患者の静脈血栓症や動脈血栓症、多臓器不全、呼吸不全、凝固障害に関与していると考えられている(42)。
適応免疫細胞によるCRSの誘導
リンパ球減少症は、重度のCOVID-19患者においてよく観察される症状である。これは、好中球の増加、単球およびマクロファージの過活動化と相まって、循環するB細胞およびT細胞の数が著しく減少していることを意味する。
重度の疾患症状を呈する患者では、CD4+ T細胞から分泌される多量のサイトカインによるT細胞のアポトーシス(46,47)または他の組織への再分配により、単核球が肺の間質領域に浸潤し、間質性肺炎の発症に寄与するT細胞およびTヘルパー細胞、Th1,Th2,およびTh17の数が低下している(45)。
ARDS患者では、発症14日後にCD4+およびCD8+ T細胞が末梢血中に認められた。CD8+ T細胞は主にIFNγを分泌するが、CD4+ T細胞は、重度のCOVID-19ではレベルが低下するものの、Th1(IFNγ、TNF-α、IL-2)およびTh2(IL-5,IL-9,IL-10)に関連するサイトカインを正常レベルで分泌する(49)。ARDS患者では、CD8+細胞の活性化が低いが、過剰に活性化されている(51)ため、T細胞が枯渇し、T細胞応答が無効になっている(50)。さらに、Th1およびTh17ヘルパー細胞を含む活性化されたT細胞は、単球の活性化をさらに刺激し、IL-1β、IL-6,およびコロニー刺激因子(脳脊髄液1および脳脊髄液2)の分泌を可能にし、臓器不全をもたらすサイトカインストームの悪化に寄与する(46)。
T細胞のもう一つの重要なサブセットは、調節性T細胞(Tregs)である。これらの細胞は、高炎症を防ぐために免疫応答を調節する役割を担っている。そのために、抗ウイルス免疫応答において急速に増殖する(52)。重度のCOVID-19患者におけるTregsのレベルについては、これまでのところ一貫性のない結果が得られている。ある者はより高いTregsレベルを観察したが、他の者はレベルの減少または変化なしを報告した(45)。
上記の結果として、多数のプロ炎症性サイトカインレベルの有意な上昇が報告された。最も顕著に上昇したプロ炎症性サイトカインは、重度の症状を持つ患者ではIL-6である。CD14+およびCD16+単球からのこのIL-6産生は、Th1細胞によって産生されるGM-脳脊髄液によって駆動される(53)が、ウイルス負荷と直接相関している(54)。さらに、IL-6は凝固カスケードを誘導することにより、肺中心性凝固症に影響を及ぼす可能性がある(55)。
ARDSを有するCOVID-19患者では、CCR4+およびCCR6+ Th17細胞の増加が測定された(56)。他のサイトカインであるIL-1,IL-17,TNF-α、GM-脳脊髄液はTh17免疫応答と関連していた(57)。これらの観察は、Th17型サイトカインストームの発生、および重度のCOVID-19患者における多臓器障害の発症を説明するかもしれない(56)。同様に、IP-10,CCL5/RANTES41,CRPおよびCダイマーの産生は、軽度のCOVID-19と比較して重度のCOVID-19患者で高かった(57)。抗炎症性サイトカインIL-10およびIL-4の増加は、肺間質性線維症の発症に関与している可能性のあるTh2応答の上昇を示唆している(13, 58)。根底にある細菌感染が炎症反応を悪化させ、CRSの発症に寄与している可能性がある(59)。
COVID-19患者に対する治療法の選択肢
COVID-19の治療を成功させるための特定の抗ウイルス薬は存在しない。いくつかの抗炎症薬は、前臨床試験および臨床試験において、重症患者のCRSを解決するための再利用薬として試験されており、デキサメタゾン(60,61)のようなステロイドおよび副腎皮質ステロイド、リウマチ科で通常使用されるモノクローナル抗体およびポリクローナル抗体、すなわち、「有名なモノクローナル抗体カクテルREGNCOV2」を含む、IL-6阻害剤トシリズマブ(62-65)がある。有名な」モノクローナル抗体カクテルREGN-COV2(66)を含むIL-6阻害剤トシリズマブ(62-65)レムデシビル(67)またはロピナビル-リトナビルのような抗ウイルス剤、またはHIV治療薬の組み合わせ。抗寄生虫薬のヒドロキシクロロキン(68)や、HIVに対して抗ウイルス作用を示したファモチジン(ヒスタミン-2受容体拮抗薬)やオメプラゾール(プロトンポンプ阻害薬)などの消化器疾患治療薬(69)のほかに、回復期血漿の投与も試験されている(22)。
最近FDAに承認されたレムデシビルを除くほとんどの薬剤は、まだ臨床試験中であるか、死亡率を低下させることができなかった(20-22)。死亡率を予防するためには、早期に疾患の進行を食い止める治療法が必要である。抗炎症機能を有するカンナビノイドは、CRSを回避するための潜在的な候補である(70-72)。
大麻とエンドカンナビノイド系
大麻植物は550種類以上の化学成分で構成されており、そのうち約150種類はカンナビノイドであり、約400種類は非カンナビノイドである。主な薬理学的に活性な化合物は、精神作用のあるテトラヒドロカンナビノール(THC)、Δ8-THC、Δ9-THC、およびカンナビノール(CBN)、カンナビジオール(CBD)、またはカンナビゲロール(CBG)のような他の非精神作用のあるカンナビノイドで、ほんの数例を挙げればキリがない。CBNは1899年に単離された最初のカンナビノイドである(73)。非カンナビノイドは、フラボノイド、テルペン、および脂肪酸である[(23, 24); 図3]。
図3 Cannabis sativa spp.に含まれるカンナビノイド。
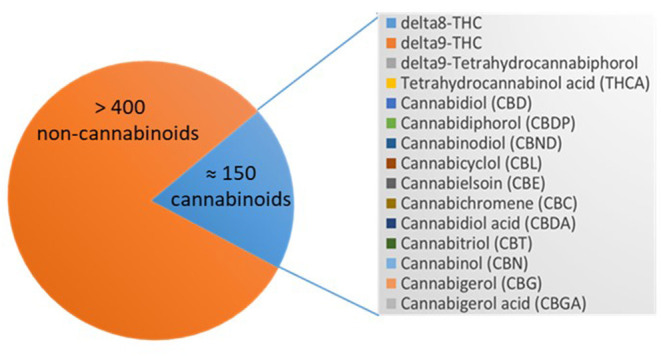
描かれているのは、大麻植物の化合物の数で、>400の非カンナビノイドと≈150のカンナビノイドが略語を含めてリストアップされている。
カンナビノイド受容体とそのリガンド
カンナビノイドは、細胞膜に固定されたカンナビノイド受容体を介してその機能を伝達する。カンナビノイド受容体は、エンドカンナビノイド系を構成するエンドカンナビノイドやフィトカンナビノイドに結合する。最も研究されているエンドカンナビノイドは、2-アラキドノイルグリセロール(2-AG)(74)とN-アラキドノイルエタノールアミド(アナンダミド、AEA)(75)である。これらは、脳または末梢組織の多くの細胞型によって生理学的または病理学的刺激に応答して膜リン脂質から「オンデマンドで」合成および放出されるか、またはトラフィッキングおよび蓄積のための潜在的なプラットフォームとして機能する可能性のある小器官に保存される可能性がある脂質メディエーターのグループに属する(76)。
2-AGは脂質代謝の中間体として機能するモノアシルグリセロールである(77)。2-AGは、シグナル伝達経路と代謝経路の2つの主要な経路によって必要に応じて合成される。シグナル伝達経路はホスファチジルイノシトール-4,5-biphosphate(PIP2)から始まり、代謝経路は2-アラキドン酸を含むトリグリセリドから始まる(78)。PIP2から 2つのセカンドメッセンジャー:ジアシルグリセロール(DAG)およびイノシトール-1,4,5-三リン酸(75)が合成される。トリグリセリドは、ホルモン感受性リパーゼ、他のリパーゼ、およびカルボキシルテラーゼによって加水分解され、2-アラキドニルグリセロール(75)を含むジグリセリドになる。ジグリセリドは、その後、ジアシルグリセロールリパーゼαおよびβ(DAGL-αおよび-β)の2つのアイソフォームによってさらに処理され、2-AGおよび脂肪酸が生成される(79)。2-AGの分解は、酵素モノアシルグリセロールリパーゼ(MAGL)またはα,β-ヒドロラーゼドメイン含有タンパク質12および6(ABHD12およびABHD6)によるアラキドン酸およびグリセロールへのエステル結合の加水分解によって達成される(80)。
AEAの生合成には2つのステップがある。(i)カルシウム依存性N-アシル転移酵素によって触媒されるホスファチジルエタノールアミンからのN-アラキドノイル-ホスファチジルエタノールアミンの形成と、(ii)5つの異なる代謝経路を介したN-アラキドノイル-ホスファチジルエタノールアミンのAEAまたは他のN-アシルエタノールアミンへの変換、そのうち最も研究されている経路はN-アシル-ホスファチジルエタノールアミン加水分解ホスホリパーゼDである(76, 81)。AEAの分解は、脂肪酸アミドヒドロラーゼ(FAAH)またはN-アシルエタノールアミン加水分解酸アミダーゼ(82)によるアラキドン酸およびエタノールアミンへの開裂を介して行われる。
2-AGおよびAEAの両方は、シクロオキシゲナーゼ(COX)、リポキシゲナーゼ(LOX)、またはシトクロムP450によって分解され、ヒドロキシル-アナンダミドおよびヒドロキシエイコサテトラエンロイル-グリセロール、またはプロスタグランジン-エタノールアミンおよびプロスタグランジン-グリセリルエステルのような酸化化合物の形成をもたらし、それらはすべて異なる生物学的機能を有する(76)。
2つの異なるクラスの受容体が、カンナビノイド受容体、Gタンパク質共役型受容体(GPCR)および一過性受容体電位チャネル(TRP)として割り当てられており、以下の2つのセクションおよび表1でさらに詳細に説明する。
表1 カンナビノイドの受容体
| 受容体 | 免疫細胞/組織内の位置 | 免疫における機能 | リガンド |
|---|---|---|---|
| CB1とCB2 | -免疫組織(脾臓及び胸腺)及びナチュラルキラー細胞、B細胞などの白血球亜集団、および末梢血単核細胞(83、84) | -IL-2合成を低下させます(85) -T細胞活性化の抑制(86 – 89) -リンパ球増殖とIL-17分泌の阻害(86) -腸内好中球の機能の調節(90) -好中球の急性輸送の調節炎症部位(の91) -骨髄における未成熟B細胞の保持(92) -免疫抑制AEAまたはΔ後のB細胞における9 -THCリガンド結合(93) |
エンドカンナビノイド: – 2-AG(94)、AEA(95)Phytocannabinoids: – Δ 9 -THC及びΔ 8疼痛管理を規制部分アゴニストとして-THC(96、97) -アゴニストとしてCBN(98) – CBD弱いアンタゴニストとして(99)、負のアロステリックモジュレーター(AS 100)、およびアナンダミド取り込みの阻害剤として(101) -弱い部分的アゴニストとしてCBG(102、103)、及びAEA取り込み(の阻害剤として101) -弱いとしてCBCアゴニスト(103)、およびAEA取り込み阻害剤(AS 101) – Δ 9アンタゴニストとして-THCV(104) |
| GPR18 | -脾臓(105) -CD4 + -およびCD8 + T細胞およびCD19 + B細胞(106) |
-CD8 + IELのサブセット(CD8ααおよびCD8αβIEL)の正常な恒常性に対する小腸の免疫調節(107) | エンドカンナビノイド: – NAGly(105)Phytocannabinoids: – Δ 9 -THCのようなアゴニスト(108) – CBDアンタゴニストとして(108) |
| GPR55 | -白血球 | -T細胞の遊走(109) -炎症性および神経因性疼痛に関連する痛覚過敏(110) |
エンドカンナビノイド: – AEA、2-AG、及びvirodhamine(111)Phytocannabinoids: – Δ 9アゴニスト(AS -THC 112)とLPI阻害剤(113) -アンタゴニストとしてCBD(111) -弱いLPI阻害剤としてCBG(113) – Δ 9部分アゴニストとLPI阻害剤(など-THCV 113) – LPI阻害剤としてCBDV(113) |
| TRPV2 | -ヒトおよびマウスB細胞 -ヒト樹状細胞および好中球 -マウス単球およびマクロファージ |
-TRPV2の原形質膜への移行は、マクロファージの走化性と食作用に役割を果たします(114)-CBDの いくつかの鎮痛および抗増殖特性はTRPV2の活性化によって媒介される可能性があります(115) |
Phytocannabinoids: – Δ 9 -THC、CBD、CBG、Δ 9 -THCV、およびCBDVアゴニストとして(101、116) |
| TRPA1 | -ヒトの肺線維芽細胞および上皮細胞で発現(117) | -アゴニスト結合はIL-8の放出をもたらします -炎症を起こした気道におけるケモカインの放出の調節における役割(117) |
Phytocannabinoids – Δ 9 -THC、CBG(118) -アンタゴニストとしてCBNとCBC(101) |
| TRPM8 | -CD38、CD79a、CD138などのいくつかの分化クラスター(CD)と共発現し、成熟B細胞新生物で発現します(119)。 | -炎症性および神経因性疼痛に関連する寒冷過敏症における役割(120) | Phytocannabinoids: – Δ 9 -THC、CBG(118) -アンタゴニストとしてCBNとCBC(101) |
CB、カンナビノイド受容体;2-AG、2-アラキドノイルグリセロール;AEA、N-アラキドノイルエタノールアミド;NADA、N-アラキドノイルドーパミン;THC、テトラヒドロカンナビノール;CBN、カンナビノール。CBD、カンナビジオール;CBG、カンナビゲロール;CBC、カンナビクロメン;THCV、テトラヒドロカンナビノール;GPR、Gタンパク質共役型受容体;LPI、リゾホスファチジルイノシトール。CBDV、カンナビジバリン;NAGly、N-アラキドニルグリシン;TRPV2,一過性受容体電位カチオンチャネル;サブファミリーV;メンバー2;IELs、上皮内リンパ球;TRPA1,一過性受容体電位カチオンチャネル;サブファミリーA;メンバー1;TRPM8,一過性受容体電位カチオンチャネル;サブファミリーM、メンバー8。
Gタンパク質共役型受容体
Gタンパク質共役型受容体は、膜タンパク質の一族である。GPCR は、細胞内ループと細胞外ループを交互に繰り返すことで分離された 7 つの膜をまたぐαらせん状ドメインによって特徴づけられている。GPCR は、神経伝達物質やホルモンに対する細胞応答を媒介し、主に味覚、視覚、嗅覚に関与している。免疫系のシグナル伝達に関与していると考えられているエンドおよびフィトカンナビノイドシグナリングを媒介する最も顕著なGPCRは、CB1R、CB2R、GPCR18,およびGPCR55である(121)。
一過性の受容体電位チャンネル
一過性受容体電位 (TRP) チャネルは、イオンチャネルの一族である。TRPは、機能的なチャネルを形成するためにテトラマーに集合するS5とS6の間の孔形成ループを持つ6つの膜貫通セグメント(S1-S6)からなるチャネルサブユニットで構成された膜タンパク質である(122)。TRPは多数の化学的・物理的刺激のシグナル伝達に関与し、多くの神経シグナル伝達プロセスや、温度感覚、嗅覚、味覚、視覚、圧力、痛みの知覚などの他の生理機能を制御している(123)。したがって、それらは、感覚、炎症性または皮膚病の治療における植物性カンナビノイドの治療的使用のための潜在的に魅力的なターゲットである(124)。ほとんどのTRPは、多くの疾患状態の危険因子であるチャネル病を引き起こす可能性がある(125)。
想定されるカンナビノイド受容体であるTRPは、TRPV1-4,TRPA1,およびTRPM8である(126)。
カンナビノイドの抗炎症特性およびCOVID-19関連CRSをダウンレギュレートする可能性
大麻がCOVID-19の疾患経過に影響を与える可能性があるという最初の兆候は、現在のパンデミックが発生する3年前にすでに発表されていた。イタリアの研究者たちは、脱脂した麻の種子からアルカリ可溶化/酸性沈殿法で調製したヘンプシードタンパク単離物のACE-2阻害剤としての可能性を調べた。一次元および二次元NMRおよびLC-MS分析により、4つの生理活性を有するペプチドGVLY、IEE、LGVおよびRVRが試験画分中に同定された。4つのペプチドはすべてACE阻害活性を有しており、麻の種子はSARS-CoV2の細胞内への侵入を阻害する可能性のある薬剤であると考えられた(127)。
最近、カナダの研究者は800種類のC. sativa系統のCBD抽出物を、口腔、気道、腸管組織の3Dヒトモデルで試験したところ、13種類の低THC/高CBD系統がACE2とTMPRSS2レベルを調節し、ウイルス負荷を低下させる可能性があることを発見した(128)。大麻由来の製品のACE2低減活性は、別のグループによって確認された。彼らは、C. sativa株のCBD、CBG、およびTHCVを含む画分を抽出し、標準的な植物性カンナビノイド剤と比較して試験管内試験で試験した。両方の製品は、肺胞上皮細胞株A549からのプロ炎症性サイトカインIL-6,IL-8,CCL2およびCCL7の分泌を減少させ、マクロファージ細胞株KG1の分極を誘導し、貪食を増加させた。CD36およびIgGのFc領域に対するII型受容体(FcγRII)がアップレギュレーションされた。研究者らは、大麻由来の画分と比較して、標準的な植物性カンナビノイドの一定の優越性を報告したが、COVID-19の治療における大麻の使用に関する推奨を与えることはできない(129)。別の最近の研究では、合成RNAポリI:Cを使用してウイルス感染をシミュレートし、ポリI:CによるARDSがアペリンのアップレギュレーションを介してCBD(130)によって阻止されることを示すことができた(131)。以下の2つのセクションでは、エンドおよびフィトカンナビノイドによる免疫応答の調節過程を紹介する。
CB1およびCB2を介したエンドカンナビノイドによる免疫応答の制御
エンドカンナビノイド系は、自然免疫および適応免疫において抗炎症作用を有する。エンドカンナビノイド系は、その受容体に依存して様々な免疫細胞の遊走や移動を制御している。健康なドナーから吸引して得られたヒト骨髄細胞を用いた実験では、ヒト造血幹細胞および前駆細胞の遊走がエンドカンナビノイドによって調節されていることが示された。エンドカンナビノイド受容体CB1とCB2は骨髄由来の造血幹細胞とCD34+細胞で発現していた。末梢血と骨髄の微小環境では、骨髄間葉系幹細胞から分泌されるAEAと2-AGが検出された。造血幹細胞の遊走はAEAと2-AGによって刺激され、エンドカンナビノイドは造血幹細胞の遊走を促進するための候補と考えられるCB受容体拮抗薬によって阻害された(132)。
リンパ球、マクロファージ、好中球、樹状細胞などの成熟した免疫細胞やエフェクター細胞の細胞移動は、エンドカンナビノイドによって制御される。2-AGを外因的に添加すると、Th1-およびTh17関連サイトカインであるIL-6,IL-2,TNF-αが減少し、リンパ球の増殖が抑制されることが報告されている。さらに、2-AGを高レベルで産生する活性化されたB細胞およびT細胞は、フィードバックループでT細胞の活性化および増殖を阻害するため、外因性に適用された2-AGは、Th1-またはTh17依存性の疾患における治療法の候補となる(134)。病原体によって抗原が活性化されると、マクロファージや樹状細胞が2-AGを産生・放出し、その結果、CB2依存的にワクチン接種中のマウスの血清やリンパ節における2-AGレベルが上昇する。マウス免疫化モデルにおいて、CB2アンタゴニストAM630または逆アンタゴニストJTE907の一過性投与は、二次リンパ組織における免疫調節遺伝子のアップレギュレーションによる抗原特異的免疫応答の強度を増加させた(135)。AEAはTNF-α感受性マウス肺胞マクロファージ細胞株L929のマクロファージ媒介死を阻害した(136)。Correaらは、免疫疾患の試験管内試験モデルにおいて、AEAがIL-12やIL-23のようなプロ炎症性サイトカインの発現を阻害し、活性化したマウスのミクログリアにおいて抗炎症性サイトカインIL-10を増加させるという証拠を提示した(137-139)。急性腸炎モデルでは、トランスポーターP糖タンパク質がエンドカンナビノイドの腸管腔への流入を助け、好中球の遊走を阻害することが示されている(90)。同様に、好中球の遊走に関連した転写プロファイルは、CB2-/-マウスにおいて増強された。Zymogenに応答して、好中球、リンパ球抗原6複合体が背側空気袋にリクルートされ、メタロプロテアーゼ9とCCL4とCXCL10が増加した(91)。
フィトカンナビノイドによる免疫応答の制御
同様に、植物性カンナビノイドであるCBDとTHCの抽出物は、活性化リンパ球の増殖とプロ炎症性IL-17の分泌を減衰させ、それによって抗炎症性IL-10の分泌を増加させることができた(86)。さらに、エンドカンナビノイドAEAおよびフィトカンナビノイドTHCもまた、抗体形成の一次および二次試験管内試験プラーク形成細胞アッセイで検討されたように、B細胞の免疫抑制を誘導することができる(93)。外因性に適用されたCBDは、NFAT、AP-1,およびNF-κBのような炎症に関与する転写因子を抑制し、その結果、多様な細胞および組織において、IL-6,IL-1β、IL-1α、GM-脳脊髄液、およびTNF-αのようなサイトカインを広範に抑制することが多くの報告で示されている(140)。これらのサイトカインは、COVID-19におけるCRSの発生に中心的な役割を持っている。IL-6はTh17細胞の分化を促進し、これはCBDによって抑制されることが示された(141)。さらに、CBDはIFNγを抑制することが示された(142)。
前臨床研究の茄多は、特定の大麻株のカンナビノイドが、肺または炎症性疾患のマウスモデルにおける炎症反応に影響を与え、その進行を停止させることができることを示している。LPS誘発性急性肺障害のマウスモデルでは、CBDは3つのメカニズムで旺盛な免疫応答を抑制した。(i)白血球および好中球の肺組織への浸潤抑制、(ii)炎症性サイトカインTNF-α、IL-6,ケモカインMCP-1およびMIP-2のBALFへの分泌抑制、(iii)好中球に豊富に発現する抗菌活性を有する酵素であるミエロペルオキシダーゼの活性抑制である(143)。慢性喘息のマウスモデルでは、IL-4,IL-5,IL-6,IL-13,およびTNF-αのサイトカインレベルがCBDによって低下したが、これはおそらくCB1受容体を介して作用していると考えられる。これにより、気道の炎症や線維化が減少した(144, 145)。さらに、炎症性疾患のマウスモデルでは、調節性T細胞の産生が増加していた(146)。
大麻のこれらの抗炎症作用は、COVID-19患者の軽症から重症への移行期に宿主の炎症反応が病的になる前のCRSの予防に有益であるかもしれない(図4)。
図4 SARS-CoV2感染時の炎症反応に対するカンナビノイドの影響
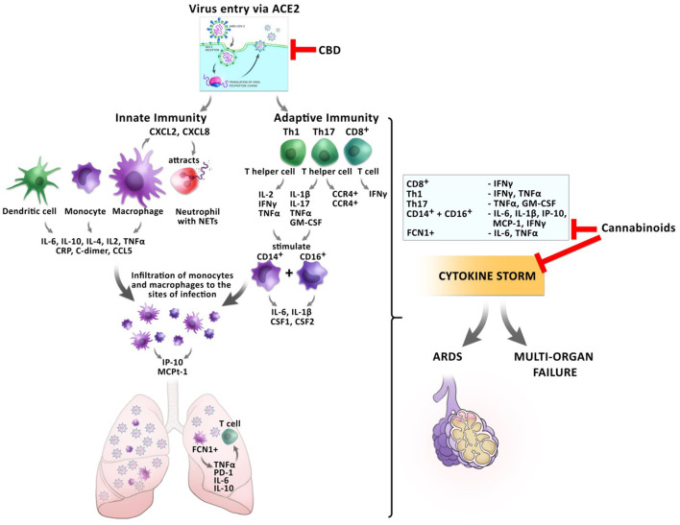
ACE2を介したウイルスの侵入は、CBDによって抑制され、細胞内のウイルス負荷を減少させることができる。ウイルスの感染は、自然免疫と適応免疫の炎症反応のカスケードを誘発する。単球やマクロファージはサイトカインやケモカインを分泌する。活性化されたマクロファージは、感染の部位にNETを解放する好中球を引き付けるCXCL2とCXCL8を分泌する。感染するFCN1+マクロファージは、T細胞のアポトーシスにつながる肺のIL-6,IL-10,およびTNF-αを分泌する。CD8+ T細胞はIFNγとTNF-αを分泌する。Tヘルパー細胞Th1およびTh17は、CD14+およびCD16+単球を刺激して、IL-6,IL-1β、および脳脊髄液1および脳脊髄液2を分泌する。これは、ARDSまたは多臓器不全の頂点に達する可能性のあるサイトカインストームの発生を導く。カンナビノイドは、いくつかの炎症性サイトカインの分泌を抑制する可能性があり、その結果、CRSの予防につながる。
結論と今後の展望
現在の臨床データによると,COVID-19の重篤な症状の多くはCRSに関連しており,COVID-19患者の致命的な転帰の原因にもなっていると推測されている.ここでは、カンナビノイドがCOVID-19患者のCRSにつながる炎症亢進を抑制する可能性があるという仮説について議論する。しかし、前臨床試験および臨床試験からの広範なエビデンスはまだ不足しているが、緊急に必要とされている。なぜなら、大麻の薬効の可能性にもかかわらず、大麻は有害または乱用されて使用される可能性があるからである。大麻は世界で最も広く使用されている違法薬物である。2020年の国連薬物・犯罪世界薬物報告書(UNODC)では 2018年に約1億9,200万人の使用者を測定している(147)。合法化後の2015年から 2018年の間に、米国では高齢者の間で使用量の増加が見られ(148)、オランダでは初のロックダウン(149)、米国では既知の大麻ユーザーが使用量を増やした(150)。大麻投与の最も一般的なルートは、タバコの有無に関わらず喫煙である。このことは、COVID-19患者の重症・重症状態の発症に関連して懸念されている。なぜならば、タバコを吸うことでACE-2がアップレギュレーションされ、ウイルスの細胞への侵入率が高まり、予後が悪化するからです(151)。ヨーロッパではまだ77.2-90.9%がタバコをベースとした喫煙を好む(152)が、米国では合法化されて以来、気化やエディブルのような大麻投与の代替ルートの使用が増加している(153)。しかし、SARS-CoV2感染の可能性とその転帰について、喫煙よりもベーパーピングの方が有利かどうかはまだ不明である(154)。
さらに、重篤な心血管系イベントは、狭心症の存在下での心筋梗塞のリスク上昇(156)を含むハーブ大麻の急性使用後に報告され(155) 2006年から 2010年の間にユーザーの26%で心血管系の死亡が報告された(157)。思春期のユーザーでは、ハーブ大麻の定期的な使用は、短期記憶の喪失、気分障害、統合失調症などの不可逆的な認知機能の低下につながる可能性がある(158)。
しかし、増加している証拠は、化学療法によって誘発された悪心・嘔吐の制吐剤として、また患者の報告に基づく多発性硬化症の痙縮の改善や睡眠改善、線維筋痛症の改善など、成人患者の慢性疼痛に対するカンナビジオールのポジティブな影響を示している(159)。しかし、カンナビノイドの便益とリスクの比を評価するためには、より正確に標的を絞った臨床研究を多く行う必要がある。これらの懸念を総合すると、薬用目的での大麻の適切な使用を可能にする、より深い科学的根拠に基づいたデータの必要性が強調される。医療用大麻研究イノベーションセンターでの研究は、このルートに沿って行われている。私たちは、薬物乱用の可能性が最も低く、副作用が最も少ない選択された系統のカンナビノイドの成分の正確な抗炎症能力について、より多くの知識を得ることを目指している。
