Contents
The Hyperoxic-Hypoxic Paradox
オンラインで公開2020年6月25日
概要
効率的な代謝は、治療上の狭い範囲の酸素に大きく依存している。したがって、低酸素は、遺伝子の発現、代謝の変化、血管新生や幹細胞の増殖・移動・分化の促進などの再生プロセスを最も強力に誘導する因子の一つである。酸素濃度の低下(低酸素)または増加(高酸素)を感知するには、特殊な化学受容体細胞を介して行われ、細胞レベルでの代謝変化が反応を制御する。興味深いことに、酸素の絶対量ではなく自由酸素濃度の変動は、細胞レベルでは酸素不足と解釈される。このように、断続的な高酸素を繰り返すことで、通常は低酸素時に誘導されるメディエーターや細胞メカニズムの多くが誘導される。これを高酸素-低酸素パラドックス(HHP)と呼ぶ。本稿では、酸素生理学、低酸素によって引き起こされる主な細胞プロセス、およびHHPによって引き起こされるイベントのカスケードについて概説する。
キーワード
高酸素、低酸素、高気圧酸素、生体形成、高酸素-低酸素パラドックス、低酸素誘導因子(HIF)
1. はじめに
酸素は、水素、ヘリウムに次いで宇宙で3番目に豊富な元素であり、地球上のほとんどの生物にとって最も支配的なエフェクターである。約3億年前の石炭紀には、大気中の酸素濃度が最大で35%に達し、この頃の動物や昆虫の大型化に貢献したと考えられている[1,2]。現在、地球の大気中の酸素は20.8%を占めており、その協働関係が少しでも変化すると、哺乳類の生理機能のすべてのレベルに劇的な影響を及ぼす。酸素のホメオスタシスを維持する能力は生存に不可欠であり、すべての哺乳類の生理学的システムは、各生物のすべての細胞に供給される最適なレベルの酸素を確保するために進化してきた。これは、酸素供給のための複雑な生理学的基盤(肺)酸素輸送担体(赤血球と血漿)酸素輸送経路(血管系)およびポンプ(心臓)の進化によって実現された。生物におけるこれらのシステムの発達と制御の両方が、酸素のホメオスタシスの基礎となっている。
効率的な代謝は、治療上の狭い範囲の酸素に大きく依存している。したがって、低酸素は、遺伝子発現、代謝変化、再生プロセス(血管新生、幹細胞の増殖・移動・分化の促進など)の最も強力な誘導因子の一つである。酸素濃度の低下(低酸素)や上昇(高酸素)は、特殊な化学受容体細胞を介して感知され、細胞レベルでの代謝変化によって反応が制御される。興味深いことに、細胞環境では、酸素の絶対量ではなく、自由酸素濃度の変動が酸素不足と解釈されることがある。そのため、酸素濃度を断続的に上昇させることで、低酸素症のときに通常誘導されるメディエーターや細胞メカニズムの多くを誘導することができる。これが高酸素-低酸素パラドックス(HHP)と呼ばれるものである。
本稿では、酸素生理学、低酸素症によって引き起こされる主な細胞プロセス、およびHHPによって引き起こされるイベントのカスケードについて概説する。
2. 酸素の恒常性
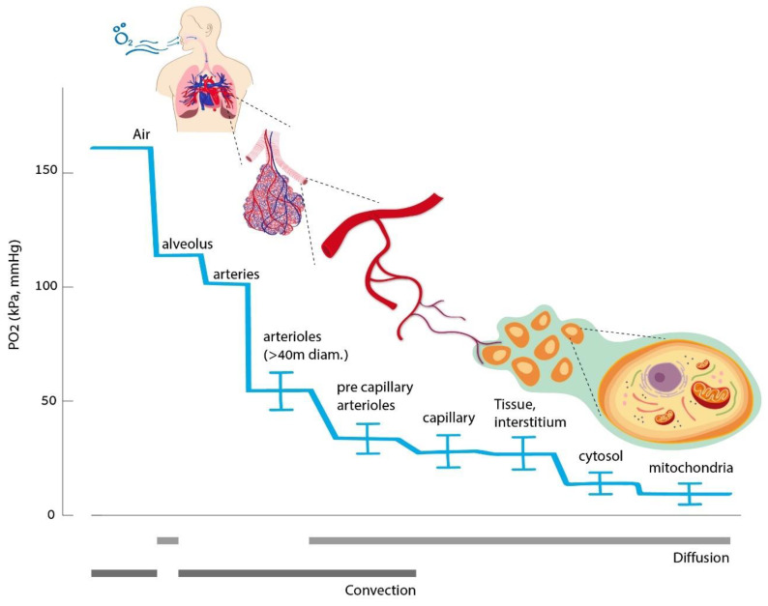
私たちの体のすべての組織は、変化する代謝需要に見合った速度で継続的に酸素を供給されることを必要としている。酸素供給の連鎖は、肺から始まり、ミトコンドリアを経由して行われる(図1)。酸素は気道と血管の対流によって運ばれる。その後、肺胞-毛細血管膜を通過し、毛細血管壁を通って間質に拡散し、目的地であるミトコンドリアに到達する。血液中の酸素は、ヘモグロビンに結合している部分と、血漿中に溶解している遊離部分の2つの形態で運ばれる。溶け込んでいる酸素の量は、ヘンリーの法則に従い、特定の温度における酸素分圧に比例する[3]。生理的な正常酸素状態、すなわち、通常の吸入酸素量(20.8%)では、酸素のほとんど(最大99%)がヘモグロビンによって運ばれ、溶解している酸素量は少ない[4]。そのため、赤血球の量が酸素運搬の総容量に圧倒的に影響する。しかし、酸素分圧が高くなると(純酸素吸入時や高気圧曝露時など)溶存量が大きくなることがある。いずれの場合も、拡散勾配が血漿からミトコンドリアへの酸素の駆動力となる。したがって、自由溶解分はミトコンドリアに支配的な影響を与える。酸素は細胞膜を自由に拡散すると考えられている。しかし、最近のデータでは、アクアポリン-1(AQP-1)などの水チャネルも酸素トランスポーターとして働いていることが示されている[5]。
図1 酸素運搬チェーン
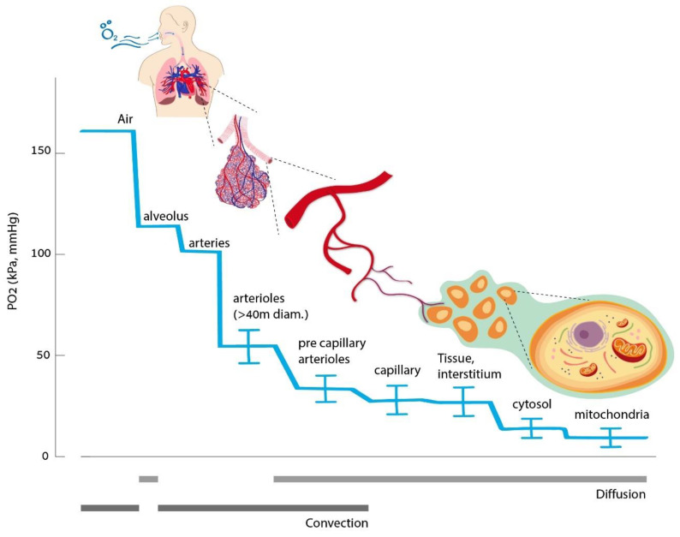
通常の定常状態では、酸素のホメオスタシスは動的に調節されたプロセスである。生理的な細胞の酸素要求量は、その時々の組織の要求に応じて変化する。例えば、運動している筋肉は、リラックスしている筋肉に比べて著しく高い酸素需要がある。そのため、組織への酸素供給量は継続的に調整される。
人体が適切な酸素供給を維持するには、いくつかのメカニズムがある [6]。低酸素に対する全身の感知と反応には、(a)動脈循環の化学センサーである頸動脈小体、(b)神経上皮小体(NEB)がある。NEBは、分岐点で気道内腔に露出している細胞の集まりで、迷走神経によって支配され、肺動脈を拡張して換気-輸液交換を最適化する。低酸素症になるとアドレナリン系が活性化され、心拍出量が増加し、より重要な臓器への血液灌流が選択的に行われる。臓器レベルでは、低酸素症に反応して動脈が拡張し、酸素供給量が増加する。酸素化レベルは腎臓でも感知され、腎臓は赤血球(RBC)の数と酸素運搬能力を調整するためにエリスロポエチンの産生を調節する。以上のように、酸素供給量の増加を可能にするダイナミックな呼吸器系と代謝系に加えて、細胞レベルでの調節機構が必要である。これらは、全身的な調節が不十分な極限環境や病的・疾患的な状態での生存に不可欠である。
細胞レベルでは、利用可能な酸素の80%がミトコンドリアで使用され、他のオルガネラでは20%しか使用されない。ミトコンドリアは酸素の消費と代謝を行う主要な組織であるため、ミトコンドリア内の酸素分圧は非常に低く、1〜3mmHg程度しかない(図1)。したがって、ミトコンドリアは、重要な酸素センサーであると同時に、重要なシグナル伝達器官でもある[7]。これまでのほとんどの証拠は、次のような説を示している。ミトコンドリアは、電子輸送鎖によって活性酸素種(ROS)のシグナルを発生させることで、低酸素症の開始を知らせている。活性酸素が膜間空間に放出されると、酵素、転写因子、翻訳後の反応の活性化と相互に作用する[8]。
さらに,いくつかの細胞は,独自のメカニズムで酸素濃度の低下に適応することができる[6]。例えば,赤血球に含まれるヘモグロビンは,低酸素状態でその形態や親和性を変化させることができる [4]。シトクロムP-450モノオキシゲナーゼ(CYP)には,幅広い化合物を酸化する膨大な数の相同性のある酸素感受性タンパク質が含まれている。多くの報告で、CYP代謝物が全身の微小血管や内皮における低酸素応答に寄与し、低酸素性肺血管収縮にも寄与している可能性が示唆されている[6,9,10]。
3. 低酸素誘導性細胞カスケード
上述したように、効果的な代謝は、酸素の狭い治療域に大きく依存している。しかし、成人哺乳動物の動脈酸素分圧は約100mmHgであるのに対し、哺乳動物の胎児では約40mmHgである。このように、低酸素症は相対的な用語であり、酸素の供給または利用のいずれかがうまくいかず、正常な機能が制限される状態と定義するのが最も適切である。
3.1. 低酸素誘導性因子
酸素濃度が低下すると、すべての生きている細胞から信号が送られ、プロリル水酸化酵素ドメイン(PHD)タンパク質と呼ばれる酵素のクラスから始まる[11,12](図2)。通常の酸素濃度下では、これらのPHD酵素には、転写因子である低酸素誘導因子(HIF)のαサブユニット上の特定のプロリンおよびアスパラギン残基を水酸化する酸素感知性水酸化酵素が含まれる。水酸化後、HIF-1αサブユニットは、フォン・ヒッペル-リンダウ・プロテイン(VHLp)としても知られるE3ユビキチンリガーゼの標的となり、HIF-1αのユビキチン化と分解が誘導される。Factor inhibiting HIF (FIH)は、HIFのαサブユニット上のアスパラギン残基を水酸化し、HIF転写因子を不活性化する追加の水酸化酵素である。HIFは、HIF-1α、HIF-2α、またはHIF-3αサブユニットからなるヘテロ二量体であり、HIF-1β、HIF-2β、およびHIF-3βサブユニットとそれぞれ二量体化してHIF-1,HIF-2,およびHIF-3因子を形成する。HIF-1αはすべての細胞種で産生されるが、HIF-2αサブユニットは骨髄系細胞、肝実質、血管内皮、II型肺細胞、腎間質などの特定の細胞で見られる。HIF-1とHIF-2が低酸素に対する転写反応の主導的な調節因子として機能しているのに対し、HIF-3の機能はまだ解明されていない。HIF1A遺伝子は、正常酸素状態では低レベルで構成的に発現しているが、低酸素に応答して有意にアップレギュレートされる[13]。
図2 HIF-1αの細胞内カスケード
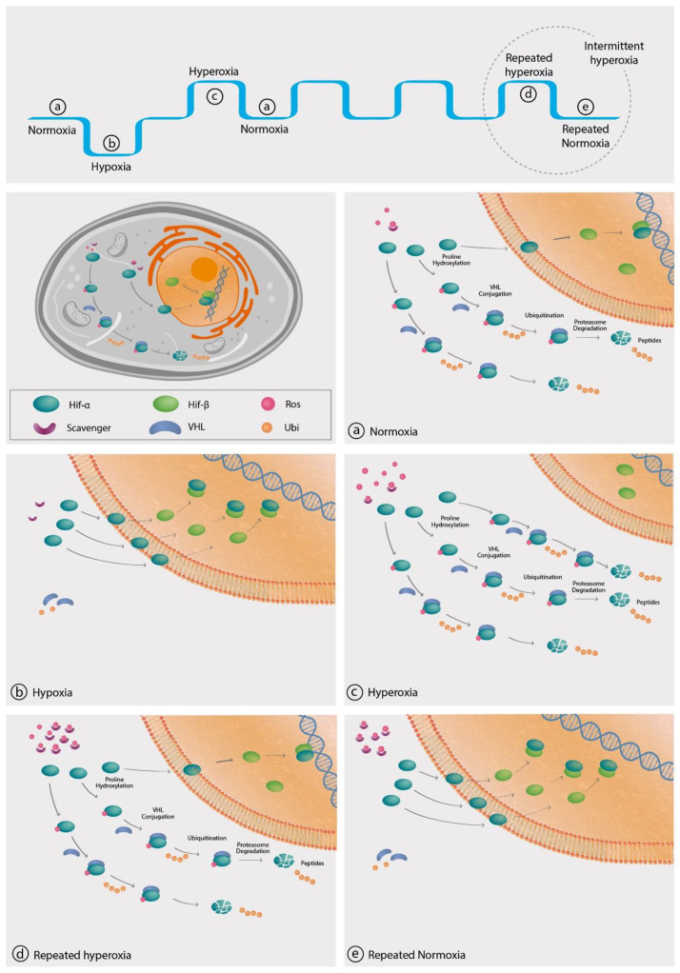
凡例。HIF-1は、細胞質側のHIF-1αサブユニットと核側のHIF-1βサブユニットからなるヘテロ二量体である。(a) 正常な酸素環境下では、活性酸素/スカベンジャーの比率が高く、遊離活性酸素分子がHIF-1αの水酸化を開始し、HIF-1αサブユニットはVHLp(von Hippel-Lindau protein)タンパク質の標的となり、HIF-1αサブユニットのユビキチン化と分解を促進する。(b) 低酸素環境下では、酸素や活性酸素分子が少なく、HIF-1αサブユニットは加水分解されず、より多くのHIF-1αサブユニットが核内に侵入してHIF-1βサブユニットと結合し、活性化したHIF転写因子を生成する。c)高酸素環境では、より多くの活性酸素と酸素が利用できるため、より多くのHIF-1αサブユニットが加水分解され、分解される。(d) 高酸素状態が繰り返されると、その適応反応として、活性酸素の発生量の増加に適応するスカベンジャーの産生が増加する。このようにして、活性酸素/スカベンジャーの比率は、高酸素の反復暴露を開始する前の通常の酸素環境下での比率と徐々に似てくる。e)高酸素暴露を繰り返した後、正常酸素環境に戻ると、スカベンジャーの消去半減期(T1/2)が活性酸素のT1/2よりも有意に長いことから、活性酸素/スカベンジャーの比率は低くなる。そのため、HIF-1αサブユニットの水酸化が少なくなり、より多くのHIF-1αサブユニットが核内に侵入し、HIF-1βと結合して活性型HIFを生成するという、低酸素状態と同様の現象が起こる。
HIF-1は、低酸素状態で安定化すると(水酸化酵素の抑制がない状態)(図2)酸素不足の状態での生存に不可欠な100以上の遺伝子を制御する転写因子として機能する[14]。これらには、酸素に依存しない方法でアデノシン三リン酸(ATP)の合成を可能にする解糖酵素、基礎呼吸数を減少させる酵素、血管内皮成長因子(VEGF)をアップレギュレートして組織灌流を改善する血管新生を誘導する酵素などが含まれる。HIF-1とは異なり、HIF-2は、iNOS(誘導性NO合成酵素)や、エリスロポエチンの産生など、成人の組織酸素化の増加をサポートする他の因子を制御する[15]。HIF-1は、低酸素環境での生存に必要な細胞代謝を調節するだけでなく、哺乳類の主要な再生プロセスをオンまたはオフにすることができる [16,17,18]。制御された哺乳類モデルでは、HIF-1を継続的にダウンレギュレートすると、瘢痕化反応が起こり、組織が失われることが明らかになった[16]。また、HIF-1は、脳や心臓など、酸素への依存度が高い重要な器官機能の再生と維持にも重要な役割を果たしている。マウスを使った研究では、HIFの発現が増加すると神経保護作用があり、再生効果を高めることで、脳卒中や脊髄損傷後の海馬の記憶を強化したり、より優れた神経再生を誘導したりすることが実証されている[17,19,20]。心臓に関しては、HIFの発現増加は、様々な種類の傷害の後に、損傷した心筋を再生し、心機能を改善するのに必要な代謝プロセスを開始する[18,21]。
3.2. 血管内皮細胞成長因子(VEGF)
VEGFファミリーは5つのメンバーから構成されている。VEGFファミリーは,VEGF-A,胎盤成長因子(PGF),VEGF-B,VEGF-C,VEGF-Dの5つのメンバーで構成されている。VEGF-Aは、VEGFファミリーの中で最も知られている因子である。すべてのVEGF因子は、細胞表面に存在するそれぞれのチロシンキナーゼ受容体に結合し、受容体の二量化、リン酸化、活性化を誘導することで、異なる細胞応答を引き起こす[22]。VEGF-Aの産生はHIF-1によって誘導され、HIF-1は血管細胞を活性化して、血管新生(既存の血管から新しい毛細血管が出芽ること)および動脈新生(元の導管動脈の狭窄部位を迂回して、増加した流れを処理するために側副血行路が再構築されること)を開始させる [11,23]。さらに、VEGF-A因子は血管拡張活性を誘導し、組織の虚血を直ちに改善するために必要な微小血管の伝染性を増加させる[11]。また、VEGF-Aは、骨髄由来血管新生細胞(BMDAC)の動員を促し、これが虚血組織に移動して、血管新生や動脈形成に関与する[11]。
3.3. サーチュイン
サーチュインは、代謝調節に関与するシグナル伝達タンパク質のファミリーである。サーチュインの活性には、モノ-アデノシン二リン酸(ADP)-リボシルトランスフェラーゼまたはデアシラーゼが含まれる[24,25]。哺乳類では、7つのサーチュイン(SIRT 1-7)が異なる細胞内コンパートメントで発見されている。SIRT1, SIRT6, SIRT7は核に,SIRT2は細胞質に,SIRT3, SIRT4, SIRT5はミトコンドリアに存在している[24,25].SIRT1は、老化関連疾患に関連するアポトーシス、炎症、老化を制御する様々なメカニズムに関与している[14,26,27,28,29]。核エネルギー状態やニコチンアミドアデニンジヌクレオチド (NAD+) レベルの低下は、SIRT1 活性を低下させ、その結果、pVHL レベルが低下し、HIF-1αが安定化する。逆に、SIRT1 を過剰発現させると、脱アセチル化によりミトコンドリアの生合成が促進され、その結果、HIF-1αが活性化される [30]。老化に伴うSIRT1の減少は、転写および転写後の両方の段階で、ミトコンドリアの生合成を減退させ、老化関連の疾患を引き起こす主要な代謝経路であると考えられている[14]。マウスモデルでは、SIRT1を過剰に発現させると、老化現象が遅延し、寿命が延びるが、SIRT1を阻害すると、寿命が延びなくなる[31]。SIRT1やSIRT6の過剰発現は、がん、2型糖尿病、心血管疾患など、多くのマウス疾患モデルにおいて保護的である[26,28,32,33,34,35]。
酸素応答性と酸化還元応答性のシグナルトランスデューサー間のクロストークは、SIRT1-HIFの相互作用を介して行われる[36,37]。低酸素状態では、ミトコンドリアでの NADH 消費量が減少し、解糖による NADH 生成量が増加するため、NAD+/NADH 比が低下し、SIRT1 の転写が抑制される。SIRT1の低下は、HIF-1αのアセチル化とその活性化を可能にし、低酸素症の間、高レベルのHIF-1活性を維持する正のフィードバックループを提供する。低酸素症における代謝危機のため、HIF-1は、(1)ピルビン酸のアセチル-CoAへの変換を阻害するPDK-1を誘導し、(2)c-Mycの抑制を介してミトコンドリア生合成を阻害し、(3)複製、転写、ミトコンドリア生合成の維持に必要なミトコンドリア転写因子A(TFAM)を減少させることで、ミトコンドリアのエネルギー代謝を阻害する[38,39]。
3.4. ミトコンドリアの生合成
一生の間に十分なミトコンドリア数を維持することは非常に重要である。ミトコンドリアの品質管理は,損傷したミトコンドリアの分解であるマイトファジーの過程と,既存のミトコンドリアの成長と分裂によって新しいミトコンドリアが形成される過程であるミトコンドリア生合成によって,新たに機能するミトコンドリアが生成される過程を経て行われる.ミトコンドリアの生合成は,ほとんどのヒトの細胞の完全性を維持するために重要であり,近年では,脳の機能性の維持や神経変性疾患において重要な役割を果たしているという証拠が増えている[40]。
ミトコンドリアの生合成は複雑なプロセスであり,(1)ミトコンドリアの内膜および外膜の合成,(2)ミトコンドリアにコードされたタンパク質の合成,(3)核にコードされたミトコンドリアタンパク質の合成およびインポート,(4)ミトコンドリアDNA(mtDNA)の複製など,いくつかの異なるプロセスを実行するために,バイゲノム(細胞およびミトコンドリアのDNA)を調整する必要がある。ミトコンドリアの生合成は、いくつかの細胞シグナル伝達経路によって厳密に制御されている。AMP活性化キナーゼ(AMPK)-PGC-1a軸とサーチュイン1(SIRT1)-PGC-1aは、ミトコンドリアの生合成を制御する2つの主要な経路である。AMPKは、運動、飢餓、一過性の低酸素などの生理的な刺激によって活性化される[41,42,43,44]。
AMPKとHIFのシグナル伝達経路は、どちらもエネルギー的なストレスに関与しているため、かなり重複しているが、その関係は複雑で、文脈によって相反する結果になったり、協力的な結果になったりする[45]。前述のように、AMPKはミトコンドリアの生合成を強力に刺激し、正常酸素状態ではATPのホメオスタシスを回復させる作用がある。しかし、上で詳述したように、低酸素状態、すなわちエネルギー的なストレス下でAMPKの活性化が起こると、さらにミトコンドリアの生合成、酸素消費が起こり、酸素の利用可能性がさらに低下し、ストレスが悪化してしまう。したがって、長期にわたる低酸素状態でのHIFシグナルは、一般的にミトコンドリアの生合成と質量を減少させるように作用する[45]。
3.5. 幹細胞
幹細胞(SC)は、未分化または部分的に分化した細胞であり、様々な種類の細胞に分化し、無限に分裂して同じ幹細胞をより多く生み出すことができる。哺乳類では、幹細胞の主なグループとして、血液や免疫細胞を補充する造血幹細胞(HSC)皮膚の上皮を維持する基底細胞、骨、軟骨、筋肉、脂肪細胞を維持する間葉系幹細胞(MSC)などがある。また、成人の脳の限られた領域に留まり、一生を通じて神経細胞を作り続ける神経幹細胞(NSC)など、より対象的なサブグループのSCもある。NSCsは、神経細胞とその支持細胞、オリゴデンドロサイト、アストロサイトを生成することができる[46]。SCは、その分化能力に加えて、抗炎症作用などの多能性を有しており、様々な疾患の治療候補となる可能性がある[47]。
正常な状態では、SCは可逆的な静止状態、すなわち、一時的な細胞周期の停止状態にある[48]。静止状態では、ストレスへの耐性が向上し、生存能力が高まる。酸素は、幹細胞の増殖と分化の制御に重要な役割を果たしている[48,49,50]。短期間の低酸素症は、幹細胞の増殖、移動、分化能力を誘導することができる[48,50]。さらに、低酸素はMSCのパラクライン活性を調節し、VEGFやエクソソームなどの様々な分泌因子のアップレギュレーションを引き起こし、これらの因子は重要な血管新生や抗炎症作用も有している[50,51,52]。低酸素が細胞に効果を発揮するメカニズムは、主にHIF-1と関連するダウンカスケードタンパク質の発現によって制御されている[48,50]。
4. 高酸素低酸素パラドックス
上述したように、低酸素は、HIF、VEGF、サーチュインの上昇を介して、ミトコンドリアの代謝変化、およびSCの増殖、移動を引き起こす自然なトリガーとなる。しかし、細胞レベルでは、酸素レベルの変動が、通常は低酸素で引き起こされる細胞カスケードの引き金となることが理解されたことで、断続的な高酸素を使用することで、低酸素の有害な影響を受けずに組織再生を刺激することができるようになった。これは「高酸素-低酸素パラドックス」と呼ばれている(図3)。
図3 低酸素および断続的な高酸素によって開始される主要な細胞応答カスケード
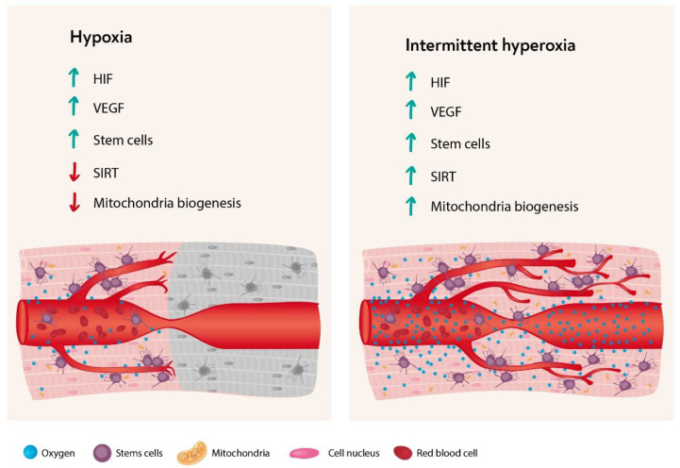
脚注 HIF: 低酸素誘導因子,VEGF:血管内皮増殖因子,SIRT:サーチュイン
臨床現場では、高気圧酸素療法(HBOT)を用いて断続的な高酸素状態を作り出すことができる。HBOTは、100%の酸素を1気圧(ATA)以上の圧力で吸入し、体内組織に溶け込む酸素の量を増加させる。HBOT中の動脈酸素濃度は通常1500mmHgを超え、組織内では200〜400mmHgとなる。健常者の場合、通常の環境(1ATAで20.8%の酸素)では、ヘモグロビンはほぼ完全に飽和している(94~99%)。したがって、高気圧環境下では、溶存酸素にのみ影響があることになる。前述の通り、溶存酸素は毛細血管からミトコンドリアへの拡散勾配を担う割合である。次のパートでは、一過性の高酸素を繰り返した後に誘発される細胞カスケードについてレビューする。
4.1. 低酸素誘導性因子
HIF の発現には、恒常的な低酸素または高酸素ではなく、酸素利用率の相対的な変化がより支配的な影響を及ぼすという仮説が提唱されている [53,54,55]。この仮説によると、細胞は正常酸素から低酸素への変化、または高酸素暴露後の正常酸素への変化を酸素不足と解釈し、HIF-1制御の遺伝子合成を誘導する [53,54,55]。HIF 発現の原因となる細胞カスケードについては理解が進んでいるが(以下に詳述)正確なレベルの吸入酸素とその反復投与の正確な時間枠についてはまだ完全にはわかっていない。
高酸素曝露後に正常酸素状態で HIF の利用可能性が高まるメカニズムとして提案されているのは、グルタチオン合成酵素やスーパーオキシドディスムターゼ(SOD)酵素などの ROS の利用可能性とスカベンジャーに関するものである [53,54,55]。上述したように(図2)酸素およびその活性酸素誘導体がスカベンジャーに比べて高い比率で利用できる正常酸素状態では、HIF-1αサブユニットのほとんどがPHDによって水酸化される。その結果、VHLpによってユビキチン化され、その結果、プロテアソームでHIF-1αが分解されることになる。低酸素状態では、酸素とその活性酸素誘導体の利用が少なく、HIF-1αは水酸化されず、VHLpによってユビキチン化されず、より多くのHIF-1αが核内に入り、HIF-1βと二量化されて活性なHIFプロモーターを形成する。高酸素状態では、利用可能な酸素量が増加すると、活性酸素の産生が促進され、グルタチオンペルオキシダーゼ、SODなどの活性酸素スカベンジャーの産生も促進される[56,57,58,59,60]。上記の累積データに基づき,我々の見解は,このスカベンジャーレベルの上昇は,1回の高酸素曝露後には限定的で緩やかなものであり,有意なスカベンジャー活性を得るためには繰り返し曝露する必要があるというものである(図2)。1回の高酸素曝露から正常酸素状態に戻ると、活性酸素/消去能の比が高くなり、すべてのHIF分子がユビキチン化される。繰り返し高酸素にさらされた後に正常な状態に戻ると、スカベンジャーのレベルが上昇するとともに、その固有の消去半減期(T1/2)が活性酸素のT1/2よりも大幅に長くなる。そのため、低酸素状態と同様に、活性酸素/(消去能)の比率は低くなる。掃気能力が高まると、PHDと結合できる活性酸素が減り、HIF-αサブユニットの分解が減り、その結果、核に入ってHIF-1βと結合し、活性化したHIF遺伝子のプロモーターを生成するようになる。つまり、間欠的な高酸素は、活性酸素/消去能の比率を低下させることで、低酸素を伴わない低酸素模倣状態を生成するのである。
HBOTによる断続的な高酸素の繰り返しがHIFの発現に及ぼす影響は、さまざまな種類の臓器や細胞で実証されている[57,58,61,62]。例えば、HBOTは損傷した脳[58,63]、消化管[57]、肝臓[61,62]において、HIFの発現とそれに関連する再生カスケードを誘導することができる。さらに、HBOTは異なるタイプのHIFの発現を、異なるタイプの幹細胞で誘導する[59,64]。加圧、時間、HBOT照射回数に関連する用量反応曲線とHIF発現との関係はまだ完全には解明されておらず、最適なHBOTプロトコルを見つけるためにはさらなる研究が必要である。HIFが過剰に発現している虚血組織にHBOTを投与すると、組織の低酸素状態が逆転して修正され、それに伴って過剰に発現していたHIFが正常なベースラインに向かって減少することに留意すべきである[65,66,67,68,69,70]。さらに、HBOTが(HIF誘導による)低酸素のためのプレコンディショニング療法として使用されている場合、組織は虚血性傷害に対する耐性が向上し、引き起こされる虚血性傷害が減少し、傷害後の全体的なHIF発現は、同じ傷害に対して予想されるよりも低くなるであろう[71,72]。
4.2. VEGFと血管新生
VEGFの産生はHIF-1によって誘導され、その後、血管新生と動脈形成の両方に必要な細胞プロセスを刺激する(上で詳述したように)。VEGFは、HHPを利用した断続的な高酸素環境下で著しく増加する。HBOTセッションを繰り返すことで、血管新生に不可欠な要素であるVEGFの発現や内皮前駆細胞(EPC)が誘導されることを示す前臨床研究や臨床研究の証拠が増えてきている[61,73,74,75]。虚血状態で誘導されるVEGFとは異なり、高酸素刺激下でのVEGF誘導は、通常の空気を吸いながら低酸素/虚血状態にある組織の血管新生を促進することができる。臨床研究では、毎日HBOTセッションを繰り返すことで、VEGF、EPCの循環レベルが増強され、治癒しない傷の有無にかかわらず、慢性末梢動脈閉塞性疾患患者の虚血部位の血流が改善されることが確認されている[73,74,75,76]。
高酸素刺激を用いて血管新生を誘導することは,ヒトの脳のような通常の状態でも酸素不足に陥る器官にとって極めて重要である[77,78]。したがって、脳の血管新生および再生プロセスを可能にするためには、VEGF誘導に加えて酸素供給量を増加させることが不可欠であり、これは周期的な高酸素暴露によって達成される。HBOTは、脳血管新生を誘導し、損傷した脳領域の脳血流を改善するために、細胞および血管の修復メカニズムを開始することができる [79,80,81]。
4.3. サーチュイン
SIRT1は、ミトコンドリア生合成因子PGC-1αを脱アセチル化する能力により、代謝センサーとして機能している。高酸素時には、クレブスサイクルとミトコンドリア代謝により NAD+/NADH 比が上昇し、SIRT1 が誘発される [82,83]。SIRT1 は FOXO3a を脱アセチル化し、SOD2 と CAT を調節することで抗酸化反応を誘導することが知られている。さらに、FOXO3aはミトコンドリア遺伝子の発現を制御し、その結果、活性酸素レベルが調節されることが示されている [82]。SIRT1は、ミトコンドリア生合成のマスターレギュレーターであるPGC-1αのアセチル化を制御する [83]。SIRT1 は、他のサルトリンとともに、酸化ストレスや活性酸素の生成に対する重要な細胞防御機構に不可欠な要素であると考えられる。
間欠的に高酸素にさらされると、活性酸素分子が生成され、マイトジェン活性化プロテインキナーゼ(MAPK)の活性化を通じて、細胞内のSIRT-1の活性を高めることができる[84]。間欠的な高酸素曝露の効果は,いくつかの動物モデルで評価された。Yanらは、中大脳動脈閉塞による局所脳虚血モデルおよび酸素-グルコース欠乏傷害を受けた初代培養皮質ニューロンにおけるHBOTのSIRT1に対する効果を評価した[84,85]。彼らの発見は、HBOTの神経保護効果がSIRT1のmRNAおよびタンパク質の発現増加によって媒介されることを示している。HBOTの神経保護作用は、SIRT1阻害剤によって弱められ、SIRT1ノックダウンラットでも弱められた[84]。中大脳動脈閉塞後の高血糖ラットで行われた別の研究では、HBOTはATP/NAD、SIRT1およびSIRT2経路の活性化を誘導し、その結果、出血性変化、脳梗塞の減少、および神経機能の改善が見られた[86]。HBOTの神経保護効果がSIRT1によって媒介されることを示す同様の結果が、術後の認知機能障害を持つ中年マウスで実証された[87]。
4.4. ミトコンドリア
遊離溶存酸素が変化すると、拡散勾配が生じ、これが、活性酸素シグナル分子の産生を通じてミトコンドリアに供給され感知される酸素に直接影響を及ぼす。したがって、HBOTによって発生する溶存酸素の断続的な増加は、繰り返し暴露することで累積効果が期待できる「激しいインターバルトレーニング」と比較することができる。よくデザインされたマウスモデル研究では、運動トレーニングに断続的な高気圧曝露を追加すると、酸化能力および解糖能力が促進され、また、筋骨格におけるミトコンドリア生合成に関与するタンパク質の発現が増加することによって、持久力パフォーマンスがさらに向上することが実証された[88]。ヒトでは、運動トレーニングレジメンにHBOTを組み合わせると、運動トレーニングのみの場合と比較して、心肺機能の向上が誘導される[89]。
脳に関しては、活性酸素は重大な代謝作用を有すると考えられており、脳における活性酸素の主な発生源はミトコンドリアである[90]。通常,ミトコンドリアで消費された酸素の1〜2%が,O2-1や,過酸化水素(H2O2)やペルオキシナイトライト(ONOO-)などの関連ROS代謝物に変換される[91]。O2-1および関連する活性酸素の生成は,酸素分圧に比例して増加し,高圧下では暴露時間に比例して増加する。曝露は、てんかん発作の形で示される高い神経活動を誘発する可能性がある[90]。Gutsaevaらの研究では、痙攣前にHBOTを投与すると、海馬で有意なミトコンドリア生合成が誘発されることが実証されている[91]。海馬における細胞反応は、NRF-2遺伝子の発現、TFAM遺伝子の発現、およびミトコンドリア遺伝子の転写の増加によって媒介された[91]。
近年、ニューロンの機能を適切に維持するために、また、細胞間のシグナル伝達として、アストロサイトとニューロンの間でミトコンドリアが移動する可能性とその重要性についての証拠が増えてきている[92,93]。神経細胞は、損傷したミトコンドリアを放出してアストロサイトに転送し、廃棄とリサイクルを行うことができる[92]。また、アストロサイトは、機能的なミトコンドリアを放出して神経細胞に侵入することができる[93]。BorlonganとLippertが行った研究では、HBOTが、回復力のあるミトコンドリアをアストロサイトから炎症の影響を受けやすい神経細胞に移すのを促進できることが実証されている[94]。アストロサイトから神経細胞へのミトコンドリアの移動は、炎症性の傷害に対する神経細胞の回復力を高める。これらの知見は、HBOTによって誘発される内因性の神経保護および神経回復メカニズムに寄与する可能性のある、神経膠のクロストークの新しいミトコンドリア・メカニズムを示唆している。
4.5. 幹細胞
低酸素および間欠的高酸素のいずれも、HIFおよびその下流の遺伝子発現を増加させ、これには幹細胞因子(SCF)も含まれる[95]。前臨床および臨床研究から得られたデータの増加により、HBOTによる断続的な高酸素の繰り返しが、幹細胞の増殖および動員に累積的な影響を与えることが実証されている[59,96,97,98,99,100,101,102,103,104,105,106,107,108,109,110,111,112]。糖尿病性創傷や外傷後脳損傷の患者を対象とした臨床研究では、HBOTセッションを繰り返すことで、臨床的改善と相関して循環(動員)幹細胞が増加することが実証されている[96,97,98]。
幹細胞のサブタイプに関しては、HBOTが神経幹細胞の増殖を促進すること [99,100,101,102,103,104,105]、血管形成幹細胞の成長と分化を刺激すること [59,106]、大腸幹細胞を刺激して粘膜の治癒を誘導すること [107]、間葉系幹細胞の骨形成特性を改善すること [108,109]、筋芽細胞の成長率を高めて筋肉の再生を促進すること [110,111,112]が実証されている。
低酸素ではなく断続的な高酸素によって幹細胞を刺激することの主な利点は、幹細胞の増殖と分化は他の再生プロセスと同様にエネルギーに依存しており、低酸素環境では達成できないということである。幹細胞の再生には酸素が不可欠であるという事実は、HBOTを併用した場合と併用しない場合の幹細胞注入の結果を比較した様々な研究で検証されている。幹細胞の注入に加えてHBOTを使用することの潜在的な付加価値は、脳[113,114]、脊髄および末梢神経[115,116]、心筋[117,118]、糖尿病性創傷[119]など、様々な組織で見られた。これら全ての研究において、幹細胞の注入にHBOTを加えることで、相乗的な有益な効果が得られた。
4.6. 酸素毒性
酸素療法は安全であると考えられているが、他の有効成分や薬剤と同様に、高用量では有害であり、 酸素中毒を引き起こす可能性がある。活性酸素とスカベンジャーのバランスが崩れた状態で高酸素圧に長時間さらされると、膜の脂質過酸化や酵素の阻害および変調につながる可能性があり、最も一般的には中枢神経系(CNS)で見られ、神経細胞の代謝およびそれに関連する電気的活動の変化につながる[120]。1878年に初めて示唆されたように、高気圧酸素を吸うと大発作が起こる可能性がある[121]。酸素毒性に比較的敏感なもう一つの器官は肺である。肺の酸素毒性は、胸の圧迫感、咳、肺機能の可逆的な低下などで示される[122]。
中枢神経系および肺の毒性はいずれも、酸素分圧と曝露時間に依存する[123]。したがって、今日使用されている新しいHBOTプロトコルでは、酸素分圧が2.4 ATAを超えないようにして、60~90分に限定したセッションを毎日繰り返すこと、および20~30分ごとにエアブレーキをかけることが含まれている。このような新しいプロトコルを用いることで、HBOTは安全であると考えられており、肺毒性や酸素毒性は非常にまれである [124,125,126]。62,614回の高気圧セッションの最近の分析では、高気圧セッション中の発作の全体的な発生率は0.011%(1:8,945セッション)であった [124,125]。さらに、慢性肺疾患のない患者では、現在使用されているHBOTプロトコルでは、60回の反復暴露後も肺毒性や肺機能の変化は生じない[126]。
5. まとめ
我々の宇宙の基本的な物理的側面を説明するアルバート・アインシュタインの「相対性理論」のように、相対的にはミクロコスモス、すなわち細胞レベルでの微小環境の解釈にも見出すことができる。図3にまとめたように、低酸素で始まる細胞カスケードのほとんどは、断続的な高酸素でも誘導される、いわゆる「高酸素-低酸素パラドックス」である。HIF、VEGF、SIRT、ミトコンドリア・バイオジェネシス、幹細胞の増殖・移動などはすべて、断続的な高酸素状態を繰り返す特定のプロトコルで細胞を「生物学的に騙す」ことで誘導することができる。正確な用量反応曲線はまだ臨床現場では発見されていないが、ある種のHBOTプロトコルはすでに損傷組織の再生を誘導することが実証されている。