Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC6260222/
要旨
アルツハイマー病は世界的な認知症の原因の第一位であり、学術的にも臨床的にも大きな関心を集めている。しかし、アルツハイマー病を改善する治療法を求めた臨床試験は圧倒的に失敗に終わっている。これは、臨床試験という枠組みに内在する破壊的な変数の影響が原因の一つではないかと考えている。具体的には、食生活、教育、精神的労作、余暇への参加、多言語、睡眠、外傷、身体活動などの日常的な要因や、環境、家族の指導、併用薬、病気などの臨床/研究パラメータが、他の方法では有意な薬物-疾患相互作用の強力な交絡因子、混乱因子、またはバイアスの原因となる可能性があることを観察している。本見解では、これらの隠れ変数が臨床試験の結果に及ぼす潜在的な影響を簡潔にまとめ、その影響を軽減するための戦略を提案する。
キーワード アルツハイマー病、臨床試験、ダイエット、認知予備能、睡眠、身体活動、コーチング、クリニック環境
1. はじめに
アルツハイマー病を対象とした疾患修飾療法を評価する臨床試験は、第I相試験に入った化合物の99%以上が承認に至らず、前例のない失敗に直面している[1]。これは、成功率が20%に近いがんなどの複雑な疾患を含む、同程度の範囲の他のすべての疾患の適応症を上回っている[1]。分析は一般的に、これらの失敗の原因をアルツハイマー病の生来の複雑さとその構成病理学のせいにしている。しかし、独立した多様な治療戦略の繰り返しの挫折は、アルツハイマー病に適用される伝統的な臨床試験デザインの構造に内在する弱点を示唆しているかもしれない。そこで我々は、標準的な臨床試験のパラダイム内での治療効果の認識を曖昧にしてしまう可能性がある、一連の隠れた(目に見えない)変数を提案する。我々はこれらの変数を2つの大まかなクラスに分類した。
(1)食事、知的刺激、身体的労作などの「日常的な」変数
(2)臨床環境、併用疾患、無関係な薬物相互作用、認知検査の変化などの「診療日」の変数。
これらは累積的に、薬剤の有効性、疾患の進行、および/または臨床医に対する疾患の認識を変化させる可能性がある。この視点では、アルツハイマー病の臨床試験の実施に関連するこれらの変数の簡単なレビューを提供し、介入と疾患相互作用の観察を妨げる潜在的な役割を概説する。さらに、将来の臨床試験におけるこれらの影響を軽減するための大まかな戦略を示唆している。(図1)
図1 アルツハイマー病臨床試験における潜在的な隠れ変数のまとめ
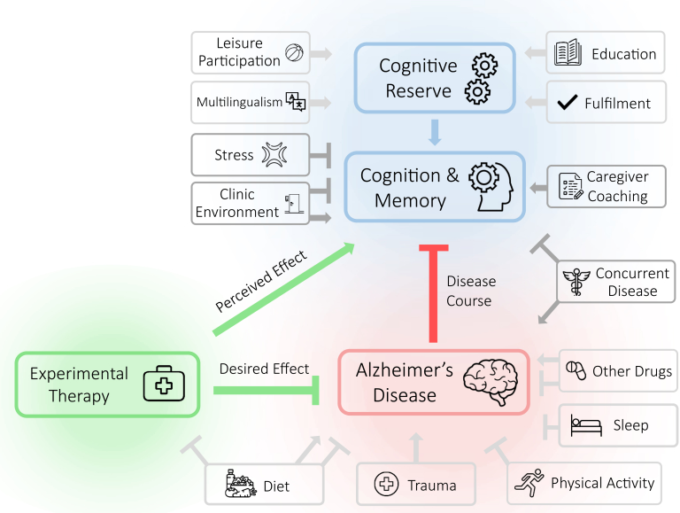
アルツハイマー病と認知・記憶に対する薬物の相互作用は、様々な変数によって調節される可能性がある。実験的治療の有効性は、食事/栄養状態(栄養失調)によって変化する可能性がある。アルツハイマー病の病態や経過は、食事、外傷、身体活動、睡眠だけでなく、併用する薬剤や疾患によっても変化する可能性がある。認知/記憶の知覚は、介護者のコーチング、クリニックの環境、参加者のストレス、認知予備軍によって変化する可能性があり、それ自体は充実感、教育、余暇の参加、および多言語主義によって調節される可能性がある。臨床的な変数は濃い灰色で、日常的な変数は薄い灰色で示されている。増幅効果は先のとがった矢印(←)で示され、阻害効果は平らな矢印(⊢)で示される;増幅効果と阻害効果を持つ変数は両方の記号で示される。
2. 日常生活の変数
研究参加者の日常生活は、当然のことながら異質で似ていない。アルツハイマー病では、食事や精神的な労作などの一見些細な要因が、病気の進行や実験的治療法への反応に大きく影響することがある。研究は通常、これらのパラメータによってもたらされる変動性を緩和するために同じように多様な対照群を含めることに依存しているが、アルツハイマー病に関連する日常生活の変数の数と範囲は、潜在的に対照群の緩和能力を圧倒し、薬物と疾患の相互作用を不明瞭にするほどに十分に大きい。このように、日常生活における隠れ変数の影響を認識し、明らかにする努力は、アルツハイマー病の臨床試験デザインにとって重要であると考えられる。
2.1. 食事療法
広範な栄養学的研究は、アルツハイマー病の病因、症状、および進行を緩和するための食事のための役割を確立している [2], [3]。コレステロールは、アポEリポタンパク質トランスポーターの変異がアルツハイマー病の主要な遺伝的素因として浮上したときに暗示された、これらの関連の最初のうちの一つであった[4]。その後の研究では、コレステロールがβ-アミロイド(アミロイドβ)のオリゴマー化を直接調節する可能性があり[5]、プラークへの凝集に関与するアミロイドβの病原性のミスフォールディングをさらに促進する可能性があることが明らかになった[3], [6]。飽和脂肪およびトランス脂肪も同様に、劇症的なリスクおよびより急速な疾患の進行と関連している。観察研究では、Morrisらは、高脂肪食はアルツハイマー病のリスクを2倍にする可能性があり、トランス脂肪の消費量のわずかな増加でさえアルツハイマー病リスクを有意に上昇させるのに十分であることを実証した[7]。メカニズム研究は、炎症性および酸化ストレスのエスカレートだけでなく、代謝性および血管障害のリスクを増加させるために、これらの脂肪をリンクしているも独立してアルツハイマー病 [2], [3]と関連付けられている。
逆に、オメガ3多価不飽和脂肪酸は、おそらくその抗炎症作用と神経保護効果のために、アルツハイマー病リスクを低下させ、症状を遅らせることと関連している[8]。一般的に、抗炎症作用を有する栄養素(ビタミンB、C、Eなど)の摂取は、アルツハイマー病のリスクを低下させ、発症後の認知力を維持する [2]。これらの栄養素を豊富に含む食事パターン(最もよく研究されているのは地中海式食事である)もまた、リスクプロファイルの低下および予後の改善と関連している[9]。単離された栄養素の介入試験では、ほとんど意味のない結果が得られているが、アルツハイマー病における食事の調節的役割は明らかである。
さらに、いくつかの薬物モデルは、食事が治療用化合物の吸収と代謝に影響を与える可能性があることを実証している[10]。Walter-SackとKlotzによって議論されているいくつかの研究は、特定の食事パターンは、生物変換プロセスを弱めることによって、または排泄とクリアランスを上昇させることによって、薬剤の有効性を減少させる可能性があることを確認している[10]。タンパク質を多く含む肉やアブラナ科の野菜などの食品もまた、治療用化合物の機能レベルとの関連性を示している[11]、[12]。このことは、アルツハイマー病リスクや経過に影響を与え、治療薬の生物活性と同様に、臨床試験における食事の両側的な役割を示唆している。
2.1.1. 食事のコントロール
神経学の試験では日常的には考慮されていないが、食事を考慮する戦略は他の分野でも十分に確立されている。これらの戦略には、受動的な推奨から、自己または介護者の報告、食事および食物摂取量の厳密な管理まで、多岐にわたる。当然のことながら、食事に介入すると、参加者や介護者の負担だけでなく、研究コストも劇的に上昇する。施設化された集団(長期療養施設など)で行われている研究は、他の環境変数の中で食事を標準化するのに適しているかもしれないが、研究結果や結論の一般化が制限される可能性がある。したがって、ほとんどの場合、観察的アプローチが優先されるかもしれない。ここでも、研究にはいくつかの選択肢があり、侵襲的ではあるが厳格なものから受動的ではあるがより誤差が生じやすいものまである。明白な戦略は、介護者または研究者による食物摂取量の追跡を行い、研究分析の際に参加者間の食生活の嗜好の有意な相違を説明することである(セクション2.5)。このような取り組みにより、例えば、高脂肪食や低食物摂取が観察された転帰と関連しているかどうかを明らかにすることができる。あるいは、研究では、生理学的濃度を測定し(血液検査または尿検査を介して分析中にそれらを転帰と相関させることによって、すでにアルツハイマー病と関連している特定の栄養素(コレステロール、脂肪、ビタミンなど)の影響を調べることができる。栄養素レベルの劇的な変化が観察された場合、薬効や疾患経過を混乱させる可能性があるため、患者の除外/除外や他の解析を行うことが推奨される。ペアマッチデザインを用いた試験では、症例と対照のマッチング基準にベースラインの食事嗜好を組み込むことも交絡や混乱を緩和するのに役立つかもしれないが、これらのベースラインの嗜好は疾患の進行に伴って変化する可能性があり、関連性がないことが判明する可能性があることに注意が必要である。
2.2. 認知的予備能と充実感
認知予備能(CR)という概念は、神経疾患と認知、機能、記憶などのパラメータに現れる神経疾患との間に弱い関係があることを説明するために考案された [13]。CRは、基礎となる脳疾患と臨床症状の出現との間の多因子緩衝材として、あるいは損傷に対処し、損傷を克服するための脳の能力として抽象的に定義することができる[14]。当初は、大脳実質の大きさだけがCRを定義すると考えられていた;しかしながら、概念はそれ以来、神経新生、神経可塑性、および神経栄養因子の調節を含む様々な神経過程を包含するように発展してきた[14]。アルツハイマー病では、CRは発症後の疾患リスクおよび認知機能低下との強固な関連性を示している[14]。病態と症状の間の直接的なメディエーターとして、CRは臨床試験との関連性が高いかもしれない。
2.2.1. 認知予備能のコントロール
臨床パラメータとしてのCRの定量化は困難である。研究では、神経心理学的パフォーマンスと関連するCRの複数の尺度が開発され、それが裏付けられている [15]。理論的には、CR(ベースラインまたはCRの変化)は、食事療法と同様に、患者の選択とマッチング、またはその後の解析に使用することができる。しかし、予備群の生物学的メカニズムを明確に理解していなければ、この方法を臨床試験に直接適用することは議論の的になるであろう。
別のアプローチとして、教育、職業、余暇活動への参加など、CRの既知の寄与因子を考慮に入れることが考えられる。1994年のコホート研究において、Sternらは、低学歴(8年未満の正式な教育を受けていない)と生涯の職業的達成度の低さが、それぞれ2倍になる可能性があることを指摘している [16]。これは、糖尿病や他の様々な伝統的な危険因子のために広く報告されている相対リスクを上回っていることは注目に値する。余暇活動への参加も同様にアルツハイマー病リスクに対する保護効果と関連している。正確な影響は頻度や活動の種類に依存するが、高い余暇活動への参加はアルツハイマー病リスクの38%の減少を提供する可能性があると推定されている報告がある[14]。多言語主義はまた、神経保護的な実行回路の発達を強制することによって、潜在的にCRとアルツハイマー病に類似した関連を共有している可能性がある。Bialystokらは、生涯にわたるバイリンガルであることが認知症の症状を平均4年遅らせることを観察した[17]。CRの他のパラメータと同様に、この予後の変化は、薬物と疾患の相互作用(症状や予後を変化させることも目的としている)の影響を直接的に曖昧にしてしまう可能性があるため、臨床試験に影響を及ぼす可能性がある。
臨床試験デザインの中で教育、生活充実度、言語状態を説明するための戦略は複数考えられる。十分なパワーのある研究では、各変数をベースラインの参加者の特徴として独立して、バイナリまたはカテゴリカルなシステムとして検討し、データモデルに使用することができる。あるいは、日常生活、職業、社会活動を含むさまざまな領域への参加を定量化するCognitive Reserve Scaleのような検査を、CRを全体的に代理して説明するために使用することもできる [13]。これらのテストのスコアは、患者のマッチングや選択、またはデータ分析に再び使用することができる。
2.3. 身体活動と外傷
疾患における身体活動の役割は十分に文書化されており、座りっぱなしの生活スタイルは様々な疾患状態に暗示されている。アルツハイマー病の文脈では、老年期に身体活動を継続すると全体のリスクが40%減少する可能性があるというデータが示唆されている [18]。発症後、定期的な運動は脳の容積を維持し、アミロイドβレベルの低下を助け、認知機能の低下を軽減または救済する可能性がある [18], [19]。これらの多面的な相互作用はアルツハイマー病に対する運動の関連性を強調している;さらに、認知、アミロイドβレベル、および脳容積はしばしば臨床試験の主要な結果の一つとなるため、薬物と疾患の相互作用を不明瞭にする可能性があることは明らかである。
2.3.1. 身体活動のコントロール
心拍数、運動、および労作を連続的に追跡するウェアラブル・フィットネス・モニターの台頭は、日常生活における身体活動を把握するための実用的な戦略を提供している。Sylviaらは、同様の戦略を検討し、低侵襲モニターからエネルギー消費の直接測定に至るまでの技術を報告しており、研究参加者の全体的な身体活動を説明するための観察データを提供する可能性があるとしている[20]。標準化された運動レジメンを処方することも検討されているが、認知症が進行している患者のアドヒアランスや介護者の負担を考慮すると、介入的アプローチではなく観察的アプローチが好ましい。
2.3.2. 外傷のコントロール
さらに重要な(無視されることが多いが)身体的変数として、外傷への曝露がある。Tg2576マウスモデルでは、繰り返しの脳損傷は、神経原線維のもつれ、脳萎縮、認知障害の有意な増加と直接関連していた[21]。他の研究では、外傷がアミロイドβ凝集および脳炎症と関連しており、これがアルツハイマー病のリスク上昇に直結することが実証されている[22]。したがって、我々は、標準的な臨床検査の過程で外傷経験の証拠がないかどうか、患者を検査および/または問診する研究を提案する。外傷の重大なエピソードは、特に試験期間の近くまたは期間中に、アルツハイマー病の経過を混乱させる可能性があり、したがって、患者の除外と除外の評価において考慮されるべきである。
2.4. 睡眠
睡眠障害は認知症患者の間でパンデミックしており、睡眠病理の大きさはしばしば疾患の進行と並行している[23]。Manderらは、アミロイドβの上昇が非遅発性眼球運動睡眠の断片化につながる可能性があることを指摘しており、この関連性は最近になって明らかになってきた[24]。さらに、Manderらは、非遅発性眼球運動睡眠の欠如もアミロイドβ凝集の上昇につながることを発見した[23], [24]。研究ではさらに、睡眠が低下するとアミロイドβのクリアランスが低下する可能性があることが観察されている[25]。このことは、自己増幅的なフィードバック機構の可能性を示唆しており、それによって睡眠不足はアミロイドβの増加につながり、その結果、有効な睡眠が減少する可能性がある。研究参加者の日常生活に見られる他の隠れ変数と同様に、睡眠習慣の変化は、このようにして薬物と疾患の相互作用の観察を混乱させる可能性がある。
2.4.1. 睡眠のコントロール
アミロイドβレベルの表向きのメディエーターとして、睡眠時間と睡眠の質を定量化して説明する努力が、特に脳のアミロイドβを減少させることを目的とした薬剤の試験において考慮されるべきである。既存の十分に裏付けされた戦略には、ピッツバーグ睡眠品質指数(Pittsburg Sleep Quality Index)のようなレトロスペクティブな質問紙や、夜間の動きを測定して睡眠時間と睡眠の質を代理する直接的なアクチグラフ(運動量)測定などがある[26]。多くの市販のフィットネスモニターも夜間の動きを追跡して睡眠パターンを定量化することができる。睡眠補助剤、鎮静剤、または抗不眠薬の使用については、睡眠の人工的な変調によって結果にバイアスがかかる可能性があるため、研究ではさらに標準化したり、考慮したりするべきである。
2.5. 交絡因子の統計的評価
統計的方法論の詳細なレビューはこの観点の範囲を超えているが、研究分析中の交絡変数の潜在的な影響を考慮するためのいくつかの広範なアプローチ、すなわち層別化と多変量データモデリングが存在する。層別化は単純で、しばしば効果的な統計的戦略であり、結果指標(典型的にはアルツハイマー病症状の発症/重症度)の強さを、ある交絡変数が一定である研究集団のサブグループで評価するものである。その後、結果は、効果の強さと交絡因子の影響力の両方を測定するために、様々な推定量を用いて調整することができる。しかし、層別化は、与えられた曝露および/またはコホートの有効サンプルサイズを劇的に減少させ、その結果、研究力を著しく損なうことがある。多変量モデルはより複雑な解決策であり、結果に対する複数の関連性の影響を調べるために線形回帰またはロジスティック回帰に依存する。しかし、これらのモデルは大規模なサンプルがないと効果がないことが多い。さらに、不適切な仮定は結果を大きく変える可能性があるため、熟練した生物統計学的分析が必要である。
交絡因子の影響を減らすために、ペアマッチドケースコントロール研究の採用などの他の戦略も使用できる。しかし、マッチドスタディーの枠組みを採用することは、患者の募集と研究デザインを複雑にする可能性がある。さらに、不適切なマッチングは交絡因子の影響を劇的に増大させ、特にマッチングが不合理に近い集団または少数の集団から選択された場合には、バイアスを導入する可能性がある。一般的に、研究解析における交絡因子の影響を否定する理想的な戦略は存在しない。しかし、これは試験から交絡因子を考慮することを無視すべきではなく、交絡因子の影響を評価するために関連するデータの収集を妨げるべきではない。
3. 診療日の変数
従来の臨床試験のパラダイムの下では、治療の有効性は、定期的な臨床評価を伴う長期の追跡調査の間隔にわたって決定される。アルツハイマー病では、この標準的なアプローチにはいくつかの限界がある。第一に、アルツハイマー病の症状は日によって非常に変化し、患者は良い日と悪い日をランダムに経験することが知られている。そのため、単独での診察はアルツハイマー病の日々の変動の影響を受け、患者の真の能力を把握することができないことがある。さらに、診療所の訪問は、患者の典型的なルーチンやスケジュールから大きく逸脱している。移動、慣れていない設定、および慣れていない担当者は、患者の精神状態を乱す可能性があり、その結果、認知的転帰の測定値を人為的に変化させることになる。このようにして、アルツハイマー病試験は、観察しようとしている現象を観察しようとする試みそのものによって、観察者効果を誘発する危険性がある。このセクションでは、患者の認知パラメータをさらに逸脱させ、その結果、観察を不注意に混乱させる可能性のある臨床研究の側面を要約する。
3.1. 認知と記憶の検査中の変数
アルツハイマー病の研究における大きな課題は、認知や記憶のような要約現象を確実に定量化することである。Mini-Mental State ExaminationやMontreal Cognitive Assessmentなどの広範囲に検証されたツールを使用することである程度の一貫性が確立されているが、これらのテストでの患者のパフォーマンスは様々な要因によって劇的に影響を受ける可能性がある。Bechtelらは、慣れない環境で認知力の測定を行うだけで、知覚されたパフォーマンスを著しく低下させるのに十分であることを実証した [27]。他の研究では、被験者がストレスを感じていたり、落ち込んでいたり、疲労していたり、睡眠が不足していたりすると、認知、記憶、注意力が同様に低下することが指摘されている [28], [29], [30], [31]。また、周囲の照明[32]や背景雑音[33]など、一見些細な外部要因が認知レベルの知覚を媒介する上で重要な役割を果たしている可能性があることもデータから示唆されている。したがって、研究者は、研究環境/投与を標準化し、参加者を苦しめる可能性のある要因を最小限に抑えるように努力すべきである。理想的には、試験は可能であれば患者の自宅で、慣れ親しんだスタッフと一緒に実施されるべきである。患者はまた、認知の測定を複雑にする可能性のある異常なうつ病や疲労などの気分障害や精神障害を併発していないかどうかをスクリーニングすべきである。
研究では、被験者のコーチングや過度な準備の証拠にも注意を払うべきである。我々のグループは以前に、40%以上の介護者が診療所に到着する前に認知測定の内容をリハーサルすることを認め、17%の参加者が準備の明確な証拠を示したことを指摘した[34]。介護者と患者はパフォーマンスを最適化することに既得権益を持っており、それは回復の知覚とやりがいに貢献している。しかし、単に日付を覚えたり、立方体を描く練習をしたりするだけでは、認知スコアが有意に上昇し、転帰尺度が歪むことがある。さらに注目すべきは、臨床試験に参加する患者や介護者は、ほとんどの標準的な認知検査に精通している傾向があるということである。一般的な認知検査を継続して使用する試験では、標準的な問題の体系的なバリエーションを使用するか、被験者のコーチングを妨げるような手順を導入することを提案している。
これらのテストの妥当性は、提供されたタスクが完了した能力を定量化するために主観的な評価に大きく依存しているという事実によって、さらに悪化する可能性がある。これは本質的に、評価者が訓練され、モニタリングされている厳しさに応じて、ばらつきや偏りが生じる危険性がある。先行研究では、臨床試験の評価者の50%以上が、評価の規定プロトコルを完全に遵守していない可能性があり、これが相互作用の観察された有意性を低下させる可能性があることが示されている[35]。まだ、コーチング、臨床バイアス、および一貫性のないテストの影響は、アルツハイマー病試験では決定的に確立されていないが、新たな傾向は今後の研究デザインで考慮することを保証するものである。
3.2. 併発する病気
複雑な障害、特にアルツハイマー病のような加齢に伴う疾患は、多くの場合、他の付随する身体的制限や病気を伴う。高次感覚機能の喪失は、アルツハイマー病の進行性神経変性の1つの確立された合併症であり、視覚 [36] および聴覚 [37] の障害はアルツハイマー病で高い有病率で発生している。Koronyo-Hamaouiらは最近、複数のADマウスモデルの目やアルツハイマー病患者の死後の剖検でアミロイドβの蓄積を観察し、タンパク質のミスフォールディングがこの低下の直接的な原因である可能性を明らかにした[36], [38]。小俣らは、蝸牛毛細胞にアミロイドβを発現させたトランスジェニックマウスモデルで有意な聴覚障害を観察することで、聴覚系も同様に影響を受けやすいことを実証した[39]。聴覚と視覚は認知の評価に必要なものであり、聴覚または視覚刺激に対する反応に直接依存している。したがって、感覚の障害は認知機能の低下を装い、潜在的に観察を混乱させる可能性がある。研究では、より高度な認知測定に進む前に、対象者の視覚と聴覚の能力を定量化することで、この問題を克服することができるかもしれない。
栄養不良、嚥下障害、およびそれらに関連する障害は、アルツハイマー病患者が直面している追加の合併症である。Tombiniらは、アルツハイマー病患者の95%が栄養失調の可能性があるか、またはそのリスクがあり、これが認知力の低下と相関する可能性があることを提案している[40]。他の研究では、消化器症状の広範で時折矛盾する配列が同定されているが、栄養不良は一貫してアルツハイマー病症状の悪化と死亡率に関連している[41]。薬物試験の文脈では、しばしば見落とされる要因は、患者が栄養失調である場合、薬物の有効性が損なわれる可能性があるということである[10]。明確なメカニズムは明らかにされていないが、必須栄養素の慢性的な欠乏は、必要な薬物活性化または形質転換反応を阻害する可能性がある[10]。これは、抗マラリア薬の研究で、重度の栄養失調の場合には治療効果が半減したことが観察されているように、薬の効果を大幅に弱める可能性がある[42]。このモデルはアルツハイマー病との関連性はほとんどないが、栄養失調と薬効との潜在的な関連性は憂慮すべきものである。
3.2.1. 併存疾患の考慮
大まかに言えば、アルツハイマー病患者は多くの場合、複数の併存疾患に直面している。ほとんどの患者の高齢化だけでは、血管疾患から癌に至るまでの様々な他の障害に罹患しやすくなる。グルコース/インスリン調節障害、糖尿病、高血圧、脂質異常症を含むアルツハイマー病の危険因子(アルツハイマー病コホートの間で高い有病率を示している)は、アルツハイマー病患者を非常に特異的な疾患プロファイルへとさらに多様化させている[2], [43]。血管障害に関連した合併症が一般的にアルツハイマー病症状を悪化させることが報告されているが、これらの併発疾患の多くがアルツハイマー病の進行にどのような役割を果たしているかはまだ明らかではない[43]。臨床試験の文脈では、実験的治療が障害を合併している患者においてどのように反応するか、また主要な転帰指標が併発疾患によってどの程度影響を受けるかはさらに不明である。これらの併存疾患の影響に関する決定的な研究が行われるまでは、複数の主要疾患の適応を除外基準として定義することが望まれる。研究では、統計的モデルを用いて併用障害の存在を考慮することも考えられるが、アルツハイマー病コホートにおける併用障害の多様性と有病率は課題となるであろう。
3.3. 併用薬
薬剤間の相互作用は、臨床試験におけるもう一つの干渉の原因となりうる。プロトンポンプ阻害薬のランソプラゾールがよく知られている例である。ランソプラゾールは胃炎の治療薬として、神経変性のメディエーターとしてはあまり懸念されていなかったが、複数の報告ではアミロイドβ産生を増強する可能性が示唆されている。しかし、ランソプラゾールはアミロイドβ産生を増強する可能性があり、プロトンポンプ療法を継続して受けている患者は認知症のリスクが高いことが複数の報告で示唆されている[44], [45]。この主張は矛盾に直面しているが、アミロイドβ産生を悪化させる可能性があることは、新規化合物の利点を打ち消す可能性がある。
あるいは、いくつかの無関係な薬剤は、アルツハイマー病の病態と闘うために働くかもしれない。例えば、肺高血圧の治療に使用されるホスホジエステラーゼ-5阻害薬(シルデナフィル、バルデナフィル、タダラフィルを含む)は、アミロイド前駆体タンパク質切断酵素の発現を減少させ、アミロイドβレベルの持続的な減少に導く能力を実証している[46]。ヒトアミロイド前駆体タンパク質とプレセニリン-1を発現するトランスジェニックマウスモデルでは、ホスホジエステラーゼ-5阻害剤は、アルツハイマー病の病態を緩和することに加えて、記憶障害を半減させ、さらには回復させた[47]。他の研究では、アンジオテンシン-1受容体拮抗薬、アンジオテンシン変換酵素阻害薬、利尿薬を含む降圧剤は、アルツハイマー病のリスク低下と関連していた[48]。薬物相互作用の包括的なカタログは、再びこの観点の範囲を超えている;しかしながら、これらの例示的な相互作用は、無関係な薬物がアルツハイマー病の病態と相互作用し、それによって新しい薬物/疾患効果の観察を混乱させる可能性を強調している。
3.3.1. 併用薬の会計処理
併用薬の会計処理は、典型的な治験では重要な課題となる。併用薬の程度と影響力を明確に把握しなければ、交絡変数を管理するための典型的な戦略は有用性が限られている。主要な併用疾患と同様に、アルツハイマー病の適応や相互作用が知られている薬物レジメンを持つ患者を除外することが、関連性のない薬物のアルツハイマー病への影響についての更なる研究が待たれる中で、最も実行可能な戦略である可能性が高い。
3.4. アルツハイマー病の異質性
アルツハイマー病は伝統的に患者がアルツハイマー病を持っているか、持っていないかのどちらかとして分類される同質の障害として概念化されている。しかし、アルツハイマー病の共通の特徴や症状は、多様な起源を隠しているかもしれない;実際に、アルツハイマー病は疾患というよりも症候群であり、異なる疾患の集合体である可能性がある。これらの違いの中で最も明らかなのは、遺伝的負荷の影響を考慮した場合に生じる。前者では、アルツハイマー病は積極的な神経変性を特徴とし、より早い死亡率に至る。遅発型アルツハイマー病は、より一般的であり、機能の典型的な、ゆっくりとした進行性の低下に関連付けられている。他のアルツハイマー病のサブタイプはアルツハイマー病の病態の分布に基づいて示唆されている;これらには大脳辺縁系優位と海馬寛解が含まれる [49]。異なるアルツハイマー病の形態は特徴的な予後と病因を示しており、一方に対して有効な治療は他方に対しては効果がないことが考えられる。アルツハイマー病患者を同種のコホートにプールする試験は、そのため特定の薬物-疾患効果を識別する能力を損なう可能性がある。Ferreiraらが示唆したように、おそらく磁気共鳴画像法によって、アルツハイマー病の臨床的サブタイプを認識し、コホートを類似のサブタイプに層別化または一致させる努力をすべきである[49]。
脳機能の全体的な低下を引き起こす障害として、アルツハイマー病はまた、他の神経病理を覆い隠す能力を持っている。したがって、一部のアルツハイマー病症例は混合型認知症に分類され、アルツハイマー病の病態が血管障害やレビー小体型の蓄積などの他の病態と一致している。研究は限られており、診断基準についてはまだ議論の余地があるが、純粋なアルツハイマー病と混合型アルツハイマー病では認知の違いが有意である可能性がある [50]。他の病態とアルツハイマー病との相互作用がさらに解明されるまでは、混合型認知症の治療法や合併症のさらなる研究が優先されるべきであるが、混合型認知症の証拠はアルツハイマー病治療の臨床試験の除外基準となることを示唆している。
4. 結論
アルツハイマー病に対する有望な治療法の繰り返しの失敗は、新しい治療法の探索が不十分であるか、または有意な有効性を検出するための臨床試験の失敗を示唆している。この観点から、臨床試験における相関関係の観察を妨げたり、薬物と疾患の相互作用を混乱させたりする様々な隠れ変数の存在についての証拠を概説してきた。これらには、食事、教育、職業的充実感、余暇への参加、多言語、外傷、睡眠、認知検査、コーチング、臨床におけるストレス要因、併存疾患、薬物相互作用、およびアルツハイマー病の基本的な異質性が含まれる。これらの変数はいずれもアルツハイマー病試験の結果を変化させることに決定的に関与していないが、それらの累積的な影響は薬効の測定と知覚を変化させるのに十分であるかもしれない。したがって、今後のアルツハイマー病治療薬の臨床評価においては、これらの変数の潜在的な影響を事前に考慮し、解析の際には試験デザインに十分な配慮をすることを提案する。提案された変数を厳密に考慮することは、臨床試験のコストを劇的に増加させるだけでなく、患者や介護者に負担を強いる可能性があり、そのすべてが試験の結果に影響を与えたという決定的な証拠がなく、時期尚早になる可能性がある。我々はさらに、提起されたすべての変数を考慮することは現実的ではないかもしれないことを認識している。しかし、参加者のガイドラインの策定、試験の分析、あるいは試験自体の構成において、これらの変数の役割を何らかの形で考慮することは、これまでアルツハイマー病試験で観察されてきた不十分さの一部に対処し始めることになるかもしれない。
文脈の中の研究
1) システマティックレビュー。アルツハイマー病を対象とした臨床試験は、主要な研究分野としては前例のない失敗に直面している。ここでは、有意な薬物-疾患関係の観察を妨げる可能性のある交絡因子や混乱変数をレビューする。
2) 解釈。食事、認知予備能(およびそれに関連する構成要素睡眠、身体活動などの日常的な変数、および家族のコーチング、クリニックの環境、併用薬や病気などの臨床的な変数が、もし考慮されていなければ、潜在的な交絡因子や混乱因子として作用する可能性がある。
3) 今後の方向性。より高いコストと研究負担にもかかわらず、今後の研究では、これらの変数(概説されているように)を研究デザインに反映させることを検討すべきである。
