Contents
The dark side of the spoon – glucose, ketones and COVID-19: a possible role for ketogenic diet?
www.ncbi.nlm.nih.gov/pmc/articles/PMC7677746/
要旨
新型コロナウイルス病(COVID-19)は、健康状態や命の損失に多大な影響を与え、世界中の医療システムに深刻な課題を投げかけている。特に、肥満とそれに関連する合併症は、COVID-19病の臨床転帰の悪化と密接に関連している。
最近では、特に関連する代謝性合併症を伴う重度の肥満の文脈で、ケトジェニック・ダイエット(KD)の臨床的使用に関心が高まっている。KDは、脂肪質量の急速な減少、除脂肪質量を維持し、十分な栄養状態を提供するために有効であることが証明されている。
特に、ケトン体の血漿レベルの生理的増加は、重要な抗炎症作用および免疫調節作用を発揮し、これは、COVID-19疾患の感染および潜在的な有害転帰を予防するための貴重なツールとして明らかになる可能性がある。ここでは、ケトン体の炎症、免疫、代謝プロファイルおよび心血管機能に対する既知の効果に基づいて、肥満、2型糖尿病および高血圧などのCOVID-19のいくつかの重要な危険因子を迅速に減少させるためのKDの重要性について議論する。
我々は、SARS-CoV-2感染の将来の波を考慮して、すべての修飾可能な危険因子、特に代謝性合併症を伴う肥満を迅速に減少させることが、公衆衛生政策と介入の柱となるべきであると確信している。
キーワード
SARS-CoV-2,VLCKD、肥満、糖尿病、高血糖、炎症、代謝リハビリテーション
序論
世界保健機関(WHO)のデータによると、季節性インフルエンザは約300万~500万人の重症患者、29万~65万人の呼吸器感染症による死亡、9万9000~20万人の下気道感染症による死亡を引き起こしているとされている[1]。一般的に、急性呼吸器感染症は世界中で罹患率の主要な原因の一つであり、より具体的には下気道感染症は感染症死因の第一位であり、全体では死因の第五位となっている。
インフルエンザワクチン接種の効果が相対的に低いことを考慮して、呼吸器ウイルスの蔓延を制限するために、保健当局によって公衆衛生慣行が実施されてきた。一般的に提案されている公衆衛生実践は、手洗い、フェイスマスクと目の保護具の使用、社会的距離などの人々の行動に関連しており、今のところワクチン[2]も有効な薬理学的治療法もないウイルス(SARS-CoV-2)によって引き起こされるコロナウイルス2019病(COVID-19)のパンデミック拡散の間に奨励されていた。
COVID-19の危険因子:生活行動の役割
現在の死亡率は2.3%であるにもかかわらず、短期間に大量の感染者が発生したことで、各国の医療システムに大きな問題が生じ、多大な犠牲者を出している。SARS-CoV-2の危険因子のうち、COVID-19の致死率は、多くの研究により、年齢が高いこと[3]や、糖尿病、高血圧、肥満、慢性腎臓病などの併存疾患の存在と特異的に関連していることが明らかにされている[4]。これらの疾患のいくつかは生活習慣と関連しているため、患者の転帰を改善し、将来の新たな感染症発生の可能性による健康への影響を軽減するためには、前述の危険因子に対処することが必須である[5]。
また、最近のロックダウン対策では、鎮静化の増加が一般的な健康状態に悪影響を与えていることも指摘しておくべきであろう。COVID-19パンデミック時に数カ国で施行されたシェルターインプレイス政策による鎮静化は骨格筋の代謝に悪影響を及ぼし、インスリン抵抗性、脂肪沈着、低悪性度の全身性炎症を誘発し、代謝パラメータ、グルコースコントロール、炎症状態を全体的に悪化させた。この点、過剰な脂肪率と低筋肉量の共存によって特徴づけられるサルコペニック型肥満は、心血管リスク、インスリン抵抗性、低悪性度炎症の増加と強く関連している;したがって、栄養状態の不備とともに、ウイルス感染症への感受性の増加に関連した状態を表している[6]。重要なことに、肥満および栄養不良を有する重症COVID-19患者は、栄養不良のない肥満患者よりも悪い転帰を示した[7]。
ロックダウン中、世界の人口の大部分のライフスタイルと食習慣は劇的に変化した。最も重要な栄養アドバイスは、ジャンクフードの消費を減らし、免疫系に積極的に影響を与える可能性のある抗酸化作用と抗炎症作用を持つ食品を好むことであった[8, 9]。脂肪と炭水化物が豊富な不健康な栄養習慣は、肥満と睡眠障害と関連していることが知られている。重要なことに、睡眠の質の著しい低下とそれに伴う体重指数の上昇が検疫中に記述されている[10]。さらに、検疫中の身体活動量の減少は、人口の一般的な健康に大きな影響を与えている[6, 11, 12]。したがって、肥満や血糖コントロール不良の患者の数が増えると、SARS-Cov2感染の新たな波にさらされるという現実的なリスクがある。
肥満と高血糖症:COVID-19ステージの2つの悪役
肥満は、集中治療を必要とし、SARS-CoV-2感染中の死亡リスクが高いことが認識されている予後因子の一つである[13]。これに伴い、重度のCOVID-19疾患の若年化への重要なシフトは、肥満によって明確に記録されている[14]。肥満はいくつかの重要な機能に影響を与え、COVID-19の有害な転帰に対する脆弱性の増大を特徴づけている[15]。肥満状態は、横隔膜エクスカーションを乱すことによって換気を制限し、ウイルス感染に対する免疫応答を変化させ[16]、慢性的な低悪性度の炎症を決定し、心血管機能に悪影響を及ぼすグルコース耐性と酸化ストレスを悪化させる[17]。重要なことに、肥満は凝固の亢進と線溶の欠損を伴う止血バランスの変化を特徴とし、その結果、血栓症が発生しやすい状態になるため、肥満患者はより重篤なCOVID-19症候群を経験する[18]。さらに、肥満と代謝性脂肪肝疾患(MAFLD)の共存は、年齢、性別、喫煙、糖尿病、高血圧、脂質異常症とは無関係に、COVID-19の重篤な転帰のリスクが~6倍に増加することを決定する[19]。
特に、最近の報告では、脂肪組織がACE2の転写産物を非常に高いレベルで発現していることが示されている[20]。この酵素は肺炎球の外表面に付着しており、コロナウイルスが細胞に侵入して感染する際に使用される。
COVID-19の世界的なパンデミックはまた、2型糖尿病(2型糖尿病)などの一般的な代謝性疾患の治療にも重要な意味を持つ。なぜなら、2つのコロナウイルス受容体タンパク質、ジペプチジルペプチダーゼ-4(DPP4)およびアンジオテンシン変換酵素2(ACE2)は、心血管生理学、炎症および腎活動の調節に関与する他の経路とともに、グルコースの恒常性を制御する代謝シグナルのトランスデューサーとして確立されているからである[22]。2型糖尿病治療に広く使用されているDPP4阻害剤のようなグルコース低下剤は、複数の免疫調節基質の生物学的活性を修飾することができる[23]。ACE2は、SARS-CoV-2のスパイク(S)タンパク質によって認識される侵入受容体であり、肺、腎尿細管、心臓、小腸管腔表面、脂肪組織および血管を含むいくつかの異なる組織で発現していることが知られている[24]。尿中ACE2タンパク質濃度とその酵素活性は、1型糖尿病(1型糖尿病)[25]と2型糖尿病の両方の被験者で増加している[26]。ヒト組織における高血糖がACE2の発現を調節できるかどうかはまだ十分に確立されていないが、糖尿病マウスモデルでは、肺、腎臓、心臓でACE2が過剰に発現していることが知られている[27]。さらに、ACE阻害薬(ACEi)やアンジオテンシン受容体拮抗薬(ARB)などの高血圧治療薬は、ACE2の発現をアップレギュレートすることが知られている[28]。したがって、糖尿病患者の複数の組織におけるACE2受容体発現の増加により、COVID-19の重症度が潜在的に悪化する可能性があると議論されてきた[29]。それにもかかわらず、レニンアンジオテンシン・アルドステロン系(RAAS)阻害薬の臓器保護効果が確立されていることを考慮して、いくつかの権威ある科学的学会は、COVID-19感染のリスクが高い患者では、これらの薬剤を中止しないことを推奨している[30]。しかし、潜在的に有害な薬物療法を生活習慣の介入で回避または中断する可能性は、慎重に考慮されるべきである。
糖尿病は、血糖値の上昇が抗ウイルス反応を抑制する可能性もあることを考えると、H1N1インフルエンザを含む重度のウイルス性呼吸器感染症のリスクの増加と関連している[31]。中国では、SARS-CoV-2で入院した500人以上の被験者を対象とした研究で、空腹時血糖値の高さが死亡率の増加を決定することが明らかになった[32]。
さらに、高血糖血漿レベルと糖尿病は、SARS患者における死亡率の独立した予測因子であり[33] 2009年のH1N1パンデミックでは、糖尿病は感染の重症度を高めることが示された[31]。これに伴い、インフルエンザおよびMERS-CoV感染糖尿病マウスでは、病気の重症度が上昇したことが示された[34,35]。
COVID-19に感染してニューヨーク市に入院した5700人の患者を対象とした研究では、糖尿病患者は非糖尿病患者に比べて侵襲的機械換気を受けている可能性が高いことが示された[36]。重要なことは、糖尿病患者の動物モデルでは、肺胞上皮の崩壊や血管透過性の上昇など、肺の構造的変化が観察されたことである[37]。さらに、糖尿病患者では非糖尿病患者と比較して、内皮毛細血管基底ラミナと肺胞上皮が厚くなっている[38]。特筆すべきは、Iacobellisらによる最近の研究で、糖尿病の病歴とは無関係に、入院時の高血糖が急性呼吸窮迫症候群(ARDS)のX線画像診断の最良の予測因子であることが示されたことである。急性高血糖症は、COVID-19患者における急性呼吸窮迫症候群(ARDS)のX線画像所見の発生と進行に寄与する炎症性および免疫性の異常反応を引き起こす可能性がある[39]。さらに、構造機能研究から、SARS-CoV-2のスパイク蛋白質は高グリコシル化されていることが示唆されており[40]、高血糖により肺上皮中の高濃度のグリコシル化SARS-CoV-2ウイルス粒子とグリコシル化ACE2がCOVID-19感染の感受性とその後の重症度に影響を与えるのではないかとの仮説が立てられている[41]。実際のところ、高グルコース血漿レベルは気道分泌物中のグルコース濃度を上昇させることができ、肺上皮細胞が高グルコース濃度に曝露されることは、インフルエンザウイルスの感染および複製を増強することが知られている[42,43]。最近の報告では、グルコースレベルの上昇がウイルスの複製に厳密に関与しているという証拠が示されている:興味深いことに、SARS-CoV-2感染はミトコンドリアの活性酸素産生を増加させ、これは低酸素誘導因子-1α(HIF-1α)の安定化を誘導する。これは、単球/マクロファージの代謝機能を高度な解糖性にシフトさせ、SARS-CoV-2複製率の誇張につながる[44]。これに関連して、最近の試験管内試験での研究では、解糖の薬理学的阻害がヒト大腸上皮癌細胞株(Caco-2細胞)におけるSARS-CoV-2ウイルスの複製を減少させることが示された。したがって、好気性解糖の減少は、ウイルス複製を制御することを目的とした代謝療法として重要である可能性がある[45]。
これらの理由から、COVID-19患者の転帰を改善するためには、高血糖および高血糖変動を十分に防止すべきである。したがって、血糖値が十分に管理されていれば、感染症のリスクの低下および/またはより良い疾患の治癒と相関することは明らかである。2型糖尿病およびその併存疾患に一般的に使用される薬剤の潜在的な副作用を考慮すると、SARS-Cov-2感染リスクおよび関連する合併症を予防または軽減するために、血糖値を下げる栄養学的アプローチを第一の選択肢として検討すべきである。
炎症:有害になる可能性のある私たちの相互の友人
SARS-CoV-2感染によって誘導されるプロ炎症性サイトカインおよびケモカインの異常放出が、COVID-19症候群の致命的な転帰の中心であることはよく知られている[46]。COVID-19病の重度の進行は、炎症状態の延長、Treg、NK、およびCD4+とCD8+の両方の細胞数の低下を伴う遅発性インターフェロンガンマ反応によって決定される [47,48]。高血糖が炎症反応を悪化させる可能性があることは、徹底的に文書化されている。実際のところ、糖尿病患者ではNK細胞活性が低下し、プロ炎症性M1マクロファージが上昇している[49, 50]。さらに、糖尿病患者は慢性的な低レベルのプロ炎症状態を示し、Th17/TregおよびTh1/Th2のアンバランスが確立されている[51]。高グルコースレベルは、ミトコンドリア活性酸素の増加を介して単球におけるサイトカイン産生を増幅させる [44]。したがって、糖尿病患者で観察される免疫細胞集団と活性の調節障害は重要な危険因子であり、SARS-CoV2感染時の炎症反応の悪化を決定している可能性が高い。
肥満と、より一般的には過剰な脂肪組織は、低悪性度の慢性炎症状態を特徴としている。正確な肥満-炎症のメカニズムはまだよくわかっていないが、いくつかの手がかりは、腸由来の分子、食事由来の代謝物(遊離脂肪酸など)低酸素、メカノトランスダクション、細胞死 [52]、およびアディポカインおよびサイトカインの変化した分泌など、脂肪細胞の肥大に関連する内在的な因子が原因であることを示している。脂肪細胞死による細胞屑の除去に機能する単球/マクロファージのリクルートは、これらのメカニズムを増幅させる[53]。いくつかの主要な炎症性マーカーが、心血管疾患や2型糖尿病などの肥満関連の併存疾患における有害転帰のリスクの増加と厳密にリンクしているため、慢性的な低悪性度炎症は、肥満および関連疾患のリスクを理解するために慎重に考慮されるべきである。全身性炎症のマーカーとして知られるC反応性タンパク質と体組成との間には正の相関関係があることを示す証拠が多数存在する[54]。さらに、プラスミノーゲン活性化因子阻害剤[55]、赤血球沈降速度[56]、主要な炎症性サイトカイン[57,58]は、肥満者においても同様の正の相関を示しており、炎症と肥満の間の厳密な関連性をさらに支持している[59-61]。
COVID-19に対する生活習慣行動アプローチとしてのケトジェニックダイエット
ライフスタイル行動の中で、栄養アドバイスが、SARS-Cov-2感染リスクおよび関連する合併症の予防または軽減についての公衆衛生の議論において、まだ十分に考慮されていないことは驚くべきことである。したがって、免疫応答およびCOVID-19に向けた潜在的な臨床転帰を改善するための適切な栄養戦略を促進するために、行動への呼びかけが必要である。
最近、Solimanらは、宿主の代謝状態を炭水化物依存性の解糖状態から脂肪依存性のケトゲン状態に変化させることにより、ウイルスの複製を変化させることを目的とした、SARS-CoV-2感染に取り組むための潜在的な予防戦略または補助療法として、断続的な絶食と中鎖トリグリセリドの補給の組み合わせを提案している[62]。このような代謝シフトは、ミトコンドリアストレスに対する抵抗力の向上、抗酸化防御の改善、オートファジーとDNA修復の増強、インスリン分泌の減少を引き起こす[63]。この文脈では、ケト原性食は、高リスク集団におけるSARS-CoV-2感染に対する免疫学的反応を改善するための興味深い理論的基盤を持つ栄養学的アプローチである[64]。ケト原性食
ケトジェニック・ダイエット(KD)は、高脂肪、低炭水化物の食事であり、1920年代以降、主に小児のてんかん治療に使用されてきた[65]。興味深いことに、それらの使用は、多量栄養素の組成とエネルギー含量を変化させることによって、異なる病理学的条件(重度の肥満、代謝性疾患、片頭痛、癌など)に直面するように適応されてきた。このような背景から、肥満およびそれに関連する併存疾患(2型糖尿病、脂質異常症、インスリン抵抗性、炎症)の治療におけるKDの重要性が最近明らかになってきた[66, 67]。特に、炭水化物摂取量の著しい制限、通常30g/日以下、脂肪およびタンパク質の割合の相対的な増加、および1日の総エネルギー摂取量が800kcal未満であることを特徴とする超低カロリーケトジェニック・ダイエット(VLCKD)は、中等度から重度の肥満および関連する心血管系の危険因子を有する患者など、短期的に急速な体重減少を必要とする患者において非常に効果的な栄養戦略を表し、インスリン抵抗性、グルコースおよび血圧コントロールの顕著な改善につながる[66,67]。VLCKDで得られる体重減少は、ほとんどが二次的な脂肪量減少であるが、除脂肪量および十分な栄養状態は維持される[68]。重要なことに、KDはMAFLDに対する効果的かつ迅速な治療法であることが証明されており、6日間の治療後にのみ肝脂肪含量および肝インスリン抵抗性が顕著に減少している[69]。実際、KDは適切な微量栄養素やビタミンの補給とともに、厳格な医学的管理と治療コンプライアンスを必要とする。このような理由から、KDの利用に対する禁忌は慎重に考慮されるべきである[67]。
血糖コントロールにおけるVLCKDの有効性を示す多くの証拠がある [52]。実際のところ、この栄養プロトコルでは炭水化物の摂取量が非常に少ないため、血糖値の大きなスパイクが緩和され、それによって血糖値の変動が改善される。2型糖尿病の肥満患者では、VLCKDへの短期暴露は、得られた体重減少によって説明できるものよりも高い程度で、β細胞機能の著しい改善を決定する。炭水化物摂取量の大幅な減少は、肝インスリン感受性の顕著な改善による肝グルコース産生の有意な抑制と関連している[70]。また、VLCKDレジメンに短期間暴露した後にインスリン反応が増強され、高血糖チャレンジに対してインスリン反応が回復することも報告されている[71]。これらの理由から、VLCKDは、糖尿病患者の代謝リハビリテーションのための集学的戦略の一部となる可能性がある。
KDは、ケトン体[アセトアセテートおよびβ-ヒドロキシ酪酸(ßOHB)]の血漿レベルを上昇させ、血糖値を低下させることにより、治療効果のほとんどを発揮する。人間では、ßOHB の基礎血しょうレベルは低いマイクロモルの範囲にあり、KD の間に 1 mM のまわりの安定したレベルに達する。エネルギー燃料としての役割を超えて、 ßOHB は細胞生理学において多元的かつ異質な効果を発揮し、酸化ストレスを抑制する遺伝子の 発現を誘導し、最近 Stubbs らによる網羅的なレビュー記事[74]で議論されているように、複数の組織で異なるメカニズムによ り、顕著な免疫調節、抗異化[72]および抗炎症[73]効果を表示する。さらに、KDのよく知られた血糖降下作用は、ウイルス感染の造影に役立つ可能性がある[44]。最後に、VLCKDは、ケトン体の尿中排泄に伴うナトリウレシスの増加により、血圧低下に有効であることが明らかにされている[75]。隔離による身体活動量の減少および集団における生活習慣の一般的な変化を考慮すると、身体運動は、血糖コントロールの改善[76]、体組成[77]、肝臓脂肪量[78]、および一般的な代謝健康[79]など、前述のKDの好ましい効果の増強因子であるように思われる。
SARS-CoV-2感染に対するケトジェニック食の潜在的な予防効果
ケトジェニックダイエットは、相乗的に病原体の攻撃から宿主を保護する自然免疫細胞と適応免疫細胞の両方を調節する役割を果たしている可能性がある。
自然細胞媒介免疫
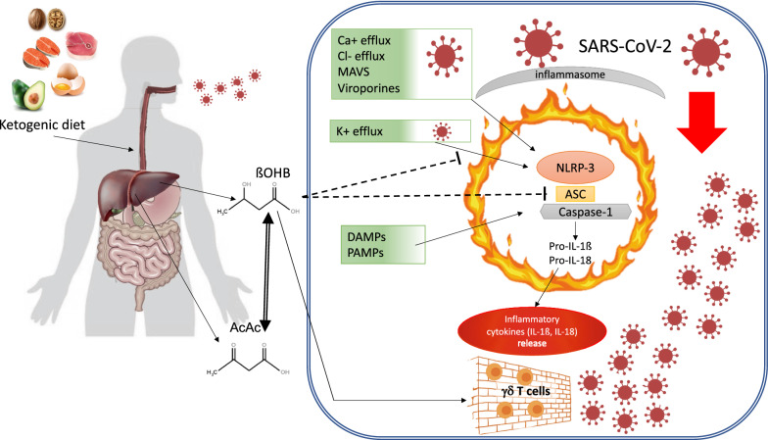
自然免疫細胞は、まず、パターン認識受容体(PRR)の活性化を介してウイルス抗原によって引き金を引かれ、ウイルスの複製を抑制し、適応免疫を調節する[80]。この文脈では、NLRP3/inflammasomeは重要な自然免疫センサーであり、インターロイキン-1β(IL-1β)およびインターロイキン-18(IL-18)分泌の誘導を介してウイルス誘発性炎症を媒介している[81]。パターン認識受容体NLRP3は、ヌクレオチドオリゴマー化ドメイン(Nod)様受容体(NLR)であり、毒素、ATP、過剰なグルコース、コレステロール結晶などのダメージ関連分子パターン(DAMP)と、ウイルスや細菌分子などの病原体関連分子パターン(PAMP)の両方を認識する。例えば、RNAウイルスは、ミトコンドリア外膜上のミトコンドリア抗ウイルスシグナル伝達タンパク質(MAVS)を介してNLRP3を活性化することができる。活性化されたNLRP3は、アダプタータンパク質ASC(C末端カスパーゼリクルートドメイン[CARD]を含むアポトーシス関連スペックク様タンパク質)と相互作用する炎症性複合体の形成を促進し、これにより、次に、ザイモゲンプロカスパーゼ-1のカスパーゼ-1への活性化を引き金とする。最後に、炎症性カスパーゼ-1は、不活性なプロ-インターロイキン-1β(pro-IL-1β)およびプロ-インターロイキン-18(pro-IL-18)を、対応する活性な炎症性サイトカインに変換する[82](図1)。
図1 ケトン体とNLRP3/inflammasome活性化
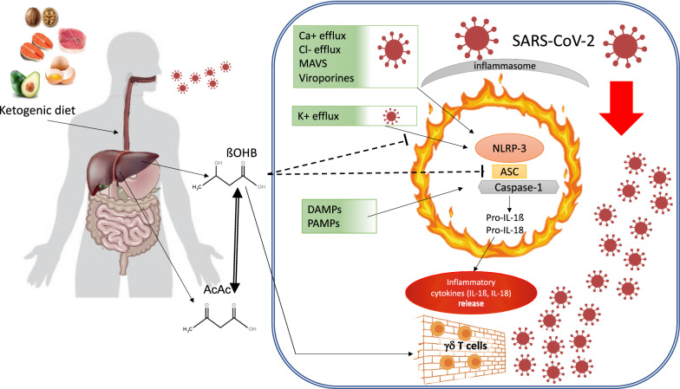
重篤なCOVID-19病に関連するリスク状態に対するケトン体ダイエットとßOHBの保護効果。ßOHB:β-ヒドロキシ酪酸、AcAc。AcetoAcetate、MAVS:ミトコンドリア抗ウイルスシグナル伝達タンパク質、LPS:リポ多糖類、NLP3:NOD-、LRR-、ピリンドメイン含有タンパク質3,ASC。カスパーゼリクルートメントドメイン(CARD)を含むアダプターアポトーシス関連Speck様タンパク質、Pro-IL-1ß:プロインターロイキン1β、Pro-IL-18:プロインターロイキン18,DAMPs:ダメージ関連分子パターン;PAMPs:病原体関連分子パターン
ウイルス感染によるNLRP3/inflammasome活性化は、インフルエンザAウイルス(IAV)脳筋炎ウイルス(EMCV)C型肝炎ウイルス(HCV)およびSARS-CoVで文書化されており、また、ホモオリゴマーに集合し、細胞質オルガネラ膜を横切って親水性の孔を形成し、それによってNa+、K+、およびCa2+フラックスを増加させる特定の分子であるビロポリンとして知られるウイルスタンパク質によっても媒介されているように思われる[83]。細胞内Ca2+濃度の増加と細胞内K+レベルの低下は、NLRP3/炎症性サイトカインの活性化とそれに続く炎症性サイトカインの大量分泌のための重要なトリガー信号を表している[84]。新たに蔓延したSARS-CoV2を含む、これまでに知られているすべてのコロナウイルスは、ビロポリンEと3aをコードすることができ、それらの発現は、COVID-19疾患におけるNLRP3/inflammasomeの活性化に機能的である[83]。
ßOHBがNLRP3/inflammasome活性化を阻害するという証拠が増えている。ヒトでの炎症性サイトカインに対するKDの好ましい効果[85]、動物および細胞モデル[86]でのKDの好ましい効果は、十分に確立されている。ßOHB は、多くの異なる炎症性刺激に応答して、NLRP3/イン フラマソームに特異的な、中央の共通のシグナル伝達経路に作用することができる。より具体的には、 ßOHB は、マクロファージからの K+ の流出の減少とインフラマソームアセンブリの阻害を介して NLRP3/インフラマソームの活性化を阻害する(図 1)。これらの観察結果と一致し、ヒト単球における IL-1βおよび IL-18 の分泌を ßOHB 依存的に抑制することが報告されている[73]。
COVID-19患者で観察された全身性炎症性カスケードの引き金となるイン フラマソーム活性化の役割を考慮すると、サイトカインストーム症候群の発症や進行を防ぐために、KDのような血漿中 ßOHB の増加に基づくアプローチが考慮されるべきである。
興味深いことに、最近の仮説論文では、炎症の初期段階でマクロファージのM1分極を減少させるために、グルコース経口供給の大幅な減少の重要性が強調されている[64]。実際、活性化がサイトカインストーム症候群[87]と関連しているM1表現型は、KD中に起こるように、グルコース取り込みの大幅な減少によって減少することが知られている好気性解糖に厳密に依存している。一方、KDは、遊離脂肪酸の継続的な供給によって、OXPHOS酵素を豊富に発現する抗炎症性のM2マクロファージの代謝を維持することができる[64]。
適応的細胞介在性免疫
Tリンパ球は、抗原認識に特化したT細胞受容体(TCR)によって特定のリガンドを認識する。ほとんどの種において、T細胞のTCRの大部分はα鎖とβ鎖で構成され、少数のT細胞集団はγ鎖とδ鎖で特徴づけられるTCRを発現している。ヒトおよびマウスでは、末梢血およびリンパ系器官のT細胞の大部分(90%以上)がTCRα/β鎖を発現し、少数のT細胞(10%未満)のみがTCRγ/δ鎖を発現している。興味深いことに、マウスでは、γδ T細胞は、上皮および粘膜において最も豊富なT細胞集団である[88]。上皮層には特異的な免疫系と常駐するTリンパ球が表示されており、上皮細胞と密接に接触している。ヒトでは、皮膚や粘膜にγδ T細胞が濃縮されており、粘膜層におけるγδ T細胞の特異的な機能が示唆されている[88]。したがって、これらの細胞は、呼吸器形質の粘膜内層におけるウイルス感染モニタリングおよび応答において重要な役割を果たしている可能性がある。
Goldbergらによる最近の研究では、インフルエンザAウイルス(IAV)の鼻腔内チャレンジに曝露された免疫不全マウスは、そのγδT細胞集団が肺で増加すると、より良好な生存率を示し、バリア機能と抗ウイルス応答の改善を決定したことが示された[89]。より具体的には、マウスは、7日間のケト原性食によりγδ T細胞を増殖させ、対照のマウスと比較して血中酸素飽和度が高く、分泌機能、気道粘液産生、およびIL-17産生が増加し、それによりCOVID-19サイトカインストーム中に減少することが知られている細胞集団である調節性T細胞(Treg)の活性化を介して抗ウイルス防御および組織修復を仲介した[47]。
特筆すべきことに、γδ T 細胞の増殖は KD によって特異的に促進された。なぜなら、ßOHB の薬理学的な増加はこの表現型の誘導に失敗したからである[89]。重要なことに、γδ T細胞はIAVに反応して増殖し、ヒトでもIAVに感染した気道細胞を死滅させることができる[90]。したがって、KD は、sshOHB レベルを生理的に上昇させ、SARS-Cov2 感染を防ぐために適応免疫細胞を最適化するための貴重な選択肢となり得る。
最近の観察では、γδ T 細胞は脂肪組織でも発現しており、そこで IL-17 産生を増加させ、それによって免疫調節および抗炎症特性を持つ Treg 細胞の機能拡大を促進することが示された [91]。
したがって、肺のSARS-Cov2感染に対するバリアの完全性を維持する上でγδT細胞が重要な役割を果たしていると推測され、脂肪組織においてもメタ炎症がウイルス感染に対するサイトカイン反応を促進する可能性がある。KDは、これらの防御機構を特異的に維持するための有効なアプローチであると考えられる(図1)。
結論
ケトン体がCOVID-19病などの重症ウイルス感染症に影響を与えるメカニズムは複数ある。最近のレビュー論文はこの概念を網羅的にまとめており、可能な治療法として呼吸器ウイルスの合併症を標的とした重症患者への外因性ケトン体の投与を提案している[74]。
我々は、KDによる内因性ケトン体の増加が、特に長期化するパンデミック緊急事態の現在の文脈において、肥満患者におけるSARS-Cov2感染および有害転帰を予防するためのより価値のある戦略を表し得ると確信している。実際、効果的な薬理学的治療およびワクチン接種がない場合には、新たな感染の波を考慮して、重篤なCOVID-19疾患(肥満、高血糖、高血糖変動、インスリン抵抗性、高血圧)に関連するすべてのリスク状態の予防および/または修正が必須である。これは、慢性炎症、肝性および全身性のインスリン抵抗性を減少させ、栄養状態、心血管の健康、免疫応答、グルコースのホメオスタシスおよび血圧制御を改善するために、脂肪質量減少を誘導することを目的とした栄養戦略で得られる可能性がある。
最後に、よく構造化された個別化されたKDレジメンの採用は、肥満患者における進行性の栄養教育とリハビリテーションを助け、ライフスタイルの行動を修正するための効果的なツールを提供し、体重の長期的なコントロールをサポートし、SARS-Cov2感染に関連した重篤な合併症の潜在的な関連するすべての危険因子の減少を支持することができる。このような仮説を確認するためには、構造化されたKDのプロトコルに従った肥満患者と従っていない肥満患者の間の重度のCOVID-19疾患の実際の発生率について、十分に設計された多中心研究が有用であろう。
この困難なパンデミックの時代には、生活習慣病予防策の採用は必須であり、慎重に実施されるべきである。