Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC5890129/
Front Med(Lausanne).2018;5: 61.
2018年3月12日オンライン公開doi:10.3389/fmed.2018.00061
概要
加齢と慢性加齢性疾患(慢性加齢性疾患s)や老年症候群(老年症候群s)の関係を理解することを目的とした新しい学際的分野であるゲロサイエンスは、加齢がこれらの病態の主要な危険因子であるという疫学的証拠と実験データに基づき、加齢と慢性加齢性疾患/老年症候群sには共通の基礎生物学的メカニズムがあると想定されている。その結果、何百もの専門分野やサブスペシャリティに細分化されることによって好まれるように、医学の主要な目標は、単一の慢性加齢性疾患/老年症候群を一つ一つ克服することではなく、老化に対抗することにある。
もし、加齢と慢性加齢性疾患/老年症候群の両方に同じ分子・細胞メカニズムがあるとすれば、加齢と慢性加齢性疾患/老年症候群の間に違いがあるとすれば、それは何かという大きな疑問が浮かび上がってくる。そこで、虚弱体質、サルコペニア、慢性閉塞性肺疾患、がん、アルツハイマー病やパーキンソン病などの神経変性疾患、そしてプロジェロイド症候群の一例であるダウン症などを取り上げ、慢性加齢性疾患sや老年症候群sは老化の促進という概念で捉えることができるのではないかという仮説について議論している。
この統合的な見解によれば、加齢と慢性加齢性疾患/老年症候群は連続体の一部であり、正確な境界は存在せず、両極端は、ほとんどの慢性加齢性疾患/老年症候群を回避または先送りし、加齢の減速を特徴とする百寿者と、60代、70代、80代に一つまたは複数の重度の慢性加齢性疾患を発症し、それぞれ加齢促進の兆候を見せている患者によって表される。
この両極端の間には、ある種のグレーゾーンを示す中間的な軌跡が連続的に存在する。このように、臨床的に異なる古典的な慢性加齢性疾患/老年症候群は、加齢と共通する限られた基本的メカニズムに関する特殊な変化の組み合わせの結果であると言える。
加齢が加速されるか減速されるかは、その人の遺伝的背景と生涯にわたる環境因子や生活習慣との相互作用に依存する。もし慢性加齢性疾患や老年症候群が加速度的に進行する老化現象であるならば、慢性加齢性疾患や老年症候群の発症リスクの高い被験者を特定するために、生物学的年齢と年齢を区別することができるマーカーを特定することが急務である。
この目的のために、DNAメチル化、N型糖鎖プロファイリング、腸内細菌叢組成の利用を提案し、疾患特異的マーカーを補完する。
キーワード 老化、長寿、加齢性疾患、炎症、バイオマーカー、ゲロサイエンス
はじめに老化と病態には共通したメカニズムがある
老年が病気であるかどうかという問題は、古くから取り上げられてきた。ローマの劇作家Terentiusが”senectus ipsa est morbus“(老年自体が病気である)と主張し、Ciceroが数十年後にDe Senectuteで主張したことに始まる。キケロはその数十年後、『老生』の中で、「老いに対して戦わなければならない。」と述べている。これらの引用は、いくつかの学者によって取り上げられた長年の老化と老いに関する見解をエレガントにまとめている(詳しくは付録を参照)。しかし、19世紀に近代医学が誕生すると、この古い考え方はいつの間にか崩れてしまった。当時の主な関心は、医学的実体(病気や症候群)とその原因(感染症、遺伝、退行過程、炎症など)を正確に定義することだったからだ。その結果、老化と病気は、いずれは相互作用する可能性があるが、本質的には異なる現象であると考えるに至った。本総説では、加齢と加齢関連疾患(慢性加齢性疾患s)および老年症候群(老年症候群s)は別個の存在であるという古い考え方を再評価し、それに異議を唱えたい。この仮説を支持するために、老化と慢性加齢性疾患s/老年症候群sが同じ基本的な分子および細胞メカニズムを共有していることを強調する。
加齢は、健康寿命を制限するほとんどの疾患や病態の主要な危険因子である。従って、寿命の延長につながる動物モデルへの介入は、多くの慢性疾患を予防したり遅らせたりする。なぜだろう?長年、加齢は生理的な条件であり、それが多くの疾患の発症に有利に働くという説明がなされてきた。しかし、両者の関係はもっと複雑である可能性が高く、その大きな理由は、基本的なメカニズムを共有しているためである。老化と慢性加齢性疾患s/老年症候群sが同じメカニズムを共有していると仮定した場合、どのような共通点と相違点があるのだろうか。本総説では、疫学的・実験的データのほとんどに適合する統合的な仮説として、慢性加齢性疾患s/老年症候群sを老化プロセスの加速とみなすことを主張したい。老化の加速という概念は、Hutchinson-Gilford progeria(2),mandibuloacral dysplasia(3),Werner症候群(4),Down症候群(5)などの異数性遺伝病(1)の観察に端を発している。ここでは、百寿者のように、ほとんどの慢性加齢性疾患/老年症候群を回避あるいは先延ばしにして超高齢に達する少数派とは対照的に、慢性加齢性疾患や老年症候群を発症している一般集団に老化の加速という概念を拡張する。このことは、百寿者の中には明らかな慢性加齢性疾患に悩まされたことのない被験者がほとんどいないという観察から、より強く意識されるようになった。これらの例外的な人々は、「健康な」老化と疾病が、共通の分子および細胞メカニズムによって促進される連続体の極限の表現型として、別々に起こり得るという原則を証明するものと考えることができる。
加齢と慢性加齢性疾患/老年症候群に共通する基本的なメカニズムは何だろうか?国際的な専門家グループは、「7つの柱」を特定した。実際には、ストレスへの適応、プロテオスタシスの喪失、幹細胞の疲弊、代謝異常、高分子損傷、エピジェネティック修飾、および炎症が含まれる(6)。多くの慢性疾患や病的状態(表1)1)は、少なくとも部分的にはこれらのメカニズムによって決定されており、次の段落で詳述するように、この仮説の裏付けとなっている。
表1 加齢に伴う病態と分子的関係
| 加齢に伴う病態 | 老化現象と共通するメカニズム | マーカー | 参考文献・レビュー |
|---|---|---|---|
| アルツハイマー病 | 炎症 酸化ストレス ミトコンドリア機能不全 プロテアソーム活性の低下 細胞老化 腸内細菌叢の変化 |
IL-6、TNF-α、IL-1β、TGFβ、IL-12、IL-18、INFγ 8-ヒドロキシグアノシン、8-ヒドロキシ-2′-デオキシグアノシン、酸化タンパク質、過酸化脂質 20Sコア活性低下 老化細胞の存在 炎症性サイトカインの活性化、腸管伝染性亢進 |
(7) (8) (9) (10) (11) (12) |
| 癌 | 炎症(Inflammation 細胞老化 |
IL-6、老化細胞の存在 | (13-16) |
| 慢性閉塞性肺疾患 | テロメア短縮 酸化ストレス 細胞老化 炎症、インフラマソーム、NLRP3の活性化 PI3キナーゼ・mTORシグナルの活性化 栄養素の感知異常、プロテオスタシス・オートファジーの損失ミトコンドリア機能不全 幹細胞の枯渇 |
p21CIP1/WAF1,p16INK4a,βガラクトシダーゼ活性,老化に伴う分泌表現型 IL-1β、IL-6、IL-18、ケモカイン(CXCL8、CCL2)、メタロプロテアーゼ Parkin、phosphatase and tensin homolog-induced protein kinase 1などのストレスマーカー |
(17,18) |
| 黄斑変性症 | 網膜の慢性炎症、オートファジーの調節障害、酸化ストレスによるダメージの蓄積、タンパク質の凝集、リポフスチン生成 | 熱ショックタンパク質、Absと自己エピトープ、そしてインフラマソーム活性化 | (19,20) |
| 変形性関節症 | 細胞障害、細胞老化、ミトコンドリア機能障害と酸化ストレス、およびオートファジーの低下、炎症 | HGMB1;HGMB2;およびIL-8 | (21) |
| 骨粗しょう症・骨粗鬆症 | 慢性炎症 | TNF-α;IL-6;CRP;および炎症性マーカー | (22) |
| パーキンソン病 | 炎症(Inflammation 細胞老化 腸内細菌叢の変化 |
炎症性細胞(アストロサイト)、老化細胞の存在 炎症性サイトカインの活性化、腸管伝染性の亢進、セロトニン系の変質 |
(23) (24) (25) |
| 歯周炎 | 炎症 | Porphyromonas gingivalisはシトルリン化エピトープを生成するpeptidylarginine deiminaseを発現している 炎症性サイトカイン |
(26) |
| 関節リウマチ | 細胞死と慢性炎症 | アブと修飾自己エピトープ;HGMB1 マトリックスメタロプロテアーゼTNF-α;IL-1β;およびIL-6 |
(27) |
| サルコペニア | 炎症と酸化ストレス | TNF-α、IL-6、IL-1、CRPの上昇。 | (28-30) |
この考えに従えば、老化と疾病の違いは、老化の細胞および分子プロセスの速度・強度に、特定の臓器・システムの遺伝的素因およびライフスタイル・生活習慣の素因が組み合わさったものに依存することになる。したがって、長期的には、すべての機能領域が生理的に低下し、最終的には、臓器/システム固有の遺伝的および環境的要因によって、明らかな臨床疾患につながる可能性がある。このような経過をたどることで、健康な若年層から障害のある不健康な高齢者層までの連続体が形成される。したがって、すべての主要な慢性加齢性疾患s/老年症候群sは、長い不顕性潜伏期間を特徴とし、そこでは、生体システムの高い運用上の冗長性により、疾患の診断的徴候がほとんど観察されない。この冗長性は、細胞やシステムの適応能力(「老化のリモデリング理論」)(31,32)と共に、分子損傷の進行性蓄積を緩衝する能力を持ち、客観的な早期診断の兆候やツールの入手を妨げている。極端な例として、パーキンソン病(PD)のような神経変性疾患では、他の疾患で死亡した患者に特別な臨床症状がないにもかかわらず、高度な解剖病理学的変化を確認することが可能である。
従って、加齢と慢性加齢性疾患/老年症候群は同じプロセスの異なる軌跡であり、多様な遺伝的背景やライフスタイルによって異なる速度で進行すると考えなければならない(33-35)。このテーマに関する推論には、いくつかの考察が役立つ。(老化は進化の過程で選択されたものではなく、これまで老化遺伝子が同定されていない。つまり、老化現象を引き起こすような遺伝子が選択されていないため、確率的な空間が大きく残っている(36)。この2点が、高齢者における表現型の異質性を説明することができる。実際、遺伝子(あるいは遺伝子群)の第一の目的は、常に生物の生存あるいは生殖能力を高めることにあり、老化はその基本的機能の予期せぬ副産物である可能性がある。この考えに従い、数年前、Mikhail BlagosklonnyとMichael Hallは、老化は、正常な発生過程とそれに関連した細胞「プログラム」の、特にmTOR駆動型成長に重点を置いた一種の調節障害として概念化できることを提案した(37,38)。この理論によれば、シグナル伝達経路の過剰な活性化、成長などの正常な細胞機能の悪化が、恒常性の変化、機能不全、臓器障害につながり、慢性加齢性疾患の発症を含む老化プロセスの原動力となる可能性がある。この説は、老化の「炎症」説を補完するものである(39)。炎症は前述の「7つの柱」のひとつであり、炎症老化とは、高齢者に見られる慢性的で低悪性度(不顕性)かつ無菌性の炎症と定義される。これは、私たちの体を構成するメタ生物としての「非自己」(持続感染)、「自己」(細胞破片、核酸、糖化タンパク質など)、「準自己」(腸内細菌叢(GM))による自然免疫系の刺激増大と、炎症性分泌プロファイルを特徴とする老化細胞の蓄積によって引き起こされる(40,41)。このように、過剰活性化理論も炎症老化理論も、発達と生存のために選択されたプログラム(炎症)が、進化によって予測された期間よりも長い間、衰えることなく活動を続けると、有害なものに変わる可能性がある、という点で一致している。同じことが、前述の”7つの柱”の他のプログラムにも当てはまると考えられる。
加齢に伴う病態
このパラグラフでは、多くの慢性加齢性疾患/老年症候群、特に虚弱やサルコペニア、慢性閉塞性肺疾患(COPD)、癌、アルツハイマー病やパーキンソン病の老化を引き起こすことが知られているいくつかの分子メカニズムの関与について議論することにする。また、DSのような遺伝的症候群の早発性老化の症状については、正常老化にも存在するが、DSでは免疫や神経系のレベルでかなり早期に発生することを説明する。心血管疾患や2型糖尿病も、何百万人もの患者に影響を与える非常に重要な病態であり、炎症や酸化ストレスなどの分子メカニズムを老化と共有しているが、紙面の都合上、これらの病態に関する詳細な議論は割愛させていただくことにする。
フレイルティ・シンドローム
代表的な疾患としては、虚弱体質、軽度認知障害、メタボリックシンドロームなどが挙げられる。特に、虚弱は、生理的予備能の低下、ストレス(たとえ軽度であっても)に対する反応や回復の悪さによって特徴づけられる高齢者の多次元的な症候群であるとされている。この状態は、さまざまな健康上の不利益に対する脆弱性を増大させ、罹患率および死亡率の上昇と関連している。しかし、フレイルは、その定義のために考慮される基準や研究対象者の年齢層によって、幅広い表現型を示すという特徴がある。このため、臨床医も研究者も、フレイルという概念にまつわるかなりの曖昧さを認識するようになってきている。フレイルの定義、フレイルの認識に用いるべき基準、老化、障害、慢性疾患との分子的関係などについて、相反する考え方が広まっている(42)。
2001年、Friedらはフレイルの定義として、意図しない体重減少、手の握力低下、遅いスピードのゲート、疲労感、身体活動の低下の5つの基準を精緻化した。これらの5つの基準のうち3つ以上を満たす人(通常65歳以上)はフレイルと分類され、その後3年間の転倒事故、移動能力またはADL障害の悪化、入院、死亡のリスクが高くなる。1つまたは2つの基準の存在によって示される中間のフレイル状態またはプレフレイル状態では、これらの転帰のリスクは中程度であった(43)。この10年間で、Frailty Risk Indexのようなフレイルレベルを検出しスクリーニングするためのいくつかのフレイル評価尺度が開発された(44-46)。複雑な臨床症状のネットワークが、3〜5年の追跡調査後に死亡率のリスク指数が異なる広範囲の虚弱状態や表現型を生み出すことを示唆する文献が多数発表されている(47)。意外なことに、特定の病態が治癒した場合や、栄養補給の有無にかかわらず、運動という観点から個人に合わせた介入を行った場合などには、フレイルの状態が元に戻り、フレイルでない状態に戻ることがある(48,49)。
この極めて特異な状態は、フレイルはエピフェノメノンであり、「病因」は、サルコペニア、すなわち後述する加齢に伴う筋肉量や筋力の低下と重なる可能性にもよるが、集団内で全く異なる可能性があるなど、いくつかの仮定に値するものである。実際、虚弱の多くの徴候はサルコペニアと関連しており、両者が同一人物に存在する場合、脆弱な状態を助長し、健康上の悪影響を及ぼす危険性が高くなる。しかしながら、高齢者の同一集団におけるこれら2つの疾患の併存を評価した研究は少ない。
最近、Toledo Study of Healthy Aging(65歳以上の地域在住高齢者を対象とした研究)において、1,611人の参加者にフレイルおよびサルコペニア評価を行ったところ、サルコペニア評価基準の違いにより、フレイル(Friedの基準で評価)のある人の割合は8.2~15.7%となることが示された。さらに、虚弱者におけるサルコペニアの有病率は、使用する基準によって40.27%から72.2%であった。サルコペニアはフレイルの診断に対して感度は低いが特異度は高いことから、フレイルとサルコペニアは異なるが相互に関連する病態であることが示唆された(50)。
さらに、後述するようにサルコペニアにも共通する炎症状態や免疫老化との密接な関係を示唆するデータが多いにもかかわらず、フレイル症候群の分子メカニズムはまだ完全には解明されていない(30)。フレイルとサルコペニアの両方が病態のさらなる進展に寄与している可能性が高い。重要なことは、虚弱症候群の発症に炎症がどのように関与しているかはまだ未解決であり(51)、慢性低悪性度炎症と虚弱の発症との因果関係や、虚弱状態の可逆性を可能にする条件・治療法を明らかにするためには、さらなる研究が必要であることだ。FriedとFerrucci(52)は、フレイルを「加速度的老化」の症候群と考え、臨床的フレイルが複数の慢性疾患の存在と関連していることを初めて明らかにした。このことは、健康、疾病、合併症が連続的に存在するという考え方を補強している。この点で、多次元的なアプローチは、炎症マーカーや抗炎症マーカーと炎症との間の様々な関係をより堅固に解釈することを可能にし(53)、おそらく、複雑な動的ネットワークの文脈で虚弱リスクや死亡率指標も導入することにより(54)、老化を加速するような集積因子をより分離することに重要な貢献をすることができるだろう。
サルコペニア
加齢に伴って起こる最も広範かつ巨視的な現象の一つは、骨格筋量、筋力、機能の進行性低下であり、サルコペニアとして示される状態に至る。サルコペニアは、高齢者における生活の質の低下と関連しており、障害、虚弱、自立度の低下、罹患、死亡に関連する健康上の負の転帰の重要な危険因子と考えられている(55,56)。サルコペニアの病態生理にはいくつかの因子が関与しているが、その病因は未だ不明である。最近の研究では、サルコペニアの発症と進行には、骨格筋の正常な生理機能を変化させる様々なメカニズムが関与していることが示唆されており、そのうちのいくつかは、老化現象の重要な推進力とも考えられている。サルコペニアの発症に関与するメカニズムとしては、内分泌系の変化、再生能力の喪失、筋繊維の脱神経、筋間および筋内脂肪の蓄積の増加、ミトコンドリア機能障害、酸化ストレス、炎症などがある(57,58)。特に後者の2つのメカニズムは、老化プロセスにも関与している。衛星細胞(筋肉の幹細胞)の再生能力の低下もまた、加齢と共通する特徴である。しかし、このメカニズムは、生体内では重要であるが、精査されているため、ここではこれ以上の考察はしない。実際、老齢筋の衛星細胞は、若いドナーの血漿を濃縮した適切な培地で培養すると、若い筋肉由来の細胞と同様の増殖能を示す(59,60)。したがって、老齢筋の衛星細胞が実際に欠陥があったり疲弊しているという事実には、いくつかの疑問が投げかけられている。それどころか、これらのデータは、衛星細胞の幹細胞性や他の特徴は、環境条件(すなわち、可溶性因子のみならず)に強く依存し、したがって、細胞には依存しないことを示唆している。
実際、疫学的、分子生物学的な研究から、免疫老化と炎症がサルコペニアの病態生理に強く関与していることが分かってきた(30,61)。自然免疫系の細胞の加齢に伴う変化は、全身的な炎症の増加によって間接的にサルコペニアに寄与している。生理的条件下では、損傷に応答して、好中球が骨格筋に移動し、次いでM1マクロファージが筋の炎症を引き起こす。この初期段階には、筋損傷を修復し再生を促進する可溶性因子を産生するM2マクロファージが浸潤する(62)。加齢に伴い、好中球の活性は低下し、特に遊走能が低下する。いったん筋内に侵入した遊走能の低下した好中球は、炎症の増大に寄与するという仮説が立てられている(30)。筋肉の不完全な回復には、炎症性サイトカインの増加や、筋肉の萎縮や筋力低下を引き起こす筋肉損傷に対する炎症反応の長期化が関係している(28)。
全身性の炎症については、サルコペニアへの関与の可能性が提唱されており、炎症の強さの程度に依存する。マウス、ラット、アカゲザル、ヒトの4種の異なる年齢における骨格筋の変化を比較分析したところ、サルとヒトでミトコンドリア量の年齢依存的減少、酸化的リン酸化複合体の減少が保存されているだけでなく、リン酸化NF-κBのヒト特異的な年齢依存的増加も認められた(63)。実は、適度な炎症は有益で、ストレスに対する反応を活性化する基本的なものであるが、炎症が慢性化し、より高まると、筋損傷に対する反応が有害に転じるのである。言い換えれば、生理的老化に存在する軽度の全身性炎症は、筋量や筋力の低下には影響せず、骨格筋の代謝の質にのみ影響すると考えられる。逆に、老化が加速した状態で存在するより重度の全身性炎症(しばしば局所炎症を伴う)は、筋量や筋力の低下、サルコペニアの進行に寄与している(30).炎症と骨格筋量の減少に関連する分子メカニズムはまだ完全に解明されていないが、研究により、炎症は筋肉の同化と異化のプロセスのバランスに影響を与えることによってサルコペニアの発生に寄与していることが明らかになった(64)。特に、TNF-α、IL-6、IL-1、CRPの増加は、NF-κBとユビキチン-プロテアソーム経路の活性化を通じて、筋タンパク質の分解を促進し、タンパク質合成を阻害する。この異化過程への移行は、筋繊維のタンパク質分解、萎縮、再生能力の喪失に至り、骨格筋の機能低下につながる(29、30)。サルコペニアの進行は、免疫老化、炎症、酸化ストレスの間の自己持続的ループによっても増幅されることを示す新たな証拠がある(58,61)。実際、炎症と酸化ストレスの分子経路は、活性酸素の生成において密接に関連し、重なり合っている。これらの活性酸素は、サルコペニアの発症に関連するだけでなく、膵臓β細胞機能の低下や甲状腺自己免疫などの典型的な加齢性内分泌機能障害など、他の多くの慢性加齢性疾患sも含めて人体の健康に病的影響を与える(65)。酸化ストレスや炎症の制御できない蓄積は、正常老化と加速老化の橋渡しとして作用していると考えられる。加速度的に進行する老化では、筋力低下はしばしば骨密度の低下や脂肪量の増加といった他の病態生理学的特徴を伴うため、骨粗鬆症や肥満の原因となる。これらの疾患は、最近「骨粗鬆症性肥満」という言葉で示されるようになり(66)、先に述べたように、フレイルの決定要因のひとつに挙げられる(30、67)。
慢性閉塞性肺疾患
加齢は、糖尿病、心血管疾患、動脈硬化、認知症、癌、COPDなどの多くの慢性炎症性疾患の主要な危険因子の一つであり、臓器や組織に様々な影響を与え、その機能や構造に影響を与える(68)。
肺の老化は、機能の低下、肺の炎症、ガストラップの増加、肺の弾性反動の喪失、遠位気腔の拡大によって特徴付けられる。これらの病的徴候はゆっくりと進行し、COPDの病徴でもある。実際、COPDの全体的な増加は、この病気が主に高齢者に発症し、有病率のピークが約65歳であることから、おそらく人口の高齢化に関係していると思われる(69、70)。COPDは、長期にわたる呼吸困難、気流不良、肺実質の破壊(肺気腫)を特徴とする閉塞性肺疾患である(71)。先進国におけるCOPDの主な原因は喫煙であるが、低開発国でも家庭の大気汚染、栄養不良、湿った住宅環境などにさらされた結果、発症する(72-74)。COPDのゆっくりと進行する気道閉塞、特に肺気腫は、加齢に伴う肺機能の正常な低下の加速を意味すると考えられる(75,76)。
最近の広範な研究(18,77)により、COPDには老化の特徴であるテロメア短縮、PI3キナーゼ-mTORシグナルの活性化、オートファジーの変化、ミトコンドリア機能障害、幹細胞の消耗、さらに低レベルの炎症と細胞および免疫の老化が多く存在することが指摘された。
COPD患者の白血球では、年齢層に関係なく、細胞老化(複製老化)や細胞死を引き起こすテロメア減少が報告されている(78)。さらに、肺気腫患者の肺実質細胞は、細胞の老化と炎症に関連した短いテロメアを示している(79,80)。14の研究のメタアナリシスでは、テロメアの長さとCOPDとの間に有意な負の相関が観察されている(81)。COPDにおけるこのテロメア短縮は、タバコの煙による酸化ストレスの増大がp21を活性化し、細胞の老化と炎症性サイトカインの放出の増加につながるためと考えられる(79)。COPDにおける細胞の老化は、肺細胞におけるp21CIP1/WAF1、p16INK4aなどの老化マーカーの発現の増強や老化関連β-ガラクトシダーゼ活性によって明らかである(82)。COPD患者の肺マクロファージもまた、老化マーカーを発現することがある(18)。さらに、COPDでは、炎症性サイトカイン(IL-1、IL-6)、ケモカイン(CXCL8、CCL2)、MMP9など、老化細胞の分泌プロファイル(senescence-associated secretory phenotype:SASP)と定義される成分の発現が増加する(18)。前述のように、SASPは免疫老化と関連して、隣接する肺組織に、そしておそらく生体全体にも悪影響を及ぼす炎症性病変の重要な決定因子である(17)。
COPDの発症・進展には、自然免疫と適応免疫の両者の免疫老化と、それに伴う炎症が関与している可能性がある。最近、慢性的なタバコの煙にさらされた高齢のマウスにおいて、免疫系の活性化と炎症化が肺気腫の病態の加速に寄与し、炎症メディエーターの産生の増加による慢性肺組織の炎症が、COPDの発症を促すことが証明された(83)。
mTOR経路は、細胞の老化や加齢に重要な役割を担っている。実際、この経路を阻害すると、多くの生物種で寿命が延びる(84)。COPD患者の肺の上皮細胞では、PI3キナーゼ-mTORシグナル伝達経路が活性化されていることが証明されている。IGF-1/AKT/mTOR経路の活性化は、オートファジーを抑制するが、代謝、細胞周期進行、プログラム細胞死の中心的な制御因子であるFOXO転写因子の活性化も打ち消す(85)。FOXO3タンパク質の発現の低下は、喫煙者やCOPD患者の肺で証明されており、プロテオスタシスの損失とともに、栄養センシングの異常がCOPDの病因に寄与している可能性を示唆している(85,86)。プロテオスタシスには、ミスフォールドやダメージを受けたタンパク質を分解・除去する2つの中心的な機構、すなわちオートファジー-リゾソーム系とユビキチン-プロテアソーム系が関与している。これらの経路の障害は、多くの慢性加齢性疾患sを特徴づけるだけでなく、老化プロセスそのものでもある(87,88)。多くのデータは、ホメオスタシスとプロテオスタシスに関与する機構が加齢とともに崩壊し、アンフォールド、ミスフォールド、または凝集したタンパク質の蓄積を促進することを示している(89)。加齢に伴うユビキチン・プロテアソームシステムの低下は、プロテアソームサブユニットの発現低下やアセンブリの不十分・不適切、ミトコンドリアの機能不全によるATP利用率の低下によるプロテアソーム機能の低下など、様々な変化によるものである可能性がある。骨格筋をはじめとする多くの組織・臓器において、上記のような変化の結果として、誘導性サブユニットの増加が確認されている。この誘導は、構成的プロテアソームと免疫プロテアソームのバランスを変化させる代償機構であり、炎症による影響である可能性がある(90)。
また、ヒトの老化線維芽細胞でもプロテアソーム活性の低下が報告されている(91)。一方、心身ともに健康で加齢をうまく乗り越えてきた百寿者の線維芽細胞は、プロテアソーム活性、酸化タンパク質、プロテアソームサブユニットのRNAやタンパク質の発現が、若いドナーから得た培養物と同じレベルであることが示された。そのため、百寿者のプロテアソーム機能の維持は、彼らがうまく年を重ねるための重要な要因であることが示唆されている(92)。プロテオスタシス破綻のメカニズムが破綻すると、生物に有害な結果をもたらす可能性がある。例えば、プロテアソームシステムの破綻は、神経変性疾患(例:アルツハイマー病、パーキンソン病、ハンチントン病)、心血管疾患(例:動脈硬化)、免疫系関連疾患(例:関節リウマチ)、皮膚の老化、癌、COPDなどの病態に関連している(93)。COPDでは、タバコの煙による酸化ストレスがヒストン脱アセチル化酵素などのタンパク質を変化させ、プロテアソーム系やオートファジーによる分解がうまくいかなくなる(94,95)。COPD患者ではプロテアソーム活性が低下しており、肺機能の低下と逆相関している(96)。さらに、タバコを吸う人の肺胞マクロファージは、損傷したタンパク質の蓄積、ミトコンドリア機能の異常、および細菌の除去の欠陥に寄与する可能性のあるオートファジーの欠損を示した(97)。肺気腫患者の肺組織でオートファジーのマーカーが増加している証拠があり、オートファジーが肺気腫のアポトーシスと肺胞破壊に寄与している可能性が示唆されている(96)。前述のようにCOPDではphosphoinositide 3-kinase-mTORシグナルの活性化を通じてオートファジーも障害され(98)、COPDにおける細菌の貪食の欠陥に寄与している可能性がある(99)。
COPDではミトコンドリア機能障害も見られる。特に、ミトコンドリアROS産生の増加とミトコンドリア数の減少は、本疾患の典型的な特徴である(100)。喫煙者の気道上皮細胞は、ミトコンドリアの構造と機能に変化を示し(101)、実際にCOPD患者の上皮細胞には、Parkin、phosphatase,and tensin homolog-induced protein kinase 1の発現増加などのミトコンドリアストレスのマーカーが存在する(102)。上皮細胞におけるこれらの変化は、IL-1β、IL-6、CXCL8などの炎症性サイトカインの分泌の増大を伴っている(101)。ミトコンドリアの変化と活性酸素の産生は、NLRP3インフラマソームを誘導し、慢性炎症性疾患におけるIL-1βとIL-18の分泌を促進する。転写因子peroxisome proliferator-activated receptor-γcoactivator(PGC)-1αは、ミトコンドリア生合成とミトコンドリアROSの生成の重要な調節因子である。軽症のCOPD患者の上皮細胞で増加しているが、COPDの重症度が上がると徐々に減少する(103)。
最後に、老化現象の典型である幹細胞の疲弊もCOPDには存在する。気道上皮の分化に必要な基底前駆細胞は、実際にCOPD患者において再生能力の低下を示している(104)。
癌
多くの種類のがんは、加齢とともにその頻度が劇的に増加することから、本質的に慢性加齢性疾患であり、加齢はがんを発生させる唯一最強のリスクファクターであることを表している。この現象は、DNA突然変異のチェックポイントや修復の効率低下とは関係がない可能性が高い。逆に、高齢の被験者で起こる形質転換突然変異の数が増えているのは、DNA損傷の発生を可能にし、おそらく最も重要なことだが、形質転換細胞が悪性化および転移に進展することを可能にする、はるかに寛容な環境によって助長されていることを示す証拠が増えてきている。このような寛容な環境の主な特徴は、癌に対する免疫反応に関連した、あるいはそれとは独立した、炎症性刺激のレベルが上昇していることであると思われる。実際、複数の証拠が、免疫炎症細胞は、血管新生、癌細胞の増殖、浸潤を促進することができるため、腫瘍の成長を積極的に促進する可能性があることを示している(16)。したがって、癌に対抗するための積極的な反応は、腫瘍の成長、浸潤、転移を促進するという逆説的な効果をもたらす(105-108)。重要なことは、炎症が新生物の進行の最も早い段階で明らかになり、初期の新生物を本格的な癌に発展させることができることである(107,109)。炎症細胞は、近くの癌細胞にとって活発に変異原となる活性酸素を放出し、悪性度を高める方向に遺伝子の進化を加速することができるからだ(106)。例えば、メラノーマでは、紫外線の照射によりケラチノサイトからHMGB1タンパク質が放出され、これが好中球を引きつけて活性化し、血管新生因子の産生を誘導する(110)など、ストレスや壊死を起こした細胞が、炎症細胞を引きつけて腫瘍に対する上記の促進効果をもたらす分子の源になる可能性がある。炎症性細胞の浸潤がなくても、他の細胞が同じように炎症性メディエーターの産生を維持できるのであれば、同じ効果が得られる可能性がある。これは、組織内に老化細胞が蓄積している場合である。細胞の老化は、DNAに損傷を受けた細胞が細胞老化に入り、増殖を止めることができるため、腫瘍化を阻止するための有効なメカニズムである。しかし、前述のように、老化細胞はメタロプロテアーゼや血管新生因子を含む炎症性分泌表現型(SASP)(111)を持つことが特徴的である。これらの因子の多くは、癌細胞の悪性および転移性の特徴を獲得することに寄与しうる(112)。したがって、抗腫瘍性のメカニズムの発生は、逆説的にSASPによる前悪性腫瘍細胞の腫瘍性転換を促進することになりかねない(13,14)。実際、老化は、老化細胞の除去がうまくいかなかったり、老化細胞の数が増加したりすることにより、老化細胞の蓄積を特徴とすることが知られており、それゆえ、SASPは炎症老化の主要なドライバーであると考えられている。SASPは、DNA損傷応答と炎症性サイトカインの合成を誘発し、自己増幅ループを形成する。このため、炎症は、高齢者に見られるがんの発生と進行の増加の実質的な原因となり得るという提案につながった(113)。
したがって、(幹細胞ニッチレベルでの)炎症現象は、がん発症の危険因子となりうる。炎症は加齢とともに増加するので、がんと老齢の関連性を説明できるだろう。このことは、骨髄増殖性新生物(MPN)を例に挙げることができる。MPNは、造血幹細胞/前駆細胞(HSPC)の後天的な加齢に伴うクローン性障害である。MPNは、生体内で活性化した白血球から炎症性物質が放出され続けることにより、慢性的な炎症状態にあることが特徴である。この慢性炎症状態は、悪性HSPCsと非悪性/悪性微小環境の両方に影響を与え、おそらくMPNのイニシエーションやクローン形成に大きく寄与している(114,115)。この炎症性微小環境は、MPN発症の重要な要因である。なぜなら、ストローマ細胞は悪性造血幹細胞によってプライミングされ、その結果、ストローマは悪性細胞を育成し保護するための好ましい微小環境を作り上げることが強く示唆されているからである(116)。
炎症反応の古典的な構成要素の中で、IL-6は重要な位置を占めている。IL-6が癌細胞の悪性表現型の獲得に向けた進行を促進すること(15)、IL-6シグナルの遮断が生体内試験で腫瘍の進行に強い影響を与え、腫瘍と転移前のニッチの両方で血管新生、線維芽細胞の浸潤、骨髄抑制細胞の動員などの腫瘍支持性の間質機能に広く干渉することが証明されている(117)。
全体として、炎症とがんは厳密に関連しており、炎症ががんの発症と進行に関与していることは広く認められている。炎症は人間の老化にほぼ共通して見られる現象なので、もし被験者が長生きできたなら、その人ががんになる確率に及ぼす炎症の影響は非常に重要になるという仮説が成り立つ。同様に、60歳でがんになった人は、(炎症に関する限り)かなり高齢の人と同等であると推論できるので、がんはある程度、老化が加速された結果であると推測される。この仮説をさらに裏付けるように、ウェルナー症候群や失調性毛細血管拡張症のような早期老化の多くの症候群は、悪性腫瘍の発生頻度が高いことも知られている(118,119)。一方、百寿者(生物学的に年代より若いと考えられる)は、がんで死ぬことはほとんどない(120)。もちろん、炎症以外にも多くの要因が悪性化に関与している。しかし、この魅力的な仮説は、確かにさらなる研究に値する。
神経変性疾患
アルツハイマー病(AD)およびPDは、世界で最も一般的な神経変性疾患である(121)。これらの疾患は加齢に伴い発症し、多くの場合、臨床症状の前に長い前駆期があり、その後の進行により、特に記憶障害、方向感覚の問題、用を足すことの困難さなど、同様の症状を伴う認知症の徴候が現れる。ADとPDは、脳の特定の部位に不適切に折り畳まれた修飾タンパク質の沈着が検出されることから、「タンパク質のミスフォールディング」疾患と呼ばれている(122-124)。ADの場合、これらの沈着物にはβ-アミロイド蛋白と過リン酸化タウ蛋白(タウP)が含まれ、それぞれ細胞外プラークと細胞内線維性絡まりを形成する(125)。PDの場合、主に黒質のドーパミン作動性ニューロンや脳の他の領域にα-シヌクレインタンパクが蓄積して、レビー小体と呼ばれる沈着物が形成される(126)。ADとPDの両方において、神経変性過程は一般に神経炎症を伴っている(127)。
アルツハイマー型認知症
ADの明確な診断は死後にしか下されず、有効な疾患修飾療法は今のところ存在しない(128)。生きている患者について、ADは認知テストと神経生物学的マーカー[脳画像、アミロイドβAbeta42(Ab)レベルの低下および/または脳脊髄液中の総タウPおよび高リン酸化タウPの増加]の組み合わせによって診断される(129)。これらの組織変化は臨床症状の発現に数年先行し、ADの神経病理学的病変が認知的に正常な高齢者のサブセットで見られることを示唆している(130)。このことは、(1)AD認知症には老人性アミロイドβ(Aβ)プラークが関与しているが、シナリオはより複雑で、他の(主要な)ドライバーも関与している、(2)神経変性AD認知症と認知症のない脳老化の間には連続性がある、ことを示唆している。ADの病態に関する現在の概念整理とアミロイドカスケード仮説の限界は、2015年に発表されたNature Neuroscienceの2つの論文によくまとめられている(131,132)。実際、ADの病態では、酸化ストレス、ミトコンドリア機能障害、神経炎症、プロテアソーム活性の低下(10)、細胞機能の基本機構(オートファジーやDNA損傷応答)の調節異常など、他の多くの潜在的に有害な現象が起こり、その一部は老化プロセスと共通している。多くの場合、これらの現象は、Aベータの沈着や神経原線維の変化とすぐには結びつかない。特に、ADにおける神経炎症は、常在細胞(ミクログリア、アストロサイト、ニューロン)だけでなく、脳内に侵入する末梢免疫系の細胞や可溶性因子も関与している(133)。この点に関して、炎症は神経炎症と神経変性の発生を刺激する可能性がある(134,135)。この効果は、血液脳関門に入ることができる可溶性メディエーター、つまり本質的にサイトカインによるものであり、そのネットワークはADにおいて狂うことがある(136)ため、末梢炎症マーカーの評価は、治療アプローチの有効性のモニタリングにおいて考慮されるべきものである。メタアナリシスでは、IL-6、TNF-α、IL-1β、TGFβ、IL-12、IL-18、IFNγの血清レベルの上昇がADの特徴であることが示された(7)。興味深いことに、IL-6は血液脳関門に入ることができ、記憶の定着に関与している(137)。炎症性サイトカインであるIL-1βとTNF-αは、長期増強維持に対してシナプス特異的な変動効果(阻害または支持)を発揮する(138)。また、IL-1βおよびTNF-αとIFNγとの併用は、β-アミロイド前駆体タンパク質(βAPP)の代謝の変化により、β-アミロイドペプチドの産生を誘発し、ADの病態を悪化させることが示された(139,140)。
ADに罹患した細胞では、抗酸化系と酸化系の活性のバランスが狂っている。酸化ストレスマーカーの上昇は、AD患者の末梢リンパ球から単離されたミトコンドリアにも認められる(141)。ミトコンドリアDNA(mtDNA)の遺伝的変異もまた、AD発症と関連している(142)。AD患者は、RNA(8-ヒドロキシグアノシン)(8)とDNA(8-ヒドロキシ-2′-デオキシグアノシン)の両方について酸化ストレスのマーカーの血球における著しい増加、および抗酸化防御のかなりの減少によって特徴づけられる(9、143、144)。さらに、酸化されたタンパク質や過酸化脂質の生成物も高いレベルで認められる。特に、AD患者の末梢血では、リポ蛋白の酸化の程度が著しく増加していることが観察された(145)。好中球は、炎症部位における活性酸素の主な産生源である。ADの発症に好中球が関与している可能性があることが証明されている(146)。神経細胞における酸化ストレスは、DNA損傷反応を引き起こし、アポトーシスや細胞老化を引き起こすこともある(11)。加齢に伴う脳の炎症に関与している可能性があるのは、細胞老化であり、おそらく複製能力のあるグリア細胞で起こっているのであろう。いくつかの研究室からの最近の報告によると、老化細胞は哺乳類の脳で検出可能であり、炎症性SASPや神経イオンと代謝の恒常性を維持する神経細胞とグリア細胞の構造的・機能的相互作用に必要な細胞間連絡を破壊することによって神経変性過程に寄与する可能性がある(147,148)。老化マーカーは、最近、剖検されたヒト脳組織のアストロサイトに存在することが報告された。p16INK4aおよびSASP因子MMP3はともに年齢とともに著しく増加し、年齢を合わせた非発達対照群と比較してアルツハイマー病患者の患部皮質脳組織ではさらに高い値を示した(149)。
腸と脳は、腸脳軸を通じて相互に深く関連している(150)。CNSからの入力は腸の機能を修正することができ、腸からCNSへの入力は特定の症状を修正することができる(151)。これらの双方向コミュニケーションの変化は、神経炎症および中枢神経系疾患の病因に寄与する可能性がある(152)。特に、腸内細菌叢の変化は炎症性サイトカインを活性化し、腸管伝染性を増加させ、ADとも関連するインスリン抵抗性の発症につながる可能性がある(12)。さらに、腸内細菌叢の細菌は、アミロイド、リポ多糖、その他の微生物滲出物の免疫原性混合物を周囲の環境に排泄することが知られている(153,154)。細菌のアミロイドは神経変性やAD発症に関与するシグナル伝達経路を活性化し、腸内細菌叢はAbの脳内蓄積に対する炎症反応を促進する可能性がある(155)。また、腸内細菌叢の他に、口腔内細菌叢がADを含むいくつかの病態に関与していることも興味深い。加齢により口腔内の嫌気性菌が増殖し、口腔上皮による強力なTNF-α反応が誘発される可能性がある(156)。ADの脳では、認知的に正常な対照群と比較して、口腔内の嫌気性菌の存在が7倍も高いことが判明している(157)。さらに、マウスモデルにおいて、細菌とAD様神経変性の因果関係が示されている(158)。
パーキンソン病
パーキンソン病は、αシヌクレインタンパク質の不適切な蓄積により黒質のニューロンが選択的に失われることで発症し、運動機能に異常をきたす。このように一見非常に特殊な原因であるにもかかわらず、PDは実際には通常の老化と同じ特徴を持ち、脳内の特定のニューロンや他の多くの解剖学的部位に影響を及ぼす、分節化した加速老化と考えることができる。まず第一に、PDの特徴は、PDの臨床的徴候のない高齢者にも認められる(159)。毎年パーキンソン病の評価を行っている2,500人の老人を対象とした研究では、このうち744人がPDと診断されずに死亡した(死亡時の平均年齢:88.5歳)ことが示された。(i)約3分の1の症例に軽度あるいは重度の黒質神経細胞喪失があり、(ii)約17%にレビー小体があり、(iii)10%の脳には黒質神経細胞喪失とレビー小体の両方が認められた(160)。このように、この疾患においても、生理的老化と神経変性加齢性運動障害との間には明らかな連続性がある。
最近のデータでは、老化細胞の蓄積、炎症、伝播現象など、老化とPDは基本的な特徴を共有していることが示されている。パーキンソン病患者の脳には老化細胞や炎症細胞(アストロサイト)が存在することが報告されており(23)、「プリオン病としてのPD」の病態に関して、病的タンパク質凝集体(α-シヌクレイン)の細胞間伝播が起こり、神経細胞障害や神経炎症がプリオン的に広がるという「伝播仮説」が提案されている(161)(162,163)。神経細胞の変性によって放出された凝集したα-シヌクレインは、PDにおいて強い炎症反応を誘発する内因性トリガーとして作用する(164)。同様の伝播現象は、β-アミロイドやアルツハイマー病でも報告されている(165)。
ビタミンD不足と関連する疾患のリストにPDを含めるべきであり、パーキンソン病患者のビタミンDレベルを定期的にモニターすべきであることを示す証拠が増えつつある(166)。最も先進的で魅力的な仮説の1つは、環境ストレスがグリアの細胞老化を促進し、脳内に慢性的な炎症環境を作り出すことによって、加齢に伴う神経変性に寄与しているというものである(167)。この観点から、脳と腸内細菌叢の間には双方向の軸が存在し、重要なことは、腸内細菌叢が様々な神経伝達物質(セロトニン、ドーパミン、ノルアドレナリン、GABA)の産生や、行動および中枢神経系機能の調節に関与していることである(168,169)。最近の研究では、PDは腸内細菌の異常と関連しており(24,170)、パーキンソン病患者の糞便中の短鎖脂肪酸濃度は対照群と比べて著しく低下しており、この低下はCNSの変調に影響を与え、PDの胃腸の運動障害に寄与している可能性がある(171)。PDのマウスモデルでは、腸内細菌叢が運動障害とミクログリア活性化のキープレイヤーであることが実証されている(172)。
加齢とPDの関係はまだ明らかではないが、その深遠な関係に基づいて、PDのマイクロバイオームに関するこれらのデータは、健康な加齢の間に腸内細菌叢で起こる変化を背景にして解釈されるべきものである。これは、百寿者の血清中に見られるトリプトファン(セロトニンの前駆体)の減少(32、176)と一致し、トリプトファン代謝経路に関与する細菌が年齢とともに増加するため(175)、炎症に関与し(174)、脳に大きな影響を与える可能性があることが最近明らかにされた(173)。加齢に伴うディスバイオーシスは、神経機能の低下に関与し、生理学的および病理学的な認知機能の低下に極めて重要な役割を果たす炎症(177)を促進することが、多くの証拠から示されている(25)。腸内細菌叢は、食事由来の必須アミノ酸であり、血液脳関門を通過して中枢神経系のセロトニン合成に寄与するトリプトファンの代謝を調節して、脳機能の調節に寄与している(25)。加齢に伴う変化は、扁桃体、海馬、前頭葉皮質でより顕著に見られる。これらの脳領域の機能は、セロトニン神経伝達に強く依存しており、トリプトファン腸内細菌叢存性代謝の変化が関与している。セロトニン系の変化は、高齢者においてしばしば観察される睡眠、気分、性的伝導の変化や、糖尿病、心血管疾患などの他の疾患の共通項を表している可能性がある(25)。トリプトファンはキヌレニン経路(KP)でも代謝され、ニコチンアミド・アデノシン・ジヌクレオチド(NAD+)(168)、キノール酸、キヌレン酸の産生につながる可能性がある。これらの後者の化合物は、CNSおよびENSのN-methyl-d-aspartate(NMDA)およびα7ニコチン性アセチルコリン受容体に作用する神経活性代謝産物である。CNSでは、キヌレン酸は神経保護作用があると長い間考えられてきたが、キノリン酸は主に興奮毒性NMDA受容体アゴニストと考えられている(178)。
KPの変化は、PD(および他の神経変性疾患)において評価されている。パーキンソン病患者は対照群と比較して血清および髄液中のl-キヌレニン/トリプトファン比が高く、トリプトファンをキヌレニンに異化する酵素(すなわち、インドールアミン2,3-ジ・オキシゲナーゼおよびトリプトファン2,3-ジ・オキシゲナーゼ)の活性が上昇することが示唆される。また、3-ヒドロキシキヌレニンのレベルは、パーキンソン病患者の被殻、前頭前野、黒質pars compactaで増加することが分かっている(179)。
PDと歯周病が関連するにもかかわらず、PDにおける口腔内細菌叢の役割に関するデータはほとんどない。最近の論文では、パーキンソン病患者の口腔内細菌叢が対照群と異なることが、β多様性および存在量の差異分析により評価された。また、男女間の差も検出され、男性では日和見的口腔病原体を含む分類群の存在度が高いことがわかった(180)。
その他の病態RA、変形性関節症(OA)、骨減少症、黄斑変性症など
RA、乾癬、強直性脊椎炎、OA、全身性エリテマトーデス、多発性硬化症、炎症性腸疾患、尋常性天疱瘡などの慢性炎症性疾患(または自己免疫疾患)は、免疫系の活性化、自己エピトープ、環境関連変数、遺伝子構成に大きく依存する炎症要素を共有していることがよく知られている。本総説では、最近、多くのデータが蓄積されてきた骨関節疾患と黄斑変性症に焦点を当てる。これらのデータは、疾患の連続的な進化を促す慢性炎症プロセスに収斂している。骨関節疾患の中でも高齢者発症のRAは、通常60-65歳以上の高齢者に発症する。RA発症の主役は、活性化T/B細胞、マクロファージ、線維芽細胞で、滑膜炎や組織破壊に重要な役割を果たす炎症性サイトカインを産生する。特に、TNF-αとIL-1βは、滑膜の増殖を促進し、MMP、他の炎症性サイトカイン、接着分子の分泌を刺激する主要なサイトカインの一つである(181)。近年、死細胞から放出されるHGMB1は、RAGE、TLR2、TLR4と結合し、NF-κBを活性化してIL-6などの下流サイトカインの発現を誘導し、局所および全身の炎症の媒介者として注目されている(27,182)。重要なことは、TNF-αとIL-1βの両方が炎症性サイトカインプロファイルに含まれていることであり(183)、HGMB1はこのプロセスを促進する分子の一つであると仮定されている(40)ことで、炎症性はRAの病因に関わる追加補因子となり得ることが示唆された。
さらに、科学者たちは、歯周炎とRA発症の間の密接な分子関係を指摘した。シトルリン化エピトープの数の増加は、ペプチジルアルギニンデイミナーゼ、抗シトルリン化タンパク質抗体が認識するシトルリン化エピトープを生成する酵素を発現できる特定のヒト細菌(Porphyromonas gingivalis)によって生成されると考えられている。両疾患とも、ごく最近レビューしたように、炎症性サイトカインによって煽られる慢性炎症、結合組織の破壊、骨浸食が関与している(26)。したがって、好中球からの損傷関連分子パターンの放出などの他のメカニズムが、局所的および全身的な炎症を加速し、また、加齢に伴って発生する可能性があり(40)、関与する分子/マーカーのネットワーク構造と伝播メカニズムが明らかにされている。
加齢はまた、関節症の主要な危険因子であり、免疫系の関与なしに軟骨の表層部の破壊から始まり、軟骨の侵食と骨のリモデリングを進行させ、障害を引き起こし、QOLを低下させる。HMGB2の発現は、正常な成熟ヒト関節軟骨の表層部の細胞に特異的に限定されており、重要なことに、ヒトやマウスの関節加齢により、HMGB2の発現が失われる一方、ヒトのOA罹患軟骨では、正常軟骨と比較してHMGB1の発現が増加する結果になている(184)。HMGB1の局所的あるいは全身的な炎症への寄与は、先に述べたように自然免疫受容体を介し、ケモカイン、特にIL-8の産生による炎症状態の亢進につながる(185)。さらに、細胞の老化、ミトコンドリア機能障害や酸化ストレス、オートファジーの減少に伴うエネルギー代謝障害、細胞シグナルの変化など、炎症に関与する多くの分子および細胞メカニズムが、最近、OA発症にも寄与するプロセスとして注目されている(21)。これらのプロセスは、炎症性、異化性状態を促進し、細胞死に対する感受性を高め、関節組織の破壊の増加と損傷したマトリックスの修復不全につながるものである。
骨減少症は、加齢だけでなく、様々な急性炎症性疾患と密接に関連し、一時的な骨再吸収を引き起こす疾患である。この過程が長期間続くと(22)、骨量の低下や骨粗鬆症を引き起こす可能性がある。実際、骨量減少は慢性炎症性疾患(186-192)や、最近報告されたサルコペニアのような他の疾患や症候群に典型的である(30)。すなわち、TNF-αやIL-6のような破骨細胞形成促進性の炎症性サイトカインのレベルの上昇、性腺ホルモンや副腎アンドロゲンのような骨同化因子の減少である(193)。C反応性タンパク質の増加は、骨粗鬆症による骨折率の上昇と関連しており(194、195)、炎症マーカーの循環レベルは、高齢者の骨密度および再吸収の変化を予測する(196)。
加齢黄斑変性症(AMD)は、非常に一般的で、多因子性、多遺伝子性で複雑な網膜変性疾患である。現在では、炎症、インフラマソームの活性化(20)、免疫系がAMDの発症に重要な役割を果たすことが広く認められているが(197)、最近では、炎症がAMDの発症に重要な寄与をすることが提唱されている(198-200)。さらに、AMDの発症におけるタンパク質の恒常性、オートファジー、プロテアソーム、熱ショックタンパク質(HSP)の相互作用とクロストークについては、ここ数年、ますます研究が進み、最近、総説が発表されている(201)。網膜色素上皮におけるタンパク質分解経路のゲートキーパーとしてのHSPの役割と、HSPを介したシャペロン機能の破綻がオートファジー制御、酸化ストレス誘発損傷の蓄積、タンパク質凝集およびリポフスチン生成に与える影響についても、炎症プロセスや不十分な組織修復と同様にレビューされている(202)(203)。
加速する老化を特徴とする遺伝的症候群 DSを中心に
老化の促進を特徴とする遺伝的症候群では、正常な老化に関与する同じ分子機構が、同様の、しかしより早熟で激しい変化の影響を受けるはずである、と推論することができる。実際、下顎骨形成不全(MADA、MADB)(204)、ウェルナー症候群(4)、ハッチンソン-ギルフォード早老症(2)など、これらの症候群は、患者に見られる老化表現型が通常のものと重なるのか、むしろ特異的な特徴を持つのかを理解するための熱心な研究対象になっている。ここでは、知的障害の遺伝的原因として最も多い、21番染色体の一部または全部がトリソミーであるDSを取り上げる。DS者の平均寿命はこの2世代で劇的に伸び、1988年には、生後間もないDS者の約44.4%が60歳まで、13.6%が68歳まで生存すると計算された(205)。その10年後、平均死亡年齢は55.8歳であった(206)。現在では平均寿命の中央値は約60歳であり(207)、近い将来さらに延びると予想されている(208)。このように平均寿命がかつてないほど延びたことと、加齢に伴う障害が早期に発生したことにより、DS患者の高齢化という全く新しい現象が生じた。実際、臨床的および実験的な知見から、DSは、特に神経系に関する限り、早期老化症候群と見なされなければならないという概念が支持されるようになった。
認知症は、移動制限、視覚障害、てんかんとともに死亡率に関連する最も重要な障害であるため、成人のDS患者の健康問題に最も関連すると思われる。さらに、知的障害の程度と施設入所が死亡率に関連している(209)。50歳になると、DS患者では、アミロイドβペプチド(Aβ)を含む老人斑の沈着、高リン酸化タウPからなる神経原線維変化、コリン作動性およびセロトニン作動性の低下など、ADの典型的な神経病理的特徴が現れる(210)。しかし、認知機能低下の兆候はもっと早くから現れ、35〜40歳ですでに検出可能である(5,211)。これは、APP遺伝子が21番染色体に位置していることが少なくとも一因であるが、エンドソーム・リソソーム経路やオートファジーなど他のメカニズムも関係していると思われる(212)。老化の過程で起こることと同様に、DS患者の細胞では、リソソームの酸性化やプロテアーゼ活性の低下により、オートファジー(特にマイトファジー)が低下している(212,213)。
DS患者において早期の老化の影響を受けるもう一つの主要なシステムは、免疫系である。実際に成人のDS患者では、免疫系の正常な老化過程をほぼ再現するような一連の変化が見られる。特に、NK活性の低下(214)、Tリンパ球のテロメアの侵食(215)、血液白血球の分裂刺激に対する反応の低下(216)、自己免疫障害のリスクの増加(217)、TおよびBリンパ球の数の減少(218)である。しかし、これらの正常な免疫老化との共通点は、免疫系の早すぎる老化ではなく、DSに典型的な内在性免疫不全と解釈されることもある(218)。正常な免疫老化とのもう一つの顕著な共通点は、DSのPBMCで観察されるサイトカイン産生の炎症性プロファイルであり、IFN-γ、TNF-α、IL-2の産生の増加(219)、IL-6、IL-10、TNF-α、メタロプロテアーゼのプラスマレベル上昇(220)である。これは、老人の炎症老化の現象に強く似ている(39)。
ダウン症は、ミトコンドリア機能障害による酸化的負荷の増加など、他の典型的な加齢に伴う変化を示すが(221)、最近、この欠陥は、転写活性化因子PGC-1aに作用してミトコンドリア生合成を再開できる薬であるメトホルミンによる治療によって部分的に回復することが明らかにされた(222)。
全体として、これらのデータは、DSが、身体の恒常性を維持するための少なくとも2つの主要なシステム、すなわち神経系と免疫系が、通常の老化で起こることをほぼ再現した早期の衰弱によって影響を受ける、分節的な症候群であることを示唆している。この考えは、生物学的年齢のマーカーに関する研究によってさらに裏付けられた(次項参照)。特に、DNAメチル化年齢とGlycoAgeTest(下記参照)という、生物学的年齢に確実に相関する2種類のバイオマーカーを用いて行った解析では、1.DS患者の組織は、平均7歳年上の人と同じレベルのDNAメチル化によって特徴づけられる(223)、2.GlycoAgeTestとして同定した年齢依存性のN-グリカンは、DS患者では、トリソミックでなく年齢を合わせた兄弟姉妹に比べて加速度的に変化している(224)、ということが示された。
生物学的年齢を示すマーカー
このような背景から、生物学的年齢のバイオマーカーに対する関心が高まっている。生物学的年齢とは、単独で、あるいは機能的マーカーと統合して、年代と相関するだけでなく、同じ人口動態コホートにおいて年代よりも「若い」または「古い」個人を識別することができる、単一のマーカーまたはいくつかの生物学的マーカーの組み合わせによって構成される合成指標を意味する。
このようなバイオマーカーを用いれば、老化の軌跡を描くことができるはずで、「加速」したものは不健康な老化や疾患を予測し、「減速」したものは健康な老化や長寿に関連すると考えられる。加齢の軌跡を描く可能性は、特に、加齢に伴う慢性疾患のほとんどを特徴づける前述の長い潜伏前臨床期間を考慮すると、魅力的で遠大な展望であり、有効な治療のための重要な時間窓と見なされる。生物学的年齢のバイオマーカーは、明らかな臨床疾患を発症するリスクの高い被験者を特定するのに非常に有効であり、その被験者に適した予防治療が大きな利益をもたらすと考えられる。しかし、これらのバイオマーカーは、慢性加齢性疾患を引き起こす加齢に伴う衰弱を支える深い分子メカニズム(7つの柱)の状態については明らかに情報を提供するが、生物学的加齢の加速を特徴とする人々がどのような特定の疾患にかかりやすいかを教えてくれるものではない。従って、生物医学の大きな目標は、それぞれの慢性加齢性疾患のリスクの高い被験者を非常に早い段階で特定することである。現在では、生物学的老化を評価できる新世代のバイオマーカーと、古典的・革新的な生化学的・機能的疾患特異的バイオマーカーを組み合わせることが、疾患特異的な老化現象を同定するための最良の戦略であると考えられている。このような観点から、核およびミトコンドリア遺伝学(体細胞突然変異を除いて安定)とマイクロバイオーム遺伝学(環境に適応しやすい)の相互作用の複雑な結果である各個人の遺伝学に特に注意を払う必要があり、栄養などの基本習慣によって変更可能な遺伝子に焦点を当てる。特に、集団遺伝学と人口動態コホートに関連するいくつかの重要性を考慮しながら、上記の統合バイオマーカー評価と慢性加齢性疾患の既存および新規の遺伝的危険因子を組み合わせることが有用であると予測される(225)。
現在までのところ、臨床的に有効な生物学的年齢のマーカーはないが、ここ数年、多くの有望な候補が提唱されている。ここでは、そのうちの3つ、(i) DNAメチル化マーカー、(ii) N-グリカンマーカー、(iii) 腸内細菌叢バイオマーカーについて説明する。
DNAメチル化マーカー
DNAのメチル化は、数年前から生物学的年齢のマーカーとして中心的な位置を占めるようになった。2005年、Fragaら(226)は、ヒトのDNAメチル化パターンが加齢とともに大きく変化することを初めて明らかにした。ゲノム上の何十万ものCpG部位のDNAメチル化レベルを定量できるマイクロアレイ技術の出現により、この分子の変動と動態に関する知識は劇的に増加した。特に、DNAメチル化は、様々な臨床状態と相関する強力なバイオマーカーの源であることが証明された(227,228)。ヒトをモデルとしたエピジェネティックな研究から得られた最も顕著な結果の一つは、DNAメチル化の方向性(229-231)および確率的(232)な変化が、年代と高い相関を示すことである。これらの観察から、メチル化レベルが年齢と相関する様々なCpG部位の組み合わせから、多くの「メチル化時計」が生み出されるようになった。このような時計の多くは、法医学的な応用として開発され(233-235)、DNAメチル化データから得られる年代推定の精度の高さを浮き彫りにしている。
Horvathが開発した時計(230)、Hannumらによる時計(231)、Weidnerらによる時計(236)である。これまでのところ、HorvathのDNAメチル化時計は、生物学的年齢のマーカーとして最も興味深い結果を示している。これはおそらく、他の2つの時計が血液でのみ検証されているのに対し、唯一、すべての組織に適用可能であるという事実によるものであろう。Horvathの時計は、癌(237,238)、神経変性(239-241)、ウェルナー症候群(242)などDS以外のプロジェロイド遺伝症候群、全死亡(243、244)など多くの異なる老化関連臨床状態において、加速する老化の特徴を把握していることが、多くの異なる研究において証明されている。さらに、この時計は、イタリアの百寿者とその子孫といった人間の長寿モデルにおいて、老化を減速させるサインを示すことができた(245,246)。
しかし、このような生物学的年齢の評価を臨床に取り入れるには、まだ多くの課題が残されている。このような観点から、大規模スクリーニングに適した安価なクロックを得るためには、限られた数のCpGサイトの解析に依存するエピジェネティックな生物学的年齢マーカーの定義に多大な努力を払うことが必要である。実際、HorvathとHannumの時計は、多くのCpG部位(それぞれ353と75)の分析に基づいており、コストが高く、大規模で幅広い用途に使用することは不可能である。
グリコミックバイオマーカー
循環タンパク質の糖鎖シェルを構成するN-グリカン種の相対的な定量化は、信頼性の高いバイオマーカーの豊富な情報源である。血清や血漿から採取された循環N-グリカンの特性は、以下グリコミックスと呼ばれ、肝疾患(247-249)、2型糖尿病(250-254)、リウマチ(255-258)および癌(259-262)などの臨床分野でマーカーとして用いられている。
2011年の研究で、Vanhoorenらは、マウスでも糖鎖パラメータが年齢と相関することを示したことは注目に値する(263)。特に、短命のモデルマウス、すなわち、klotho遺伝子発現欠損マウス(kl/kl)、長命のモデルマウス、すなわち、,このことは、N-グリカンプロファイリングがマウスモデルにおいても生物学的年齢の有望なマーカーであることを示し、老化に関する前臨床研究と臨床研究の橋渡しとなる強力なツールであることを意味している。同じ研究で、著者は、加齢に伴うN-グリカンの変化の基礎となるメカニズムが、肝臓のグリコシレーション機構の障害によるものである可能性が高いことを明らかにした。
Borelliらによる研究(224)は、DS患者(DS)の糖鎖プロファイルの特徴づけを行った。この研究では、著者はDSA-FACEプロトコルとマトリックス支援レーザー脱離イオン化-飛行時間型質量分析計のハイスループット・プロトコルを用いてDSの糖鎖定量を行なった。この2つのプロトコルの組み合わせにより、著者らは初めてDSの特異的な糖鎖シグネチャーを得ることができ、年齢感受性の高いN-グリカン種が、DSでは非トリソミックの兄弟姉妹や母親と比べて加速度的にダイナミクスを示すことが示された。
オランダの家族性長寿モデルに関する研究(264,265)において、著者らは、糖鎖プロファイルが、代謝的健康および心血管イベントと相関する、生物学的年齢の減速の特徴を示したと報告した。
最後に、加齢に伴う糖鎖の変化は、IgGの構造や機能に影響を与えることで、炎症性疾患の一因となり得ることが示唆されている。実際、二アンテナのN-グリカンのアスパラギン297の末端ガラクトース残基を欠いたIgG(IgG-G0とも呼ばれる)は、補体のレクチン経路や食細胞の活性化をより効率的に行い、炎症促進作用を発揮し、その産生量は加齢とともに増加する(266).
腸内細菌叢バイオマーカー
若年成人、高齢者、百寿者の腸内細菌叢を比較すると、腸内生態系の組成と多様性における相互作用の変化は、年齢と線形関係になく、若年成人から70歳までは非常によく似ているが、百寿者では著しく変化していることが明らかになった。このように、腸内細菌叢は人生の第3期から第8期までは安定した状態にあるが(174)、ヒトの宿主と共生して100年経つと、深い、そしておそらく適応的な改造を示すようである。百寿者の腸内細菌叢は、その種の構成において高い多様性を示すことから、別個の集団として際立っている(173)。百寿者では、共生細菌の優占種が減少し、長寿に適応した、おそらく健康を増進する亜優占種(例えば、Akkermansia、Bifidobacterium、Christensenellaceae)の増加によって相殺される(267)。一方、腸内細菌叢ディスバイオーシスは、いくつかの疾患と関連しており、その組成の変化が疾患関連メカニズムに関与している可能性を示唆している(268)。
最近の論文で、生物学的年齢と腸内細菌叢の潜在的な相互作用が取り上げられた。著者らは、生物学的年齢と密接に関連する腸内細菌叢のグローバルな変化と特異的な変化の両方を同定したが、年齢とは関連しなかった(269)。
全体として、エピジェネティック(DNAメチル化)、グリコミック、および腸内細菌叢マーカーは、生物学的年齢の貴重なマーカーであり、有益な老化の軌跡を描くための有望なツールであるように思われる。特に-omic解析から得られる他の多くの分子パラメータは、現在、生物学的年齢のマーカーとして使用可能かどうか評価中である。メタボロミクス(32)、リピドミクス(270)、循環核酸、特にmiRNA(271)と無細胞mtDNA(272)、メタゲノム(176)に関する研究は、健康な高齢者と慢性加齢性疾患の両方で、加齢による複雑な変化を示しており、言及するに値すると思われる。
結論
前節で述べたような複雑なシナリオは、補完的ではあっても、2つの異なるタイプの結論に値し、刺激するものである。前者は生物医学的、分子生物学的な側面、後者は哲学的、社会的、倫理的な意味合いと、ここで紹介する概念化がもたらす問題に直面している。
生物医学・生物学
老化はそれ自体が病気なのかどうかという議論が存在する。ある著者は、生理的老化(あるいは老化)は病理学的なものとあまり区別できないとし(273)、一方、老化は加齢関連疾患やその他の病理学的なものとは異なると主張する(274,275)人もいる。この疑問に対する答えは、老化時計を遅らせることができる様々な戦略が出現していることを考慮すると、理論的にも実際的にも重要な結果をもたらすことを強調しておきたい(276-278)。最も重要な帰結は、老化が病気と同じであることに同意するならば、すべての人間を治療すべき患者と見なす必要があり、この治療をいつ開始すべきかは未解決の問題であるということである。このレビューで要約しようとしたように、老化を引き起こすとされる多くのメカニズムは、慢性加齢性疾患/老年症候群の根底にあることが知られているメカニズムと同じであり、老化の表現型と慢性加齢性疾患/老年症候群は別々のものではなく、おそらく異なる速度で進行する同じプロセスの目に見える結果であるという仮説の裏づけとなる。
このような概念的枠組みの中で、老化の特異な現れである長寿という現象を位置づけるのは、いささか戸惑いがあるかもしれない。長寿は、確かに老化が成功した結果であると考えることができる。では、なぜ同じ分子メカニズムが、一方では老化の成功や長寿をもたらし、他方では老化の失敗や慢性加齢性疾患をもたらすのだろうか?さらに複雑なことに、この総説では取り上げていないが、もう一つ考慮すべき重要な側面がある。女性は高齢になっても生存率が高いことが知られているが、逆説的にQOLが悪くなることが特徴である(279)。実際、女性は多くの慢性加齢性疾患、特に変性疾患の有病率が高く、その結果、身体障害も増加する。したがって、男性と女性では極端な長寿に達するまでの軌跡が異なり、長寿を達成するための量的チャンスも多様で、老化プロセスも男女間で質的に異なっている可能性が高い(280)。また、いくつかの研究により、性ホルモンが宿主と微生物叢の相互作用に関与していることが明らかにされている。実際、「マイクロジェンデローム」という用語は、自己免疫疾患や神経免疫疾患に対する意味を持つ、腸内細菌叢能および組成に対する性ホルモンの潜在的な仲介および調節の役割を定義している(281)。
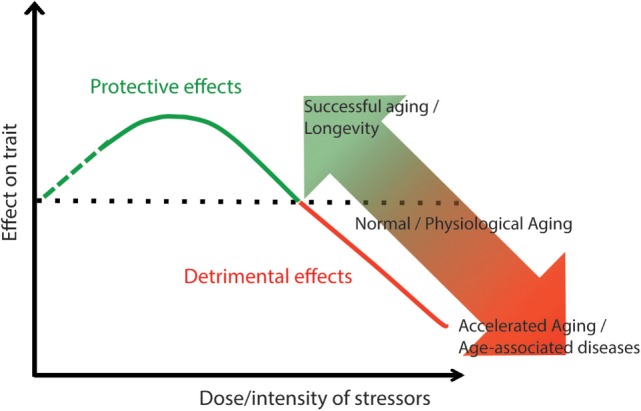
ここで提示された加齢と慢性加齢性疾患s/老年症候群sの関係の全体的な概念的枠組みは、加齢と長寿の包括的な概念化とされるホルミシスの概念にかなり適合している(159,282,283)。ストレス刺激は、その強さによって有害な効果も肯定的な効果も決定することが知られている。ストレスの強度が低ければ、生体システム(細胞、器官、あるいは生体全体)の反応は、ストレスによるダメージを克服する利益を生み出すことができる(283-285)。このパラダイムは、老化現象にも適用することが可能である(図1).ストレス(酸化ストレス、炎症、プロテオスタティックストレス、テロメア消耗など)の強度が、そのストレスによる有害な影響が、生体のストレス反応による適応的、保護的効果よりも高くなる閾値を超えない場合、老化がうまく進む可能性が高い。この仮説の帰結として、ストレスがないと保護作用が発動しない可能性が高いため、ストレスはまったくないより低くてあったほうがよいということになる(286)。また、ストレスに対する反応が有効であればあるほど、許容できるストレスの強さが高くなることも、この仮説の帰結である。もし、自分の反応を「ホルミシスゾーン」(図1の緑線)の範囲内にできるだけ維持することに成功すれば1)、臨床症状や顕性疾患への軌道は遅れる(図(図2A、2A、緑線))。逆に、有害作用が強いと、老化や慢性疾患の発症が加速される(図2Aの赤線)。私たちは最近、適応ホルモンのパラダイムが、炎症性疾患(287)だけでなく、炎症性疾患の有害作用を打ち消す地中海食などのライフスタイルにも適用できることを主張した(283)。

図1 健康な老化と老年症候群(老年症候群s)/慢性加齢性疾患sの連続性を説明する可能なメカニズムとしてのホルミシス
生涯続く低強度のストレス因子は、健康の維持・修復機構を刺激し、健康に良い影響を与える。しかし、ストレスの強度が増すと、臓器やシステムの適応能力を超えてしまい、有害な影響(老年症候群/慢性加齢性疾患)をもたらす可能性がある。
図2 健康な老化と不健康な老化の軌跡。
(A)様々な加齢の軌跡は、それぞれ異なる傾きを持つ線として描かれ、生涯のストレス要因に対する反応と適応の速度に対応し、加速的、正常、または成功した加齢につながり、異なる年齢で慢性加齢性疾患sの閾値に到達する。(B)氷山のメタファーを用いて、健康な加齢と老年症候群(老年症候群s)/慢性加齢性疾患の間の連続性を説明したものである。氷山の隠れた部分は、臨床的な徴候は見られないが生物学的な年齢を示すマーカーが加速される長い潜伏期間を示している。緑の矢印:老化が遅く、老年症候群/ARSを発症しない人、オレンジの矢印:老化が速く、老年症候群を発症する人、赤の矢印:老化が速く、慢性加齢性疾患を発症する人。
図2に描かれた老化の軌跡をより急峻なものにしているのは、どのような決定要因なのだろうか。まず、環境条件(前述のように、ストレス要因の強度と種類)であるが、同時に、おそらく最も重要なのは、これらのストレス要因に対応し、適応するための身体の能力である。この能力は、少なくとも部分的には、個人の遺伝的背景と、適応とリモデリングの多くの現象を媒介するエピジェネティックな変化により決定される。いずれにせよ、老化の進行を支えるプロセスと、それに対応する適応メカニズムの成否には時間がかかり、最終的に臨床的に明らかな慢性加齢性疾患/老年症候群の発症には、現在の技術や知識では特定が困難な、深い/隠れた分子および細胞の変化が何年も何十年も先行して、長い潜伏期間が必要である。この状況は、図2B,2Bの漫画で、健康な状態、糖化、慢性加齢性疾患の連続性を氷山として表現している。氷山の一角は、正常な状態から病的な状態へと移行する、より長いプロセスの(臨床的に)目に見える部分に過ぎない。百寿者のように、高齢になっても慢性加齢性疾患や老年症候群の発症を避け、あるいはほとんど先延ばしにして「健康」を維持している人もいれば(緑の矢印)、老年症候群に移行する人もおり(オレンジの矢印)、大多数は慢性加齢性疾患を発症する(赤の矢印)。このように考えると、「健康な」百寿者でも、加齢に伴う生理的低下や分子傷害の蓄積は免れないが、その進行速度は十分遅く、臨床的に病的な状態を引き起こす閾値以下であることがわかる。CpG DNAメチル化、N-グリカンプロファイリング、腸内細菌叢組成に基づくバイオマーカーは、生物学的年齢と年代を区別し、臨床症状を予測する深い変化を測定するのに、現在最も適切で強力な方法であると私たちは考えている。しかし、個別化医療や精密医療が求めるように、同一人物の様々な臓器やシステムのレベルで加齢速度を評価するためには、さらなる研究が必要である。最後に、先に述べた加齢と慢性加齢性疾患s/老年症候群sに共通する分子メカニズムの他に、さらに基本的なメカニズム(エントロピー障害)を含む深層が存在すると考えられ、今後の検討課題である。
哲学的、倫理的、社会的意義
第二の結論は、医学は老化に対抗するために、一つ一つではなく、一度に多くの慢性加齢性疾患に対抗しなければならないということである。この観点から、この結果を得るための戦略として、以下の2つの可能性が考えられる。
- (A)生活習慣を変え、場合によっては上記のメカニズム(7つの柱とその他かもしれない)の障害に対抗する薬物や医療行為によって、老化速度を遅らせるようにすること。この戦略によって、人々はできるだけ長く健康で活動的でいることができ、慢性加齢性疾患を何十年も、理想的には人間の寿命が必然的に尽きるまで(288)待つことができるようになるはずだ。
- (B)もっと根本的に、人間の組織や臓器、全身を若返らせようということだ。この場合、前述の人間の寿命の限界を超える可能性もある。
倫理的、社会的な観点から、より実現可能であり、受け入れられると思われる最初の戦略(A)、すなわち、平均寿命の伸びと、90歳、100歳以上の健康な人の数の増加が比較的用意されている。ほとんどの人が超長寿になったとしても、生物医学的、社会的にさまざまな問題が生じるだろう。しかし、この戦略は実行可能であり、人々がより長く健康に生き、家族や福祉国家の負担を軽減し、何よりも苦痛や障害、依存を避けることができるという利点がある。
特に社会的、倫理的な観点から、ユートピア、ディストピア、SF小説で取り上げられるような、多くの人々が若返り、長生きするという不気味なシナリオを描く第2の戦略(B)への準備はまだ整っていない。老化と若返りの分野における科学的発見の速度が前代未聞であることを考慮すると、まず一般市民をはじめ、さまざまな分野(経済、人口統計、哲学、宗教、生命倫理など)の専門家を巻き込んだ大規模な討論を開くことがタイムリーかつ緊急の課題であると言える。実際、年齢延長や若返りといったデリケートな話題は、最近まで無視されてきたか、あるいは利用可能な科学的知識が乏しいため、つまり現在および将来の可能性とは比較にならないほど少ないため、概念化されてきた。
著者による寄稿
PG,CM,MaC,AS,AG,DM,MiC,SSは文献を修正し、原稿の様々な部分を執筆した。全ての著者はこの原稿の最終版の批判的修正と承認に貢献した。
利益相反に関する声明
著者らは、本研究が利益相反の可能性があると解釈される商業的または金銭的関係がない状態で実施されたことを宣言している。
付録
病気としての老いの歴史
古代ギリシャに登場し、中世に復興された最初の老化理論は、ヒポクラテスの四体液説(前5)に従って、老齢は生来の熱が徐々に消費され、体の水分が必然的に失われた結果であるとしている。ヒポクラテス(紀元前460年頃〜370年頃)は、すべての生物はある量の生来の潜在的な熱(calor innatus)を持って生まれ、それは自然死に向けて徐々に減少していくとした(289)。
この理論の影響を受けて、アリストテレス(紀元前384-322)の『青年と老年』では、老年そのものをモルバス(病気)あるいはマラスムスとしてとらえている。アリストテレスは、このような不可避の変性過程を表現するために、生命燃料が尽きたランプのイメージを用いたが、この比喩は数世紀にわたって医学文献で広く使われた(290,291)。
老年医学という言葉が初めて登場するガレノス(AD129-AD199)の『De Sanitate Tuenda』は、ヒポクラテス医学とアリストテレスの理論を融合させ、老いを病気として捉えることを避け、むしろ老人の健康は不完全で回復者に相当するものであると述べている。具体的には、老化は個人の過去の経歴、生活習慣、病気によって異なる影響を与える事象であり、一定の食事療法を守ることで老化の到来を遅らせることができるとし、老化は不均質で先延ばしできる過程であるとした(292)。
「老い=病気」という考え方は、古代ローマにもあった。劇作家テレンスの喜劇『フォルミオ』(前161)で老クレメスが自分の苦しみについて「病気は老齢そのものだ」と断言したことや、セネカ(前4年頃-後65)が老齢を不治の病と呼んだこと、キケロ(前106年-後43年12月)の『老生』(291)で「病気に対するように老化に対しても戦わなければならない」ことを論じていることからも、この考えは見て取ることができる。
古典から中世、ルネサンスから18世紀にかけて、「老化は病気である」という考え方と「老化した身体は灯火である」というイメージが、老化研究の大きなテーマとして展開された。
アラブの偉大な医師アヴィセンナ(980-1037)は、ガレンのように、老化や死を病的なものと考えることを拒否し、それらをhumidum radicaleの消費によるcalor innatusの自然な減少の結果として捉えたのであった。実際、彼は老化を遅らせる医学の可能性に懐疑的であり、延命は医学的目標としては適切でないと考えた(293)。中世の最後の世紀には、サレルノとモンペリエの2つの主要な医学部のうち、後者は4つの体液と生来の熱との間の均衡が、遅延し損なわれない老化を楽しむために重要であることに集中した(294)。
興味深いことに、13世紀の作者不明のDe retardatione accidentium senectutis(Roger Bacon,1219-1292)は、老化現象がある特徴(すなわち白髪)と識別できることに気づき、結果として、そのような現象(accidentia senectutis)が思春期に起こるとすれば、それを病気と呼ぶだろうと提案した(291)。
1500年頃までには、老齢の病は文学的な決まり文句となり、ロッテルダムのエラスムスがバーゼルの医師ギリエルムス・コプスへの詩やマルティン・ルターの伝道者の書の解説に見られるようになり、彼が宣言している。「老いはそれ自体病気である」(291)と宣言している。
18世紀、老年期の医療化に最も影響を与えた概念は、ガレノスにまでさかのぼることができる消耗熱や消耗に関連した「マラスムス」の概念であった(295)。老人の衰弱を意味するマラスムスは、一般的な病的状態であり、一時的な病気の影響ではなく、発熱を伴わずに起こる可能性がある。しかし、ドイツの医師ブルクハルト・ザイラー(1779-1843)がその代表的な著作ANATOmia corporis humani senilis specimen(1799)で示したように、ほとんどの老人は加齢や老衰の弱さのために死ぬのではなく、いくつかの病気が累積して相互に影響し合った結果であるということ(291)、この概念は20世紀の多くの主要な老化論に再び現れることになる(289)ことを、この優勢な理論の背景は妨げないようにした。
脚注
資金提供本研究は、CFにCARIPLO-Fondazione Cassa di Risparmio delle Province Lombarde(Rif. 2015-0564)、MCにCARIPLO(Rif 2016-0835)、EU FP7 Project HUMAN: “Health and the understanding of Metabolism,Aging and Nutrition”(grant agreement no.)から一部支援を受けている。602757)およびEU JPND「Adage」からCFへ、EU H2020プロジェクト「Propag-aging」(助成契約番号634821)からCFとPGへ、イタリア保健省「Ricerca Finalizzata」若手研究者(40歳未満)/Giovani Ricercatori番号から、それぞれ助成を受けた。GR-2013-02358026よりASに授与された。