Contents
- The circulating metabolome of human starvation
- 要旨
- 序論
- 結果
- 飢餓は循環代謝物のグローバルなシフトをもたらす
- 図1 飢餓状態では、循環代謝物のグローバルなシフトが起こる
- 飢餓による脂肪酸の動員と異化
- 図2 飢餓による脂肪酸の動員と異化
- 高い二重結合含量を有するTAGおよびCE脂質への飢餓媒介のシフト
- 図3 二重結合含量の高いトリアシルグリセロールおよびコレステロールエステル脂質への飢餓を介したシフト
- 図4 飢餓を介した血漿リン脂質の動態
- 脂肪酸とケトン利用へのシフトの候補ドライバーとしてのアミノ酸サージ
- 図5 飢餓によって媒介されるアミノ酸の動態
- 代謝クラスター解析により、複数の離散的な飢餓状態が明らかになった
- 図6 クラスター分析で明らかになった時間的な代謝物飢餓期
- 適応的飢餓反応のドライバーとしての飢餓誘発性低オレイン酸血症。
- 図7 急性飢餓を介した低オレイン酸血症はコルチゾールの急上昇と関連している
- 考察
- 研究方法
The circulating metabolome of human starvation
www.ncbi.nlm.nih.gov/pmc/articles/PMC6141167/
要旨
ヒトの適応的な飢餓反応は、長期的なカロリー不足時の生存を可能にする。カロリー制限による経路の活性化は長寿を促進する可能性があるが、カロリー過剰の状況では、同じ経路が肥満の原因となる可能性がある。
ここでは、ヒトにおいて10日間の0カロリー断食中に長期的に採取したサンプルの血漿代謝物プロファイリングを行った。
本研究では、糖質から脂質代謝への移行を示すグルコース原性アミノ酸の早期消費と血漿中の非エステル化脂肪酸のその後のサージを含む適応的飢餓の古典的なマイルストーンを同定し、(a)不飽和脂肪酸の優先的な放出と不飽和度の高い血漿脂質種の関連するシフト、および(b)急性飢餓を媒介とする低オレイン酸血症がヒトにおけるグルコースから脂質代謝への移行のドライバーである可能性があることを示す知見を示した。
キーワード:内分泌学、代謝学 内分泌学、代謝
キーワード 糖質代謝、脂肪酸酸化、レプチン
序論
私たちの進化の過去は飢饉の期間によってマークされた。飢餓の期間への応答の調整されたセットの進化は、私たちの生存に不可欠であった。しかし、飢餓の生理学は、公衆衛生への重要な脅威のままパンデミック性飢饉を超えて関連性があるかもしれない(1)。実際、飢餓反応のいくつかの側面が、長寿などのカロリー制限から得られる逆説的な有益な効果を説明しているかもしれない。しかし、長期にわたる飢餓状態を生き抜くヒトの驚くべき能力が適応的なものか不適応的なものかは、文脈に依存しているかもしれない。先進国では現在、栄養過剰と肥満の状態が一般的であるが、これは飢餓状態の間の生存を可能にするのと同じ反応によって悪化している可能性がある。したがって、飢餓の生理を理解することは、肥満のパンデミックの根底にあるメカニズムを明らかにし、長寿に関与する経路を明らかにする可能性がある。
ヒトの飢餓は、グリコーゲン分解とグルコジェネシス(3,4)の初期の期間によってマークされている。断食に入って2-3日目までに、脂質貯蔵庫から放出された脂肪酸が燃料の主要な供給源となる;脂質代謝へのこの重要な移行は、飢餓状態の長期期間中にタンパク質を節約することを可能にする(3)。ブドウ糖から脂質代謝への移行を媒介するホルモンシグナルとは?低インスリン血症、グルカゴン、グルココルチコイドが飢餓時の糖新生の主要なメディエーターであると考えられているが(3, 5-8)、糖新生からケト新生への移行についてはあまり知られていない。げっ歯類モデルにおける最近のデータは、低オレイン酸血症が視床下部-下垂体-副腎(HPA)軸の活性化を促進し、飢餓時の脂質代謝への移行の重要なステップである脂肪組織の脂肪分解(9)の必要なメディエーターである可能性を示唆している。しかし、ヒトの飢餓研究を取り巻く実際的な課題は、モデル生物とヒトとの間の重要な違いと相まって、ヒトにおける飢餓時の代謝を支配する調節機構を取り巻く現在進行中の不確実性を説明している。
全身の代謝過程を反映する循環メタボロームは、飢餓生理学の中でも特に不完全に理解されている側面である。先行研究では、長時間の絶食が代謝産物の小グループに及ぼす影響が実証されている(10)。このことから、大規模な代謝物プロファイリングと臨床表現型を用いてヒトの飢餓反応を再検討し、これまでにないレベルの粒度でヒトの飢餓を特徴付けることができた。我々は,0 カロリー、10 日間の断食を行った個体を調査し、縦断的な代謝物データを提示した。我々は、脂肪酸および脂肪酸異化物、脂質、アミノ酸を含む代謝物のクラスを順番に調べ、絶食中の不飽和脂肪酸および脂質の種の優先的な正のシフトを実証した。次に、代謝物を、代謝物のクラスに依存しない時間的な動態に基づいて分類し、特定のホルモン相関を持つ離散的なクラスタを明らかにした。この偏りのない評価により、ヒトにおけるグルコース代謝から脂質代謝への移行には、飢餓を媒介とした急性の低酸素血症が関与している可能性があることが明らかになった。
結果
飢餓は循環代謝物のグローバルなシフトをもたらす
我々は、10 日間の入院中の健康なヒトボランティアから血漿サンプルを連続的に採取し、極性種と非極性種を含む代謝物プロファイリングを行った(図 1A)。今回の分析には12人の被験者が含まれており、そのうち8人は10日間の絶食プロトコル全体を完了した。4人の被験者は、試験からの自己除去(n = 2)体重減少の程度による試験スタッフの判断(n = 1,7日間の断食を完了)およびベースラインでのトランスアミナーゼ上昇(n = 1)のために早期に中止した。この研究集団のサブセット(11)について以前に報告されたベースラインの臨床的特徴は、補足表1に記載されている(はこの論文と一緒にオンラインで入手可能である;…doi.org/10.1172/jci.insight.121434DS1)。サンプルは、絶食開始の10日前(ベースライン前訪問)絶食訪問のための入院時(ベース)絶食1,2,3,5,7,9,10日目(最終絶食日)の午前中、および再給餌後の午前中に採取された(図1,A、B)。被験者は初期体重の7.0%から11.7%の間で体重を減少させた。試験期間中、351の代謝物がベースラインの測定値から有意に逸脱し(P < 0.05,多重検定で調整)(図1C)292の代謝物が、調整後のP値が0.05未満、対数倍変化が0.5を超えるという、より狭い基準を満たした(図1,C、D)。代謝物の変化は、空腹時2日目以降に特に明らかになった(図1,BおよびC)。脂質代謝物の多様なクラスは、トリアシルグリセロール(TAG)とジアシルグリセロール、脂肪酸、アシルカルニチン、コレステロールエステル(CE)およびリン脂質(PL)を含む、表現された。また、アミノ酸、核酸、胆汁酸の代謝に関連するクラスも表現されている。
図1 飢餓状態では、循環代謝物のグローバルなシフトが起こる
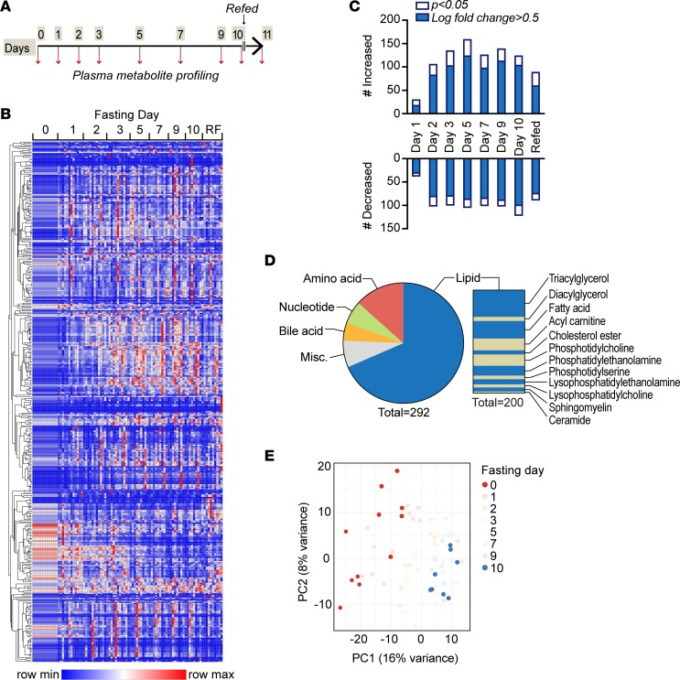
A)ヒト断食プロトコルの模式的な時間軸(0日目、ベースライン日;10日目、最終断食日)。B)空腹時の血漿代謝物のヒートマップ(n = 544)。RF、refed 1日目。C)各時点でのベースライン(0日目)から逸脱した代謝物の数(調整済みP < 0.05)。青色のバー、対数倍変化>0.5でも逸脱したサブセット。(D) C の青いバーで表される代謝物のクラス別内訳を示す円グラフ。 (E) 主要主成分(PC1 および PC2)の主成分分析(PCA)プロット。濃い赤のドットはベースライン、濃い青のドットは絶食10日目、薄い色のドットは中間の時間点。空腹時には、被験者は右下の象限に収束した(紺色のドット)。
次に、2つの主成分を用いて、時間の関数として代謝物プロファイルを調べる主成分分析(PCA)を実行した(図1E)。断食の過程で、被験者はより離散的なクラスタに収束した(図 1E、青のドット)。次に、測定された臨床共変量と主成分との間の相関を検証した。絶食の持続時間や体重減少の程度など、飢餓の持続時間や規模を示す因子は、主成分と相関していた(補足図1)。主成分の最強の生化学的および/またはホルモン相関は、循環ケトンと非エステル化脂肪酸(NEFA)であった。これらのデータは、ケトン体とNEFAを含む共通の適応機構に向けて飢餓を媒介した収束と一致している。
飢餓による脂肪酸の動員と異化
先行研究では、NEFAの上昇を含む、ヒトの飢餓による血清脂質と脂肪酸のグローバルな変化が実証されている(12)。本研究では、個々の脂質および脂質代謝物の解析を行う。我々は、空腹時に介在する個々の脂肪酸の増加を観察したが、それは空腹時2日目までにほぼ一様であり、断食期間中も持続した(図2A)。我々は、脂肪組織のトリグリセリド貯蔵から脂肪酸の脂溶性放出は、脂肪酸のアイデンティティに不可知であるだろうという仮説を立てたが、そのベースライン値に相対する個々の脂肪酸の循環レベルの変化は、脂肪酸種全体で同様であろう場合には。代わりに、我々は二重結合(図2,BおよびC)の増加数の関数として循環脂肪酸のより深遠な増強を観察した。進行性の脂肪酸酸化と一貫して、我々は、様々な長さと空腹時の飽和度の循環アシルカルニチンの持続的なサージを観察した(図2D)。このサージは、短鎖アシルカルニチンとC4:0(OH)、β-ヒドロキシ酪酸(図2E)などのより一般的に測定されたケトン種と相関するケトン体などの最終生成物が含まれている(13)。二重結合含有量の効果は脂肪酸のために観察されるほど強くなかったが、完全に飽和アシルカルニチンの増加はまた、同様の長さの不飽和種に相対的に減衰した(補足図2)。不飽和脂肪酸の優先的なサージは、それらの異化副産物の上昇の方向的に一貫したパターンと結合されたので、これらのデータは、脂質貯蔵庫から不飽和脂肪酸の優先的なリリースと異化フラックスと一致している。
図2 飢餓による脂肪酸の動員と異化
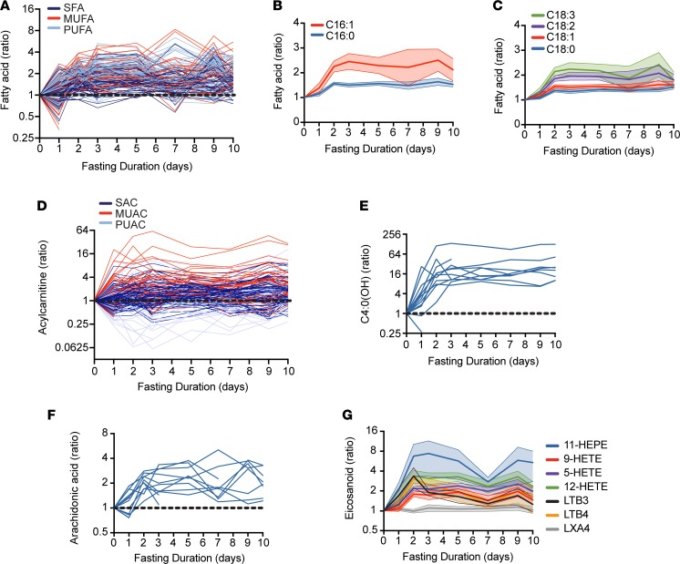
A)飽和(SFA)一価不飽和(MUFA)および多価不飽和(PUFA):飽和度によってグループ化された各被験者のベースライン(破線)に対する脂肪酸のスパゲッティプロット。
B)炭素数16からなる脂肪酸(C16)のベースラインからの平均変化(±SEM)。一価不飽和C16:1は完全飽和パルミチン酸(C16:0)よりも増加している。コロン以降の数字は二重結合数を示す。
C)二重結合数の関数としての脂肪酸レベルの増加を示す、炭素数18からなる脂肪酸(C18)のベースラインからの平均相対変化(±SEM)
D)飽和、一価不飽和、および多価不飽和:飽和の程度によってグループ化された各被験者のベースライン(破線)に対するアシルカルニチンのスパゲッティプロット。
(E) 各被験者のベースライン(破線)に対するC4:0(OH)のスパゲッティプロット。
F)各被験者についてのベースライン(破線)に対するアラキドン酸のスパゲッティプロット。
G)血漿エイコサノイドのベースラインからの平均変化(±SEM)。
燃料を提供することに加えて、アラキドン酸などの長鎖多価不飽和脂肪酸(PUFA)は、エイコサノイドシグナル分子を産生する酵素反応に基質を提供する。他の脂肪酸種と同様に、アラキドン酸(C20:4)を含む循環長鎖PUFAは、空腹時に増加した(図2F)。このサージと一致して、我々はまた、エイコサノイド(図2G)のレベルの増加を観察した。エイコサノイドの増強は、増加した基質の可用性の非特異的な波及効果であるかどうか、または生合成経路の調整されたファスティング媒介の刺激に起因するかどうかは、これらのデータによって明らかにされていない。
高い二重結合含量を有するTAGおよびCE脂質への飢餓媒介のシフト
先行研究では、絶食に伴うTAGを含む血漿脂質の適度な変化が実証されている(14)。我々は以前、このコホートの被験者のTAGを臨床検査用アッセイを用いてベースライン時と絶食終了時に測定し、TAGが増加する傾向があることを発見した(11)。TAGの標準的な臨床検査アッセイでは、総TAGの代理としてアシル鎖加水分解後のグリセロールを測定している。対照的に、ここで使用されているリピドミクスプラットフォームは、TAG、CE、および様々なPLクラスを含む無傷の脂質種を同定することができ、各種は炭素含有量と炭素-炭素二重結合数(不飽和度)によって定義されている(15)。脂肪酸とは対照的に、脂質のダイナミクスは、しばしばクラス内で方向的に不一致であった(図3および4),4)血漿TAGおよびCEを含む(図3)。これらの種は、空腹時の変化の方向に関してはほぼ均等に分かれていたが、二重結合の数と炭素数に依存した顕著なパターンが観察された。二重結合の数が多い(不飽和)TAGは、より飽和したTAGは空腹時に減少する傾向があるのに対し、空腹時に増加する傾向があった。極端なところでは、TAG C60:12は約30倍増加したが、完全に飽和したTAG C44:0は約2倍減少した。離散的で検出可能なCE分析物は少なかったが、二重結合含有量に依存する同様のパターンが現れ、20~22個の炭素と4個以上の二重結合を含むCEではより顕著な増加が見られた。
図3 二重結合含量の高いトリアシルグリセロールおよびコレステロールエステル脂質への飢餓を介したシフト
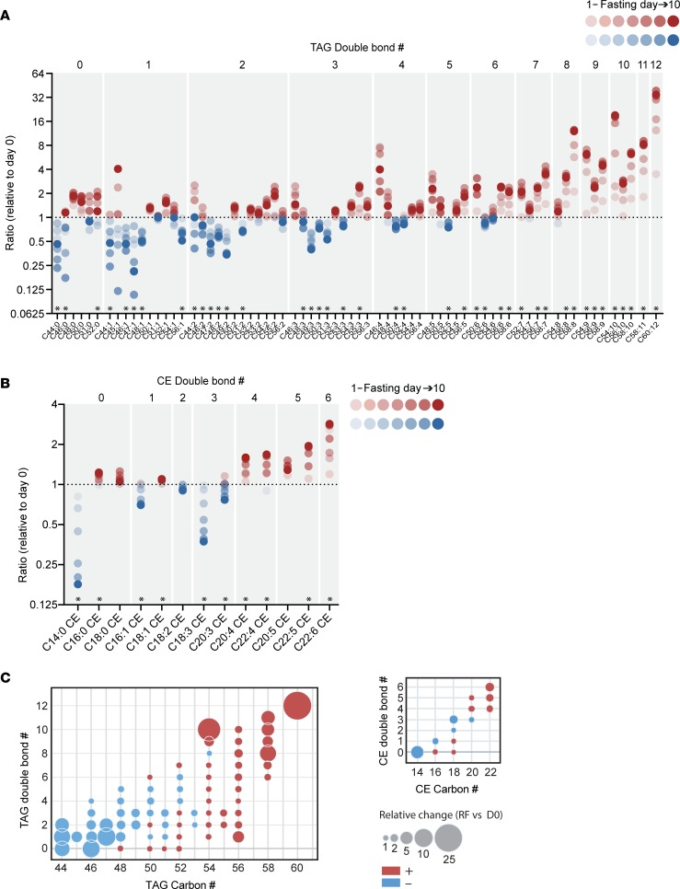
A)各ドットは、ベースライン(破線)に対する平均トリアシルグリセロール(TAG)レベルに対応している。
B)各ドットは、ベースライン(破線)に対する平均コレステロールエステル(CE)レベルに対応する。AおよびB)青のドットは、ベースラインに対する負のレベルを示し、赤のドットは、ベースラインに対する正のレベルを示す。空腹時の持続時間の関数として、ドットは徐々に暗くなる。脂質は二重結合の数によってグループ化されている(上部に示されている)。各二重結合グループ内では、脂質は、炭素数の昇順に並べられている。*P < 0.05,10日目とベースラインを比較(多重比較のための偽発見率調整)。
C)ベースライン(D0)との相対的な再給餌(RF)後の平均TAGレベルと平均CEレベルを表示するバブルグラフ。青色の泡は、ベースラインに比べて低く、赤色の泡は、ベースラインに比べて高くなっている。バブルの大きさは、相対的な変化の程度に対応している。
図4 飢餓を介した血漿リン脂質の動態
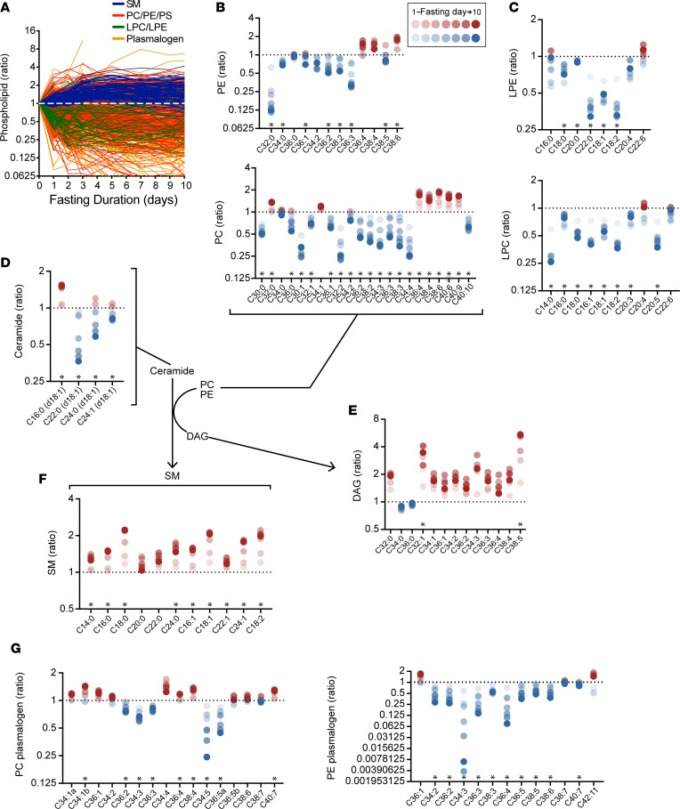
A)各被験者のリン脂質のスパゲッティプロット、リン脂質クラスによって色分けされている。SM、スフィンゴミエリン;PC、ホスファチジルコリン;PE、ホスファチジルエタノールアミン;PS、ホスファチジルセリン;LPC、リゾホスファチジルコリン;LPE、リゾホスファチジルエタノールアミン。
B)ベースラインに対するホスファチジルエタノールアミンおよびホスファチジルコリンの平均値(破線)。
C)ベースラインに対するリゾホスファチジルエタノールアミンおよびリゾホスファチジルコリンの平均値(破線)。リゾホスファチジルエタノールアミン/リゾホスファチジルコリンは、それぞれホスファチジルエタノールアミンおよびホスファチジルコリンからの脂肪酸放出に起因する異化生成物である(B)。
D)ベースラインに対する平均セラミドレベル(破線)これはPCおよびPEとともにスフィンゴミエリン合成の基質として機能する。
E)ベースラインに対するジアシルグリセロール(DAG)レベルの平均値。ジアシルグリセロールはスフィンゴミエリン合成の副産物である。
F)ベースラインに対する平均スフィンゴミエリン濃度(破線)。
G)ベースライン(破線)に対するホスファチジルコリンおよびホスファチジルエタノールアミンプラスミゲンの平均値。B-G)青のドットは、ベースラインに対する負のレベルを示す;赤のドットは、ベースラインに対する正のレベルを示す。ドットは、空腹時の持続時間の関数として徐々に暗くなる。x軸にリストされているリン脂質は、左から右へ二重結合の増加数で順序付けられている。ベースラインと10日目の値を比較する*P < 0.05,(複数比較のための偽発見率調整)。
PLは脂質の第三の主要なクラスである。膜の構造と機能に重要な、PLまたはその誘導体はまた、シグナル伝達機能を果たす可能性があり、それらの脂肪アシル成分は、追加の潜在的なエネルギー源を表している。我々は、PLクラス間およびPLクラス内の両方で、PLの血漿レベルに対する飢餓の発散的な効果を観察した(図4)。多くのホスファチジルコリン(PC)とホスファチジルエタノールアミン(PE)プラスマロゲンは空腹時に減少し、その中には2倍以上のものも含まれてた(PC 34:5,PE 34:2,PE 34:3,PE 36:3,PE 36:4);しかしながら、いくつかのプラスマロゲンは増加したが、ベースラインの2倍未満であったにもかかわらず(図4,AとG)。絶食はまた、異化脂肪酸放出のそれぞれの副産物であるリゾホスファチジルコリンとリゾホスファチジルエタノールアミンの増加に対応することなく、PCとPEの多くの減少につながった(図4,BとC)。多くのPCおよびPEの減少にもかかわらず、高炭素含有量および高度な不飽和度(>4二重結合)を有するサブセットは、TAGおよびCEについて観察されたものと同様に、空腹時に緩やかな増加を示した(図4B)。対照的に、別の脂質クラスであるスフィンゴミエリン(SM)は、空腹時の血漿レベルの一貫した増加を示した(図4,AおよびF)が、これは炭素含有量または飽和度とは無関係であった。
ここで発表されたリピドミクスデータをまとめると、空腹時に介在する循環脂質への影響を包括的に見ることができる。最も一貫性のあるテーマとして浮上したのは、TAG、CE、PC、およびPEで観察されたパターンである、高炭素および高二重結合含量の血漿脂質へのファスティングを介したシフトであった。空腹時に起こった代謝物のシフトのほとんどは、再摂食でベースライン値に収束したが、不飽和で高炭素含有量のCEとTAGへのシフトは再摂食後も持続していた(図3Cおよび補足表2)。
脂肪酸とケトン利用へのシフトの候補ドライバーとしてのアミノ酸サージ
肝臓によるケトン体生産へのシフトは、ヒトが飢餓状態の長期的な期間を生き残ることを可能にする重要な応答を表している。このことから、脂肪酸利用とケトン体生成へのシフトにおける代謝産物の参加者候補を探索する根拠が得られた。我々はまず、以前に測定された血清 NEFA およびケトン(β-ヒドロキシ酪酸)に対する個々の代謝物の相関関係を評価することで、これを探索した(11)。NEFA(n = 62)およびケトン体(n = 57)と有意な正の相関(調整後P < 0.05)が認められた(補足表3)。NEFAと相関した代謝物のサブセットは、それ自体が脂肪酸(62のうちn = 25)であり、したがって、グローバルなNEFA測定の構成要素、またはアシルカルニチンなどの下流の脂肪酸代謝物(62のうちn = 16)であった。ケトンが脂肪酸異化作用の産物であるという事実と一致して、ケトン相関体の多くはまた、脂肪酸異化作用の中間体であった(57中のn = 19)。同様に、ケトン代謝物相関体のうち7つは、ケトン性アミノ酸(例えば、ロイシン)または関連代謝物(例えば、アミノカプロン酸、リジン代謝物)のいずれかであった。多くの代謝物 (n = 25) は、両方のリストに共通していた。この重複の多くは、NEFAとケトンとの間の基質-生成物関係によって説明できるが、いくつかのアミノ酸はこの分類に当てはまらなかった。
先行研究では、ヒトの飢餓状態の最初の数日間の間に、骨格筋を含む組織からのアミノ酸の放出が実証されている(16)。血漿レベル(図2)で方向的に均一なサージになる脂質からの脂肪酸の異化放出とは異なり、アミノ酸測定は、アミノ酸ダイナミクス(図5)の可変パターンを明らかにした、その多くは以前に肥満個体(10)で実施された長期飢餓の古典的な研究によって文書化されている(補足表4)。ロイシン、イソロイシン、バリン、アスパラギン、グリシン、メチオニン、フェニルアラニン、チロシン、リジンが空腹時に増加したのに対し、アラニン、グルタミン酸、グルタミン、トリプトファンを含む他のアミノ酸は、減少した。また、方向性の一致するアミノ酸でも、変化のタイミングに違いがあった。例えば、分岐鎖アミノ酸(BCAA)は1~2日以内に増加したのに対し、チロシン、グリシン、アスパラギン、メチオニン、リジンは5日目頃に急増した。
図5 飢餓によって媒介されるアミノ酸の動態
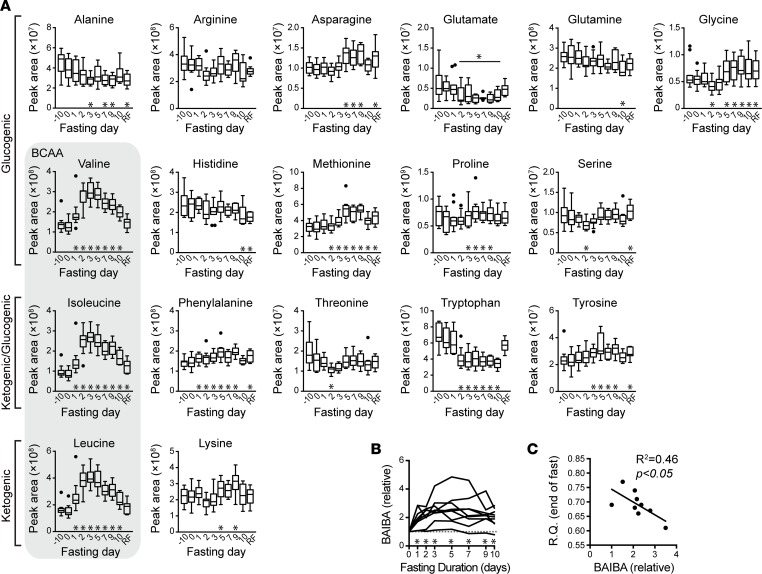
A)アミノ酸のTukeyボックスプロット、それらがグルコジェニックであるか、グルコジェニックとケトジェニックの両方であるか、またはケトジェニックであるかによってグループ化されている。分岐鎖アミノ酸(BCAA)は斜線のボックス内に表示されている。*ベースライン(0日目)との相対的な調整P<0.05の絶食およびリフェッド(RF)の時間点。
B)ベースライン(0日目、破線)に対するβ-アミノイソ酪酸(BAIBA)レベルの各被験者のスパゲッティプロット。*ベースライン(0日目)に対する相対的なP<0.05(多重比較の偽発見率調整)の時間点。C)最終断食日の呼吸器商(R.Q.)と断食中の平均相対的なBAIBAレベルの一変量回帰。
グルコネオジェネシス、ケトジェネシス、またはその両方の基質としての潜在的な利用によって分類された場合でも(図 5A)我々はアミノ酸ダイナミクスの不均一性を観察し、燃料利用だけではない役割を示唆している。
トリプトファンはそのような例の一つである。血漿中のトリプトファン濃度は空腹時2日目までに低下し、その後平準化した(図5A)が、キヌレニン経路のメンバーを含むいくつかの下流のトリプトファン代謝物の増加と一致した(補足図3)。我々は、セロトニン、トリプトファン代謝物とシグナリング分子の有意な増加を見なかったが、空腹時3日目に増加する傾向があった(調整P = 0.07)。トリプトファンなどの必須アミノ酸が、食事によるトリプトファンの摂取がない場合に、これらの経路を優先的に淘汰される可能性があるという事実は、関連する代謝産物の1つまたは複数が、空腹時に重要な調節的役割を果たしているかどうかという疑問を提起している(17-19)。
BCAAは一様な方向性と時間的変化を示し、空腹時発症から1-2日以内に急増した(図5A)。重要なことに、我々は、β-アミノイソ酪酸(BAIBA)(図5Bおよび補足図4)を含む、いくつかの下流のBCAA異化産物の同時増加を観察した、BCAAのサージは、おそらく下流の異化作用のブロックではなく、循環へのリリースの増加に起因することを示唆している。脂肪酸の酸化とケトン体産生におけるBAIBAの役割を示唆する先行証拠を考えると(20, 21)我々はBAIBAがBCAAサージと脂質代謝へのシフトの間のリンクを表すかもしれないという仮説を立てた。本研究では、被験者は断食終了時に間接的なカロリー測定を行い(11)異なる燃料源が利用されている相対的な度合いを示す呼吸商(RQ)の計算を可能にした:脂質およびケトン体利用へのシフトが完全であればあるほど、RQは低くなる。我々は、BAIBA と RQ の間に逆相関があることを発見した(図 5C)。BAIBA がこの燃料利用の移行のメディエーターとして機能しているのか、それとも単に移行のマーカーとして機能しているのかは、今回の解析では判断できない。
代謝クラスター解析により、複数の離散的な飢餓状態が明らかになった
代謝物の個々のクラスを検討した後、次に、グローバルデータセットを公平に再評価することで、これまで評価されていなかった時間的な代謝物パターンが示される可能性を検討した。ベースライン前、ベースライン、飢餓時、再給餌時を含む代謝物データセット全体を入力として使用し、統計的にユニークな 7 つのクラスタを同定した(図 6A および補足表 5)。4つのクラスターは、飢餓を媒介とした減少の時間的パターンを示した(図6A、クラスター4-7)。クラスター4とクラスター7は断食中も継続的な減少を示し、クラスター7は再給餌でベースラインに急速に戻ったことで区別された。クラスター5は、断食の最初の3日間は比較的安定していたが、その後、断食9~10日目まで低下し、その後、再摂食でさらに低下した。クラスター6は3日目に直下型に低下し、その後ベースラインに戻った。空腹時に減少のパターンを示したクラスターは、脂質および脂質代謝物、特に二重結合が少ないものに富み、図3および4.4に示されたデータと一致していた。3つのクラスターは空腹時に相対的に増加するパターンを示した。胆汁酸と不飽和CEからなるクラスター3は、絶食中に徐々に増加した。クラスター1とクラスター2は、それぞれ空腹時3日目と7日目にピークを迎えた。
図6 クラスター分析で明らかになった時間的な代謝物飢餓期
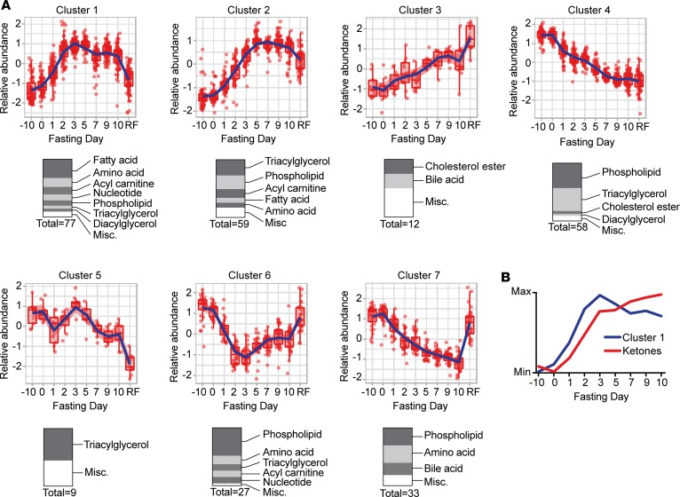
(A) 7 つの代謝物クラスターが、離散的な時間的パターンで同定された。各クラスターの下には、そのクラスターに含まれる代謝物の数と種類が記載されている(補足表5)。B)クラスター1(青)と血清ケトン体(赤)がほぼ一致することを示すグラフ。日目-10,断食開始10日前,0日目、ベースライン日、10日目、最終断食日、RF、再給餌日1。
クラスター1は、空腹時1-2日目の早期増加がケトン体の急増と一致したため、特に注目された(図6B)。さらに、クラスター1はケトン体の基質である脂肪酸、アミノ酸およびBCAAおよびBAIBAを含む関連代謝物に富み、これらは我々の先行解析ではケトーシスおよびNEFAサージの予測因子であった。脂質/ケトン利用へのシフトの程度を示す指標である相対的な BAIBA レベルと RQ(図 5C)との間に観察された逆相関を考慮して、RQ 関連がクラスター 1 代謝物のより一般的な特徴であるかどうかを検討した。全 77 種類の代謝物のうち、BAIBA は逆相関を示した 3 種類のうちの 1 種類であった。BAIBA(R2 = 0.46,P = 0.046)SM(22:0)(R2 = 0.46,P = 0.044)およびγ-アミノ酪酸(GABA)(R2 = 0.58,P = 0.018)である。これら3つの代謝物のうち2つ(BAIBAおよびGABA)は、以前に異なる文脈で脂肪酸の酸化を促進することが示唆されている(20-22)。これらのデータをまとめると、クラスタ1は飢餓の中間段階を示し、初期のグルコース代謝への依存とその後の燃料のための脂質の利用へのシフトの橋渡しをする可能性を提起する。
適応的飢餓反応のドライバーとしての飢餓誘発性低オレイン酸血症。
クラスター解析により、飢餓状態の時間的に異なる段階が明らかになったのであれば、これらの解析結果を利用して、新たなホルモン駆動因子の候補を明らかにすることができると考えられる。本研究で使用したメタボロミクスプラットフォームには、コルチゾールを含む多くのコルチコステロイドが含まれている。コルチゾールは、脂肪組織における脂肪分解の媒介物質として知られている(23)が、空腹時の 1-2 日目に増加した(図 7A)。また、レプチンも測定した。レプチンは、以前にヒトでは初期の飢餓時に減少することが示されているが、長期の絶食時の動態は不明であった(24, 25)。我々は、レプチンの減少を観察した ・最初の日に約50% ・脂肪質量の減少に関連するにはあまりにも急性の効果(図7B)。
図7 急性飢餓を介した低オレイン酸血症はコルチゾールの急上昇と関連している
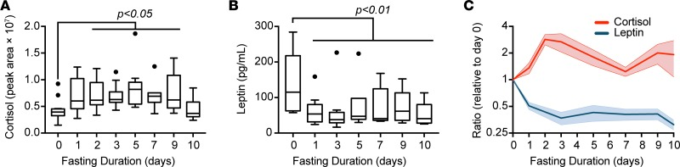
A)メタボロミクスプラットフォームを用いて測定した空腹時の相対コルチゾール濃度。データはTukey box plotで表されている。B)空腹時のレプチン濃度。データはトゥッキーボックスプロットとして表されている。C)コルチゾールおよびレプチンレベルは、ベースライン(0 日目)との相対的な平均 ± SEM で表される。有意性は、ベースライン(0日目)との相対的なP < 0.05(多重比較のための偽発見率調整)に割り当てられた。
コルチコステロイド、レプチン、およびインスリン、グルカゴン、アディポネクチン、T3,FGF21を含む、以前に報告された代謝関連ホルモンの数多くの時間的動態を用いて、図6(補足表6)で同定されたクラスタとの相関関係を試験した。我々はまた、NEFAの放出とケトーシスが適応飢餓の指標であることを考えると、陽性のコントロールとして分析にNEFAとケトン体を含んでいた。ケトン体はクラスタ3を除くクラスタのすべてと相関しているのに対し、実際には、NEFAは、クラスタのそれぞれと有意に相関していた。コルチゾールまたは関連するコルチコステロイドは7つのクラスタすべてと有意に関連していた。インスリンはクラスター6と7と統計的に有意な関連を示したが、グルカゴンはクラスター7と有意に関連していた。興味深いことに、早期にピークを迎えるクラスター1はコルチゾール、コルテゾロン、ケトン、NEFAと正の相関を示したが、レプチンとは逆の相関を示した。げっ歯類における絶食誘発性低オレイン酸血症は、最近、HPA軸とコルチコステロン産生の増加が関与する制御ループに関与していることが示唆されており、これは炭水化物代謝から脂質代謝への適応的なシフトを促進する(9)。げっ歯類の低オレイン酸血症/HPA回路のパラダイムがヒトでも活性化しているとすれば、レプチンの減少はコルチゾールの急増と相関しているのではないかと推論した(図7C)。実際、混合効果3次モデルでは、2つのホルモン間に逆相関が見られた(R = -0.84; P < 0.02)。まとめると、レプチンの急性低下(1日目で約50%)とコルチゾールとの逆相関、および初期に急増する代謝物クラスター1との組み合わせは、ヒトにおける飢餓適応の初期段階での低オレイン酸血症の役割の可能性を示唆している。
考察
ヒトの飢餓への適応について知られていることの多くは、数十年前に実施された古典的な研究(3)に遡ることができるが、この研究では、空腹時の被験者から採取した血液サンプル中の個々の代謝物または代謝物のクラスを生化学的に測定した。このような研究は典型的には、ここで研究されている正常からやや過体重の被験者ではなく、肥満の個人で実施された(10, 26)。循環アミノ酸のダイナミクスを文書化したこれらの研究は、多くの場合、毛細管床をまたいで追加のサンプリングと尿中の窒素含有量の測定が含まれていた、とタンパク質を惜しまず、グルコースから脂質の異化にシフトすることによって、人間がどのように長期的な飢餓状態を生き残るかという現在のパラダイムにつながった。本研究では、健康な被験者を対象に 10 日間の 0 カロリー断食を実施し、血漿中の代謝物をプロファイリングした。血漿は 1-2 日ごとに連続的に採取されたが、これは代謝物の幅とその他のホルモンおよび臨床的共変量と相まって、ヒトの飢餓時の循環代謝物および潜在的な調節因子の最も包括的な縦断的な試験を提供するものである。本研究は比較的少数の被験者を対象としているが、代謝物のシフトは、異なる代謝物プロファイルが収束するにつれて非常に一様であり、共通の適応メカニズムの活性化と一致していた。
すなわち、個々の代謝物を事前定義されたクラスの一部とみなし(図 2-5)動的なアミノ酸の変化(3)や NEFA の一様な急増(27)など、飢餓反応における古典的なマイルストーンを同定したことで、データセットの頑健性が強化されると同時に、新規代謝物の時間的な参照点を提供した。サンプリングの頻度と、個々の脂質種のようないくつかのクラスは、最新の質量分析法によって得られる粒度ではこれまで研究されていなかったという事実によって促進された、このアプローチによる観察を記述する。最も予想外のテーマは、飢餓時の脂質ダイナミクスに対する炭素含有量と水素飽和度の修飾効果であり、高炭素および高二重結合含有量の脂肪酸、TAG、およびCEの優先的なサージによって示された。脂肪酸の効果は、完全に飽和種(28)に相対する不飽和脂肪酸のより迅速なリリースに脂肪分解の刺激が生じることを示す、培養脂肪細胞での先行データによって、部分的には、説明できるかもしれない。さらに、我々は一般的に不飽和アシル基を持っている多くの形質転換体の減少を観察した。この減少はプラスマロゲンの異化を示している場合は、プラスマロゲンのアシル基のリリースは、不飽和脂肪酸の優先的なサージの追加の要因である可能性がある。
脂質貯蔵の動員は、無傷の中性脂質が血漿膜を横断できないため、NEFAの溶血性放出を必要とし、したがって、高炭素および高二重結合含量のTAGの血漿レベルを駆動するメカニズムは、脂質貯蔵の動員のみに基づいて容易に和解されない。循環TAGの2つの主要な供給源は、食事性TAGのカイロミクロンへの消化管リパッケージングと、肝臓によってVLDLにパッケージングされたTAGのde novo合成である。飢餓時に食事源がない場合、肝臓は新しいTAGの最も可能性の高い供給源である。実際、先行研究では、飢餓状態の間、肝臓によるTAG合成の不可解な増加および率直な肝ステアトーシスの発生が実証されている(9,29-31)。脂肪組織からのNEFAの動員は即時の異化ニーズを超えており、したがって、肝臓はde novo TAG合成のために過剰な脂肪酸を捕捉し、その一部は肝臓に保持され、その一部はVLDLを介して循環に放出される。高炭素と高二重結合含有量のTAGのサージは、したがって、肝臓でのデノボTAG合成のための基板としてモノとPUFAの高い可用性を反映している可能性がある。
方向性の異なるアミノ酸ダイナミクスは、血漿中代謝物濃度の正味の変化が、基質供給(細胞内コンパートメントからのアミノ酸放出など)と基質利用(肝臓での取り込みなど)に関与するメカニズムの複雑な相互作用によって決定されるという、より一般的なテーマを示している。先行研究では、ヒトの飢餓状態の最初の数日間に、骨格筋を含む組織からアミノ酸が放出されることが実証されている(16)。このアミノ酸の急増にもかかわらず、アラニンやトリプトファンのようないくつかのアミノ酸は、絶食中に減少する。アラニンの場合、それは純減少は、グルコース原性基質として利用するための肝臓による高取り込みに起因することを侵襲的な動脈および静脈サンプリングを使用して実証されている (10)。これは、我々の研究の重要な制限を強調している:我々は、複数の血管コンパートメントの侵襲的なサンプリングを実行しなかった。しかし、いくつかのケースでは、下流代謝物の分析により、さらなる明確さが得られたり、興味をそそる新しい仮説が提示されたりする。トリプトファンの場合、空腹時のトリプトファンの減少は、キヌレニン経路の代謝物やセロトニンの増加傾向など、いくつかのトリプトファン依存性代謝物の増加と同時に起こった。下位生物におけるセロトニンシグナル伝達とキヌレニン酸を含むトリプトファン依存性経路の調節は、摂食行動の調節と関連している(17-19)。したがって、トリプトファンなどの必須アミノ酸がこれらの経路を優先的に淘汰される可能性があるという事実は、関連する代謝産物の1つまたは複数が、長期的な飢餓への適応時に空腹感を減衰させる上で重要な役割を果たしているのではないかという疑問を提起している。
BCAAの急増は、ベースラインからの追加の顕著なアミノ酸の発散を表し、古典的な研究で観察された効果を確認した(3)。BCAAが分岐異化運命を持っているという事実にもかかわらず ・バリンはグルコース原性であり、ロイシンはケト原性であり、イソロイシンはその両方である ・彼らは、飢餓時のBCAAの血漿レベルが共通の生化学的メカニズムによって制御されていることを示唆し、循環中に一様に急増した。BCAAサージのための1つの可能な説明は、共通の異化酵素の活性が低下している。BCAA代謝には、BCAT酵素によって駆動される共通の近位異化ステップが存在する。マウスでは、BCATの遺伝的機能喪失はBCAAの高レベルをもたらす(32)。しかし、我々は、いくつかの下流のBCAA異化産物もまた、絶食の発症から1-2日以内に急増したことを発見した(図5Bおよび補足図4)BCAAのサージは、むしろ基質利用における下流のブロックではなく、循環への放出の増加に二次的である可能性が高いことを示唆している。我々の研究は、BCAA放出のメカニズムを解明するために必要なトレーサー研究や組織解析を行うようには設計されていなかった。このような研究が行われた場合でも、細胞内の遊離アミノ酸貯蔵量の増加(33)タンパク質の異化作用の増加(34)タンパク質合成のためのアミノ酸利用の減少(35)など、複数のメカニズムが示唆されている。このようなメカニズムは、循環にアミノ酸のより一般的なフラックスを説明することができる。細胞膜を横切る細胞内遊離アミノ酸の移動には、1つ以上のアミノ酸に特異的なトランスポーターの機能が必要であるため、我々は、細胞膜におけるBCAAに特異的なトランスポーターの機能増強が、BCAAの特に顕著な増加を説明しているのではないかと推測している(36)。
TAG(図 3)とアミノ酸(図 5)で明らかになったように、より大きなクラスの中で個々の代謝物のダイナミクスが発散していることから、代謝物のクラスに依存せず、変化の方向性とタイミングだけで定義されたデータを再調査する根拠が得られた。偏りのないクラスター分析の結果、7つのクラスターが明らかになった。方向性、変化のタイミング、および多様な代謝物クラスによる表現の違いにもかかわらず、7 つのクラスターのうち 6 つは血清ケトンと相関し、7 つのクラスターのうち 7 つはグローバル NEFA と相関していた(補足表 6)。一方で、このことは、NEFAとケトン体の急増によって示されるような脂質代謝へのシフトが適応応答の中心であるという概念を補強するものである。もう一つの見方は、これらは飢餓状態のユニークな時間的相を表している可能性があるということである。特に1つのクラスター(図6A、クラスター1)は、ケトンサージに似た早期上昇のパターンを示し、それが炭水化物から脂質代謝への切り替えのバイオマーカーとして見ることができるかどうかという疑問を提起した。クラスター1には、ケトン産生の基質となる個々の脂肪酸に加えて、BCAAや関連する異化産物のような潜在的に生理活性のある代謝産物も含まれており、これらもまた個々にケトンやグローバルなNEFAと関連していた。BCAAシグナルの潜在的な生理学的意義は、血漿BCAAが癌、肥満、糖尿病などの全身的な代謝変化を特徴とする疾患状態のバイオマーカーであることを示す先行の疫学研究によって裏付けられている(37-39)。興味深いことに、BCAAの異化の最初のステップを触媒するBCATの遺伝的に欠損したマウスは、BCAAが著しく上昇しているが、空腹時のケトン体形成が損なわれていることを示している(32)。このことは、ケトン体形成を促進するのはBCAAそのものではなく、下流のBCAT依存性BCAA異化産物である可能性を示唆している。バリン異化産物である BAIBA は、そのような生理活性メディエーターの一つである可能性がある。BCAAAと同様に、BAIBAは早期サージングクラスター1のメンバーである。さらに、空腹時に介在する BAIBA の増加は、脂質代謝への移行効率のマーカーである RQ と逆相関している。BAIBA は他の文脈でも脂肪酸の酸化とケト生成を増強することが示されている(20, 21)。したがって、クラスター 1 は炭水化物代謝から脂質代謝への移行のためのバイオマーカーであるだけでなく、炭水化物代謝から脂質代謝への移行に寄与する BAIBA のようなエフェクターも含まれている可能性があると推測される。
個々の代謝物が生理活性エフェクターとして機能する場合でも、そのような経路は、しばしばホルモンのシフトによって緊密に編成される。例えば、インスリンの絶食に伴う減少は、適応的飢餓状態(6-8)において中心的な役割を果たしており、その一部は、脂肪細胞からの脂肪酸の脂質貯蔵から脂肪分解的放出へのシフトを促進することによってもたらされている(3, 40)。我々は、代謝的に関連するホルモンのパネルと飢餓の特定の段階のマーカーとして提案するクラスタの間の関連性をテストした。脂肪分解を促進することが知られているコルチコステロイドに加えて、いくつかのクラスターとレプチンとの間に相関があり、その中には早期に急増するクラスター1との逆相関も含まれていた。ヒトとげっ歯類を用いた先行研究と一致して、我々は絶食後1日目にレプチンレベルの急激な低下を観察した(24, 25, 41)。レプチンは脂肪細胞によって産生され、脂肪率と相関する可能性があるが、急性変化のパターンは、飢餓を介した脂肪組織の質量の収縮によって説明することはできない。レプチンはエネルギー恒常性の調節因子として広く研究されてきたが、肥満でレプチンが完全なヒトにレプチンを投与しても、体重減少とエネルギー恒常性への影響はほとんどない(42)。したがって、我々のデータは、レプチンの欠如(または低オレイン酸血症)が生理学的に重要であるという新たな概念を支持するものである(43)。これは、ラットを用いた最近の研究で、HPA軸とコルチコステロンによる脂肪分解の刺激が関与するメカニズムにおいて、脂質代謝へのシフトの原因となるドライバーとして、絶食を介する低オレイン酸血症の役割が示されたことによると推定されている(9)。げっ歯類を用いた複数の研究では、レプチンレベルの操作が HPA 軸、特にコルチゾールレベルに影響を与えることが示されているが、HPA 軸が代謝制御にどの程度作用しているかについては、特に糖尿病状態におけるグルコース代謝に関連していることから、議論の余地がある(44-46)。今回の研究では、げっ歯類研究(9)と同様の因果関係を論じることはできないが、我々のデータは、ヒトの飢餓状態における炭水化物代謝から脂質代謝への移行において、HPA軸の低オレイン酸血症的刺激も役割を果たしている可能性を示唆している。
心代謝性疾患などの長期転帰に影響を及ぼす可能性のある飢餓反応の構成要素を特定するには、転帰データや最初の再給餌日以降のサンプリングがない我々の研究デザインでは限界がある。しかし、飢餓状態で大幅に変化する代謝物の大部分は、最初の再給餌日内にベースライン値に急速に近づいた。特筆すべき例外は TAG と CE のサブセットで明らかになったが、このサブセットでは、再給餌後も高炭素および高二重結合含量の種を好むシフトが維持された。同様のシフトは急性運動でも観察されている(15)。さらに、縦断的な疫学的データから、このようなシフトが持続する場合、糖尿病リスクの低下と関連していることが予測されている(15)。したがって、これらのデータは、飢餓状態の期間が有益な方法で脂質代謝を再プログラムする可能性があるという興味をそそる仮説を提起している。
要約すると、我々は、ヒトの長期的な飢餓状態の間に血漿代謝物の縦断的な進化を提示する。ヒトのボランティアを医学的に管理された十分に定義された入院中の絶食を行うという研究デザインにより、介入(絶食)と結果としての代謝物シフトとの間の因果関係を明らかにすることができた(図1-4および図5A)。候補代謝物を他の代謝物、ホルモン、または機能的共変量との関連性を検証した追加の二次解析により、特定の仮説を支持する証拠が得られた(図5,BおよびC、図6および7),7)。我々のデータは、脂質代謝へのシフトは、空腹時発症から1-2日後に急増する異種クラスの代謝物のクラスターによって特徴づけられるという作業モデルを支持している(図6,クラスター1)。この段階はケトーシスの発症と一致し、BAIBA など、脂肪酸の酸化とケト新生を促進することで適応的な代謝反応を直接促進する可能性のある生理活性を持つ候補代謝物と関連している。この段階はまた、急性低血圧と関連する高コルチゾール血症の状態によって特徴づけられる。これらのデータは、本稿で述べたもの以外にも生物学的に関連する事象を捉えていることは間違いないので、これらのデータが、絶食や摂食の代謝に影響される生理的・病態生理的状態を調べるためのリソースになることを期待している。
研究方法
試験計画書
以前に述べたように(11)我々は、BMIが正常または太りすぎの範囲(BMI範囲、22.7-29.3 kg/m2)である健康な12人の被験者(女性8人、男性4人;平均年齢、30.7歳;年齢範囲、21.8-48.3歳)を調査した。被験者をオンライン広告で募集した。すべての被験者は甲状腺機能が正常で、定期的な月経周期を持っていた(女性)。摂食障害または慢性疾患の既往歴のある者は除外した。ベースライン前の訪問では、一晩(8時間以上)の断食後に採血を行った。約10日後、一晩の断食後、被験者は0カロリー断食プロトコルのためにブリガム・アンド・ウィメンズ病院の臨床調査センターに入院した。被験者には水を自由摂取させ、マルチビタミン剤、20meqの塩化カリウム、および200mgのアロプリノールを、以前に記載したように毎日投与した(11)。安静時エネルギー消費量は、間接熱量測定法(VMAX Encore 29 メタボリックカート、Carefusion)を用いて、ベースライン時および空腹時の終了時に測定した。血液サンプルは、ベースライン前訪問時、ベースライン(0日目)1日目、2日目、3日目、5日目、7日目、9日目、10日目、および再給餌後約24時間後に採血した。
メタボロミクス解析
血漿中の代謝物は、以前に記載されているように液体クロマトグラフィー・タンデム質量分析(LC-MS)を用いて測定した(47-49)。MSピークは、TraceFinder 3.3(Thermo Fisher Scientific社)およびProgenesis QI(Nonlinear Dynamics社)を用いて統合した。代謝物の同一性は、参照標準および参照サンプルとの比較に基づいて決定した。
脂質法
血漿脂質を、島津ネクセラX2 U-HPLC(島津製作所)を用いてプロファイリングした。1,2-ジドデカノイル-sn-グリセロ-3-ホスホコリン(Avanti Polar Lipids)を含む190μlのイソプロパノールを用いて、血漿(10μl)から脂質を抽出した。遠心分離後、上清を100mm×2.1mm、1.7μm AクロロキンUITY BEH C8カラム(ウォーターズ)に直接注入した。カラムを80%移動相A(95:5:0.1vol/vol、10mM酢酸アンモニウム/メタノール/蟻酸)で1分間アイソクラティックに溶出し、次いで80%移動相B(99.9:0.1vol/vol、10mM酢酸アンモニウム/メタノール/蟻酸)への線形グラジエントを行った。 1 vol/vol/vol, 10 mM酢酸アンモニウム/メタノール/ホルム酸)への直線的グラジエントを2分間、100%移動相Bへの直線的グラジエントを7分間、100%移動相Bで3分間行った後、100%移動相Bで3分間行った。その他のMS設定は、シースガス、50,インソースCID、5 eV、スイープガス、5,スプレー電圧、3 kV、キャピラリー温度、300°C、ヒーター温度、300°C、およびSレンズRF、60であった。脂質の同一性は、総アシル炭素数および総二重結合数によって示された。
中間極性法
遊離脂肪酸および胆汁酸を含む中間極性の代謝物を、Q Exactive(サーモフィッシャーサイエンティフィック)に結合した島津ネクセラX2 U-HPLC(島津製作所)を用いてプロファイリングした。血漿サンプル(30μl)を、内部標準物質(ケイマンケミカル社)としてPGE2-d4を含む90μlのメタノールを用いて抽出し、遠心分離(10分、9000g、4℃)した。上清(10μl)を150mm×2.1mm AクロロキンUITY BEH C18カラム(Waters)に注入した。カラムは、20%移動相A(水中の0.01%ギ酸)で3分間、100%移動相B(アセトニトリル中の0.01%酢酸)への直線的なグラジエントを12分かけて行った後、450μl/分の流速でアイソクラティックに溶出された。マイナスイオンモードMS分析は、70,000分解能、3Hzのデータ取得率で70~850m/zのESIおよびフルスキャン分析を使用した。追加の MS 設定は、イオンスプレー電圧 -3.5 kV、キャピラリー温度 320°C、プローブヒーター温度 300°C、シースガス 45,補助ガス 10,および S レンズ RF レベル 60 であった。
正に帯電した極性代謝物
極性代謝物は、Q Exactive(Thermo Fisher Scientific)に結合したShimadzu Nexera X2 U-HPLC(Shimadzu Corp.)を用いてプロファイリングした。代謝物を、安定同位体標識された内部標準物質(バリン-d8,MilliporeSigma、およびフェニルアラニン-d8,Cambridge Isotope Laboratories)を含む74.9:24.9:0.2(vol/vol/vol)のアセトニトリル/メタノール/蟻酸90μlを用いて、血漿(10μl)から抽出した。試料を遠心分離(10分、9,000g、4℃)し、上清を150mm×2mm、3μmのAtlantis HILICカラム(Waters)に直接注入した。カラムは、5%移動相A(ギ酸アンモニウム10mMとギ酸0.1%の水中)で0.5分間、250μl/分の流速でアイソクラティックに溶出し、その後、40%移動相B(ギ酸0.1%のアセトニトリル)への直線的なグラジエントを10分間かけて行った。ポジティブイオンモードMSデータは、ESIおよびフルスキャン分析を用いて、70〜800m/z、70,000分解能、3Hzのデータ取得率で取得した。その他のMS設定は、シースガス、40,スイープガス、2,スプレー電圧、3.5kV、キャピラリー温度、350℃、ヒーター温度、300℃、SレンズRF、40であった。
負に帯電した極性代謝物
極性代謝物は、Q Exactive Plus(Thermo Fisher Scientific)に結合したShimadzu Nexera X2 U-HPLC(Shimadzu Corp. 代謝物を、イノシン-15N4,チミン-d4,およびグリコレート-d4の内部標準物質(Cambridge Isotope Laboratories)を含む80%メタノール120μlを用いて、血漿(30μl)から抽出した。試料を遠心分離(10分、9,000 g、4℃)し、上清を150 mm × 2.0 mm Luna NH2カラム(Phenomenex)に直接注入した。カラムは、10%移動相A(20mM酢酸アンモニウムと20mM水酸化アンモニウムの水溶液)と90%移動相B(10mM水酸化アンモニウムの75:25 vol/volアセトニトリル/メタノール)の初期条件で、100%移動相Aへの10分間の線形グラジエントを経て、400μl/minの流速で溶出された。追加のMS設定は以下の通りであった:イオンスプレー電圧、-3.0 kV、キャピラリー温度、350°C、プローブヒーター温度、325°C、シースガス、55,補助ガス、10,およびSレンズRF、レベル50。
生化学的評価
β-ヒドロキシ酪酸(ケトン)インスリン、グルカゴン、FGF21,アディポネクチン、T3,グルコース、およびベースライン脂質(計算されたLDLを含む)を既報のように測定した(11)。レプチンは固相サンドイッチ ELISA(R&D Systems社)を用いて測定し、測定中の CV は 3%~3.3%、測定間の CV は 3.5%~5.4%であった。
統計データ
DEGreport BioC パッケージを使用して PCA 分析を行い、ケンドール順位検定を使用して主成分と臨床共変量の間の相関を評価した。空腹時の代謝物の変化を評価するために、 limma BioC パッケージ(50)を使用して、各空腹時ポイントをベースライン(0 日目)と比較し、被験者ごとに補正した差動発現を実行した。偽発見率法を用いて、ベースラインとの多重比較で調整した P 値を報告する。代謝物クラスター分析では、代謝物間のすべてのペアワイズ相関を計算し、6 個の代謝物の最小クラスター サイズを使用して、cluster Bioc パッケージを使用して分割型の階層的クラスタリングを実行した。代謝物の変化と NEFA およびケトンとの関連を評価するために、被験者および時間を補正した limma (50) を使用して差動発現解析を行った。7つのクラスターと13のホルモン変数の間の相関を評価するために、相関検定分析を行い、多重検定エラーを制御するために偽発見率で補正した。レプチンとコルチゾールの縦断的測定値の間の関係を評価するために、混合効果3次モデルを使用した。分析のためのコードは github.com/hbc/msteinhauser_starvation_timeseries/releases/tag/time_of_publication で入手可能であるが,0.05 未満の P 値は有意であると考えられた。
