www.ncbi.nlm.nih.gov/pmc/articles/PMC7449535/
2019年10月31日オンライン公開
Jaganathan Lakshmanan,1,* Baochun Zhang,1 Kalen Wright,1 Amierreza T. Motameni,1 Vaitheesh Jaganathan,1 David J. Schultz,2 Carolyn M. Klinge,3 and Brian G. Harbrecht1

概要
テンダーココナッツウォーター(TCW)は、植物化学物質を豊富に含む天然植物製品であり、毒性肝障害から保護する。しかし、TCWがどのようなメカニズムで炎症や組織損傷を抑制するのかは不明である。我々は、in vitro敗血症モデルにおいて、初代ラット肝細胞の生存率、サイトカイン誘発遺伝子発現、炎症性シグナル伝達に対するTCWの効果を検討した。その結果、TCWは肝細胞の生存率を向上させ、サイトカインを介した細胞死から肝細胞を保護することが確認された。TCWは、IL-1βによるNos2、TnfおよびIl6 mRNAの増加を抑制し、ヘムオキシゲナーゼ1(HMOX1)タンパク質を増加させた。PI3KおよびJNKシグナルを阻害すると、iNOSタンパク質の発現と活性に対するTCWの効果が減少することから、TCWはAKTおよびJNK経路の活性化を介してiNOS発現を阻害することがわかった。これらの結果は、TCWが炎症性サイトカインの上昇によって生じる炎症性遺伝子の発現および肝細胞障害を軽減し、一酸化窒素の産生を抑制することを実証している。
キーワード:肝細胞、iNOS、インターロイキン-1β、テンダーココナッツウォーター、敗血症
グラフィックアブストラクト
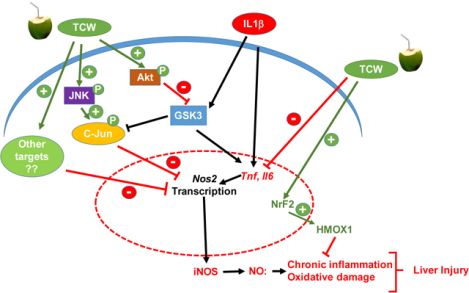
テンダーココナッツウォーター(TCW)は、JNKおよびAKTシグナル経路を活性化することにより、単離した初代ラット肝細胞においてIL-1βによって誘導されるNOの生成を減少させ、TnfおよびIl6生成を阻害する。TCWは肝細胞の生存率を改善し、抗酸化物質であるHMOX1の発現を増強した。
1. はじめに
一酸化窒素(NO)は、多様な生理的および病態生理学的役割を担っている(Tuteja, Chandra, Tuteja, & Misra, 2004)。構成的に活性なニューロンNOS (N-NOS, NOS1) と内皮NOS (E-NOS, NOS3) によって産生されるNOは、神経伝達、平滑筋機能、血管収縮を制御する (Bredt & Snyder, 1992; Buchwalow et al., 2002)。誘導性NOS(iNOS、NOS2)により産生されるNOは、感染に対する宿主防御に必須の役割を果たすが、iNOSによる過剰なNO産生は組織損傷、慢性炎症を引き起こし、肝線維化、移植拒絶、臓器機能不全に寄与しうる(Nussler & Billiar、1993; Cannon、1999). NOは、虚血再灌流(I/R)傷害と炎症性サイトカイン産生により、敗血症性ショック患者やショック、敗血症、肝移植の動物モデルの肝臓で増加している(Hierholzerら、1998;Shah & Kamath、2003)。慢性的な肝炎は肝細胞癌(HCC)のリスクを高め、iNOSの上昇はHCCの発症に関与しているとされている(Kawanishi, Hiraku, Pinlaor, & Ma, 2006)。肝細胞のiNOSはサイトカインによって発現が上昇し、cAMP、グルカゴン、インスリンがサイトカインを介したiNOS発現を抑制することが示されている(Harbrecht, Taylor, Xu, Ramalakahmi, Ganster & Geller, 2001; Zhang, Li, & Harbrecht, 2011; Zhang, Perpetua, Fulmer, & Harbrecht, 2004)。ショック、I/R、炎症および移植の間に肝臓におけるNO産生を減少させるか、または過剰なNOを捕捉することは、肝臓損傷および組織損傷を減少させる(Chen, Liao, Yang, & Wang, 2014; da Cunha, Lopes, Panis, Cecchini, Pinge-Filho, & Martins-Pinge, 2017)ことから、iNOSからのNO産生の低減は有益となり得、これらの侮辱中の肝臓を保護することができると示唆される。
テンダーココナッツウォーター(TCW)は、ビタミン、ミネラル、糖、アミノ酸、ペプチド、タンパク質、植物代謝物、植物ホルモンなどの生物活性化合物を含む若い(6〜8ヶ月)ココナッツ(Cocos nucifera L)の栄養豊富な液体胚乳で(補足表1)、熱帯地域でよく消費されている(Adams & Bratt, 1992; DebMandal & Mandal, 2011)。その組成から水分補給液として有用であり、下痢、赤痢、発熱、体の痛みの治療に用いられてきた(Adams & Bratt, 1992; DebMandal & Mandal, 2011)。TCWは、抗糖尿病、抗炎症、抗血栓、抗菌、創傷治癒、抗癌活性を有する(Bhagya, Prema, & Rajamohan, 2012; Loki & Rajamohan, 2003; Prabhu et al, 2014; Preetha, Devi, & Rajamohan, 2015; Rao & Najam, 2016).
いくつかの生物活性天然物は、疾病の予防/緩和のために予防的または治療的に使用されてきた化合物の供給源である。天然物を使用する利点は、通常、副作用が少なく、忍容性が高いということだ。植物に含まれる多くのフラボノイド、クマリン、タンニンは、実験モデルにおいてNOの生成を抑制し、天然物がiNOSを含む炎症経路を阻害する可能性が示唆されている(Murakami, 2009)。TCWは実験モデルにおいて肉眼浮腫を軽減し、創傷治癒を促進するが、その抗炎症作用のメカニズムは解明されていない(Radenahmad et al.2012; Rao & Najam, 2016)。TCWの抗炎症作用が報告されていることから、TCWがラット初代肝細胞における炎症性メディエーターの発現やサイトカインを介したNO産生、Nos2 mRNA、iNOSタンパク質の発現を調節すると仮定している。
2. 材料と方法
2.1. 材料
地元の食料品店で購入した成熟期6-8ヶ月のMaphora Nam Hom品種(Cocos nucifera.L. var. nana)のココナッツから新鮮なTCWを採取した(ココナッツはタイ産、USDAの有機認証を取得している)。2〜4個のココナッツから得られたTCWをプールし、滅菌ろ過し、50mLのアリコートにして4℃に保存した。異なるブランドで販売されている市販のココナッツウォーターも地元の食料品店から購入し、上記と同様に滅菌ろ過した(補足表2、および3)。ウィリアムズ培地E、ペニシリン、ストレプトマイシン、L-グルタミンおよびHEPESは、Life Technologies (Carlsbad, CA)から入手した。インスリンはLilly社(Indianapolis, IN)より入手した。iNOSに対するポリクローナル抗体(カタログ番号610431)はBD Bioscience(Billerica, MA)から、HMOX1(カタログ番号PC340)はCalbiochem(San Diego, CA)から、β-Actin(カタログ番号MAB1501)はMillipore(Burlington, MA)からであった。total-GSK3α/β(カタログ番号5676)、S21/S9でリン酸化されたGSK3α/β(カタログ番号9331)、total-AKT(カタログ番号9272)、S473でリン酸化されたAKT(カタログ番号5012)、total-JNK1/2(カタログ番号3708)に対する抗体であった。phopsho-JNK1/2(カタログ番号4668)、total-c-Jun(カタログ番号9164)、S63でリン酸化されたc-Jun(カタログ番号2361)、及びGAPDH(カタログ番号5174)はCell Signaling Technology(Danvers,MA) から購入した。LY294002およびSP600125はCalbiochem(San Diego,CA)から、ヒト組換えインターロイキン1β(IL-1β)はDupont(Boston,MA)からであった。この研究で使用された他のすべての化学物質は、試薬グレードであり、入手可能な最高純度であった。
2.2. 初代肝細胞の分離と培養
初代肝細胞は、雄のSprague-Dawleyラット(150-200 g; Envigo, Indianapolis, IN, USA)から、修正コラゲナーゼ灌流法(Zhang, Li & Harbrecht, 2011)を用いて単離された。実験動物は、米国国立衛生研究所のGuidelines for the Care and Use of Laboratory Animalsに規定されたガイドラインに従い、Institutional Animal Care and Use Committee(IACUC)が承認したプロトコルに従って世話された。単離・精製した肝細胞(トリパンブルー排除による生存率が95%を超える純度98%)を、L-アルギニン(0.5 mM)、L-グルタミン(2 mM)、HEPES(15 mM)、ペニシリン、ストレプトマイシンおよび10%炭粉除去FBS(CS-FBS;ハイクローン研究所、ローガン、UT)入りWilliams Medium E中で4時間コラーゲンコートしたプレート上で、培養した。付着していない細胞を洗い流し、インスリンが培養ラット肝細胞のサイトカイン媒介性iNOS発現を抑制することが知られているため、肝細胞を5%CS-FBSを含むインスリンフリー培地でインキュベートした(Harbrecht, Nweze, Smith, & Zhang, 2012)。10%CS-FBSを含む2 X William EにTCW (v/v) と滅菌水を加え、TCWの添加によって培地とFBSが希釈されないようにし、様々な濃度のTCWを含む培地を調製した。肝細胞は、200U/mlのIL-1βを添加する前に、上記のように調製した培地中の表示量のTCWで30分間前処理された。LY294002またはSP600125を含む実験では、対照肝細胞およびIL-1β単独で処理した肝細胞は、阻害剤で処理した肝細胞に存在する量に相当する0.001%DMSOをビヒクル対照として培養液中に受けた。3匹の異なるラットから単離した肝細胞を同一の実験条件下で使用し、3つの独立したデータセット(生物学的複製)を生成した。
2.3. 亜硝酸塩(NO2-)の測定
肝細胞培養上清のNO2-をGriess反応によりNO産生の指標として測定した(Harbrechtら、2001)。
2.4. ウェスタンブロット
初代肝細胞からのタンパク質(50μg)を12%SDS-PAGEゲルで分離し、ニトロセルロース膜に移し、記載されているようにウェスタンブロット分析を行った(Lakshmanan, Zhang, Nweze, Du, & Harbrecht, 2015)。膜は、最初にタンパク質のリン酸化形態についてプローブし、次に、内部標準、β-アクチン/GAPDHについてプローブする前に、適切な抗体を使用して、それぞれのタンパク質の総レベルについてストリップし、再プローブした。バンド強度の定量化は、ImageJソフトウェア(Lakshmananら、2015)を用いて行った。
2.5. RNA抽出およびQ-PCR
TRIzol Reagent(Life Technologies)を用いて、製造者のプロトコルに従って肝細胞から総RNAを単離した。TaqMan Reverse Transcription reagent (Applied Biosystems) を用いて、total RNAからcDNAを生成した。Q-PCR用のラットNos2(Rn00561646_m1)、Serpine1(Rn01481341_m1)、Tnf(Rn9999017_m1)、IL6(Rn00561420_m1)およびGapdh(Rn01775763_g1)の独自プローブはLife Technologies(ニューヨーク州、グランドアイランド)から購入した。サンプルは、StepOne Plus PCR machine (Applied Biosystems) を用いて、実験のセットごとに重複して解析し、その平均値を定量に使用した。Gapdhは内因性コントロールとして使用した。遺伝子発現の定量には、比較CT法(サイクル閾値)を用いた。
2.6. MTTアッセイ
肝細胞の生存率を測定するために、MTTアッセイを記載通りに採用した(Mosmann, 1983)。
2.7. TCWの分画
TCWを酢酸でpH 3.0まで酸性化し、ろ過した。酸性化したTCWの全量(80 ml)を2つに分けた。一方(16 ml)は、未分画のコントロールとして-80℃で保存した。残りの64 mlを、メタノール-酢酸(100:1、v/v)、メタノール-水-酢酸(50:50:1、v/v)、メタノール-水-酢酸(30:70:1、v/v)で順次平衡化し、最後に既出(Geら、2005)のように水とした逆相重力流C18 SPEカラム(ボンドエルートC18;500 mg、3 mL、Agilent Technologies、サンタクララ、カリフォルニア)に通した。カラムを酢酸でpH3.0に調整した水4mLで洗浄した。次に、結合画分を6mLのエタノール-水-酢酸(80:20:1、v/v/v)で溶出し、最終生成物を50%エタノールに溶解した状態で、溶媒を真空下で蒸発させた。画分と出発物質をNaOHで滴定してpH7.4に中和し、初代ラット肝細胞によるIL-1β誘発NO2-産生を抑制する各種画分の能力をテストした。フロースルー、ウォッシュ、溶出液を回収し、-80℃で保存した。画分のHPLC分析のために、試料を凍結乾燥し、5mg dry mass/mlで水に溶解した。総フェノール含量は、記載され (Slinkard & Singleton, 1977) 、修正された (Siriwoharn, Wrolstad, Finn, & Pereira, 2004; Tsao & Yang, 2003) ように測定された。フェノール類の推定含量に基づいて、各サンプルは0.1 mg フェノール(没食子酸相当)/ml水に希釈され、HPLC分析に供された。HPLC 分析は、脱気装置、第四ポンプ、自動注入器、カラムオーブン、ダイオードアレイ検出器(設定:280 nm、帯域幅 16 nm、基準:360 nm、帯域幅 100 nm、スリット:2 nm、ピーク幅[応答時間]0.4min[8s]) を備えた Agilent 1100 システムで実施した。250 ×4.6 mm Altima HP 5 μm C18-AQカラムを装着した。流速を1.5 ml/min溶媒A (水中1%酢酸) に設定し、0.02 ml試料を注入した。サンプルは以下のように溶出させた。溶媒A 100%で5分、溶媒B 50%(メタノール中1%酢酸)で5分から20分まで直線的に増加、溶媒B 100%で20分から25分まで直線的に増加、30分までB 100%で保持、30分から35分まで溶媒A 100%に戻す。
2.8. 統計解析
結果は、少なくとも3種類のラットから分離した肝細胞を用いた3回の独立した実験の平均値±SDとして表した。データは、一元配置分散分析(oneway ANOVA)後、p値決定のためのポストホックTukey検定により分析した。複数の成分を含むデータは2元配置分散分析で有意性を解析し、群間の有意性が明らかな場合はTukeyのポストホックで一対比較とp値の決定を行った。p < 0.05の値を統計的に有意であるとみなした。統計解析は、IBM SPSS 21 ソフトウェアを使用して行った。
3. 結果
3.1. TCWはin vitroでの初代ラット肝細胞の生存率を高める
IL-1β非存在下および存在下で培養した初代ラット肝細胞の生存率に対するTCWの効果を、MTTアッセイを用いて測定した。TCWを添加しない場合、サイトカイン処理により、24時間後の肝細胞の生存率は、無処理の細胞に比べてわずかに低下した(図1a)。TCWを添加した肝細胞は、IL-1βの存在下でも、濃度依存的に生存率が上昇することがわかった。その効果は、TCWを10%および25%添加した場合に最も高かった。さらに、TCWを添加した初代ラット肝細胞培養は、5% CS-FBS以外の成長因子を追加で添加しなくても、少なくとも5日間、in vitroでその典型的な形態と表現型を維持した(図 1b)。一方、5% CS-FBSのみを添加した培地で培養した初代ラット肝細胞は、典型的な外観を失い、アポトーシスの形態的証拠(小さな丸い細胞、図1b、上段)が明らかであった。
図1 TCWはラット初代肝細胞の生存率を向上させた
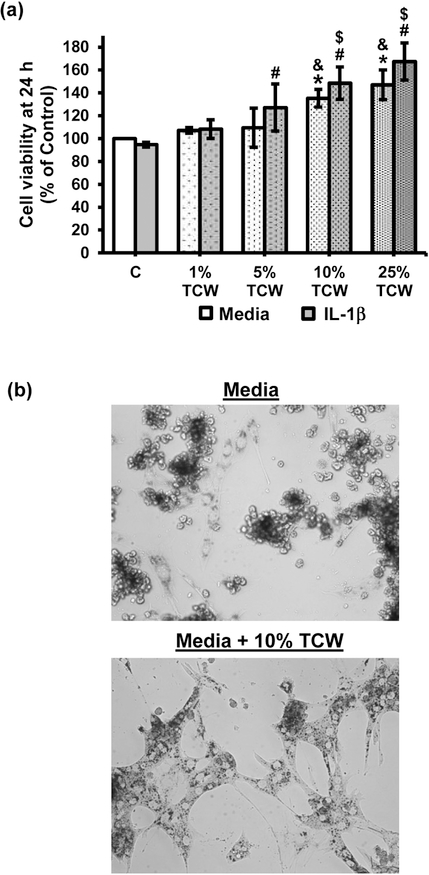
(a) 異なる濃度のTCWを投与したラット初代肝細胞の生存率は、24時間処理後のMTTアッセイで評価した。棒グラフは平均±SD、n = 3を表す。*p < 0.05 vs コントロール;#p < 0.05 vs IL-1β 処理;&p < 0.05 vs 1% および 5% TCW 処理および$p < 0.05 vs 1% および 5% TCW + IL-1β 処理(b)10%TCW補充有無で5日間培養した初代ラット肝細胞の形態が示されている。細胞は、Methodsに記載した培地で培養した。C、Control;TCW、Tender Coconut Water
3.2. TCWは、初代ラット肝細胞によるIL-1β媒介のNO産生を抑制する
TCWが肝細胞において抗炎症作用を持つかどうかを調べるために、初代ラット肝細胞を200 U/mL IL-1βで20時間処理し、NO2-を誘導した(図 2a)。TCWで前処理(30分)すると、濃度依存的にIL-1βによるNO2-誘導が抑制された。また、TCWはIL-1βによるiNOSタンパク質発現の増加(図 2b)およびIL-1βによるNos2転写物の発現増加(図 2c)を抑制した。TCWを10分間煮沸しても、IL-1βによるiNOSタンパク質発現の抑制やNO2-産生の抑制能力は低下しなかった(データは示さず)。これは、TCWの有効成分が熱安定性であることを示している。これらのデータは、TCWがラット初代肝細胞において、IL-1βによって誘導されるNos2、iNOSタンパク質、およびNO2-産生を抑制することを実証するものである。我々は、異なるブランドで販売されている市販のココナッツウォーター製品を新鮮なTCWと比較した。市販のココナッツウォーターは、新鮮なTCWと同様に、ラット初代肝細胞によるIL-1βを介したNO2-産生を抑制する効果があった(Table 1)。
図2 TCWは、ラット初代肝細胞のNO2-産生、iNOSタンパク質およびiNos
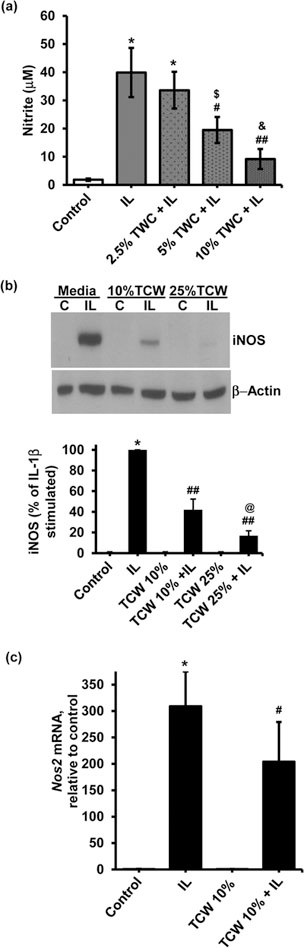
mRNAの発現を抑制する。(a) 細胞を、William E培地中の表示濃度(体積%)のTCWで30分間前処理した。その後、細胞を200U/mLのIL-1βで20時間処理した。培地中のNO2-のレベルをGriess法により測定し、IL-1βのみで処理した細胞中のNO2-レベルと比較した。対照群の細胞は、TCWもIL-1βも投与しなかった。(b)iNOSタンパク質発現に対するTCW濃度の効果についての代表的なウェスタンブロットであり、下図は、比較のためにIL-1β誘導値を100%としたiNOS/β-アクチンのデンシトメトリー定量を示したものである。(c)ラット初代肝細胞におけるNos2 mRNAレベルを、IL-1β(200U/mL)処理後180分後に測定し、IL-1βなし(コントロール)、TCW(10%)単独で前処理した肝細胞、およびTCW+IL-1βを受けた肝細胞と比較した。Gapdh発現は、iNOS発現レベルを正規化するための内部コントロールとして使用された。p < 0.005 vs control; #p < 0.05 vs IL-1β; ##p < 0.005 vs IL-1β; $p < 0.05 vs 2.5% TCW + IL-1β; &p < 0.05 vs 5% TCW+ IL-1β および @p < 0.05 vs 10% TCW + IL-1β. C、コントロール;IL、IL1β、TCW、テンダーココナッツウォーター。補足図3は、図2bのウエスタンのフルブロットを示す
表1
| 処理 | 相対的な亜硝酸塩レベル(%コントロール±SD) |
|---|---|
| メディアのみ | 8.15 ± 0.55 |
| 平均+IL-1β | 100.00 ± 0.00 |
| 10%フレッシュTCW+IL-1β | 34.20 ± 8.78* |
| 10%ブランドATCW+IL-1β | 31.66 ± 1.33* |
| 10%ブランドBTCW+IL-1β | 26.78 ± 6.32* |
新鮮なTCWと市販のココナッツウォーター(異なるブランドで販売されている、AおよびB)の、ラット初代肝細胞によるIL-1β媒介亜硝酸塩生成を阻害する能力に関する比較。ラット初代肝細胞を、200 U/mlのIL-1βを添加する前に、10%のTCWまたはココナッツウォーターAまたはBで20分間前処理した。硝酸塩レベルは24時間後にGriess反応によって測定した。
3.3. TCWは、初代ラット肝細胞の炎症性メディエーターの発現を変化させる
TCWの抗炎症作用がiNOSに特異的であるかどうかを調べるために、急性期タンパク質Serpine1(PAI-1)、Tnf(TNFα)、IL6(IL6)といった他の炎症性肝細胞遺伝子のmRNA発現を測定した。TCW処理単独では、肝細胞のSerpine1 mRNAレベルは、IL-1β処理した肝細胞と同程度に増加した(図 3a)。TCWとIL-1βの組み合わせでは、Serpine1 mRNAレベルがさらに増加したが、TCWまたはIL-1β単独で処理した肝細胞と比較すると、その増加は統計的に有意ではなかった(図 3b)。IL-1βはTnf mRNAレベルを増加させ、TCWはIL-1β刺激によるTnf発現をわずかではあるが統計的に有意に減少させた(図 3b)。IL-1βは肝細胞のIl6 mRNAレベルを有意に増加させない一方で、TCWは基礎Il6転写レベルを減少させたが、IL-1βと培養した場合には減少しなかった(図 3c)。
図3 ラット初代肝細胞のSerpine1、Tnf、Il6およびHMOX1発現に対するTCWの効果
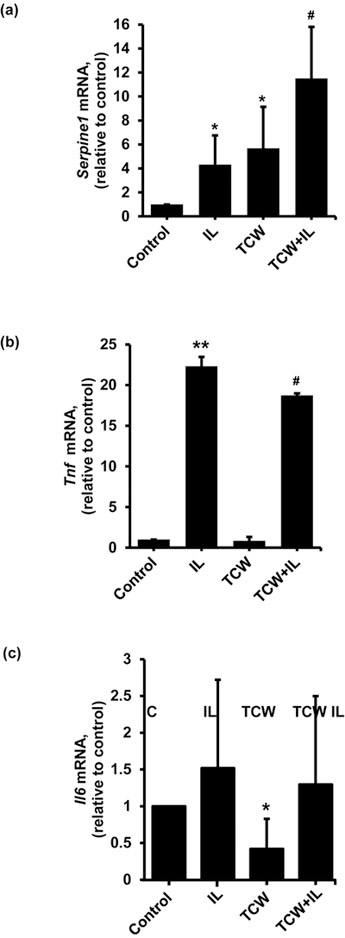

初代ラット肝細胞を、IL-1β(200 U/mL)添加前に、TCWなしまたは10% TCWでプレインキュベーションした。180分後、トータルRNAを単離し、Gapdhを内部コントロールとしてQ-PCRによりSerpine1 (a), Tnf (b) およびIl6 (c) mRNAレベルを測定した。(d) TCWで処理し、IL-1β(200U/ml)と共に一晩インキュベートした肝細胞からのタンパク質抽出物(50μg)を、ウェスタンブロットによりHMOX1レベルについて分析した。ブロットは、ローディングコントロールとしてβ-アクチンを剥離し、再プロービングした。下パネルは、3つの複製ウエスタンにおけるHMOX1タンパク質のデンシトメトリー分析の要約を示す。IL-1β誘導試料におけるHMOX1/β-actinは、比較のために1とした。すべての実験において、培地のみを投与した肝細胞をコントロールとした。バーは平均±SD、n = 3を表す。*p < 0.05 および **p < 0.001 vs control; #p < 0.05 および ##p < 0.01 vs IL-1β; $p < 0.005 vs TCW. C、コントロール;IL、IL-1β;TCW、テンダーココナッツウォーター。補足図4は、図3dの西洋人のフルブロットを示す
ヘムオキシゲナーゼ-1(HMOX1)は抗酸化物質であり、酸化ストレスに対して細胞保護的である(Waza, Hamid, Ali, Bhat, & Bhat, 2018)が、培養肝細胞におけるHMOX1の誘導はIL-1βが弱いことが分かった(図3d)。しかし、TCWはラット初代肝細胞においてHMOX1タンパク質の発現を顕著に増加させ、TCW処理細胞にIL-1βを添加すると、HMOX1タンパク質がさらに増加した(図3d)。これらの結果は、TCWの抗炎症作用を支持し、TCWが初代ラット肝細胞において抗炎症性HMOX1タンパク質の発現を増加させることを実証している。
3.4. TCWは、初代肝細胞においてAKTシグナルを活性化する
我々は以前、AKTがサイトカイン刺激による肝iNOS発現を制御することを明らかにした(Harbrecht et al.、2012;Zhang et al.、2011)。そこで、我々は、ラット初代肝細胞において、TCW(10%、v/v)がAKTシグナル伝達に及ぼす影響を検討した。以前に報告されたように(Harbrechtら、2012;Zhangら、2011)、IL-1βは肝細胞においてAKTリン酸化を増加させ、この刺激はPI3K/AKTの特異的阻害剤であるLY294002によって阻害された(図4a)。TCW単独では、AKTリン酸化が有意に上昇した(18倍増)(図4a)。興味深いことに、p-AKT/AKTの増加は、TCW処理後60分よりも30分でより大きくなることが観察された。IL-1βとTCWを併用すると、AKTのリン酸化はIL-1βまたはTCW単独で刺激された場合よりも有意に大きなレベルまで上昇した(図 4a)。LY294002は、IL-1βの存在下および非存在下の両方で、TCWによるAKTリン酸化の有意な減少を引き起こした(図 4a)。我々の以前の報告(Lakshmananら、2015;Zhangら、2011)と同様に、LY294002 -によるAKTリン酸化の抑制は、IL-1β媒介のNO2-生成およびiNOSタンパク質発現の著しい増加と関連していた(図4bおよび4c).4c).4。LY294002は、IL-1βを介した亜硝酸塩産生(図4b)およびiNOSタンパク質発現(図4c)に対するTCWの抑制効果を部分的に逆転させた。これらのデータから、TCWはAKTリン酸化の活性化を介して、iNOSタンパク質発現の抑制を一部仲介していることが示唆された。
図4 TCWは、初代ラット肝細胞のAKTシグナルを活性化する

(a) IL-1β刺激後30分および60分におけるAKTのリン酸化に対するTCW(10%), IL-1β(200 U/mL), LY294002(10 μM)の影響についての代表的なウェスタンブロット。下段は定量デンシトメトリー解析。(b)および(c)は、IL-1β模擬NO2-およびiNOSタンパク質レベルに対するTCWおよびLY294002の効果をそれぞれ示す。cの下段は、ローディングコントロールとして、同じレーンにあるβ-アクチンに正規化したiNOSタンパク質の定量化を示している。(d)GSK3リン酸化に対するTCWおよびLY294002の効果。(d)の下段は、GSK3レベルのデンシトメトリー分析を示す。a)および(d)では、内部標準としてGAPDHを使用した。(a), (b), (c), (d)のバーは、平均値±SD、n = 3を表す。*p < 0.05, **p < 0.005 vs control; #p < 0.05 vs IL-1β; €p < 0.05 vs TCW; &p < 0.005 vs TCW; $p < 0.01 vs TCW+IL-1β; @p < 0.05 vs LY; ©p < 0.05 vs LY + TCW and £p < 0.05 vs LY + IL-1β. C、コントロール;TCW、テンダーココナッツウォーター;IL、IL-1β;LY、LY294002。補足図5-7は、この図におけるウエスタンのフルブロットを示す
GSK3はAKTの下流標的であり、肝細胞におけるIL-1β誘導iNOS発現のポジティブレギュレータである(Lakshmananら、2015)。AKTによるGSK3のリン酸化は、その不活性化につながる。TCWはGSK3α/βのリン酸化を増加させ(図4d)、リン酸化パターンはphospho-AKT(図4a)と平行であり、60分より30分の方が大きな効果を含むことが示された。TCW処理前にLY294002をプレインキュベーションすると、phospho-GSK3α/βのレベルが低下した(図4d)。これらの結果は、TCWによるPI3K/AKTの活性化が、ラット初代肝細胞におけるGSK3α/βの阻害的リン酸化をもたらすことを実証している。
3.5. TCWによるラット初代肝細胞のJNKシグナルの活性化
JNKシグナルは、サイトカインを介した肝細胞のiNOS発現を抑制する(Zhang, Perpetua, Fulmer, & Harbrecht, 2004)。そこで、この経路がIL-1β誘発iNOS発現に対するTCWの抑制効果に寄与しているかどうかを調べるために、JNKシグナル伝達に対するTCWの効果を評価した。以前に示したように、IL-1βはJNKのリン酸化を増加させた(図5a)(Zhangら、2004)。TCW単独では、30分と60分の両方で、JNK1/2リン酸化をIL-1β単独の場合よりも有意に大きなレベルまで誘導した(図5a)。30分では統計的に有意ではなかったが、IL-1βとTCWの組み合わせは、TCW単独の場合よりもJNKリン酸化が増加する傾向を示し、この差は60分でより明確になった(図5a)。
図5

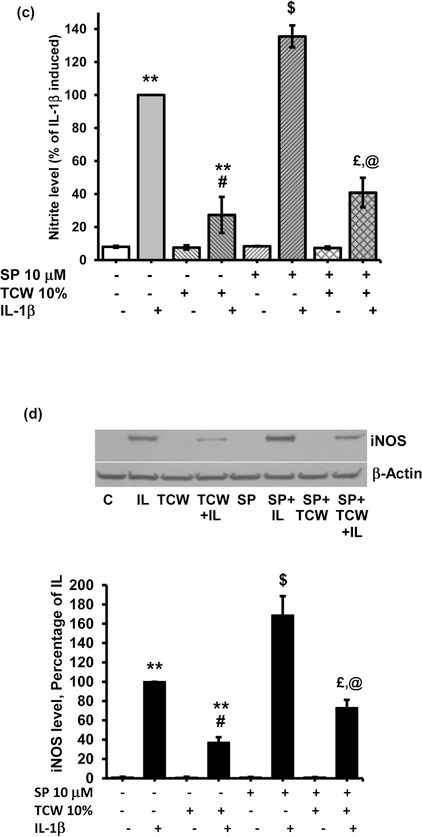
TCWは、ラット初代肝細胞のJNKシグナル伝達経路を活性化する。(a) ラット初代肝細胞をTCW(10%)とIL-1β(200 U/mL)で示した時間処理し、IL-1β添加後30分と60分後にphosphoと総JNK1/2タンパク質について分析した。(b) ウェスタンブロットで、リン酸化(S63)および総c-Junに対するTCWの効果を示す。a)および(b)の下段は、GAPDHをローディングコントロールとしたデンシトメトリー解析の結果を示す。(c)ラット初代肝細胞におけるIL-1β仲介NO2-生成に対するTCW仲介効果に対するJNK阻害剤、SP600125(10μM)の効果および(d)iNOSタンパク質発現の効果。d)の下段は、ローディングコントロールとしてβ-アクチンに正規化したiNOSバンド強度のデンシトメトリーデータである。バーは平均±SDを表し、(a)、(b)、(d)ではn = 3、(c)ではn = 4である。*p < 0.05 vs control; **p < 0.005 vs control; #p < 0.005 vs IL-1β; $p < 0.05 vs IL-1β; €p < 0.05 vs TCW; @p < 0.05 vs SP+ IL-1β; £p > 0.05 vs SP+ IL-1β. C、コントロール;IL、TCW、テンダーココナッツウォーター;IL-1β;SP、SP600125。補足図8-10は、この図におけるウエスタンのフルブロットを示す。
肝細胞では、JNKのリン酸化はc-Junの増加をもたらし、iNOSを抑制する(Zhangら、2004)。そこで、10%TCWで処理した肝細胞のphospho-c-Jun (Ser63) レベルを測定した。TCWはc-Junのリン酸化を増加させ(図5b)、phospho-JNKの増加とも並行していた。JNK阻害剤SP600125を用いてJNKシグナルを遮断したところ、肝細胞単独で培養した場合、SP600125は対照のNO2-産生やiNOS発現を変化させなかった。SP600125は、IL-1β単独と比較して、IL-1βによるNO2-およびiNOSタンパク質の発現を有意に増加させた(図5cおよびandd).d)。IL-1β処理肝細胞におけるTCW誘発のNO2-およびiNOSタンパク質における抑制は、SP6001255によって部分的に逆転したことから、JNKは、TCWによるIL-1β誘発iNOSの抑制を調節していると考えられた。
3.5. 非極性 TCW 成分はラット肝細胞において iNOS 抑制活性を有する
IL-1β誘導性炎症を抑制するTCWの有効成分を明らかにするため、TCWを分取C18カラムで分画し、iNOS発現による生物学的活性のスクリーニングを行った。非結合極性画分(フロースルー)は、この画分で前処理した肝細胞のIL-1β刺激NO2-レベルの減少によって明らかなように、iNOS抑制能を保持していた(表2)。C18カラムから溶出したフラクションは、TCWのiNOS抑制活性を欠いた(Table 2)。フラクションの総フェノール量から、溶出液にフェノール類が濃縮されていることがわかった(Supplementary 図1)。さらにC18カラムのフラクションをHPLCで分析したところ、フロースルー画分に見出されたピーク(Supplementary 図2のピーク1-4)は、溶出液中に見出されないか非常に低いレベルであった。逆に、溶出液画分に見出されたピーク5-6は、フロースルー画分には見出されないか、非常に低いレベルで見出された。このように、iNOS阻害活性の違いは、フロースルーに濃縮され、溶出液に存在しない植物化学物質と相関している(Supplementary 図)
表2 C18カラム分離後のTCWの活性画分の同定
| 処理 | 相対的な亜硝酸塩レベル(%コントロール±SD) |
|---|---|
| メディア | 7.70 ± 1.63 |
| 平均+IL-1β | 100.0 ± 0.00 |
| 10%TCW+IL-1β | 42.83 ± 9.47* |
| 10%C18フロースルー+IL-1β | 38.39 ± 7.58* |
| 10%C18溶出液+IL-1β | 103.73 ± 4.37 |
C18カラムから得られたTCWの非結合画分および結合画分について、ラット初代肝細胞によるIL-1β仲介亜硝酸塩生成を阻害する能力をテストした(実験の詳細については表1を参照)。
4. 考察
炎症の有害な影響を減少させることは、非アルコール性脂肪性肝疾患(NAFLD)、非アルコール性脂肪肝炎(NASH)、およびC型肝炎感染を含むいくつかの慢性肝疾患の治療戦略である(Campo、Gallego、&Grande、2018)。虚血、ショック、敗血症に伴う組織損傷に関連する炎症および誘導されたiNOS発現をダウンレギュレートすることは、臨床転帰を改善するための潜在的戦略である。
テンダーココナッツ水は、いくつかの実験モデルにおいて抗酸化特性を有し、化学毒素誘発性傷害から肝臓を保護する天然植物ベースの製品である(Bhagyaら、2012;Loki&Rajamohan、2003)。これまでの研究では、TCWの経口投与により、ラットのアイソプロテロナール誘発心筋梗塞による酸化ストレスが減少し(Prathapan & Rajamohan, 2011)、炎症が軽減された(Rao & Najam, 2016)ことが報告されている。しかし、TCWの抗炎症作用のメカニズムは不明である。ここで我々は、TCWがラット初代肝細胞において、IL-1βによるTnfおよびIl6転写物の発現を減少させる一方で、急性期タンパク質(Serpine1転写物)および抗酸化物質(HMOX1タンパク質)の発現を増加させて肝細胞の炎症を抑制することを初めて報告する。TCWは、AKTおよびJNKシグナル伝達経路の刺激を通じて、初代ラット肝細胞におけるNos2転写レベルおよびiNOSタンパク質のIL-β媒介減少を抑制した。
NOは重要な免疫調節分子であり、炎症を抑えるためにiNOSを阻害してNO産生を抑制することは、動物モデルで成功している(Clancy, Amin, & Abramson, 1998; Cross & Wilson, 2003; Vallance & Leiper, 2002)。本研究では、TCWが初代肝細胞による亜硝酸塩の産生を抑制するだけでなく、Nos2 mRNAおよびiNOSタンパク質の発現も抑制することを示した(図 2a-c)。これは、TCWが酸化的な侮辱を受けた後の亜硝酸塩生成を抑制した研究(Loki & Rajamohan, 2003; Manna et al., 2014)と一致するが、これらの研究ではTCWによるiNOSの抑制のメカニズムは検討されていない。我々は以前、AKTおよびJNKが肝iNOSの重要な負のレギュレーターであることを証明した(Zhang et al, 2011, 2004)。ここで紹介するデータは、TCWがAKTおよびJNKシグナル伝達経路を活性化することによって、部分的に肝炎、Nos2 mRNAおよびiNOSタンパク質発現(図2)を抑制することを示している(図、4および5)。PI3K-AKT経路は炎症を媒介し、この経路を阻害すると、敗血症の動物モデルで血清サイトカインレベルが上昇し、生存率が低下した(Schabbauer, Tencati, Pedersen, Pawlinski, & Mackman, 2004; Williams et al.) TCWはさらに細胞内シグナル伝達経路を活性化する可能性があり、TCWが介在するNos2 mRNAおよびタンパク質発現への効果に他のシグナル伝達経路が関与することを否定するものではない。TCWは、熱ショックや過酸化水素(H2O2)などのストレス要因に続いてNF-κB核転座を抑制し(Kumar、Manna、&Das、2018;Mannaら、2014)、NF-κBの調節が我々のモデルにおける抗炎症作用に寄与する可能性がある。敗血症または感染症におけるサイトカインおよびIL-1β媒介のNF-κBの核転座の抑制におけるTCWの役割は、まだ完全に決定されていない。
他の研究室からの研究により、in vivoで、TCWは、CCl4およびH2O2誘導酸化損傷ならびにフルクトース誘導酸化ストレスをラット肝臓に減少させることが実証されている(Bhagyaら、2012;Loki & Rajamohan、2003)。これらの研究では、TCWはフリーラジカル消去酵素であるスーパーオキシドジスムターゼ(SOD)、カタラーゼ、グルタチオンペルオキシダーゼ(GPX)を増加させたが、これらの変化のメカニズムは特定されていない。我々の研究室の予備研究では、TCWがマウスの肝虚血再灌流傷害モデルにおいて、in vivoで肝臓のNos2を減少させることも示されている(未発表データ)。肝臓では、iNOSは、感染症や傷害などの低酸素および虚血状態で生成されるフリーラジカルの主要な寄与者であり(Iwakiri & Kim, 2015)、TCWによるiNOS発現減少という我々の発見は、おそらく抗酸化作用を有すると考えられる。我々は、TCWが炎症や酸化傷害に対する肝反応に重要な抗酸化および抗炎症タンパク質であるHMOX1(図3d)のタンパク質レベルを増加させたことを実証し、これらの研究では酸化剤を介した膜損傷を直接測定していないが、TCWによる強力な抗酸化効果を示唆している。TCWはIL-1βを介したTnfの発現を抑制した。TNFαは肝臓における炎症の確立されたメディエーターである(図3b)。肝細胞はマクロファージなどの他の細胞ほどTNFαを産生しないかもしれないが、これらの知見は、TCWがその保護効果の構成要素として、肝細胞の抗酸化防御および炎症反応を有利に変化させる可能性を示唆している。これらのメカニズムが、TCW存在下での細胞死の減少を説明することができる(図1a)。この知見は、TCWがH2O2媒介酸化損傷から肝細胞を保護し、熱誘発損傷から精巣を保護することを示した以前の研究と一致する(Kumarら、2018;Mannaら、2014)。GSK3は、Nrf2活性の負の調節因子であり、炎症性サイトカインの産生に不可欠である(Biswasら、2014;Jain&Jaiswal、2007;Martin、Rehani、Jope、&Michalek、2005;Wang、Brown、&Martin、2011)。GSK3の阻害は、急性肝不全および虚血・再灌流の動物モデルにおいて、肝サイトカイン産生を減少させる(Chen et al.、2012;Ren et al.、2011)。したがって、TCWによって観察された炎症性TnfおよびIl6の減少ならびに抗炎症性HMOX1の増加は、AKTを介したGSK3の阻害を介したものであると考えることができる。このことは、我々の実験で見られたTCW存在下でのGSK3のS9/21での阻害的リン酸化の増加と一致するだろう(図4d)。
TCWの有効成分には、植物二次代謝産物、植物ホルモン、ビタミン類、アミノ酸などが含まれる。例えばクマリン、4-ヒドロキシクマリン、クマリン酸、フェルラ酸グルコシド、プロシアニジン、シキミ酸、キナ酸はTCWで同定され、実験環境において抗酸化作用および肝保護作用を示すことが知られている(Kumarら、2018; Mannaら、2014)。我々の分画アプローチは、極性に基づく植物化学成分の明確な分離をもたらす(補足図2;フロースルー(パネルB)のピーク1〜4、溶離液(パネルD)のピーク5および6を参照)。iNOS抑制活性はフロースルー画分で示されたが、溶出液画分では示されなかったことから、フロースルー画分のより極性の高い成分は生物活性とよく相関していると考えられ、今後の研究においてさらなる特性解明が必要である。
結論
TCWは、in vitroにおいて、AKTおよびJNKシグナル経路を通じてNos2 mRNAおよびiNOSタンパク質の発現を抑制することにより、肝細胞のIL-1β仲介炎症性障害を抑制する。我々の研究は、TCWが肝細胞の炎症性サイトカインの発現を減少させ、急性期タンパク質であるSerpine1およびHMOX1の発現を増加させたことを示している。この結果は、TCWが肝Nos2の発現が亢進している状況において、治療薬として有益となる可能性を示唆している。TCWの有益な効果について、さらなる研究が望まれる。
ハイライト
- テンダーココナッツウォーター(TCW)は、IL-1βによる肝細胞のiNOSの発現を抑制する。
- TCWはIL-1βによって誘導されるTnfとIl6の発現を抑制する。
- TCWはSerpine1 mRNAの発現およびHMOX1タンパク質の発現を増加させる。
- TCWは、AKTおよびJNKシグナル伝達経路を活性化する。
