Temperature Dependence of the SARS-CoV-2 affinity to human ACE2 determines COVID-19 progression and clinical outcome
2020年12月16日
www.ncbi.nlm.nih.gov/pmc/articles/PMC7738279/
要旨
SARS-CoV-2ウイルスとその同族体であるSARS-CoVは、ウイルススパイク蛋白質とヒトアンジオテンシン変換酵素II(ACE2)が結合してヒト細胞に侵入する。SARS-CoVはほぼすべての患者に高熱を引き起こすが,SARS-CoV-2は高熱を引き起こさない。さらに、臨床データを解析した結果、COVID-19患者では体温の上昇が防御因子であることが明らかになり、SARS-CoV-2のヒトACE2受容体への結合親和性は温度に依存していると考えられた。
本研究では、分子動力学シミュレーションとタンパク質表面プラズモン共鳴を用いて、40℃ではSARS-CoV-2-ACE2結合は最適温度37℃(6.2nM)に比べて親和性が低く安定であることを証明したが、SARS-CoV-ACE2結合はそうではなかった(6.4nM vs. 8.5nM)。
また、温度が高いほど感染率が低下することは、Vero細胞やCaco-2細胞を用いたシュードウイルス侵入アッセイでも確認された。また、2つのコロナウイルスの温度依存性の構造的基盤を明らかにした。さらに、メタ解析の結果、COVID-19の初期段階では炎症反応が穏やかであることが明らかになり、COVID-19の微熱傾向を説明し、ウイルスタンパク質の構造と炎症反応の共進化が示唆された。また、結合親和性の温度依存性から、COVID-19の初期段階で体温を高くすることがCOVID-19患者にとって有益である可能性が示唆された。
1. はじめに
コロナウイルスは、コロナウイルス科に属するウイルスの中で最大のグループであり、通常は呼吸器疾患を引き起こす。ヒトのコロナウイルスは7種類あり、そのうち4種類(HCoV-NL63,HCoV-229E、HCoV-OC43,HKU1)は限定的な軽度の呼吸器症状を引き起こす。一方、他の3つは動物由来の高病原性コロナウイルス-重症急性呼吸器症候群コロナウイルス(SARS-CoV)中東呼吸器症候群コロナウイルス(MERS-CoV)重症呼吸器疾患を引き起こす2019コロナウイルス(SARS-CoV-2)-である。SARS-CoV-2は、パンデミックコロナウイルス疾患2019(COVID-19)を引き起こしている。
COVID-19の重症患者では、急性呼吸窮迫症候群(ARDS)による呼吸不全が死亡原因の第一位となっている[1]。重症患者の致死率は67%にも達することがある[2]。そのため、重症化につながる可能性のある要因を分析することが臨床では不可欠である。1099人のCOVID-19患者の臨床統計から興味深い結論が得られた。入院時体温、入院中の発熱、結膜うっ血、鼻づまり、頭痛、咳、喉の痛み、痰の分泌、疲労、喀血、嘔吐時の吐き気などを含むすべての呼吸器症状を考慮した中で、死亡には直接関係しないが死亡の予後を予測する唯一の統計学的に有意な因子は入院時体温である:死亡例は生存例(37.3℃)よりも有意に低体温(36.8℃)であった[3], [4]。米国のCOVID-19患者を対象とした別の研究でも、低体温(36℃以下)の患者は高体温の患者に比べて有意に死亡率が高いことが示された[5]。
SARS-CoVとSARS-CoV-2のゲノムサイズは通常29kbである。SARS-CoV-2は 2002-2003年に重症急性呼吸器症候群(SARS)のアウトブレイクを引き起こしたSARS-CoVと80%以下のゲノム相同性を共有していた。コロナウイルス粒子は、4つの主要な構造タンパク質を含む。これらは、スパイク(S)膜(M)エンベロープ(E)およびヌクレオカプシド(N)タンパク質であり、これらはすべてウイルスゲノムの3′末端内にコードされている。Sタンパク質(∼150 kDa)は、グリコシル化されたホモ三量体である。三量体のSタンパク質は、宿主受容体への接着を媒介している。コロナウイルスのSタンパク質は、2つのポリペプチドに切断される。S1とS2 [6]。S1はSタンパク質の受容体結合ドメインを構成し、S2はスパイク分子の茎を形成する [7]。
実際、両CoVのヒト細胞への侵入は、スパイクタンパク質(Sタンパク質)RBDドメインとヒトアンジオテンシン変換酵素II(ACE2)との結合によって媒介される[8]。しかし、これら、 2つのCoVの臨床症状は大きく異なる。最も認識しやすい違いは、患者の体温である。SARSは全症例の97%で高熱(>38℃)を示し、非常に有効なスクリーニングマーカーとなっている[9]。一方、SARS-CoV-2では、入院時に発熱(37.5℃以上)を示した患者は43.1%に過ぎず、そのうち38℃以上の高熱を示した患者は21.7%に過ぎなかった[10]。近年、多くの無症候性感染者が確認されており、人口の17.9%〜41.6%と推定されている[11], [12]。COVID-19患者の体温が「ほぼ正常」であることは,群集の中から患者を迅速にスクリーニングする上で大きな課題となっている.COVID-19感染者の86%は文書化されていないと推定されており、そのために病気の急速な広がりを促進している[13]。
温度はタンパク質-タンパク質相互作用の親和性に影響を与える可能性がある。したがって、我々は、SARS-CoV-2 RBD-ACE2親和性は高温(>38℃)で低下するが、SARS-CoV RBD-ACE2親和性は低下しないと仮定する。これが本当であれば、患者が高熱を出した場合にはウイルスの増殖が遅れ、ウイルス障害の進行を遅らせることになる。本研究では、この仮説を計算と実験の両面から検証し、臨床に役立つ可能性を示した。
2. 材料と方法
2.1. 分子動力学シミュレーション
SARS-CoV-2 Sタンパク質RBDドメインとヒトACE2の複合構造は、Nation Microbiology Data Center (ID: NMDCS0000001) (PDB ID: 6LZG)より取得した。PDBデータベース(PDB ID: 2AJF)より、SARS S-protein RBDドメインとヒトACE2の複合構造を取得した。分子動力学シミュレーションは、GROMACS 2019を用いて、以下のオプションとパラメータで行った:陽溶媒モデル、系温度37℃と40℃、OPLS/AA全原子力場、LINCS拘束。2fsステップで、各シミュレーションを100nsで行い、各モデルを3回シミュレーションして、3つの独立した軌跡の複製を生成した。結合自由エネルギー(ΔG)はMM-PBSA法(GitHubからしたソフトウェア:https://github.com/Jerkwin/gmxtool)を用いて計算し、構造平衡後の軌道はRMSD(Root Mean Square Deviation)7を用いて評価した。平衡状態での軌跡から、揺らぎを表す各アミノ酸のC-αのB-係数を導出した。B-factorは、=83π2Ps・27E8 contains|Δr|2Pe・27E9 containsと定義され、ここで、Ps・27E8 contains|Δr|2Pe・27E9 containsは、平均位置に対する平均二乗原子変位である[14]。b因子を持つ平均構造は、GROMACS 2019を用いて生成した。構造はPymolソフトウェアを用いて可視化した。
2.2. 表面プラズモン共鳴(SPR)実験
SPR実験は、BIAcore T200装置(GE、米国)で行った。SARSおよびSARS-CoV-2 S-タンパク質は、マニュアルプロトコルに従って、それぞれセンサーチップNTA(GE、米国)に固定化した。ヒトACE2タンパク質を8濃度(3.125,6.25,12.5,25,50,100,200,400nM)で各実験に注入した。各サイクルについて、吸収相は120秒持続し、解離相は600秒持続した。各サイクルの後、チップを350mM EDTAおよび50mM NaOHを用いてそれぞれ120秒間再生した。0nM ACE2を用いたブランクコントロールを行い、ブランクシグナルをサイクルシグナルから減算した。各タンパク質について、実験はそれぞれ36,37,38および40℃で実施した。KD値は、装置に付属のソフトウェアを使用して曲線をフィッティングすることにより計算した。
2.3. SARS-CoV-2偽ウイルスの産生と滴定
SARS-CoV-2株Wuhan-Hu-1(NC_045512.2)の完全長S遺伝子をSARS-CoV-2 Spikeベクター(PackGene, Guangzhou, China)にクローニングし、配列決定により確認した。pNL4-3-Luc-R-EのプラスミドとSARS-CoVスパイクベクターpuc-SARS-CoV-spike [15]は復旦大学のLu Lu教授から寄贈された。
SARS-CoV-2およびSARS-CoVスパイクHIV-1バックボーンシュードウイルスの生成は、以前に記載されたように、いくつかの修正を加えて行われた[16], [17]。簡潔に説明すると、SARS–CoV-2スパイク偽ウイルスについては、293T細胞を、それぞれ9μgのpLv-CMV、6ugのpSPAX-レンチウイルスおよび6ugのpCB-スパイクを、70〜90%のコンフルエンスの150mmプレートに共導入した。SARS–CoVスパイク疑似ウイルスについては、293T細胞を、15μgのpNL4-3-Luc-R-Eおよび15μgのpuc-SARS-CoVスパイクを70〜90%コンフルエント150mmプレートに共トランスフェクトした。疑似ウイルスは、2.5mlの滅菌シリンジを用いて、48時間後のトランスフェクションを収穫し、その後、シリンジ駆動0.45μmフィルターを介してファルコンまたはマイクロ遠心管に濾過した。ウイルス導入された滴定は、(RT)-qPCR標的をWPREまたは疑似ウイルスのエンベロープ遺伝子上で絶対定量を介して測定した。SARS-CoV-2シュードウイルスのウイルス導入価は、WPRE遺伝子を標的とするプライマーを用いたリアルタイム(RT)-qPCRを用いて、ウイルスストック溶液1mlあたりのウイルス導入DNA数を求めることにより算出した。センスプライマー:5′-CACCACCTGTCAGCTCCTTT-3’、アンチセンスプライマー:5′-ACGGAATTGTCAGTGCCCAA-3’SARS-CoV-2偽ウイルスの力価は、エンベロープ遺伝子を標的とするプライマーを用いたリアルタイム(RT)-qPCRを用いて、ウイルスストック液1ml当たりのウイルス導入ゲノム数を決定して算出した。センスプライマー:5′-TAGTAGTAGGAGGCTTGGTAGG-3’、アンチセンスプライマー:5′-AGGTGGGTCTGAAACGATA-3’を用いた。
2.4. SARS-CoV-2およびSARS-CoVスパイク媒介シュードウイルス侵入アッセイ。
温度依存性ウイルス侵入を試験するために、24ウェルプレートで増殖させたVero E6およびCaco2細胞(5×104)を、250μL DMEM中の等しい2.1×103 TUシュードウイルスでそれぞれ感染させた。浸潤は、それぞれ37℃および40℃の条件下で行った。その後、培地中のウイルスを洗い流し、細胞を37℃で培養した。感染後3時間後に細胞を回収するか、または感染後6時間後に150μLの新鮮なDMEM培地を添加した。標的エンベロープ遺伝子のRNAとDNAコピー数から算出した感染ウイルスの相対的な倍数変化を感染3hおよび24h後に測定した。RNAは感染後3hにTrizolを用いて抽出し、Reverse Transcriptase M-MLV(RNase H free)(タカラ、日本)を用いて逆転写した。TB Green™ Premix Ex Taq™ II (Tli RNaseH Plus) (日本、タカラ)を用いたリアルタイム(RT)qPCRを用いて、侵入シュードウイルスRNAと導入されたDNAコピーの関連倍数を算出した。
また、エンベロープ遺伝子を標的としたプローブとプライマーを用いたリアルタイム(RT)-qPCRおよびqPCRを用いて、1本あたりのウイルス導入ゲノム数を決定することにより、疑似ウイルスの関連倍数を算出した。
3. 結果
3.1. 温度依存性侵襲の臨床的ヒント
もし高熱がウイルスの侵入を弱めるならば、高熱の患者はウイルス負荷が低くなる。この仮説を検証するために、Zouら[18]の発表データを再解析した。ウイルス負荷はRT-PCR実験のCt値(閾値でのサイクル)で評価した。Ct値が低いほどウイルス負荷が高いことを示す。発熱患者を低熱(37.5〜38℃)と高熱(>38℃)の2つのグループに分けた。各グループの患者数が最大となるように咽頭スワブの結果を採取した。その結果、高熱群のCt値は低熱群よりも有意に高く(P=0.0444,片側Mann-Whitney U-test、図1)低熱群の方が高熱群よりもウイルス負荷が有意に高いことを示しており、温度依存性浸潤仮説を支持する臨床データとなった。
図1 低熱患者と高熱患者のRT-PCR Ct値
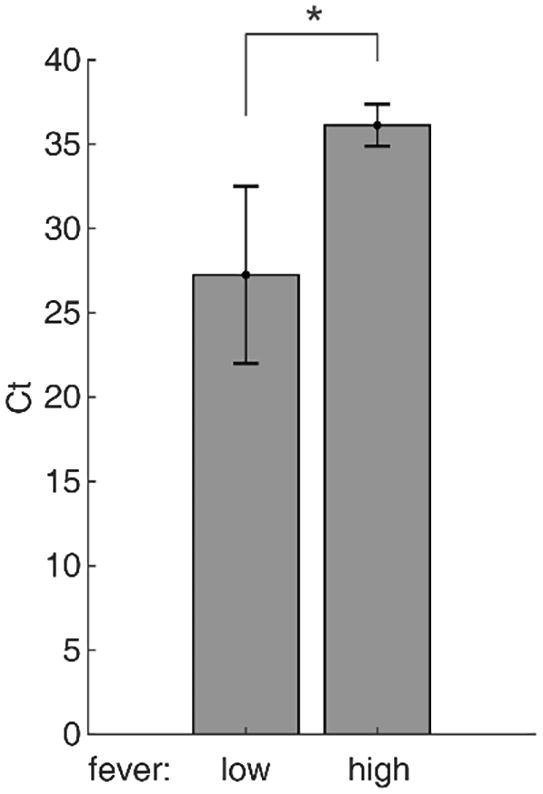
データは平均値±SEで示す。
3.2. RBD-ACE2結合親和性の温度依存性
SARS-CoV-2侵入の最初のステップはヒトACE2とスパイク蛋白質のRBDとの結合であり、この結合親和性は温度によって影響を受ける可能性がある。RBD-ACE2結合親和性の温度依存性を調べるために、まず、ヒトACE2とSARS-CoV-2のRBDおよびSARSのRBDが結合した複合体について分子動力学シミュレーションを行った。シミュレーションは、それぞれ37℃および40℃の温度設定で行った。各シナリオは、100nsのシミュレーションを行い、3回繰り返した。複合体のRMSD曲線は、50ns後に平衡に達した(図2A)。SARS-CoV-2の40℃での結合エネルギー(ΔG)は37℃での結合エネルギー(ΔG)よりも有意に高かった(P=0.0179,Student t-test)が、SARSは両温度で有意な差を示さなかった(図2B)。このことから、ヒトACE2は高温ではSARS-CoV-2との結合が弱く、SARSとの親和性は変わらないことが示唆された。
図2 RBD-ACE2結合親和性の計算および実験的評価
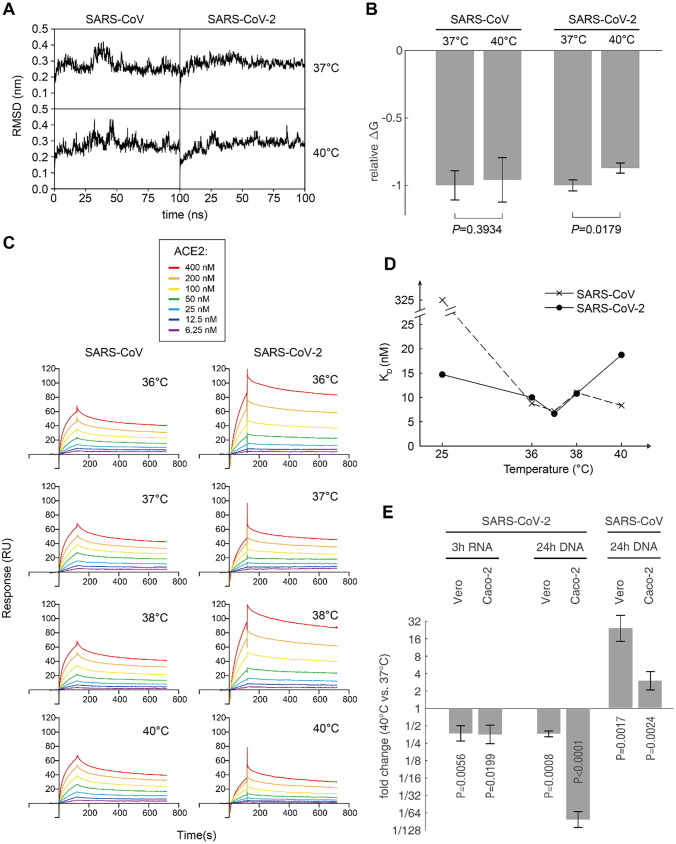
(A) RBD-ACE2複合体の37℃および40℃における100ns分子動力学シミュレーション軌跡の代表的なRMSD曲線。B)それぞれ各CoVの37℃におけるΔGを用いて正規化した相対結合自由エネルギー(ΔG)。ΔGが低いほど親和性が高いことを意味する。データは平均値±SD(3つの独立した複製)で示す。C)異なる温度でのヒトACE2に結合する2つのCoVのSタンパク質の表面プラズモン共鳴(SPR)アッセイ。結合データの詳細は、補足表S1にまとめられている。D)異なる温度でのSPR実験を用いて測定したKD値。25℃におけるデータポイントは、Wrappら[19]から引用した(E)Sタンパク質含有シュードウイルス感染アッセイ。ACE2過剰発現ベロ細胞およびカコ-2細胞を宿主として使用した。浸潤は37℃および40℃で行い、細胞を洗浄して未浸潤ウイルスを除去した。その後、細胞を37℃で培養した。浸透したウイルスRNAを感染3時間後に測定し、宿主に統合されたウイルスゲノムをqPCRで測定した。
in silicoで得られた結果を実験的に検証するために、36℃から40℃までの間で、完全長Sタンパク質とヒトACE2の結合親和性を測定する表面プラズモン共鳴(SPR)実験を行った(図2C)。36℃から38℃では、2つのコロナウイルスのSタンパク質はヒトACE2とほぼ同じ親和性で結合していた。しかし、40℃では、SARS-CoV-2のSタンパク質の親和性は著しく低下し、平衡解離定数(KD)は3倍近くまで有意に増加した(P=0.0002,Student t-test)が、SARS RBDは低温時と同様のKDを維持していた(図2D)。これらのデータは、実験的に計算結果と我々の仮説を検証した。
また、試験管内試験での結果を検証するために、SARS-CoV-2の侵入効率を生体内試験で実験した。ACE2 を発現させた Vero 細胞と Caco-2 細胞を用いて、それぞれ S タンパク質含有シュードウイルス感染アッセイを行った。感染効率は2つの次元で評価することができる:a)侵入後まもなく宿主細胞内のウイルスRNA、これは侵入したウイルスの直接的な尺度である;b)宿主ゲノムに統合されたレンチウイルスゲノムのコピー数、これは細胞に侵入した機能的なウイルスの数を表している。感染の3時間後にqRT-PCRを行ったところ、40℃での浸透ウイルスRNAは、37℃での浸透ウイルスRNAと比較して、Vero細胞では37.0%、Caco-2細胞では35.5%にとどまった。また、感染24時間後には、40℃での統合されたウイルスゲノムは、37℃でのものに比べ、Vero細胞では36.5%、Caco-2細胞では1.20%にしか達しなかった(図2E)。図2E)40℃での減少はすべての実験で統計的に有意であった(P<0.05,t検定)。これは、高温ではSARS-CoV-2 RBDのACE2に対する親和性が低下し、ウイルスの侵入を遅らせることを示している。一方,SARS-CoVでは,感染後のコピー数は40℃で37℃よりも高くなった(図2E).
3.3. SARS-CoV-2の温度依存性親和性の構造的基盤
RBDはヒトACE2と直接相互作用するドメインである。Sタンパク質とは比較的独立した構造をしている。このドメインの中心には、βシート構造によって構築された足場がある。この足場がドメイン全体、特に結合部位を安定化させており、主にランダムコイル構造になっている(図3A)。平衡時の柔軟性は構造の剛性を反映しており、これは各アミノ酸のCα原子のB係数によって評価することができる[14]。より剛性の高い構造は、結合親和性を強化する。温度を37℃から40℃に上昇させると、SARS-CoV-2 RBDの結合状態での揺らぎは、特に結合部位や足場の下部付近で顕著に増加する。これに対して、SARSのRBDはほとんど差が見られなかった(図3B)。これらの結果は、2つのRBDの温度依存性のパターンを説明している。
図3 結合親和性の温度依存性の構造的基盤
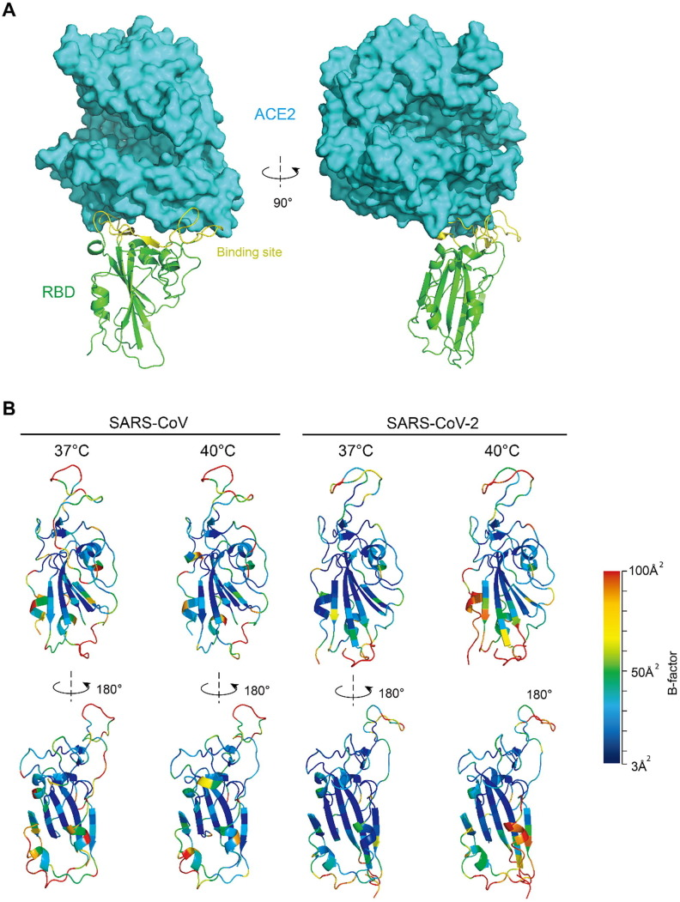
A)SARS-CoV-2 RBDとヒトACE2複合体の構造。(B) 各アミノ酸のBファクターに応じて色分けされたRBDバックボーン。Bファクターが高いほど変動が大きく、柔軟性が高いことを意味する。
4. 議論
本研究では、SARS-CoV-2 Sタンパク質のヒトACE2への結合親和性の温度依存性を明らかにした。SARS-CoV-2 S-proteinのヒトACE2に対する結合親和性は、37℃で最適化され、40℃ではRBDドメインの揺らぎが大きくなるために有意に低下することが明らかになった。この特徴は、高体温でも同じような結合親和性を示す相同性のSARS-CoVとは区別された。この知見は、臨床的にも生化学的にも重要な示唆を与えるものと考えられる。
高熱はウイルス感染に対する旺盛な反応である。高熱(>38〜38.5℃)が続くことによる臓器障害を避けるために、高熱が検出された場合には直ちに体温を下げるための輸血が行われることが多いであるが、高熱の初期段階では体温が上昇している。しかし、SARS-CoV-2感染初期の高熱はヒト細胞との結合を阻害し(図1)ウイルスの進行を遅らせ、患者のウイルス負荷を低下させる(図3)。このことは、ウイルスと宿主細胞のKDがウイルスの増殖度に負の相関があるという以前のモデルと一致している[20]。早期のウイルス負荷が低いほど、多臓器の病変を遅らせることができ、多臓器が重症化する前に免疫系がウイルスを殺してクリアする時間を確保することができる。入院時の体温が高いことは呼吸器症状の中で唯一の要因であり、致死率が有意に低いこと[10]、小児患者の約80%が高熱であり、肺炎は成人患者ほど重症ではなかったが、その中で高熱は21%しかなかった[21], [22], [23], [24], [25]。
COVID-19とSARS患者の自然免疫応答の違いを調べ、COVID-19の微熱傾向を説明するために、2300人の患者の臨床データを解析した。身体的炎症反応の発現である発熱は、ウイルス侵入後、特にマクロファージ、樹状細胞、リンパ球などの免疫細胞が感染した場合に、サイトカインやケモカインの異常産生・放出によって引き起こされる[26]。SARS-CoV-2はSARS-CoVに比べて炎症反応(サイトカインの放出)が穏やかであり、これが初期の発熱の低さを説明する一因となっている。SARS-CoVはマクロファージやリンパ球で炎症性サイトカインの産生や発火を誘導したが[27]、SARS-CoV-2も同様の機能やメカニズムを持つかどうかはまだ不明である。2つのCoVの特徴的な免疫指標は、これら、2つの疾患の免疫応答経路が根本的に異なることを示唆しており、今後の研究の価値があると考えられる。したがって、SARSとMERSの免疫反応から得られた知見を参考にして、COVID-19の研究や治療を行う際には十分な注意が必要である。
COVID-19患者の初期段階でのマイルドな免疫反応は、患者のウイルス進行を最適化する。また、死亡例のほとんどが初期段階では重篤な症状を示さなかったが、疾患の後期や回復の過程で急に症状が悪化したという事実も一致している。後期になると、サイトカインストームがARDSの原因であると考えられていた[28]。COVID-19では、後期のサイトカインの大量放出のメカニズムはまだ明らかになっていないが[28]、SARS患者よりも好中球、リンパ球、単球の数が多いことから、過剰なサイトカインによって刺激され、突然の重篤な病変を引き起こし、ARDSに至ったと考えられる。このことは、二次性血球貪食細胞性リンパ組織球症(sHLH)という炎症性亢進症候群がARDSの引き金になるという意見と一致している[29]。過剰なサイトカインはまた、後期の体温を上昇させる。これは、入院中の最高体温が臨床転帰に関係しないという事実を説明している[10]。これらの知見を総合すると、高炎症性sHLHの前の初期段階でウイルス感染と進行をコントロールすることの重要性が強調されている。SARS-CoV-2期の初期段階では、一般的には解熱剤の使用は避けるべきであるが、体温を一時的に上昇させる治療法も考えられる。
SARSもCOVID-19も自己限定性の疾患(自然治癒する疾患)であり,病原体が生存するためには健康な人に継続的に感染する必要がある.偶然にも、SARS-CoVとSARS-CoV-2は、ヒトの正常体温である37℃で最も低いKD(すなわち、最も高い親和性)を示している(図1D)。これは、健康な人に感染するように最適化されていることを示しており、進化が生み出した特徴かもしれない。しかし、感染に成功した後、これら、2つのウイルスは炎症反応を異なる形で刺激する。SARS-CoV-2は、体温を比較的低く保つためにサイトカインを低レベルに保つ傾向があり、そうでなければ高熱で進行が遅れる。しかし、SARS-CoVの結合親和性は高温時に最適化されているため、低温時にはその進行を遅らせることになる。Sタンパク質RBDドメインの特異的な構造的性質が、温度に依存した構造剛性を決定し、その結果、温度に依存した親和性を決定する。これが、これら、 2つのウイルスの異なる進化の方向性を駆動している。別の側面では、霊長類以外のほとんどの他の哺乳類および鳥類は、37℃より高いか、またはそれ以下の正常な体温を示している[30]。このことは、SARS-CoVおよびSARS-CoV-2ウイルスが、発生前にヒト宿主に十分に適応していたことをある程度示唆している。このことは、SARS-CoV-2が中国武漢で発生するずっと前から人間社会に蔓延していたのではないかという意見と一致している[31]。
