www.ncbi.nlm.nih.gov/pmc/articles/PMC8952284/
Nutrients. 2022 Mar; 14(6): 1292.
2022年3月18日オンライン公開
要旨
肥満、2型糖尿病およびそれらに関連する併存疾患は、脳の代謝および機能に影響を与え、認知機能障害のリスクファクターとなる。タウリンのホメオスタシスの変化は、浸透圧コントロール、カルシウムのホメオスタシス、抑制性神経伝達など多くの生物学的プロセスに影響を与え、代謝性疾患および神経変性疾患の両方で報告されている。神経変性疾患のモデルでは、脳内タウリン濃度が低下していることが確認されている。一方、インスリン依存性糖尿病、インスリン抵抗性、食事誘発性肥満のモデルでは、海馬にタウリンが蓄積していることが確認されている。タウリンの細胞保護作用が期待されることから、このような脳内蓄積は神経変性を予防しようとする代償機構を構成している可能性がある。本稿では、脳内タウリンのホメオスタシスについて概観し、肥満や糖尿病患者におけるタウリンによる神経保護作用の機序について検討した。そして、脳機能に影響を及ぼす代謝性疾患におけるタウリンのホメオスタシスを理解するために、さらなる研究が必要であると結論づけた。
キーワード2-アミノエタンスルホン酸、神経変性、脳代謝、糖尿病、肥満症
1.はじめに
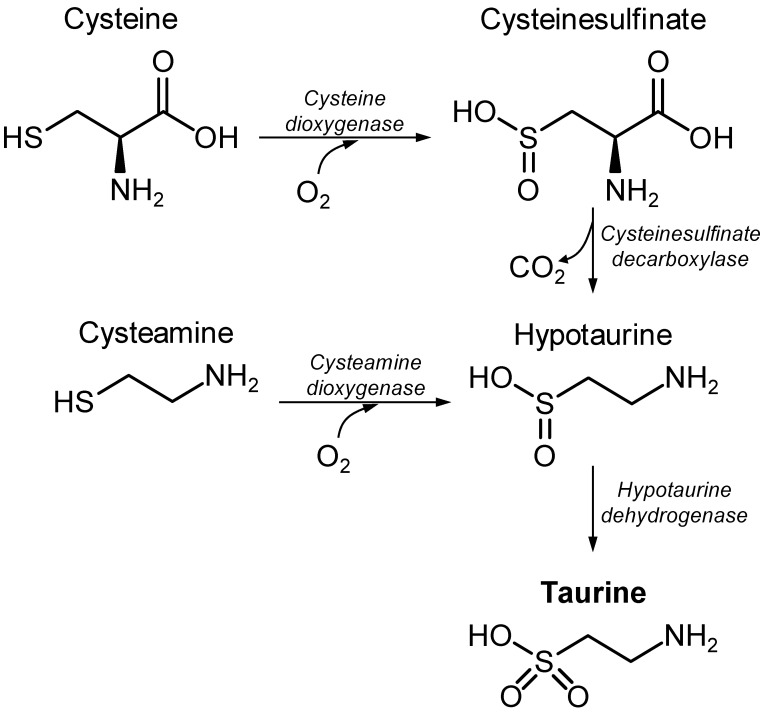
タウリン(2-アミノエタンスルホン酸)は、1827年にFriedrich TiedemannとLeopold Gmelinによって牛の胆汁から初めて単離された。タウリンは、食事から摂取されるか、アミノ酸であるシステインの異化作用によりde novo 合成される(図1)。タウリンはグリシンと共に胆汁酸アミド化作用があり、胆汁酸塩を生成して排泄することがよく知られている。タウリンの補給は、例えば、高血圧[1,2]、うっ血性心不全[3]、虚血再灌流心筋障害[4]、脳内出血[5]、肺線維症[6]、肥満による低級炎症[7]など多くの疾患に対して有効であると示唆されている。タウリンの神経保護効果はかなり注目されており、神経学的障害の動物モデル(Jakariaらによるレビュー[8])と同様に、in vitroでニューロンまたはアストロサイトの毒性を防ぐ外因的に加えられたタウリンの能力を示す多くの出版物がある。すなわち、タウリン処理は、酸化ストレス(例えば、[9])、ミトコンドリアストレス(例えば、[10])、または炎症(例えば、[11])に対して組織および細胞を保護することが示されてきた。また、脳内タウリンは、浸透圧調節因子および神経調節因子として知られており[12,13]、神経細胞の興奮性の調節、心肺系の大脳制御、食欲調節、低酸素への抵抗、浸透圧調節、抗酸化など多数のプロセスに関与している[14]。タウリンを合成する酵素はネコ、イヌ、キツネで活性が低く、タウリン欠乏食を与えると心筋症や心筋機能障害、網膜変性、神経異常、免疫反応の低下、妊娠・胎児の発育合併、胃腸障害という病態を呈する([15]およびその参考文献を参照のこと)。これは、タウリンの重要性を提唱する明確な証拠である。
図1 哺乳類において硫黄アミノ酸システインからタウリンが合成される
タウリンは中枢神経系に最も多く存在する代謝物の一つであり、その量は生物種、脳部位、発達段階によって大きく異なっている(図2)。特に発達期の脳ではタウリンの濃度が高いことから、発達段階におけるタウリンの重要性が示唆されている。実際、血漿タウリンと神経発達の関係が提唱されている[16]。CNSの発達におけるタウリンのこの役割は,タウリン欠乏食を与えた猫の実験によって明らかにされた[17]。さらに最近の研究では、タウリンには神経栄養効果があり、脳の発達の初期段階における神経突起の伸長、シナプス形成、シナプス伝達において重要な役割を果たすと提唱されている[18,19]。
図2 各種動物種の血漿中(A)および大脳皮質(B)、マウス脳の各部位(C)、発生期のマウス大脳皮質(D)のタウリン濃度
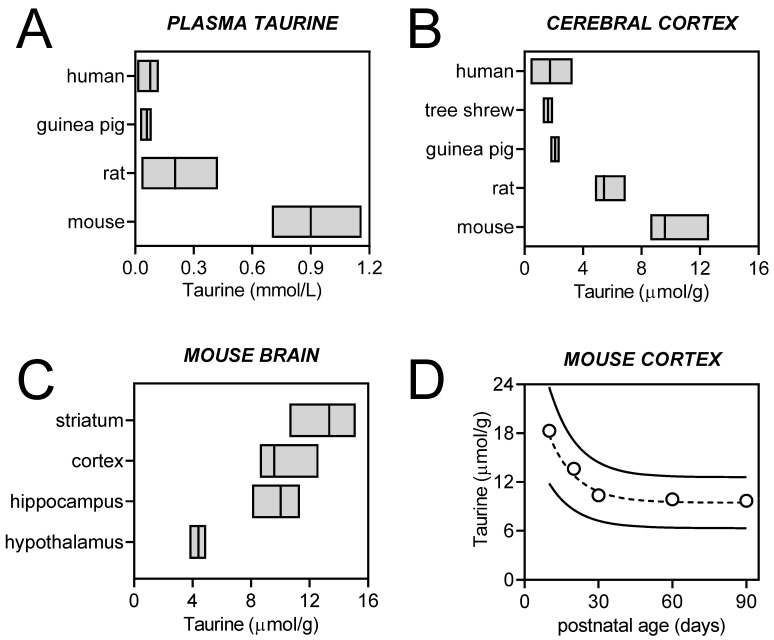
血漿中タウリン濃度は、ヒト[2,20,21,22,23,24,25,26,27]、モルモット[28,29]、ラット[30,31,32,33,34,35,36]、マウス[37,38,39,40,41]の平均値と範囲で示している。プロットされた脳内タウリン濃度範囲は、ヒト[42,43,44,45,46,47]、ツリートガリネズミ[48]、モルモット[49]、Sprague-Dawley ラット[50,51,52,53,54,55] 及びC57BL/6J マウス[38,56,57,58,59,60]に対する1H MRS 研究で報告されている濃度がベースになっている
2. タウリンのホメオスタシス
タウリンは腸で吸収され、血流に放出され、腎臓から尿として、肝臓からは胆汁酸に抱合されて排泄される[14,61]。血漿中ではサブミリモル濃度のタウリンが観察され(図2A)、心臓などのエネルギー代謝率の高い臓器でははるかに大きな濃度で存在する[62,63,64,65]。
2.1. 脳内タウリンの輸送
脳内のタウリンは、末梢からの輸送(主な供給源と考えられている)と局所的なde novo合成によってもたらされる。ほとんどの哺乳類では、タウリンは主に肝臓で合成され、その後血液脳関門を通って脳実質に活発に輸送される。
タウリンは、ヒポタウリン、β-アラニン、その他のβ-アミノ酸と同様に、高親和性、低容量のNa+-およびCl-依存性の輸送系によって血液脳関門を通過して脳に取り込まれる[66,67]。血液脳関門を通過するタウリンの受動拡散はごくわずかである[14]。内腔膜とアルブミン膜の両方におけるタウリンの取り込みまたは排出は、TauTとも呼ばれるSLC6A6トランスポーターによって媒介されることが提案されている[68]。血液脳関門にはGAT-2として知られるGABAトランスポーターSLC6A13も発現しており、膜を越えてタウリンを運ぶ能力がある[69,70]。TauTとGAT-2の両方は、ヒポタウリンを効率的に運ぶことができる[71]。マウスにおけるタウリントランスポーター(TauT)の遺伝子欠損は、血漿および脳を含む組織におけるタウリン濃度を低下させる[37]。一方,マウスでGAT-2を遺伝子欠損させると脳内タウリン濃度が上昇することから,GAT-2は主にタウリンの脳から血中への排出系として機能していることが示唆された[69]。
TauTはアストロサイトで発現し、ニューロンではそれほどでもない[72,73]。GAT-2の発現は、レプトメニングと血管に限定されているようである[74]。タウリンはまた、一般に体積調節陰イオンチャネル(VRAC)と呼ばれるユビキタスに発現する体積感受性有機浸透質-陰イオンチャネルによって輸送され、細胞の膨張によって活性化される([75]とその中の参考文献を参照されたい)。脳実質内では、タウリンの取り込みはTauTが、タウリンの放出は主にVRACが仲介していると提唱されている。古川らは、マウス新皮質において、タウリンの取り込みはTauT阻害剤で、タウリンの放出はVRAC阻害剤で阻害されることを示している[76]。
2.2. タウリンの代謝
タウリンの合成は、神経細胞とアストロサイトの両方でシステインの異化から起こり(図1)、ヒポタウリンの酸化によって制限される[77,78]。システインジオキシゲナーゼとシステインスルフィネートデカルボキシラーゼは協調してシステインからヒポタウリンを生成している。マウスにおけるシステインジオキシゲナーゼの遺伝子欠損は、ヒポタウリンとタウリンを枯渇させる一方で、システインとグルタチオンなどのシステイン含有代謝物の蓄積を引き起こす[48]。システイン硫酸脱炭酸酵素の遺伝子欠損も、脳内のタウリンレベル(対照群の4倍)だけでなく、血漿や他の組織内のタウリンレベルも減少させる[79]。これらのマウスモデルのいずれでも、脳容積の減少を含む発達障害が見られる。システアミンはまた、システアミンジオキシゲナーゼを介してヒポタウリンに変換されることができる。ヒポタウリンからタウリンの生合成を触媒する酵素(ヒポタウリンデヒドロゲナーゼと呼ばれる)の正体は不明のままであった。最近,Veeravalliらは,ヒポタウリンからタウリンへの酸素添加は主にフラビン含有モノオキシゲナーゼ1によって触媒されると提唱した[80]。従って、マウス脳におけるこの酵素の発達的発現は、脳内タウリンレベルの発達的減衰に伴っている[81](図2)。
神経細胞やアストロサイトはタウリントランスポーターを発現し(例えば[82])、システイン酸化に由来するヒポタウリンやタウリンを放出する[77,78]。しかし、他で提案されているように、タウリン代謝が神経細胞とアストロサイトによって相互依存的に制御されているかどうかは、まだ実験的に決定されていない(Banerjeeらによる議論[83]を参照)。
2.3. 硫黄含有アミノ酸
タウリンはタンパク質合成に利用されない。一方、含硫アミノ酸であるメチオニンやシステインはタンパク質の構成成分であり、タンパク質の構造を維持する上で重要な役割を担っている。メチオニンは非常に疎水性の高いアミノ酸で、タンパク質と脂質二重膜の間などの相互作用に寄与する一方、システインは主に他のシステイン残基とジスルフィド結合を形成してタンパク質のフォールディングに関与している[84]。メチオニンは補酵素であるS-アデノシルメチオニンに代謝され、メチル供与体として働くことにより、エピジェネティックな制御 [85]やカテコールアミン代謝(エピネフリン合成)[86]など、多くの代謝経路に関与している。このようなトランスメチル化反応は、トランススルホ化によってシステインを生成するホモシステインを生成するために流されることがある[85,87]。注目すべきは、タンパク質の分解から生成されるメチオニンとシステインの両方が、最終生成物としてタウリンを生成することである[88]。
3. 細胞生理学におけるタウリン
3.1. タウリンによるオスモレギュレーション
細胞は浸透圧の変化に応じて膨張・収縮する.細胞外、細胞内の刺激や浸透圧変化に応じた細胞体積の調節は、細胞のホメオスタシスにとって重要である。神経活動は、活発なイオンフラックスの結果として細胞膜の分極の変化に関連し、細胞容積の調節に関与する(例えば、[89])。細胞の膨張に起因する病的な浮腫は、低浸透圧状態または細胞毒性イオンの不均衡が存在する場合に起こる。水分は主にアストロサイトに発現するアクアポリン-4を介して取り込まれるが、急性低浸透圧ストレス時には神経細胞とアストロサイトの両方が膨張することが報告されている(例えば、[90])。細胞の膨潤に対する反応として、いくつかの低分子有機化合物が細胞内の浸透圧に影響を与えることになる。
タウリンは、生理的pH範囲において双性イオン形態で存在し、浸透圧調節のための優れた代謝物となる[14,91]。実際、10mmol/Lまでの外因性タウリンに曝された神経細胞とアストロサイトは、細胞体積の変化なしに細胞外のタウリンを取り込むことができる[92]。有機浸透圧として作用するタウリン濃度が厳密に調節されていることと一致して、脳細胞をシステインまたはシステアミンに暴露すると、タウリンではなくヒポタウリン濃度が上昇する[78]。超融合マウス大脳皮質スライスは、浸透圧負荷時にタウリンの放出を制御する[93]。脳内タウリンレベルは、in vivoのラットでは2週間の低ナトリウム血症で減少し[94]、高ナトリウム血症では増加する[95]。したがって、培養神経細胞では高張力条件下でタウリン合成が促進される[78]。高浸透圧培地におけるアストロサイトは、タウリンを蓄積する[96,97]。これは、タウリン合成の刺激というよりも、タウリンの取り込みのためのTauTの発現が増加したためと考えられる[98]。一方、低浸透圧培地にて培養したアストロサイトはタウリンを放出する[99]が、このプロセスはVRACによって媒介されていると思われる[100]。浸透圧はタウリンによって調節されるが、K+とCa2+のバランスに対するこの化合物の他の効果もあり、これは神経伝達に対して意味を持つかもしれない[92]。
3.2. 神経伝達物質としてのタウリン
初期の研究では,タウリンのシナプトソームへの取り込みと電気刺激による放出 [101,102] ,さらにタウリンのシナプトソーム膜への結合 [103,104]が報告されている.このような観察から、タウリンは中枢神経系における神経伝達物質としての役割が示唆され、実際、タウリンは抑制性神経伝達のモジュレーターであることが判明した。
γ-アミノ酪酸(GABA)およびグリシンは、化学シナプスにおける抑制性伝達を仲介するアミノ酸である。GABAシナプスには、Cl-を透過するイオン性受容体GABAAとGABAC、代謝性受容体GABABの3種類のシナプス後膜受容体が存在する。グリシン受容体もまた、リガンド結合時にCl-に対して透過性を示す。タウリンはGABAA、GABAB、およびグリシン受容体と相互作用することが知られている(図3;[12,105])。GABAAおよびGABABへのタウリンの結合はGABAよりも弱いだが、タウリンはグリシン受容体のかなり強力なリガンドである[105]。
図3 グルタミン酸とプリン体によるニューロンまたはアストロサイトからの活性依存的なタウリン放出調節と抑制性受容体へのタウリンの作用の模式図
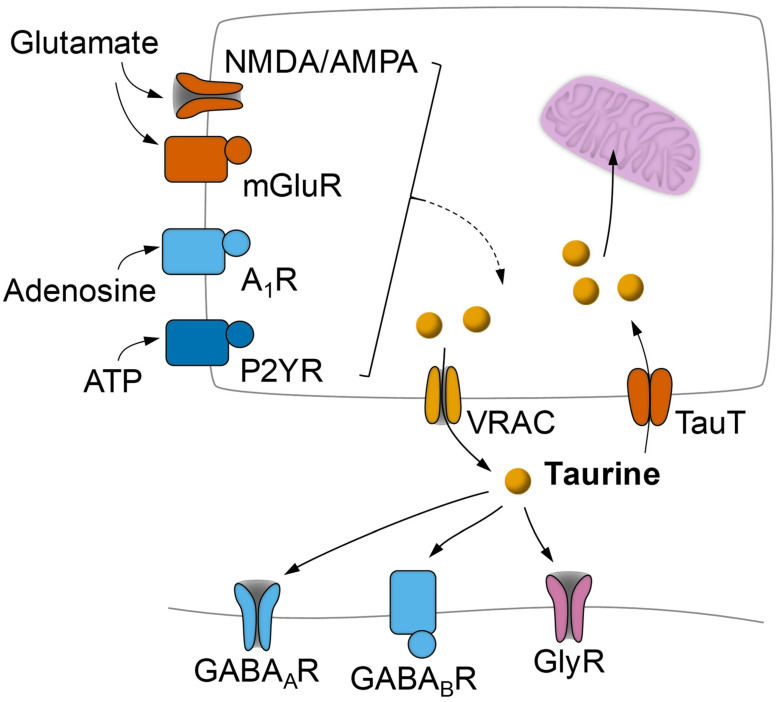
タウリン放出は主に低浸透圧条件や電気的活動によって活性化される体積調節性アニオンチャネル(VRAC)を介し、グルタミン酸代謝性(mGluR)およびイオン性受容体(主にNMDAおよびAMPA)、アデノシンA1受容体(A1R)および代謝性ATP受容体(P2Y)を介して刺激を受けることが可能である。タウリンは、GABAA、GABAB、グリシン受容体に結合することにより、神経調節作用を発揮する。タウリンの再取り込みは、タウリントランスポーターであるTauTによって行われる
細胞内のタウリン濃度は、細胞外の濃度の400倍と推定されている[30]。マイクロダイアリシスを用いて細胞外で測定した脳内のタウリン濃度は一般に10μmol/L以下であり、脱分極により少なくとも1桁増加する[106,107,108]。放出後、タウリンはGABAとグリシン受容体に作用し、ナトリウム依存性輸送によってクリアされる(上記参照)。タウリンの放出はシナプスのみで行われるのではなく、グリア由来であることもあり[109,110,111,112]、アストロサイトからニューロンへの伝達を媒介することもある[110,113]。
1mmol/L以下のタウリン濃度は、基底外側扁桃体 [114]、上坐骨核 [115]、海馬 [116]、側坐核 [117]、下小嚢 [118]のニューロンで観察されるように、グリシン受容体にむしろ選択的である。1mmol/L以上では、タウリンはGABA受容体も活性化する。しかし、タウリンは10~100μmol/Lの濃度でシナプス領域外GABAA受容体の内因性リガンドとして作用することが示された[119]。
グルタミン酸作動性神経伝達を調節しない一方で、タウリンは細胞質およびミトコンドリア内のCa2+ホメオスタシスを調節する。したがって、タウリンは、神経細胞におけるグルタミン酸誘発性Ca2+過渡現象、ひいては細胞内Ca2+依存性シグナル伝達メディエーターを弱めることができ、さらにはグルタミン酸興奮毒性を防ぐことができる[120,121,122]。したがって、タウリンの神経細胞の興奮抑制作用は、GABA作動性及びグリシン作動性神経伝達の直接的な増強、並びに細胞内作用を介したグルタミン酸作動性神経伝達の減衰に起因すると考えられる(El Idrissi and Trenknerによって論じられた[123])。
3.3. 中枢神経系におけるタウリン放出の調節
中枢神経系では、基礎的なタウリン放出はほとんどCa2+に依存せず、Ca2+依存性の成分はグルタミン酸およびK+によって刺激されることがある[124,125,126]。グルタミン酸によるタウリン放出の促進は緩慢かつ長期的であり、寿命にわたって変化し、NMDAおよびAMPA受容体、ならびに発達中の脳におけるカイニン酸受容体によって媒介される[125]。メタボトロピックグルタミン酸受容体もまた、急性海馬スライスからのタウリン放出を調節することが提案されている[127]。アデノシンはA1受容体を介してマウス海馬スライスからの基礎およびK+刺激タウリン放出の両方を調節することが提案されている[126]。アデノシンA1受容体の活性化は、発育期のマウスの海馬スライスにおいて基礎的なタウリン放出を増加させ、それを刺激したが、成体では基礎的な放出を抑制したが刺激された放出は抑制されなかった。ATPによるプリン体活性化も,ラット海馬培養神経細胞におけるタウリン流出を刺激することが提案された[128]。ATPはP2X受容体ではなくP2Y受容体を介した用量依存的なタウリンの喪失を引き起こし、これはVRAC阻害剤によってブロックすることができた。まとめると,タウリンの放出はグルタミン酸作動性活性とその調節因子(図3),すなわちプリン体によって生理的に制御されているようである.
3.4. ミトコンドリアにおけるタウリン
脳ミトコンドリア内のタウリン濃度は,シナプトソームなどの他の細胞内コンパートメントに見られる濃度と同じオーダーである[129] .最近、培養HeLa細胞において、ミトコンドリアマトリックス中のタウリン濃度もまた、全細胞中の濃度と同程度であることが決定された[130]。さらに著者らは,ピエリシジンで複合体Iを阻害するとタウリン濃度が40%低下するが,複合体IIやATP合成酵素を阻害しても,マトリックスのタウリン濃度には実質的な影響がないことを見出した[130]。
37℃でのpKaが8.6のタウリンアミノ基は、ミトコンドリアマトリックスのpH緩衝剤として作用するのに適している[131]。神経細胞とアストロサイトの両方におけるミトコンドリア代謝は、脳活動に反応するため、ミトコンドリアpHの調節は脳機能にとって重要である([132]とその参考文献を参照)。プロトン勾配とミトコンドリア膜電位は、ATPを産生するプロトン起電力のドライバーである。他の細胞と同様に、培養中のニューロンおよびアストロサイトは、7.5〜8のミトコンドリアマトリックスpHを示す[133,134,135]。例えば,シナプス放出後にアストロサイトがグルタミン酸を取り込むと,細胞内の酸性化が誘発され,ミトコンドリアマトリックスに広がる[134]。著者らはさらに、グルタミン酸によるミトコンドリアマトリックスの酸性化が細胞質酸性化を上回り、細胞質からミトコンドリアマトリックスへのpH勾配が消滅し、代謝と酸素消費量が調節されることを示した[131,134,136]。一方、興奮毒性レベルのグルタミン酸にさらされると、神経細胞のミトコンドリアマトリックスのpHは上昇した[133]。タウリンは、極端なミトコンドリアpH変動に対抗し、ミトコンドリア生理学の保存に役立つ可能性がある。Mohammadiらは、マウス肝臓から単離したミトコンドリアを広範囲の外因性タウリン濃度に暴露し、タウリンがミトコンドリア電位、Ca2+誘導ミトコンドリア膨潤、ミトコンドリア脱水素酵素活性およびATP濃度の調節に関与することを発見した[137]。マウスの脳や肝臓から単離したミトコンドリアは、アンモニアにさらされるとミトコンドリアデヒドロゲナーゼ活性の阻害、ミトコンドリア膜電位の崩壊、ミトコンドリアの膨潤の誘導、活性酸素の増加などを示し、これらはすべてタウリンにより緩和される[138]。
タウリンはラジカルスカベンジャーとして作用することができない[139]。しかし、細胞におけるタウリンの有益な抗酸化作用は、ほとんどがミトコンドリア作用の改善とミトコンドリアスーパーオキシドの生成の減少に関連している。肝臓または脳から単離したミトコンドリアへのタウリン投与は、アンモニア誘発性ミトコンドリア膜電位の崩壊、ミトコンドリア膨潤、ATP枯渇、および活性酸素種と酸化ストレスの増加を防止または改善するなど、アンモニア誘発性ミトコンドリア機能障害を軽減することが示された[138]。タウリンはまた、タモキシフェン毒性時にグルタチオンペルオキシダーゼとマンガンスーパーオキシドディスムターゼの活性を低下させ、脂質過酸化、タンパク質カルボニル量、スーパーオキシドラジカル生成を通して測定されるミトコンドリア酸化ストレスの減少に貢献した[140]。
タウリンは、タンパク質翻訳に不可欠なタウリン含有修飾ウリジンでミトコンドリアtRNAの構成要素である[141,142]。このタウリンの修飾はミトコンドリア最適化-1という酵素によって触媒され、その欠損はミトコンドリアタンパク質の翻訳、ひいては呼吸の効率を低下させる[143]。いくつかの病気は、ミトコンドリアtRNAのタウリン修飾の欠如と直接的に関連している[144,145]。
まとめると、タウリンの補給はミトコンドリアの機能を改善し、エネルギー代謝と効率的な酸化的リン酸化に重要なミトコンドリア膜電位、プロトン勾配、マトリックスpHの維持、さらに細胞内カルシウムの恒常性に寄与すると提案されている。
3.5. タウリンのアポトーシス抑制作用
タウリンは、多くの有害なチャレンジの際にアポトーシスを防ぐことが見出された(例えば、[146,147,148])。タウリンの最も顕著な神経保護効果は、脳虚血時のアポトーシス率の低下と神経学的転帰の改善について観察された。そのメカニズムとして、ミトコンドリアストレスおよび小胞体ストレスの防止が示唆された。タウリンは,脳卒中モデルの虚血コアおよびペナンブラにおいて,抗酸化機構の刺激,エネルギーチャージの減衰の防止,抗アポトーシスBcl-xLの減少およびプロアポトーシスBaxの増加の抑制,ミトコンドリアからのシトクロムCの放出の防止,カルパインおよびカスパーゼ3の活性化の阻害により,ミトコンドリア依存性の細胞死を抑制することが明らかになった[149,150,151]。また、タウリンは、転写因子6(ATF6)、プロテインキナーゼR様ERキナーゼ(PERK)、イノシトール要求酵素1(IRE1)経路を介して、アンフォールドドタンパク質応答を阻害し、虚血/低酸素誘発性小胞体(ER)ストレスを防ぐことが見出されている[152,153]。
4. 糖尿病における脳内タウリン
糖尿病やメタボリックシンドロームの多くの因子は脳に影響を与え、代謝の変化、シナプス機能障害、グリオシス、記憶障害などを引き起こす[154,155]。ストレプトゾトシン投与により糖尿病になったラットのMRS研究では、海馬(+23%)[156]と大脳皮質(+8%)[157]でタウリン濃度の増加が見られ、このモデルにおける脳のタウリン取り込み増加とも一致する[31]。非肥満、インスリン抵抗性の五島柿崎ラットは、学習と記憶に関与する脳領域である海馬のタウリン濃度もWistar対照ラットと比較して増加(+22%)している[158]。脳内タウリンの変化は、食事誘発性肥満モデルでも報告されている。すなわち、ラードベースの60%高脂肪食を6ヶ月間与えたマウスは、低脂肪食マウスと比較して、大脳皮質(+7%)、視床下部(+9%)、そして最も顕著に海馬(+12%)でタウリンの増加を示した[159]。最近、我々はさらに、高脂肪・高糖食により4週間後に海馬のタウリンレベルが上昇し、それが数ヶ月間持続し(低脂肪食の対照に対して+8%から+14%の範囲)、食餌正常化により回復することを証明した[38]。糖尿病マウスにおけるこのような脳内タウリンレベルの増加は、メタボリックシンドロームに対する細胞防御の代償機構から生じたのかもしれない。
糖尿病モデルの脳では海馬のタウリン濃度が上昇することが報告されているが、糖尿病患者ではまだ証明されていない([160]でレビューおよび議論されている)。糖尿病患者における脳内タウリン濃度の変化に関する証拠がないのは、ヒトの脳内タウリン濃度が比較的低いこと(図2参照)、および臨床MRS研究で用いられる弱い磁場ではタウリンピークを識別することが困難であること([161]で議論)に起因している。しかし、高磁場、すなわち7T以上のMRSでは、生きているヒトの脳内のタウリンを調べる能力が向上する。糖尿病患者のMRS研究は多くないが、アルツハイマー病(AD)を含む他の神経変性疾患はより研究が進んでいる。
4.1. アルツハイマー病患者の脳内タウリン濃度について
肥満とインスリン抵抗性が加齢に伴う認知機能低下、軽度認知障害、血管性認知症、ADの発症リスクを高めることを示唆する疫学的証拠が増えつつあり、T2DとADを結びつける分子および代謝メカニズムが提案されている[154,162,163]。糖尿病患者の脳内タウリンを測定した研究は限られているが、AD領域からの研究により、神経変性に伴うタウリンの変化についてさらなる手がかりが得られるかもしれない。
AD患者の脳のMRSによるタウリン濃度は、健常者のそれと比較してほとんど注目されていない([164,165]とその参考文献)。それは、ほとんどのMRS研究が低磁場で行われたからである。7.0Tで実施された最近のMRS研究では、Marjańskaらは、ADによって影響を受けることが知られている領域である後帯状皮質および後頭皮質において、AD患者および年齢と性別をマッチさせた認知的に健康な対照者のタウリンの濃度が同程度であることを見いだした[166]。AD患者に関する初期の研究でも、脳脊髄液(CSF)タウリンレベル[167,168]または死後の脳タウリンレベル[169,170]に実質的な変化は見られなかった。しかしながら、これらの研究は、過去の投薬による交絡効果によってバイアスがかかっている可能性がある。実際、抗うつ薬や神経遮断薬による治療を受けたことがない認知症と思われるADと診断された人 [171]とADの症状が進行した人 [172]のCSFでタウリンレベルが低下(最大-36%)していることが明らかになった。別の研究では、AD患者のCSFタウリンレベルは認知スコアと有意な相関があった[168]。総じて、AD患者におけるタウリンの喪失は、認知機能の悪化に関連していると推測される。
4.2. 認知症およびアルツハイマー病患者における血漿タウリンレベル
アルツハイマー病患者では、神経変性症状のない患者と比較して、血中タウリンレベルの低下(-23%~-40%)が観察されている[173]。別の研究では、タウリンの低値は認知症リスクと関連していたが、ADリスクとは関連していなかった[174]。したがって、著者らは、タウリンの低濃度は神経変性よりもむしろ血管機能障害(おそらく血管性痴呆)に関連している可能性があると仮定している。したがって、低濃度の食事性タウリンは高血圧と関連し[175]、マウス研究におけるタウリン補給は血流調節に関与し[176]、臨床試験においてタウリンの慢性補給は降圧効果を示した[2]。しかし、すべての研究がADに低いタウリンレベルを関連付けるわけではなく、実際に血漿中の高いタウリンレベルは、対照群と比較して軽度認知障害(+43%)およびアルツハイマー病(AD)(+49%)の患者で発見されている[177]。
4.3. ADモデルにおける脳内タウリンレベル
ADのトランスジェニックラットTgF344-ADラットは、生後18ヶ月で大脳皮質のタウリンレベルが上昇(+35%)するなど、脳代謝物の年齢依存的な変化を起こすことが報告されている(178)が、それ以前には見られなかった。McGill-R-Thy1-APPラットの海馬(+16%〜+21%)と大脳皮質(+25%)でも、対照群と比較して年齢依存的なタウリン濃度の増加が観察された[179]。ヒトスウェーデン型APP変異体Tg2576を持つ高齢トランスジェニックマウスに関するある研究では、大脳皮質におけるタウリンレベルの上昇(+21%)が認められた[180]。しかし、ADのトランスジェニックマウスに関する他の多くの研究では、脳の加齢によるタウリンレベルの変化は認められなかった(文献[181,182,183]とその参考文献)。以上のことから、AD患者とADの動物モデルにおける脳のタウリンレベルは対照的であると結論づけられる。
5. タウリンによる神経保護
タウリンによる神経保護作用は、多くの脳損傷や神経変性のモデルで報告されている。動物モデルでは,外傷性脳損傷 [184,185]や虚血性脳卒中 [149,176,186]の後,タウリンの投与により機能回復が有意に改善されることが報告されている.タウリンは神経変性に対して有益な効果を有するだけでなく、炎症プロセスを調節することができる。すなわち、重度のグリオーシスを発症する虚血性脳卒中や外傷性脳損傷の動物モデルにおいて、タウリンが神経炎症を抑制することが立証されている(例えば、[11,184,186])。
抑制性伝達物質としての役割を考えると、タウリンはカイナイト誘発てんかんのマウスモデルにおいて発作を減らし、海馬における細胞死、ならびにミクログリオシスおよびアストログリオシスを予防することが示された[187]。さらに、タウリンは、パーキンソン病のマウス及びラットモデルにおいて、すなわち神経炎症及びミクログリオーシスを抑制することにより、ドーパミン作動性ニューロンを保護することが示唆された[188,189]。タウリンは、繰り返される固定化または騒音への暴露によって誘導される慢性ストレスにさらされたげっ歯類の海馬における細胞および神経化学的変化を改善し、記憶性能にかなりの改善をもたらすことが発見された[190,191]。また、細菌感染を模倣したリポポリサッカライドの反復投与により誘発された慢性炎症モデルラットにおいて、タウリンの補給は神経保護と抗アポトーシス活性、およびミクログリアの活性化を減少させることが示唆された[192]。
老化マウスにおいて、タウリンの投与は、前駆細胞の形成率を高めることにより海馬の神経新生を刺激し、ミクログリアの活性化状態から静止状態への移行を誘導することが報告されている[193]。
タウリンは、in vitroでアミロイドβやグルタミン酸によって誘導される興奮毒性からニューロンを保護することが示されている[121,194]。さらに、タウリンの補給は、APP/PS1マウスモデルにおける空間記憶の回復 [195]と5xFADマウスモデルの脳におけるグルタミン酸活性の改善 [196]が報告された。両モデルにおいて、タウリンはアミロイドβ沈着速度を減少させることができなかったが、タウリンは、タウタンパク質フィブリルの形成を促進する一方で、アミロイドβ凝集を減少させる能力を有することが報告された[197]。
5.1. 糖尿病モデルにおけるタウリンの神経保護作用
ストレプトゾトシン誘発糖尿病ラット(インスリン欠乏性糖尿病)において、1ヶ月間100mg/kg i.p.の用量でタウリンを投与すると、前頭葉皮質および海馬における酸化ストレス、DNA損傷および炎症性サイトカインレベルが低下し、記憶能力の向上に寄与した[198,199]。Agcaらの研究[200]では、ストレプトゾトシンを投与したラットに飲料水中の2%(w/v)タウリンを8週間補給することで、糖尿病が誘発する炎症プロセスに関与する転写因子NF-κβの増加、糖尿病が誘発する脳内のNrf2、グルコーストランスポーターGlut1およびGlut3の減少が改善されたことが実証されている。さらにRahmeierら[201]は、ストレプトゾトシン投与ラットの脳にタウリンを投与(100 mg/kg daily i.p.)すると、抗アポトーシス作用があることを示した。Liら[202]は、タウリンがシュワン細胞のアポトーシスを抑制することにより、ストレプトゾトシン投与ラットの坐骨神経のミエリン損傷に対する保護剤として機能することを説明した。最近、メタボリックシンドロームを発症する脂肪の多い食事を与えたマウスにおいて、飲料水に3%(w/v)のタウリンを2ヶ月間補充すると、記憶障害を予防することが実証された[203]。さらに、in vivoでの代謝プロファイリングのための磁気共鳴分光法(MRS)により、タウリン投与が肥満による海馬の神経細胞マーカーであるN-アセチルアスパラギン酸の減少を防ぐことが示された[203]。この研究では、高脂肪食マウスの海馬でもエネルギー代謝の障害が観察されたが、タウリンでは防ぐことができなかった。しかし、タウリンやグルタチオンの合成にシステイン供与体として働くN-アセチルシステインで処理すると、肥満による海馬の代謝異常が完全に防止された。興味深いことに、タウリン投与は脳のインスリン受容体密度、特に海馬を増加させることが提案されており[204]、これは脳のインスリン感受性を改善し、したがって認知障害に対抗する有益な効果を有する可能性がある[154,162,163]。総じて、利用可能な文献は、肥満および糖尿病患者における神経細胞機能不全を予防する方法として、タウリンの投与を支持するものである。
5.2. 糖尿病管理におけるタウリンの有効性
タウリンは前臨床試験および臨床試験において、メタボリックシンドローム要因に対して有益な効果を示している。最近,高脂肪食を2ヶ月間与えた雌マウスにおいて,タウリン非補給の肥満マウスと比較して,タウリンによる耐糖能の改善が報告された[202]。同様の結果はRibeiroら[205]によって記述されており,彼らは飲料水に5%(w/v)タウリンを6ヶ月間使用した.
T2D患者の血漿中タウリンレベルは、健常者よりもわずかに低いことが判明した[20,21]。興味深いことに、血漿タウリンは空腹時血糖値と逆相関するが、糖化ヘモグロビンHbA1c値とは相関せず[206]、肥満や肥満度とは無関係であることが明らかにされた[20,22]。このことは、タウリンが急性の代謝調節とグルコースのホメオスタシスに関与しているが、糖尿病の病因には関与していないことを示唆している。実際、血漿タウリンは、健常者における血糖値過上昇クランプ時 [23]や運動に対する代謝反応時 [207]に減少する。代謝調節におけるタウリンの役割によると、我々は以前に、ストレプトゾトシン処置した糖尿病ラットの海馬におけるタウリン濃度が、インスリン投与による急性血糖正常化によって減少し得ることを観察した[156]。
糖尿病患者の循環タウリンレベルが低いことから、食事によるタウリン補給が糖尿病管理に貢献する可能性が推測されている。したがって、糖尿病の動物モデルに関するいくつかの研究は、タウリンの補充が血糖値を下げ、インスリン分泌および感受性を改善することを示した(例えば、[205,208,209,210,211,212])。興味深いことに、このような効果は、タウロウルソデオキシコール酸の形成など、胆汁酸へのタウリンの抱合とも関連し得ることが提案されている[213]。
ヒトでの研究からの証拠は論争のままであり、タウリンの補給はメタボリックシンドロームまたはT2Dおよびその合併症を改善する上でほとんどまたは全く効果がない([214]でレビューされる)。糖尿病に対するタウリンの効果に関する論争の源は、貧弱な研究デザインとテストされた被験者の数が少ないことかもしれない。例えば、8週の毎日のタウリンの補足の管理に基づく十分に検出された、二重盲検の、無作為にされた、クロスオーバーの調査はインスリンの分泌および行為とT2Dの肯定的な歴史の太り過ぎの男性の血しょう脂質レベルの効果を見つけない[215]。それでも、タウリンの有益な効果は、糖尿病の合併症から様々な身体システムを保護するために貢献するかもしれない。
6. 結論
過食と座りがちなライフスタイルは、全身的な代謝の不均衡の発生と、全死因性認知症、アルツハイマー病(AD)、血管性認知症と強く関連する肥満と糖尿病予備軍の出現を促す(例、[216])。肥満は、高血圧、心血管疾患、メタボリックシンドローム、インスリン抵抗性または2型糖尿病などの併存疾患と関連しており[216,217]、これらは神経変性疾患に対する遺伝的感受性を調節し[218]、したがって認知低下の危険因子を構成する可能性がある[219,220]。タウリンの細胞保護作用は、抑制性神経伝達の調節、したがって興奮性-抑制性バランスの促進、抗酸化システムの刺激、ミトコンドリアの安定化、したがってエネルギー生産とCa2+ホメオスタシスなど、神経機能を改善する様々なメカニズムを通じて、肥満と糖尿病を有する被験者の脳の健康改善に寄与することが報告されている。肥満や糖尿病の実験モデルにおいてタウリンの補給は、メタボリックシンドロームに関連した記憶機能障害の予防に効果があることを示す証拠となるが、タウリンの作用機序の正確な解明は今後の研究課題であると思われる。このように、脳機能に影響を及ぼす代謝性疾患におけるタウリンのホメオスタシスを明確に理解するためには、さらなる研究が必要であると結論づけた。
タウリンに加えて、タウリンを生成できるアミノ酸のメチオニンおよびシステイン(セクション2.3参照)は、肥満およびメタボリックシンドロームと関連しており[207,221,222]、含硫アミノ酸の生体利用率の調節は、例えば、抗酸化物質のグルタチオンの合成を促進することによって、さらなる利益をもたらすかもしれない([203]で議論されている)。
略語
- AD アルツハイマー病
- AMPA α-アミノ-3-ヒドロキシ-5-メチル-4-イソオキサゾールプロピオン酸
- CNS 中枢神経系
- CSF 脳脊髄液(cerebrospinal fluid
- GAT-2 GABAトランスポーター(SLC6A13)
- MRS 磁気共鳴分光法
- NMDA N-メチル-D-アスパラギン酸
- TauT タウリントランスポーター(SLC6A6)
- VRAC 容積制御アニオンチャネル
助成金について
著者らの研究は、スウェーデン研究・高等教育国際協力財団(BR2019-8508)、スウェーデン研究評議会(2019-01130)、Diabetesfonden(Dia2019-440)、Direktör Albert Pålssons財団、Crafoord財団、Tage Blücher財団、Dementiafonden、ルンド王立生理学協会による支援を受けている。J.M.N.D.は、The Knut and Alice Wallenberg foundation、ルンド大学医学部、Region Skåneから寛大な財政支援を受けたことを認める。ルンド大学糖尿病センターは、スウェーデン研究評議会(戦略的研究領域EXODIAB、助成金2009-1039)およびスウェーデン戦略的研究財団(助成金IRC15-0067)の助成を受けていることを、著者らは謝意を表する。
