Contents
Targeting Neurological Manifestations of Coronaviruses by Candidate Phytochemicals: A Mechanistic Approach
オンラインで公開2021年1月20日
Sajad Fakhri, 1 Sana Piri, 1 Mohammad Bagher Majnooni, 2 Mohammad Hosein Farzaei, 1 ,* and Javier Echeverría 3 ,*.
概要
重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)に起因する新型コロナウイルス(COVID-19)は,様々な症状を呈している。その中で,COVID-19の神経学的関連性に注目する声が高まっているが,確立された病態生理学的機序や関連する治療法は不足している。そこで、PubMed, Scopus, Web of Science, Cochraneなどの電子データベースを用いて、COVID-19に関連する神経シグナル伝達経路に関する筆者の専門知識を加えて、包括的なレビューを行った。また,COVID-19の神経症状に対する植物化学物質の可能性も示されている。SARS-CoV、中東呼吸器症候群、SARS-CoV-2の間には高い相同性があることを考えると、それらの正確な病態生理学的メカニズムを明らかにすることは、COVID-19の神経症状の治療への道を開くと思われる。
COVID-19の中枢症状には、疼痛、低・無感覚、せん妄、意識障害、錐体外路症状、虚血性脳卒中など、複雑な病態生理学的メカニズムが存在する。その中でも、神経炎症、アンジオテンシン変換酵素2(ACE2)/スパイクタンパク質、RNA依存性RNAポリメラーゼ、プロテアーゼなどの神経細胞の制御異常が注目されている。そのため、安全性と有効性に優れたマルチターゲット治療薬を採用することは、COVID-19の神経症状と戦う上で明るい未来を示しているように思われる。
最近では,天然の二次代謝産物が,COVID-19のいくつかの合併症と闘うためのマルチターゲットの植物化学物質として注目されている。
この総説では、SARS-CoV-2の中心的な病態生理学的メカニズムと治療ターゲットが示されている。また,薬理学的メカニズムの観点から,フィトケミカルがCOVID-19の中枢神経系合併症に対抗するためのマルチターゲット薬剤となる可能性があることを紹介した。
キーワード
コロナウイルス,COVID-19,SARS-CoV-2,神経学,神経系,フィトケミカル,薬理学,シグナル伝達経路
はじめに
コロナウイルス(CoV)には、NL63,229E、OC43,HKU1,中東呼吸器症候群(MERS)-CoV、重症急性呼吸器症候群コロナウイルス(SARS-CoV)重症急性呼吸器症候群新型コロナウイルス(SARS-CoV-2)など、様々な種類があることが、ゲノム構造の系統学的研究によって紹介された(Gurung et al, 2020a; Vellingiri et al 2020)α(229EとNL63)β(OC43とHKU1)γ、δの4つのコロナウイルスに分けられる。コロナウイルスのうち、α群とβ群はヒトの呼吸器症状を引き起こす(Gurung et al 2020b; Gurung et al 2020c; Rasool et al 2020)。最近、コロナウイルスの新しい株、すなわちSARS-CoV-2が発見され、これはβコロナウイルスの異なるクラスに属している(Divani er al)。 SARS-CoV-2は、「コロナウイルス感染症2019(COVID-19)」と呼ばれる致命的な疾患を世界中で発生させた(Fitriani et al 2020,Nemoto et al 2020)。COVID-19は、27-32kbの大きさのポジティブセンスRNAゲノムと、スパイク(S1とS2)/共役タンパク質を持つエンベロープを持つことが特徴で(Holmes and Lai, 1996; Davidson et al 2020)、2-14日間に渡って症状が現れる。ウイルスが肺組織細胞に侵入して増殖すると、肺胞や間質の炎症性分泌物や浮腫を引き起こし、肺胞のガス交換障害や中枢神経系(CNS)の低酸素症を引き起こし、それによって脳細胞のミトコンドリアの嫌気性代謝が増加することが研究で明らかになっている(Wu er al)2020c)。さらに、SARS-CoVは鼻腔に侵入し、免疫系の調節不全によって神経の炎症反応を引き起こす。SARS-CoV-2の侵入因子は、鼻腔上皮細胞に高発現している(Sungnak er al)2020)。その結果、CoVは、鼻腔内のワクチン接種や感染の初期段階で、嗅覚路を介して脳に侵入する(Mori, 2015; Wu er al)。 したがって、このウイルスは呼吸器系にとどまらず、末梢神経に侵入して中枢神経系に入り、その後、神経変性疾患を引き起こしたり、悪化させたりする(Matsuda er al)2004; Vellingiri er al)2020)。大脳皮質、海馬、脊髄、脳幹、小脳、線条体、上丘、視床下部にSARS-CoVが存在することが研究で示されている(Jacomy and Talbot, 2003)。その結果、COVID-19の患者は、頭痛、めまい、味覚低下、吐き気、嘔吐、無嗅覚などの神経症状を示している(Ahmad and Rathore, 2020; Vellingiri et al 2020)。
病態生理学的観点からは、COVID-19の形態のスパイクタンパク質は、肺胞上皮細胞タイプ2(AT2)上のアンジオテンシン変換酵素(ACE)受容体に結合し、膜貫通型プロテアーゼセリン2(TMPRSS2)によってプライミングされ、コロナウイルスの侵入を可能にする(Marchetti et al 2018;Li et al 2019b;Wang et al 2020b;Vallamkondu et al 2020)。実験的には、COVID-19が呼吸器を介して肺に入り、AT2細胞に侵入して、肺胞内の関連張力を低下させることに関するサーファクタントを生成し、虚脱圧を緩和することが示された。また、ACE2は、腎臓、心臓、腸細胞、膵臓、内皮細胞に存在し、脳にも広く分布しており、SARS-CoV-2の細胞内への侵入を促進する(Li er al)。 ACE2の神経分布については、当初、賛否両論があった。定量的なリアルタイムRT-PCR研究では、ヒトの脳におけるACE2 mRNAのレベルは低いことが示されたが(Harmer et al 2002年)免疫組織化学の結果では、ACE2タンパク質の発現は動脈および内皮の平滑筋細胞に限定されることが示された(Haming et al 2004)。さらに、脳の初代培養細胞では、グリア細胞でのACE2の発現が優勢であることが示された(Gallagher et al 2006)。さらに、脳全体にACE2のmRNAとタンパク質が広く存在していることも示された(Doobay et al 2007)。また、感染者の脳からSARS-CoVが検出されたことで、ACE2の関連した分布が確認された(Ding et al 2004,Gu et al 2005,Xu et al 2005,Xia and Lazartigues 2008)。
COVID-19の重要な徴候として、神経系のインターロイキン(IL)-1β、IL-2,IL-4,IL-6,IL-8,IL-10,IL-12,腫瘍壊死因子-α(TNF-α)インターフェロン-γ(IFN-γ)の上昇による神経炎症が挙げられる。顆粒球コロニー刺激因子(GM脳脊髄液)IFN-γ誘導性タンパク質10(IP-10)単球化学吸引性タンパク質1(MCP1)マクロファージ炎症性タンパク質1α(MIP1α)T細胞発現(Xu er al)。 , 2005; Yarmohammadi et al 2020)。コロナウイルスは炎症性メディエーターを放出してマクロファージを刺激する。これらのマクロファージは、IL-1,IL-6,TNF-α、C-X-Cモチーフケモカインリガンド10(CXCL10)およびケモカインリガンド2(CCL2)を活性化する。CoVは、中枢神経系の神経細胞、アストロサイト、ミクログリアに到達することが分かっている。その結果、ミクログリアやアストロサイトは神経炎症に大きな役割を果たし、炎症性メディエーターを放出する(Murta et al 2020)。これらのサイトカインやケモカインは血管拡張を引き起こし、また毛細血管の貫通を増加させてAP-2細胞のサーファクタントステージを低下させ、肺胞の崩壊やガス交換の乱れを引き起こす(Zaki et al 2012; Wu et al 2020a; Guan et al 2020; Yang et al 2020)。他のレベルの疾患では、CD4+を介した炎症性メディエーターのレベルが上昇し、また、IL-17,IL-21,IL-22を用いた好中球およびマクロファージの生成が増加し、呼吸困難、低酸素血症、および咳が発生する(de Wit et al 2016;Gao et al 2020;Wan et al 2020)。中枢神経系および関連する神経細胞の会合における神経細胞の炎症性メディエーターの上昇に加えて、ACE2/スパイクタンパク質および下流メディエーターであるRNA依存性RNAポリメラーゼ(RdRP)/プロテアーゼは、関連する神経細胞の兆候を止める上で黄金のターゲットであるように思われる。
残念ながら、現在のところコロナウイルス感染症を治療するための抗ウイルス剤やワクチンは存在しないが、候補となる植物化学物質は感染症治療のための抗ウイルス作用を持つ有望な因子となりうる(Liu and Du, 2012; Gurung et al 2020b)。いくつかの先行研究では、コロナウイルスの神経学的症状が指摘されている(Ahmed et al 2020; Yavarpour-Bali and Ghasemi-Kasman, 2020)。その上、限られた研究では、コロナウイルスの予防や治療に役立つ薬剤として、天然物や候補となる植物化学物質が示唆されている(Hasan et al 2020; Majnooni et al 2020; Zhou and Huang, 2020)。本研究では、コロナウイルスの神経学的症状、および前述のシグナル伝達経路に対する候補フィトケミカルの効果について広範なレビューを行った。さらに、本研究は、COVID-19神経症状の予防と治療に関して、CoVの神経病原性経路を標的とした抗ウイルス作用と神経保護作用を持つフィトケミカル(候補フィトケミカルと呼ぶ)を強調した初めてのレビューである。
研究デザイン
電子データベース(Scopus, PubMed, Medline, Web of Scienceなど)や他のソースの関連論文を用いて、コロナウイルスの神経症状とフィトケミカルの効果について包括的なレビューを行った。キーワード(”Severe Acute Respiratory Syndrome” OR “SARS” OR “Middle East Respiratory Syndrome” OR “MERS” OR “Coronavirus disease 2019” OR “COVID-19” OR “SARS-CoV” OR “SARS-CoV-? 2”) AND (“neurological sign” OR “neurological manifestation” OR “neuron” OR “nerve” OR “central nervous system” OR “中枢神経系” OR “brain” OR “neurology” OR “neuropathy” OR “stroke” OR “multiple sclerosis” OR “encephalitis” OR “encephalopathy”) [title/abstract/keywords] を用いた。また,抗ウイルス活性と神経保護活性の両方を有するフィトケミカルをキーワード(「フィトケミカル」OR「二次代謝産物」OR「植物」OR「ポリフェノール」OR「フェノール化合物」OR「フラボノイド」OR「アルカロイド」OR「テルペン」OR「テルペノイド」OR「キノン」)で全文検索した。抗ウイルス作用や神経保護作用が報告されている植物化学物質で,コロナウイルスの病態生理学的メカニズムを調節する可能性のあるものを対象とした。データは2020年10月まで、言語や日付の制限なく収集した。また、検索された論文のスクリーニングは、参照リスト/引用文献に基づいて行われた。電子データベースでのレビュー完了については、中枢神経系におけるSARS-CoVsの病態生理メカニズムや候補となるフィトケミカルに関する著者の専門知識に基づいて、ハンドサーチも行った。
コロナウイルスの神経学的症状
コロナウイルスの神経症状には、中枢神経系と末梢神経系(PNS)の2つのタイプがあることが実験的に示されている。末梢神経系では、低眼圧症、低嗅覚症、眼球運動障害、三叉神経障害、ミラー・フィッシャー症候群、頭蓋多発性神経炎、横紋筋融解症、ギラン・バレー症候群、嗅覚障害などの様々な神経学的関連がある(Ahmad and Rathore, 2020; de Freitas Ferreira et al, 2020; Mochan and Modi, 2020; Nordvig et al 2020; Pascual-Goñi et al 2020; Yavarpour-Bali and Ghasemi-Kasman, 2020)。) また、COVID-19は、脳血管障害、急性虚血性脳卒中(1~3%)頭蓋内出血(0.5%)脳炎(脳の炎症)脱髄、髄膜炎、頭蓋多発性神経炎、血管炎、骨格筋障害などの中枢神経系障害を引き起こす(Li et al, 2016;Dorche et al 2020;Filatov et al 2020;Mao et al 2020;Moriguchi et al 2020;Zhou et al 2020)。) 229EおよびOC43コロナウイルス株は、神経芽細胞腫、神経膠腫、星細胞腫、ミクログリア、および乏突起細胞の細胞培養物に侵入し、神経系の合併症を明らかにすることが示されている(Cheng et al 2020b)。Wernerらは、急性壊死性脳症、頸部硬直、両側足首のクローヌス、Brudzinski陽性、左Babinski陽性、右Chaddock徴候など、いくつかの症例の追加症状を示している(Werner et al 2020)。COVID-19のその他の神経症状としては、運動失調、難治性てんかん重積状態(Xu et al 2005年)神経細胞の変性・壊死、グリオソーム形成を伴う広範なグリオサイトの過形成(Yassin et al 2020年)筋肉痛、呼吸困難(Prakash et al 2020年)味覚・嗅覚障害、急性脳血管障害、動眼神経麻痺(Nepal et al 2020)が挙げられる。Maoらは、クレアチンホスホキナーゼ(CPK)C反応性タンパク質(CRP)Dダイマー、壊死性ミオパシー、太いフィラメントミオパシー、重症ミオパシー(非特異的)および急性四肢麻痺性ミオパシーの上昇がCOVID-19の他の神経学的症状であることを示している(Mao et al 2020,Suri et al 2020,Warner 2020)。また、ビッカースタッフ脳炎、重症疾患ミオパシー、重度のリンパ球減少、血小板減少および尿毒症、顔面麻痺、毒素関連ミオパシーおよびニューロパシーなどの他の神経学的症状を示す報告もある(Wu et al 2017; Gulati et al 2020; Zheng er al)。 臨床行動徴候のうち、頭痛、失神、興奮、せん妄、味覚障害、疲労、めまい、急性錯乱、睡眠障害、意識レベルの変化、精神状態の変化などがCOVID-19患者に観察されている(Stewart et al, 1992;Dessau et al 2001;Lau et al 2004;Wang et al 2020a;Wang et al 2020c;Wu et al 2020c;Dorche et al 2020;Helms et al 2020;Mochan and Modi 2020;Nalleballe et al 2020)。) 前述の神経学的徴候は、COVID-19の患者の84%に現れている(Wang et al 2020c;Helms et al 2020)。
COVID-19の重大な障害の一つである重症呼吸器症候群は、全身の低酸素、高炭酸、嫌気性代謝を引き起こし、神経細胞の腫れや脳浮腫・損傷を引き起こす可能性がある(Suri er al)2020)。SARS-CoV-2は脊髄にも侵入し、脊髄の灰白質の急性炎症(脊髄炎)を引き起こし、下肢の急性弛緩性脊髄炎、尿失禁、便失禁などで認識されていた(Zhao er al)。 エビデンスでは、COVID-19とパーキンソン病との密接な関係が示されており、運動症状(振戦など)の増加、歩行の凍結やジスキネジア、ドパミン系薬剤の効果の低下などが認められている(Macht et al 2007,Zach et al 2017,Ehgoetz Martens et al 2018)。興味深いことに、ドーパミン合成経路とCOVID-19の病態生理の間には密接な関係があるようである。このラインでは、ドーパミン経路の調節酵素としてのドーパ脱炭酸酵素が、ACE2受容体と有意義に共発現している。一方、SARS-COVウイルスはACE2をダウンレギュレートし、ドーパミン合成の変化と一致している(Kuba er al)2005)。また、ドーパミンは肺胞上皮細胞に発現していることから、ACE2と同様に肺の免疫にも貢献している(Bone er al)。 したがって、パーキンソン病におけるドーパミン欠乏の重要な役割を考慮すると、SARS-CoV-2ウイルスは、このような散発的な兆候COVID-19患者を引き起こす可能性がある(Rietdijk er al)2017)。
さらに、CoVが多発性硬化症の病因において必須の機能を果たしている可能性を示す証拠が得られた(Saleki er al)。 多発性硬化症患者から分離したCoVを、患者の血清を用いて中和した。これにより、多発性硬化症の病因におけるCoVの破壊的な役割が明らかになった(Burks et al 1980)。COVID-19を持つ多発性硬化症患者に対する免疫調節剤や疾患修飾剤の使用を評価する研究が増えている。その結果、それらの治療を受けた患者ではCOVID-19の合併症のリスクが高まることが宣言されている(Baysal-Kirac and Uysal, 2020; Ramanathan et al, 2020)。これらの患者における免疫療法の継続/中止の決定は、疾患の重症度と活動性に密接に依存している(Giovannoni er al)2020)。
Orsucciらは、COVID-19の患者に共通する神経障害として、嗅覚や味覚の機能障害があることを明らかにしている(Orsucci er al)2020)。中枢神経系-CoV疾患では、リンパ球、好酸球のレベルが低く、単球だけでなく好中球のレベルが高いことが示されている(Saleki er al)2020)。また、ToscanoらはCOVID-19において、ギラン・バレー症候群、下肢の脱力感と知覚障害、顔面麻痺に続く運動失調と知覚障害、弛緩性四肢麻痺または四肢麻痺を観察した(Toscano et al 2020)。研究者はいくつかのケースで、強直間代性発作、不安、精神病症状、髄膜刺激徴候、足底伸展反応、脳炎、嚥下障害、構音障害、水疱障害、大量出血性転換を観察した(Wang et al 2020a)。
中枢神経系におけるコロナウイルスの病態生理学的メカニズムパスウェイ
コロナウイルスが神経細胞やグリア細胞に侵入して、神経細胞のネクロプトーシスに関するアンフォールドタンパク質反応(UPR)を誘導することが実験的に示されている(Meessen-Pinard et al 2017)。前述のように、コロナウイルスは、関連する神経炎症反応とともに神経細胞の損傷と死を引き起こした(Morfopoulou er al)。 SARS-CoV-2が中枢神経系に侵入し、関連する合併症を引き起こすメカニズムは複数ある。それらのメカニズムは、血液を介した汚染(血行性)神経細胞を介した感染(神経原性)免疫不全に関連した損傷、直接呼吸器感染、低酸素性損傷であり(Ahmed er al)2020)これらは以下のように説明される。血行性の場合、CoVは血液脳関門(BBB)を通過して脳内に侵入する。これは、BBBを越えたウイルス粒子の直接侵入、または末梢血細胞のハイジャックによる2つのメカニズムで起こる(Bohmwald er al)2018)。後者の侵入方法では、ヒトコロナウイルスOC43(HCOV-OC43)は、神経原性の方法で中枢神経系にアクセスし、嗅覚ニューロンの細胞体や樹状突起に出現した後、海馬、大脳皮質、脊髄に拡散する(Niu er al)2020a)。ウイルス血症の段階では、BBBが破壊されることで、ウイルスが脳に直接侵入することになる。SARS-CoV-2は、嗅球に近接した篩骨から拡散/散布され、7日間で脳が原因となる(Baig er al)。 また、シナプスを介してCoVが神経末端の末梢に侵入すると、ウイルスが中枢神経系に侵入する(Ahmad and Rathore, 2020)。さらに、重度の肺炎による全身の低酸素状態は、血管拡張、嫌気性代謝、低酸素状態、および毒性化合物の蓄積を引き起こし、脳障害を引き起こす(Tu et al 2020)。
SARS-CoV-2の神経病理学的メカニズムとして最も広く受け入れられているのは、炎症亢進状態である(Yavarpour-Bali and Ghasemi-Kasman, 2020)。これに伴い、免疫介在性障害は、サイトカインストーム、Tリンパ球、内皮細胞、マクロファージの活性化により、血管漏れ、凝固、末梢器官の損傷につながる(Mehta er al)。2020; Tveito, 2020)。コロナウイルスは、ミクログリア誘導性のINF-α/βの放出に関連する自然免疫を誘発することが示された(Savarin er al)2018)。これに関連して、IL-1α、IL-1β、IL-6,IFN-γ、TNF-α、CXCL10など、いくつかのサイトカインおよびケモカインがミクログリアおよびアストロサイトによって放出される(Joseph et al 1993)。Liらは、COVID-19患者において、IL-6,IL-8,MCP-1,顆粒球-マクロファージコロニー刺激因子(GM-脳脊髄液)など、脳脊髄液中の多くの炎症性メディエーターのレベルが上昇していることを指摘している(Li et al 2016)。CoV神経感染の初期段階では、IFN-γの影響を受けた患者の末梢血中にCXCL10とCXCL9が存在する(Jiang er al)。 実験では、IL-6,IFN-γ、TNF-α、CXCL9,CXCL10などの炎症性メディエーターの増加と相関する急性散在性脳脊髄炎(ADEM)において、CoVが破壊的な役割を果たすことが示されている(Kothur er al)。 IL-1β、IL-6,IL-8,TNF-α、IL-10,COVID-19のレベルと、視神経脊髄炎(デビック病としても知られる)などの中枢性炎症性合併症との間には、直接的な相関関係があることが実証されている。視神経脊髄炎(デビック病)横髄炎、急性散在性脳脊髄炎、筋萎縮性側索硬化症、単純ヘルペス脳炎、パーキンソン病、外傷性脳損傷、てんかん、脳卒中などの中枢性炎症性合併症(Vezzani er al)。 , 2002; Rodney et al 2018; Vezzani et al 2019; West et al 2019)。この系統では、IL-2およびIL-2受容体(IL-2R)がJanus kinase/Signal transducer and activator of transcription(JAK/STAT)シグナル経路を介してT細胞の活性化に重要なシグナルを持つことが示されている(Fu er al)。 転写因子である核内因子-κB(NF-κB)は、免疫系におけるもう一つの必須の調節因子であり、SARS-CoVによって誘発される肺の炎症性免疫病理において活性化される(DeDiego et al 2014;Catanzaro et al 2020)。
前述のように、研究では、正確なメカニズムは明らかではないものの、SARS-CoV-2が神経系に侵入するメカニズムがいくつか示唆されている(Yavarpour-Bali and Ghasemi-Kasman, 2020)。科学者たちは、コロナウイルスが嗅球・上皮に入り、その後、中枢神経系に侵入することを示唆している。そのため、無嗅覚症や低嗅覚症がCOVID-19の神経症状として現れていると考えられている。最近の研究では、COVID-19における無嗅覚症のさまざまなメカニズムが示唆されている。たとえば、嗅覚裂孔症候群、粘膜閉塞、嗅覚ニューロンの直接損傷、嗅覚知覚中枢の障害、脳内サイトカインストームなどである(Yazdanpanah et al 2020)。放出された炎症性因子は、BBBの浸透性を変化させ、炎症カスケードを増加させた(Singhi, 2011)。また、神経細胞の小胞体(ER)が欠損すると、SARS-CoVによって引き起こされるUPRの活性化につながるという研究結果もある(Chan er al)。 これまでに、ATF6,p-ERK(phospho-extracellular signal-regulated kinase)/eIF2-α、IRE1/XBP1など、いくつかの関連シグナル経路がUPRの処理に機能的な役割を果たしていることが明らかになっている(Ron and Walter, 2007)。Favreauらは、HCoV-OC43がUPRを誘導し、カスパーゼ-3の活性化と核の断片化によって神経細胞死を引き起こすことを指摘している(Favreau et al 2009)。別のメカニズムとしては、SARS-CoV-2が重度の炎症を引き起こし、それが血栓症を引き起こすことが示唆されている。SARS-CoV-2はTLR(toll-like receptors)にも結合し、IL-1の合成と放出を引き起こす。実際のところ、TLRは、ウイルス感染に対する重要なプレーヤーとして放出されるI型インターフェロン(IFN)と同様に、インフラマソームの活性化による生化学的カスケードを活性化する(Marchetti et al 2018,Conti et al 2020,Vaninov 2020)。
コロナウイルスの神経症状におけるレニン-アンジオテンシン系の役割
SARS-CoV-2は、主にACE2またはTMPRSS2受容体を介して中枢神経系に侵入することが示されている。これらの受容体は脳/脊髄のグリア細胞に発現しており、それによってコロナウイルスの脊髄への侵入が促進され、SARS-CoV-2の宿主細胞への侵入、さらには細胞膜の融合にも不可欠である(El Tabaa and El Tabaa, 2020; Nemoto et al, 2020)。また、コロナウイルスが細胞内に侵入すると、ACE2はADAM Metallopeptidase Domain 17 (ADAM17)によって膜腔内に破れて排出されることが指摘されている(Li and De Clercq, 2020)。ACE2のSer680でのリン酸化は、ACE2のユビキチン化を阻害し、また関連する膜発現を増加させることが研究で示唆されている(Amraei and Rahimi, 2020)。レニン・アンジオテンシン系(RAS)には、アンジオテンシンII(Ang II)ACE、ACE2,アンジオテンシンタイプ1受容体(AT1R)アンジオテンシンタイプ2受容体(AT2R)Mas受容体(MAS)などが含まれ、重要な生理機能を担っていることが指摘されている。これまでの研究で、Ang IIがCOVID-19の感染を防ぐには、ATR1に結合してACE2の内在化を活性化し、ERK1/2やp38 mitogen-activated protein kinase(MAPK)経路を減少させることが示唆されていた(Koka et al 2008,Fernandes et al 2011,Divani et al 2020)。最近の報告では、Ang IIは、ヒト肺組織に発現しているAT1Rやアンジオテンシンタイプ2受容体(AT2R)などの2つのGタンパク質共役型受容体(GPCR)を介して作用することが示されている。また、AT1Rは、MAPK/ERK、IP3/diacylglycerol、チロシンキナーゼ、NF-κBなどのシグナル伝達経路を強化することで、Ang IIの活性化を仲介することができる(Balakumar and Jagadeesh, 2014; El Tabaa and El Tabaa, 2020)。これと並行して、AT1は単球、マクロファージ、血管平滑筋細胞を刺激して、TNF-αやIL-6を生成させる(Balakumar and Jagadeesh, 2014)。さらに、Ang IIは、血管収縮、炎症性サイトカインの放出、血管内皮機能障害、血小板凝集を促進する(Nakashima er al)。2006; Shatanawi er al)。2011)。また、Ang IIとエンドセリン-1(ET-1)の間にも関係がある。実際、ET-1は、IL-6の放出を誘導することで、Ang IIによる内皮機能障害や血小板の活性化に重要な働きをしている(Touyz and Schiffrin, 1993; Browatzki et al, 2000)。SARS-CoV-2の侵入とそれに関連する副作用を抑えるためには、ACE2活性を低下させる必要がある。ACE2は、人体に重要な機能役割を持つRASの重要な酵素であることがわかっている。この経路では、腎臓で生成されたレニンが肝臓のアンジオテンシノーゲンを切断してAng Iを生成し、ACEによって切断されてAng-II(ACE2の基質)になる。Ang IはRAS系と同様にAT1R、AT2Rに結合し、SARS-CoV-2の感染にも重要な働きをしている(Battagello et al 2020)。
COVID-19の神経細胞の病態には、血液、低酸素、ACE2,神経炎症が重要な役割を果たしていることに加えて、SARS-CoV-2の複製に関与する重要な酵素として、RdRP/3-キモトリプシン様プロテアーゼ(3CLpro)とパパイン様プロテアーゼ(PLpro)を調節することは非常に重要である。また、SARS-CoV-2の侵入を促進する受容体として、CD209L(L-SIGN)、CD209(DC-SIGN)、ニューロピリン受容体(NRP)、CD147/Basiginなどがある(Amraei and Rahimi, 2020)。このように、前述の制御不能なシグナル伝達経路の間には、密接な相互関係がある。このような観点から、前述の標的を同時に調節できるマルチターゲット薬剤を提供することは、COVID-19の神経学的症状に対する道を開く可能性がある。
COVID-19の一般症状に対する天然物の重要性
COVID-19が世界中で大パンデミックし、何百万人もの人々が感染し、何千人もの人々が命を落としたことで、研究者たちはSARS-CoV-2に対する薬剤やワクチンの候補を見つけるために熱心な努力をするようになった。しかし、SARS-CoV-2の病原性/合併症には固有の複雑さがあるため、これらの努力はまだ信頼できる薬剤には至っていない(Sharma er al)2020)。複数の治療標的に同時に作用し、副作用が少ないことから、アルカロイド、フラボノイド、ポリフェノール、キノン、テルペノイドを含む植物化学物質は、SARS-CoV-2に対する有効な治療法を見つけるための最も有望な選択肢の一つである(Efferth and Koch, 2011; Mani et al 2020)。
最近の研究では、植物化学物質からSARS-CoV-2に対する有効な治療薬を発見するために、主なプロテアーゼを含む3つの主要な標的、およびACE2とのSタンパク質の相互作用が、研究者の最も注目を集めていることが示された。さらに、植物化学物質は、COVID-19に関連する神経細胞の徴候に対抗するために、神経炎症を標的とする可能性がある。
COVID-19の神経学的徴候に対するフィトケミカルの可能性
近年、SARS-CoV-2の治療や予防のための薬剤やワクチンは開発されていない。植物化学物質は、中枢神経系において重要な抗ウイルス生物学的活性と健康上の利点を果たすことが示されている(Kähkönen et al 1999)。前述したように、コロナウイルスに対するフィトケミカルの主要な標的としては、ACE2,スパイクタンパク質、TMPRSS2,3CLpro、RdRp、PLproなどがあり、中でもACE2はSARS-CoV-2の細胞/神経細胞への侵入の初期段階に関して重要な役割を果たしている(Huang et al 2020b)。また、3CLproとPLproはSARS-CoV-2の成熟と複製に重要な役割を果たしている(Xue et al 2008; Ryu et al 2010a)。
SARS-CoV-2によって引き起こされる神経炎症を抑制する植物化学物質の可能性は、COVID-19の神経細胞の兆候に対抗する有望な薬剤でもある。
フィトケミカルがCOVID-19の神経炎症と神経徴候を抑制する
先に述べたように、SARS-CoV-2の重要な神経病理学的メカニズムの一つとして、IL-2,IL-6,IL-7,IL-10,TNF-αの放出に伴う炎症亢進が挙げられる(Yang et al 2020)。また、COVID-19患者におけるIL-8,MCP-1,IFN-γ、CXCL9,CXCL10,GM-脳脊髄液のレベル上昇を示唆する研究もある(Li et al 2016,Marchetti et al 2018,Conti et al 2020,Vaninov 2020)神経症状の引き金に関して。BBBが移動する前の白血球の活性化に続く全身の炎症は、ウイルスによる神経学的合併症に向けたもう一つの主要なメカニズムである(Campbell et al 2014)。放出された炎症物質はBBBの伝染性を変化させ、神経炎症の流れを誘発し、グルタミン酸受容体の活性化を通じて神経細胞の過剰興奮を引き起こし、急性発作を引き起こす(Libbey et al 2011; Yavarpour-Bali and Ghasemi-Kasman, 2020)。COVID-19の神経病理発生に炎症が重要な役割を果たしていることを考えると、神経細胞の抗炎症作用を持つフィトケミカルは、関連する神経細胞の症状と闘う道を開く可能性がある。また、最近の報告では、抗ウイルス作用(Fitriani et al 2020)や神経炎症と相互に関連する経路の抑制(Abbaszadeh et al 2020)を通じて、健康管理におけるフィトケミカルの重要な役割が宣言されている。抗酸化作用や抗炎症作用が期待できるフィトケミカル(カロテノイドやポリフェノールなど)は、Nrf2やNF-κBなどの主要な転写因子と相互作用する(Iddir er al)。
ナリンギン
ナリンギン(図1)は、フラボノイドクラスに属するフェノール性フィトケミカルであり、抗神経炎症作用(Chen et al 2016; Chtourou et al 2016; Ngwa et al 2020)抗ウイルス作用(Ng et al 1996)を有しており、COVID-19の予防/治療に用いられる可能性がある(Dabaghian et al 2020)。また、ナリンギンは、COVID-19における高移動度グループボックス1(HMGB1)の抑制を介して、シクロオキシゲナーゼ(COX)-2,誘導性一酸化窒素合成酵素(iNOS)IL-1β、IL-6の発現レベルを抑制する(Park et al 2003;Huang et al 2020a)。また、p38MAPKの発現レベルを低下させて、HMGB1による炎症性メディエーターの生成とそれに伴う肺傷害を抑制した(Gil et al 2016;Kim et al 2019b)。COVID-19の神経学的徴候における炎症性メディエーターの重要な破壊的役割によれば、ナリンギンは、関連する神経学的症状に対抗する上で、期待できる抗炎症/抗ウイルス性の候補であると思われる。ナリンギンのアグリコン型として、ナリンゲニンは同様に抗神経炎症作用(Nouri et al 2019,Alberca et al 2020年)抗ウイルス作用を示しており、COVID-19に対して使用できる可能性がある(Tutunchi et al 2020)。我々は以前、中枢神経系における炎症性メディエーター(NF-κB、TNF-α、IL-1βなど)およびミクログリアの活性化を調節することによるナリンゲニンの神経保護能を示しており(Nouri er al)2019年)それによって炎症性メディエーターによって媒介されるCOVID-19の神経細胞徴候を緩和することができる。
レスベラトロール
別のフェノール化合物として、レスベラトロールは、生存、DNA保護に関連するERK1/2およびSIR1シグナル伝達経路の活性化(Levy et al 2020,MaおよびLi 2020年)および抗神経炎症反応(Bastianetto et al 2015)を介して、COVID-19に対する有望な有益な効果を示している。また、FGF-2を減少させ、NF-κBを抑制することで、神経アポトーシスを抑制する(Xu er al)2018)。COVID-19における前述の炎症性メディエーターの重要な役割を考慮すると(Yarmohammadi et al 2020年)レスベラトロールはCOVID-19患者の神経炎症性徴候を低下させる可能性がある(Chen et al 2005)。レスベラトロールの主要な天然誘導体であるポリダチンは、NF-κB、TNF-α、IL-1β、IL-6,IL-8,プロスタグランジンE2(PGE2)、NO、COX-2,iNOS、マトリックスメタロプロテアーゼ(MMP)-3,MMP-9の神経レベルを低下させる可能性があり、COVID-19の神経炎症症状に対抗する新しい薬剤となる可能性がある(Lo Muzio et al 2020)。また、Bonucciらの最近の研究では、ポリダチンがCOVID-19に対する保護植物化学物質として紹介されている(Bonucci et al 2020)。このように、レスベラトロールやプライダチン誘導体は、神経炎症を改善する作用や、関連する抗ウイルス作用に着目すると、COVID-19の神経細胞の兆候に対抗するフィトケミカルの候補となり得る。
図1 COVID-19の神経症状に対して使用される可能性のある選択されたポリフェノール/フラボノイドの化学構造

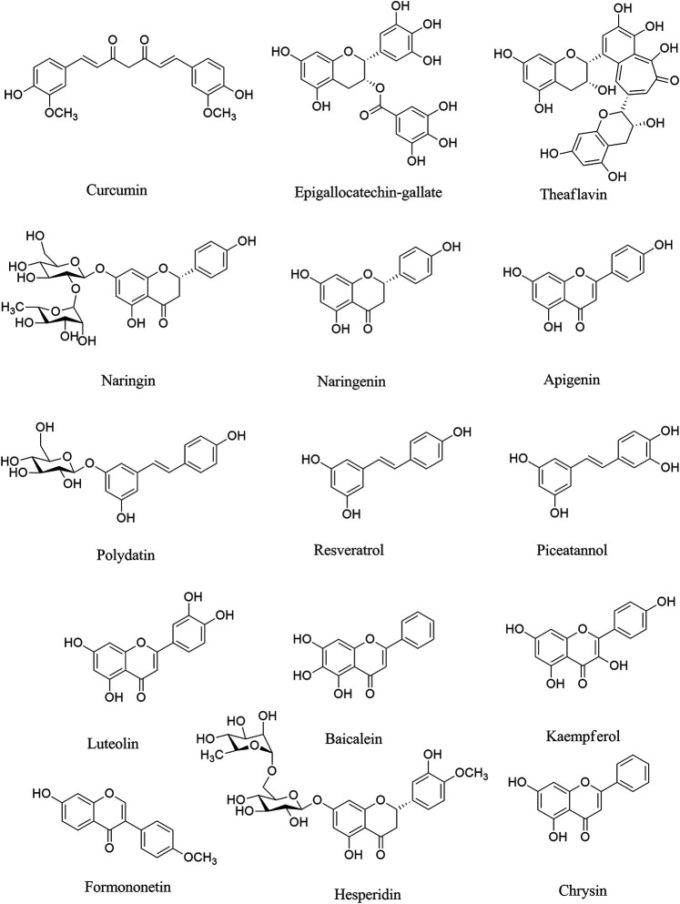
EGCG
一貫して、天然のポリフェノール化合物としてのエピガロカテキンガレート(EGCG)が、抗腫瘍作用、抗炎症作用、抗菌作用、抗酸化作用、抗増殖作用などの重要な機能を果たしているという証拠が示されている(Chacko et al 2010,Ge et al 2018,Mhatre et al 2020)。ミクログリアの活性化を抑制し、炎症性メディエーターを抑制することによる抗神経炎症作用(Abbaszadeh et al 2020)およびEGCGの抗ウイルス作用(Steinmann et al 2013)により、COVID-19の神経症状の治療のためのポリフェノールの可能性がある。緑茶に含まれるEGCG、エピカテキンガレート、エピカテキン、カテキンなどのポリフェノールは、抗ウイルス作用(Chojnacka et al 2020)、抗SARS-CoV-2作用(Ghosh et al 2020)、抗神経炎症作用(Calis et al 2020)を有しており、COVID-19の神経合併症の治療に有望な役割を果たすと考えられる。EGCGは、SARS-CoV-2をウイルスのライフサイクルのさまざまな段階で抑制するために、いくつかの他のメカニズムを採用している(Jang er al)2020)。
フォルモノネチン
もう一つのポリフェノールであるフォルモノネチンは、TNF-α、IL-6,IL-1β、PGE2,iNOS、COX-2のレベルを低下させることで神経炎症を抑制した。フォルモノネチンは、NF-κBシグナル経路を抑制することで神経炎症を抑制し、それによりCOVID-19の神経学的症状に対する新規薬剤となり得ることが示された(El-Bakoush and Olajide, 2018; An et al 2020)。フォルモノネチンは、MAPK、ERK、p38,JNK経路および下流のメディエーターを調節して、抗ウイルス効果を発揮し、感染症による炎症を抑制することが示された(Wang er al)。 また、最近の報告では、COVID-19に対して許容できる有効性を有する主要な植物由来の二次代謝産物の1つとして、フォルモノネチンが考えられている(Mirzaie er al)2020)。
テアフラビン
一貫して、テアフラビンは、抗ウイルス作用、抗炎症作用、抗酸化作用、および抗菌作用を有する他のフェノール化合物である(Higdon and Frei, 2003; Lambert and Yang, 2003)。また、テアフラビンは、COX-2,TNF-α、細胞間接着分子1(ICAM-1)NF-κBのmRNAなどの炎症メディエーターのレベルを抑制した(Mhatre et al 2020)。テアフラビンは、前述の抗ウイルス作用に加えて(Zu et al 2012)神経細胞のIL-1β、IL-6,TNF-α、IL-10,グリア線維酸性タンパク質およびBaxを調節することで、COVID-19の神経学的徴候に対する有用な治療法として紹介することができる。また、ACE2/スパイクタンパク質や主要なプロテアーゼとの相互作用にも関連しているという。
フェノール化合物
また、Kumarらは、分子動力学的解析に基づき、ロスマリン酸、フェルラ酸、ウルソル酸、ピペリン、ジンゲロール、クルクミン、シリマリンなどの他のフェノール化合物がSARS-CoV-2の抑制に重要な役割を果たしていることを示した(Kumar et al 2020)。これまでに、このような植物由来の二次代謝産物の神経保護作用は、炎症と相互に関連するメディエーターを阻害することによって報告されている(Abbaszadeh er al)。 前述の植物化学物質のうち、フェルラ酸、シリマリンおよびクルクミンは、関連する抗ウイルス作用に加えて、特定の抗神経炎症作用を有する(Dutta et al 2009;Borah et al 2013;Ghosh et al 2017)。クルクミンの抗神経炎症作用は、ミクログリア細胞を抑制することで適用される(Ghasemi er al)。 ルテオロシドとバイカレインのような他のフラボノイドもまた、抗ウイルス効果に向けて、神経炎症に対する潜在的な調節効果を有する(Nagai et al 1995;Cao et al 2016;Li et al 2019a;Welcome 2020)。
フィトステロール
他のクラスの植物化学化合物の中で、フィトステロールもまた、潜在的な抗炎症効果を示している(Dash er al)2020)。それらの化合物のうち、スティグマステロールおよびβ-シトステロールは、COX-2,TNF-α、iNOS、IL-6,IL-1β、PGE2およびNF-κBの発現を減少させた(Philip er al)2018)。その結果、Krupanidhiらは、SARS-CoV-2に対するスティグマステロールとβ-シトステロールの抗ウイルス効果を計算機的に示した。つまり、スティグマステロールとβ-シトステロールの抗ウイルス性と抗炎症性を考慮すると、これらはCOVID-19の神経学的徴候に対抗する潜在的な薬剤である可能性がある(Krupanidhi et al 2020)。
アシアチコシド(サポニン)ボルネオール(テルペン)カタルポール(イリドイド)
さらに、アシアチコシド(サポニン)ボルネオール(テルペン)カタルポール(イリドイド)などの植物化学物質が神経細胞のTNF-α、IL-6,TLR4,NF-κB、IL-β、IL-8のレベルを低下させることが複数の証拠によって示されており、COVID-19の神経症状に対抗する薬剤として期待されている(Welcome, 2020)。実際、COVID-19では、炎症が中枢神経系の病因のいくつかのカスケードを引き起こすため、関連するメディエーターを抑制することで、関連する症状を改善できる可能性があると考えられている。他のフィトケミカルの中で、いくつかのアルカロイドも有望な抗炎症および抗ウイルス効果を示しており(Chen er al)2015; Powers and Setzer 2016)COVID-19に対して使用できる可能性がある(Bleasel and Peterson 2020)。アルカロイドのこの効果は、GargとRoyによる最近のin silico研究でも確認された。彼らの研究では、ソファリンDとタリモニンの2つのアルカロイドが、主要なウイルスプロテアーゼ(Garg and Roy, 2020)と炎症経路を抑制することで、潜在的な抗ウイルス活性を示した(Varadinova et al 1996; Pour et al 2019)。
サルササポゲニン(ステロイド系サポゲニン)ノボビオシン(クマリン)αテルピニルアセテート(テルペノイド)
他にも、サルササポゲニン(ステロイド系サポゲニン)ノボビオシン(クマリン)αテルピニルアセテート(テルペノイド)など、いくつかの植物化学物質がSARS-CoV-2の抑制に重要な役割を果たしている(Kumar et al 2020)。これまでに、このような植物由来の二次代謝産物の神経保護作用は、炎症と相互に関連するメディエーターを阻害することで報告されている(Abbaszadeh er al)。2020; Fakhri er al)。2020b)。
カンナビノイド
また、カンナビノイドは、ウイルス性疾患において重要な抗炎症作用を有する(Walter and Stella, 2004; Rizzo er al)。 これらの化合物は、大麻植物の主要な構成要素である。カンナビノイドと大麻の生理的役割は、主にカンナビノイド受容体(CB1RおよびCB2R)エンドカンナビノイド、および関連する代謝酵素によって媒介され、これらは体全体、特に中枢神経系に広く分布している。カンナビノイド受容体のメディエーターは、炎症や自己免疫疾患に関連する疾患を含む多くの疾患の潜在的な標的として考えられている(Rizzo et al 2020)。大麻由来のカンナビノイドは、サイトカインの抑制、免疫細胞の移動・増殖の抑制など、極めて重要な抗炎症・免疫調節作用を有することが有力視されている(Almogi-Hazan and Or, 2020)。さらに、選択的カンナビノイドアゴニストは、ウイルスによる神経炎症の治療に関する新しい方法を提示している。カンナビノイドは、医薬品として世界中で受け入れられていることを考えると(Onaivi er al)。
総合的に見て、免疫系を調整し、神経細胞のサイトカインストームを抑制する可能性のあるフィトケミカルは、COVID-19の神経細胞の合併症と闘う道を切り開く可能性がある。
フィトケミカルがACE2を阻害し、スパイクタンパクを抑制することでCOVID-19の神経症状を改善する
前述したように、SARS-CoV-2はACE2またはTMPRSS2受容体を介して中枢神経系に侵入する(El Tabaa and El Tabaa, 2020; Nemoto et al, 2020)。SARS-CoV-2の神経細胞への侵入を低下させるためには、ACE2活性を低下させる必要がある(Battagello er al)。 宿主細胞に結合し、宿主種の抗体の一部からウイルスを保護する重要な役割を持つ、SARS-CoV-2の主要な構造タンパク質としてのスパイク(S)糖タンパク質は、フィトケミカルのもう一つの標的である(Schoeman and Fielding, 2019)。
ACE2は、ヒト細胞の外膜に存在する酵素で、Sタンパク質の結合部位として機能する。いくつかの研究で、ACE2とSタンパク質の間には強い相互作用があることがわかっている。そのため、ACE2をブロックすることも、SARS-CoV-2に対抗するための植物化学的な戦略のひとつである(Li et al 2005)。
フラボノイド
フラボノイドは、Nrf2を活性化することでACE2の発現を抑え、それによってSARS-CoV-2に対抗する(Mendonca and Soliman, 2020; Muchtaridi et al 2020)。分子ドッキング変異誘発研究と実験的検証結果に基づいて、ヘスペリジン、クリシン、エモジンはCOVID-19治療に使用できる(Basu et al 2020)。in silico研究では、ケンフェロール、ケルセチン、フィセチンが、hACE2とSタンパク質の結合界面付近で、hACE2-S-タンパク質複合体に結合することが示された(Pandey er al)2020)。Rebas et al 2020による最近の研究では、前述の化合物の神経保護効果が示されている。つまり、ケンフェロール、ケルセチン、フィセチンは、COVID-19の神経学的徴候に対して有望なフラボノイドである。2つのin silico研究により、ケルセチン、ケルセチン3-グルクロニド-7-グルコシド、ケルセチン3-ビシアノシド、アブシンチン、グラブリジン、没食子酸は、COVID-19の阻害に向けて、ACE2とのより良い結合エネルギー(BE)を与えることが示された(Joshi er al)。
ピセアタンノール
同じ分子ドッキング分析を通じて、ピセアタンノールもまた、ACE2に結合する可能性を持つ神経保護反応を示しており(Zhang et al 2018;Talebi et al 2020年)それによってCOVID-19の予防と治療に重要な役割を果たしている(Wahedi et al 2020;Ahmad et al 2020)。
バイカリン、スクテラリン、ヘスペレチン
植物化学物質であるバイカリン、スクテラリン、ヘスペレチンもまた、ACE2に結合し、COVID-19の神経症状の軽減に関して(Cheng er al)。 いくつかのin silico研究により、ヘスペリジンのSARS-CoV-2スパイクタンパク質および主要プロテアーゼとの結合エネルギーは、リトナビル、ロピナビル、インディナビルよりも低いことが示された。これにより、ヘスペリジンが有効な抗ウイルス剤であることが紹介された。また、ヘスペリジンは、ウイルス感染、炎症、フリーラジカルによって引き起こされる細胞の損傷を打ち消すことが示されている(Bellavite and Donzelli, 2020)。ナリンゲニン、ヘスペレチン、ヘスペリジン、バイカリンを含む他のフェノール化合物の多くは、ACE2活性を阻害する可能性を示し、それによってCOVID-19および関連する神経症状に対する効果が期待されている(Muchtaridi et al 2020)。別の研究では、スチルベン系化合物、特にレスベラトロールは、スパイクタンパク質とヒトACE2受容体複合体を破壊することで作用する有望なフィトケミカル候補であるとしている(Wahedi et al 2020)。
EGCGとテアフラビンガレートは、SARS-CoV-2のスパイクタンパク質中央チャネルを標的とする有望なフィトケミカルであると考えられる(Maiti and Banerjee, 2020)。Kulkarniらの最近の研究では、カルバクロール、ゲラニオール、アネトール、l-4-テルピネオール、酢酸シンナミル、チモール、プレゴンなどのテルペノイド類や、シンナムアルデヒドなどのフェノール類が、ウイルスのスパイクタンパク質を阻害する可能性のある有効な抗ウイルス剤であることがわかった。また、ニンビン(トリテルペノイド)やクルクミン(ポリフェノール)は、ACE2やSタンパク質と高い結合親和性を示した(Maurya et al 2020)。ChenとDueは、フラボノイド配糖体であるスクテラリンとトリテルペノイドであるグリチルリチンのACE2との相互作用のBEをそれぞれ-14.9kcal/molと-9kcal/molと推定し、バイカリン、ヘスペレチン、ニコチアナミンなどの他の研究された植物化学物質よりも強いとした(Chen and Du, 2020)。Vardhanらの研究では、リモノイドやトリテルペノイドの154種類の類似物質が、ACE2,3CLpro、PLpro、スパイクプロテイン、RdRpに対する潜在的な阻害作用を示すことが示された。また、別のin silico研究では、リモニン、オバキュノン、ウルソール酸、グリチルリチン酸、7-deacetyl-7-benzoylgedunin、マスリン酸、コロソリン酸がSARS-CoV-2タンパク質を効果的に標的とすることが示された(Vardhan and Sahoo, 2020)。
分子ドッキング分析によって評価されたジチモキノン(キノンの一種、図2)は、ACE2に結合することで神経保護反応を示し(Zhang et al 2018;Talebi et al 2020年)COVID-19の予防と治療に重要な役割を示すために(Wahedi et al 2020;Ahmad et al 2020)。Nigella sativa L. (Ranunculaceae) の潜在的なフィトケミカルとして、結合親和性が-8.6 kcal/molのdithymoquinoneが、SARS-CoV-2のACE2に結合する高い可能性を示した(Ahmad et al 2020)。SARS-CoV-2に関する分子モデリングの結果によると、N. sativaの種子から得られた新しいインダゾールアルカロイドであるnigellidineは、SARS-CoV-2の活性部位に有意義に結合することがわかった(Maiti er al)。
図 2 COVID-19の神経学的症状に対して使用される可能性のある選択されたアルカロイド/テルペン/キノンの化学構造
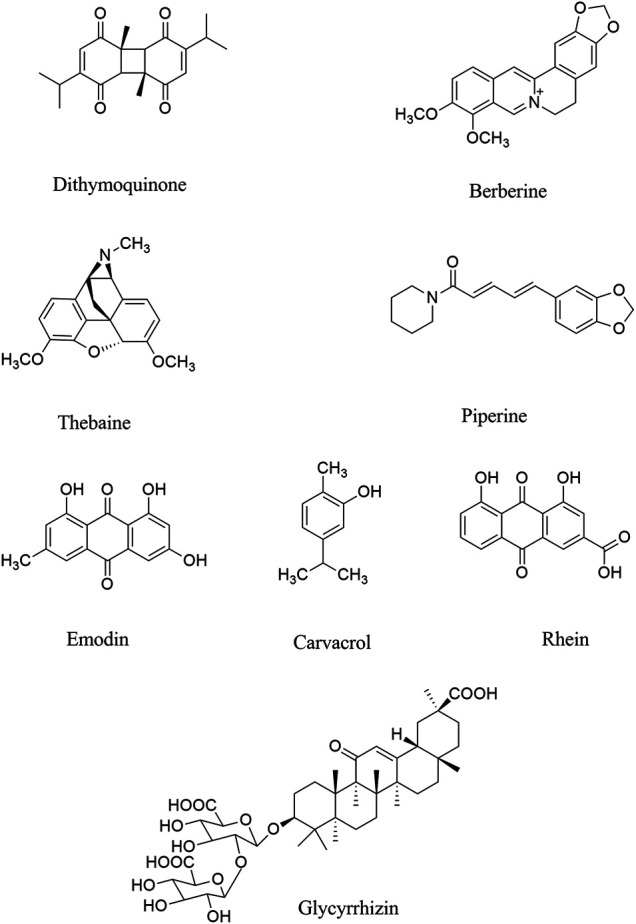
Parvezらは、in silico研究において、2つのカルコンであるアゾベカルコン(結合エネルギー[BE]、-14.4kcal/mol)およびアイソピラカルコン(BE、-12.8kcal/mol)ならびに2つのアルカロイドであるファングキノリン(BE、-12.5kcal/mol)およびテトラランドリン(BE、-12.6kcal/mol)が、SARS-CoV-2のSタンパク質に対して高い結合親和性を示すことを示した(Parvez et al, 2020). また、セファランチン、ファンキノリン、テトロンリンを含む3つのアルカロイドは、以前にウイルス疾患における抗炎症作用の役割を示したように、5μMでHuman-CoV-OC43のSタンパク質の発現を阻害した(Kim er al)2019a)。別の研究では、Hoと共同研究者は、アントラキノンエモジン(IC50, 200 µM)がACE2とSタンパク質の間の相互作用をブロックすることを示した(Okamoto et al, 2001; Ho er al)。
Niuらの調査では、ACE2のmiRNAに影響を与える植物化学物質として、glabridin、genistein、chrysoeriol、tectorigeninが紹介されている(Niu et al 2020b)。In vitroの調査では、rhifolin, δ-viniferin, myritilin, homoflavone A, lactucopicrin15-oxalate, nympholide A, afzelin, biorobin, phyllaemblicin B, cyanidin, baicalin, scutellarin, glycyrrhizin, tangeretin, pro-cyanidin, nobiletin, brazilein, galangin, acetoxychavicol acetate (ACA), delphinidinなどの植物化学物質は、ACEを阻害してCOVID-19を抑制する(Maroli er al)。 , 2020; Muchtaridi et al 2020)。
最近の報告では、ネオヘスペリジン、ノビレチン、スクテラリン、ニコチナミン、グリシリノジンなど、ACE2活性を阻害する植物化学物質が他にもいくつかあることが確認されている(Muchtaridi et al 2020)。また、グリチルリチン酸は、抗ウイルス作用を持つ別の天然物として、ACE2に結合することから、COVID-19の神経症状の治療に使用できる可能性がある(Pilcher, 2003)。ルテオリンはまた、SARS-CoVのSタンパク質を分解するfurinタンパク質を阻害した。同様に、ヘルバセチンは、Sタンパク質とACE2の相互作用を阻害した。したがって、これらの植物化学物質は、ACE2/スパイクタンパク質を標的として、神経症状の引き金となるSARS-CoV-2の中枢神経系細胞への浸透/付着を抑制することで、COVID-19の神経症状の治療/管理に有用であると考えられる(Wu et al 2020b)。ベルベリン、テバイン、ピペリン(アルカロイド)ウィザフェリンA(ステロイドラクトン)ニンビン、エンベリン、カフェストール、ムラヤニン、ムラヤキノン-A、アンドログラフォリドは、例えば、SARS-CoV-2のスパイクタンパク質やACE2受容体に結合することで、抗ウイルス作用を発揮する可能性のある植物化学物質であることが示されている(Grover et al, 2011; Boukhatem and Setzer, 2020; Gupta et al 2020; Parida et al 2020)。) 一貫したドッキングの結果、SARS-CoV-2に対しても同様に許容できる阻害効果を示した。
ACE2およびスパイクタンパク質に対する阻害効果が報告されている主な植物化学物質を表1に示す。
表1 COVID-19 の神経学的徴候に対して、ACE2,スパイクタンパク質、プロテアーゼ、RdRP を阻害する効果を持つ選りすぐりの植物化学物質/候補物質
| 植物化学物質のクラス | 化合物 | 研究タイプ | 参考文献 |
|---|---|---|---|
| ACE2の相互作用 | |||
| アルカロイド | ニコチアナミン | インシリコ | (Chen and Du、2020) |
| フラボノイド | バイカリン | インシリコ | (Cheng et al。、2020a ; Chen and Du、2020) |
| フラボノイド | クリシン | インシリコ | (Basu et al。、2020) |
| フラボノイド | フィセチン | インシリコ | (Pandey et al。、2020) |
| フラボノイド | ヘスペレチン | インシリコ | (Chen and Du、2020) |
| フラボノイド | ケンペロール | インシリコ | (Pandey et al。、2020) |
| フラボノイド | ナリンゲニン | インシリコ | (Muchtaridi et al。、2020) |
| フラボノイド | ケルセチン | インシリコ | (Joshi et al。、2020 ; Williamson and Kerimi、2020) |
| フラボノイド | スクテラリン | インシリコ | (Chen and Du、2020) |
| ポリフェノール | クルクミン | インシリコ | (Maurya et al。、2020) |
| ポリフェノール | ピセアタンノール | インシリコ | (Wahedi et al。、2020) |
| ポリフェノール | レスベラトロール | インシリコ | (Wahedi et al。、2020) |
| キノン | ジチモキノン | インシリコ | (Ahmad et al。、2020) |
| テルペノイド | グリチルリチン | インシリコ | (Chen and Du、2020) |
| テルペノイド | ニンビン | インシリコ | (Maurya et al。、2020) |
| スパイクタンパク質の相互作用 | |||
| アルカロイド | ベルベリン | インシリコ | (Maurya et al。、2020) |
| アルカロイド | セファランチン | 試験管内で | (Kim et al。、2019a) |
| アルカロイド | ピペリン | インシリコ | (Rout et al。、2020) |
| アルカロイド | テバイン | インシリコ | (Maurya et al。、2020) |
| アルカロイド | ファンギノリン | インシリコ、invitro | (Kim et al。、2019a ; Parvez et al。、2020) |
| アルカロイド | テトランドリン | インシリコ、invitro | (Kim et al。、2019a ; Parvez et al。、2020) |
| フラボノイド | エピガロカテキンガレート | インシリコ | (Maiti and Banerjee、2020) |
| フラボノイド | フィセチン | インシリコ | (Pandey et al。、2020) |
| フラボノイド | イソロフィラカルコーンA | インシリコ | (Parvez et al。、2020) |
| フラボノイド | ケルセチン | インシリコ | (Pandey et al。、2020) |
| フラボノイド | テアフラビン | インシリコ | (Maiti and Banerjee、2020) |
| フェノール | シンナムアルデヒド | インシリコ | (Kulkarni et al。、2020) |
| ポリフェノール | クルクミン | インシリコ | (Maurya et al。、2020) |
| ポリフェノール | レスベラトロール | インシリコ | (Wahedi et al。、2020) |
| キノン | エモジン | 試験管内で | (岡本ほか、2001年;ホーら、2007年;ホーら、2007年) |
| テルペノイド | カルバクロール | インシリコ | (Kulkarni et al。、2020) |
| テルペノイド | グリチルリチン | インシリコ | (Chen and Du、2020) |
| テルペノイド | ニンビン | インシリコ | (Maurya et al。、2020) |
| テルペノイド | 小柴胡湯 | インシリコ | (Sinha et al。、2020) |
| RdRPブロッカー | |||
| アルカロイド | 6-アセトニルジヒドロケレリスリン | インシリコ | (Pandeya et al。、2020) |
| アルカロイド | アロクリプトピン | インシリコ | (Pandeya et al。、2020) |
| アルカロイド | セファランチン | インシリコ | (Ruan et al。、2020) |
| アルカロイド | ファンギノリン | インシリコ | (Parvez et al。、2020) |
| アルカロイド | プロトピン | インシリコ | (Pandeya et al。、2020) |
| アルカロイド | テトランドリン | インシリコ | (Parvez et al。、2020) |
| フラボノイド | アピゲニン | インシリコ | (Rameshkumar et al。、2020) |
| フラボノイド | シアニジン | インシリコ | (Rameshkumar et al。、2020) |
| フラボノイド | デルフィニジン | インシリコ | (Rameshkumar et al。、2020) |
| フラボノイド | ヘスペリジン | インシリコ | (Singh et al。、2020) |
| フラボノイド | イソロフィラカルコーンA | インシリコ | (Parvez et al。、2020) |
| フラボノイド | ミリセチン | インシリコ | (Singh et al。、2020) |
| フラボノイド | テアフラビン | インシリコ | (Lung et al。、2020 ; Singh et al。、2020) |
| ポリフェノール | エピガロカテキンガレート | インシリコ | (Singh et al。、2020) |
| ポリフェノール | 没食子酸 | インシリコ | (Abd El-Aziz et al。、2020) |
| ポリフェノール | レスベラトロール | インシリコ | (Abd El-Aziz et al。、2020) |
| 主なプロテアーゼ阻害剤 | |||
| アルカロイド | ベルベリン | インシリコ | (Narkhede et al。、2020) |
| アルカロイド | ファンギノリン | インシリコ | (Parvez et al。、2020) |
| アルカロイド | ソラニン | インシリコ | (Hasan et al。、2020) |
| アルカロイド | トリプタンスリン | インシリコ | (Narkhede et al。、2020) |
| フラボノイド | アメントフラボン | 試験管内で | (Ryu et al。、2010a) |
| フラボノイド | アピゲニン | 試験管内で | (Ryu et al。、2010a) |
| フラボノイド | フォーチュネリン | インシリコ | (Panagiotopoulos et al。、2020) |
| フラボノイド | ヘスペリジン | インシリコ | (Adem et al。、2020a) |
| フラボノイド | イソロフィラカルコーン | インシリコ | (Parvez et al。、2020) |
| フラボノイド | ルテオリン | 試験管内で | (Ryu et al。、2010a) |
| フラボノイド | ナルシシン | インシリコ | (Owis et al。、2020) |
| フラボノイド | ナリンゲニン | インシリコ | (Kim et al。、2019b) |
| フラボノイド | Oolonghomobisflavan-A | インシリコ | (Bhardwaj et al。、2020) |
| フラボノイド | パピリフラボノール | 試験管内で | (Park et al。、2017) |
| フラボノイド | ケルセチン | 試験管内で | (Ryu et al。、2010a ; Nguyen et al。、2012) |
| フラボノイド | ルチン | インシリコ | (Adem et al。、2020a) |
| イリドイド | ジェニポシド | インシリコ | (Rahman et al。、2020) |
| リグナン | サビニン | 試験管内で | (Wen et al。、2007) |
| ポリフェノール | ディエコル | 試験管内で | (Park et al。、2013) |
| ポリフェノール | ガロカテキン-3-ガレート | インシリコ | (Ghosh et al。、2020) |
| キノン | ライン | インシリコ | (Narkhede et al。、2020) |
| キノン | タンシノンI | 試験管内で | (Park et al。、2012) |
| テルペノイド | 1,8-シネオール | インシリコ | (Sharma and Kaur、2020) |
| テルペノイド | アンドログラフォライド | インシリコ | (Enmozhi et al。、2020) |
| テルペノイド | ベツリン酸 | 試験管内で | (Wen et al。、2007) |
フィトケミカルがRdRp, 3CLpro, PLproを阻害することでCOVID-19の神経発現を抑制する
SARS-CoV-2の神経病態には、RdRp、3CLpro、PLproが重要な役割を果たしていることがわかってきたので、現在、研究を進めている。プロテアーゼ、特に3CLproとPLproは、SARS-CoV-2の成熟と複製に重要な役割を果たしており、抗SARS-CoV-2フィトケミカルの主な標的の一つである(Xue et al 2008; Ryu et al 2010a; Shamsi et al 2016)。ポリフェノール、特にフラボノイドは、プロテアーゼを阻害することで抗SARS効果を持つフィトケミカルの一つである(Senthilvel et al 2013;Shamsi et al 2016;Annunziata et al 2020)。Ademと共同研究者は、80種類のフラボノイドの分子ドッキング研究において、24種類のフラボノイドがSARS-CoV-2の主要プロテアーゼと適切な相互作用を持つことを示し、その中でもヘスペリジンとルチンが最も高い相互作用を持つことを示した(Adem er al)。 また、別のin silicoの報告では、458種類のフラボノイドがスクリーニングされ、アピゲニン7-(6″-マロニルグルコシド)、シアニジン-3-(p-クマロイル)-ルチノシド-5-グルコシド、デルフィニジン3-O-β-グルコシドなどが挙げられている。delphinidin 3-O-β-D-glucoside 5-O-(6-coumaroyl-β-D-glucoside), albireodelphin, (-)-Maackiain-3-O-glucosyl-6″-O-malonateなどがSARS-CoV-2の阻害に最も高いポテンシャルを有していた。前述のフラボノイドは、SARS-CoV-2のRdRPおよびSタンパク質に対して最も高い結合エネルギー値を示した(Rameshkumar et al 2020)。23種類のフラボノイドと25種類のカルコン化合物を対象とした別の研究では、これらの化合物が主なプロテアーゼをブロックする能力を持つことが示された。彼らの研究では、シアニジンがRNAポリメラーゼを阻害し、また、ケルセチンがウイルスのスパイクをブロックした。前述のように、RdRpはSARS-CoV-2のRNA複製を触媒することから、抗ウイルス剤設計の重要なターゲットと考えられている。分子ドッキングの調査により、EGCG、テアフラビン、テアフラビン-3′-O-ガレート、テアフラビン-3′-ガレート、テアフラビン3,3′-ジガレート、ヘスペリジン、ケルセタゲチン、ミリセチンがRdRpの活性部位に結合することが明らかになった(Singh et al 2020)。全体として、フラボノイドとインドールカルコンは、SARS-CoV-2と闘うことができた(Vijayakumar et al 2020)。さらに、ケルセチンおよびケンフェロールは、SARS-CoVの3CLpro、PLpro、およびSタンパク質を阻害する可能性のある有益な抗炎症、抗酸化、抗ウイルス、および抗アレルギー効果を有することが確認された(Di Pierro er al)2020)。従って、ドッキングの結果、ケルセチンとケンフェロールはSARS-CoV-2に対する有望な化合物であることが示された。つまり、これらの植物化学物質は、COVID-19患者の神経学的症状を軽減する可能性があるのです(Ryu er al)。 Gorla et al 2020)による最近のin silico報告では、SARS-CoV-2のACE2/スパイクタンパク質と最も受け入れやすい相互作用を持つバイオフラボノイドとして、シリマリンとビオチャニンAが提案された。また、ナリンゲニンは3CLpro鎖を阻害することがin silico研究で示されており、COVID-19患者の神経症状を緩和するための有望なフィトケミカルであると考えられている(Kim er al)。 プレニル化フラボンとしてのパピリフラボノールAは、SARS-CoVのPLproおよび3CLproをそれぞれ3.7および103.6μMで阻害した(Park et al 2017)。また、Ryuらは、ビフラボノイドであるアメントフラボンが3CLproを8.3µMで阻害する一方、アピゲニン、ルテオリン、ケルセチンはそれぞれ280.8,20.2,23.8µMで酵素を阻害することを示した(Ryu et al 2010a; Yao et al 2018; Istifli et al 2020)。Oolonghomobisflavan-A (Bhardwaj et al 2020), narcissin (Owis et al 2020), isolophirachalcone (Parvez et al 2020), fortunellin (Panagiotopoulos et al 2020), dieckol (Park et al 2013), gallocatechin-3-gallate (Ghosh et al 2020) は、SARS-CoV-2プロテアーゼに対する阻害作用を有する他のポリフェノールである。
緑茶を発酵させた後に生成されるポリフェノール群であるテアフラビンは、RdRpに非常に強い親和性で結合する(Lung et al 2020,Singh et al 2020)。Lungらは、テアフラビンがSARS-CoV2,SARS-CoV、およびMERS-CoVのRdRpに対して高い親和性を有することを報告した(Lung et al 2020)。また、Singh et al 2020)は、テアフラビン-3,3′-ジガレート、テアフラビン-3′-ガレート、テアフラビン-3′-O-ガレート、およびテアフラビンが、それぞれ-9.9,-9.6,-9.6,および-9.3kcal/molの結合エネルギーで、RdRpに対して最も高い親和性を有することを示した。EGCGとヘスペリジン(Singh et al 2020)、アイソフィラカルコンA(Parvez et al 2020)、没食子酸とレスベラトロール(Abd El-Aziz et al 2020)は、RdRpへの高い結合親和性を介して抗SARS-CoV-2活性を有する他のポリフェノールである。
ソラニンはステロイド系のアルカロイドであり、C3-like proteaseの2つのアミノ酸クラスターと相互作用する。第一のクラスターはHis163,His164,Met165,Pro168からなり、後者はAsp187,Gln189,Ala191からなる(Hasan er al)2020)。他にもC3様プロテアーゼと相互作用するアルカロイドとして、ソラスリン、オマチデノール、シクロアルタノール、ジオスゲニン、ルペオール、パープリンなどがある(Hasan er al)。 そのほか、セファランチン(Ruan et al 2020)ファンキノリン、テトラランドリン(Parvez et al 2020)プロトピン、6-アセトニルジヒドロケレリスリン、アロクリプトピン(Pandeya et al 2020)などのアルカロイドは、ドッキング研究においてSARS-CoV-2 RdRpと強い結合を示した。
Nsp15は、コロナウイルスの機能において必須である自然免疫反応に対するタンパク質の干渉を担っている。研究によると、サルササポゲニン、ウルソル酸、アピゲニン、クルクミン、アジュマリシン、ノボビオシン、シリマリン、αアミリン、ポモリック酸、カルノソール、アシアティック酸、レセルピン、ベツリン酸、プラタニック酸、タスパイン、アルフィトール酸、タキシフォリン、ウォゴニン、クロロゲン酸、アフロモシン。gliotoxin, psoralen, carinatine rhinacanthin, caffeic acid, coriandrin, scopoletin, cordycepin, ricinoleic acid, alpha asarone, allicin, aranotinなどの植物化学物質は、Nsp15タンパク質と結合することができ、COVID-19の阻害剤として有用な因子となる可能性がある(Kumar er al)。 , 2020; Umesh et al 2020)。Ademらの研究では、カフェ酸誘導体がCOVID-19 Nsp15,主要プロテアーゼ、スパイクタンパク質の阻害を介して、SARS-CoV-2の阻害剤として有益な効果を示した(Adem et al 2020b)。
アルカロイドやフラボノイドに加えて、テルペノイドやキノンもSARS-CoV-2の主要プロテアーゼに対する阻害作用を持つ植物化学物質である。SARS-CoV-2のアントラキノン類(レイン、クリソファン酸など)アルカロイド類(インディカン、インディゴ、ベルベリン、トリプタンスリンなど)テルペン類(ビクロゲルメクレイン、グリチルリチンなど)の天然物が、SARS-CoV-2の主要プロテアーゼと強い相互作用を示すことがin silico研究で明らかになっている。彼らの研究では、最も低い結合エネルギーに基づいて、レイン(BE, -8.9 kcal/mol)とトリプタントリン(BE, -8.2 kcal/mol)がSARS-CoV-2に対する適切な候補として紹介されている(Narkhede et al, 2020)。また、アンドログラフォリド(Enmozhi et al 2020)、1,8-シネオール(Sharma and Kaur, 2020)、ベツリン酸とサビニン(Wen et al 2007)、ゲニポシド(Rahman et al 2020)、タンシノンI(Park et al 2012)などは、SARS-CoV-2のプロテアーゼを阻害することで、抗SARS-CoV-2活性を有する植物化学物質である。同様の研究で、シリビニン、ジヒドロロビネチン、ピオニジン、ロビネチン、5-デオキシガランギン、スクテラレイン、プルプリン、イソラムネチン、トリセチン、ゴシペチン、ノラティリオル、クメストロール、イソサクラネチン、ペクトリナリゲニン、タンゲリチン、ノビレチン。プラテンセイン、ヒスピドゥリン、バイカルエイン、モリン、ウロリチンA、アカセチン、ペラルゴニジン、イリロン、ピノセンブリン、マルビジン、ダルベルギン、ブテイン、ビオチャニンA、フスティン、5-ヒドロキシフラボン、ピノストロビン、ピノバンクシン、ダチセチン、ガランギン、シアニジン ダイゼイン、グリシテイン、ウォゴニン、フロレチン、ウロリチンB、アンゴレンシン、ピノシルビン、フォルモノネチン、リクイリチゲニン、プルネチン、アルピネチン、バイオチャニンA、ラポンチゲニン、エクオール、ピセアタンノール、イソラポンチゲニン、ダンシェンス、オイゲニン、シナピン酸。SARS-CoV-2 RdRpに結合する天然物として、プテロスチルベン、ピロガロール、レサセトフェノン、シリンジ酸、p-クマル酸、パイオノール、プロトカテク酸、チロソール、カテコール、4-エチルフェノール、桂皮酸などが挙げられる(Kurokawa er al)。 , 2001; Bosch-Barrera et al 2020; Singh et al 2020)。) 同様に、Umesh et al 2020)の研究によると、天然の植物化学物質であるカルノソール、ロスマノール、アルジュングルコシド-Iは、分子ドッキングアプローチを用いてSARS-CoVのメインプロテアーゼに対する潜在的な阻害効果を示しているとのことである。Chojnackaらの最近の研究では、ケルセチン、ベツリン酸、ルテオリン、インジゴ、アロエモジン、キノメチルトリテルペノイド、またはガレートのようないくつかの生物学的に活性な植物化学物質が、ウイルスプロテアーゼをブロックする重要な抗ウイルス剤となる可能性があるとしている(Chojnacka et al 2020)。さらに、18-ヒドロキシ-3-エピ-アルファヨヒンビン、ビンカプシン、アロヨヒンビン、ガムマジオールなどの植物化学物質が、SARS-CoV 3CLpro、SARS-CoV-2 3CLpro、MERS-CoV 3CLproの阻害に向けて、COVID-19神経細胞の治療に役立つことが示されている(Bhardwaj er al)2020)。また、RdRPおよびプロテアーゼを阻害する可能性のあるフィトケミカルも表1に示した。
フィトケミカルの薬物動態学的相互作用とBBB伝染性。新規デリバリーシステムへのANアプローチ
しかし、そのようなフィトケミカルの神経保護効果は、いくつかの研究で提供されており、フィトケミカルのBBBを介した伝染性の推定は、SwissADMEプログラムによって評価された(Daina et al 2017)。BBBを介した伝染性の推定値、ならびに予測される吸収、分布、代謝、排泄(ADME)パラメータ、薬物動態特性、ドラッグライクな性質、およびメディシナルケミストリーの親和性に関する情報は、補足表S1に示されている。55種類のフィトケミカルのうち、BBB伝染性のスクリーニングでは、15種類の化合物が肯定的な効果を示した。その中には、モノテルペノイドの1,8-シネオールとカルバクロール、アルカロイドの6-アセトニルジヒドロケレリスリン、アロクリプトピン、ベルベリン、ピペリン、プロトピン、テバイン、トリプタンチン、フラボノイドのクリシン、キノンのジチモキノンとタンシノンI、フェノール化合物のレスベラトロールとシンナムアルデヒド、リグナンのサビニンなどが含まれる。上述のような植物化学物質の薬物動態上の欠点を克服するために、BBBへの浸透性を高めるための新しいデリバリーシステムが適用されている。これまでに、ナノ製剤、高分子ミセル、ナノ/マイクロエマルション、ナノゲル、固体脂質ナノ粒子、高分子複合体、リポソーム/リン脂質などが研究されている(Abbaszadeh et al 2020;Fakhri et al 2020a)。
先に述べたように、炎症状態はCOVID-19疾患の病因において重要な役割を果たしている。注目すべきは、炎症が植物化学物質のBBB伝染性を高めて、中心部への浸透を促進する可能性があることである。この病態は、浸透に限界のあるそれらのフィトケミカルの中枢神経系への浸透を単純化する。
考察
COVID-19のパンデミックは人間の生命にとって重要な脅威である。現在までのところ、COVID-19の様々な合併症に対抗する有効な薬剤やワクチンは提供されていない。そのため、COVID-19に関連する症状に対抗する治療薬を見つけることは非常に重要である。COVID-19の様々な合併症の中でも、特に注目されているのが神経学的症状である。COVID-19の神経症状の病態生理には、低酸素、神経炎症、ACE2/スパイクタンパク質、ウイルス増殖に関連する酵素(RdRP、3CLpro、PLproなど)など、複数の調節不能なメカニズムが関与していることが明らかになってきている。そのため、マルチターゲットの薬剤を提供することで、COVID-19に関連する神経細胞の症状に対処する道が開ける可能性がある。長年にわたり、植物界は有望な抗ウイルスおよび抗神経炎症の結果を示してきた。そのため、候補となる植物化学物質の新たな用途を見出すことは、補完・代替医療の分野で成功した歴史がある。私たちは以前、ウイルスの侵入、被覆解除、複製、放出など、ウイルスのライフサイクルの様々な段階における植物由来の二次代謝産物の抗ウイルスアプローチと治療標的を示した(Pour et al 2019)。
本研究では、コロナウイルスの侵入/付着段階および複製段階の阻害に関して、抗ウイルス効果と神経炎症、ACE2/スパイクタンパク質、およびウイルスのライフサイクルにおける関連する主要プロテアーゼに対する調節力を持つ潜在的なフィトケミカルが強調されている(図3)。前述の植物化学物質の中で、COVID-19の神経学的徴候を抑制する可能性のある候補として、in silico/試験管内試験の結果から、ポリフェノール(主にフラボノイド)アルカロイド、テルペン/テルペノイドが紹介された。植物化学物質の中枢神経系への浸透はBBBによって制限されているが、疾患に関連した炎症状態や新しいデリバリーシステムは、BBBの力学を克服して制限を解消する可能性がある。その結果、ナリンギンとそのアグリコン(ナリンゲニン)テアフラビン、シリマリン、クルクミン、EGCG、ポリフェノールのレスベラトロールとその誘導体(ポリダチン)などのフラボノイド類、さらにいくつかの植物ステロール類やカンナビノイド類が、SARS-CoV-2の神経合併症に対して、抗神経炎症作用と抗ウイルス作用を同時に示すことがわかった。ウイルスの侵入・付着を抑制するためには、フラボノイド類のヘスペリジン、クリシン、ケンフェロール、ケルセチン、フィセチン、バイカリン、ナリンジェニン、EGCG、テアフラビン、テルペン類のカルコン、グリチルリチン、ニンビン、アルカロイド類のベルベリン、テバイン、ピペリン、テルペノイドなどがACE2/スパイクタンパク質を標的とすることで、将来性が期待されている。その結果、コロナウイルスの主要なプロテアーゼを標的とする場合、フラボノイド類のアピゲニン、シアニディング、デルフィニジン、EGCG、テアフラビン、ナリンゲニン、ヘスペリジン、ケルセチン、ケンフェロール、さらにカルコン類、ステロイド系アルカロイド、テルペノイド、キノン類などが候補となる。以上のように、前述の植物化学物質は、神経炎症、ACE2/スパイクタンパク質、主要プロテアーゼの抑制を介して、COVID-19の神経学的徴候と闘う可能性のある薬剤であることを示す証拠が増えている。
COVID-19における神経学的症状、関連する病態生理学的メカニズム、およびフィトケミカルの有望な役割
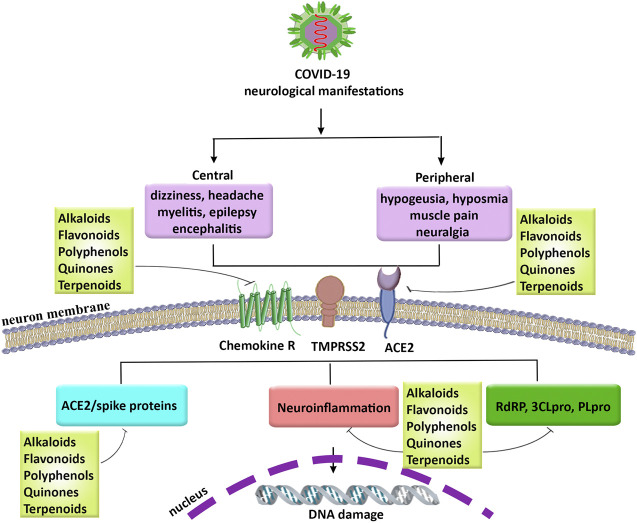
COVID-19:新型コロナウイルス019,PLpro:パパイン様プロテアーゼ、RdRP:RNA依存性RNAポリメラーゼ、SARS-CoV-2:重症急性呼吸器症候群新型コロナウイルス,TMPRSS2:膜貫通型プロテアーゼ、セリン2,3CLpro: 3CLpro:3-chymotrypsin-like cysteine protease(3-シモトリプシン様システインプロテアーゼ)。
このような研究は、COVID-19の神経症状に対抗するための新たな治療薬の発見に道を開く可能性がある。今後は、COVID-19の神経症状の原因となっている正確な調節異常経路や、治療に有用なフィトケミカルを明らかにするためのさらなる報告が必要である。
