Contents
- Systems healthcare: a holistic paradigm for tomorrow
- 概要
- 背景
- ホリスティックヘルスとシステムヘルス
- システムヘルスの実際 分子ネットワークの機能不全
- アルツハイマー病へのシステムアプローチ
- アルツハイマー病ネットワークの研究
- アルツハイマー病に対する現在のアプローチ-ゲノミクス
- アルツハイマー病に対する現在のアプローチ – メタボロミクス
- アルツハイマー病へのホリスティックアプローチ
- 循環器疾患へのシステムアプローチ
- 心血管疾患に対する現在のアプローチ – ゲノミクスとエピジェネティクス
- 心血管疾患に対する現在のアプローチ – メタボロミクス
- システム医療 – 政策、倫理、社会的問題
- システムズ・ヘルスケア – 政策と具体的な課題
- システム医療 – データ、プライバシー、差別
- システム・ヘルスケア – アクセスとコスト
- システム医療 – 社会的決定要因
- システム医療 – 経済的意味
- 結論
Systems healthcare: a holistic paradigm for tomorrow
www.ncbi.nlm.nih.gov/labs/pmc/articles/PMC5738174/
2017年12月19日オンライン公開
概要
システム医療とは、システム生物学と医学を前提とした健康への総合的なアプローチである。このアプローチでは、分子、細胞、臓器、個人、家族、コミュニティ、自然・人工環境からのデータが統合される。外的要因、内的要因の両方が、健康に関連する生物学的ネットワークに絶えず挑戦している。このような影響は、ネットワークの調節を狂わせ、病態を進展させ、その結果、早期の臨床症状を引き起こし、その緩和を図るために適切な評価とタイムリーな介入を必要とする。ここでは、関連する生物学的システムの構成要素と、リスクのある状態から顕在化した疾患への進行の性質について説明する。また、2つの臨床例を用いて、このシステムアプローチを説明する。アルツハイマー病と心血管疾患である。また、経済学、倫理学、政策、法学などの観点から、システム医療マネジメントの意義について考察する。最後に、システム医学の時代における医療従事者の訓練を強化するために、新しい教育パラダイムを開発する必要性を提案する。
背景
人間は複雑な生物システムであり、最適な生存利益を得るためには、多様な機能要素間の協調的かつ時間依存的な相互作用が必要である[1]。また、生物系は、生物の恒常性アクチュエータを修正する様々な外部性の影響を直接受けている[2]。同様に、協調的なヘルスケアへの取り組みも、システム科学と密接に関連している。なぜなら、個人と集団の両方のレベルでうまく機能するためには、独自の指標の監視と大きな変動への効率的な対応が必要となるからである。実際,集団健康管理は,個人,地域社会,環境にどのように影響を及ぼすのが最善であるかを独自に理解することが前提となっている.したがって、システムアプローチは、様々な構成要素が時間とともにどのように相互作用するかを深く理解することを包含している。
これに対して、従来の医療は、還元主義的な傾向のある診断・治療法に頼ってきた [3]。患者の訴えは、しばしば、根本的な病因および/または発症メカニズムを解明することを目的として、問題に焦点を当てた方法で分析される。歴史的に、専門医の訓練と実践は、問題を特定の臓器や生化学的欠陥に還元しようとするものである。このようなアプローチは、臓器系、細胞出力、内在性(神経/内分泌/免疫など)および外来性(環境化学物質、栄養、感染など)の調節因子間の重要な相互作用をしばしば無視するため、最適な結果を得ることができない。しかし、アルツハイマー病(AD)[4]や心血管疾患(CVD)[5]の病態には、内在性および外来性の調節因子が複雑に絡み合っていることが明らかであり、通常数十年にわたって展開する個々の動的軌道が、リスク状態から前駆期、顕性疾患への移行を支えている[6, 7]。したがって、研究努力、医薬品開発戦略、ヘルスケアアプローチを、システムを構成する構成要素の相互作用ネットワークではなく、システムの単一要素に集中させることは、疾患の前駆段階で明らかになるものを含め、重要な病因の原理や疾患メカニズムが不明瞭になる可能性がある。システム科学[8]のヘルスケアへの応用は、健康や疾病が、個人の内在するマルチオミクス要素(遺伝、エピジェネティックなど)、その結果としての表現型、および内在環境に影響を及ぼす外来(環境)要因の動的相互作用によってもたらされると想定している。
ここでは、研究者、医療教育者、臨床医、医療リーダーに対して、個人を(環境に影響された複雑な生物学的システムとして)よりシステム的に捉えることを促す、全体論的アプローチについて述べる。このような個人情報を集約することで、集団の多様性(および集団医療)をよりよく説明できるようになり、それによって、より正確な診断と効果的な治療結果をすべての人にもたらすことができるようになるかもしれないのである。(図1参照)。
図1 システム医療
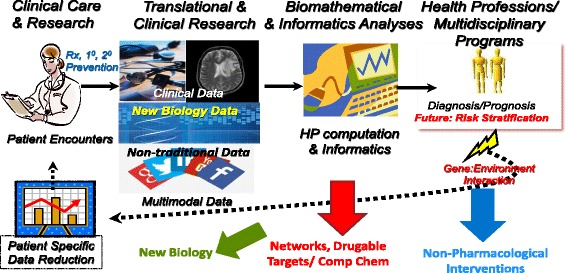
新しいパラダイム。左上から時計回りに、従来の臨床データや画像データ、新しい生物学(オミック)データ、ソーシャルメディアなどの非伝統的データを生成する臨床研究を組み込んだ臨床ケアモデルである。ハイパフォーマンスコンピューティングとインフォマティクス解析を活用したデータマイニングと削減は、リスク層別化、より正確な診断と予後をもたらし、後者は遺伝子と環境の相互作用を反映し、患者との次の出会いにより良い情報を与えることができる患者固有のデータ削減に到達する。各色の矢印には、青色(非薬理学的介入)、緑色(新たな薬物標的を発見するための新しいネットワーク)、緑色(新しい生物学的洞察)のように、派生的な利点がある。
ホリスティックヘルスとシステムヘルス
ウェルネス、健康増進、疾病予防を目的とした統合的な健康アプローチが潜在的に有効であることを示すエビデンスが増えてきている。統合医療のアプローチは、全体として、ライフスタイルの変化、行動の修正、ストレスの軽減を重視しており、システム医学のアプローチでリスクのある個人を特定する際に重要な介入となる。全国的な調査データによると、特定の病気の治療よりも、健康やウェルネスを増進するために補完的アプローチを利用する人の方が多いことが示されている [9] 。2012年のNational Health Interview Survey(NHIS)では、ヨガを実践している回答者の94%、天然物サプリメントを使用している回答者の89%が、ウェルネスに関する理由からそうしていると答えており、特定の疾患の治療としてこれらのアプローチを使用している人ははるかに少なかった [9] 。
病気の予防や健康増進における統合医療の有効性は広く検証されていないが、健康への全体的なアプローチにケースを作ることは可能である。顕在疾患を遅らせたり予防したりするための主要な手段の中には、個人の食事、身体活動、睡眠、ストレス管理を最適化するライフスタイルの変化がある。睡眠と栄養は、主に統合的な実践者によって強調され、従来のプライマリーケアプロバイダーではあまり強調されない中心的な内容である [10] 。消化器系の健康は、機能性医学 [11] 、アーユルヴェーダ [12] 、自然療法 [13] 、中国伝統医学 [14] の中心的な要素であることに変わりはない。最後に、心身を重視した統合医療の全体的な性質から、心理療法や身体療法を取り入れた治療計画がしばしば行われる [15, 16] 。
ホリスティックとは、「全体は部分の集合体以上である」という考え方を前提としている。したがって、そのようなシステムを理解するためには、個々の構成要素を理解するだけでなく、構成要素間の時間依存的、相互依存的な関係も評価しなければならない [17, 18]。図2には,健康の連続性と疾病への移行を定義するエポックが示されており,この議論に有用な枠組みを提供している。形式的には、システムは、各構成要素(ノード)および各ノードの相互作用(エッジまたはエレメントとして定義)の記述によって特徴付けることができ、これらが協働してネットワークの創発的特性を生み出す [19、20]。したがって、システムの特性は、ノード間に存在する複雑な相互作用を考慮することなく、個々のノードの機能の単純な線形和集合では予測することができない。このようなシステムの創発特性(具体的な出力行動や、このような協調ネットワークの性能に影響を与える支配原理に関する洞察の追求など)については、科学的に大きな関心が持たれている。医療に応用する場合、システムアプローチはしばしばシステム医学と呼ばれるが、我々はこの概念を拡張し、分子、細胞、臓器、人、家族、コミュニティ、社会、環境など多次元マトリックスの複数のレベルでネットワークを形成し、相互作用するノードの構造とダイナミックスの両方を研究対象とするものである。ヒトのシステムヘルス、ウェルネス、予防のためには、これらの頻繁で多様かつ時間制限のある相互作用が複雑な生物内の変化を媒介すると仮定している。我々の課題は、様々な状態(健康、リスク、疾患)の根底にある最も顕著なノードを推論することだ。これらのノードと相互作用するエッジが特定されたら、そのネットワークを有益に調節し、可能な限り健康を維持し、二次疾患の予防を行い、最もリスクの高い人々の病態を緩和することが目標であるべきである。
図2 ウェルネスから疾患への移行をシステムとしてとらえたもの
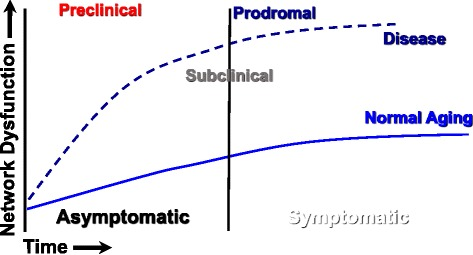
システムズビューでは、生物学的ネットワークは健康を維持するが、ノードやエレメントの機能異常によって障害が生じると、前臨床状態から始まり、不顕性疾患、前駆症状、そして顕性疾患へと移行する病理生物学的プロセスを推進することを認識している。無症状期と有症状期の区別は、個人の身体的変化に対する認識のみを限定するものであるが、ネットワークの機能不全は、臨床的な徴候や症状よりもかなり先行していることが重要である。
システムヘルスの実際 分子ネットワークの機能不全
リー・フッドのP4医学モデル[21]を拡張した我々のP5(精密、予測、予防、参加、個別化)パラダイムは、個人の表現型を形成する複雑な分子ネットワークの制御と調節不全を包括的に理解することにある。この枠組みでは、疾患は、臓器や器官の機能障害(例えば、患者の臨床症状)につながる細胞および分子ネットワークの異常再構成の結果である。人体内の疾患器官との相互作用により、制御不能なネットワークのカスケードが生じ、その結果、関連する併存疾患が生じ、その一部は明らかであるが、その他は無症状(前臨床)である。健康な状態では、ネットワークは複雑な恒常性維持機構によって精密に制御されている。ネットワーク(またはサブネットワーク)の1つまたは一連の擾乱を通じて、ウェルネスは結節の活動を変化させる方向に駆動される。このような節々の変調は、リスクのある状態を構成し、前臨床ではあるが、一般に、識別および定量化可能な全身的サインを提供し、前臨床段階での調節不全の検出を可能にする。システムレベルの健康、疾病予防、および健康は、したがって、特定の結節の摂動を特徴付けることを目的としている。環境的に媒介されるものもあれば、前述の摂動によってのみ明らかになる内在する多次元ネットワークの複雑さに根差すものもある。疾患については、前臨床での早期発見が重要であり、疾患の進行を遅らせるために必要な特定の治療介入、理想的にはネットワークの異常とその結果生じる病理生物学を完全に停止させることを決定する可能性がある。このようなアプローチには、多次元のデータセットを集約し、高性能の計算と分析を使って解読することが必要である。その目的は、異常なネットワークを標的とした介入を決定し、システムレベルの改善を促進することだ。長期にわたって収集されたマルチオミックデータを活用したウェルネスへのこのような包括的なアプローチは、すでに試みられており [22] 、段階的な改善を必要とする概念実証を提供している。現在収集されている医療情報にこのような改良を加えるにはコストがかかり、連邦政府だけでなく、民間企業や慈善団体からも初期支援が必要である。もし、特定の阻止に反応し、それによって病気そのもののコストを制限するような病気の重要なパラメータの定義に大きな進展があれば、医療サービスの支払者に対し、このような生涯をかけた取り組みへの財政支援を求める説得力のある議論を行うことができるだろう。このような新しい個人データ要素のいくつかをどれくらいの頻度で監視すべきか、またいつ監視を開始すべきかについては、まだ決定されていない。しかし明らかなことは、健常者と疾病の軌跡を示す者の両方において、個人と集団ベースで健康と疾病の両方をモデル化し始めるために、長期間にわたる連続した評価が必要であることだ。以下のセクションでは、ADとCVDという、世界の人々の健康に重大な影響を及ぼす可能性のある2つの疾患に対するシステムアプローチを検討する。これらの疾患に対するシステムアプローチから得られる理解は、人間の健康への影響を予防または軽減する能力に影響を及ぼすと考える。このようなシステムアプローチは、人々の健康状態の改善、より良い患者体験、一人当たりの医療費の減少など、「トリプル・アイム」[23]の理念を実現するために有効であると考えられる。
アルツハイマー病へのシステムアプローチ
システム医療は、健康状態や疾病状態における生体機能を決定するネットワーク構成要素間の固有の多数かつしばしば峻厳な相互作用を包含している。個々の疾病に特異的な危険因子は数多く知られており、様々な健康状態の悪化への移行を監視するために利用されている。前立腺特異抗原(PSA)や乳がん2型(BRCA2)遺伝子変異のような個々のバイオマーカーが見つかれば、前臨床段階での健康状態をより詳細に調べることができる。また、最近では、ゲノム、エピゲノム、トランスクリプトミクス、プロテオミクス、メタボロミクスなどの「オーミック」技術やその解析手法の進歩により、個々の要素や健康・疾病との関連性を拡大する機会が提供されている。生物学、数学、コンピュータサイエンス、その他のアプローチを組み合わせた生物試料の調査により、システム(臓器、生体分子など)間の複雑な相互作用の広さと深さがより容易に理解されるようになる。このように、生物学的システムに関連する複雑さを理解するために、より詳細な情報を提供する。
アルツハイマー病ネットワークの研究
ADは、米国をはじめ、世界中で最も一般的な認知症である[24]。ADはまた、最も一般的な神経変性疾患であり、現在、治療法、疾患修飾療法、効果的な治療法はない。年齢が最大の危険因子であり、有病率は65歳以降5年ごとに倍増し、最終的には85歳で50%近くに達する[25, 26]。65歳以上の高齢者は、2050年には8,500万人を超えると予測されている[27]。このグループの医療費だけでも、同年には1兆2,000億ドルを超えると予想されている。ADの発症を遅らせる選択肢がなければ、経済的コスト、医療負担、患者本人やその家族、社会への影響は壊滅的なものになるだろう。
ADの有効な治療法の欠如が世界の人々の健康と活力にもたらす悲惨な結果を理解するならば、これまで有益な成果が得られなかったことの根拠を理解することにも努めなければならない。我々は、ADの治療法開発が大きく後退したのは、非常に複雑な疾患に対して還元主義的なアプローチをとったことが一因であると主張する。次の段落で述べるように、複雑さを特徴とする疾患は、システムバイオロジーのアプローチにより適している。我々は、還元論的な視点がいかにAD治療薬に関して十分な情報を提供できなかったかについて、参考になる過去のアプローチを2つ紹介する。
第一に、最近まで、AD治療試験のための患者選択は、軽度認知障害(MCI)[28]またはAD[25]として、疾患の明らかな臨床症状の存在が前提となっていた。しかし、ADの症状が出るまで介入を待つことは、治療効果にとって最適でない可能性がある。ADの臨床症状の存在に伴い、神経基盤が十分に損傷し、治療薬に対して有効な反応を示さない可能性があるからである。最近の臨床試験に関する勧告 [29] では、ADの前臨床期(すなわち、無症状期)に薬物療法を導入し、障害の少ない、より受容性の高い神経基盤を利用することが推奨されている。後者のアプローチでは、ADのリスクを正確に分類するバイオマーカーを、臨床症状よりかなり前に開発し、利用可能にする必要がある。さらに、前臨床および臨床の豊富な情報から病因の違いが明らかになっているにもかかわらず、早期発症AD(EOAD)と後期発症AD(LOAD)という2つの主要なADに向けた治療法の開発および試験において、明確な区別がなされていない。両疾患は、脳の神経病理学において類似した最終段階の要素(例えば、プラークともつれ)を特徴とする一方で [30, 31] 、その主要な病因と臨床的な経過において大きく異なっている [32, 33] 。具体的には、EOADのほとんどの症例は比較的稀であり(〜5%)、65歳以前に症状を呈し、典型的には3つの遺伝子(PSEN1またはプレセニリン-1遺伝子、APPまたはアミロイド前駆体タンパク質遺伝子、またはPSEN2またはプレセニリン-2遺伝子)のいずれかに変異があり、家族性素因を有し、通常は常染色体優性形式で表現される。一方、LOADは、より一般的な(約95%)散発型で、通常65歳以降に発症し、単独の遺伝的基盤や家族性傾向はなく、環境(エピジェネティック)要因の影響を受けた遺伝的素因を示唆する病理生物学的プロファイルが特徴である。ある種のトランスジェニック動物モデルは、EOADの遺伝的形態の適切なサロゲートとなるが [34, 35] 、LOADに関連するモデルは存在しない。
還元論的アプローチでは、アミロイドβとタウ蛋白の蓄積はEOADとLOADの両方の脳で終末期の特徴であるので、これらの分子の蓄積を調節することがADの有効な治療法につながるかもしれないと結論づけられるだろう。このような薬剤が処方され、トランスジェニック動物モデルで試験された結果、遺伝的形態のEOADで特徴的であったのと同様に、アミロイド形成プロセスを減弱させることが確認された[36]。しかし、臨床試験で治療された患者の大多数は、LOADの症候性ステージ(MCIまたはAD)に苦しんでいた。このような還元的思考の結果、後期の臨床試験において、治療介入は、印象に残らないか、完全に欠落した有効性指標を提供した [37] 。
ADに対する全体論的なアプローチは、アミロイドとタウの蓄積を特徴とする最終段階の神経病理学の上流に横たわるEOADとLOADの病理生物学の特定の違いに基づく前臨床治療の選択肢の開発をもたらすと思われる。ADのシステム生物学的アプローチには、複雑な病態をよりよく理解するために、多様な情報を積極的に統合することが必要である。オミックス技術を用いることで得られる膨大な情報は、少なくとも部分的には、直交するデータの統合によるものであり、複雑でしばしば観察不可能な相互作用を含むネットワーク機能に対する理解を深めるものである。生成された「オーミック」情報による複雑なネットワークの表現は、グラフ理論などの数学/計算機科学に基づくものである[38]。生物学的システムに特化すると、取得された異種情報の断片は、最終的に複雑な健康状態(例えば、EOADやLOAD)の明確な理解を提供するために定式化される。したがって、還元主義と全体主義の区別は微妙であり、後者は創薬ターゲットの定義、遺伝子や代謝物の疾患特異的役割や機能、あるいは無症状疾患状態の診断に威力を発揮する。
以下の「オーミック」手法は、システム(ネットワーク)生物学の原則がAD研究にどのように適用されてきたか、また現在も適用され続けているかの例を示すものである。個々の “オーミック “手法は、システム内の変化したネットワークに関する実質的な見解を提供するが、”マルチオミック “データをより容易に統合することが主流となった時点で、これらの技術の究極の威力が認識されることになるのである。
アルツハイマー病に対する現在のアプローチ-ゲノミクス
ハイスループットDNAシーケンサーを用いて患者由来のDNAをスクリーニングし、疾患関連アレルの有無を調べ、遺伝的リスク評価を導き出すことは、実験室の枠を超えて発展している。現在、一般の人々がこの技術を利用できるようになってきており、様々な営利企業が特定の疾患のリスクに関する実用的な情報を提供している。ゲノムワイド関連研究(GWAS)は、多数の被験者サンプル(症例と対照)を用いて、疾患と特異的に関連する可能性のある一塩基多型(SNPs)を同定するものである。例えば、23andMe(http://23andme.com)は、低価格で消費者に直接提供するゲノム検査と解釈を提供している。2017年現在、23andMeは、家系だけでなく、最大10の疾患および健康状態に関する限られた数の健康リスク分析に関して個人に情報を提供する唾液検体の分析オプションを提供している。例えば、APP遺伝子座の重複は、常染色体優性遺伝のEOADの原因として確認されている[39]。疾患病因におけるAPP遺伝子座の特異性は、ADを発症していないスカンジナビアの小さな集団で指摘されたように、アミロイドベータの産生を減少させるその遺伝子内の保護変異(A673T)の発見によってさらに裏付けられ、さらに詳しく説明されている[40]。年齢とともに、LOADの最もよく知られた危険因子は、アポリポ蛋白E(APOE)E4対立遺伝子の継承であり、1つの遺伝子コピーは、通常の生涯においてLOADを発症する確率を2〜4倍増加させ、2つの対立コピーは、8倍以上の可能性をもたらす [41]。大規模な単原性血統の評価により、3つの浸透性の高い常染色体優性遺伝子がEOAD症例の大部分に関与していることが確認されたが [42]、GWASにより、LOADの20以上の感受性遺伝子に関する証拠が得られており [43-46]、そのほとんどが、神経病理に遡って有意な統計的関連性を示す [47](GWAS:Golden Words, 2004)。個々の遺伝子座の多型性 [49] 、遺伝子-環境相互作用 [50] 、エピスタティック遺伝子-遺伝子相互作用 [51] はこの “missing heritability” の多くを説明しうるが、遺伝的寄与の一部はまだ説明されていない [48]。実際、最近のAlzheimer’s Disease Genetics Consortium(ADGC)データセットの評価では、LOAD遺伝子座の間で多数のSNP-SNPおよび遺伝子-遺伝子相互作用が確認され[52]、LOAD被験者のシステム解析[53]では、特定の遺伝子ノード、周辺相互作用、ネットワーク摂動が定義されており、関連する複雑な病理生物学のメカニズムを解明することが可能になってきている。ネットワーク生物学と機能的遺伝子モジュール[53-55]のこのような深い理解は、LOAD(そしてCVDも)[56]に関連した治療のブレークスルーのためのより良い機会を提供するだろう。
Alzheimer’s Disease Neuroimaging Initiative (ADNI) や他の共同研究によって提供される能力によって、神経画像と結合したAD遺伝学はこの分野に大きな勢いを与えており、ADNIだけで、2010年から年間100以上のPubMed引用に企業共著者として挙げられている。関連する例としては、AD発症の数年前にfMRIや他の画像所見とAPOE4がリンクしていること [57] 、海馬体積の減少に関連する新しいGWASで確認された遺伝子座のリンク [58] がある。ADNIコホートは、ADとMCIの多くの新しい画像バイオマーカー候補を定義するためのマルチモーダル解析にも使用されており、神経病理学的に定義されたADに関連するものよりも多くのSNPが関連している[59]。最近の例では、ADGCコホートにおけるGWAS SNP(IGAP)データ、APOEステータス、および人口ベースのAD発生率を用いて、年齢特異的ADリスクの連続多因子ハザードスコアを導き出し、死後(NACC、神経病理)および死前(ADNI、CSFバイオマーカー)コホートで独立に検証している[60]。この多因子ハザードスコアは、神経病理学的(BraakステージとCERADスコア)、認知的(CDR-SB)、CSF(AB42と総タウ)、画像バイオマーカー(内果皮と海馬の体積)とよく相関していた[60]。残念ながら、これらのゲノム解析手法は還元主義的であり、臨床試験や日常の患者ケアにおいてADリスクをより総合的に評価するためには、ゲノムデータの追加入力とともに、マルチオミクス入力変数が必要である。
アルツハイマー病に対する現在のアプローチ – メタボロミクス
メタボロミクスは、同化または異化のプロセスに由来する小分子の量の変化を調べるもので、生体流体(血液、尿、唾液、脳脊髄液)、細胞、組織、臓器内で検出可能なものである。現在、メタボローム解析に最もよく用いられている技術は、(a)電気泳動またはクロマトグラフィー(気体または液体)分離法を特徴とする質量分析法、(b)NMR(核磁気共鳴)分光法である。メタボローム解析技術は過去10年間で著しく進歩し、複雑な生物学的システムの評価がますます高まっている。メタボローム解析は、疾病の下流の結果を詳述し、臨床表現型に近接したネットワーク情報を提供する。このような情報は、一般的に表現型の上流と考えられる情報を提供するゲノムや他の「オーミック」解析とは対照的である。メタボロミクスによる定量・定性分析が可能な物質は何万種類もあるが、パスウェイへの統合や同定(またはアノテーション)には至っていない物質も多くある[61]。脳組織の直接分析は、ADに関連するメタボローム調節異常の最も早い証拠を提供し[62]、特定のスフィンゴ脂質種の顕著な減少を示した。その後、我々のグループ[63-65]や他の研究者[66-70]は、LOADの病理生物学に関連し、健康から病気への表現変換を予告する可能性のある、脳内および末梢の脂質や他の代謝物の調節異常を確認している。このような進歩にもかかわらず、メタボロミクスを用いた分析だけでは、包括的なリスク評価に必要な全体的な評価には至らない。代謝ネットワークの異常はAD(および他の疾患状態)と関連しているが、代謝経路、他の「オミックス」、外部環境の影響とのユニークな相互作用を理解するには、マルチモーダルシステムアプローチが必要である。このような方法論は、最終的には、健康やADへの移行をより包括的に捉えるコンビナトリアルネットワークアプローチによる臨床表現型の定義の向上に寄与することになる。
アルツハイマー病へのホリスティックアプローチ
システム生物学的手法により健康や病気の基礎を理解することで、ADリスクを軽減するための個人のライフスタイルの選択肢が明らかになるかもしれない。その代表的な例が、エピジェネティック修飾 [71, 72] 、特にDNAメチル化 [73, 74] を介した代謝とゲノムの関連性である。代謝がエピジェネティックな調節に及ぼす影響については、依然として多くの人にとって複雑な研究分野であるが、地中海食 [75] と運動 [76, 77] による健康へのプラスの効果については、採用は限定されているものの、よく認識されている。
治療薬がないため、特に生涯の健康戦略として採用された場合、最終的に行動修正が個々の疾患予防に最適な選択肢を提供する可能性がある。言い換えれば、ADに関連する個人の健康をコントロールするための重要な要素は、人間の食事と運動に関連している [78, 79]。具体的には、人生の半ばから後半にかけての適度な運動は、認知症リスクの低下と関連している [80]。一方、高脂肪食は概日時計を乱し[81, 82]、腸内細菌叢を変化させ[83]、それによってADと関連して代謝に悪影響を及ぼすことが知られている[84]。対照的に、特定の食事脂肪酸やその他の栄養補助食品を増やすことは、動物モデルにおいてADの進行を遅らせるのに有益であることが証明され [85]、LOADの初期の臨床段階でヒトに投与すると [79, 86]、その効果が期待される。後者の栄養補助食品は、シナプスの蘇生に必要な基質を提供すると考えられ、記憶能力の向上が記録されている [87]。ヒト血漿中の同様の基質の利用可能性の低下は、ADの前臨床期および臨床期と関連している [63, 69, 70]。
最終的には、まだ開発されていない有効な治療薬と前述の生活習慣の改善との直接的な比較が試されることになる。健康や疾病に関連する様々な内在的・外在的要因を考慮したシステム生物学の視点は、ADを軽減または予防するために必要な将来の治療標的の特定を可能にすると思われる。現在のシステム生物学では、遺伝子、タンパク質、小分子から構成され、作用機序、生理的過程、疾患、特定の薬物標的を共有するネットワークノード間の理論的・機能的関係を見出すために、結合性マッピングに焦点が当てられている[88]。トランスクリプトーム、プロテオーム、または代謝経路内の新規ネットワーク相互作用の発見といった研究目的から出発して、研究者は遺伝子、タンパク質、および代謝物の複雑なネットワークを構築し、そのような「マルチオミック」ネットワーク内の新規相互作用を調査することができる。このような関係情報は、経験的に検証された相互作用と計算機的予測から得られた相互作用の両方を含む進化するデータベースに追加される。このようなアプローチにより、経験的に有効なネットワークと理論的なネットワークが記述され、疾病に関連する新しい標的が発見され、検証されることになる。Broad InstituteとHarvardが開発したConnectivityマップ[89]は、疾患と関連する遺伝子パターンを薬剤候補が作り出す対応するパターンにリンクさせ、研究者が事前に選択した標的遺伝子セットではなく、ゲノム全体の疾患サインに対して化合物をスクリーニングする機会を提供する[90-93]。疾患と個別化リスク評価に対するマルチオミクスアプローチ(図3)は、最近の出版物の数々で定義されるように関心が高まっているにもかかわらず、開発の初期段階にとどまっている。具体的な考察は、詳細な事例と分析(追加ファイル1参照)として提供されており、最終的にLOADリスクプロファイルを開発するために使用されるかもしれない個人の内在的および健康情報および外来的影響を考慮している。同様の戦略は、最終的には他の疾患にも適用可能であるが、最終的には、個人が健康状態を維持し、疾患に関連する要因を最小化できるような健康指導のアプローチを提供することができる。
図3 症例に関連するシステム生物学的枠組み
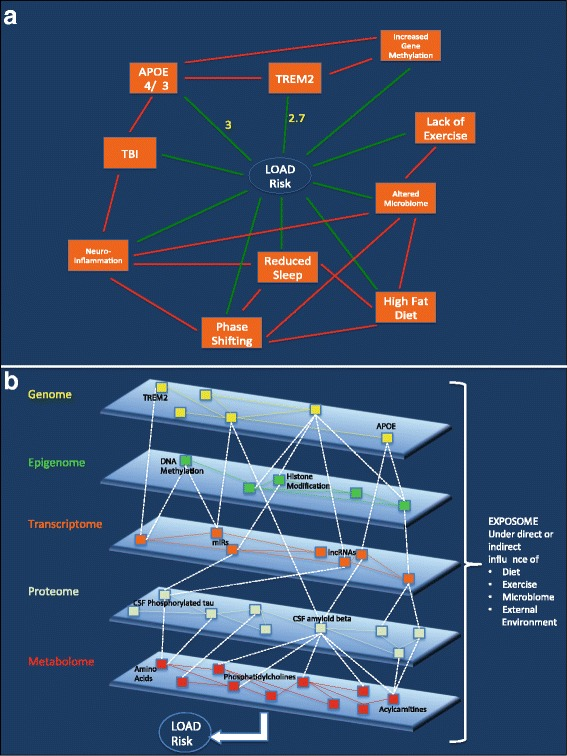
パネルaおよびbは、それぞれ、症例に関連する内部および外部ネットワークアーキテクチャの2次元(2D)および3次元(3D)描写を示す。(a) 我々の被験者に関連する臨床的特徴は、ノード(オレンジ色の長方形)およびノードをLOADリスク(緑)に直接接続し、他のノード(赤)と相互作用するエッジ(線)として2Dで表現されている。黄色の数字は、特定のノードとLOADリスクとの間の既知のリスク関係を表す。エッジの大部分には数値表現がなく、すべてのノードがエッジを介して相互作用することが示されているわけではないことに注意。エッジはノード間の単方向または双方向の関係を表し、正または負の影響を与えることができる。(b) この例のケースは3Dで表示され、この例の被験者の個人的なマルチオミックスプロファイルとLOADリスクについて、より全体的な関係が提案されていることが示されている。このケースに特有な特徴(太字の黒文字 – APOE、TREM2、DNAメチル化)と、このケースに特有ではない特徴(黒文字)を含む、個人の内在するマルチオミックマトリックスの各層におけるノード(小さな色の長方形)間の複雑な相互作用に注目してほしい。各オミックス層内には、複雑でまだ解明されていない関係(ノード間の実線のエッジ)があり、また、別のオミックス層のノード間の関係(白の点線のエッジ)も表現されている。これらのノードとエッジは、1) 個人に固有のものであり、2) 外的(環境)要因(すなわちエクスポソーム)が内部のマルチオミックマトリックスの様々な層に作用し、LOADリスクを低減または増大させるという相互作用の複合システムを多次元的に表現したものである。LOAD=遅発性アルツハイマー病。APOE=アポリポ蛋白質E遺伝子。TREM2 = trigger receptor expressed on myeloid cells 2 遺伝子。CSF = 脳脊髄液 miR = マイクロリボ核酸 lncRNA = ロングノンコードリボ核酸
循環器疾患へのシステムアプローチ
システムヘルスケアのアプローチの価値は、CVDの文脈でさらに評価することができる。診断と治療の進歩にもかかわらず、CVD、特に冠動脈疾患(CAD)は、依然として世界の男女における死亡と疾病の主要原因である。CADは、約30〜50年の前駆期を経てゆっくりと始まり、その後約10年の無症状期が急速に拡大し、症状を伴う臨床期へと急速に進行する、長期間に渡って発症する幅広い転帰を持つ異質な疾患体である[94, 95]。ライフスタイル、ストレス、汚染、および疾患の社会的決定要因などのマクロ環境因子は、ゲノム変異と相互作用して、個人を疾患の初期段階に素因づける。炎症のような微小環境因子は、次に疾患の進行を制御する細胞シグナルの発現につながる [96] 。
過去10年間、CADの発症は減少してきたが、最近のデータはこの傾向が頭打ちになったことを示唆しており、実際、直近ではCADによる死亡が増加傾向にあることが観察されている [97]。先のセクションで述べた還元主義的アプローチは、CADの臨床的治療におけるブレークスルーをもたらした。しかし、従来の危険因子に対して最適な治療を受けた人であっても、CADイベントの発生や疾患進行の残存リスクは存続する[98、99]。他の慢性疾患と同様に,残存リスクを低減しCADの転帰を改善するためには,遺伝的,分子的,環境的要因の相互に関連した枠組みを用いて,同定された危険因子間の関係や新規経路の効果を検討する全体的システム医学アプローチが必要である[100, 101].システム医学の全体論的アプローチは、与えられた個人における複雑な臨床CAD表現型をより正確に記述する可能性を持っており、不顕性疾患の早期発見だけでなく、より効果的で指向性のある治療、それによって残留リスクを排除し、予後を改善することにつながる。
心血管疾患に対する現在のアプローチ – ゲノミクスとエピジェネティクス
CVDには、単原性と多原性の両方が含まれ、非常に大きな異質性を持っている。GWASによって同定されたCAD遺伝子座は、主に動脈硬化性臨床疾患の表現型の後期よりも初期段階に関連している。CARDIoGRAMplusC4Dコンソーシアムを通じたGWASのメタアナリシスにより、現在、CADの152の感受性遺伝子座が同定されており[102-104]、動脈硬化性臨床疾患表現型の後期というよりも血管壁または動脈硬化の初期経過で作用しているように見える遺伝子を含む多くの新規生物学的経路に光を当てている [105, 106]。
個々のSNPの効果サイズが小さいため、疾患の可能性を予測するための個々のSNPの臨床的有用性は非常に控えめである[107]。その結果、Genetic Risk Score (GRS)の概念が利用されるようになり、長期的なCVDイベントの予測値を評価するために、加重または非加重SNPを使用して単一の集計スコアを生成している[108]。GRSは、従来の危険因子を超えて、CVDイベントの発生に対する予測値および臨床的有用性を増加させ、複数の独立または相互作用するバリアントに起因する遺伝的要素を示している[109-116]。心筋梗塞遺伝子(MI-GENES)臨床試験において、CAD GRSが従来のリスク予測アルゴリズムに組み込まれた。研究参加者にCADの遺伝的リスクを知らせることは、臨床的危険因子の開示のみよりもLDLコレステロール値の低下と関連していた [117]。一般的な多因子性CADの根底にある遺伝的素因を知ることで、医師と患者の双方が、疾患発症前に修正可能な危険因子にもっと積極的に対処するようになるかもしれない。
遺伝的分散だけを用いたGWASアプローチでは、CAD表現型の病的変化と臨床的進行を認識し説明することはできない [118] 。動脈硬化のプロセスは、様々な遺伝子発現に適応しプログラムされたエピジェネティックな調整を伴う複雑な現象である。エピジェネティクスまたは遺伝子発現の調節に関連するメカニズムには、メチル化およびヒストン修飾が含まれ、その多くはライフスタイル要因によって誘発される。疫学的および臨床試験により、コレステロール、高血圧、糖尿病、喫煙、不健康な生活習慣などの様々な危険因子が、動脈硬化性プラークの病因および動脈硬化性疾患への緩やかな進行と関連していることが立証されている。55,685人の参加者を対象に遺伝要因と生活習慣要因を調べた最近の研究では、50SNP GRSで評価した遺伝的リスクの高い人では、健康的な生活習慣によってCADのリスクが50%近く低下し、生活習慣によって引き起こされるエピジェネティックな変化が、有害な遺伝リスクに直面して回復力をもたらすことが示された[119]。
心血管疾患に対する現在のアプローチ – メタボロミクス
メタボロミクス研究により、CAD(およびその他のヒト疾患)のメカニズムや病態に寄与する可能性のある、食事や腸内細菌の変動やそれらの間の潜在的な関連性など、これまで知られていなかった要因が明らかにされ始めている。一例として、高脂肪食は概日時計の同調を変化させ [81, 82] 、腸内細菌叢にも影響を与えるようである [83] 。その結果、腸内細菌は肝臓の振動転写プログラムに直接影響を与え [84] 、メタボローム解析によって明らかにされた。血中代謝物のプロファイリングは、潜在性動脈硬化症の予測やモニタリング、早期CADのリスクのある患者の同定に重要な役割を果たす可能性がある。トリメチルアミン-N-オキシド(TMAO)やリゾホスファチジルコリンなど、多くの循環代謝産物は、心血管事故のリスク増加のバイオシグネチャーとなりうると考えられている [120, 121]。具体的には、TMAOは、腸内細菌と食事中のホスファチジルコリンおよびカルニチンとの相互作用によって生成され、肉をベースとした料理においてより高濃度で存在する[122-124]。さらに、あるマルチコホート疫学研究では、68種類の血漿代謝物を調べ、フェニルアラニンや一価不飽和脂肪酸の値が高いとCVDリスクが高く、逆にオメガ6脂肪酸やドコサヘキサエン酸(DHA)の値が高いとCVDリスクが低くなると指摘されている[125]。
心血管疾患に対する全体論的アプローチ – 画像処理、情報統合、そしてその先へ
システム医学的アプローチを完全に実行するには、不顕性疾患の正確な評価と表現型が重要である(図2参照)2)。心臓コンピュータ断層撮影(CT)では、冠動脈カルシウムスコアリングやCTアンギオグラフィーにより、プラーク負荷と相関のある動脈の石灰化を評価し、不顕性疾患の正確な指標とすることが可能である。光コヒーレンス・トモグラフィ(OCT)は、動脈プラークの脂質とマクロファージの含有量を測定し、プラークの組成と安定性に関する洞察を与えるために使用されている。分子経路の変化を感知する化学的・生物学的プローブや動物モデルでのイメージング剤の開発により、CVDにおけるこのような調節異常のモニタリングが可能になっている。磁気共鳴画像、蛍光画像、生物発光画像、陽電子放出/単一光子放出コンピュータ断層撮影(PET/SPECT)および超音波は、酵素、受容体、内皮細胞、ならびにアポトーシス、血管新生および血栓症の生物学的プロセスを画像化するように設計された分子プローブを利用する技術である [126].代謝的に活性な細胞に蓄積される18F-フルオロデオキシグルコース(FDG)を用いた陽電子放射断層撮影(PET)は、心筋と血管系に関与する炎症ネットワークをマークすることが可能である。システム医学のアプローチでは、オミックス技術の補助として高度なイメージング技術を使用することにより、前駆症状を有する患者から最も脆弱な患者まで、CAD表現型の定義を改善するだけでなく、治療に対する反応や疾患の進行をモニタリングすることが可能になる。
以上のようなオミックス技術と画像技術の積み重ねが、個人のバイオシグネチャーを正しく把握するために必要なデータの一部を形成しているのである。これらの技術に加えて、Topol氏は、バイオセンサー、ソーシャルメディア、エクスポソームや環境暴露データなどのデータの層を含む、個人の健康の「パノラマ」ビューを捕らえるための他の技術の層化について説明している(図4)[127]。このレベルの統合は、中央リポジトリからの情報の保存や検索だけでなく、自動分析も必要となる。
図4 エクスポソームをゲノムの読み出しに接続する

人間の主要な疾患のほとんどが遺伝的に複雑であることを考えると、複数の内臓器官や中枢神経系、または消化管における転写を変化させるエピゲノム修飾を生み出すことができる外因性(環境)曝露(エクスポソーム)と摂取栄養素(マイクロバイオームを通じて作用)のそれぞれの特徴を明らかにする必要がある(マイクロバイオーム、自然免疫シグナル、腸神経系への求心性の活性化)。”図はCell, Volume 157, Issue 1, / Eric J. Topol, Individualized Medicine from Womb to Tomb, Pages 241-253, 2014, with permission from Elsevier” [127] から転載している。
国立心肺血液研究所が開発した「精密医療のためのトランスオミックス(TOPMed)」研究イニシアティブでは、「全ゲノムシーケンス(WGS)およびその他のオミックスデータを、心臓、肺、血液、睡眠障害に焦点を当てた研究から得られた分子、行動、画像、環境、臨床データと結合する」[128]予定である。既存のコホート研究(例えば、フラミンガム心臓研究、ジャクソン心臓研究)から得られる表現型、ゲノム、行動、社会経済学的データが、新しい方法で組み合わされることになる。これらの統合されたデータプラットフォームを使用することにより、CVDの転帰に影響を与える併存疾患、ライフスタイル、社会経済的背景の間の全身的な相互作用について、より深く理解することができるようになるかもしれない。システム医学の枠組みは、臨床研究でも活用され始めている。米国心臓協会が最近資金を提供したFAMILIA研究は、ニューヨーク州ハーレムの低所得で十分なサービスを受けていないリスクの高い家族を対象とし、両親/介護者と未就学児の行動リスク因子に対する家族ベースのライフスタイル介入の影響を理解することを目的としている [129] 。この研究では、ゲノムおよび分子データの使用に加え、家族単位での行動とライフスタイルを評価する。この研究の目的は、ライフスタイルへの介入に良好な反応を示す人とそうでない人の遺伝的、ゲノム的、分子的特徴を明らかにすることで、将来的にテーラーメードのアプローチを可能にし、また初期のアテローム血栓症のネットワークモデルにおける新しい治療・診断標的を明らかにすることだ。
このような基礎科学、疫学、臨床研究からのデータが利用できるようになると、システム医学のアプローチは、集団的なスケールでより妥当なものとなる。システム医学が採用されれば、急性期医療から、前向きで全人的な個別化医療への大きなパラダイムシフトがもたらされるであろう。システムズ・メディシンは、病気になりやすい個人の迅速な特定、診断と予後の精度を高めるための分子レベルでの病気の分類、予測可能な薬理ゲノム・プロファイルの発見、病気の検出と治療への反応をモニターする非侵襲的画像診断法の開発を可能にし、生活の質と長寿を改善するという究極の目標に到達することになる。
CVDとADの両方に対して、ライフスタイルの改善など、個人の内在する「オーミック」機能に対する調節的な外部影響を含む特定のシステムアプローチが、疾病リスクのある個人の大半に短期的にプラスの影響を与える可能性があると予想している。最終的には、関連するバイオマーカー、ポイントオブケア技術、ウェアラブルセンサーを開発し、リアルタイムで評価、処理、個人に有用なフィードバックを提供することが、最終的に患者の利益となる行動とリスクの修正につながる。これらのデータ要素を永続的に統合することで、システム生物学的アプローチの強みが実現されるのである。
システム医療 – 政策、倫理、社会的問題
システム医学は、病気の診断や治療、医療の提供に大きな進歩をもたらすことが期待されている。しかし同時に、現在の政策や規制の力学、データやプライバシーに関する懸念、アクセスやコストをめぐる問題、健康に影響を与える直接的な医療以外の外部要因を考慮することの難しさなど、完全な実施には大きな課題もある。
システムズ・ヘルスケア – 政策と具体的な課題
医療を取り巻く米国連邦政府の政策状況は依然として不透明であり、真のシステム医療への移行には大きな影響を及す。2010年に医療保険改革法(ACA)が成立して以来 [130] 、下院では60回を超える修正・廃止の投票が行われ、予防医療や医療成果・医療連携に焦点を当てた支払いへと移行しようとする条項が廃止された。最近の廃止案は上院で否決されたものの [131]、この種の法律が引き続き取り込まれる可能性はあり、行政や行政府は現行法を解体する動きを続けている。
この議論において注目すべきは、最近下院で可決された法案と同様の法案が将来のある時点で署名された場合、予防プログラムと適用要件が大幅に削減されるということだ。このような法律が成立すると、現在、疾病対策センター(CDC)の基本予算の12%を占める予防・公衆衛生基金が廃止されることになる。さらに、州は、マーケットプレイスの保険プランが、予防・健康サービスや慢性疾患管理を含む10の必須健康給付(Essential Health Benefits)[132]をカバーしなければならないという要件から免除される権利を持つことになるであろう。予防プログラムの重要性と健康全般への影響に対する認識の欠如は、真の予測医療と個別化医療のアプローチを連邦政策レベルに反映させることの難しさを示唆している。実際、「革新」は支持を得ているようだが、それを広範な予防の実施につなげることは、より困難であることが証明されている。
大統領の2018年度予算では、国立衛生研究所(NIH)やCDCを含む科学とイノベーションの両方に資金を提供する連邦非国防裁量支出の大幅削減を要求したにもかかわらず [133]、イノベーションと「治療」は引き続き立法・行政府の優先事項であり、今や「予測的分析」が、ケアの提供と管理を改善し不正を取り締まりながらコストを削減する方法として議論されるようになっている。例えば、2016年に署名された21世紀治療法[134]は、精密医療と生物医学研究のために63億ドルの資金(NIHへの48億ドルを含む)を承認した。それらの資金の一部は、ジョー・バイデン副大統領のCancer Moonshotプログラムやオバマ大統領のPrecision Medicine Initiative(PMI)を対象としたものであった。この資金はまだ認可されただけ(充当されていない)だが、充当プロセスによる資金拠出のコミットメントはすでに進められている。しかし、この法案を相殺する、つまり「支払う」ために、議会は予防・公衆衛生基金を利用した。これは間違いなく、公衆衛生分野のイノベーションを元々対象としていた唯一の資金源である。実施への道筋のない科学的革新は、その程度を実感しにくいものである。
PMIは、ピッツバーグ大学が主導する国立衛生研究所(NIH)の事業で、2015年にオバマ大統領によって立ち上げられた。PMIに関連する主な構成要素は2つある。短期的な焦点は癌であり、長期的な目標では、病気のリスクとメカニズムを理解し、予測的な治療法は広範な影響に達するという、より広い枠組みで健康と病気を見ることが含まれる[135]。100万人の参加者のうち1万人から1万5千人を募集する小規模な展開と、来年には全国展開が予定されている。
さらに、Healthy People 2020には、「臨床と公衆衛生の実践において、有効かつ有用なゲノムツールによって健康を改善し、危害を防止する」という目標を持つゲノミクスのトピックエリアが新たに含まれている[136]。この目標は、米国予防医療専門委員会(USPSTF)と診療・予防におけるゲノム応用評価ワーキンググループ(EGAPP)の勧告に基づいており、それぞれ、早期スクリーニングや介入によって広範な健康アウトカムを改善できるという証拠がある個別の疾病に焦点を合わせている。ゲノミクスは、ヘルスケアに対する完全に統合されたシステム医学的アプローチの一部分に過ぎないが、ゲノムレベルのデータが集団レベルの健康を改善する可能性があるという認識は重要であり、システム医学の実施に必要なステップである。
現在では、病気の原因や、我々が健康でいるための能力に影響を与える経路が数多く存在することが広く認識されている。これらの例はすべてを網羅したものではなく、民間企業に比べて動きが遅く機敏でない傾向にある連邦政府の政策レベルにおいても、病気の根本的な構成要素への配慮や病気の予防・治療方法の理解に向けた取り組みが行われていることを示す一例である。
システム医療 – データ、プライバシー、差別
システム医学のアプローチでは、多くの種類の医療専門家とさまざまな管理システムで、非常に機密性の高い情報を保存し共有する必要があり、これらすべてがプライバシーに関する多くの問題を提起する。ほとんどの場合、保護されるべき健康情報(PHI)をどのように保護するかを含め、正式なデータ共有計画が必要となる。システム医療を実現するために必要な膨大なデータは、誰が所有し、どこに保存され、誰がそれにアクセスできるのか、というような重要な問題を提起している。現在の “ビッグデータ “の領域、特に現在電子的に保存され容易にアクセスできる膨大な量のデジタル情報は、進化するシステム医療のアプローチと直接結びついている。ビッグデータは、医療従事者との対話、病歴、体内の「オーミック」指標、外部の社会的・環境的影響に基づいて、個人の将来のヘルスケアニーズを予測するために、高度な分析を行うようになってきている。収集された情報には、ソーシャルメディアにおける個人の存在も含まれるかもしれない[137]。現在利用可能な膨大な量の電子医療記録は、個人の臨床情報、人口統計、治療経過を含む膨大なデータセットに寄与しており、データ分析には最適ですが [138]、侵入から保護される必要がある [139]。最近の大規模デジタル・データベースへのハッキング [140]は、今後のセキュリティ向上の原動力となるはずである。しかし、かなりの数のシステムはオンライン化されていないか、他のシステムと容易に統合できないため、データが断片化し、有用性が限定されている。様々なシステム上の全ての臨床記録とデータを互いにリンクさせる機会がなければ、システム医療の実現は困難であろう。
医療にビッグデータを活用する公的・私的な支払者は増えているが、これらの高度なアルゴリズムを取り巻くプライバシーに関する懸念は、上述のように依然として大きい。医療保険の相互運用性と説明責任に関する法律(HIPAA)[141]や遺伝情報非差別法(GINA)[142]などの現在のプライバシー構造は限られており、PHIの範囲が大きく広がった環境には適していない可能性が高い。保険会社からのPHIのセキュリティ侵害は壊滅的である。収集される情報の範囲を拡大することは、機密データのプライバシーと保護を保証するための規制構造になる可能性が高い。さらに、リアルタイムで収集・保存されるデータは流動的であるため、セキュリティリスクは常に更新されなければならない。
技術の進歩のスピードが増すにつれ、個人的な意思決定へのデータの利用は重要な要素となっている。病気特有のバイオマーカーを特定し、病気の発症を予測することができたとして、個人は自分の病気のリスクについて、いつ、どの程度知りたいと思うだろうか。もし、特定された病気に治療法がなく、進行を遅らせる治療法もない場合、答えは変わるだろうか?このトピックに関する会話は、社会全体を巻き込んで拡大する必要がある。さらに、将来の世代に受け継がれるような遺伝子の変化や「編集」を可能にする新しい技術が開発されつつある [143] 。どのような目的で、何が継承され何が継承されないかを編集することを選択できるのだろうか?偶発的な遺伝子変異のような、遺伝暗号をいじくることの意図しない結果をどのように予測することができるのだろうか。[144, 145].
より最近では、インターネットの自由を回復するという名目で、米政権は医療に重大な影響を及ぼすネット中立性ルールの変更を提案している。この規則案では、ブロードバンドプロバイダーが接続のレベルに応じてより多くの料金を請求することになり、小規模な医療行為や地方の病院が高速接続を確保できず、データ収集能力に支障をきたす可能性がある[146]。さらに、健康アプリの開発と利用が影響を受け、疾病モニタリングや行動変容プログラムの効果が低下する可能性もある。
システム・ヘルスケア – アクセスとコスト
新しく革新的なテクノロジーは、常にアクセスと公平性の問題をもたらす。最新・最高のものを誰もが利用できるようにするには、どうすればよいのだろうか。新しい治療法が高価な場合、保険会社はその一部しかカバーしない可能性があり、その場合、自己負担できる人だけがその恩恵を受けることになり、健康状態の格差が拡大する。システムズ・メディシンのアプローチにおける複数の要素の一つである遺伝子検査を、保険会社はまだ十分に受け入れていないのである。システムズ・メディシンのアプローチによって人々の健康を真に向上させるためには、特に十分なサービスを受けていない人々において、慢性疾患の発症を予防・抑制する方法を理解することが必要である。何百万人ものアメリカ人が基本的なプライマリーケアさえ受けていないのに、どうやって新しい診断技術や治療法への平等なアクセスを保証できるのだろうか?ヒトゲノムの配列決定コストは過去10年間で大幅に低下しているが [147, 148]、常に更新を必要とする膨大な情報のデータセットを維持するためのコストは法外なものとなりうる [149]。
システム医療 – 社会的決定要因
病気や健康に関するゲノムレベルの議論ではしばしば軽視されるのが、我々の健康に影響を与える外的変数、すなわち社会的決定要因であり、システム医学のアプローチではこれを取り入れることになる。これには、環境(汚染されていない空気を吸い、歩きやすい緑地で活動的なライフスタイルを維持する能力)、健康食品へのアクセス、教育、雇用状況、社会経済的状況などが含まれ、これらの変数が寿命や世代を超えて互いにどのように影響し合っているかも含まれる。健康の社会的決定要因の定義は、大まかなものから様々である。「健康に影響を及ぼすあらゆる非医学的要因」、「個人では制御できないが個人の環境に影響を及ぼすもの」、より具体的には「人々が生まれ、成長し、生活し、働き、年をとる条件であり、世界、国、地域レベルでの金銭、権力、資源の分配によって形成されるもの」 [150] と様々である。非臨床因子が人々の健康に大きな影響を与えることが認識されつつある一方で、アウトカム、特に何年も結果が出ないかもしれないもの、維持するために多額の投資を必要とするものを測定することは、困難なことである場合がある。
個人の健康に関与するすべての要素を活用することが進められている。しかし、現在、連邦政府の医療費のうち、病気を未然に防ぐために使われているのは、わずか3%に過ぎない。真に「コストカーブを曲げる」ために、そしてすべての人のための強固な健康ソリューションを確保するために、我々が住み、働き、遊ぶ場所といった外的要因に対処する必要がある。
システム医療 – 経済的意味
ヘルスケアに対するシステム・アプローチの見返りは、個人の生活の質の向上や寿命の延長にとどまらないはずである。特に、システムズ・アプローチは、集団ベースのウェルネスと予防の促進を通じて、公的および私的な医療費の有意義な節約を生み出し、病人の世話をする家族や友人にも有益な波及効果をもたらす可能性を秘めている。アルツハイマー病に対するシステムアプローチと心血管疾患の二次予防は、その好例である。
2010年、認知症に起因する年間医療費は、他の併発疾患による経済的負担を差し引くと、一人当たり41,000ドルから56,000ドル、総額で1590億ドルから2150億ドルである [151] 。これらの費用の約4分の3は、施設や在宅での長期介護によるものである[151]。これらの推計は、家族や友人によるインフォーマルなケアに金銭的価値を置いているが、社会的、身体的、心理的な幸福への悪影響という点で、介護者にかかる相当な非金銭的コストは考慮していない [152, 153]。アルツハイマー病に対するシステムアプローチによって発症を数年でも遅らせることができれば、直接的な医療費として数千億円、介護者の幸福の改善という点ではそれ以上の節約になる可能性がある。
心血管疾患(CVD)の治療は、医療費の6分の1、年間約3,130億ドルを占める [154, 155]。CVDの二次予防、特にライフスタイルの変化(例:禁煙、運動)、服薬アドヒアランス、多職種チームによるケアを促進する疾患管理プログラムは、生活の質を改善し、入院を減らし、医療費を削減できることが、多くのレビューで示されている [156, 157]。二次予防を促進する移行期ケアモデルは、実際、コスト削減につながることが示されている [158, 159]。二次予防がCVDに対するシステムアプローチに不可欠である限り、年間数十億ドルを節約できる可能性を持っている。
結論
システムズ・アプローチを臨床に取り入れるためには、新進の医療従事者や現役の医療従事者が、新しく、異なるトレーニング・プログラムに触れる必要がある。トレーニングには、科学者、臨床医、その他のプロバイダーが参加し、人間全体(心、体、精神)へのケアを含むホリスティックなアプローチを取り入れ、これらに情報技術を取り入れることが必要である。したがって、完全に統合されたシステムトレーニングには、ナースプラクティショナー、臨床心理士、栄養士、代替療法のライセンスプロバイダー(自然療法医、鍼灸師、ヨガインストラクター、マッサージセラピスト)など幅広い医療専門家が参加し、それぞれの専門分野に関する基礎知識を提供し、患者のために理想的な教育を可能にすることができる [160] 。このような統合的、学際的なトレーニングアプローチは、生物学とともに行動と社会的環境の次元が認識される疾病の生物心理社会的モデルにも見られる [161]。最終的には、このようなトレーニングが、患者に最も適したチームベースの協調的なケアにつながるであろう。
このようなトレーニングのための「ベストプラクティス」は比較的少ないが、いくつかは出現しつつある。Coordinating Action Systems Medicine (CASyM) [162] は、システム医学教育のための欧州計画を策定し、次の目標を包含している。(1) 医学教育のすべての側面と関連するすべての分野にまたがるフレームワークを確立する、(2) 動的システムアプローチと可視化ベースのガジェットを組み込んだ「伝統的」トピックに関するコースを促進する、(3) 統計、バイオインフォマティクス、オミックス技術、医療目的のモデリングを研究医師と臨床医に徹底的に教育する、 (4) 臨床医による実際の使用に合わせてソフトウェアを適合させる、。米国の多くの学術機関は、トレーニングの必要性を考慮し、システム医学に関連するプログラムを開始している [3, 163, 164]。他の臨床分野と比較して、学習の周期が長いことを考慮すると、長期にわたるトレーニングが重要である [135] 。また、NIHのCTSA、システム生物学センター、ACGMEの臨床情報学フェローシップ(2014年発足)などが、学際的トレーニングのさらなる種や中心的な役割を担っている。K-12[165]や開業医を対象としたCMEプログラム[3]は、システム医学のトレーニングパイプラインにおけるさらなるギャップを埋め始めている。
近い将来、システム医療は、全体的なアプローチの効果を十分に発揮するために、教育学的に専門家間、臨床的に学際的でなければならない。既存の卒後臨床プログラムの修正が必要であり、これは認定機関と調整する必要がある。診療報酬の改革、そして最終的には大規模な導入には、臨床効果と費用対効果の向上を実証することが必要である。システム指向のマルチモーダルデータの堅牢性は、医療提供者と患者によって削減され、実用化されたとき、臨床的有用性をさらに刺激し、変曲点または転換点をもたらすであろう。このような未来は、あなたの近くのクリニックにまもなくやってくる予定である。
