Synergy of melanin and vitamin-D may play a fundamental role in preventing SARS-CoV-2 infections and halt COVID-19 by inactivating furin protease
www.ncbi.nlm.nih.gov/pmc/articles/PMC7642579/
要旨
キリストの誕生以来、これらの2019年に、地上の人間は、SARS-CoV-2と比較して、どのような細胞性原生生物からの生存挑戦を経験したことがない。特定の薬はまだ承認されていない。宿主免疫は、感染を予防し、または感染率と死亡率を同様に減少させるための唯一の代替手段である。
ここでは、メラニンを媒介とする宿主免疫の新規なメカニズムが提案されており、COVID-19のヘルスケア管理におけるバイオテクノロジーの可能性を秘めている。ビタミンDはメラニン合成を促進することが知られており、これは同時にファーリンの発現を調節している可能性がある。in silico解析の結果、メラニンの中間体はフーリンプロテアーゼの活性部位と強く結合することが明らかになっている。
一方、フーリンの発現は、ビタミンD経路に属する1-α-水酸化酵素(CYP27B1)を介してネガティブに制御されており、細胞内のカルシウム濃度を制御している。ここでは、生物学的なメラニンの利用可能性を想定し、そのバイオメディカルの可能性を明らかにしてきた。
本研究では、メラニンとCYP27B1(ビタミンD生合成を制御する酵素)の相乗効果を利用して、フーリンプロテアーゼの不活性化を介してウイルスの侵入を防ぎ、細胞レベル、体液レベルでの免疫力を高めることができる可能性を提案した。
キーワード
ビタミンD、フーリン、メラニン、SARS-CoV-2,COVID-19,微生物メラニン合成
序論
SARS-CoV-2,後期パンデミック、新型コロナウイルス疾患2019(COVID-19)の根本原因である。病人は軽度から重度の呼吸器系の問題を経験する。感染した集団の中で、症状のある患者が入院せずに回復することはほとんどなく、その大部分は異常な治療のために入院している。これは、病院が最前線にあり、医師は医療支援チームと共に指揮官としてCOVID-19と常に戦っているという、驚くべき世界規模の戦争である[1, 2]。COVID-19は、他のSARS-CoV感染症と同様の症状を呈し、敗血症を伴うARDS(急性呼吸窮迫症候群)へと急速に進行し、最悪の場合、ウイルス感染によって体内でサイトカインストームが発生し、多臓器不全が起こる[3]。新型コロナウイルス(SARS-CoV-2)は、感染者が何気なくくしゃみや咳をしたり、人と会話をしたりした際に、周囲の環境に放出された微小な飛沫を介して感染するのが一般的である[4]。
既存の棚には確証のある抗COVID-19薬はない[5]。現在、いくつかの臨床試験が進行中であり、クロロキン、レムデシビル、アルビドール、ファビピラビルなどのいくつかの薬剤が試みられているが、いずれも生存率を向上させる効果はないとされている[6]。現在のところ、COVID-19のガイドラインや治療法は特に決まっていない。ほとんどの治療法は対症療法であり、支持療法に基づいている。細胞レベルで大きな妥当性を示した薬剤はほとんどなく、さらなる試験と承認が必要である。COVID-19患者の治療には、抗ウイルス薬を含むいくつかの抗菌薬が使用されており、例えば、レムデシビルやロピナビル、リトナビルとクロロキンのブレンド[7-9]や、いくつかの薬剤が開発中である[10]。ウイルスやその他の微生物に敵対する薬剤を使用した場合、腸内マイクロバイオームの自然なバランスが崩れ、患者の罹患率の悪化をさらに助長する。コロナ患者は、IL-6およびIL-10を含むサイトカインレベルの閾値を維持する必要がある場合に、白血球(WBC)およびリンパ球の減少による弊害を主に経験する[11]。このような状況において、COVID-19に対抗するためには、宿主-免疫に基づく協調的な治療が決定的であり続ける。
コロナウイルス感染患者に対する栄養剤治療、特にVit-CとVit-Dの投与は、長い間知られている治療法である[12]。現在、COVID患者に対するビタミンD治療の第3相試験が進行中である[13]。ビタミンDはSARS-CoV-2感染症に対する安定した治療法として興味をそそられるかもしれない。いずれにしても、今のところ論理的な証明や科学的な根拠はない。ここでは、ビタミンDとメラニン合成経路の間のクロストークが、メラニン合成の副産物が、SARS-CoV-2を媒介とする疾患の進行に不可欠なヒトプロテアーゼfurinのダイナミックな部位と明確に結びついているという興味深い観察結果とともに報告されている[14]。
ビタミンD:人間の健康への貢献
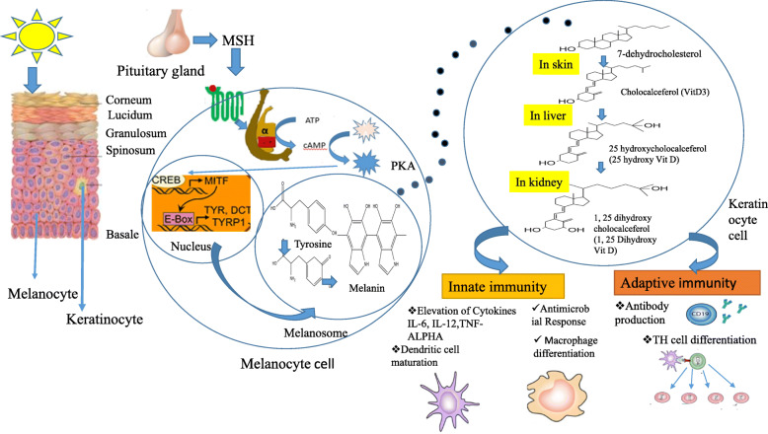
ビタミンDは、一般的に食品から入手するか、ヒトの皮膚内で合成されている[15]。このビタミンDは、適応性と生得性の両方を調節することが広く知られている(図1)。B細胞/T細胞やAPC(抗原提示細胞)に発現するビタミンD受容体(VDR)は、ビタミンDから活性代謝物を合成することができる。ビタミンDの必須の活性は、カルシウムの恒常性と骨格の健康の維持である。肝臓では、水酸化されたビタミンDはダイナミックな形、すなわち25 OHビタミンD3(25Dとも呼ばれる)になる。腎臓の中では、25Dは酵素、1-α-水酸化酵素(CYP27B1)の作用によってカルシドールとも呼ばれる別の動的な形態すなわち-1,25,ジヒドロキシビタミンD(1,25 D)に変換される。その後、24-ヒドロキシラーゼ(CYP24)は、1,25 Dを不活性化合物である1,24,25ビタミンDに変換する(図2)。活性型の1,25 DはVDRに結合した後、腸や骨に影響を与える[16]。
図1 太陽光、ビタミンD合成、メラノサイトの活性化、免疫分子の制御の間のクロスロードを模式的に示す
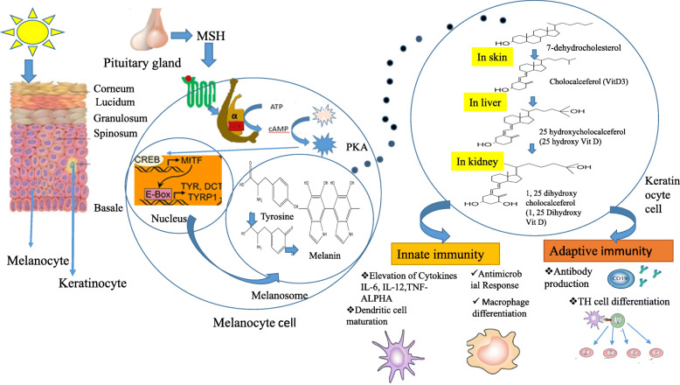
図2 ビタミンDの健康への影響と肝臓での代謝
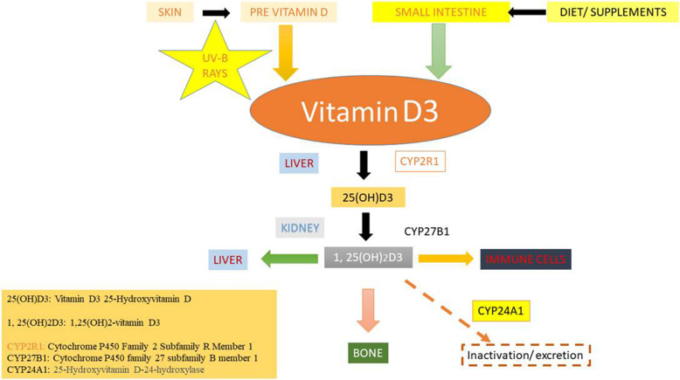
水酸化型の25 OHビタミンD3(25 D)は肝臓で合成され、1-α-水酸化酵素(CYP27B1)によって最も活性な1,25,ジヒドロキシビタミンD(1,25 D)に変換される。CYP27B1は、ビタミンD生合成の鍵を握っている
いくつかの横断的な調査で、体内のビタミンD含有量がインフルエンザなどの病気の進行に直結していることが明らかになった[17]。[18, 19]. 抵抗力の低下したビタミンDの低レベルとウイルス性疾患の罹患率の高さとの間には、直接的な関係がある(表1)。マクロファージがリポ多糖類(LPS)を検出するためにTLR(toll like receptors)を使用していることはよく知られており、LPSは細菌感染の好ましい標的である。マクロファージのTLRは、1-α-ヒドロキシラーゼとVDRの両方の発現を促進する。呼吸器上部のウイルス感染症は、ビタミンDの含有量が十分な人に比べて低いため、ますます増加している。ビタミンDのレベルは、年齢、季節、性別、人種、体重によって変動するが、これはウイルス感染症と同様に関連している[32]。VDRの発現は、骨格や腸以外の脳、乳房、骨髄、大腸、悪性細胞、免疫原性細胞などで見られ、ビタミンDは骨組織のカルシウムの恒常性を維持するだけでなく、ヒトの病原体と戦うための免疫力を高めることで、大きな防御的役割を果たしていることが示唆されている[33]。
表1 ビタミンDの効果で抗ウイルス効果が証明されたウイルス性病原体のリスト
| Sl番号 | 標的ウイルス | 参考文献 |
|---|---|---|
| 1 | C型肝炎ウイルス(HCV)。 | Gal-Tanamy et al。、2011 [ 20 ] |
| 2 | 呼吸器合胞体ウイルス(RSV) | Hansdottir et al。、2010 [ 21 ] |
| 3 | 慢性C型肝炎ウイルス(HCV)。 | Falleti et al。、2012 [ 22 ] |
| 4 | ライノウイルスの複製 | Telcian et al。、2017 [ 23 ] |
| 5 | HIV-1 | Aguilar-Jimenez et al。、2016 [ 24 ] |
| 6 | デング熱ウイルスの複製 | Puerta-Guardo et al。、2012 [ 25 ] |
| 7 | 単純ヘルペスウイルス-1(HSV-1)感染 | Kumar et al。、2018 [ 26 ] |
| 8 | エプスタインバーウイルス | Disanto et al。、2011 [ 27 ] |
| 9 | 風疹ウイルス | Ovsyannikova et al。、2010 [ 28 ] |
| 10 | B型肝炎ウイルスの複製 | Farnik et al。、2013 [ 29 ] |
| 11 | インフルエンザA | 浦島ほか、2010 [ 30 ] |
| 12 | SARS-CoV-2(Covid-19) | Christianto et al。、2020 [ 31 ] |
ビタミンDが介在する自然免疫
呼吸器感染症の間に、病原体は、呼吸器管に入り、上皮細胞に植民地化を開始し、また、すぐに自然免疫と炎症性シグナリングネットワークが応答するように開始する[34]。まず、好中球は、肺の実質細胞を入力し、植民地化は、感染の1時間以内に開始される。その後、感染後数日以内にナチュラルキラー細胞、単球/マクロファージ、T細胞に影響を与える。RIG様受容体とTLRはウイルス病原体を認識し、サイトカインとI型インターフェロン(IFN)を産生することで抗ウイルス防御システムに参加する。IFNと炎症性サイトカインは、ウイルスの複製と翻訳を阻害し、それによって感染を制御する [25]。これらの免疫分子はさらに、ウイルスの切断を作動させ、細胞溶解細胞の活性化によるウイルス融合を抑制し、体液性因子、例えば、急性期タンパク質、コレクチン、補体タンパク質を含むディフェンシンを刺激する [35, 36]。
ウイルス抗原の存在下では、マクロファージおよび樹状細胞は、患部リンパ節に存在するCD 4+およびCD 8+ T細胞の処理を開始する。その後、T細胞は感染した組織に移動し、プロ炎症および細胞溶解の影響を介入させる[37]。その後、Tヘルパー細胞はB細胞の増殖を促進するとともに、血漿細胞とメモリー細胞への分化を促進し、抗体クラスの切り替えを行い、IgAとIgGの両方を合成する[35]。B細胞が抗体を運搬することで、ウイルスの細胞内への侵入を防ぎ、自然免疫原性細胞による貪食を促す。その後、自然免疫応答と適応免疫応答は、呼吸器ウイルス感染症から個人を保護するために協力的な役割を果たすことができる[37]。
すべてのビタミンの中で、ビタミンDのみが皮膚上の日光(280-315 nm)に曝露されることによって合成される。ケラチンを多く含む皮膚膜に日光が当たると、7-デヒドロコレステロールが最終的にビタミンD3,カルシトリオールに変換される[38]。全身のビタミンDの大部分は皮膚に由来するものであるが、一部のビタミンDは同様に栄養補助食品から摂取される [39]。中間体である1,25(OH)2D3は、VDRとの相互作用の後、1000以上の遺伝子を制御している。上皮細胞は、RSV感染のリスクに関連したSNPを持つ重要なレベルのVDRを発現している[40, 41]。1,25(OH)2D3は、気道内のNK細胞、好中球、マクロファージの成熟を活性化し、さらにいくつかの抗菌ペプチド(AMP)例えばカテリシジンやディフェンシン[42]。このようなAMPは、hCAP18/LL-37と結合することにより、抗ウイルス(主に抗インフルエンザ)効果を示している[43]。また、CD14やTLRの発現も同様に1,25(OH)2D中間体の影響を受ける[44]。マクロファージの活性が高まると、感染中のオートファジーの活性が低下する[45]。オートファジーは、サイトカインによって誘導される細胞恒常性維持プロセスである。オートファジーはIFN-α/CXCL10の放出と結合して、インフルエンザA感染時にはウイルスの複製を停止させる[46]。したがって、ビタミンDがオートファジー抑制を介在させることで、肺の呼吸器系ウイルス疾患を抑制することができる。作用ビタミンDによる自然免疫応答は、特定のTH細胞/およびB細胞を刺激するためにリンパ器官へのミエロイド樹状細胞の動きを活性化するために、より広範になる[47,48]。インフルエンザA感染時には、1,25(OH)2Dは肺上皮層の腫瘍壊死因子(TNF)-αやインターロイキン(IL-8, IL-6, IFN-β, RANTESなど)を減少させる[21]。特に病原性の高いウイルスでは,病原性の低いウイルスよりもウイルスの複製率,サイトカインのレベルが高い[49].呼吸器ウイルス感染率は冬よりも夏の方が低い [47]。ビタミンDは、TH1とTH2のサイトカインレベルを低下させ[50]、T調節細胞を増加させることで適応免疫を調節することで、呼吸器ウイルス感染を制御することができる[51]。印象的なことに、日光にさらされていない乳児は下気道感染症に罹患しており、血中の血清中に 25(OH)D の低レベルが検出されていることが明らかになっている[52]。日光を浴びた母親は、日光にさらされていない母親よりも子供に高いビタミンDを与えることが報告されている。胎児の発育や免疫力の発達を維持するためには、日光の照射と同様にビタミンDの希釈が必要であり、日光はビタミンD合成の重要な刺激因子であると考えられている[53]。
ビタミンDとメラニン生合成のクロストーク
ヒトの皮膚は日光に曝露されると自然にビタミンDを産生する。この手順は、表皮に存在する7-デヒドロコレステロールがUV-Bを吸収した後に開始される光化学反応であり、したがって、合成はUV-B用量、温度、脂質環境などのいくつかの要因に依存する[54]。メラニン色素系は、白人の皮膚のメラニン生成機械と循環する25(OH)Dの間のリンクを介してビタミンDのシグナル伝達に影響を与える[55]。メラニンはUV-B(290-320 nm)を吸収し、皮膚上皮に浸透するUV-B放射の量を決定する光のろ過に参加している[56]。世界の緯度による人種分布は、個人のビタミンD産生によって調節されていることが確認されている[57]。人々が低緯度から高緯度に移動すると、日照量の減少により皮膚の色が退色する。このように、皮膚の色素沈着は、メラニンと7-デヒドロコレステロールとの競合でビタミンD3合成を調節するための支配的な変数である[58]。このような状況では、有名な仮説「ビタミンD-葉酸仮説」が、紫外線照射状況におけるヒトの皮膚の陰影の明らかな適応の背後にある説明を描いている。ビタミンDと葉酸は紫外線に対して多様な感度レベルを持っているが、不思議なことに、ビタミンDが紫外線曝露を利用して配合され、その後、葉酸が分解されると、ビタミンDは紫外線に対して多様な感度レベルを持つ。ビタミンD-葉酸仮説 “の提案された仮定は、皮膚の色素沈着がビタミンD [59]の細胞の恒常性を維持することである。いくつかの代替理論がこの仮説を制限している。ビタミンの分野の専門家は、皮膚色素の枠組みとビタミンDの生成との間の収斂関係についての理論を受け入れている[60, 61]。
通常の日中の光の中では、UVBはUVAよりもビタミンD合成のためのダイナミックな放射線である。ある調査では、顔色の薄い人は20,000 IUのビタミンD3を生成するために20-30分、7日間に数回の照射が必要であるのに対し、メラニンレベルの高い褐色の顔色の人は、同等のビタミンD3を生成するために2-10倍の照射時間が必要であることが報告されている[62]。ビタミンDと皮膚のメラニンの相乗作用は、基本的に若者の25(OH)Dのレベルをスクリーニングするために不可欠である、妊娠中の女性だけでなく、若者、高齢者に。メラニンとビタミンDはともに、ウイルス感染だけでなく、細菌や真菌の病気に対する保護の役割を持っている[63]。皮膚におけるメラニンとビタミンDの合成にはいくつかの因子が関与している。しかし、様々なカテゴリーの色素の合成とビタミンDとの直接的な相関関係については十分な情報が得られていない。実際のところ、ビタミンD合成の制御やメラノサイトの関与については、病状が変化した状態での詳細な研究は行われていない。
メラニン
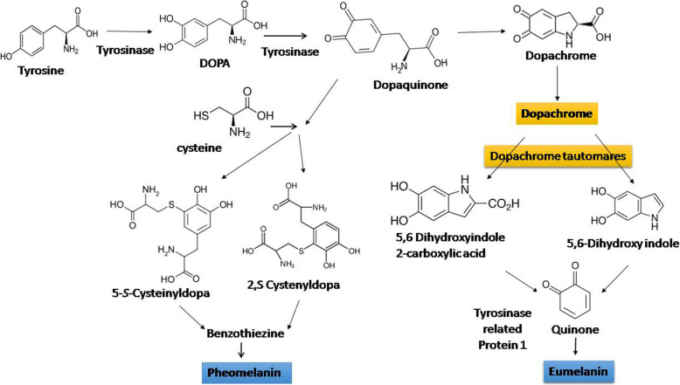
メラニン色素を含むインドールポリマーは、モネラからアニマリアまでの5つの王国で発見された。メラニンは進化研究のバイオマーカーとして活躍している。それは、恐竜や羽毛の生き物の化石で認識されている自然の中で最も古い顔料と考えられている。ジュラ紀の時代から頭足類のインク嚢[64]から発見されている。メラニンには3種類あり、例えば、ユーメラニン、フェオメラニン、アロメラニン[65]。自然条件とは別に、ほとんどの場合、人間の皮膚の色相には2つのシェード、例えばユーメラニンとフェオメラニンが責任を負っている。メラニン合成経路では、主にカテコールアミンの前駆体である3,4-ジヒドロキシフェニルアラニン(DOPA)がチロシンから生成され、酸化後に3,4-ジオキシフェニルアラニン(ドーパキノン)に変換され、これが環化して5,6-インドールキノンとなり、メラニンへと重合する(図3)。溶解性メラニンは、L-ß-3,4-ジヒドロキシフェニルアラニン(L-DOPA)が酸化された後、またはL-チロシンが化学的に酸化された後に編成される[66]。
図3 ヒトにおけるフェオメラニンとユーメラニンを含むメラニン合成の模式図
メラニンは、高域の電磁スペクトルを吸収する際に光による損傷を防ぐだけでなく、化学的・熱的ストレスからの保護も保証している。このようにして、メラニンは光保護クリームや化粧品の製造に広く利用されているほか、眼鏡の設計や放射性廃棄物の処理にも利用されている[67]。メラニンは、紫外線によるダメージから皮膚を保護し、体温調節を維持するだけでなく、ストレス応答、代謝、免疫力の管理にも役立つ[68]。脊椎動物のα-メラノサイト刺激ホルモンとメラニン濃縮ホルモン合成遺伝子は、いずれも組織のMRC(メラノコルチン受容体)に結合し、寄生虫感染に対する防御を含むさまざまな生理活性に関与するという高度に保存されていることが、先行研究で確認されている[69]。また、メラノコルチンリガンド(アルファMSHとACTH)はMHCIの発現を助けている。
このように、メラニンはがん予防、抗ウイルス、抗菌、抗炎症、抗腫瘍、免疫刺激、放射線保護作用などの特性を持つため、健康材料として利用されることが多くなっている[71]。合成メラニンは、試験管内試験条件下でHIV-1やHIV-2の複製を阻害し、HIV-1エンベロープ表面糖タンパク質を阻害するが、逆転写酵素の活性を阻害しないことが判明している[66]。このように、メラニン色素は悪性増殖や感染症の予防に重要な役割を果たしていると考えられている。
フーリンは癌やウイルス感染症の発症を媒介する
500種類以上のプロテアーゼがヒトゲノム上に存在し、すべての生理過程で分子のハサミとして重要な役割を果たしている。プロテアーゼ分解開裂は、健康と病気のいずれかにつながるいくつかの生理的および発病経路を制御する。一般的に重要でユビキタスに発現するプロテアーゼの一つは、セリンプロテアーゼのフーリン[72]である。フーリンは、いくつかのウイルス粒子の活性化に関与している。エンベロープされたタンパク質のウイルスは、ちょうど非エンベロープと同様に、感染の準備ができている成熟したウイルスを生産するためのエントリのための他のプロテアーゼとともに、このプロテアーゼによって処理される。ホルモン、成長因子、サイトカイン、および受容体は、フーリンの哺乳類基質であり、フーリンの異常な活性は、癌およびウイルスまたは細菌感染を含む多数のダイアーゼと直接関連している[73]。
フーリンは、例外的に明示的なカルシウム従属プロテアーゼ/プロホルモン変換酵素(PC)のグループに属している[74]。このエンドプロテアーゼは、枯草菌との相同性の相乗的な領域を強調し、制限されたタンパク質分解によって膨大な数の放出されたタンパク質を開始する。フーリンは、膜貫通型セリンプロテアーゼであり、普遍的に伝達され、経ゴルジ系からエンドソーム骨格を介して細胞へと循環している。温血動物では、PCファミリーは、開裂(R/K)Xn(R/K)↓(ここでは”↓”はscissileペプチドのセキュリティを示す)のサイトで異なる基本的な堆積後に分裂する7つの個体を把握し、フーリンは特に配列R-X-K/R-R↓を知覚している[75]。この例外的な継代明示的切断は、様々なPC基質の開始のための基本的なものである。
フーリンは通常、様々な細胞で発現しているが、そのmRNAとタンパク質のレベルは細胞/組織の種類によって変動する;骨髄、唾液腺、肝臓ではかなりの量が存在しているが、筋肉細胞ではフーリン産生は比較的低いです[76]。フーリンのプロペプチドは小胞体からゴルジ網(trans-Golgi network: TGN)に移動し、その間に2つのステップで自己タンパク質分解プロセスが起こり、フーリンは酵素的に活性化される[77]。同時に、N-結合オリゴ糖が取り込まれ、ペプチドがトリミングされる。フーリンのレベルはTGNで上昇しているので、エンドソーム経路を介して細胞表面に移動し、TGNに戻ることができる[78]。最後に、フーリンは、その触媒的膜結合ドメインのタンパク質分解的切断の後、細胞外タンパク質として排出される[79]。細胞内または細胞外空間でのセルマー基質の範囲に作用する能力は、TGNおよびエンドソームコンパートメント内だけでなく、細胞表面上でもフーリンのユビキタスな存在に関連している。
ほとんどの場合、ウイルスのエンベロープ上に存在する糖タンパク質は、宿主細胞に入る前にタンパク質分解的に切断される。ウイルスは、トリプシンやサブチライシンに似たエンドプロテアーゼなどの細胞内酵素を利用して、このような作用を行うことがある。トリプシン様プロテアーゼは、単一のArgまたはLys残基の隣に切断するために一塩基サイトを認識し、多塩基座で切断する[80]。いくつかのウイルス(Borna, Pneumo, Orthomyxo, Herpes, Flavi, Toga, Bunya, Filo, Paramyxo, Corona, Retroviridae)のコートに属する糖タンパク質は、これらのウイルスは進化的に分岐しているが、フーリンによって切断されることが様々な報告で示されている。
フーリンとメラニン中間体のin silico解析
ウイルスのフーリン基質は多塩基正準切断部位を含むが、その活性部位結合ポケットは多くの種で保存されている。ウイルスの糖タンパク質とフーリンタンパク質は、両方とも、ウイルスゲノムの複製中の様々な時点でタンパク質分解開裂を可能にし、分泌経路に入る。いくつかのウイルス株のタンパク質コートは、生産者細胞内でゲノムとは別に生産されていないが、他のウイルスでは、タンパク質エンベロープは、ウイルスが別の標的宿主細胞を攻撃する前に細胞外で処理されている。多くのウイルスは、宿主細胞への侵入を調節し、高い病原性を発現させるために、フーリンや他のプロタンパク質変換酵素(PC)を利用している[72]。いくつかの成長因子、受容体、マトリックスメタロプロテアーゼ、ウイルスエンベロープ糖タンパク質がそれらの生理活性型への変換に関与していることはよく知られている[81, 82]。最近では、SARS-CoV-2スパイク糖タンパク質の開裂抑制のためのフーリン活性を阻害するために、in silicoから試験管内試験までの戦略が実施されている[83]。したがって、フーリンは、多くのウイルスの侵入を阻止するための分子である。また、furinとメラノソームの生合成との間には直接的な相関関係が見られた。フーリン様プロ蛋白質変換酵素(PC)によるPmel17の切断には、メラノソーム内線維が必要であることが証明された。Pmel17の切断はルーメンナルドメインフラグメントを解放し、このフラグメントはフィブリル化活性を制御することでメラノソームの生合成を制御するのに役立つことが明らかになった[84]。
furinの触媒ドメインは、区別されたオキシアニオンホール(ASN295)を持つ触媒トリアード(ASP153,HIS194,SER368)の標的部位に結合している。それとは別に、SER253からPRO256までの残基も同様に、フーリンと結合する低分子に対する強い親和性を示している。本研究では、フラニンとメラニン生合成経路のいくつかの重要な中間体(PubChemに掲載されている構造)との相互作用を紹介する。
エネルギー最小化と分子ドッキング
受容体分子として、ヒトフーリン (PDB ID:4RYD)のProtein Data Bankファイルを利用し、メラニン (PubChem CID:6325610)、ユーメラニン (PubChem CID:102582077)、L-DOPA (l- 3,4-ジヒドロキシフェニルアラニン) (PubChem CID:6047)、L-ドパキノン (PubChem CID:44229226)をドッキングのためのリガンド分子とした。各分子は、安定した分子コンフォメーションでMM2エネルギー最小化が確認された高品質のワークステーションであるChemBio3DUltra 13.0ソフトウェアを用いてエネルギー最小化を行った。最小RMS勾配は0.010であった。メラニン、ユーメラニン、L-DOPA、L-Dopaquinoneとヒトフーリンのドッキングに関する研究は、iGEMDOCK v2.1ソフトウェアを使用して、自動ドッキングを行うための基本的なアルゴリズムを使用して行われた。さらに、分子ドッキング後に得られた結果の解析には、AutoDockVinaと呼ばれるソフトウェアを利用した。このソフトウェアは、PyrexツールまたはAuto-Dock Tools (ADT) [85]を使用した。ガステイガー電荷は、高分子から水の残基を除去した後に決定した。リガンドと高分子をPyrexツールに投入した[86]。最後に、リガンドと受容体のファイルを “pdbqt “形式のファイルとしてエクスポートした。
分子ドッキング解析と自己保護効果
分子ドッキングの結果から、メラニン、ユーメラニン、L-ドパキノン、L-DOPAがフーリンタンパク質の活性部位と強固に結合し、ウイルスの侵入を確実に阻止していることが確認された。メラニンとフーリン蛋白質のin silico・ドッキング研究により、結合親和性は-95.25 kcal/molであることが明らかになった(表2)。メラニンは、furinタンパク質の残基-HIS194,ASP258,ALA292,SER253,TRP254,GLY255,SER293,GLY294,ASN295,THR367と相互作用する。図4AおよびA’から、フェリンタンパク質のオキシアニオン開口部(ASN295)と触媒三叉路の単一残基(HIS194)と並んでメラニンが結合する阻害剤結合部位である残基SER253,TRP254およびGLY255とメラニンとの相互作用が示された。別のドッキングを行ったところ、ユーメラニンとフーリン蛋白質は-119.51 kcal/molの強い結合親和性を示した(表2).2)。オイメラニンは、フーリンタンパク質の残基-ARG197,ASP153,ASP191,ARG193,ARG197,GLU257,HIS364,THR365,HIS194,LEU227に結合している(図4B4BおよびB’)。この相互作用研究では、相互作用残基ASP153とHIS194は、オイメラニンが強く結合する触媒トリアドの一部であることが明らかになった。L-ドパキノンとフーリン蛋白質とのドッキング研究では、結合自由エネルギーは-77kcal/molであった(表2).2)。L-ドパキノンは、フーリンタンパク質のARG197,ARG193,HIS194,ARG197,HIS364,およびTHR365の6つの残基と相互作用する(図5AおよびA’)。ここでは、さらに、触媒トリアードの残基の一つ(HIS194)が相互作用研究に関連していた。L-DOPAとfurinタンパク質とのドッキング研究は、さらに-77.15 kcal/molの結合親和性を発見した(表(表2).2)。L-DOPAとfurinとの相互作用は、明らかにfurinのPRO256,ASP258,SER293,GLY294,ASN295,ASP306,SER368,TRP254,GLY255残基の関与を示している(図5b5bおよびb’)。残基TRP254, GLY255, PRO256は、L-DOPAが触媒トリアッドの1つの残基(SER368)と結合しているフーリンタンパク質のインヒビター結合部位である。
表2 iGEMDOCKを用いたメラニン、ユーメラニン、l-ドパキノン、l-ドパとヒトフーリン(4RYD)とのドッキング相互作用の結合自由エネルギーの決定
| 受容体 | リガンド | 結合自由エネルギー(kcal / mol) | ファンデルワールスエネルギー(kcal / mol) | 水素結合エネルギー(kcal / mol) | 静電エネルギー(kcal / mol) | リガンドインディングサイト |
|---|---|---|---|---|---|---|
| 4RYD:A –人間の風鈴 | メラニン | −95.25 | − 79.46 | −15.79 | 0 | HIS194、ASP258、ALA292、SER253、TRP254、GLY255、SER293、GLY294 、、 ASN295、THR367 |
| 4RYD:A –人間の風鈴 | ユーメラニン | −119.51 | −93.09 | −23.45 | − 2.98 | ARG197、ASP154、ASP191、ARG193、ARG197、GLU257、HIS364、THR365、HIS194、LEU227 |
| 4RYD:A –人間の風鈴 | L-ドーパキノン | −77 | −41.99 | −28.26 | −6.75 | ARG197、ARG193、HIS194、ARG197、HIS364、THR365 |
| 4RYD:A –人間の風鈴 | L-ドーパ | −77.15 | −46.9 | −29.72 | −0.53 | PRO256、ASP258、SER293、GLY294、ASN295、ASP306、SER368、TRP254、GLY255 |
図4 PyMOで見たHuman フーリン (PDB ID: 4RYD)とメラニンのドッキング画像(A)
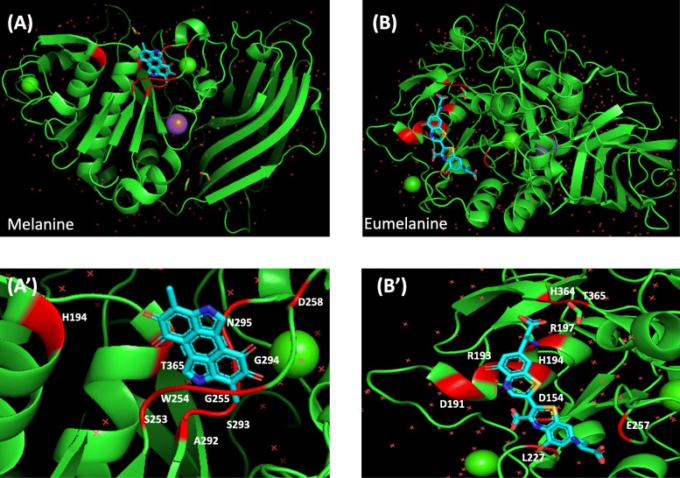
フーリン-メラニン複合体のリガンド結合部位の拡大図(A’). PyMO(B)で見たヒトのフーリン(PDB ID: 4RYD)とユーメラニンのドッキング画像。フーリン-ユーメラニン複合体のリガンド結合部位の拡大画像(B’)
図5
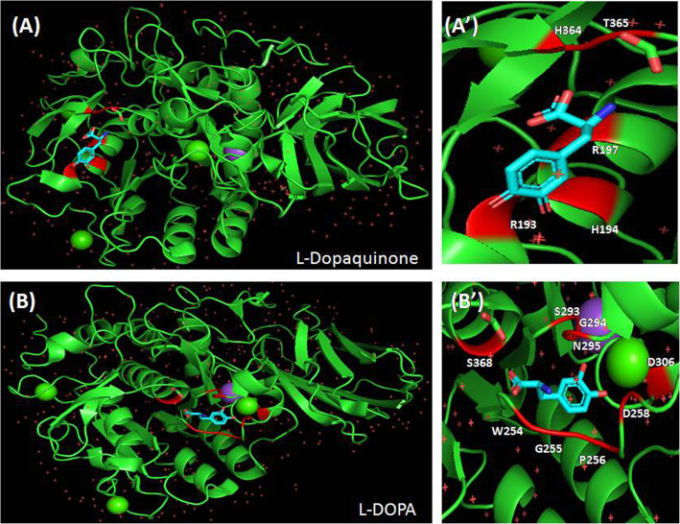
ヒトフーリン (PDB ID: 4RYD)とL-Dopaquinoneのドッキング画像(A)。フーリン-L-ドパキノン複合体のリガンド結合部位の拡大図(A’).ヒトフーリン (PDB ID: 4RYD)とL-DOPAのドッキング画像(B)。フーリン-L-DOPA複合体のリガンド結合部位の拡大画像(B’)
メラニンの利用可能性と製薬/バイオテクノロジー産業の機会認識
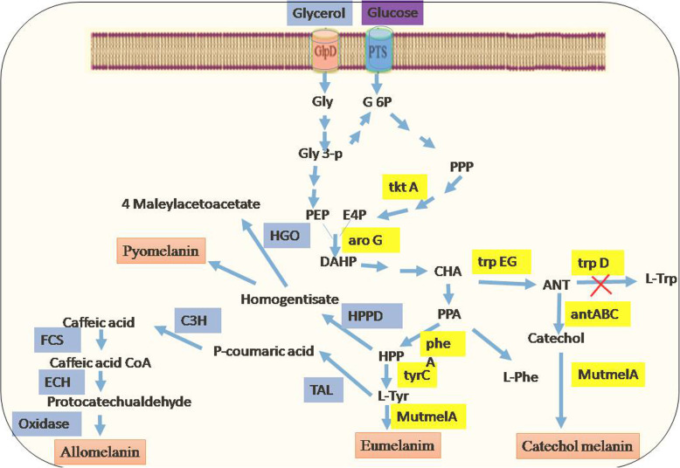
メラニンが病気の蔓延を防ぐという大きな役割を果たしていることがわかってきたので(表3)まもなく医薬品の日和見市場が誕生することになる。日光を利用して皮膚で合成されたメラニンは、入院中に患者が補給することは不可能である。また、長い目で見た場合、遺伝子の発現レベルは個人差、人種差、季節差がある。そのため、「予防医学」としての保健医療への応用において、メラニンの利用可能性は重要な問題となっている。哺乳類以外にも微生物由来のメラニンが市販されている[92] 。メラニンは化学合成以外にも、植物、動物、真菌、バクテリアなど多くの生物由来のものがある。近年、環境に優しい微生物由来のメラニンは、合成・化学生産とは対照的に、バイオテクノロジーの選択肢の一つとして注目されている[93]。大規模な微生物メラニン合成酵素は、ラッカーゼとチロシナーゼのグループに属している。チロシナーゼはメラニン生成に広く関与している。微生物チロシナーゼは、アミノ酸配列と触媒活性の観点から、5つの主要なクラスに属している[94]。チロシナーゼ(モノオキシゲナーゼ)は、二核銅触媒中心を持ち、モノフェノールのオルトヒドロキシル化を触媒するが(クレソラーゼ活性)カテコールを酸化してオルトキノンを合成することもできる(カテコールゼ活性)。微生物によるメラニン生成の生合成経路を図6にまとめた。やはり、一部の微生物、例えばRhizobium etli、Bacillus megaterium、Bacillus thuringiensisのチロシナーゼは、シャペロンタンパク質の活性化に銅を必要としない。その後、再び、別のメラニン生成酵素ラッカーゼ(銅依存性酸化還元酵素)は、主に植物、真菌および細菌に見られる[95]。
表3 細菌やウイルス性病原体に対するメラニンの明確な作用
| 抗菌 | 参考文献 | 抗ウィルス薬 | 参考文献 |
|---|---|---|---|
|
Escherichia coli、Salmonella typhi 、、 Vibrio parahaemolyticusListeria monocytogenes、Bacillus megaterium 黄色ブドウ球菌、大腸菌、尋常性ラクトバチルス、プロテウス・ミラビラス、コレラ菌、黄色ブドウ球菌、サルモネラ・パラチファエ、クレブシエラ・オキシトカ。 |
Xu et al。、2017 [ 87 ] Vasantha-bharathi et al。、2011 [ 88 ] |
インフルエンザウイルス ヒト免疫不全ウイルス1型および2型(HIV-1およびHIV-2) 単純ヘルペス2型、およびワクシニア。 |
Guobing et al。、1999 [ 89 ]; Ashkinazi et al。、2019 [ 90 ] Sidibe et al。、1996 [ 91 ]; Montefiori&Zhou。、1991 [ 66 ]; Ashkinazi et al。、2019 [ 90 ] Ashkinazi、et al。、2019 [ 91 ] |
図6 微生物におけるメラニンの生合成経路
細菌のメラニン
哺乳類と同様に、細菌もメラニンを合成する能力がある[67]。Aeromonas, Bacillus, Azotobacter, Legionella, Proteus, Micrococcus, Mycobacterium, Azospirillum, Pseudomonas, Rhizobium, Shewanella, Streptomyces, Escherichia, Bacillus, Klebsiella, Vibrio.のようないくつかの細菌属が内因性メラニンを産生することが報告されている[64]。Streptomyces spp.は、アポチロシナーゼとチロシナーゼ酵素をコードする melC1 と melC2 遺伝子からなるメラニンオペロン(melC)を有している[93]。また、4-ヒドロキシフェニル酢酸ヒドロキシラーゼという重要な酵素を用いて、L-チロシンからメラニンを生成する細菌群が知られている[96]。さらに、細菌遺伝子をレポーター遺伝子の形で使用して、組換え細菌株をスクリーニングし、メラニンの合成のために使用した[97,98]。メラニン産生の選択された細菌および真菌由来のリストを表4に示す。
表4 微生物由来のメラニン産生促進効果が一目でわかる
| 菌株 | 参考文献 | 菌株 | 参考文献 |
|---|---|---|---|
|
Actinoalloteichus sp.MA32 Streptomyces sp。、 コレラ菌とシュワネラコルウェリアナ |
Manivasagan et al。、2013。)[ 99 ] Vasanthabharathi et al。、2011 [ 88 ] |
Cryptococcusneoformans、S。schenckii、P。brasiliensis、Pneumocystis sp、Aspergillus fumigatus、Alternaria alter、Cladosporiumsp。Yarrowiali polytica Exophiala(Wangiella)dermatitidis、Cladosporiumcarrioni、およびFonsecaea pedrosoi Spergillusnidulans、Aspergillus niger、Exophiala Jeanselmei、Fonsecaea Compacta、Hendersonula toruloidii、 Phaeoannellomyces wernickii、Phialophora richardsiae、 P. verrucosa、Xylo hyphabantiana、Histoplasma capsulatum |
Nosanchuk et al。、2006 [ 100 ] Apte et al。、2013 [ 101 ]。 Romero-Martinez et al。、2000 [ 102 ] ジェイコブソン、2000年[ 103 ] ゴメズとノサンチュク、2003年[ 104 ] |
菌類のメラニン
いくつかの真菌は、ジヒドロキシナフタレン(DHN)γ-グルタミニル-4-ヒドロキシベンゼン、HGA、チロシン、カテコールから相当量のメラニンを生成することができる。メラニンを産生する内生菌の約80%の生息地は、アントラクティカでは、草本植物であるDeschampsia Antarctica Desv(イネ科)である。メラニン産生菌、例えばTrimmatostroma salinum、Hortaea werneckii、Aureo basidium pullulans、Phaeotheca triangularis、Cladosporium sp.などがサルタナに生息している[105]。メラニン産生菌の中には、産業廃棄物や都市廃棄物から発生する重金属や不飽和炭化水素で汚染された生息地に生息するものもある [92]。A. fumigatus は、ジヒドロキシナフタレン(DHN)メラニンを合成し、灰緑色をしている共子膜にメラニンを移動させる能力を持つことから、多くの病原体を抑制することができる。DHNメラニンはpksP遺伝子の産物であり、A. fumigatusを活性酸素中間体(ROI)から保護することが示されている。PksP はリソソームとファゴソームの融合を阻害し、A. fumigatus のコニディアを破壊することが明らかになっている [106]。Cryptococcus neoformans、Aspergillus fumigatus、Pneumocystis cariniietcは、メラニンを産生することが報告されている主要な真菌である[107]。真菌のメラニンは、光保護作用や抗酸化作用の他に、抗真菌剤、酸化剤、塩分濃度、干ばつ、重金属、熱、紫外線、電磁放射線などの生物学的、生物学的、放射線的ストレスに対する抵抗力を発揮することが可能である[106-108]。ヒトのメラニンは真菌のメラニンと構造的に類似しており、特に真菌であるクリプトコッカス・ネオフォルマンズから抽出されたメラニンは、転移性メラノーマに苦しむ患者の治療のためのモノクローナル抗体(mアミロイドβ)の産生に使用されてきた;このモノクローナル抗体はヒトのメラニンと結合することができる[98]。
組換えメラニンの産生
メラニンを生産するためには、野生型細菌と並んで多くの組換え細菌株が構築されてきた。大腸菌を宿主とし、放線菌ストレプトマイセス・アンチバイオティクスの特定の遺伝子をクローニングして発現させることで、初めての組換えメラニンを生産することができた。主に mel, ORF438S 遺伝子がメラニン産生に関与している[67]。大腸菌の改変株は、L-チロシンを摂取した後、培地中で30℃でユーメラニンを産生した[108]。L-チロシンエチルエステルや N-アセチル-L-チロシンなどの合成アミノ酸は、S. antibioticus チロシナーゼによるメラニン合成に利用されている[109]。大腸菌株 JM109 を用いて S. antibioticus の mel 遺伝子をクローニングし、転写にはファージ T5 プロモーターと lac オペレーターを用いた [67]。また、実験室での培養条件では、Streptomyces kathirae SC1 の組換え株を用いて melC 遺伝子の発現を調整することで、かなりの量のメラニンを産生することができた [93]。
ビタミンDとフーリンプロテアーゼのクロストーク
私たちの固有の免疫システムの機能は、ビタミンDの含有量に依存しており、それは順番に私たちの健康と幸福の保護につながる。前に議論したように、マクロファージは、細菌感染の間、TLRを介して、LPSに付着し、CYP27B1(1-α-水酸化酵素)とVDRの発現の増加につながる(図(図2)2.2)。ビタミンDのレベルが低い(30ng/ml未満)人は、年齢、性別、体重、人種、季節によって、ビタミンDレベルが十分な人に比べて、上気道の感染症が絶えないことを訴えている[32]。
VDRは脳細胞、骨髄、乳房細胞、骨格細胞、腸管細胞で発現している。このことは、カルシウムと骨の恒常性維持という確立された機能以外に、ビタミンDが果たすべき役割があることを示唆している[110]。他の経路(副甲状腺ホルモン処理、プロファクターIXなど)におけるフーリン(構成的分泌経路内に存在するユビキタスエンドプロテアーゼ)活性は、分泌経路内のカルシウムレベルとビタミンDの両方によってネガティブに制御されている[111-113]。フーリン活性の増加は、ウイルスの宿主細胞への侵入におけるTMPRSS2の役割を強化すると考えられている。ビタミンDによるネガティブな制御は、フーリン活性と関連するTMPRSS2の作用を低下させ、コロナウイルス感染の可能性を減少させる可能性がある(図7)。
図7 STRINGソフトウェアを用いて解析した様々なタンパク質間の関連付けの可能性を示す図
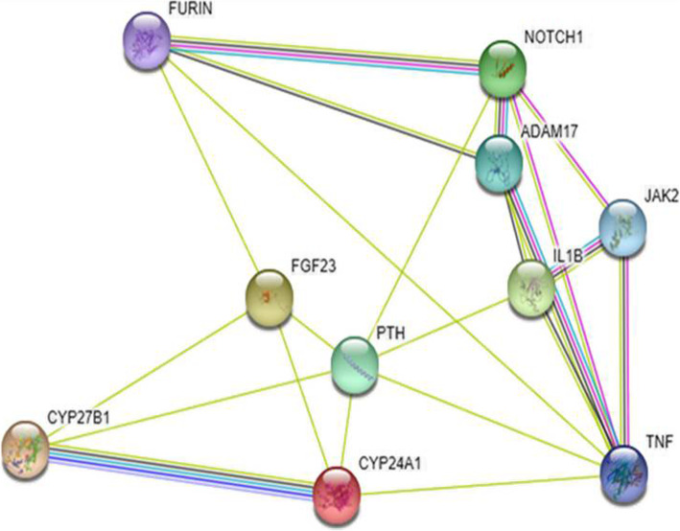
FGF23,CYP27B1,CYP24A1,PTH、FURINなどが主なノードを形成している。この図は、FGF23,CYP27B1,CYP24A1を含むビタミン代謝の重要性を示しており、最終的にはフーリンの調節が重要であることを示している。
結論と今後の展望
メラニンは、植物、微生物、動物細胞、半合成混合物などのバイオリソースをベースに、産業界で多くの潜在的な応用が期待される天然物に分類される有用なポリマーである。皮膚の色素沈着は、メラニンが7-デヒドロコレステロールと競合して紫外線を保持しているため、太陽光照射が少ない条件下でビタミンD3の産生を調節する主要な変数である。いくつかの検査では、ビタミンDの量が少ないと急性感染症への感受性の増加だけでなく、慢性感染症(HIV感染症など)との相関関係があることが示されている。ビタミンDのサプリメントを摂取することは、C型慢性肝炎や肺結核のようなウイルスや細菌によって引き起こされる病気の治療に対する反応を改善する可能性がある。肺の感染症を減らすためにビタミンDを使用して単独治療から得られる利益はなかった。抗ウイルス薬や抗菌薬と一緒にビタミンDを補給する必要があるかどうかは、よく定義されていない。紛れもなく、1,25(OH)2Dは多くの免疫調節作用を有しており、ウイルスによる呼吸器感染症のリスクを減少させる可能性がある。このレビューで議論されているように、この道筋の一つは、新規メラニン原性生物からバイオ抽出された天然メラニンの応用に基づいていると考えられる。我々は、ヒトの免疫を調節するためのビタミンDとD3の適用可能性をレビューしてきたが、これはビタミンD/D3をCOVID-19の治療に使用することを示唆している。我々は、3つの主要な問題を推測している-
- 第一に、ビタミンDは免疫を誘導する。
- 第二に、ビタミンDの産生はメラニンの影響を受けている可能性がある。
- 第三に、ビタミンDとメラニンの両方がCOVID-19の管理に大きな影響を与える可能性がある。
ビタミンD産生のために指定された量で使用するメラニン色素(オイメラニンまたはフェオメラニン)の適切なカテゴリーを決定すること、その体内での移動性、および初期の水酸化については、今後研究する必要がある。この短いレビュー論文が、COVID-19の治療の今後の経過を形作る上で有用であることを信頼している。
略語
AMPs 抗菌ペプチド
ARDS 急性呼吸窮迫症候群
COVID-19 新型コロナウイルス病2019
IFN I型インターフェロン
DOPA 3,4-ジヒドロキシフェニルアラニン
L-DOPA L-ß-3,4-ジヒドロキシフェニルアラニン
SARS-CoV-2 重症急性呼吸器症候群コロナウイルス2
CYP27B1 1-α-ヒドロキシラーゼ
ビタミンC Vit-C
ビタミンD ビタミンD
VDR ビタミンD受容体
CYP24 24-ヒドロキシラーゼ
TLR Toll様受容体
LPS リポ多糖類
TNF 腫瘍壊死因子
UV-B ウルトラバイオレットB
MRC メラノコルチン受容体
MSH メラノサイト刺激ホルモン
ACTH 副腎皮質刺激ホルモン
MHC1 主要組織適合性複合体(MHC)クラス1
Pcs プロホルモン変換酵素
TGN トランスゴルジネットワーク
TMPRSS2 膜貫通型プロテアーゼセリン2前駆体