Contents
Symptomatic amyloid‐related imaging abnormalities in an APOE ε4/ε4 patient treated with aducanumab
www.ncbi.nlm.nih.gov/pmc/articles/PMC7545921/
要旨
はじめに
アミロイド関連画像異常(ARIA)は、アミロイド標的抗体の用量依存的な作用であり、アポリポ蛋白E(APOE)ε4対立遺伝子との関連性が高いとされている。
方法
アミロイドおよびタウのポジトロン・エミッション・トモグラフィー(PET)を含む観察研究に登録され、ENGAGE臨床試験でアデュカヌマブを投与された66歳の白人男性(APOE ε4/ε4)の臨床経過と管理について述べた。
試験結果
急性症状は頭痛と脳症で、磁気共鳴画像ではARIA-EとARIA-Hが検出された。悪性高血圧とてんかん様症状に対して,ニカルジピンとレベチラセタムが投与された。その後、臨床的・画像的に悪化したため、メチルプレドニゾロンの投与を開始した。症状とARIA-Eは6ヵ月後に消失したが,ARIA-Hは持続した。間隔アミロイドPETの定量的解析では、既存の領域では信号が減少したが、後方では信号が増加し、タウPETでは全体的に信号が増加した。
考察
APOEε4/ε4患者において、ARIA症状は悪性高血圧とてんかん様活動を伴っており、ステロイドのパルス投与により浮腫が回復した。より大規模なコホートでの研究により,ARIAの最適な治療法と病態生理が明らかになるかもしれない。
キーワード:アデュカヌマブ,アルツハイマー病,アミロイド関連画像異常,アポリポ蛋白E,フロルタウシピル,FTP,ピッツバーグ化合物B
1. 序論
Aducanumabは、脳内のアミロイドβ(Aβ)凝集体に結合してこれを除去するモノクローナル抗体であり、アルツハイマー型認知症による軽度認知障害および認知症の治療薬として評価されている1。1 初期の臨床試験では、Aducanumabは、アミロイド陽電子放射断層撮影法(PET)で示される実質的なAβ凝集体を減少させたが、アミロイド関連画像異常(ARIA)は用量制限のある副作用であった。2 , 3
ARIAとは,基礎疾患である血管新生性浮腫(ARIA-E)や脳内出血(ARIA-H)に関連する画像所見のことで,ARIAのリスクはAβ凝集体に対する抗体のクラス効果であるとされている。4 , 5 , 6 aducanumabによるARIAは用量依存性であり、発生率の増加はアポリポ蛋白E(APOE)遺伝子のε4対立遺伝子(APOE ε4)と関連しており、これまでのAβ標的抗体の臨床試験と同様である。4, 5, 6, 7, 8 aducanumabの2つの第3相臨床試験では、最高用量(10 mg/kg)投与群の40%の患者に何らかのARIAが発生し、10%に症状が認められた。1
ARIAは抗アミロイド治療の結果として認識されているにもかかわらず、この現象の臨床経過と管理に関する詳細な報告はほとんどない。本稿では、脳アミロイドーシスが確認されたAPOEε4/ε4の退職神経内科医が、アデュカヌマブ投与後に重篤な症候性ARIAを発症した際の病歴、経過、管理、画像所見を報告する。
2. 方法論
2.1. 臨床検査と神経心理学的検査
カリフォルニア大学サンフランシスコ校(UCSF)における早期発症ADの観察研究の一環として、64歳と67歳の時に、白人男性の患者に神経学的評価と神経心理学的検査を行った。
2.2. 神経画像
磁気共鳴画像(MRI)はUCSFで,11C-Pittsburgh Compound B(11C-PIB)および18F-flortaucipir(18F-FTP)PETはLawrence Berkeley National Laboratoryで入手した。MRIは,早期アルツハイマー病に対するAducanumabの第3相試験(ENGAGE,NCT02477800)を通じて入手した。画像、処理、および参照領域の選択については、eMethodsに記載されている。
2.3. ヒト被験者の承認
研究への参加およびこの情報の公開について,患者から書面による同意を得た。UCSF、カリフォルニア大学バークレー校、ローレンス・バークレー国立研究所の機関審査委員会(IRB)が、PET研究を承認した。ENGAGEのIRB承認はUCSFで得られた。
研究の背景
システマティックレビュー。著者らは従来の方法で文献をレビューした。アミロイド関連画像異常(ARIA)は、アミロイド凝集体標的抗体の副作用として知られており、アポリポ蛋白E(APOE)ε4に関連しているが、臨床症状、経過、管理についての詳細な報告はほとんどない。
解釈している。ENGAGE試験でアデュカヌマブを投与した後に発症したARIAの重症例で,ARIAに伴う典型的な症状(頭痛,脳症,局所神経障害など)に加え,悪性高血圧とてんかん様活動が認められたが,最終的にはメチルプレドニゾロン,ニカルジピン,レベチラセタムの投与により症状が軽減した。認知機能障害と浮腫は6ヵ月間に渡って並行して消失し、後遺症はなかった。
今後の方向性 この新しい臨床現象の診断と適切な治療法を決定するためには、典型的なARIAと非典型的なARIAの症状、その後の経過と管理について、より大規模な臨床コホートからのさらなる記述が必要である。また,画像所見と症状を関連付ける詳細な研究により,ARIAの病態生理が解明されるかもしれない。
3. 結果
3.1. 臨床歴
この患者は、神経科医としての独自の視点を含め、ADの個人的な経験を以前に詳述している。9 簡単に説明すると、55歳の時に軽度の嗅覚障害があり、その後、61歳から軽度の記憶症状が現れたとのことである。62歳のときに神経内科を自主退職し、神経心理学的検査を受けたところ、遅延記憶と流暢性の生成課題に微妙な障害が認められた。その結果、軽度の認知障害と診断された(サポート情報の表S1)。
2015,64歳のときにUCSFの観察研究に登録したところ、APOEε4/ε4遺伝子型が明らかになり、MRIでは頭頂部と側頭中部の萎縮が最小限に抑えられていた(図1A)。11C-PiB PETでは、両側の前頭葉と楔前部を中心に信号が増加し、脳のアミロイド化が確認された(図1B)。18F-FTP PETでは、白質、基底核、脈絡叢にオフターゲット結合が見られ、左側頭葉では皮質の信号がボーダーラインとなっていた(図1C)。
図1 アデュカヌマブ/アミロイド関連の神経画像の前後の画像異常
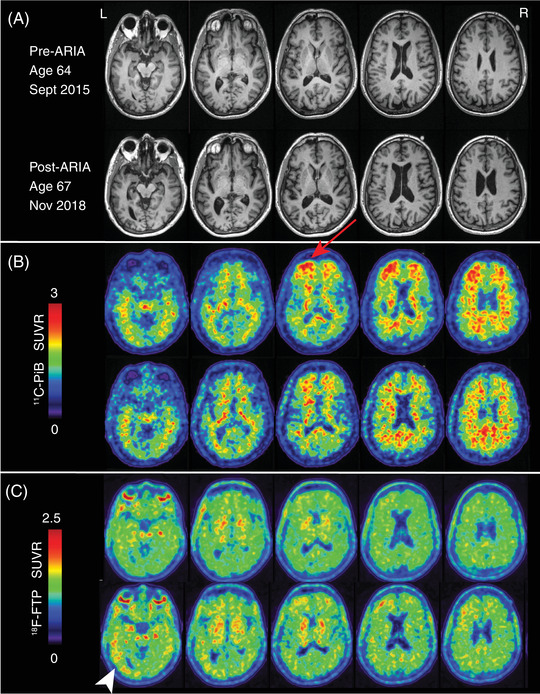
A, 2015年64歳時(上段)2018年67歳時(下段)に得られたT1シーケンス磁気共鳴画像。B, 2015年(上段)および2018年(下ロム)に得られた11C-Pittsburgh Compound B(11C-PiB)ポジトロン・エミッション・トモグラフィー(PET)赤矢印は左前頭葉で局所的に取り込みが増加している領域を示し、アデュカヌマブによるインターバル治療後に減少した。C, 2015年(上段)と2018年(下段)の18F-flortaucipir(18F-FTP)PET, 白矢印は左下側頭葉にある放射性物質の信号が増加した領域を示す。D, 11C-PiB(上段)と18F-FTP W-scoreマップ(下段)の定量的な比較で、健常対照者と比較して陽性のボクセルがあることがわかる
3.2. ENGAGE試験とARIA
2016,アデュカヌマブのENGAGE試験に登録し、試験の78週間はプラセボ群に無作為に割り振られたという。その後、オープンラベルエクステンションに参加し、目標用量の6mg/kgに向けてアップタイトレーションを開始した。アデュカヌマブ1mg/kgを月2回、3mg/kgを月2回投与したところ、その後、突然発症した爆発性の頭痛と変動性の混乱が生じ、失行を伴わないアレキシアと自己診断した。病院に来院し、集中治療室(ICU)に入院した際に収縮期血圧が206/116となり、ニカルジピンの点滴を受けた。血圧が安定し、脳症が消失した後、降圧剤を内服して自宅に退院した。
MRIでは,T2のFLAIR(fluid-attenuated inversion recovery)シーケンスにより,ARIA-Eに一致した局所的でコンフルエントな増感が認められ(図2A),感受性強調画像(SWI)により,ARIA-Hに一致した微小出血が認められた(図2B)が,いずれも左前頭葉と側頭頭葉に最大であった。さらに、造影剤を用いた検査では、血液脳関門(BBB)の破壊に一致する結節性の増強が認められた(図2C)。これらの領域は 2015年に実施された11C-PIB PETで高い放射性物質の取り込みを示していたことが注目された。
図2 アデュカヌマブによる治療後のアミロイド関連画像異常(ARIA)
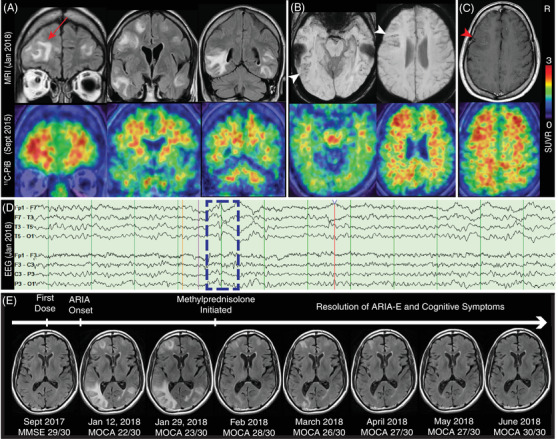
A, アデュカヌマブ投与後のARIA-Eを示すT2流体減衰反転回復(FLAIR)シーケンス(上)と 2015年の11C-Pittsburgh Compound B(11C-PiB)ポジトロン・エミッション・トモグラフィー(PET)(下)との比較;赤矢印は左前頭極のアミロイド高信号領域の浮腫を強調している。B, ARIA-Hを示す感応度強調画像(上)と2015年の11C-PIB PET(下);白矢印は左前頭葉および側頭葉の微小出血を示す。C, 2015年の11C-PIB PET(下)と比較した造影後のT1シーケンス(上);赤い矢頭は左前頭葉の結節性増強を示す。D, 左側頭部の鋭い波と後に続く遅い波(青の点線枠)を伴う脳波、T1,F7,T5,O1へのフィールドを持つT3で最大の電気陰性度を示す。E, 最大浮腫のレベルでの連続したT2 FLAIR、その後ステロイドの静注による治療で消失、認知機能の評価ではARIA-Eと並行して消失を示している。
約1ヵ月後、失行を伴わない失行症が悪化し、MRIを繰り返したところ、局所的な神経症状に対応して、左下側頭葉にFLAIR増多が認められた(図2E)。脳波では左側頭部に鋭い波が認められ(図2D),レベチラセタムの投与を開始するとともに,メチルプレドニゾロン1000mgを5日間静注し,経口投与による漸減は行わなかった。頭痛と失語症は消失し,追跡調査のMRIではARIA-Eの劇的な改善が認められた。モントリオール認知機能評価(MoCA)は、ARIA発症時に22/30であったが、6ヶ月間で30/30まで改善した(図2E)。
3.3. アデュカヌマブ/ARIA投与後の評価
2018,ARIAのエピソードから約1年後、彼は再評価のためにUCSFに戻ってきた。彼は高機能を維持していたが、語彙記憶の悪化と新たな顔認識の困難に気づいた。再度の神経心理学的検査では、安定した言語能力と視空間能力を伴う言語/視覚記憶の低下が認められた(表S1)。2015年に受けたMRI検査と比較すると、左後側頭頭頂領域で最も顕著な萎縮の進行が見られた(図1A)。11C-PiB PETでは 2015年と比較して、左前頭葉の皮質の放射性物質保持量が有意に減少し、楔前部で信号が増加した(図1B)。18F-FTP PETでは、左内側および外側側頭葉、右側頭葉、両前頭皮質、楔前部で軽度の増加が見られた(図1C)。各時点での11C-PIBの陽性度を健常者と比較して定量的に解析したところ、左前頭葉を中心に陽性ボクセルの総数が減少し、18F-FTPでは陽性度が増加したが、全体的な変化は軽度であり、疾患の初期段階を反映していると考えられた(図1D)。
4. 考察
アミロイド標的抗体であるアデュカヌマブは、脳アミロイドーシスのクリアランスに高い効果があると思われるが、この免疫介在性クリアランスは、APOEε4対立遺伝子を持つ患者に多く見られる血管原性浮腫や脳内出血(総称してARIAと呼ばれる)のリスクと関連している。APOEε4対立遺伝子を2つ持つ我々の患者では、ARIAの典型的な症状として報告されている症状(頭痛、脳症、および浮腫部位に関連する局所神経学的症状)に加えて、悪性高血圧およびてんかん様活動という重度の非典型的特徴があり、ICUへの入院が必要であった。退院後、症状の再発とARIAの悪化に伴い、メチルプレドニゾロンによる治療が行われ、その後6カ月間で症状とARIA-Eが効果的に消失したという。
2015年と2018年の観察研究のインターバルスキャンでは、アデュカヌマブの治療により、グローバルの11C-PiBシグナルが減少し、左前頭葉で有意に減少したが、撮影間隔が長く、アデュカヌマブの投与を4回しか受けていないことを考えると、注目に値する。2018年の検査では、11C-PiB信号が後部、特に楔前部で増加しており、これは、治療期間中にアミロイドが蓄積したか、治療中止後に再び蓄積したことを示唆している。18F-FTP PETでは、アデュカヌマブ投与前には最小限の信号が見られたが、全体的に信号の増加が見られ、主に左側頭葉で萎縮と一致しており、症状の悪化が報告されている。タウPETの信号を減少させるのに十分なアデュカヌマブの曝露が得られなかったのではないかと推測される。
興味深いことに、ARIA-Eと類似したMRI所見は、後退行性脳症症候群(PRES)と脳アミロイド血管症の炎症反応(iCAA)の両方で認められ、治療後に症状と同時に画像変化が消失するなど、臨床症状に大きな重なりがある。PRESでは、内皮傷害によりBBBが破壊され、悪性高血圧を伴うことが多いが、10 iCAAでは、血管内皮傷害は、血管内のAβを標的とした抗体または血管周囲のクリアランス経路への実質的なAβの動員の増加によって引き起こされ、ARIA-Eと共通の病態生理である可能性が示唆されている。11 ARIAにおける血管損傷の免疫介在性仮説を考えると、我々は、この患者の悪性高血圧は、自己調節機能の喪失による一次内皮機能障害に反応している可能性が高いと考えている。
今後、ADの治療に抗アミロイド抗体が使われるようになれば、ARIAに関連した症状の知識と対処法は、治療を行う臨床家にとって重要なものとなるだろう。また、APOEε4遺伝子型別によるリスク層別化は、治療方針の決定に役立つと思われる。モニタリングや治療に対する最適なアプローチを決定するためには、より大規模な臨床コホートによるさらなる研究が必要である。また、PETでのアミロイドやタウとARIAとの共局在、MRIでのCAAとの共局在などの追加研究により、これらの実体の関係が明らかになり、ARIAや関連する臨床症候群の病態生理についての洞察が得られるかもしれない。
利害の衝突
Adam L. Boxerは、NIH、Tau Research Consortium、Association for Frontotemporal Degeneration、Bluefield Project to Cure Frontotemporal Dementia、Corticobasal Degeneration Solutions、Alzheimer’s Drug Discovery Foundation、およびAlzheimer’s Associationから研究支援を受けている。また、Aeton社、Abbie社、Alector社、Amgen社、Arkuda社、Arvinas社、Asceneuron社、Ionis社、Lundbeck社、Novartis社、Passage BIO社、Samumed社、Third Rock社、Toyama社、UCB社のコンサルタントを務めており、Avid社、Biogen社、BMS社、C2N社、Cortice社、Eli Lilly社、Forum社、Genentech社、Janssen社、Novartis社、Pfizer社、Roche社、TauRx社から研究支援を受けている。その他の著者は利害関係を報告していない。Biogen, IncorporatedはENGAGE試験に資金を提供し、Avid Radiopharmaceuticalsは18F-Flortaucipirの前駆体の使用を可能にしたが、BiogenおよびAvidは著者に直接資金を提供しておらず、データの解析および解釈にも関与していない。バイオジェン社とAvid社は、投稿前に原稿を確認し、コメントすることができた。
