Contents
Sympathetic activation: a potential link between comorbidities and COVID‐19
www.ncbi.nlm.nih.gov/pmc/articles/PMC7405290/
要旨
コロナウイルス疾患2019(COVID-19)では、より高い罹患率および死亡率は、年齢、男性性、および慢性肺疾患、心血管疾患、高血圧、腎疾患、糖尿病、および肥満などの併存疾患と関連している。
上記のすべての状態は、肺、心臓、血管、腎臓、代謝、および/または免疫系に対する作用を介して、COVID-19患者に重大な有害な影響を及ぼし得る交感神経放電の増加を特徴とする。さらに、COVID-19はまた、血液ガスの変化(慢性間欠性低酸素、過呼吸)、アンジオテンシン変換酵素(ACE)1/ACE2アンバランス、免疫/炎症性因子、または感情的苦痛を介して、交感神経放電を増加させる可能性がある。
それにもかかわらず、交感神経系の潜在的な役割は、COVID-19の病態生理においてはまだ考慮されていない。交感神経の過剰活性化は、COVID-19と合併症との悪循環のメカニズムとして、今のところ過小評価されている可能性があると考えられる。
キーワード
自律神経系、COVID-19、糖尿病、心不全、高血圧、腎臓病、肥満、SARS-CoV-2、喫煙、交感神経活性化
要旨
加齢および併存疾患(肺、心臓血管、腎臓、および代謝性疾患)は、交感神経の過剰活動によって特徴づけられ、これは、コロナウイルス疾患2019(COVID-19)患者の肺、心臓、血管、腎臓、代謝、および/または免疫系に有害な影響を及ぼす可能性がある。
COVID-19は、低酸素、アンジオテンシン変換酵素(ACE)1/ACE2アンバランス、免疫/炎症性因子、および感情的苦痛を介して、交感神経の排出をさらに増加させる可能性がある。このように、交感神経の活性化は、COVID-19と併存疾患との間の悪循環のメカニズムとして、これまでのところ過小評価されている可能性がある。
略語
ACE1アンジオテンシン変換酵素型1ACE2アンジオテンシン変換酵素型2AngIアンジオテンシンIAngIIアンジオテンシンIIARDS急性呼吸窮迫症候群AT1-ランジオテンシンII型1 受容体COVID-19コロナウイルス疾患2019ILinterleukinMasRMas受容体MSNAmuscle交感神経活性化SARS-CoVsevere acute respiratory syndrom-coronavirusTNF-αtumor necrosis factor-α
序論
コロナウイルス疾患2019(COVID-19)では、より高い罹患率および死亡率は、慢性肺疾患、心血管疾患、高血圧症、腎疾患、糖尿病、および肥満などの併存疾患と関連している[1、2、3]。
逆に、COVID-19の死亡は、肺の損傷だけでなく、心臓、循環器、腎臓、および/または代謝の影響によって引き起こされる最終的なホメオスタシスの異常によって引き起こされることが多い。
交感神経の活性化は上記の合併症の特徴の一つであり、COVID-19患者に有害な影響を与える可能性があるにもかかわらず、交感神経系の潜在的な役割はまだ考慮されていない。
COVID-19における罹患率/死亡率の増加に関連するすべての併存疾患は、交感神経の過剰活性化によって特徴づけられる
交感神経放電の増加は、慢性閉塞性肺疾患、閉塞性睡眠時無呼吸症候群、心血管疾患(高血圧、心不全)、腎疾患、代謝障害(糖尿病、肥満、メタボリックシンドローム)と関連していることが広く知られている。末梢性低酸素化学感受性の亢進は、上記の病態における交感神経活性化を刺激する一般的な機序である[4, 5, 6, 7, 8, 9]が、他の刺激機序も存在する。
慢性閉塞性肺疾患や閉塞性睡眠時無呼吸症候群では、主に慢性間欠性低酸素を介して交感神経の活性化が亢進し、末梢の化学感覚反応を亢進させることで作用する[10, 11]。
心不全では、交感神経の流出量の増加は疾患の進行や予後不良と相関している[12, 13]。動脈/心肺圧反射の低下、化学感受性の亢進、代謝反射の亢進、または相関する腎不全や睡眠時無呼吸症候群の進行が原因であると考えられている[14, 15, 16]。
腎損傷(例えば、腎虚血再灌流の実験モデル)もまた、腎求心性および脳レニン-アンジオテンシン系の活性化に起因する交感神経の活性化と関連している。逆に正のフィードバックループでは、交感神経の過活動は尿細管Na+/H2O再吸収を刺激し、腎血流を低下させ、レニン-アンジオテンシン系を刺激する。また、それは、プロ炎症性機序を介して虚血/再灌流誘発性腎障害を悪化させる(文献[17]でレビューされている)。
肥満、糖尿病、メタボリックシンドロームでは、交感神経の過活動は、中枢および末梢の両方で交感神経の流出を刺激する高レベルの循環インスリンとレプチン、および/または閉塞性睡眠時無呼吸による慢性の間欠性低酸素症に起因すると考えられている[18, 19]。交感神経の過剰活性化はインスリン抵抗性を増加させ、正のフィードバックループを維持する[20]。
COVID-19に対する喫煙の影響はいまだに議論の余地が大きく、文献には相反するデータが存在する。疫学研究およびメタアナリシスでは、COVID-19入院患者における喫煙の有病率が予想外に低いことが報告されている[21]。逆に、他の著者は喫煙とCOVID-19入院患者の臨床進行および死亡率との有意な関連を観察しており、喫煙が肺機能に及ぼす有害な影響はよく知られている[22, 23]。たばこの喫煙は交感神経放電の増加と圧反射活動の低下をもたらすので、自律神経系の影響の潜在的な役割も評価の対象となりうる[24, 25, 26, 27, 28]。
交感神経の過活動はCOVID-19患者に重大な有害影響を及ぼす可能性がある
COVID-19では、交感神経活動の併存症誘発性亢進は、肺、心血管系、腎、代謝、および免疫/炎症性のホメオスタシスに負の影響を示すことがある。
COVID-19では、不整脈、心筋炎、心不全、心筋梗塞などの心血管系合併症が頻繁に起こる[29]。これらの状態はすべて交感神経の過剰活性化によってネガティブな影響を受けており、併存疾患によって誘発される交感神経の活性化がCOVID-19の罹患率/死亡率を増加させる可能性があることを示している。
いくつかの報告では、入院症例の20~40%で心筋損傷が報告されている[30, 31, 32, 33]。たこつぼ症候群の症例もCOVID-19で報告されている[34, 35, 36, 37]。この種のストレス関連心筋症では、心筋損傷は、おそらくカテコラミン誘発性血管痙攣および/または心筋細胞に対するカテコラミンの直接的作用によって媒介される。
特に、サイトカインストームに応答したカテコラミン放出、または代謝性および感情的苦痛がCOVID-19関連のたこつぼ症候群において役割を果たすことが提案されている[34, 35, 36, 37]が、我々の仮説と一致している。
急性腎障害は、重症または死亡したCOVID-19患者の20%以上で報告されており、慢性腎臓病もまた、重症COVID-19と有意に関連している[2]。さらに、交感神経の過活動と腎機能との間の悪循環に関与する上記のメカニズムは、心循環器[38、39]および肺[40]機能にも有害な影響を示す。
このように、交感神経の活性化はCOVID-19においても腎機能を介して負のホメオスタシス効果を発揮する可能性があると考えられる。さらに、COVID-19患者では肝障害も報告されており[41]、交感神経の活性化は肝機能にも有害である可能性がある[42]。
自律神経系は免疫系にも調節的な役割を果たしており、COVID-19の複雑な免疫学的状況における自律神経系の潜在的な役割はすべて研究されなければならない。交感神経線維は骨髄を含むほとんどのリンパ系器官に神経を供給し[43]、アドレナリン受容体は多くの異なる免疫細胞型に存在する[44]。免疫系に対する交感神経系の影響は非常に複雑で、免疫細胞の分化状態に依存する。
しかし、少なくともいくつかの組織や実験的または病理学的条件では、炎症を促進する効果についての証拠が得られている。例えば、アンジオテンシン(Ang)II介在性高血圧のマウスモデルでは、交感神経刺激はノルアドレナリン介在性T細胞活性化と血管炎症を引き起こす[45]。腎交感神経を両側から切除することで、AngII誘発性高血圧のマウスモデルにおいて、免疫活性化と腎炎症を防ぐことができる[46]。
カテーテルを用いた腎脱神経は、高血圧患者の単球活性化と炎症マーカーを減少させることが実証されている[47]。慢性ストレスの実験マウスモデルでは、交感神経線維によるノルアドレナリン放出に反応して、造血幹細胞の増殖、好中球および炎症性単球の出力増加が報告されている[48]。
脾臓神経を介した交感神経放電の増加は、脾臓細胞によるサイトカイン放出を増加させることも報告されている[49]。逆に、迷走神経はマクロファージによる腫瘍壊死因子α(TNF-α)放出を抑制する効果がある[50、51]。
副交感神経迷走神経系の抗炎症作用は、腸疾患[52、53、54]および関節炎[55]にも関連して観察されている。交感神経/副交感神経のアンバランスによるこれらの潜在的な免疫/炎症作用は、COVID-19の病態生理において特に興味をそそられるようである。
全身のホメオスタシスへの上記の影響とは別に、交感神経活動の亢進は呼吸器系に特定の有害な影響を及ぼす可能性がある。交感神経の過剰活性化および相関するレニン-アンジオテンシン系のオーバーフローは、肺高血圧症の進行において極めて重要な役割を果たしている[56, 57, 58]。アンジオテンシン変換酵素(ACE)1/ACE2の不均衡が、肺血管収縮、炎症、酸化的・線維化的損傷を介してCOVID-19患者の急性呼吸窮迫症候群(ARDS)への進行に寄与する可能性が指摘されている[29]。
交感神経の神経支配は、肺毛細血管の漏出を増加させ、ARDSに有利であることが知られている[59, 60, 61, 62]。肺機能の制限は、心不全における交感神経活動の亢進と関連しており、おそらく間質性肺水腫または肺胞毛細血管単位の変化が原因であると考えられている[63]。
加齢や男性の性別も交感神経活動と関連している
重度のCOVID-19および関連する死亡率のリスクは、交感神経の活性化と同様に、年齢および男性の性別の上昇とともに増加する。実際、筋交感神経活性(MSNA)は、非肥満の正常血圧の男性と女性では年齢とともに増加することが報告されており、後者は50歳未満では低い値を示している[64]。
逆に、小児は重症化すると保護されることが知られている;様々なメカニズムが関与していると思われるが(免疫の発達変化、併存疾患の有病率の低下、肺の再生能力の向上)、交感神経/副交感神経バランスの非常に複雑な成熟の役割の可能性を排除することはできないかもしれない。
例えば、主に交感神経終末に由来する血漿ノルエピネフーリンは、男性では思春期が進むにつれて増加する [65]。肥満による交感神経活動の亢進には、関連する性差が存在する。例えば、安静時MSNAは男性では体重指数と正の相関があるが、女性ではない[66, 67]。
この性別による違いは、交感神経の過剰活性化が皮下脂肪よりも腹部脂肪との相関によって部分的に説明されている[68]。したがって、交感神経の活性化の亢進は(少なくとも部分的に)、COVID-19の罹患率/死亡率と加齢および男性性の病態生理学的関連に寄与している可能性がある。
COVID-19は悪循環の中で交感神経出力をさらに増加させる可能性がある
交感神経系は、呼吸機能障害を特徴づける低酸素刺激やハイパーカプニック刺激によって活性化される。特に、慢性的な間欠性低酸素は頸動脈体感度の上昇を介して交感神経出力を増加させることが多くの研究で強調されている。したがって、COVID-19による呼吸機能の変化は、交感神経の過剰活動をさらに悪化させる可能性がある(図1)。
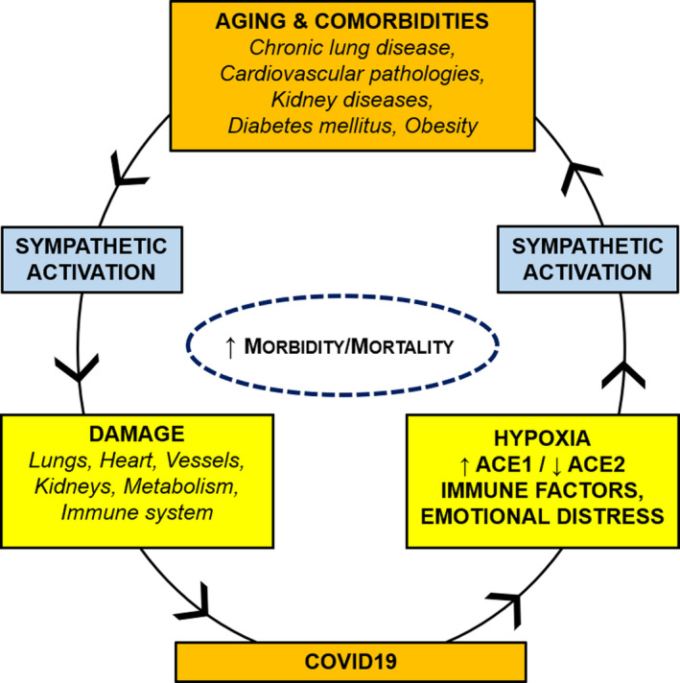
図1
COVID-19と併存疾患との悪循環。加齢と併存疾患(肺、心臓血管、腎臓、代謝性疾患)は交感神経の過活動を特徴とし、COVID-19患者の肺、心臓、血管、腎臓、代謝、免疫系に有害な影響を及ぼす可能性がある。COVID-19は、低酸素、ACE1/ACE2アンバランス、免疫/炎症性因子、および感情的苦痛を介して、交感神経の排出をさらに増加させ得る。
COVID-19はまた、AngIIの産生および放出の増加を介して交感神経系を活性化する可能性がある。重症急性呼吸器症候群コロナウイルス(SARS-CoV)およびSARS-CoV-2の細胞受容体は、アンジオテンシン変換酵素の通常膜結合型ホモログであるACE2である。ACE2は肺だけでなく、心臓、脳、腎臓、腸など他の臓器にも広く発現している。
ACE1とACE2では酵素の働きが異なり、異なる効果を発揮する。ACE1はAngIをAngIIに変換し、ACE2はAngIをAng(1-9)に変換し、Ang(1-7)に変換し、AngIIをAng(1-7)に変換することもある。このように、異なる組織では、2つの経路[ACE1/AngIII/アンジオテンシンIII型受容体(AT1-R)とACE2/Ang(1-7)/Mas受容体(MasR)]の間のバランスが存在しており、これは様々な臨床状態で影響を受ける可能性がある。
その結果、ACE2はAng(1-7)に有利にAngIIの産生を減少させる。AngIIはAT1-R結合を介して血管収縮、線維化、肥大、炎症を媒介し、Ang(1-7)はMasR結合を介して血管拡張、抗線維化、抗成長、抗炎症を媒介する[4]。
上記の作用とは別に、AngIIは交感神経興奮を媒介し、Ang(1-7)は交感神経抑制を媒介している。SARS-CoV-2の内部化はACE2活性の阻害と膜結合型ACE2の漸進的な枯渇を引き起こし[69, 70, 71, 72, 73]、ACE1/ACE2の不均衡とAngIIの増加を伴う。
循環中のAngIIは、中心的には円周臓器(後胸部および産道下臓器)[58]のレベルで、そして末梢的には頸動脈体に作用して交感神経出力を増加させる可能性がある[58, 74]。したがって、COVID-19によって誘発されるAngIIの増加(ウイルス負荷に比例する)[75]は、併存疾患における交感神経活動をさらに悪化させる追加的な方法を表している可能性がある。
さらに、脳幹、特に孤立路核は異なるタイプのコロナウイルスによって直接侵襲されるため、SARS-CoV-2による神経侵襲も仮説されている[76]。ACE2は孤道核や頸動脈にも発現しているため、局所的なACE1/ACE2アンバランスやAngII刺激によって交感神経の活性化がさらに亢進する可能性がある。
COVID-19重症患者では、「サイトカインストーム」[インターロイキン(IL)-6、IL-10、およびTNF-α]の発生が報告されている[77]。AngIIはまた、マクロファージや他の免疫細胞を活性化して、IL-6、TNF-αなどの炎症性サイトカインを産生する可能性がある[78、79、80]。循環サイトカインは主にいわゆる炎症性反射経路を介して副交感神経系を活性化するが、特定の条件下では交感神経出力の刺激も報告されている[81]。
COVID-19の心血管への影響についての議論の中で、Guzikら[82]は最近、交感神経系の活性化がウイルス感染そのもの、さらには社会的孤立と関連していることを想起している[83, 84]。
結論
結論として、COVID-19患者の罹患率/死亡率の増加に関連するすべての併存疾患は、加齢や男性性と同様に交感神経の過活動化によって特徴づけられる。交感神経の過剰活性化は、肺、心臓、血管、腎臓、代謝、および/または免疫系に対する作用を介して、COVID-19患者に著しい有害な影響を及ぼす可能性がある。
さらに、COVID-19は、血液ガスの変化(慢性間欠性低酸素、過呼吸)、ACE1/ACE2アンバランス、またはサイトカイン放出を介して、交感神経の排出をさらに増加させ得る。このように、交感神経の過剰活性化は、COVID-19と併存疾患との間の悪循環の根底にある、これまでのところ過小評価されていないメカニズムである可能性がある。
最後に、COVID-19の臨床経過は、異なる進化の段階と個人の反応の異質さによって特徴づけられることを心に留めておかなければならない。
