Contents
第7章 腫瘍の抵抗力、EMT、自己増殖力
Chapter 7 TUMOR RESISTANCE, EMT and AUTOPHAGY
はじめに
癌に宣戦布告して治療を開始すると、腫瘍は反撃してく。腫瘍の広がりが大きければ大きいほど、その反撃は強力である。
これまで述べてきたように、腫瘍の大部分を攻撃すると、ヘッジホッグ、WnT、NOTCHの3つの主要なシグナル伝達経路を通じて癌幹細胞を刺激することにより、抵抗性が生じることが多い。手術、化学療法、放射線療法を腫瘍に行う際には、必ずCSC集団への刺激を打ち消すための再処方薬カクテルを加える必要がある。
しかし、このCSC以外にも、腫瘍はオートファジーとEMTという2つの方法で反撃してく。オートファジーは、栄養が不足すると刺激される。がん患者が絶食したり、低血糖食を食べたり、メトホルミンを追加したりすると、腫瘍は代謝的にストレスを受ける。グルコースを利用する能力が低下し、飢餓状態に陥って死に至る危険性がある(アポトーシス)。これが我々の望むことである。
ジェーン・マクレランドは、『飢餓癌』という本の中で、癌から栄養を奪うことで癌を克服する方法を紹介している。メトホルミンは、がんが好んでグルコースを無駄に使用するワーグブルク代謝を阻害することで、がんを薬漬けにする。先に説明したように、癌は単に調整し、他の形態の代謝を使い、あるいはタンパク質や脂肪を処理することを学習する。
メトホルミン、脂溶性スタチン(リピトールのような)、アスピリン、ジピリダモール、糖質制限、絶食などを組み合わせて、これらの代償経路を遮断すれば、腫瘍はストレスを受けることになる。腫瘍は必要なことをするだろう。
腫瘍の脱出を阻止する
- オートファジーを阻止する * クロロキン/ロラチジン
- ワーグブルクの阻止 * メトホルミン/ベルベリン
- ブロック リバース・ワーグブルク * メトホルミン/DCA
- アポトーシス/酸化を誘導する * パルス状クロロキン/NSAID/ビットC
多くの場合、この時点でがんはオートファジーという保護プロセスによって反撃する。リソソームを使って死んだ細胞の残骸を集め、燃料を再利用するのである。これは、飛行機事故の生存者が、死んだ仲間を共食いさせて試練を乗り越えるのとあまり変わらない。癌細胞はまた、逆ワーグブルクプロセスで乳酸のような栄養分をリサイクルする。腫瘍細胞は基本的に、より多くのエネルギーを得るためにゴミを燃やし、燃料を節約しているのである。
しかし、クロロキンやヒドロキシクロロキンのような再利用可能な薬を使うことで、オートファジーを阻害し、アポトーシスを起こしてがん細胞を死滅させることができる。しかし、EMTもブロックしなければ、戦争に勝つことはできない。
CSC + TGF-β = EMT(転移)という公式を思い出してほしい。腫瘍がCSCとコミュニケーションをとることを絶対に許さず、TGFとmTORのデュオをブロックするよう常に努力してほしい。
メトホルミン、クロロキン、一晩の断食と低血糖食の組み合わせは、P13 K mTOR経路をブロックするのに威力を発揮する。メトホルミンとクロロキンの2つの薬は、オートファジーの遮断にも役立つ。128 ロラティジンもオートファジーを低下させる。しかし、腫瘍の大部分を死滅させなければならないことも忘れてはならない。そのためには、手術、化学療法、放射線療法などの標準的な治療を行うのが理想的である。
デバルキング、P13 mTORの阻害、オートファジーの阻害の3点セットは、腫瘍の脱出を阻止する上で良い戦略である。Jane McLellandはさらに一歩進んでいる。彼女は、NSAIDsの使用とともに、ビタミンCを酸化剤として静脈内投与し、アポトーシスと呼ばれる癌細胞の死を周期的に起こしている。また、高圧酸素で酸素を供給する人もいる。経口のビタミンCサプリメントは、点滴のように酸化しない。
薬剤や食生活の改善で癌を弱らせた後、癌を酸化させたこともジェーンが生き延びた理由の一つである。周期的またはパルス的にビタミンCを点滴したことが、彼女の戦争勝利の決め手になったのかもしれない。クロロキン(クロロキン)とヒドロキシクロロキン( ヒドロキシクロロキン)はともに強力なアポトーシス誘導剤である。後日、腫瘍が最も脆弱な重要な時期にクロロキン/ ヒドロキシクロロキンやNSAIDSをパルス投与することについて説明する。
標準的な治療を受ける際には、CSCをターゲットにした再利用可能な薬剤やサプリメントも同時に使用したいものである。治療の初期に行われることが多い化学療法や放射線療法は、CSCを誘発する可能性があるので、この時期にカクテルを追加することが最も重要だ。これにより、耐性の発生を防ぐことができる。P13のmTORをブロックする、TGFをブロックするなどの抗EMT戦略、NSAIDSやクロロキン/ ヒドロキシクロロキンなどの薬剤を使うなどの抗オートファジー戦略は、スマートで戦略的である。
***
これまで見てきたように、急速に成長する腫瘍から幹細胞のルートへのシグナル伝達は、3つの主要なドライバーによって行われる。ヘッジホッグ(Hh)WnT、NOTCHである。これら3つのドライバーが一体となって、急速に成長する腫瘍の大部分(例えて言うならば癌の木)と地下にある根、すなわち癌幹細胞(CSC)との間のコミュニケーションリンクを形成する。
癌軍団の将軍であるCSCは、通常は眠っているが、腫瘍塊が攻撃されているという信号で目を覚まする。手術、化学療法、放射線療法などで腫瘍が攻撃されると、Hh、WnT、NOTCHが助けを求める。CSCの将軍たちは行動を開始し、EMT、転移、そして新たな抵抗性腫瘍の成長を引き起こす。
図2 WnT、NOTCH、ヘッジホッグをブロックしてがん幹細胞を狙う
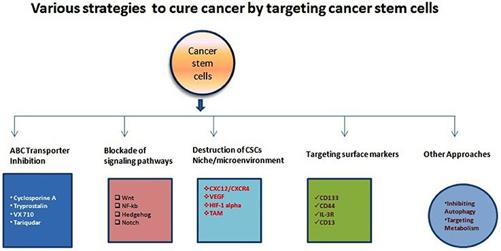
幹細胞とTGF-βを合わせて、EMTや転移拡大の2大ドライバーとしている。CSCは、成長して分裂し、自分自身を複製したり、完全な腫瘍組織を作ったりすることができる。CSCはまた、ほとんど魔法のように、固定された上皮細胞を間葉系細胞(または自由に浮遊する細胞)に変え、移動した後、再び魔法のように上皮細胞に戻り、再び固定することができる。
これらの細胞は全く新しい腫瘍コロニーに成長する。腫瘍(バルク)は急速に分裂しており、自分のすぐ前では成長因子を分泌している。癌の前面には、癌幹細胞と間葉系組織が豊富に存在する。腫瘍の前の部分、つまり腫瘍微小環境には、上皮成長因子であるEGFだけでなく、より多くのCSCとEMTの成長を促すTGF-βが多く含まれている。EGFは多くのがんを促進し、乳がんやグリオーマでは悪名高い。129 標的療法としては、成長因子の作用を阻害するセツキシマブ(化学療法)のようなEGF受容体に対する抗体がある。当然のことながら、これに対する耐性は早く発現する傾向がある。
解糖系やワールブルグ代謝を好むため、腫瘍は低酸素、低pHを呈し、他の成長因子が産生されるようになる。さらに、血管の供給が不足しているため、血管新生が促される。新しい血管が形成され、腫瘍にサービスを提供する。
血管は、物資を運び、老廃物を運び出す道路のようなものと考えることができる。血管は、腫瘍がより早く成長するのを助ける。低酸素状態になると低酸素誘導因子(HIF)が分泌され、プロジェクトエンジニアに道路を増やすように指示する。HIFはVEGF(血管内皮増殖因子)を刺激し、がんに栄養を与える血管を迷路のように増やしていく。
腫瘍の微小環境
前進する腫瘍の前線は、ワーグブルク乳酸が豊富で、血液の供給が乏しい。腫瘍は、酸素不足の不毛な微小環境の中で生きている。ワーグブルク代謝は、効率的な細胞炉であるミトコンドリアで行われないため、無駄が多いことを思い出してほしい。その代わりに、発酵プロセスで行われる。これにより酸素が消費され、腫瘍周辺は低酸素状態となり、酸性になる。酸と低酸素は、HIFの放出を促し、VEGFと新しい血管の成長を促し、腫瘍を静脈と血液で膨らませる。
VEGFを攻撃するモノクローナル抗体が開発されたことは、がん治療における大きなブレークスルーとなった。ベバシズマブとして知られるアバスチンは、VEGFに結合し、その活性を阻害することで血管新生を抑制し、腫瘍の成長を止める可能性のある遺伝子組み換えモノクローナル抗体である。この抗体は、私の友人であるエヴァンの膠芽腫を含む多くの癌に効果がある。しかし、他の化学療法と同様に、この薬にもいくつかの副作用があり、中には重篤なものもある。さらに、耐性ができることもあり、VEGFを阻害する再利用可能な薬剤を追加することが重要だ。また、血小板由来の成長因子も補助する。
血管新生をブロックする
- VEGFをブロック * 抗VEGF抗体。アバスチン
- EGFをブロック * プロプラノロール、イトラコナゾール
- PDGFをブロック * クルクミン、レスベラトロール
* セツキシマブ
* アスピリン、ジピリダモール
EGF、HIF、血管新生の間で、腫瘍前面が前進する。VEGFと血小板由来成長因子(PDGF)の両方を阻害できる再利用された薬剤には、アスピリンとジピリダモール(すなわち、Jane’s cocktail)がある130。これは、腫瘍コロニーの特殊な性質によるもので、主に腫瘍結合組織の構成要素である特殊な線維芽細胞によるものである。血小板由来の成長因子であるPDGFは、線維芽細胞の成長を誘導する。
TAFとTAMが道を開く
TAF(腫瘍関連線維芽細胞)は、MMP(メタロプロテアーゼ)をはじめとする様々な物質を分泌し、腫瘍の道を切り開くのに役立つ。免疫細胞であるTAM(腫瘍関連マクロファージ)は、炎症を助長し、腫瘍の成長とVEGFを強力に刺激する。
これらの成長因子はすべて、低pH、低酸素、高血管、硬い、炎症を起こしているため、腫瘍周辺の局所領域を癌になりやすい状態にしている。このような状態に対抗する再販薬としては、セレブレックなどのCOX-II阻害剤やイブプロフェンやナプロキセンなどのCOX一般阻害剤などのNSAIDがある。これらは炎症を抑えることができる。高気圧酸素による治療は,02レベルを上昇させ、腫瘍が好む環境に対抗することができる。
マトリックスメタロプロテアーゼの阻害と炎症の抑制
- マトリックスメタロプロテアーゼをブロックする * メベンダゾール、ドキシサイクリン
- 炎症をブロック * アスピリン、プロプラノロール
* NSAIDS (Celebrex, Ibuprofen)
* ポリフェノール(コーヒー、緑茶)
MBZとドキシサイクリンは、MMPをブロックするのに役立つ。132 私は、ドキシサイクリンとMBZの組み合わせを気に入っているが、プロプラノロールとアスピリンも効果的である。私はいつも患者に、食事やライフスタイルが炎症に果たす役割を忘れてはいけないと言っている。内臓脂肪、つまりお腹の脂肪は、インスリン抵抗性のある人や太っている人の場合、マクロファージが炎症性サイトカインであるインターロイキン6や組織壊死因子αを放出するきっかけとなる。これらは、がん発症のリスクを大きく高める。
コーヒーやクロロゲン酸などの植物性ポリフェノールには、強い抗炎症作用がある133。コーヒーは、炎症を抑えるだけでなく、食欲も抑えてくれるので、両方をコントロールすることで、インスリン抵抗性とお腹の脂肪を抑えることができる。炎症レベルが上昇しているかどうかを知るにはどうすればよいであろうか。CRP(C-reactive protein)の値を調べてみてほしい。これは簡単な血液検査である。この数値が0.5以下であることが重要だ。
HAMPT 手術後の転移を防ぐ
Wan博士らは、HAMPTと呼ばれる再利用可能な医薬品を開発した。彼らは、「アスピリン、リジン、ミフェプリストン、ドキシサイクリンを併用することで、効果的かつ安全にがんの転移を予防・治療することができる」と書いている134。このカクテルは、CSCとEMTのプロセスを標的として設計されている。ミフェプリストンは、プロゲステロン受容体拮抗薬で、一般的には人工妊娠中絶薬として使用されている。
ミフェプリストンは、様々なヒトの癌に対して細胞毒性を示する。腫瘍の浸潤、移動、血管新生を阻害する。また、TGF-βを阻害する。ある研究では、ミフェプリストンが複数の大腸細胞株のEMTによる広がりを阻害することが示された135。
科学者たちは、胚着床を阻害するこの薬のメカニズムと、腫瘍の転移との間に類似性を見出した。また、14年という長期間にわたって使用されてきた安全性の高い薬剤である。アスピリンはCOX-IIとプロスタグランジン経路を阻害する。大腸がん患者の生存率を向上させる136
HAMPT 4 カクテル
- アスピリン
- ドキシサイクリン
- ミフェプリストン
- リジン
1日75~325mgの低用量で、MMP-2(メタロプロテアーゼ-2)を阻害することにより、抗転移作用を助ける。また、EMTをダウンレギュレートし、血小板を介したNF-κB(核内因子カッパB)を低下させる。NkfBは、炎症を増強し、がんに対する免疫反応を抑制する。NkfBは、ほとんどの場合、腫瘍増強因子であるが、まれにTGFβと同様に、腫瘍抑制因子として機能することがある。
アスピリンは、NKfBをブロックすることに加えて、血管の接着と浸潤を抑えることができる(VEGFをブロックする)。アスピリンの長期使用は、遠隔転移を約30〜40%減少させ、転移性腺癌のリスクを約50%減少させることが示されている137。
ドキシサイクリンは40年以上前から使用されている抗生物質である。ドキシサイクリンは40年以上前から使用されている抗生物質で、安全性が高く、比較的毒性が低いとされている。ドキシサイクリンは強力なMMP阻害剤であり、様々な場面でがんの骨転移を抑制・予防することが古くから知られている138。
リジンは、MMPを阻害するアミノ酸で、腫瘍に優しい酸環境を破壊する働きがある。腫瘍微小環境を緩衝する。リジンは、細胞モデルにおいて転移を抑制した。139 HAMPT併用療法を用いた臨床試験は行われていないが、Wan博士らは、がん患者が原発巣を外科的に除去した後に使用する転移予防戦略として妥当であると感じている。
進化したカクテル EIS
EISは、米国の医師Richard Kast氏らが開発した再利用薬カクテルである。140 ピルフェニドン、ナプロキセン、リファンピン、クエチアピン、イトラコナゾール、メトホルミンの6種類の薬剤を組み合わせて、膠芽腫のEMTトランスフォーメーションを阻害する。
1つ目の薬剤はピルフェニドンで、最初は線維症の治療薬として承認された忍容性の高い薬剤である。ピルフェニドンは、上皮から間葉転換(EMT)の主要な要因であるTGF-βシグナルを阻害する。
転移や腫瘍の広がりに関する私の公式を思い出してほしい。CSC + TGF-β = EMT(拡散)。これを簡単に考えると、転移を防ぐにはCSCとTGF-βの両方をブロックする必要があるということである。共通するのは、ヘッジホッグ、WnT、NOTCHを介したコミュニケーションネットワークである。
ピルフェニドンは、炎症性サイトカインであるTNF-αを阻害するという利点もある142。また、C型肝炎ウイルスの慢性感染症患者の腫瘍転移を刺激するPDGFも阻害する。
また、C型肝炎ウイルスに慢性的に感染している患者の腫瘍転移を刺激するPDGFも遮断する。がんでは、サイトカインであるインターロイキン6とTGF-βがともに上昇する。ピルフェニドン(400mgを1日3回)を2年間投与したところ、インターロイキン6とTGF-βのレベルがともに約50%低下した143。
RANKは、NOTCHシグナルに関与するSNAILの活性を高め、CSCとEMTの主要な刺激因子となる。GBMはRANKを分泌し、これがEMTとグリオーマ細胞の移動を促進する。
RANKは、乳がん、肝細胞がん、子宮内膜がん、肺がん、前立腺がんなどで過剰に発現している。145 クエチアピンは、RANK経路の遮断に役立つ。EIS療法は、RANKとTGF-βを介した成長の両方を標的としている。
3つ目の薬剤であるリファンピンは、もともと結核や耐性黄色ブドウ球菌の治療に用いられていた抗生物質である。リファンピンは、ピロリ菌感染症やハンセン病の治療にも使用されている。リファンピンは、強力なWnTシグナル伝達経路を阻害することで、抗EMT活性を発揮することができる146。
WnTのアップレギュレーションは、GBMの標準的な治療法であるTMZによる化学療法のいずれかに反応して生じる。WnTは、がん幹細胞にシグナルを送り、EMTの変化を引き起こし、TMZと放射線治療の両方に対する耐性を生み出する。理論的には、リファンピンはTMZと放射線の両方に対する治療抵抗性を低下させることが期待されている。
EIS SIX カクテル
- ピルフェニドン
- ナプロキセン
- リファンピン
- クエチアピン
- イトラコナゾール
- メトホルミン
ナプロキセンは、COX阻害作用のある非ステロイド系抗炎症薬としてよく使用されている薬剤である。インターロイキン6は、EMTのコファクターとしてがんを促進する。GBM細胞は、腫瘍増殖因子としてインターロイキン-6(Il-6)を産生する。ナプロキセンはIl-6のレベルを低下させる。古くからある抗真菌薬であるミコナゾールは、Hhシグナルを強力に阻害する。147 Hhをダウンレギュレートすることで、転移を抑制することが示されている。Hhは、標準的な化学療法によってアップレギュレートされ、同様にEMTを刺激する。
また、SNAIL経路との相互作用もある。イトラコナゾールは、その両方をブロックするのに役立つ。148 Hhシグナルを阻害することで、乳がん、メラノーマ、子宮内膜がんの成長を抑制することが示されている。
最後に紹介する6つ目のEIS薬剤は、複数の作用機序を持つため、ほとんどのがん治療薬に含まれている。先に述べたように、この薬剤はがんを予防することも殺すこともできる。CSCに対する作用も優れているので、抗転移の組み合わせとしては当然の選択である。それがメトホルミンである。
メトホルミン:EMTの新星
メトホルミンは 2013年にBarriere博士と共同研究者によって「腫瘍学におけるEMTと戦う新星」と呼ばれた149。
メトホルミンには、AMPキナーゼを上昇させ、P13K経路に沿ってmTORをダウンレギュレートするなど、多くの抗腫瘍作用がある。
腫瘍のミトコンドリアのエネルギー処理(OXPHOS)を妨害する。メトホルミンはまた、非小細胞肺がん(NSCLC)におけるTGF-βによるEMTを抑制する150。
メトホルミンによるEMTの抑制
- mTOR/P13/Aktの減少 * AMPKの上昇による
- NOTCHシグナルの減少 * SNAIL-2の低下による
- TGF-βの減少 * SNAIL-2の低減による
- インターロイキン6の減少 * 非小細胞肺がん
- 化学療法/放射線療法抵抗性の軽減 * SNAIL-2の低下による
- 化学療法の効果を高める * 5-FUおよびシスプラチン
- 化学療法効果の回復 * テモゾロミド(TMZ)
SNAILの活性と子宮頸がんのEMTを阻害する。151 NOTCHはSLUGやSNAILと呼ばれるEMT関連遺伝子を制御し、EMTの過程で転移がんの拡大を促進する。メトホルミンは、SNAILとSLUGの両方を減少させることができる。SNAILとSLUGは総称してSNAIL-2と呼ばれている。メトホルミンはまた、SNAILとSLUGの両方の経路を介して、放射線誘発EMTと化学療法誘発EMTをブロックするのに役立つ152。ドセタキセルによる標準的な化学療法は、残念ながら、転移関連のMMP-9を刺激するが、メトホルミンはこれを部分的に逆転させる153。
図3 メトホルミンは主要ながんのパスウェイをブロックする。
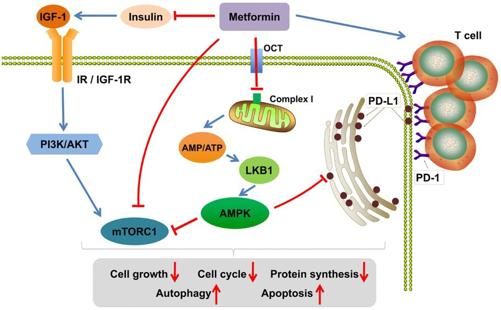
メトホルミンは、SNAIL-2を減少させることにより、TGF-βにさらされた肺癌および腺癌細胞のEMT変化を減少させる154。TNBC、トリプルネガティブ乳癌は、TGF-βのレベルが高い。メトホルミンはTNBCのTGF-βを阻害し、細胞の増殖、浸潤、運動性を低下させる155 メトホルミンは、AMPKの活性化を介して、エストラジオールにより誘発される子宮内膜腺腫のEMTを逆転させ、TGF-βを低下させる156。
メトホルミンは、NSCL癌ではインターロイキン-6を低下させ、前立腺癌ではTGF-βを低下させ、両者のEMTの抑制に寄与している157。
158 メトホルミンは、神経膠腫の細胞株に対して、化学療法剤であるソラフェニブと一緒にアポトーシス(がん細胞死)を促進した159。
159 メトホルミンは、試験管内試験(組織培養)でグリオーマ細胞の殺傷に相乗効果を発揮した。わずか数日間メトホルミンにさらされただけで、TMZ治療に対する感受性が回復した。160 メトホルミンはまた、多くの癌における化学療法抵抗性を回復させる。
GBMの友人であるEvanは、すでにCare Oncology Clinicの試験に参加しており、標準的な治療に加えて、メトホルミン、アトルバスタチン、ドキシサイクリン、メベンダゾールからなる基本的な4剤併用療法を受けている。標準治療では、放射線治療とテモゾロミド(TMZ)による化学療法を行っている。また、VEGFブロッカーであるアバスチンの投与も受けている。残念ながら、彼の腫瘍は大きすぎて取り除くことができず、手術不可能と考えられている。
そのため、この恐ろしい腫瘍に打ち勝つチャンスを得るためには、GBMを攻撃するために調整された、より多くの経路を遮断する先進的なカクテルが必要なのである。
そこで、CUSP-9カクテルを序論する。
このカクテルは、がん研究者のリチャード・カスト博士が、27人の科学者とともに 2013年にGBMを消滅させるために開発した9種類の薬の組み合わせである。CUSP-9とは、「再利用された9種類の薬剤で生存経路を協調的に損なわせる」という意味の略語である。Kast博士らは、この7年間、追加のデータを収集し、有望な結果を得ている161。
Kast博士が発見した後、このカクテルは多くの人がコンパッショネートユースの設定で適用した。Skaga と Skaga は、実験室でテストされるまでは、GBM 生存者の間で流通していた民間療法であると述べている。
CUSP-9 GBMカクテル
CUSP-9は、膠芽腫に使用する9種類の薬剤のカクテルである。これは先進的なカクテルである。ケアオンコロジークリニックがMETRICS試験で使用した4剤のカクテルのような基本的なカクテルは、膠芽腫患者の生存期間を2倍にするという大きな成果を上げている。HAMPTやESISの6剤併用療法など、より高度なカクテル、すなわち第二世代の併用療法は、複数のグリオーマ経路を標的として設計されている。
CUSP-9戦略は、GBMの標準的な化学療法であるTMZと、再利用された9種類の薬剤を組み合わせたもので、お気に入りの組み合わせの1つである。アプレピタント(Aprepitant)、オーラノフィン(auranofin)、カプトプリル(Captopril)、セレコキシブ(Celecoxib)、ジスルフィラム(disulfiram)、イトラコナゾール(itraconazole)、ミノサイクリン(minocycline)、クエチアピン(Quetiapine)、セルトラリン(sertraline)である162。
研究者であるErland Skaga博士とIda Skaga博士らは、複数のシグナル伝達経路を同時に遮断することで、リワイヤリングを求めるCSCの逃避を阻止し、TMZの細胞毒性作用に敏感に反応するようになると考えた。
この9剤併用療法が選ばれたのは、毒性パラメータが低いからである。患者の中には、この9種類の薬剤を自分で選んで使っている人もいるという。科学者たちは、これを正式な研究で検証したいと考えた。研究者たちは、CUSP-9を細胞障害性薬剤であるTMZと併用すれば、効果が期待できると考えた。そして、それは正しかったのである。
CUSP-9とTMZを併用することで、再発した膠芽腫の患者5人から採取した膠芽腫腫瘍幹細胞を培養し、それぞれの薬剤の効果を検証した。標準的な治療法であるTMZは、これらの培養細胞のどれに対しても効果がなかった。すべての細胞が耐性を獲得していたのである。しかし、CUSP-9とTMZの組み合わせでは、大きな効果が得られた。
グリオーマ細胞の50%において、CUSP-9とTMZの併用は高い感度を示したのである。
研究者たちの目標は、重要なシグナル伝達経路、特にWnT、Hh、mTORを攻撃することで、腫瘍内のCSC集団を標的にすることであった。2種類の耐性GBM幹細胞の培養液をin silico(=実験室で)でテストした。CUSP-9とTMZの併用療法は、WnTシグナルを80〜90%減少させる効果があった。T1459と呼ばれる別のGBM細胞培養では、CUSP-9とTMZの併用はCSの球体形成を阻止するのに100%の効果があった。CUSP-9とTMZの組み合わせは、CSの球体形成を100%阻害し、すべての細胞を死滅させた。興味深いことに、それぞれの薬剤は単独では効果がなかった。興味深いことに、それぞれの薬剤は単独では効果がなかった。このカクテルは、がん細胞を消滅させたのである。
また、T1506 GBM細胞にも効果があった。別の集団であるT1502では、併用療法の効果は限定的で、腫瘍細胞の75%が生き残った。
この教訓は、個々の患者と特定のGBM腫瘍の遺伝子に応じて、カクテル+TMZの可能性は、治癒から最小限の効果にまで及ぶ可能性があるということである。私は、T1459という細胞株に対する所見の写真を見た。各薬剤の試験には、最小限の成長阻害を示すペトリ皿が含まれていた。癌のコロニーができていた。それぞれの薬剤では、ほとんど効果がなかった。
しかし、「CUSP-9」と「TMZ」を組み合わせて投与したシャーレには、がんが見当たらない。生き残った細胞は1つもなかった。このようなテストは、理想的には、抵抗性の神経膠腫・芽細胞腫、大腸がん、膵臓がんなど、自分のがん細胞で行うべきである。併用療法が有効であることは明らかであり、腫瘍細胞の感受性試験は推測の域を出ない。
このことについては、最後のセクションである個別化されたがん治療の項で詳しく説明する。
そして、それは理にかなっている。CSCへの主要なシグナル伝達経路をブロックすることで、CSCに再配線の通知をせずにTMZで腫瘍を分解することができる。
GBMの長期生存者であり、再利用医薬品の提唱者であるリチャード・ガーバー博士も、同じ論理を認識していた。
「私のアプローチは、膠芽腫を活性化するような経路を遮断できる薬剤をできるだけ多く見つけ、それを一度に行うことで、膠芽腫が変異して経路を逃れる機会を少なくすることにあった。
確かに、この方法は、GBMの長期にわたる末期がん生存者の秘密の鍵のようである。ベン・ウィリアムズ博士とリチャード・ガーバー博士が偶然の産物ではなく、がん治療のパラダイムシフトの砦である理由はまさにここにある。CSCの経路が遮断されていない場合、腫瘍は化学療法や放射線療法に対する耐性を獲得し、EMTや転移を促進する。再利用可能な薬剤のカクテルを加えると、CSCとEMTの経路が遮断され、がんのコロニーが根絶され、長期的な生存が保証されるのである。
スカガ博士は、CUSP-9は血液脳関門を通過する薬剤に基づいて選択されたと述べている。しかし、患者の代謝の違いにより、血中濃度や脳内濃度は変動する。そのため、毒性をモニタリングするためには、医師のモニタリングが引き続き重要である。
一般的に、GBMに対するCUSP-9とTMZの併用療法は、一律のアプローチとしては悪くない出発点だと思う。しかし、シーケンシングによって腫瘍に特有の遺伝子やバイオマーカーを特定し、感度試験に基づいてカクテルをカスタマイズすることが最善である。この点については、最後のセクション、カスタマイズされたがん治療のセクションで詳しく説明する。
私の場合は、さらにMBZとメトホルミンを加えたいと思っている。MBZとメトホルミンは無毒で、それぞれが非常に多くの経路を遮断するからね。そして、もし私に任されているとしたら、間違いなく、ナノクルクミン、ケルセチン、レスベラトロール、メラトニン、ターキーテールマッシュルーム、ラクトフェリン、フィッシュオイル、亜麻仁油などの様々なサプリメントを加えるだろう。

