Contents
Sulforaphane Augments Glutathione and Influences Brain Metabolites in Human Subjects: A Clinical Pilot Study
www.ncbi.nlm.nih.gov/pmc/articles/PMC5981770/
要旨
統合失調症やその他の神経精神疾患は、メカニズムに関連した介入を待っている。過剰な酸化ストレスが脳障害の病態生理に関与していることがますます注目されており、主要な抗酸化物質であるグルタチオン(GSH)の減少が複数の研究で報告されている。
イメージング技術を用いた脳内の酸化ストレス関連変化の推定に関する技術的な注意点から、研究者は、酸化ストレスに関連した脳の変化の病理学的サインとして末梢GSHの可能性を探ることになった。GSH欠乏症の前臨床モデルでは、脳全体と末梢GSHレベルの間に相関関係があることを発見した。
また、天然に存在するイソチオシアン酸スルフォラファンは、健康なヒトに毎日7日間経口投与することで、血中GSH値を上昇させることを発見した。また、スルフォラファンが前帯状皮質、海馬、視床の脳内GSH値に及ぼす影響を7-T磁気共鳴分光法を用いて検討したところ、血中GSH値と末梢GSH値の間に有意な正の相関が認められた。
スルフォラファン投与後と投与前の血中GSH値と視床GSH値の間には有意な正の相関が認められた。本研究は、末梢GSHと臨床・神経心理学的指標との関連性、および神経精神疾患で変化する機能指標に及ぼすスルフォラファンの影響を探ることの価値を示唆するものである。
キーワード スルフォラファン、グルタチオン、酸化ストレス
序論
酸化ストレスは、心血管症候群や糖尿病からアルツハイマー病やパーキンソン病などの神経変性疾患に至るまで、複数のヒト疾患の病態生理の根底にある[1, 2, 3, 4, 5]。さらに、最近の研究では、酸化ストレスが統合失調症(SZ)などの神経精神疾患にも役割を果たしていることが示唆されている[6, 7, 8, 9]。
グルタチオン(GSH)は、酸化ストレスおよび酸化還元バランスの最も重要な調節因子の一つである。この抗酸化トリペプチドは細胞内に低ミリモルレベルで存在し、20以上の酵素によって直接利用され、その抗酸化および細胞保護効果を発揮している。多くの疾患において、GSH の病態への関与が報告されている[10, 11, 12, 13]。
脳障害の研究や治療の障害となっているのは、生物学的試料へのアクセスであり、これは末梢の疾患ではより容易に入手可能である。したがって、多くの研究では、神経精神疾患の分子基盤を特徴づけるために、よりアクセスしやすい血液および脳脊髄液サンプルに頼っている [14, 15, 16, 17, 18, 19, 20, 21, 22, 23]。被験者間にはばらつきがあるが、複数の研究では、血液などの末梢的にアクセス可能な組織および体液中のSZ中のGSHの有意な減少が報告されている[6, 18, 19, 24, 25, 26, 27, 28, 29]。
しかし、SZに関連する脳内のGSHの分子的性質は不明である。生体内磁気共鳴分光法(MRS)は、脳内代謝物のレベルを測定するために使用される分析技術である[30]。MRSの応用の成功により、SZ患者の脳内グルタミン酸(Glu)およびγ-アミノ酪酸(GABA)レベルの変化が示されている [31, 32, 33, 34]。対照的に、GSHのデータはあまり一貫性がない[19, 35, 36]。GSHレベルの検出における3-T MRSの感度が限られていることがこの矛盾の根底にあると考えられ、7-T MRSを用いた研究では検出を改善し、より一貫性のある結果が得られるはずである。したがって、現時点では、MRSに基づくGSHの測定値の解釈には慎重になるべきである。現在のMRSの方法論は、病理学的変化に関連した微妙ではあるが重要な変化を検出するのに十分な感度を持っていない可能性がある。その結果、多くの研究者が、酸化ストレスに関連した脳の変化のサインとして末梢GSHの潜在的な有用性を探っている。
スルフォラファンは、ブロッコリーなどのアブラナ科植物の種子や新芽に豊富に含まれる天然のファイトケミカル化合物である。スルフォラファンは、外傷性脳および脊髄損傷の前臨床モデルにおいて有望性を示している[37, 38]。スルフォラファンは、転写因子NF-E2関連因子2(Nrf2)を活性化し、その細胞質阻害剤であるケルチのようなECH関連タンパク質1(KEAP1)と結合し、解離する能力を持つ。このように、スルフォラファンは適切な酸化還元バランスを促進し、酸化ストレスから身を守ることが期待されている。スルフォラファンは消費食品に含まれていることから、ヒトでの研究が期待されている。実際、スルフォラファンの潜在的な有用性は、喘息、大気汚染損傷、前立腺肥大症、紫外線誘発性紅斑、糖尿病、ヘリコバクター・ピロリ(胃癌の一種である)の制御、そして多くの異なる癌の予防に実証されている[42, 43, 44]。さらに、最近の報告では、スルフォラファンの投与が自閉症やSZのようなヒトの脳障害に有益な結果をもたらすことが示唆されている[45, 46, 47]。しかし、スルフォラファンが神経精神疾患の病態とどのように関連しているのか、そのメカニズムは未だ解明されていない。
我々は、スルフォラファンをヒトに投与することで、血中および脳内のGSHレベルが上昇し、末梢血中GSHレベルが酸化ストレスやレドックスに関連した脳内の生理・病態を反映しているのではないかと仮説を立てた。スルフォラファンが治療薬の候補となることを考えると、スルフォラファンがGSHに及ぼす影響を研究することは、有益な効果を予測するためのマーカーを定義するための第一歩となるかもしれない。
研究方法
マウスモデル
興奮性アミノ酸キャリアー1ノックアウトマウス(Eaac1 KO)[48]および野生型(WT)マウスを使用し、両方ともCD1バックグラウンドを有し、餌と水を自由に利用できる管理された施設(23±1℃、湿度50±5%、明暗サイクルはそれぞれ午前7時と午後7時に開始)で飼育した。3ヶ月齢の雄マウス(Eaac1 KOマウス、n = 4; WTマウス、n = 5)から全脳のGSHレベルを定量した。発情期にはげっ歯類の GSH 酵素レベルが最大 50%まで変動するため、雄の動物を用いた [49]。3ヶ月齢の動物は、1歳以上のげっ歯類で観察されるGSHレベルの年齢依存的な低下は見られない[50]。
ブロッコリースプラウトエキス(スルフォラファン
本研究で使用したブロッコリースプラウト抽出物は、スルフォラファンの高度に標準化された製剤である[51, 52]。抽出物は、以前に記載されたように、連続した7日間にわたって1日2個のゲルカプセルの形で100μmolのスルフォラファンに標準化されていた[45,53,54,55,56,57,58]。100μmolのスルフォラファンの用量と7日間の治療期間は、ヒトの鼻腔洗浄細胞における抗酸化酵素の誘導 [59] と大気汚染物質の排泄の改善 [56] を含む先行研究から経験的に決定されたものである。我々が開発したスルフォラファンの製剤は、80%の生物学的利用可能性があり[58]、経口摂取後1時間で血漿中のピークレベルに達し、一次動態で減少し、尿中に積極的に排泄される(8時間後に60%) [58, 60]。
ヒト試験参加者
健康なボランティア9名(男性5名、女性4名)を、米国メリーランド州ボルチモアのジョンズ・ホプキンス統合失調症センターで募集した。人口統計学的情報を表1.1に示した。GSH値は60歳を過ぎると低下し始めるが、男女差はない[61]。本研究では、若い参加者(21~26歳、56歳の参加者1名)を対象とした。重度の精神疾患の個人的または直系の家族歴、最近の院内感染の既往歴、慢性神経障害、意識喪失をもたらす外傷性頭部外傷、または積極的な薬物乱用の既往歴がある場合には、被験者は除外された。喫煙は酸化ストレスの誘発因子として知られているため[62,63]、この研究からタバコを吸う人を除外した。ベンゾジアゼピン系薬剤への依存、禁忌的閉所恐怖症、金属製のインプラントや義肢、ペースメーカー、または参加者にとって安全上のリスクとなる病状(例:中耳障害)など、MRI検査の禁忌を有する患者も除外した。
表1 臨床的および人口統計学的特徴
- 性別、n (%)
男性 5 (56)
女性 4 (44) - 平均年齢±SD、年 27.8±10.67
- 人種/民族、n (%)
白人 2 (22)
アフリカ系アメリカ人 3 (34)
アジア2 (22)
その他 2 (22) - 学歴、n(%)
高度な学位 5 (56)
学部4 (44) - 喫煙者数 n (%)
喫煙者 0 (0)
非喫煙者 9 (100)
臨床試験のデザイン
参加者は、7 日間(1 週間)離れた 2 回の訪問を完了した。参加者には、標準化されたブロッコリースプラウトエキスとして100μmolのスルフォラファンをゲルカプセル2個の形で与え、1週間毎朝摂取するように指示した。研究コーディネーターが電話で参加者に連絡を取り、毎日の摂取の注意喚起を行った。ブロッコリースプラウトエキスの初回投与前と最終投与後4時間以内に尿検体と血液検体を採取した。MRSスキャンは初回投与前と最終投与後4時間以内に実施した。参加者は、抽出物を摂取した日時を記録し、試験中に経験した可能性のある不快感や病気を記録した。3人の参加者は、空腹時にエキスを摂取した際に軽度から中等度の吐き気や腹痛を示した。研究デザインは、オンライン補足図1に要約されている(すべてのオンライン補足資料については、www.karger.com/doi/10.1159/000487639 を参照してほしい)。
血中および脳組織中の GSH レベルの測定 (マウスおよびヒト)
総GSH(GSHとグルタチオン二硫化物[GSSG]の合計)は、Tietzeの方法[64]を改変したものを用いてヒト血球中で測定した。我々は、”総GSH “を単に “GSH “と呼ぶ。我々は、これらの方法論を用いた複数の研究において、GSHおよび酸化ストレスを定量化した[18, 65, 66]。非単球性血液細胞を、200mM 2-(N-モルホリノ)エタンスルホン酸および1mM EDTA(エチレンジアミン四酢酸)を含む緩衝液に再懸濁し、超音波をかけた。溶解した細胞懸濁液を、4℃で10,0000gで15分間紡糸した。結果として得られた上清は、新たに調製した10%メタリン酸の50%v/vを添加し、室温で5分間インキュベーションすることにより脱蛋白化された。脱蛋白化されたサンプルは、その後、2,000 gで2分間スピンし、上清をアッセイするまで-20℃で保存した。キネティックアッセイは、100μLのメタリン酸処理細胞溶解液に5μLの新鮮な4Mトリエタノールアミンを加えることによって行われた。次いで、キット(Cayman Chemical Company; 703002)を用いて、製造者の指示に厳密に従ったGSHを測定した。GSHによる5,5′-ジチオビス(2-ニトロ安息香酸)の還元を測定する415nmにおける吸光度の増加率は、総GSH含有量を反映している。キネティックアッセイは、1分間隔で収集したデータで、20分間実行することを許可した。血漿中の総GSHの濃度はnmol/mLとして報告された。0から16 nmol/mLまでの標準曲線は、アッセイを校正するために使用された。報告された各GSH値は、2つの独立した測定値の平均を使用して決定した。
7-T磁気共鳴分光法
すべての参加者は、32チャンネルのヘッドコイル(Nova Medical, Wilmington, MA, USA)を装備した7-Tスキャナ(Philips Achieva; Philips, Best, The Netherlands)を使用してスキャンされた。3D T1強調画像は、勾配エコーシーケンス(FOV = 220 × 220 × 180 mm)で磁化準備された迅速取得を使用して取得した。スペクトルは、前帯状皮質(ACC;30 × 30 × 30 × 30 mm左海馬(HP;35 × 15 × 15 mmおよび両側視床(THAL. 20 × 30 × 15 mm)を使用して、刺激エコー取得モードシーケンス(TE/TM/TR = 14/33/3,000 ms、NEX = 128)を使用して、スペクトルは38 × 30 × 30 × 30 mmのボクセルサイズを持つACCからのみ記録された2人の参加者を除いて(オンラインsuppl. 図2)。)
残りのすべての参加者は、すべての3つの脳領域について取得したMRSデータを持っていなかった。VAPOR(可変パワーおよび最適化された緩和遅延)水抑制を使用して、支配的な水信号を最小化した[67]。さらに、水抑制なしのリファレンススキャンも各ボクセルから取得した(NEX = 16)。スペクトルは LCModel ソフトウェアパッケージ [68] を用いて解析し、基底セットは VeSPA プロジェクト [69] からシミュレートした。代謝物濃度は、抑制されていない水の信号を基準として正規化した。フィット誤差はCRLB(Cramér-Rao lower bounds)で評価した。CRLB値が20%以下の場合にのみ、代謝物濃度を統計解析に含めた。
我々の研究の目的は、スルフォラファン投与による脳内GSHレベルの変化を明らかにすることであり、おそらく血中GSHレベルとの相関関係を明らかにすることであった。GABA、グルタミン(Gln)、グルタミン(Glu)、N-アセチラスパルテート(NAA)は副次的な指標とした。GABA、Gln、Glu、GSH、およびNAAの濃度における治療前と治療後の測定値の差は、ペアードt検定を用いて比較した。
分析と統計
統計解析は Windows 用 R バージョン 3.3.0 を用いて行った。スルフォラファン前後の血中GSH比および代謝物比を用いて、MRSで測定した血中GSH値と脳内代謝物値との相関関係を算出した。血中GSH比はShapiro-Wilk正規性検定で求めたノンパラメトリック値であったため、スピアマンの相関係数を用いて血中GSH値と脳MRSデータの相関関係を求めた。ノンパラメトリックデータについては、Mann-Whitney検定を用いて、WTマウスとEaac1 KOマウスのリンパ球と脳の両方における総GSHレベルの間の2群比較を行った。脳内の総GSHレベルとマウスのリンパ球内の総GSHレベルとの関係は、スピアマンの相関係数を用いて決定した。
血中GSH値におけるスルフォラファン反応に対する性の影響を決定するために、スピアマンの相関分析とペアワイズ、両側 t 検定を用いた。人種区分が血中GSH値の共変量であるかどうかを決定するためにWilcoxon順位和検定を用いた。ピアソンの相関分析は、血中GSH値におけるスルフォラファン反応に対する年齢の影響を決定するために使用された。徹底した分析を行うために、一変量線形回帰モデルと多変量線形回帰モデルを用いて、THAL GSH値におけるスルフォラファン反応に対する人種と年齢、性別と人種の影響をそれぞれ決定した。正規性(パラメトリックまたはノンパラメトリック)を確認するためにShapiro-Wilk検定を適用した。すべてのデータは、平均値±標準偏差(SD)およびp < 0.05のαで表されている。
結果
マウスモデルで観察された末梢および脳内GSHレベル
我々は、末梢GSHレベルが動物モデルにおける脳GSHレベルの病態生理学的変化を反映しているかどうかを検討した。私たちはまず、マウスモデル系を用いて、遺伝子と環境を制御した環境下で、血中および脳内の GSH 欠乏の影響を研究した。スルフォラファン投与が GSH レベルに及ぼす影響を研究することが私たちの主な関心事であり、ヒトでの研究は一般的に遺伝的・環境的にある程度のばらつきがあるため、私たちはマウスモデルを用いて、制御された遺伝的・環境的システムの中で末梢血と脳の GSH レベルの関係を調べるというヒトでの研究の指針となることを期待した。我々はEaac1 KOマウスを用いた。Eaac1 KOマウスは合成欠損により脳内GSHレベルが低下している[48]が、末梢のGSHレベルの変化はまだ不明である。まず、Eaac1 KOマウスではWTマウスと比較して脳内GSHレベルが低下しているという以前の知見[48]を再現した(図1a)。今回、Eaac1 KOマウスの末梢循環リンパ球では、WTマウスに比べてGSHレベルが大幅に低下していたことを報告した(p=0.008)(図1b)。重要なことに、脳と末梢のGSHレベルはWTマウスとKOマウスの両方で強く相関していた(ρ=0.967; p<0.001)(図1c)。このように、これらの観察結果を一般化することには注意が必要であるが、末梢GSHレベルの測定は、脳GSHレベルの潜在的に有用な指標となる可能性がある。
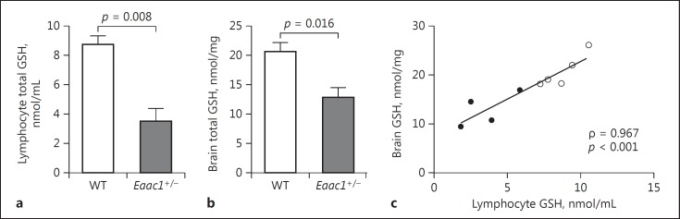
図1
野生型(WT)およびEaac1ノックアウト(+/-)マウスの血球および脳組織におけるグルタチオン(GSH)レベルの測定。c リンパ球中の総GSH量と脳内の総GSH量は個体間で異なっていた(白丸はWTマウス、黒丸はEaac1+/-マウス)。しかし、リンパ球の総GSHレベルと脳の総GSHレベルの比は一定であった。
スルフォラファンを毎日7日間連続投与した被験者の血中GSH濃度の上昇
スルフォラファン投与前後の尿検査では、尿中にスルフォラファン代謝物が存在することが確認され、被験者がスルフォラファン経口投与のプロトコルを遵守していることが確認された(データは示されていない)。スルフォラファンを1週間投与した後、被験者はT細胞、B細胞、NK細胞の混合物を含む非単球でGSHの有意な増強を示した(図(図2)2)。GSH値はスルフォラファン投与前は9.22nmol/mL、投与後は12.2nmol/mLと32%の上昇を示した。年齢(r = -0.1936; p = 0.62)および性別(ρ = 0.087; p = 0.825)は、スルフォラファンのGSHへの影響を説明する共変量ではなかった。人種もまた、4つのグループのWilcoxon順位和検定(p = 0.318)で示されたように、説明変数ではないことがわかった。
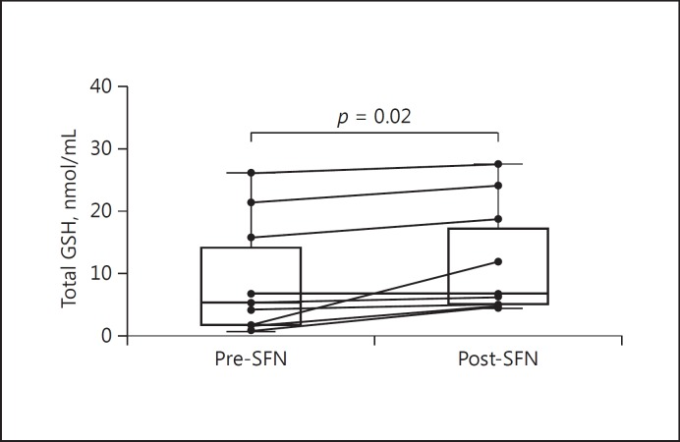
図2
ヒト血球中のグルタチオン(GSH)レベルの測定。スルフォラファン(SFN)を1週間投与した後、細胞のGSHは有意に増加した(両側検定、ペアードt検定:p = 0.02)。
MRSによる脳内代謝物の測定
本研究では、3つの異なる脳領域(THAL、HP、ACC)における5つの代謝物(GSH、GABA、Gln、Glu、NAA)の測定を行った。特にこれら3つの脳領域を選んだのは、SZで影響を受ける主要な構造的および機能的連結性の根底にあるからである [70, 71, 72, 73, 74, 75, 76, 77]。本研究では、スルフォラファンがこれらの脳領域のGSHレベルに影響を与え、末梢血中のGSHレベルと相関があるのではないかという仮説を立てた。
その結果、末梢血中の GSH 濃度は 1.11 ± 0.34 から 1.38 ± 0.28 mM まで上昇した(p = 0.041; paired, two-tailed t 検定; online supplementary Figure 2)。THALおよびACCにおけるGSHレベルの変化は有意には達しなかった。スルフォラファン投与前後の THAL GSH レベルの代表的なペアワイズ解析をオンライン補足図 3 に示す。本研究の非一義的仮説のために定量した他の脳内代謝物については、THAL の Gln は 1.21 ± 0.22 から 1.49 ± 0.26 mM(p = 0.017; paired, two-tailed t 検定)に増加していた。サンプルサイズが限られていたため、多重比較のポストホック補正を行っても、この増加は有意ではなかったが、参加者の数が少ないことを考慮すると、この結果は示唆的であることに変わりはない。
脳GSHレベルにおけるスルフォラファン反応は、線形回帰分析によって決定されたように、年齢、性別、人種の影響を受けていない。スルフォラファン摂取前後の血中GSHレベルの生化学的測定結果と最も有意に相関する結果がTHALで得られたため、THALで測定されたGSHレベルの代表的な分析を行った。例えば、スルフォラファン投与前後のTHAL中のGSH濃度の年齢、性、人種別のp値は、多変量解析ではそれぞれ0.582,0.900,0.567であり、人種別の一変量解析ではp=0.406であった。以上のことから、年齢、性、人種は脳内GSHレベルのスルフォラファン反応と関連する共変量ではないことが示唆された。
血中GSHレベルとTHAL脳領域のGSHレベルとの間には有意な正の相関が観察された(ρ=0.943; p=0.017; q=0.051)。透明性のために、3 つの異なる脳領域内で測定された 5 つの代謝物すべてについて得られた相関結果も報告する(オンライン補足表 1)。スルフォラファン投与後、血中GSHの増加はTHALのGABA、Gln、Glu、GSHと正の相関を示した。これらの相関は多重比較では有意ではなかったが、示唆に富むものであることに変わりはない。パワー分析の計算では、サンプルサイズが n = 50 であれば有意な結果が得られることを示唆しており、これは今後の研究の焦点となるであろう。
議論
スルフォラファンの短期投与により、末梢GSH値が有意に上昇したことを報告した。スルフォラファンを短期投与した場合、末梢GSHの増加はHPで認められたが、脳の他の部位では認められなかった。末梢GSH比は、スルフォラファン投与時にTHALの脳内GSHレベルと強い正の相関を示し、遺伝的にも環境的にも同質なGSH欠損マウスの前臨床試験で得られた結果と一致した。
本研究では、年齢、性別、人種がスルフォラファンのGSH値に影響を与えないことを確認するための統計解析を行った。GCLC GAG TNR 多型はヨーロッパの白人集団では GSH レベルに影響を与えることが報告されているが [78]、我々の研究集団(アフリカ系アメリカ人を含む北アメリカ人集団)では特定の遺伝子型が GSH レベルに影響を与えていない可能性があることを報告した [79]。どのような遺伝的および/または環境的要因がGSHレベルのスルフォラファン応答に影響を与える可能性があるのかは、まだよくわかっていない。
心血管疾患および脳血管疾患で報告されているように、より長い治療期間および/またはより高い投与量が必要とされるかもしれない。例えば、2型糖尿病患者を対象とした臨床試験では、スルフォラファンを10g/日(〜225μmol)4週間投与した場合に、酸化ストレスの改善が報告されており、それぞれ今回の試験よりも大幅に改善している[80]。これは、本研究ではスルフォラファン投与後の脳代謝物に示唆的な変化が観察されただけであったことを説明するものであろう。それにもかかわらず、我々の短期投与戦略は十分に忍容性があり、これは臨床バイオマーカーと患者志向のアウトカムをリンクさせる試みの中で、その後のスルフォラファンのプロトコルをさらに促進するものであろう。
マウスの末梢血と脳内GSHレベルは、標準的な生化学的アッセイで定量したところ、相関性が認められた。それにもかかわらず、スルフォラファンによる血中GSHの増強が脳にとってどのような意味を持つのか、少なくとも現在のスルフォラファンの使用量と期間についてはあまり明らかになっていない。ヒトを対象とした MRS による脳内 GSH 濃度の推定には限界があり、少なくとも現時点では注意が必要である [81]。スルフォラファンは血液脳関門を通過する可能性が高いが、その効力と必要な投与量はヒトではまだ確立されていない。ラットでは、スルフォラファンの末梢投与は脳内の抗炎症性HO-1遺伝子を誘導し、脳卒中、外傷性脳損傷、フェンシクリジン誘発性高運動に有益な効果があることが報告されている[37, 82, 83]。
スルフォラファン介入のアウトカム研究は、臨床表現型と、疾患の病態生理を反映する可能性のある客観的に測定されたバイオマーカーとを結びつけることから利益を得ることができるだろう。例えば、提出された研究では、末梢GSHレベルが認知機能と相関している可能性があることを報告する。このように、末梢GSH値と臨床・神経心理学的指標との相関関係や、神経精神疾患で変化する機能指標に対するスルフォラファンの影響を探ることは意義があると考えている。今回の研究は、このような将来の研究に向けた重要な第一歩となる。
