Contents
Studying the Relationship of Intermittent Fasting and β-Amyloid in Animal Model of Alzheimer’s Disease: A Scoping Review
www.ncbi.nlm.nih.gov/pmc/articles/PMC7590153/
要旨
アルツハイマー病の動物モデルにおけるβアミロイドに影響を与える予防手段として、断続的な断食(IF)のエビデンスを検討した。Scopus, Ovid, PubMed, Web of Science (WoS)で検索した結果、「アミロイドβ」、「間欠的断食」、「間欠的カロリー制限」、「代替日断食」、「修正代替日断食」、「時間制限食」、「ラマダン断食」、「間欠的カロリー制限」、「間欠的制限食」、「アルツハイマー」のキーワードで29件の結果が得られた。間欠的な断食がアルツハイマー病の動物モデルにおけるβアミロイドレベルに及ぼす影響を直接的に取り上げた研究論文は5本あり、これらの研究には代替日断食(ADF)と時間制限給餌(TRF)の方法が取り入れられている。研究デザインは不均質であることがわかった。食事介入後の動物における海馬、皮質領域、またはその両方におけるβアミロイドペプチドまたはプラークのレベルの変動が、自由摂取群と比較して観察された。3つの研究では有意でない変化が観察されたが、2つの研究では興味深いことにβアミロイドレベルの改善と減少が観察された。このような相反する結果が得られたことを考えると、本プロトコルがアルツハイマー病の予防的治療法として適用される前には、十分な注意が必要であると考えられる。食生活がアルツハイマー病の病態の上流または下流でどのようにアルツハイマー病の緩和に役立つかを十分に把握するためには、長期的な研究が必要である。
キーワード
断食、日替わり断食、時間制限食、アルツハイマー病、βアミロイド
1. はじめに
間欠的断食は、その実践に関連するいくつかの健康上の利点のために最近人気を集めている[1]。間欠的断食は、カロリー制限(1日のカロリー摂取量を20~40%減少させる)および/または身体活動を受ける従来の方法とは対照的に、体重減少を達成するために使用される代替手段である。この生活様式の介入は、従来の意味での食事療法の一種ではなく、断食の期間と、制限されていない食事の期間との間で繰り返しサイクルするパターンである。飢餓とは対照的に、断食は食物からの自発的な断食であるが、後者は自発的でも制御されてもおらず、慢性的な栄養不足の状態である。
間欠的断食にはいくつかの異なるバリエーションがある:隔日/オルタネートデイ断食(ADF)(24時間の完全断食と翌日の無制限の食物摂取からなる)定期的断食(2日~3週間の断食期間)[2]、時間制限摂食(TRF)(食物摂取を8時間以内の時間窓に制限する摂食パターン)。3]、および間欠的なエネルギー制限(エネルギー消費を制限する期間と制限しない期間を交互に行う)[4]。ヒトを対象とした研究では、健康状態と疾患状態の両方で健康指標の改善が実証されている。これらの健康成果は、体重管理のみに限定されるものではなく、心血管障害、メタボリックシンドローム、および癌を含む多くの他の状況においても同様である[2,5,6,7,8,9,10,11,12]。
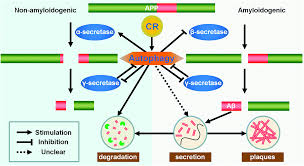
最近の研究では、断続的な絶食が神経変性に対する有望な保護効果を示すことが示されている。食事断続的なプロトコル[13,14,15,16]以下のパーキンソン病(PD)ハンチントン病(HD)および外傷性脳損傷(外傷性脳損傷)の動物モデルで観察された有意な改善にもかかわらず、ほとんどは、より具体的にはアルツハイマー病脳内のβアミロイドで、アルツハイマー病における転帰が知られている。アルツハイマー病は進行性の認知機能障害を特徴とし、脳内のβアミロイドプラークと神経原線維のもつれの決定的なホールマークの存在に基づいて診断される[17,18]。βアミロイドは神経細胞やアストロサイトだけでなく、非神経組織でも産生される[21]。アミロイド原性βアミロイドペプチドの産生には、βアミロイドのN末端にあるβ-セクレターゼとC末端にあるγ-セクレターゼによるアミロイド前駆体タンパク質(APP)の逐次的な切断が必要であり、これによりモノマー(β-40とβ-42が最も多く産生される)が産生される [22,23]。アルツハイマー病の遺伝的遺伝性は、APPとプレセニリン1,2をコードする遺伝子の1つに変異があると、βアミロイドの過剰産生をもたらすことが示されている[24,25]。何十年にもわたって認知症の研究を導いてきた「アミロイドカスケード仮説」は、アルツハイマー病の根本的な原因は細胞外βアミロイドペプチドの沈着であると主張している[26]。しかし、この仮説は、そうでないことを示すいくつかの知見のために抵抗と論争に直面してきた[27,28,29]。
これらの発見にもかかわらず、βアミロイドの研究はまだ関連性がある。最近の機械学習アルゴリズムは、βアミロイドとタウのバイオマーカーの上昇が、初期の認知症状態の良好な予測因子として重要であることを実証している[30]。さらに、アルツハイマー病の神経細胞培養モデルでは、β-42/40の比率がタウ病理を促進することが明らかになっている[31]。さらに、βアミロイドのオリゴマー形態は、取り込まれてから24時間以内に誘導された多能性幹細胞由来の神経細胞において、早期かつ広範なプロテオミクス変化を誘導することが明らかにされている[32]。これは、アルツハイマー病の発症と進行を媒介する鍵となる可能性のある新しいバイオマーカーと戦略のリポジトリを提供する。
現在までのところ、アルツハイマー病を停止させたり予防したりする治療法はない。アルツハイマー病は遺伝的要因に加えていくつかの生活習慣の要因によって影響を受けるため、生活習慣の介入が認知機能の改善や維持、神経細胞の病理学的な負担を軽減するための支援を提供することができるのは当然のことである。これまでのところ、間欠的断食は、ヒトAD患者における潜在的な治療法として検討されなかった。しかしながら、ケトン体であるβ-ヒドロキシ酪酸 [33,34,35,36,37]を含む多くの研究で見られるように、アルツハイマー病の症状を改善する能力を考えると、断食が病気に対して強力な実用的なツールであるかもしれないと信じる証拠を持っている。
このスコーピングレビューは、アルツハイマー病の動物モデルにおける断続的絶食とβアミロイドとの関係に関する公表データをまとめるために実施された。このスコーピングレビューは、文献中の所見の不一致を指摘しながら、後者が食事介入によってどのように影響を受けるかをよりよく理解するために実施されている。要約は、多くの異なるデータベース間の系統的な検索を使用して提供されるものとする。我々は、断続的な絶食がアルツハイマー病脳におけるβアミロイド沈着に影響を与えることができるという仮説を立てている。
2. 材料と方法
このスコープ・レビューでは、本研究に関連した関連性のある適切な論文を特定し、マップアウトするために、システマティックな検索を行った。1960 年から 2020 年 5 月までの早い時期から、以下のような電子データベースに掲載された査読付き全文英語論文を収集した。また、検索には、Scopus, Ovid, PubMed, Web of Science (WOS)を使用した。検索用語は、論理演算子 AND および OR と合わせて以下の通りとした。”アミロイドβ” OR “β-アミロイド” OR “β-アミロイド” OR “アミロイドβ” AND “間欠的断食” OR “間欠的カロリー制限” OR “代替日断食” OR “修正代替日断食” OR “時間制限給餌” OR “ラマダン断食” OR “間欠的制限食” AND “アルツハイマー*”であった。本研究の除外基準は、(1)一次論文のみを検討、(2)アルツハイマー病の実験動物研究のみをショートリスト化、(3)これらの動物に適用された介入は断続的な断食を行ったもののみ、(4)βアミロイドプラークまたはペプチドの効果を測定したものであること、であった。一方、本研究の除外基準は、(1)ヒトを対象とした研究であること、(2)アルツハイマー病に特異的でないこと、(3)適用された介入が継続的なカロリー・エネルギー制限または飢餓であること、(4)βアミロイドプラークまたはペプチドの効果が測定されていないこと、であった。検索結果のすべてのタイトルおよび要旨
は、最初にスクリーニングされ、すべての著者によって独立した批評が行われた。除外基準と包含基準に基づき、全著者によるコンセンサスが得られた後、論文は適格性のためにショートリストに登録された。
3. 検索結果
文献検索では、これらのデータベースから合計 29 本の論文が同定された。16本の論文は(タイトルと要旨
に基づいて)重複していることが判明し、その後削除された。残りの13本の論文は、その後、適格性のために詳細にスクリーニングされ、分析された。その結果、5本の論文が包含基準を満たし、今回のレビューに含まれた。5本の論文から抽出されたデータの要約を表1に示す。
表 1 対象となる論文から抽出したデータの要約
| 年 | 著者 | 動物モデル | セックス | 介入開始時の動物の年齢 | 介入期間 | 断続的断食のモード(レジーム) | 分析方法 | 測定された脳の面積 | 結果 | 行動/認知の変化 |
|---|---|---|---|---|---|---|---|---|---|---|
| 2020 | [ 38 ] | 5xFAD(トランスジェニックマウスモデル) | (F) | 2ヶ月 | 4ヶ月 | (ADF)(治療) | (IHC)(ELISA) | 皮質と海馬 | 断続的断食(IF)群と随意群の間でβ-アミロイドレベルに有意な変化はありません | 1. 5xFAD-ADFは、明暗ボックステストで自由に摂食させた非トランスジェニックマウスよりも不安のレベルの増加を示しました。 2. 5xFAD-ADFは、新規物体認識および位置(NOR&NOL)テストで自由に摂食した非トランスジェニックマウスよりも短期記憶の有意な低下を経験しました。 3. 5xFAD-ADFは、新規オブジェクト位置(NOL)テストで、5xFAD-アドリブよりも短期記憶の有意でない減少を示しました。 4. 5xFAD-ADFは、オープンフィールド試験で移動性の欠陥を示しませんでした。 |
| 2020 | [ 39 ] | 3xAD(ノックインマウスモード)(APP NL-GF)) | (M) | 12ヶ月 | 9ヶ月 | (TRF; 2日/週)(治療) | IHC | 海馬 | IF群とアドリブ群の間でβ-アミロイドレベルの量が少なくなるという有意でない傾向 | 1. APP NL-GF -TRFは良好APPよりも有意に行わNL-GF Y迷路試験において-ad自由。 2. TRF食餌(WTとAPP NL-GFの両方)で維持されているマウスは、2日間の水迷路テストでより低い目標潜時を示しました。 |
| 2018年 | [ 40 ] | 卵巣切除されたSpragueDawleyラット(aβ-42、aβ-45、aβ25-35の直接注入) | (F) | 2ヶ月と3週間 | 2ヶ月 | TRF(3時間/日)(予防的) | IHC | 海馬 | IF群と自由群の間のβ-アミロイドレベルの有意な減少 | 1.卵巣切除-AD-TRFは、受動的回避テストにおける短期記憶障害を改善しました。 2. Ovariectomized-AD-TRFは、Morris Water Mazeテストで、Ovariectomized-AD-adlibitumよりも改善された空間記憶を示しました。 |
| 2017年 | [ 41 ] | APP / PS1(トランスジェニックマウスモデル) | (M&F) | 5ヶ月 | 5ヶ月 | ADF(治療) | IHC | 大脳皮質 | IF群と自由群の間のβ-アミロイドレベルの有意な減少 | 1. APP-PS1-ADFは、Morris Water Mazeテストで、APP / PS1-adlibitumよりも改善された空間記憶を示しました。 |
| 2007年 | [ 42 ] | 3xtgAD(トランスジェニックマウスモデル) | (M&F) | 3ヶ月 | 14ヶ月 | ADF(治療) | ELISA | 海馬 | IF群と自由群の間でβ-アミロイドレベルに有意な変化はない | 1. 3xAD-ADFは、オープンフィールド試験で、加齢に伴う歩行数と移動距離の改善を示しました。 2. 3xAD-ADFは、Morris WaterMazeテストで3xAD-adlibitumと比較して改善されたパフォーマンスを示しました。 |
略称。M(雄)F(雌)IHC(免疫組織化学的分析)ELISA(酵素結合免疫吸着アッセイ)IF(断続的絶食)ADF(代替日絶食)TRF(時間制限給餌)。WT(野生型)5x家族性アルツハイマー病-ADF(5x家族性アルツハイマー病トランスジェニックマウスは交互に1日絶食)5x家族性アルツハイマー病-ad libitum(5x家族性アルツハイマー病トランスジェニックマウスはアドリビタム給餌)APPNL-G-F(ノックインマウスモデル)。APPNL-G-F-TRF(ノックインマウスに時間制限給餌を行った)APPNL-G-F-ad libitum(ノックインマウスにアドリビタム給餌を行った)Ovariectomized-アルツハイマー病-TRF(非トランスジェニックOvariectomizedラットにβアミロイドを注入した)。時間制限給餌)Ovariectomized-アルツハイマー病-ad libitum(β-アミロイドを注入した非トランスジェニックOvariectomizedラット、アドリビトゥム給餌)APP-PS1-ADF(APP-PS1二重トランスジェニックマウスは交互に一日絶食を行った)。APP-PS1-ad libitum(二重トランスジェニックマウスをアドリビトゥムで給餌した)3xアルツハイマー病-ADF(三重トランスジェニックマウスを交互日絶食で給餌した)および3xアルツハイマー病-ad libitum(三重トランスジェニックマウスをアドリビトゥムで給餌した)。
いくつかの異なるトランスジェニックマウスモデルが、選択されたレビューで使用された。1つの研究では、5つの家族性アルツハイマー病変異を有する5x家族性ADマウスを組み込んだ。スウェーデン(K670N)M671L)フロリダ(1716V)ロンドン(V7171)のヒトアミロイド前駆体タンパク質(APP695)の変異、およびヒトプレセニリン1タンパク質の2つの変異(M146LおよびL286V)を有する5つの家族性アルツハイマー病変異を有する5x家族性ADマウスを用いた研究がある[38]。ある研究では、スウェーデンの二重変異、βアミロイド前駆体タンパク質(βAPPSwe)プレセニリン-1(PS1M146V)ヒトタウP301Lを持つトリプルトランスジェニックADマウスを採用しており[42]、他の研究ではAPPノックインマウス(APPNL-G-F)でアルツハイマー病のいくつかの特徴を発症していた[39]。さらに、他の1つの研究では、二重トランスジェニックAPP-PS1マウスを採用した[41]。これらのマウスはすべて、生後2ヶ月で脳内のβアミロイドの沈着率を増加させるように設計されていた[38]。興味深いことに、代わりに卵巣摘出した雌ラットを用いた研究が1つだけ発見されており、そのラットの海馬にβアミロイドペプチドを注入していた[40]。介入開始時のマウスとラットの年齢は研究によって異なっていた。3つの研究では2~3ヶ月齢で介入を開始しており[38,40,42]、他の研究では5ヶ月齢で介入を開始しており[41]、最後に12ヶ月齢で介入を開始している[39]。
3件の研究では24時間の間食物を奪われるADF法が行われた[38,41,42]が、残りの2件の研究では1日3時間[40]と週2日の食物を奪われるTRFプロトコルが採用された[39]。介入期間もまた、研究によって幅があることが明らかになった。ADFプロトコルでは、最も短い期間が4ヵ月[38]、次いで5ヵ月[41]、最も長い期間が14ヵ月[42]であった。1日3時間の時間制限プロトコルは、暗黒サイクルの開始時(午後7時から10時)に開始され、これはヒトの朝に相当し、2ヶ月間[40]であったが、週2日の食事制限は9ヶ月間実施された[39]。
本レビューで報告された研究の大部分は、βアミロイドプラーク形成の検出に免疫組織化学的(IHC)分析を利用したものであった[38,39,40,41]。しかし、これらの研究は、βアミロイドの検出に用いられる染色または一次抗体の点で異なっていた。少なくとも1つの研究ではチオフラビン-s染色を用いていたが[38]、他の研究ではモノクローナルまたはポリクローナルのaβ-42一次抗体を用いていた[39,41]。さらに、1件の研究ではIHCに使用した一次抗体の種類は詳細には明記されなかった[40]。さらに、2つの研究では、aβ-42単独またはaβ-40を用いたELISA法が採用されている[38,42]。
海馬および/または脳の他の皮質領域におけるβアミロイド沈着量の変化に対する断続的な絶食の効果は相反することがわかった。ADFを受けているトリプルトランスジェニック(3xTgAD)ADマウスの海馬におけるβアミロイドレベルは、アドリビタム[42]を与えられた実験動物で発見されたレベルから有意に異なるものではないことが判明した(アミロイドβ-42とアミロイドβ-40)。この観察は、同様のプロトコル[38]を受けた5x家族性ADマウスで実証されたようにも真であった。チオフラビン-S陽性プラークレベルは、5x家族性アルツハイマー病の両方でアドリビトゥム給餌と5x家族性アルツハイマー病-ADFの両方で同等で有意差がないことが判明した[38]。その後、これらの脳領域の両方でELISAによる個々のβアミロイドペプチドの測定を行ったところ、同様に有意な変化は認められなかった [38]。興味深いことに、ノックインマウスモデル(APPNL-G-F)を用いた TRF 研究では、APPNL-G-F マウスのβアミロイド蓄積量は、APPNL-G-F をアドリバイタル投与した場合と比較して、プロトコルでは有意ではない傾向が見られた [39]。対照的に、アルツハイマー病の二重トランスジェニックマウス(APP/PS1)モデルにおいてのみ、アドリビトゥムとADFを与えたマウスとの間で皮質領域でβアミロイドレベルに有意な差が観察された[41]。同様の結果は、TRFを受けた非トランスジェニック卵巣切除ラットでも示された[40]。これらのラットでは、海馬におけるβアミロイドの沈着は、アドリビトゥム餌を与えたラットと比較して少なかった[40]。
また、異なる認知および/または行動テストの数はまた、ADマウス/ラットモデル上の断続的な絶食の効果を測定するために、これらの研究で採用された。モリス水迷路試験は、間欠絶食を受けた動物モデルのすべてではないにしても、ほとんどの動物で採用され、アドリバイタム給餌されたリターメートと比較して、改善された目標潜時[39,40,41,42]と同様に、水泳タスクのプローブ試験のスコア[40,41,42]で、実証した。さらに、ADFを受けたノックインADマウスモデル[39]は、自由摂取を与えられたその対応するものと比較して、Y迷路試験でのパフォーマンスの向上を示した。モリス水迷路テストと同様に、断続的な絶食とノックインADマウスは、彼らの2日間の水迷路テストでは、非絶食アドリビタムリッターメイト[39]とは対照的に、より低いゴールレイテンシースコアを持っていた。さらに、TRFを受けたovariectomized アルツハイマー病ラットは、自由食を与えられたものとは対照的に、受動的回避テストでの潜伏期間の減少を示した[40]。対照的に、ADFを受けた5x家族性ADマウスは、5x家族性ADマウスに比べて、明暗箱テスト後の不安様行動の増加と、新規物体位置(NOL)実験での短期記憶の悪化を示した[38]。さらに、絶食させた5x家族性ADマウスは開放野試験で運動障害の兆候を示さなかったが[38]、ADFを投与した3齢のトランスジェニックマウスでは、ADFを投与したトランスジェニックマウスと比較して、移動距離と歩行回数のスコアが改善された[42]。
4. 議論
本レビューでは、摂食頻度の制限とβアミロイド値の低下のエビデンスはまだ黎明期にあることを示唆している。アルツハイマー病のトランスジェニックマウスモデルで継続的なカロリー制限を採用した研究では、結果はβアミロイド負荷の有意な減少を示したが [43,44,45,46]、ここでレビューされた2件の研究 [40,41]のみが断続的な絶食と脳内プラーク沈着の減少との間の正の関係を提唱していた。残りの3つの研究では、βアミロイドプラークの有意な変化や減少は認められなかった[38,39,42]。
このことから、マウスの遺伝的背景および/またはトランスジーンの発現が、介入後の最終的な分子的転帰に強い影響を与えているという仮説が導かれた。最近の研究では、トランスジェニック系統間のプラーク負荷とその分布は非常に不均質であり、その生涯にわたる変化は系統や領域に依存していることが示されている[47]。この研究では、密度の高いコアプラーク負荷は系統間で一桁以上のばらつきがあることが示された [47]。さらに、15ヶ月齢5x家族性ADマウスの皮質プラーク負担中央値は、21ヶ月齢Tg2576マウスと15ヶ月齢rTg9191マウスの4.5倍であったことが報告されている[47]。このことを考えると、ダブルトランスジェニックマウスモデルやβアミロイドペプチドを直接注入したラットのみを用いた研究と比較して、負担が大きすぎるため、これらのマウスでは介入による効果が得られないと考えられる。これは、介入は、人間が家族性、動物モデルのアルツハイマー病 [47,48,49]に比べてはるかに少ないプラークの蓄積と小さいサイズを持っているので、人間の散発性アルツハイマー病ケースではるかに高い成功率を持っている可能性があることを示すことになる。
さらに、我々がさらに注目した驚くべき発見は、5x家族性アルツハイマー病のような複数の遺伝子を導入したマウスの初期または前駆期に断続的な絶食給餌を行うと、これらのマウスの大脳皮質における神経炎症活動が悪化するという結果になったことである[38]。5x家族性ADマウスでは、強力な炎症性サイトカインである腫瘍壊死因子α(TNF-α)のレベルの上昇と相まって、Iba1陽性ミクログリア細胞が2倍に増加していることが、5x家族性ADマウスでは対照群と比較して検出された[38]。この観察は、不安に似た行動の増加傾向をさらに伴っていた [38]。この負の効果は、炎症のポリ(イノシン:シチジル)(I:C)モデルでも実証された[50]。ADFはポリ(I:C)に反応して循環サイトカインのレベルを増幅し、病気の行動を悪化させることが判明した[50]。さらに、同じ食事プロトコルでは、TRFおよび間欠的エネルギー制限(IER)とは対照的に、大腸炎および関連する行動障害に対する保護効果を示すことができなかった[51]。これは、異なる食事プロトコルは、いくつかの潜在的にそのような5x家族性ADマウスに適用されるようなADFの場合のような既存の病理学を悪化させると、異なる効果の範囲を持っている可能性があることを意味する可能性がある。
さらに、それは介入の結果としてのβアミロイドレベルの変化のための結果は一般的に混合されているが、認知機能障害は、これらの動物で改善されることが判明したことに注意することは驚くべきことである。5x家族性ADマウスを対象とした1つの研究[38]を除き、断続的な絶食はアドリバリウム食を与えた動物と比較して、失調した空間学習と記憶を改善することで、これらの動物を保護した[39,40,41,42]。トランスジェニックマウスとノックインマウス、および間欠的な絶食を受けたβアミロイド中毒アルツハイマー病ラットは、野生型またはトランスジェニック/ノックイン/中毒アルツハイマー病動物と比較して、Y迷路テスト、2日間の水迷路テスト、受動的回避テスト、およびモリス水迷路テストで認知的改善を示した[39,40,41,42]。ヒトにおけるプラーク負荷と認知機能障害との間の相関関係についての現在の理解は、全体的にかなり矛盾している。最近の所見では、プラーク負荷はアルツハイマー病を持つヒトの認知機能障害とよく相関しないことが示されている[52,53]。さらなる研究では、認知的に正常な高齢者において、広範なβアミロイド病理が示されている [54,55]。新たな証拠は、認知転帰がβアミロイド斑よりもタウタンパク質と密接に関連していることを示唆している [56]。このことは、高いβアミロイド負荷に耐えても認知障害を起こさないヒトがいることについて、もっともらしい説明を提供している[42]。しかし、ADFを受けた3xtgADマウスモデルでは、対照群と比較してタウタンパク質のレベルが低下していることが見られない。同様の観察は、断続的な絶食[40]を受けたβアミロイド中毒アルツハイマー病ラットでのために言うことができる。このことは、断続的な絶食が、タウおよび/またはβアミロイドの作用や存在とは異なる、明確化されていないメカニズムの経路を介して、これらの動物を保護しているのかどうかという疑問を投げかけている。
今日まで、ヒトの アルツハイマー病 被験者における断続的な断食の可能性を探った研究はない。しかし、高齢者を対象とした1つの関連性のある研究では、間欠的断食の応用が肯定的な結果をもたらした。定期的に断食を実践している軽度認知障害(MCI)の高齢者は、不規則な断食者や非規則な断食者とは対照的に、広い範囲の心理的ドメインにおける認知スコアの有意な増加を示した[57]。これらの人々は、抗酸化物質スーパーオキシドジスムターゼレベルの有意な上昇を示し、DNA損傷イベントの有意な低下を示した[57]。また、ベースライン時のレベルと比較してマロンジアルデヒドおよびc-反応性蛋白質レベルが低下していることも明らかになった[57]。これらの被験者は興味深いことに、36ヵ月間の追跡調査で健康な認知状態への回帰を示した [57]。これは、アルツハイマー病を持つ人々の間欠的な断食の潜在的な神経保護と神経認知効果のための予備的な証拠を提供する。
間欠的な断食は、神経栄養因子シグナル伝達の増加とオートファジーの活性化を介して神経保護効果を与える [58,59,60,61]。現在のレビューでは、間欠的な絶食がアクアポリン-4(AQP4)レベルを回復させたことが示唆されているが、これはAQP4に依存するグリアやリンパ系の経路系にとって重要であり、間質からの可溶性βアミロイドの除去に重要な役割を果たしている[41]。さらに、Liuらの研究[39]では、APPNL-G-Fをノックインしたマウスで断続的な絶食を行った場合、SIRT-3を介した海馬のニューロンネットワークの適応が報告されており、βアミロイドプラーク沈着とは無関係に、不安に似た行動の減少と海馬依存性の記憶力の上昇とが関連している。これらのことから、βアミロイドが存在していても断続的な断食はシナプス機能を維持する可能性があるという、限定的ではあるがもっともらしい証拠が得られた。
この知見には注意が必要である。このレビューの限界は、断続的断食とβアミロイド沈着に関連した5つの研究しか取り上げていないことである。これらの研究の研究デザインは、食事プロトコル、使用した実験動物の種類、発症年齢、研究期間などが多岐にわたっており、性質的に異質であることが判明した。このため、アルツハイマー病のβアミロイドレベルに影響を与えたり、減少させたりするための治療/予防ツールとしての断続的な断食の有効性について、自信を持って明確に解釈することは困難である。
ここで報告されている動物モデルは、ほとんどが自然界でのトランスジェニックであることを再度心に留めておくこと。これらの動物は、高レベルのβアミロイドを発現させようとするマルチコピートランスジェニック、アミロイド前駆体タンパク質(APP)プレセニリン1/2(PS1/2)および/またはタウの変異の組み合わせを持っている。例えば、5x家族性ADモデルは、3つのAPPおよび2つのPS1変異を組み合わせて作成された複雑なモデルであり、生後2ヶ月の時点でβアミロイドプラーク蓄積の急速な発症を引き起こす。同様に、ここで報告されているノックインマウスモデルは、5x家族性アルツハイマー病のようなAPPの過剰発現はないが、生後2ヶ月から進行性のプラーク形成を生じ、生後7ヶ月で飽和状態になる。一方、ダブルマウスやトリプルマウスのモデルでは、生後6ヶ月でβアミロイドが時々見られ、年齢とともにさらに進行する。これらのことから、1つの時点(すなわち、介入期間の終了時)でしか測定されない場合、治療または介入の成功または失敗をまとめて、決定的に確認することは困難である。間欠的な絶食は、この場合、βアミロイドを測定した時期や、試験対象のマウスの遺伝的背景に応じて、様々な経路を標的としていた可能性がある。このことが、本レビューで報告された所見の意義が一貫していない理由の一部を説明していると思われる。
この問題を解決するためには、複数の時点でのβアミロイドのレベルを調べる縦断的なアプローチが有効である。例えば、断食期間の2ヶ月、4ヶ月、6ヶ月の間に分子レベルでの時間的・年齢的な変化や、それに対応する行動や認知の変化を研究することで、断食がアルツハイマー病の病態にどの程度の効果を発揮しているかを把握するのに大いに役立つであろう。さらに、これらの期間にメタボロミクスプラットフォームを適用することで、間欠的断食の神経保護メカニズムを解明する上で重要なバイオマーカーに関する貴重な情報を得ることができる。さらに、この研究では、動物の健康を脅かしたり、既存の病態を悪化させたりすることなく、最適なプロトコルと状況を観察するために、いくつかの異なる形態の介入(ADFまたはTRF)を並行して試験する必要がある。さらに、絶食期間の期間を固定することは、複数の異なるモデルでのこの介入の潜在的な使用を考慮すると、この場合には非常に理想的であろう。
さらに、ここで報告された異なる研究では、βアミロイドのレベルを分析する方法が異なる(すなわち、IHCまたはELISA)ため、データを適切に比較することには少々問題がある。今後の研究では、プラークの総数や平均数ではなく、βアミロイド反応性を占有していた面積のパーセンテージを用いて、IHCの所見を提示すべきである。これらの免疫反応性測定値の定量方法は、研究室内/研究室間での再現性を確保するために、単一の機械やソフトウェアを用いて標準化する必要がある。これは、切片の収集方法や準備方法にも及ぶ。さらに、ELISAでは、固定スケールを用いたデータ表示が非常に重要である。これらは、将来の研究デザインの一貫性を可能にし、異なる研究間での直接比較を可能にするために必要である。
さらに、間欠的な絶食が神経原線維束の発現に及ぼす影響についても、さらに検討する必要がある。今回のレビューで報告された研究以外に、間欠的断食のタウの病理学的効果についての研究は他にない。今日までに、ケトン体であるβ-ヒドロキシ酪酸(絶食の副産物として知られている)のタウのタングルに対する効果を測定した研究は1つだけである。この研究では、その投与後のアポリポ蛋白質E4(APOE4)欠損マウスにおけるタウのタングルの高脂肪食(高脂肪食)誘発性凝集体の減少を実証した[62]。これは、適切なモデルを使用する場合には、断続的な絶食のアプリケーションが非常に関連性が高いことを有望な証拠を提供する。
さらに、これらのマウスは、プラークのいずれかまたは神経原線維性タウ抗原との組み合わせで発症する稀な遺伝的形態を模倣しているため、散発性ADモデルの使用は、将来の研究のために非常に保証されている。げっ歯類の脳内にグルコサミン・ニトロソ尿素であるストレプトゾトシン(STZ)を脳室内または腹腔内注射することで可能になった最近のモデルの1つが、散発性アルツハイマー病の代表的なモデルとして提案されている[63]。STZの投与は、ヒトにおける散発性アルツハイマー病の共通の特徴を共有するインスリン抵抗性の脳状態をもたらした。これには、空間学習障害、記憶障害、脳内凝集βアミロイド断片およびβアミロイド沈着物の増加、総タウ蛋白質、神経炎症、酸化ストレス、コリン作動性障害、およびグルコース代謝低下が含まれる[63]。これまでのところ、このモデルでの間欠絶食の応用は、糖尿病症候群の調節に向けられたものであり、神経変性に向けられたものではなかった[64]。このことは、アルツハイマー病に関連して間欠的な断食を研究する新しい道を提供するものである。
さらに、神経炎症に対する断続的な断食の効果を研究することはまた、食事の介入がどのようにアルツハイマー病の病理学に影響を与えることができるかについての我々の理解を高めることができる。間欠的断食、アルツハイマー病、神経炎症の直接的な研究は不足しているが、将来の取り組みのために考慮することができる予備的な証拠を提供することができる以前の関連性のある研究がある。そのような研究の一つは、間欠的な断食の前処置が炎症に対する持続的な神経保護を提供し、血管性痴呆のラットモデルにおいて認知障害を低下させることを報告している[65]。さらに、別の研究では、敗血症のラットモデルで認知障害の改善が示されている[66]。今後の研究分野は、βアミロイドおよび/またはタウの存在により活性化されたミクログリアによって引き起こされる炎症作用や、散発的なADモデルにおける断続的な絶食がどのように状態を改善するかを調べることによって拡大される可能性がある。
さらに、アルツハイマー病患者の女性の有病率が高いことを考慮すると、アルツハイマー病における性差の影響と断続的な断食との関係についての今後の研究に投資することが最善である。違いを直接比較した研究は1件しか報告されていない。しかし、その比較は断食後の認知的変化のみに限定され、βアミロイドおよび/またはタウの病理学的変化は認められなかった。この研究では、雄の3xtg-アルツハイマー病と比較して、雌の3xtg-アルツハイマー病 ad libitum給餌マウスのモリス水迷路試験では、脱出潜時が悪いか、またはより長い経路長が示された[42]。さらに、オスとメスの3xtg-ADマウスは、間欠絶食後の隠れたプラットフォーム試験で改善された性能を示した[42]。間欠的断食を性差に適用することは、男女ともにアルツハイマー病の臨床症状が現れる前に標的を絞った介入を導入することを可能にするために適切である。
さらに、散発性アルツハイマー病はβアミロイドクリアランスの失敗によって生じると考えられているため、βアミロイド蛋白質クリアランスと分解経路に対する食事プロトコルの効果に関する研究は、より長期化する必要がある[67]。さらに、間欠的な断食が腸内マイクロバイオームに及ぼす影響を調べ、神経変性をどのように相乗的に改善するかを調べることで、本研究をさらに発展させることができる。最近の研究では、間欠的な断食が糖尿病誘発性認知障害を改善し、腸内細菌叢を介していることが実証されている[68]。最後に、現在の状況での間欠絶食とカロリー制限の実践可能性に関する研究はまだ限られている。このことは、これら2つのライフスタイル介入から異なる活性化された経路を調べるために、動物とヒトでさらなる調査が行われることを保証するものである。
5. 結論
このスコープ・レビューは、間欠的な断食の現在の知識と理解、および アルツハイマー病 の実験動物モデルにおける βアミロイド沈着との関係を要約したものである。本研究から得られた知見は、レビューされた研究の数が限られていることと、研究デザインの不均一性を考慮すると、一般化することが困難であることが判明した。しかし、断続的な絶食とβアミロイド沈着との間には関係があるようであり、この分野での追加研究を保証し、介入がヒトでどのように潜在的に機能し得るかについての機会を提供している。将来的には、特定の動物モデルを用いたいくつかの異なる断食プロトコルをメタボロミクス解析と組み合わせて検討する縦断的研究を行うことで、この2つがどのように関連しているかについての新たな機序的洞察を提供することができるだろう。タウの病理学と神経炎症に関する更なる研究を検討する必要がある。今後の研究の成功は、間欠的な断食が安価で実行可能な、そして強力なアルツハイマー病予防ツールであることを実証する可能性がある。