Contents
www.ncbi.nlm.nih.gov/pmc/articles/PMC7115788/
要旨
レクチンは、様々な糖の構造を認識し、糖質複合体との相互作用により可逆的な結合を形成する立体特異性の高いタンパク質である。植物や動物をはじめ多くの種に豊富に存在し、赤血球の様々な血液群を凝集させることが知られている。
また、レクチンはその特異な糖質認識特性から、糖質複合体の検出・単離・特性評価、細胞・組織の組織化学、腫瘍細胞の認識など、タンパク質-糖質認識を利用した多くの生物学的機能に広く利用されている。
本総説では、植物レクチンの免疫調節作用と抗菌作用を含む疾患に対する効果をまとめた。
その結果、多くの植物レクチンが宿主の免疫応答を誘発し、サイトカインの放出とエフェクター機構の活性化をもたらすことで、その抗菌作用を媒介していることが明らかになった。
さらに、ある種のレクチンは、微生物感染時にマクロファージの貪食活性を高めることも明らかにした。レクチンは、熱で死滅した微生物と一緒にワクチンとして作用し、致命的な微生物からの長期的な保護を提供することができる。
したがって、レクチンを用いた治療法は、将来的には微生物疾患と効率的に闘うためのより良い代替手段として利用される可能性がある。
キーワード
レクチン、微生物、抗菌作用、免疫応答
1. はじめに
レクチンは、糖を特異的に結合する能力を有する天然の生理活性タンパク質および糖タンパク質である(Kennedy et al 1995; Goldstein and Hayes, 1978; Lis and Sharon, 1977; Gallagher, 1984; Brown and Hunt, 1978)。
これらの糖結合タンパク質は、細胞を凝集させたり、糖質共役体を沈殿させたりする非免疫起源のものである(Goldstein, 1980; Nilsson, 2007)。これらのタンパク質は、自然界にどこにでも存在し、多くの生命プロセスにおいて極めて重要な役割を果たすことが知られている(Kennedy et al 1995)。
これまでに、植物、藻類、真菌、無脊椎動物の体液、下部脊椎動物など、様々な供給源から多数のレクチンが単離されてきた。レクチンは、タンパク質と炭水化物の相互作用を研究するためのモデルとして、また、遊離型、脂質結合型、タンパク質結合型炭水化物を分析するための微妙なツールとして使用することができる。
レクチンは、その炭水化物結合特異性のために、作用部位に薬物を送達するためにさらに使用されている。植物や動物のレクチンは、様々な生物学的システムにおいて、細胞-分子間、細胞-細胞間相互作用における認識分子としての特異的な特性を示す報告が多くなされている(Sharon and Lis, 2004)。また、生物学的プロセスの解明や臨床診断システム、糖質構造の解明にも大きな役割を果たしている(Sharon and Lis, 2004; Moreira er al)。
2. 歴史の紹介
古来より、ある種の植物や動物の製品は人間に毒性があることが知られている(Warden and Waddell, 1884)。19世紀後半には、細菌学の科学が科学的思考とそのアプローチに大きな影響を与えていたが、種子の毒性は細菌の毒素によるものと考えられていた。
しかし、この理論は1884年にWanderとWaddellによって反論された彼らは、マメ(Abrus precatorius、Leguminosae)の毒性は、マメの水性抽出物からアルコールによって沈殿した’フラクション’にあることを報告した(WardenとWaddell、1884)。
同様に、Dixsonは1886年にヒマシ豆(Ricinus communis, Euphorbiaceae)の種子抽出物の毒性を報告した。19世紀の著名な薬理学者であるルドルフ・コバート(Rudolf Kobert, 1854-1918)は、彼の医学生であるピーター・ヘルマン・スティルマルク(Peter Hermann Stillmark, 1860-1923)に「毒性原理」化合物を求めてヒマシ豆の研究を依頼した。
1888年、彼はヒマシの種子からリシンを単離し、部分的に精製したタンパク質抽出物の動物(馬、犬、ウサギ、猫)の赤血球に対する反応性を調べ、ヒマシと他の4つのユーフォルビア科の植物から抽出した毒性のある抽出物がタンパク質であり、血球を凝集させる能力を持っていることを報告した。
彼は、リシンが毒性と凝集性を示す酵素(当時は「発酵」)であると仮定した(Stillmark, 1888)。その後、ハインリッヒ・ヘリンは、ドルパット大学でマメの抽出物に有毒なヘマグルチニンであるアブリンの存在を明らかにした(ヘリン、1891)。
スティルマルクの発見後、ポール・アールリッヒは、リシンとその関連毒物をモデル抗原としてジキマメの免疫学的研究に利用した。その後、リシンとアブリンの粗抽出物(市販されているものとして)を用いて、1891年に免疫学の最も基本的な原理を提唱した(Ehrlich, 1891)。
数年後の1902年、ウィーン大学のカール・ランドシュタイナー(Karl Landsteiner)は、異なる動物の赤血球に対するいくつかの種子抽出物の相対的な血糊化活性を観察し、この特異性を動物の血液血清の抗体と比較した。彼は、赤血球に対する植物アグルチニンの種特異性を観察し、ヒトのA、B、Oの血液群を発見した(Landsteiner and Raubitschek, 1907)。
1954年、ランドシュタイナーの発見に魅せられたボストン大学のウィリアム・C・ボイドは、その種を用いて血液群特異性の試験を行った。ボイドは、血液型A型では凝集が認められたが、リマインゲン(Phaseolus lunatus, Leguminosae)では特にB型やO型では凝集が認められなかった (Boyd, 1963; Boyd and Shapleigh, 1954)。
1954年、BoydとShapleighは、特定の赤血球に対する特異性を調査した後、血液型特異的な植物由来のアグルチニンを記述するために「レクチン」という用語を造語した。「レクチン」という言葉は、ラテン語の動詞 legere に由来し、選ぶ、読む、集めるという意味である(Boyd and Shapleigh, 1954)。
一般的に、この用語は、血液型特異性およびソースに関係なく、非免疫起源のすべての糖特異的アグルチニンを指定するために使用された(Brown and Hunt, 1978; Sharon and Lis, 1972)。ヘマグルチニン活性を示すタンパク質は、ヘマグルチニン、フィトヘマグルチニンまたはフィトアグルチニンとして言及される(Goldstein、1980;AllenおよびBrilliantine、1969;LisおよびSharon、1973)。
1980年に、Goldsteinらは、レクチンを、少なくとも2つの結合部位を介して炭水化物と結合し、植物および/または動物の細胞を凝集させ、多糖類、糖タンパク質または糖脂質を沈殿させる、非免疫起源のタンパク質または糖タンパク質と定義した(Goldstein, 1980)。
3. 命名法
レクチンは動物だけでなく植物にも存在することから、それぞれに特徴的な名称が付けられている。レクチン名の中には,Ricinus communis,Abrus precatorius,Canavalia ensiformis,Vicia faba からのレクチンの場合はそれぞれ,Ricin,Abrin,Concancanavalin(Con A),favin のように原種の学名に由来するものや,Pisum sativum,Phaseolus lunatus,Glycine max の種子からのエンドウ,リマビーン,ダイズのレクチンのように一般的な名称に由来するものもある(Goldstein and Hayes, 1978. Gallagher, 1984; Lis and Sharon, 1973; Carrington er al)。
, 1985). Prokop と彼の同僚たちは、血液群血清学の命名法を採用して、植物および動物のアグルチニンの命名法を提案した(Wiener, 1961, 1966)。彼らの提案した命名法では、レクチンは、異なる血液群の赤血球を凝集させる能力によって分類された(Prokop er al)。
A 型赤血球を凝集するすべてのレクチン、例えば Dolichos biflorus, Helix hortensis, Helix pomatia のレクチンは、それぞれ ADb, AHH, AHP と呼ばれ、A は抗原、Db, HH, HP はラテン語名の頭文字をとっている (Goldstein and Hayes, 1978)。
この方法では、炭水化物特異性が血液抗原と関係のないレクチンは分類できない。そこで、Goldstein と Hayes は、最初にレクチンの起源を述べ、それに続いて、カッコ内に糖結合特異性を引用し、次に、関連する場合には、異性特異性または嗜好性を示すという命名体系を提案した。
例えば、Con Aは’Canavalia ensiformis (α-D-Manp > α-D-Glcp > α-D-GlcNAcp)’と記載されている。この方式の主な欠点は、レクチンの反応性が炭水化物配列中の相補糖の位置に及ぼす影響や、特定の隣接糖の相乗効果を考慮していないことでした(Goldstein and Hayes, 1978)。
現在、新しいレクチンのほとんどは、その属名と種名で引用されている(Kennedy er al)。
4. レクチンの種類
現在、レクチンの定義の基準は、「レクチンまたは糖タンパク質は、炭水化物認識ドメインを有し、抗原性チャレンジとは異なる外部刺激によって誘導され、結合する炭水化物を修飾しないこと(Goldstein, 1980; Kocourek and Horejsi, 1983; Gabius, 1997)」とされている。
*
レクチンは微生物から哺乳類まで幅広い生物が産生しているため、その産生種に応じて、藻類レクチン、真菌類レクチン、細菌類レクチン、動物類レクチン、植物類レクチンなどに分類することができる。
4.1. 藻類レクチン
フィコレクチンとも呼ばれ、単糖類よりも糖タンパク質に特異性を示す。酸性アミノ酸を多く含み、金属イオンを必要としない生物活性を示する。藻類レクチンは、糖質結合性に基づいて、複合型N-グリカン特異的レクチン、高マンノース型N-グリカン特異的レクチン、および上記の両型N-グリカン特異的レクチンの3つに大きく分類される(Hori et al 1990; Rogers and Hori, 1993)。これらのレクチンは、抗炎症性、抗ウイルス性、抗腫瘍性、および費用対効果の高いタンパク質系のために、生物医学研究で使用されている(Singh er al)。
4.2. 真菌レクチン
ムチンやN-アセチルガラクトサミン(GalNAc)残基に対して高い特異性を示す。様々な真菌レクチンが同定されているが、そのうち82%はキノコ由来、15%は微小菌類(カビ)由来、3%は酵母由来である(Singh et al 2010, 2011; Kobayashi and Kawagishi, 2014)。
これらは通常、菌糸体の中のいくつかの例外を除いて結実体に存在する(Khan and Khan, 2011)。また、菌糸体の成長、発達、形態形成、分子認識に重要な役割を果たしている(Singh et al 2010; Khan and Khan, 2011; Varrot et al 2013)。
また、宿主糖質との相互作用を介して感染の初期段階に参加する(Singh et al 2011; Kobayashi and Kawagishi、2014; Khan and Khan、2011; Varrot et al 2013)。
4.3. 細菌レクチン
感染時に細菌の宿主細胞への付着を促進することからアドヒーシンとも呼ばれている。これらは糖質認識ドメイン(CRD)を介して糖鎖受容体に結合する(Hooper and Gordon, 2001)。ほとんどの細菌は、様々な糖質特異性を持つ複数の接着剤を保有している。
あるアドヒーシンはCRDを介して末端糖残基に結合するのに対し、他のアドヒーシンは直鎖または分岐オリゴ糖鎖の内部配列に結合する(Nizet et al 2017)。それは、宿主糖鎖との相互作用の間、共生体または対応する病原体のトロピズムを決定する上で重要な役割を果たす(Hooper and Gordon, 2001)。これらのレクチンは、接着および共生に役立つ(Nizet et al 2017; Lis and Sharon, 1986a)。
4.4. 動物性レクチン
CRD を介して複雑な炭水化物構造を結合させることが可能な、アミノ酸配列の変化に富んだ炭水化物結合タンパク質である。各動物レクチンは、115~130 アミノ酸残基の同一の配列モチーフを持つ独自の CRD を保有している(Kilpatrick, 2002)。
これらは、ガレクチン(または S 型レクチンラムノーズ結合レクチン(RBLC 型レクチン(CTLX 型レクチン(XTLP 型レクチン、F 型レクチン、ペントラキシンなど、CRD 配列モチーフとカチオン要件に基づいていくつかのファミリーに分類される。これらは、発生、免疫応答、オプソニゼーション、ファゴサイトーシス、補体経路の活性化に関与している(Gabius, 1997; Lis and Sharon, 1986a)。
4.5. 植物レクチン
特定の単糖またはオリゴ糖に可逆的に結合する少なくとも1つの非触媒ドメインを有する(Damme et al 1998; Van Damme、2007)。これらのタンパク質は、広大な分布と単離の容易さのために研究された最初のタンパク質でした。
現在までに 500 種類の植物レクチンが単離され、特徴付けられている (Van Damme et al 1998)。これらのレクチンは主に種子 (Hořejší and Kocourek, 1978; Pueppke, 1981; Young et al 1982; Tollefsen and Kornfeld, 1983)、根 (Gade et al 1981; Kalsi et al 1992)、貯蔵器官 (Allen and Neuberger, 1973; Cammue et al 1986) や葉 (Cammue et al 1985; Suzuki et al 1979; Yanagi et al 1990) に存在する。
これらのレクチンは、糖タンパク質とオリゴ糖の分離や構造解析のために、細胞表面の糖質共役体を認識するのに役立つ。さらに、これらのレクチンは、宿主と病原体の相互作用、発生、細胞のシグナル伝達、細胞間のコミュニケーションに重要な役割を果たしていることがわかっている(Sharon and Lis, 2004)。
さらに、これらのレクチンは、有害な植物病原性微生物、昆虫、捕食性動物から植物を保護する役割も果たしている(Bohlool and Schmidt, 1974)。植物レクチンはまた、宿主植物と窒素固定微生物との間の共生関係を確立する上で重要な役割を果たしている(Diaz er al)。
Nod因子が発見される以前は、マメ科植物の種子から分離されたレクチンは、2つの共生関係者の間の仲介者と考えられていた(Bohlool and Schmidt, 1974; Hamblin and Kent, 1973; Dazzo and Hubbell, 1975)。
マメレクチンは、細菌表面に存在する炭水化物部位を特異的に標的とし、結合する。この相互作用は、根から遠く離れたバクテリアの凝集、または根の上皮細胞への付着のいずれかにつながる。根毛への細菌の相互作用は、有効な根結節の拡大に不可欠な感染糸の生成を促進する(De Hoff er al)。
例えば、PSL(Pisum sativum lectin)遺伝子は、A. rhizogenesの形質転換によりTrifolium repens(ホワイトクローバー)に導入され、有効な結節を形成した(van Eijsden er al)。
他の研究では、宿主植物の根粒菌を介して結節を促進するための交雑種レクチンの役割も強調されている。例えば、Lotus corniculatus(通常は Mesorhizobium loti によって結節されている)に SBL(Soybean lectin)トランスジーンを挿入すると、ダイズ植物に適した根粒菌である Bradyrhizobium japonicum との結合親和性が向上した(van Rhijn er al)。
同様に、トランスジェニックイネ(一般的に菌根菌との共生関係を確立する)の根へのPSLトランスジーンまたはGlycine maxレクチンアピラーゼ/GSC2の挿入は、対照根と比較して、異なる根粒菌(R. leguminosarum、B. japonicumおよびRhizobium species NGR234)による根の植民地化をもたらした(Sreevidya et al 2005)。
また、L. japonicumへのGSC2遺伝子の導入は、Mesorhizobium lotiを接種した際に結節形成や感染糸の進行を増加させることが報告されている(McAlvin and Stacey, 2005)。また、レクチンヌクレオチドホスホヒドロラーゼ(LNP)として知られるLecRK DB46は、窒素制限条件下で発現レベルが上昇する結節形成に影響を与えることが示されている(Etzler er al)。
5. 植物レクチンの分類と構造
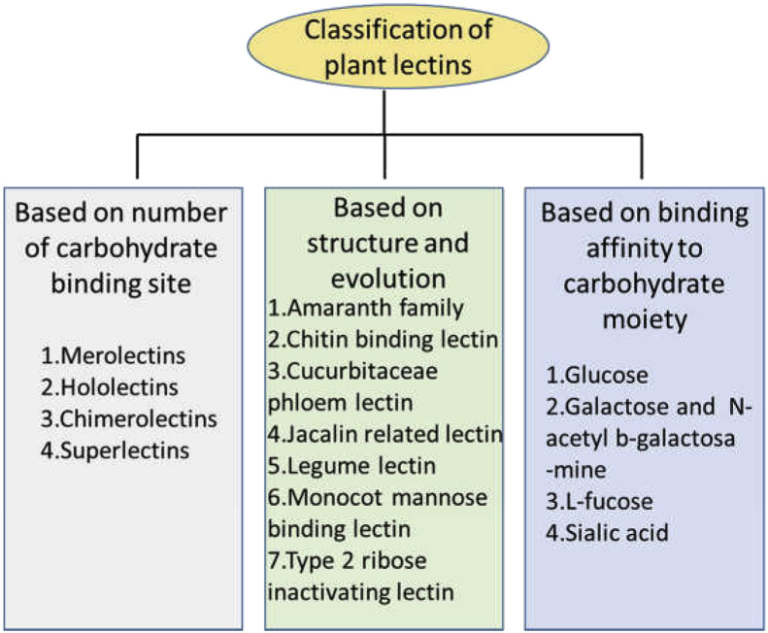
5.1. 全体構造によるレクチンの分類(図1)
図1 植物レクチンの分類
このような分類方法によると、植物レクチンは大きく4つに分類される。
5.1.1. メロレクチン
単一の糖質結合ドメインを有するレクチンはメロレクチンとして特徴づけられている。例えば、ゴム植物のラテックス(Hevea brasiliensis)に由来する小さなキチン結合タンパク質はメロレクチンであり、このタンパク質の唯一の炭水化物結合ドメインはHeveinである(Van Parijs er al)。
ヘベインはこのタンパク質の唯一の炭水化物結合ドメインである(Van Parijs et al 1991)。メロレクチンは一価であるため、グリココンジュゲートを沈殿させたり、細胞を凝集させたりすることができない。
5.1.2. ホロレクチン
ホロレクチンは、少なくとも2つの同一かつ類似の糖質結合ドメインを有する。ホロレクチンは自然界では二価および多価であるため、細胞の凝集および糖質共役体の沈殿を引き起こす。
5.1.3. スーパーレクチン
スーパーレクチンは、ホロレクチンとは異なるクラスのホロレクチンであり、キメロレクチンの特殊なグループとも考えられている。スーパーレクチンは、構造的に異なる糖を認識する2つの非同一の糖質結合ドメインを持っている。例えば、チューリップ球根レクチン TxLCI は、マンノースと GalNAc 糖残基を特異的に結合する 2 つの異なる糖質結合ドメインを含む (Van Damme et al 1997)。
5.1.4. キメロレクチン
キメロレクチンは、そのような炭水化物ドメインを含まないが、酵素活性を有する他のドメインとタグ付けされた炭水化物結合ドメインを有する「キメラ」タンパク質である。酵素ドメインは、糖質結合ドメインとは独立して動作する。存在する糖質結合部位の数に基づいて、キメロレクチンはメロレクチンまたはホロレクチンとして作用することができる。
例えば、2型リボソーム不活性化タンパク質(RIP)は多価であるため、細胞を容易に凝集させるのに対し、1価であるクラスI植物キチナーゼにはそのような活性はない(Barbieri et al 1993; Collinge er al)。
5.2. 構造的・進化的に関連するタンパク質によるレクチンの分類
図2 構造分類に基づく各種レクチンのリボン図
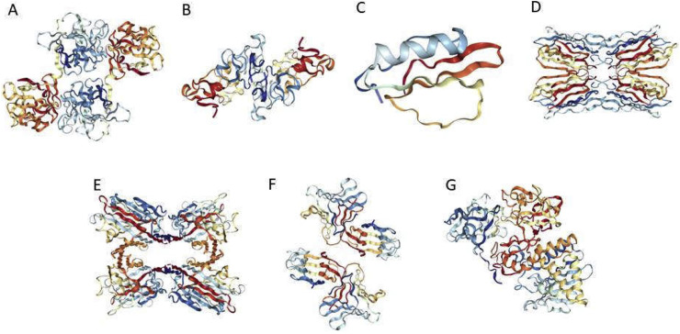
*
アマランチンレクチン(A、アマランチン科の最初のメンバー、PDBコード1JLX小麦胚芽アグルチニン(B、キチン結合レクチン科の最初の単離株、PDBコード1WGCカボチャレクチン(C、ウコン科のフロームレクチン科のメンバー、PDBコード1MITジャカリンレクチン(D. ジャカリン関連レクチンファミリーのメンバー、PDB コード 1JACSBL(E、マメ科レクチンファミリーのメンバー、PDB コード 1SBFGalanthus nivalis agglutininin(GNA)(F、マンノース結合レクチンファミリーのメンバー、PDB コード 1JPCリシン(G、Type-2 リボース不活性化レクチンファミリーのメンバー、PDB コード 2AAI)などがある。
5.2.1. アマランチン
このファミリーに属するレクチンは、専らアマランサス属の種子に由来する(Koeeppe and Rupnow, 1988; Zenteno and Ochoa, 1988)。このファミリーの最も重要なメンバーは,アマランサス属の種子からスクリーニングされた (Bird, 1954) ので,アマランチンと名付けられた。
この家族のレクチンは、完全に似ている約33 kDaの2つのサブユニットで構成されている。アマランチンのプロトマーは300アミノ酸残基で構成されており、短いらせんによってリンクされている2つの相同ドメイン(NとCドメイン)が含まれている。
各ドメインは、β-ヘアピンのキャッピングを有する6本の反平行βシートからなり、β-バレルアセンブリを形成している(Transue er al)。 2つのプロトマーは、実質的な非共有結合によって互いに連結されており、ネイティブホモ二量体を形成している。
炭水化物結合部位は、対向するモノマーのN-ドメインとC-ドメインの間の界面に形成される。アマランチンへの炭水化物残基の結合は、表面に露出したヘアピンおよびターン上に位置するアミノ酸残基との複雑な水素結合パターンに依存する。アマランチンは、T-抗原二糖であるGal β(1,3) GalNAcに対してより高い親和性を示すGalNAc特異的レクチンと考えられている(Rinderle et al 1989)。
5.2.2. キチン結合レクチン
少なくとも1つのヘベインドメインを含むタンパク質はすべてキチン結合レクチンに分類される。キチン結合レクチンである小麦胚芽アグルチニン(小麦胚芽アグルチニン)の単離と特徴付けは、永田とレヴィーンのグループが最初に行った(Nagata and Burger, 1972; LeVine et al 1972; Wright, 1990)。
キチン結合レクチンのファミリーは、ホロレクチンの他にメロレクチンや異種のキメロレクチンから構成されているため、ネイティブレクチンの分子構造とは異なる。最も単純なキチンレクチンは、単一のヘベインドメインで構成されている。
*
完全なヘベインドメインは43個のアミノ酸残基と4個の鎖内ジスルフィド橋を有しているが、一部のレクチンに見られる切断ヘベインドメインは30個のアミノ酸残基と3個の鎖内ジスルフィド橋を有している。2つのドメインプロ トマーを持つキチン結合レクチンは、単量体の Urtica dioica agglutininin (UDA) に見られ、2量体のキチン結合レクチンは Viscum album (Beintema and Peumans, 1992; Peumans et al 1996) や Phytolacca americana lectin Pa-5/PL-D (Yamaguchi et al 1996) に見られる。
3つのドメインのプロトンマーは、Phytolacca americanaのルートレクチンに排他的に見出されている(Yamaguchi er al)。 また、グラミネア種のレクチンには、4つのヘベインドメインプロトンマーが存在する。
キチン結合型レクチンには,メロレクチンとホロレクチンの他に,少なくとも2種類のキメラレクチンがある。第一のグループは、二量体であり、O-グリコシル化されたセリンヒドロキシプロリンリッチドメインに連結された3つのヘベインリピートを持つN末端キチン結合ドメインからなるプロトンマーからなるソラマメ科のレクチンである(Kieliszewski et al 1994; Allen et al 1996)。
第2のグループは、触媒的に活性なキメラースドメインにグリシン/プロリンリッチヒンジドメインを介して連結された単一のN末端ヘベインドメインを含むクラス1キチナーゼである(Colllinge et al 1993;Beintema、1994)。
キチン結合レクチンの炭水化物結合部位は複雑であり、それらは優先的にGlcNAc(N-アセチルグルコサミン)三量体または四量体に結合する。キチン結合レクチンの炭水化物結合ドメインの立体構造は、主にヘベイン単位の構造によって決定される。
H-NMR分光法により、ヘベインドメインは、ポリペプチド鎖のN末端に位置するアミノ酸残基の伸張からなり、反平行βシートに続くαヘリックスに続く2本のストランドを形成していることが明らかになった(Andersen er al)。
N末端領域の折り畳みは、4つの鎖内ジスルフィド結合によって安定化されている。反平行βシートの両鎖は、GlcNAc含有オリゴ糖の結合に関与するいくつかの残基(Ser19,Trp21およびTrp23のような)を含む(Asensio et al 1995)。
5.2.3. ウリ科のフロームレクチン
ウリ科のフロムレクチンは、キチン結合レクチンの亜科である。これらのレクチンは、ウコン科の葉に含まれている。この科の最初のレクチンはカボチャ(Cucurbita maxima)から単離され、カボチャレクチンと命名された(Hossaini, 1968; Liu er al)。
その後、Cucurbita, Citrullus, Cucumis, Sechium, Luffa, Coccinia 種など、様々な種類のウリ科の樹皮から多くのレクチンが単離され、アグルチニン活性を示すようになった(Allen et al 1996; Read and Northcote, 1983)。
一般的に、ウリ科のフロームレクチンは、2 つのサブユニット(各 25 kDa)が 2 つの鎖間ジスルフィド結合を介して共有結合した二量体を形成している(Read and Northcote, 1983)。
5.2.4. ジャカリン関連レクチン
ジャカリンとは、ジャックフルーツ(Artocarpus integrifolia)の種子に由来するレクチンの俗称である。ジャックフルーツのレクチンに構造的・進化的に関連するレクチンはジャカリン関連レクチンと呼ばれている。ジャカリン関連レクチンは、ガラクトース特異的亜科に属するものとマンノース特異的亜科に属するもののいずれかである。
ガラクトース特異性を持つレクチンは、単一の糖結合部位を持つ大α鎖と小β鎖からなる4つの同一のプロトンマーから構成されている。X線回折解析の結果、ジャカリン(Sankaranarayanan et al 1996)の3次元構造は、3倍の対称的なβ-プリズムから構成されていることがわかった。
各β-プリズムはさらに3本の4本鎖βシートを含んでいる。12本の鎖のうち、11本の鎖はα鎖によって構成されており、β鎖は12本目の鎖を形成している。4つのプロトンマーは、非共有結合により互いに連結し、四量体構造を形成している。
各プロトマーは、メチルα-D-ガラクトースのO3,O4,O5,O6と水素結合のネットワークを形成するα鎖のGly、Tyr、Trp、Aspからなる単一の炭水化物結合部位を含んでいる。ガラクトース特異的サブグループは、Galβ(1,3)GalNAcに対して高い親和性を示す(Sarkar et al 1981;Sastry et al 1986)のに対し、マンノース特異的ジャカリン関連レクチンは、マンノースおよびマルトースに特異的に結合し、オリゴ糖に対して高い親和性を示す(Van Damme et al 1999;Peumans et al 1997)。
5.2.5. マメ科レクチン
マメレクチンは、マメ科から分離されたレクチンの一族である。マメレクチン科は植物レクチンの中で最大の科である。
現在までに、マメ科の70種から100種のマメレクチンが単離されている。ロビンは、1890 年に Power と Cambier によって、マメ科の木であるブラックイナゴ(Robinia pseudoacacia)の樹皮から単離された最初のマメ科レクチンである (Liener, 2012)。
マメ科レクチンファミリーは、他のどのレクチンファミリーよりも幅広い特異性を示すことが示唆されている。すべてのマメ科レクチンは、30 kDa のプロトンマーで構成されている(Olsen er al)。 マメ科レクチンの多くは、約250アミノ酸残基からなる1本のポリペプチド鎖からなる成熟したプロトマーであるため、1本鎖マメ科レクチンと呼ばれている。
マメ科レクチンの中には、2種類の異なるポリペプチド形態を持つものもあり、それらは2本鎖マメ科レクチンと呼ばれている。また、多くのマメ科レクチンはN-グリコシル化されており、これらのレクチンでは、プロトンマーは1本または2本のグリカン鎖を含んでいる。
また、マメ科植物レクチンは、すべての植物レクチンの中で唯一、原体が強固に結合したMn2+とCa2+イオンを含む金属タンパク質であり、これが炭水化物結合特性に関与している(Peumans et al 2001)。
また、両二価の陽イオンは、単糖結合部位の機能的コンフォメーションを安定化するために不可欠である(Agrawal, 1967)。炭水化物結合部位の他に、プロトンマーは、主に保存された疎水性残基によって形成される疎水性空洞を含む。
ほとんどのマメ科レクチンは、二重対称平面内で相互作用する2つのプロトンマーから構成されている。その結果、対向する2つのモノマーが、それらの平坦な底面とループによって、二量体の末端に位置する単糖結合部位を形成することによって、12本の鎖状のβ-サンドイッチが形成される。ドーム状のプロトンマーの上部に見られる数個のアミノ酸残基が単糖結合部位を形成している。これらの部位を介して、マメ科レクチンはマンノース、グルコース、フコース残基に特異的に結合する。
5.2.6. 単糖マンノース結合レクチン
単子葉植物のマンノース結合レクチンは、マンノース特異的なレクチンのスーパーファミリーである。単子葉植物に排他的に見られる。マメ科のレクチンやジャカリン関連のレクチンとは構造的にも進化的にも異なる。
最初の単子葉植物のマンノース結合レクチンは、スノードロップバルブ(Galanthus nivalis)から単離され、GNA と呼ばれるようになった(Van Damme er al)。 他の類似のレクチンを異なるモノコット科から分離した後、それはモノコットマンノース結合レクチンファミリーと命名された。
このファミリーのレクチンの立体構造に関する詳細な情報は、GNAおよび関連レクチンの構造を研究することによって得られている(Wright et al 1990; Hester et al 1995)。ネイティブGNAは、109残基(12kDa)の4つの同一の非共有結合プロトンマーから構成されている。
各プロトンマーは、3つのタンデムに配列したサブドメイン(サブドメイン1,2および3と呼ばれる)から構成されている。さらに、各サブドメインは、4本の鎖状βシートを含み、ポリペプチド鎖の延長C末端に位置するシートによって完成されている。
すべてのサブドメインは、ループによって互いに連結されており、βシートの3つの束によって形成された裂け目に位置するマンノース結合部位を含む12本鎖β-バレルを形成している。プロトンマーのCys29,Cys52の間には単一のジスルフィド結合が存在する。
4つのプロトンマー(A、B、CおよびD)が非共有結合的相互作用によって一緒に結合されると、GNAホモ四量体は、16 A0の中央の幅の広い溶媒チャネルを有する扁平なクラウンのように見えるように形成される。4つのプロトンマーは、水素結合によって対になって(つまり、AはDと、BはCと)結合し、C末端の鎖交換によって安定化されたタイトな二量体になる。
さらに、A-DおよびB-C二量体の四量体への結合は、主に疎水性相互作用を伴う。プロトマーあたりの炭水化物結合部位は3つであり、したがって、合計で12の機能的なマンノース結合部位がネイティブGNAテトラマーに見出されている。
5.2.7. 2型リボソーム不活性化タンパク質(RIP)
RIPは、真核生物のリボソームの触媒的阻害剤として知られている(Barbieri et al 1993)。RIPは、1型RIPと2型RIPの2つのグループに細分化されている。タイプ1 RIPはポリヌクレオチド:アデノシングリコシダーゼ(PAG)活性を持つ小型のタンパク質であり、タイプ2 RIPは酵素活性と糖質結合活性を持つ機能的にも構造的にも異なる2つのA鎖とB鎖を持つ典型的なキメラタンパク質である。
N末端のA鎖(25-30 kDa)はN-グリコシダーゼ活性を持ち、C末端のB鎖(30-35 kDa)は2つの異なる糖質結合部位を持っている。さらに、両方の鎖は、A鎖のC末端とB鎖のN末端に位置するシステイン残基の間のジスルフィド結合を介して一緒に残っている。
成熟した原体は[A-s-s-B]ペアと呼ばれ、酵素的にも炭水化物と結合する性質を持っている。ネイティブ2型RIPは、単量体(1つのプロトンマー対を持つ2量体(2つのA-s-s-B対4量体(4つのA-s-s-B対を持つ)のいずれかである。
このファミリーの3次元構造情報は、Ricinの結晶構造解析から得られている(Rutenber and Robertus, 1991)。各プロトマーに存在する鎖は、8本のαヘリックスと6本のβシートから構成されている。N末端酵素部位は、Tyr80,Tyr123,Glu177,Arg180およびTrp211残基を含み、これらは、触媒のコンフォメーションを維持するのに役立つ残基、すなわちAsn78,Arg134,Gln173,Ala178,Glu208およびAsn209に囲まれている(Rutenber and Robertus, 1991; Kim and Robertus, 1992; ChaddockおよびRoberts, 1993)。
各プロトマーのB鎖は、ドメイン1とドメイン2と呼ばれる2つの類似したドメインから構成されており、各ドメインは、λ、α、β、γという4つのサブドメインを含み、α、β、γは高い残留類似性を示す。リシンのB鎖は、いくつかの短いβシート鎖とともに、ターンとループで連結されたコイル構造から構成されている。
B鎖の折り畳みは、4つのジスルフィド橋によってさらに安定化されている。ドメイン1および2の全体的な折り畳みは、典型的なβ-トレフォイル構造によって特徴づけられる(Murzin et al 1992)。タイプ2のRIPの多くは、ガラクトース、GalNacまたはGal/GalNac残基に対して特異性を示すことが見出されている(Peumans et al 2001)。
6. 植物レクチンの一般化された機能(図3)
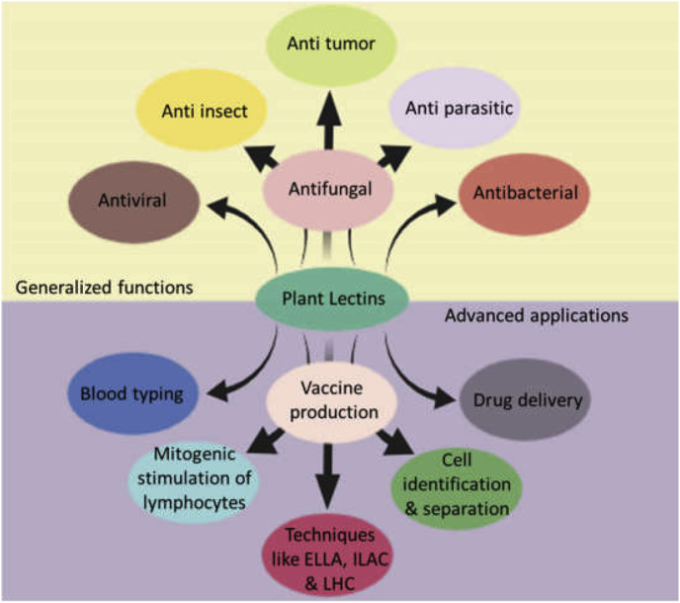
植物レクチンの一般化・高度化応用
レクチンは特定の糖質を糖複合体に結合させる能力を持っているため、タンパク質の糖質相互作用を利用した多くの生物学的分野で利用されている。レクチンの主な貢献の一部を以下に紹介する。
6.1. レクチンの抗昆虫活性
植物レクチンは、コレオプテラ、双翅目、鱗翅目、ヒメノプテラ、イソプテラ、ニューロプテラ、ホモプテラなどの異なる目に属する広範囲の昆虫に 対して潜在的な殺虫剤として作用する。それらは、従来の昆虫防除手段の代替手段として以前に成功裏に使用されてきた(Santos et al 2014; Hamid et al 2013)。
いくつかの植物レクチンは、昆虫の正常な生理学的プロセスを妨害することで、昆虫の様々なライフステージ(ニンフ、成虫、排卵)に対して有害な効果を示すことが報告されている(Sadeghi et al 2006; Lagarda-Diaz et al 2017)。
さらに、過去数十年の間に、レクチン遺伝子の導入は、小麦、イネ、タバコ、ジャガイモなどのアブラムシ、蛾、プラントホッパーなどの昆虫からの保護を提供する上で非常に重要であることが判明している(Lam and Ng, 2011; R. Lam and Ng, 2011; Rüdiger and Gabius, 2001)。
植物レクチンの殺虫作用の正確なメカニズムは完全には知られていないが、多くの研究により、レクチンの炭水化物認識特性がこの作用を媒介することが示唆されている(Lagarda-Diaz er al)。 レクチンは、腸周囲膜および/または腸中域のキチン質構造物との相互作用を介して毒性を発揮し、それにより消化・吸収を阻害し、昆虫の死に至る栄養欠乏を引き起こす(Walski er al)。
また、他の報告では、レクチンの細胞内標的が、中腸上皮または腸周囲マトリックスのいずれかに結合することにより、食物摂取量を減少させることが示されている(Fitches et al 1997)。上皮細胞の表面には糖タンパク質が豊富に含まれており、レクチン結合の十分な標的となる。
さらに、これらの分子は、中間腸管上皮バリアを越えて昆虫の循環系に入り、自己防衛に関与する血 液中に存在する内因性レクチンとの干渉により、毒性作用をもたらす(Fitches et al 2001 )。他の方法では、内細胞小胞によるレクチンの上皮細胞への内部化は、核局在化と配列依存性の核タンパク質輸入を阻害し、最終的には細胞増殖を阻害することになる(Yu er al)。
レクチンと昆虫細胞との相互作用に関与するメカニズムの如何に関わらず、レクチンが毒性効果を発揮するためには、消化酵素によるタンパク質分解を回避し、昆虫の腸内で同化性タンパク質に対する抵抗性を示さなければならない。消化酵素に対する抵抗性のレベルは、昆虫の腸のグリココンジュゲートに結合するレクチンの能力に依存する(Lagarda-Diaz et al 2017)。
通常、レクチンのための重要な受容体は、腸上皮細胞の表面に存在するが、レクチンが内在化を受ける場合には、いくつかのケースでは、それらは、宿主の新しい標的セットと相互作用し、特定の代謝経路に影響を及ぼす可能性がある。しかし、このような内包化は、非マメ科のレクチンに多く見られる。
例えば、ニンニク葉のレクチンは、昆虫の中腸膜に存在するグリコシル化アルカリホスファターゼとの結合を介して内包化される。人工飼料または実験環境に組み込まれた場合のレクチンは、昆虫を標的とする(Lagarda-Diaz et al 2017)。例えば、Arisaema jacquemontii レクチン(Kaur et al 2006 )は Bactrocera cucurbitae の幼虫の発育に悪影響を与え、Arisaema helleborifolium レクチン(Singh et al 2006 )は人工飼料に組み込むと B. curcurbitae の第二齢幼虫に対して殺虫効果を発揮した。
同様に,Dioscera batatas レクチンは,幼虫のブラシ縁や腹膜に強固に結合することで,Helicoverpa armigera の幼虫の成虫への到達を阻害した(Ohizumi er al)。 また,Annona coriacea レクチンは,腸膜環境を変化させ,消化酵素のリサイクル機構を阻害することで,アナガスタ クチネラに対して毒性を示すことが実証されている(Coelho er al)。
さらに、レクチンの特定の糖残基に対する特異性も、その抗昆虫活性を媒介する上で重要な役割を果たしている。Sadegehi らの研究では、複数の特異性を持つ 14 種類のレクチンを使用した場合、すべてのレクチンが C. maculatus 成虫の排卵を阻害する効果を示した。
さらに,キチンと結合する能力を持ち,マンノースやグルコースで阻害される Talsia esculanta レクチンは,Callosobruchus maculatus や Zabrotes subfasiatus の幼虫の死亡率を増加させた (Macedo et al 2002)。
これらとは別に、過去 10 年間で様々な植物レクチン遺伝子が様々な作物に組み込まれ、害虫による大きな被害から作物を守ることができるようになった。昆虫特異的なクモの神経毒である SFTI(Segestria Florentine toxin I)と融合した GNA レクチンは、その神経毒を鱗翅目の幼虫のヘモリンに運び、SFTI と GNA の融合は幼虫に毒性をもたらした(Fitches er al)。
Bauhina monandra の葉レクチンを添加した人工飼料は、Zabrotes subfaciatus と Callosobruchus maculatus で死亡率を示した (Braga et al 2007)。
また、Allium sativum レクチンを発現させたトランスジェニックタバコ植物の葉の剥離は、Spodoptera littoralis 幼虫の体重増加、発育、変態の減少をもたらした(Sadeghi er al)。 また、GNAアグルチニンを発現させた植物は、Rhopalosiphum maidisのニンフの産生量の有意な減少を示した(Wang er al)。
6.2. レクチンの抗癌活性
レクチンは、糖タンパク質中の特定の糖残基や糖脂質複合体に結合するという本質的な性質を持っているため、癌研究を含む多くの生物医学研究への応用が期待されている(Hamid er al)。 これまでに、様々な植物レクチンは、白血病、肉腫、肝腫、乳癌などの様々な癌種に対する抗腫瘍剤/抗腫瘍剤として使用されてきた(Li er al)。
Li er al)。 レクチンの抗がん性は、アポトーシスやオートファジーを誘導してテロメラーゼ活性を低下させ、血管新生を阻害してがん細胞への細胞毒性を誘導することで、腫瘍の増殖を抑制する能力に基づいている(Hamid et al 2013; Yau et al 2015)。
さらに、レクチンは、腫瘍細胞で優勢に発現する修飾された糖鎖構造を認識することにより、正常細胞と悪性細胞を区別するためにも使用される(Haseenabeevi et al 1991)。これらとは別に、化学療法剤と結合した後のレクチンは、腫瘍細胞を特異的に標的とするための担体として作用する。
例えば、Neutschらの研究では、小麦胚芽アグルチニンで機能化したナノキャリアの尿道粘膜細胞への結合親和性が増加したことが示されている。さらに、このマイクロ粒子はまた、強化された抗腫瘍活性を示した(Neutsch et al 2013)。
同様に、チモペンチンを担持した小麦胚芽アグルチニンタグ付きナノ粒子は、ウィスターラットの腸管粘膜への吸収と薬物送達の増加を示した(Yin et al 2006)。アルギン酸マイクロビーズにカプセル化されたPisum sativum種子から単離されたレクチンは、肝細胞癌への薬物送達が強化されたことを示した(El-Aassar et al 2014)。
Con A関連マイクロスフィアはまた、刺激された消化管液中のアモキシシリン三水和物薬物の増加した付着および放出を示した(Bakowsky et al 2008年;Jain et al 2014)。Bauhinia purpurea agglutininin結合リポソームは、ヒト前立腺癌を標的として使用され、このリポソーム製剤は、マウスのDU145細胞に特異的に結合した後、細胞増殖を抑制することが示された(Ikemoto et al 2016)。
*
これまでに多くの研究が、癌治療の様々な局面でのレクチンの抗腫瘍剤としての使用を結論的に示唆してきた。それらのいくつかは、以下のように要約することができる。
6.2.1. アポトーシスとオートファジー誘導を介したレクチンの抗癌活性
マメ科植物アルトカーパス(Artocarpus incise)から単離されたレクチンであるフルタリンは、HeLa 細胞において、腫瘍細胞の増殖を阻害する細胞ストレスを誘導することで、アポトーシス活性を示した(Olivira er al)。
マンノース/グルコースと特異的に結合するマメ科レクチンであるCon Aは、ミトコンドリアの集合とチトクロームcの放出を介して、マウスマクロファージPU5-1.8細胞においてアポトーシスを誘導することが報告されている(Li et al 2010)。
また、ハトムギ由来のレクチンは、慢性骨髄性白血病細胞株 K562 において Bcl-2 の発現を低下させることで、カスパーゼ依存性のプロアポトーシス活性を示した(Lavrik er al)。 また、別の研究では、ヒトメラノーマ A375 細胞において、ミトコンドリア依存性の膜電位崩壊を介してチトクローム c の放出とカスパーゼ活性化を誘導し、ミトコンドリアを媒介とするアポトーシスを誘発するコン A 処理の役割も実証されている。
Viscum album 由来の別のレクチンは、Molt 4 細胞株(T 細胞由来の白血病)に細胞毒性を示した(Peumans et al 1996 )。また、HeLa 細胞で大豆レクチンを処理すると、細胞内のアポトーシス、オートファジー、DNA 損傷を誘導し、活性酸素種の発生を用量依存的に増加させることが報告されている(Hajela et al 2002)。
ハリコロナクレーターレクチンは HeLa 細胞と Fem X 細胞に細胞毒性効果を示し、暗赤色インゲン豆アグルチニンは白血病の L1210 細胞に抗腫瘍活性を示した(Pajic et al 2002 )。デルモンテバナナのレクチンは、L1210細胞や肝腫(HepG2)細胞の増殖を遅らせることが報告されている(Cheung er al)。
エクストラロングパープルビーン由来のレクチンは、アポトーシス体の産生を介して、肝細胞腫HepG2細胞の成長を遅らせた(Fang et al 2010)。さらに、B16 -BL6 メラノーマ(Park er al 2009aヒトメラノーマA375細胞のPolygonatum cyrtonemaレクチン(Liu et al 2009b乳癌MCF-7細胞のフレンチビーンアグルチニン(Lam and Ng、2010)は、腫瘍細胞のクリアランスにつながるアポトーシスの誘導を示した。
これに加えて、レクチンは、死の受容体(FAS 受容体など)を介したアポトーシスの開始にも重要な役割を果たしている(Liu er al)。 さらに、レクチンは、Bcl-2,オートファジー(ATG)関連、カスパーゼ、p53,ERK、Ras-Raf、BNIP3 などの様々なファミリーのメンバーの発現に関与するシグナル伝達経路を変化させ、アポトーシスやオートファジー誘導を引き起こす可能性がある。
また、生体内試験系でのレクチンの抗癌効果もよく研究されている(Jiang er al)。 肉腫 180 を有するホワイトキンミングマウスの腹腔内注射による Plurotus citrinopileatus (Li et al 2008) および R. lepida (Zhang et al 2010a) のレクチンは、腫瘍の増殖を抑制することが判明した。
しかしながら、細胞死を誘導するためには、レクチンエンドサイトーシスが必要である。例えば、Con Aの毒性は、細胞膜糖タンパク質のマンノース部位への結合に依存し、その後、オートファジーを活性化し、影響を受けたミトコンドリアを分解し、リソソームを介して細胞死を引き起こすミトコンドリア内への内在化および蓄積に依存する(Kim et al 1993; Chang and Lei, 2008)。
6.2.2. 癌治療におけるレクチンベースのデリバリーシステム
臨床現場でのレクチンの有用性を広げるために、レクチンベースの送達システムが開発されてきた。Plattner らは、小麦胚芽アグルチニン および Ulex eueropaeus agglutininin(UEA)がヒト尿路癌 5673 細胞と強い相互作用を持ち、膀胱癌細胞を標的とするために使用されたことを実証した(Plattner et al 2008 )。
さらに、リポソームにカプセル化された Cratylia mollis レクチンは、肝臓および腎臓への毒性が低く、肉腫 180 を有するスイスのマウスでは抗腫瘍活性が改善された (Andrade et al 2004)。また、生分解性ポリマー壁でコーティングされたアルギン酸/キトサンマイクロカプセルは、ヤドリギレクチンに安定性を与え、胃の酸性pHでの分解から保護している(Lyu et al 2004)。
ナノ粒子の表面に取り込まれた後、Bauhinia monandra leaf(BmoLL)およびLens culinaris(LCL)に由来するレクチンは、放出が制御された経口薬のための潜在的なツールとして作用する(Rodrigues er al)。
6.2.3. 悪性腫瘍の同定のためのレクチン
新生細胞内の糖タンパク質や糖脂質は、その糖鎖パターンの変化を受け、その結果、細胞接着、血管新生、細胞分裂、転移など、腫瘍の発生や癌の進行に直接関係するいくつかのプロセスを誘導することができる膜シグナル分子が生成される(Taniguchi and Korekane, 2011)。
これらの異常な糖鎖パターンは腫瘍特異的なものと考えられており、疾患の進行と予後の間の指標となる。腫瘍内で発現している糖鎖構造の変化はレクチンを用いて検出することができる(Teixeira er al)。 Litynskaらによる研究では、異なるヒトメラノーマ細胞株におけるフィトヘマグルチニン(PHA)レクチンおよびGNA、S. nigraレクチン、MAL、Datura stramonium agglutininin(DSA)および小麦胚芽アグルチニンのような他の非レグルマレクチンの結合パターンを実証し、表面に露出したオリゴ糖へのレクチンの結合の程度が、転移を誘導する腫瘍細胞の能力と関連していることを発見した(Litynska et al 2001)。
さらに、G. simplicifolia lectin-1(GSL-1)およびVicia violsa agglutininin(VVA)を用いたヒト乳管癌in situ(DCIS)における炭水化物抗原の発現解析により、DCIS患者におけるVVAおよびGSL-1の発現と腫瘍グレードとの間に正の相関があることが明らかになり、癌の浸潤性における抗原性決定因子の役割が示唆された(Korourian er al)。
ラット前立腺癌で発現した豊富なN-アセチルグルコサミン(α1,3N-アセチルグルコサミン/ガラクトースおよびガラクトース(β1,4N-アセチルグルコサミン(α,2)マンノース(α1,6)残基をN-アセチルグルコサミン特異的および複合オリゴ糖特異的レクチンで標識することにより、これらの糖残基が前立腺細胞の形成不全および新形成挙動に関与していることが示唆された。
また、Con AとUEA 1は、耳下腺癌と粘表皮癌のマーカーとしても使用されており、それぞれ高悪性度、低悪性度、中悪性度の異形成を示している(Sobral et al 2010)。ジャックフルーツレクチン(JFL)およびピーナッツアグルチニン(PNA)は、さまざまな口腔粘膜病変における腫瘍進行のさまざまな病理学的ステージの同定に使用されていた(Kumar et al 2012)。上記の研究は、レクチンが癌診断および転移検出のための潜在的なツールを開発するために使用できることを明確に示唆している。
6.2.4. 臨床現場でのレクチンの使用
近年、多くの植物レクチンが癌治療に利用されており、その中には優れた抗腫瘍活性を示し、現在、前臨床試験や臨床試験が行われているものもある。様々なレクチンの中で、マメ科レクチン、Con A、PHA、ヤドリギなどのレクチンが癌治療に最も貢献してきた(Liu er al)。
最近の報告では、オートファジー誘導やT細胞のマイトジェンとしての免疫刺激作用により、生体内での肝細胞腫に対するCon Aの抗がん剤としての役割が解明されている(Chang and Lei, 2008; Lei and Chang, 2009)。また、化学的に修飾された形態のCon Aをメラノーマのマウスに投与すると、腫瘍細胞に対する末梢リンパ球の抗がん能が増強された(Ueno et al 2000)。
同様に、生インゲン豆由来のPHAを食事に取り入れると、マウスの非ホジキンリンパ腫腫瘍の増殖を抑制した(Liu et al 2010;Remmelink et al 1999)。並行して、小麦胚芽アグルチニン処置は、宿主免疫応答の調節を介してマウスの寿命を増加させることが示されている(Liu et al 2010)。
ヤドリギのレクチンを投与すると、腫瘍細胞の有糸分裂を停止するだけでなく、アポトーシスや壊死を刺激して腫瘍の成長を減少させる結果となった(Seifert et al 2008)。また、韓国のミズナラタケからの抽出物は、マウスモデルで大腸がん、リンパ腫、メラノーマ細胞の腫瘍転移をブロックすることが示されている(Yoon er al)。
これとは別に、様々な癌患者群に対するヤドリギレクチン抽出物の臨床的有効性および安全性を確認するために、多くの臨床試験が実施されている(Stauder and Kreuser, 2002)。標準化されたヨーロッパ産の発酵ヤドリギエクストラクトであるイスカドールは、異なる病期のメラノーマ患者の術後アフターケア中に使用した場合、安全であり、未治療群と比較してさらなる腫瘍増強の減少を示したことが判明した(Augustin et al 2005)。
天然ヤドリギレクチンIの組換え補体であるアビスクミンもまた、様々な臨床病期の癌患者におけるその安全性プロファイルおよび最適な忍容量をモニターするために臨床的に試験されている。Rüdiger及びGabius、2001;Schöffski et al 2004)。
6.3. レクチンの抗糖尿病活性
糖尿病は、一般的に糖尿病としても知られている、血糖値の増加を引き起こす代謝性疾患である。それは、ほぼ糖尿病網膜症、糖尿病神経症、糖尿病腎症、心臓病や脳卒中のリスクなど、多かれ少なかれ似たような医療合併症を示す1型とII型糖尿病に分かれている。
Kolb Hらは、ストレプトゾトシン誘導糖尿病マウスにCon Aを投与したところ、高血糖状態が抑制されたことを示している(Kolb et al 1986)。また、ヤドリギ(Viscum album)の水性抽出物は、クローンB細胞からのインスリン産生を刺激することにより、抗糖尿病効果を示すことが報告されている(Gray and Flatt, 1999)。
また、ストレプトゾトシンで糖尿病を誘発したラットに使用した場合、Urtica pilulifera の種子から分離されたレクチンは、未処理のラットに比べて大きな血糖降下作用を示した(Kavalalı er al)。
同様に、Cratavea tapia 樹皮(Crata B)由来のレクチンは抗糖尿病活性を有しており、アルロキサン刺激糖尿病マウスにおいて血糖値を低下させ、肝・腎合併症を改善することが明らかになっている(Rocha er al)。
さらに、アルロキサン一水和物誘導糖尿病ラットに使用した場合、Abrus precateriusの種子から単離されたレクチンは、血清グルコースレベルを低下させるとともに、体重および食物消費量を増加させた(Sawant et al 2017)。
上記の報告に加えて、Leongらは、レクチンで機能化したインスリン充填微粒子が糖尿病ラットにおいて12〜14時間まで血糖降下効果を延長することを報告している(Leong et al 2011年;Coelho et al 2017)。また、小麦胚芽アグルチニン を接続したアルギン酸塩微粒子は、ストレプトゾトシン誘導糖尿病ラットにおいてインスリンの経口送達を強化した (Kim et al 2005)。
6.4. レクチンの抗菌活性
抗腫瘍性および抗殺虫性の他に、多くの植物レクチンは、多くの細菌(グラム陽性およびグラム陰性の両方真菌種およびウイルスに対しても抗菌作用を有する。植物レクチンは一般的に微生物の侵入の潜在的な部位に存在し、微生物細胞膜表面の糖質成分との相互作用は、微生物の増殖およびその接着および移動の阻害を導く(Breitenbach Barroso Coelho et al 2018)。
レクチンは、膜の構造や透過性を変化させたり、侵入した微生物の正常な細胞内プロセスを中断させたりすることはできないが、微生物の凝集や固定化のような代替メカニズムを介して殺菌活性を発揮する(Lagarda-Diaz et al 2017)。
6.5. レクチンの抗真菌作用
レクチンは多くの種類の特性を有しているにもかかわらず、抗真菌活性を示すものは限られている。レクチンは真菌表面のキチンなどの糖鎖と結合することで殺菌作用を示し,真菌の生存などに影響を与える。レクチンがハイパーに付着すると、栄養吸収や胞子の発芽過程に影響を与える(Hamid et al 2013; Lis and Sharon, 1981)。
さらに、レクチンの結合はまた、細胞壁におけるキチンの合成および/または沈着の障害を引き起こし、それによって真菌の成長を阻害する(Selitrennikoff, 2001)。上述のメカニズムとは別に、レクチンはまた、真菌を様々なストレス条件に対して感受性の高いものにするいくつかの形態学的変化を誘発する(Ciopraga er al)。
ある種のレクチンは、相互作用により菌糸の膨潤、細胞内容物の液胞化、菌糸細胞壁の溶解を引き起こし、それゆえ浸透圧ショックに対する感受性を高めることが報告されている(Lis and Sharon, 1981)。さらに、いくつかの小さなレクチンも真菌細胞壁に直接侵入し、細胞膜に到達し、活性部位に結合して酵素活性を阻害し、細胞壁の形態形成に影響を与える。
小麦胚芽アグルチニン を添加すると、Trichoderma viride の胞子の発芽と糸状成長が阻害され、キチンの合成が阻害された (Kumar et al 2012)。また,Ophiopogon japonicus の根茎から分離されたレクチンは,植物病原菌である Gibberella saubinetii と Rhizoctonia solani に対して抗真菌活性を示した (Tian et al 2008)。
Curcuma longa のレクチンは,Exserohilum turicum,Fusarium oxysporum, Colectrotrichum cassiicola の真菌の生育を抑制することが報告されている(Petnual er al)。 ジャガイモ(Gómez et al 1995)および赤インゲンマメ(Ye et al 2001)からのレクチンもまた、抗真菌活性を示した。
同様に,Talisia esculenta の種子から分離されたレクチンは,Fusarium oxysporum, Colectrotrichum lindemuthianum,および Saccharomyces cerevisiae に対して抗真菌効果を示した(Maria das Graças er al)。
キチンを結合させた Artocarpus integrifolia の 2 つの新規種子は、Fusarium moniliforme と Saccharomyces cerevisae の生育阻害を示した (Karnchanatat, 2012)。
レクチンが真菌の生育に及ぼす直接的な効果とは別に、レクチン遺伝子はトランスジェニック植物に真菌感染からの保護を付与する。例えば、タバコ植物にアカネのイソレクチン I の前駆体遺伝子を挿入すると、Botrytis cinerea、Colletotrichum lindemuthianum、T. viride の胞子発芽が抑制された (Does et al 1999)。
マメ科植物のレクチンは、Botrytis cinerea, Fusarium oxysporum, F. moniliforme, F. colletotrichum lindemuthianum, T. viride (Does et al 1999)などの植物病原性真菌に対して殺菌作用を示した。
moniliforme、F. solani、Colletotrichum species、Drechslera turcia、Exserohilum turcicum、およびCandida albicans、Penicillium italicumおよびAspergillus speciesのような病原性真菌(Sharon and Lis, 2001; Qadir er al 2013; Yan et al 2005; Chen et al 2009; Boleti et al 2007; Rao et al 1998)。
6.6. レクチンの抗ウイルス活性
植物レクチンは、ウイルスのエンベロープ糖タンパク質上に存在する糖鎖を結合する能力を有しており、それによってウイルスの宿主細胞への感染や浸透を防ぐことができる(Barton et al 2014; Akkouh et al 2015)。
さらに、レクチンはまた、ウイルス表面の糖鎖を架橋し、それ故に他の共受容体との相互作用を防ぐ。植物レクチンの抗ウイルス活性は、それらの炭水化物特異性に依存し、異なるレクチン間で異なる。D-マンノース特異性を有するGerardia savagliaから分離されたレクチンは、H9細胞におけるHIV感染をブロックすることが最初に報告された。
また、このレクチンは、HIV-1 gp120 エンベロープ分子のオリゴ糖鎖と反応して、HTLV-IIIB/H9-Jurkat細胞系やHIV-1/ヒトリンパ球系でのシンチチュウム形成を抑制することも報告されている(Müller et al 1988)。
その後、Con A、小麦胚芽アグルチニン、Lens culinaris agglutinin、Vicia faba agglutin、PSLおよびPHAのような異なるレクチンが、HIV感染細胞と特異的に結合することにより、HIV感染細胞とCD4+細胞との融合の阻害に関連していることが発見された(Hansen er al)。
また、コロナウイルスは、重症急性呼吸器症候群においてマンノース特異的レクチンに感受性があることが報告されている。これらのレクチンは、複製サイクルの初期段階ではウイルスの付着を阻害することで作用し、ウイルス感染サイクルの終了時に結合することでウイルスの発生を抑制する(Keyaerts et al 2007)。
*
非マメ科レクチンの中では、グリフィスシン(GRFTシアノビリン(CV-Nバナナレクチン(BanLec)(Swanson et al 2010)などが抗ウイルス効果を有することが知られている。非常に多くの場合、これらのレクチンは、HIV感染を防ぐために、膣や直腸用ジェル、クリーム、座薬に組み込まれている(Lusvarghi and Bewley, 2016)。
ここで、レクチンはウイルスを結合させ、感染を回避することで標的細胞への侵入や融合をブロックする。さらに、エクストラロング秋紫豆レクチンやキノコ類のRussula delicaレクチンなどのレクチンは、HIV-1のRNAからDNAへの変換を阻害し、宿主細胞の核への侵入を阻害することで抗ウイルス効果を誘導している(Zhao er al)。
6.7. レクチンの抗寄生虫活性
Trypanosoma cruzi、Leishmania spp.、Tetrahymena pyriformisおよびGiardia lambliaなどのような感染症を引き起こす寄生虫のいくつかは、アジュバントとして作用する能力のために、植物レクチンの影響を受けることが報告されている。
植物レクチンの抗寄生効果は、寄生虫に存在する特定の炭水化物に結合し、それによって下流の生物学的プロセスに干渉を引き起こす性質に基づいている(Iordache er al)。 しかしながら、少数の植物レクチンのみが抗寄生活性を示す。
ジャカリンと名付けられたジャックフルーツの種子から単離されたそのようなレクチンの1つは、アジュバント特性を有し、細胞性および体液性免疫を調節することが報告されている。トリパノソーマ・クルジまたはその抗原に感染した細胞を治療するために使用すると、寄生虫の抗原に対する抗体産生を増加させる(Jandú et al 2017a)。
6.8. 植物レクチンの抗菌活性
植物レクチンの抗菌活性は、細菌の表面に存在する様々な複合炭水化物と相互作用する能力に起因している。主に、リポ多糖類(LPSペプチドグリカン、タコ酸などの複合糖質は、レクチンに存在するグリカン結合部位と水素結合を介して相互作用し、細菌の形態を変化させる。
この相互作用により、細菌の形態が変化し、グラム陽性細菌と陰性細菌では、それぞれ細孔形成と細胞壁の泡立ちを引き起こす(Hamid et al 2013; Lagarda-Diaz et al 2017)。微生物殺傷効果を発揮するために、レクチンはまた、グラム陽性またはグラム陰性細菌の細胞表面に存在するN-アセチルムラム酸(NAMN-アセチルグルコサミン(NAG)およびN-アセチルムラム酸またはLPSに連結されたテトラペプチドと相互作用する(Ayouba et al 1994)。
レクチンはさらに、Punica granatumのsarcotestaからのレクチンのように細菌の付着および侵入を抑制することが見出され、ヒト細胞におけるSalmonella enterica、S. aureus、S. marcescensおよびAeromonas種の付着および侵入を減少させた(Silva et al 2016a)。
バングラデシュのジャガイモの栽培品種から単離されたレクチンは、キチンに特異的に結合し、Shigella boydii、Salmonella enteritidis、大腸菌およびListeria monocytogenesに対して殺菌効果を示した(Hasan et al 2014)。
Apuleia leiocarpa 種子由来の別のレクチンは、セレウス菌、枯草菌、マイクロコッカス・ルテウス菌、エンテロコッカス・フェカリス菌、ストレプトコッカス・ピオゲネス菌、黄色ブドウ球菌などのグラム陽性菌や、S. enteritidis、P. aeruginosa、大腸菌、Klebsiella pnumoniae、Xanthomonas campestris などのグラム陰性菌の細菌増殖を抑制することが示された(de Souza Carvalho er al)。
いくつかのレクチンもまた、細菌の細胞壁透過性を妨害する。例えば、Mouraらによって実施されたある研究は、腐食性細菌に対するM. oleiferaの種子からの水溶性レクチンの使用が、用量依存的に壁/膜の完全性の喪失による細胞内タンパク質の漏出を引き起こしたことを実証した(Moura et al 2017)。
殺菌および静菌効果とは別に、植物レクチンはまた、細菌のバイオフィルム形成を阻害する。細菌のバイオフィルムは、洗剤や抗生物質に対する耐性を示すので、この文脈でのレクチンの使用は、バイオフィルム形成の問題を効果的に軽減/制御するのに有用であると推論することが不可欠である。
Canavalia ensiformis、T. foenumgraecum、Arachis hypogaea、Cajanus cajan、P. vulgaris、Pisum sativumに由来する著名なマメ科植物のレクチンは、Streptococcus mutansによるバイオフィルム形成を抑制することが報告されている(Islam and Khan, 2012)。
7. 植物レクチンを介した免疫応答
抗生物質の発見にもかかわらず、細菌感染症の効果的な制御はまだ厳しい挑戦である。これは、世界中に広がっている一般的な薬剤に対するさまざまな細菌の抗生物質耐性株の出現のためである(Davies and Davies, 2010)。
さらに、病原体はまた、宿主の免疫防御を回避するための多くの戦略を進化させ、その結果、宿主組織の損傷をもたらす過剰な炎症を誘発している(Chaves et al 2016; Gomes et al 2016)。したがって、この状況に効率的に取り組むためには、微生物を直接標的とすることなく、微生物感染時に宿主免疫応答を調節することができる新規な抗菌薬の発見が緊急に必要である。
天然化合物の中でも、植物レクチンは免疫調節活性を有することが知られている。それらは、サイトカインの分泌および活性酸素種(ROS)および活性窒素中間体(RNI)のような他の免疫メディエーターの産生を調節して、微生物感染に対する宿主の防御を改善することができる(Coello et al 2017年;Souza et al 2013年;Da SilvaおよびCorrreia、2014)。
植物レクチンは、細菌細胞および宿主の免疫細胞の両方の膜に存在する特定の炭水化物残基に結合する性質を有する。すなわち、細菌細胞表面に結合して細菌の宿主細胞への付着を直接抑制する方法と、免疫細胞表面に発現する糖鎖部位に結合して、侵入した微生物に対するシグナル伝達とエフェクター機構の活性化を誘導する方法である(Souza et al 2013)。
*
いくつかのグループが様々な植物レクチンの細菌の増殖を直接抑制する効果を確認しているが、これらのレクチンが宿主免疫系を調節して試験管内試験で病原体を効果的にクリアする役割を研究しているのはごくわずかである。
*
自然免疫系は、さまざまな病原体による感染症に対する防御の第一線として機能している。このシステムは、少数のタンパク質と特定の病原体に特異的ではない特定の食細胞から構成されている。これらの細胞は、病原体関連分子パターン(PAMP)と呼ばれる、虫に保存されている特定のタンパク質、炭水化物残基、脂質部位を認識し、感染を抑制するように作用する。
宿主における自然免疫の活性化は、あらゆる病原体に対する適応免疫の発達の前提条件である。植物レクチンは、PAMPを識別するパターン認識受容体(PRR)として植物の防御に重要な役割を果たすだけでなく、動物の自然免疫を活性化するための優れた免疫調節剤としても重要な役割を果たしている。
*
様々な免疫細胞における植物レクチンの免疫調節活性は、これらのレクチンの多くが、細菌感染に応答して免疫細胞のサイトカイン産生をvis-à-対して、免疫細胞の貪食活性を増強する能力を有することを明確に示唆する文献によく記載されている(da Silva et al 2015)。
Con Aは、主要な免疫調節特性を有する最も広く研究されている植物レクチンの一つである(AgrawalおよびGoldstein、1968)。マウスマクロファージにおけるそれの処理は、JNK、p38およびNF-κB依存性シグナル伝達経路を介して様々なトール様受容体(TLR)の発現を増加させることが示されている(Da Silva and Correia, 2014; Sodhi et al 2007)。
さらに、これらの処理されたマクロファージはまた、感染性病原体の生存を阻害するTLR媒介経路において、異なるプロ炎症性サイトカインおよび一酸化窒素(NO)を分泌した(Sodhi et al 2007; KesherwaniおよびSodhi、2007)。
TLR は自然免疫系の主要な受容体であり、異なる細菌の PAMP を認識すると、それらに対する免疫応答を活性化する (Sodhi et al 2007)。このように、レクチンによる TLRs の誘導は、感染症の治癒に非常に有用である。
別のグループは、マウスのクレブシエラ肺炎に対するCon Aの効果を報告している。Con Aの単回投与ではマウスの生存率が55%向上したのに対し、連続投与では83%向上した。また,Con Aを前処理したマウスでは,未処理マウスに比べて肝壊死の危険性が非常に低いことが観察された。
また、Con Aの投与により、感染マウスの血中および肝臓では、肝臓壊死の抑制、アラニンアミノトランスフェラーゼの減少、アスパラギン酸アミノトランスフェラーゼの減少が認められた(Kuo et al 2007)。このことは、Con Aが宿主の病原体との戦いの能力を高める宿主免疫力を高めていることを示している。
*
ConBrは、Canavalia brasiliensisから分離されたD-グルコースレクチンであり、ConAと99%の相同性と物理的性質を共有している。それはまた、生体内のリンパ球を活性化し、アポトーシスを引き起こし、PBMCsでTNF-αを産生し、肥満細胞からヒスタミンを放出することが示されている(Cavada et al 2001年; Lopes et al 2005)。
Cratylia argenteaから分離されたConBrおよびCFLの抗菌効果は、Salmonella enterica serovar Typhimurium感染においても確認されている(Silva et al 2016b)。
ConBrおよびCFLはそのようなS. entericaに対する細胞毒性はないことが観察されたが、マウスへの感染の1日前にレクチンを投与した場合、無処置マウスと比較して80%近い用量依存性の生存率が得られた。さらに,感染3日前から10 mg/kgのレクチンを毎日投与したところ,腹膜腔,脾臓,血流,肝臓での細菌増殖が減少し,CFLは90%,ConBrは100%の生存率を記録した。
また、Con BrおよびCFL処理は、腹膜液中のIL-10およびTNF-αの発現および量の減少をもたらした(Silva et al 2016b)。さらに、TLRおよびNOの発現を調節することにより、マウス腹膜マクロファージにおけるサルモネラのコロケーションを中止することが報告されている(Batista et al 2017)。
上記の他にも、レクチンは、経口投与された抗原と一緒に使用される場合には、全身免疫を増強するために使用される。殺したヘリコバクター・ピロリまたはカンピロバクター・ジェジュニを用いたUlex europaeus agglutininin(UEA-1)の経口免疫化は、細菌チャレンジに対する保護応答を誘導した(Chionh et al 2009)。
Con Aはまた、C. albicans感染時にマウスの抗真菌反応を活性化することが報告されている。これは、マクロファージおよび好中球による貪食の増加を介した病原体の死による宿主の生存の増加を導く(Loyola et al 2002年;Moresco et al 2002)。
細胞表面上のマンノース受容体の発現を増加させることによって病原体を殺すマウス腹膜細胞の能力を増強するCon Aの能力も報告されている(Loyola et al 2002)。Artocarpus integrifolia(Raval er al 2004)から単離されたアルチンMおよびジャカリンレクチンは、Th1およびTh17応答、マンノース受容体発現、TNF-α産生および細菌殺傷に影響を与えることにより、C. albicans感染を封じ込め、感染したスイスマウスの生存を増強することが報告されている(Custodio er al 2011; Loyola er al 2012)。
Coltriらは、アルチンMがパラコクシディオイデス・ブラジレンシスに対しても作用することを報告しており、アルチンMを投与したマウスは、TLR-2依存的な方法でIL-12の産生を増加させ、無処置マウスに比べて肺および肺病変の真菌負荷が少ないことを決定的に証明している(Coltri et al 2008)。
好中球の遊走を助けるという別の機能的属性もまた、細胞外マトリックス中に存在するマンノース残基と相互作用することにより、アルチンMがハプトタクシスとして知られるプロセスと相互作用することが示唆されている(Souza et al 2013年;Ganiko et al 2005)。
抗真菌活性を有することが示されている別のレクチンは、Cratylia mollisから単離されたCramollである。Cratylia mollisから分離されたCramollは、マウスの感染の1日前に処理すると、Cryptococcus gattiiの試験管内試験での増殖を抑制することが報告されている。また、クラモールはマウスのIFN-γ、IL-6,IL-10,IL-17,活性酸素のレベルを調節することにより、免疫調節作用を有することが報告されている。クラモールは、フルコナゾール(別の抗真菌薬)の抗真菌効果を何倍にも増強することが示されており、このレクチンが真菌感染の広がりをチェックする効果を明確に示唆している(Jandú et al 2017b)。
8. その他の用途
植物は、耐性病原体による感染症を治癒できるように、新規な薬剤候補を開発するためにその可能性を利用することができる優れた治療物質の供給源である(Peumans and Damme, 1998)(Chandra er al)。 植物由来のレクチンは、タンパク質と炭水化物との相互作用の分子基盤の理解など、様々な技術的介入に広く利用されてきた。
8.1. 技術的介入における植物レクチン
近年、レクチンは、機能性糖鎖だけでなく構造解析の分野でも広く利用されている。レクチンの特異性と感度はさらに、器具的技術と比較して、疾患診断における貴重なツールとなっている(Pihíková et al 2015)。本レビューの以下のセクションでは、レクチンをベースとした技術を丁寧に取り上げている。
8.2. 酵素連結レクチンアッセイ(ELLA
ELLAは、未固定細胞表面の特定の糖質単位を検出するために使用されている。この測定法は、酵素連結免疫吸着法(ELISA)の原理を採用している。しかし、ここでは、植物由来のレクチン(例えば、PNA)が、抗体の代わりに(サンドイッチELLAでは)捕捉だけでなく検出試薬として使用される(Hashim et al 2017)。
酵素共役レクチンの強度は、被覆されたグリコール共役体のレベルを決定する。植物レクチンは、糖鎖の異なる構造に対して非常に特異的であるため、ELLA技術における様々な組織サンプルにおける糖鎖発現プロファイルを検出するために使用される。
この技術は、高いスループットの可能性と、それが実行しやすく、非常に費用対効果が高く、サンプルの量を必要とするような他の利点を持っている。本技術は、レクチンがバイオフィルムのマトリックス中で最も多く見られる糖残基に特異的に 結合することから、バイオフィルム外多糖類の in situ での特性評価と定量化に役立つ(Hashim er al)。
8.3. レクチンブロッティング
レクチンブロッティング技術は、抗体の代わりに糖質結合モジュールを有するレクチンを使用するウェスタンブロッティングの拡張である(Hashim et al 2017; Shan et al 2001)。糖鎖構造の多様性は、少量のタンパク質を高い特異性と感度で可視化できる可能性があるため、糖鎖特異的レクチンプローブを用いて検出されてきた。
また、複雑なタンパク質サンプルのスクリーニングには非常に便利な方法である。特定のグリコシダーゼと組み合わせて、ConA、Chempedak(Artocarpus integer)ガラクトース結合レクチン(CGB)(Phang et al 2016)のようなこれらの標識された植物レクチンは、エリスロポエチン(Kim et al 2008)と同様に、組換え組織プラスミノーゲンアクチベーターの炭水化物鎖の特性評価に適用されてきた(Kim et al 2008)。
8.4. 固定化レクチンアフィニティークロマトグラフィー
固定化レクチンアフィニティークロマトグラフィーは、グリコミクス研究の分野における糖タンパク質分離の濃縮のための分子ベースの技術である(Hashim et al 2017)。これは、選択されたマトリックス上に固定化されたCGBまたはCon A(Hashim et al 2017)のような固定化された植物レクチンとその糖質リガンドとの相互作用に基づいて、最も広く採用されている分離技術である(Hage et al 2012)。
クロマトグラフィーカラムをレクチン共役ゲルマトリックスで充填し、特定の炭水化物溶液を用いた結合した糖タンパク質の溶出だけでなく、非結合タンパク質の洗浄を伴うプロセスを実施する。この技術は、質量分析法を用いて多くのタンパク質の部位特異的なグリコシル化を分析し、同定するための新しいアプローチを提供する可能性がある。
さらに、この技術は、O-リンク3オリゴ糖を有するタンパク質の精製だけでなく、特性評価にも広く適用可能である(Hashim et al 2017; Pang et al 2010)。
8.5. レクチンアレイに基づく糖鎖プロファイリング
生体認識要素の選択と利用可能性(Angeloni et al 2004)に伴い、このレクチンベースの技術は、グリコミクスの挑戦的な分野を研究するために開発された。レクチンアレイ技術は、糖質複合体上の炭水化物の迅速かつ高感度な特性評価を提供する。
高密度で固体支持体上に固定化された植物レクチンを用いて、単一のサンプル中の糖タンパク質や糖脂質の異なる糖質含量を検出している。複数のレクチンとレクチンビーズは、このタイプのアレイ分析に使用されている(Hashim et al 2017)。
8.6. フローサイトメトリー
フローサイトメトリーは、混合物中の異なるタイプの細胞の構造的特徴を定量化できる強力な技術である (Zhelev et al 2005)。化学的に修飾されたレクチンを用いたフローサイトメトリーでは、特定の細胞タイプの細胞表面の特異的な糖鎖構造が特徴づけられており(Lam and Ng, 2011この技術は細胞の選別にも利用できる。
PNA(Gillan et al 2005)のような植物レクチンに結合した細胞は、フローサイトメーターで蛍光を調べることで検出されている。細胞とは別に、結合部位の数も蛍光の程度と相関させることができる(Zhelev et al 2005)。
8.7. レクチン組織化学
免疫組織化学と同様に、標識レクチンは、個々のレクチンによって糖鎖部位が認識されるという性質に基づいて、組織染色手順において特定の糖鎖共役成分を検出するための抗体として使用される。
組織標本中の糖タンパク質を検出するための直接的な方法では、Con A(Hashim et al 2017)のような植物レクチンは、フルオロフォア、酵素、コロイダルゴールドまたはフェリチンのような異なる実体に共有結合されている。
一方、より感度の高い間接標識法では、ビオチンなどのハプテンと共役したレクチンを酵素結合型ストレプトアビジンで認識する。レクチン組織化学は、さまざまな疾患に関連したグリコシル化の変化の研究に多大に利用されている(Sobral et al 2010 )。
8.8. 電気化学インピーダンス分光法(EIS)
EIS技術は、糖質の組み合わせにより、感度が高く、特異的で、堅牢で、ポータブルなバイオセンシングシステムを提供し、また、表面修飾およびバイオ認識プロセスを特徴付け、検出するための有効なツールとして使用することができる(Grossi and Riccò, 2016)。
EISは、Con Aなどの植物レクチンを用いて細菌を検出するレベルフリーバイオセンサーとして採用されており、合成糖鎖で捕捉し、10∧2 CFU/mlという低い検出限界を達成した後、EISで細菌を検出することができる(Guo et al 2011)。
この技術は、レクチンを分子認識要素として採用して開発されたα-フェトプロテイン(AFP)(Chen et al 2008; Johnson et al 1999)の高感度判定・識別にも用いられている。
8.9. 8.9. 血液型診断における植物レクチン
植物レクチンは、動物の赤血球や他の細胞と相互作用することができる(Kriipe, 1956)。これらのレクチンは、ヒトの血液細胞の表面に存在する末端糖残基に特異的に結合する。レクチンと赤血球上に存在する表面糖残基との相互作用により、異なる血液群(A,B,H血液群)を区別するのに役立つ凝集(ヘマグルティネーション)が生じる。
Dolichos biflorusの種子由来のレクチンは、血清学において最も広く使用されている植物レクチンであり、A型赤血球を凝集させる(A1型に向かってより熱心)(Judd and Issitt, 1980; Boyd er al)。
また、Vicia craccaやlima bean(Phaseolus lunatus)からのレクチンも抗A1試薬として使用されている(Judd and Issitt, 1980; Boyd and Reguera, 1949)。
植物レクチンは、その不安定性、不完全な凝集、他の血液型との交差反応性の性質から、B型血液型のチェックには主に使用されていない。Ulex europaeus lectinのような抗H試薬として使用される植物レクチンは、例外的な血液型検査の結果を解決し、血液血清検査における水溶性分泌物質の検出に使用されている(Judd and Issitt, 1980)。
8.10. 細胞同定における植物レクチン
植物レクチンは、わずかな構造の違いで様々な糖質を含む哺乳類細胞を識別することができる(Yim et al 2001)。植物レクチンライブラリーは、高度に特異的な方法で様々な細胞タイプの間で識別するために使用される。多種多様な細胞を識別するために、既に利用可能な植物レクチンの配列にランダムな変異を組み込むことで、細胞識別におけるレクチンの用途を拡大してきた。
Maccakia amurensis (MAH) や Maccakia amurensis leukoagglutinin (MAL) などの植物レクチンは、シアル酸を有する炭水化物鎖を認識し、様々なタイプの赤血球の同定に応用されている (Yim et al 2001)。
糖鎖修飾を含む翻訳後修飾は、特定の分化段階における特定の細胞型を認識するために重要である。したがって、細胞表面の糖鎖のプロファイリングは、細胞の識別に重要な側面を提供する(Yim et al 2001)。
8.11. 植物レクチンを介したリンパ球の分離
リンパ球亜集団の分画で生じる収量不良の問題を克服するために、レクチンベースの分画を採用することができる。この分離の原理は、いくつかの植物レクチンの存在下で、リンパ球亜集団が凝集する能力に基づいている(Reisner et al 1976)。
凝集した細胞は、重力沈降によって凝集していない集団から分離され、次いで、その特定の植物レクチンの特定の阻害剤によって単一の生存可能な細胞に分離され得る。植物レクチンの中では、SBLと小麦胚芽アグルチニンがTリンパ球よりも特異的にBリンパ球を凝集させるのに対し(Reisner et al 1976; Bourguignon et al 1979PHAはTリンパ球に優先的に結合する(Janossy and Greaves、1971)。
レクチンに基づくリンパ球の分離は、移植片対宿主病(GVHD)を制御するのに本当に役立ち、GVHDの原因となる細胞は、SBLを用いて凝集させることにより除去される(Reisner et al 1983;Friedrich et al 1984;O’Reilly et al 1986)。
植物レクチン(特にSBL)は、免疫不全疾患に対して使用される。重度の複合免疫不全症(SCID)の患者は、上述したのと同様の方法で、ハプラスティック骨髄移植を受けることができる(O’Reilly et al 1986; Cowan et al 1985)。
8.12. リンパ球の植物レクチン媒介マイトジェネリック刺激
植物レクチンは、カルシウム依存的にリンパ球の有糸分裂を刺激する能力を持つ分裂促進物質である(Sharon and Lis, 2004; Alford, 1970; Whitney and Sutherland, 1972)。
植物レクチンの中で初めてPHAの有糸分裂活性が研究された。その後、SBL、小麦胚芽アグルチニン、およびCon Aを含む他の植物レクチンもまた、マイトジェネリックな刺激を引き起こすことが発見された。この刺激は、植物レクチンとリンパ球表面に存在する表面糖鎖との相互作用の結果である。
カリステギア・セピウム(ヘッジ・バインドウィード)の根茎から得られる新規な植物レクチンは、強力なT細胞のマイトジェンとして使用することができる(Peumans et al 1997)。 β-ガラクトシド特異的なレクチンもまた、血管細胞においてマイトジェン活性を有することが報告されている(Sanford and Harris-Hooker、1990)。
植物レクチン(PHAとCon A)が細胞膜での分裂活性を刺激することが研究で示されており、それは膜の構造とダイナミクスに関連した研究に有用であるかもしれない(Barnett et al 1974; Andersson et al 1972; GreavesとBauminger、1972)。
8.13. ナノテクノロジーの開発における植物レクチン
レクチンと炭水化物の相互作用は、特定の細胞を標的とするだけでなく、上皮細胞への、あるいは上皮細胞を横切る小胞輸送を助ける(Bies er al)。 レクチンを媒介とした生体接着に関わる初期のメカニズムは、上皮バリアでの標的化の可能性を示している(Haltner er al)。
レクチンおよびレクチンコンジュゲートの結合、内部化、細胞内輸送などのプロセスは、レクチン-グリカン相互作用に依存している(Mathiowitz er al)。 これらのグリカンは、細胞膜の多くのグリコシル化脂質や細胞表面のほとんどのグリコシル化タンパク質上に存在している(Bies er al)。
特定の生物学的位置への薬物担体の付着は、生物付着の基本的な性質である(Jiménez-castellanos et al 1993)。この性質を利用するために、植物レクチンは、腸管通過時間を遅くし、経口薬物のバイオアベイラビリティーを高めることが示されている(Bies er al)。
トマトレクチン(TP/LEA)は、消化管への薬物送達に使用されてきた。レクチンはまた、医薬製剤の通過時間を短縮するために、マイクロおよびナノ粒子との共役に使用されている。小麦胚芽アグルチニンのような植物レクチンは、低い細胞毒性と脳毛細血管内皮に対する高い親和性を示すため、血液脳関門への薬物ターゲティングの良い候補として使用されている(Fischer and Kissel, 2001; Banks and Kastin, 1998)。
角膜および結膜上皮に付着する共役レクチンは、眼内薬物送達を延長する可能性があり、また、これらの上皮を横断する薬物吸収を促進する可能性がある(Nicholls et al 1996; Panjwani et al 1995)。
レクチンはまた、この種の生体接着システムが薬物または免疫原と吸収部位との間の接触時間を向上させることから、頬腔への薬物送達や鼻粘膜への送達にも使用することができる(Smart, 2004)。それに加えて、多くの組織学的データや最近の研究では、肺細胞の先端表面にレクチンが結合して取り込まれることが明らかにされている(Brück er al)。
この性質は、DNA を標的化して取り込みを促進することができるため、レクチンを媒介としたドラッグデリバリーや遺伝子導入研究の分野に応用されている(Batra et al 1994)。ドラッグターゲティングの分野では、レクチンの利用は今後の発展が期待される課題である。
8.13.1. ナノ粒子共役植物レクチンの利用を意味する技術
8.13.1.1. 電気化学的レクチンベースの免疫センサーアッセイ
これは、レクチンベースのバイオセンサーと、金ナノ粒子(AuNP)に連結された(レクチンとチオニンレベルを特徴とする)バイオコンジュゲート(レクチン-Au-Th)を組み合わせた技術である。選択性、感度、シグナル増幅など、この手法に関連するさまざまな利点を考慮すると、ほとんどのがん研究で使用されている(Zhang er al)。
8.13.1.2. 水晶振動子マイクロバランス(QCM
レクチンと抗体をサンドイッチ構造にして、レベルフリーのインピ メントで検出する技術である。これは、検出だけでなく、グリコプロファイリングにも応用されている(Zhang er al)。
8.14. 腸管刺激剤としての植物レクチン
植物レクチンは、健康な胃腸管(GIT)を得るために使用することができる(LisおよびSharon,1986b)。植物レクチンは、GITに沿って通過する間、消化酵素の影響を受けない(Pusstai et al 1990)。
これらのレクチンは、細胞タンパク質合成の刺激、GITの器官の成長、腸内細菌叢の最適化、ホルモン分泌の調節など、様々な生物学的側面に関与している。PHA や SBL のような植物レクチンは、小腸の過形成を誘導することが示されている(Pusztai et al 1990; Bardocz et al 1990)。
その上で、植物レクチンはまた、胆汁毒素(CCK)を介した膵臓の成長を誘導し、膵臓酵素分泌の促進剤である。このため、植物レクチンは、ペプシン分泌に影響を与えることなく、用量依存的に胃分泌の強力な阻害剤として使用されている(Kordás et al 2000,2001)。
細菌の過剰増殖に起因する小胞の粘膜損傷はまた、腸内細菌叢を改善することにより、より良い宿主の防御機構に続く精製されたPHAを消費することによって制御される(Banwell et al 1985; SharonとLis、1989)。
8.15. 炎症性疾患における植物レクチンの役割
炎症性疾患におけるレクチンの役割は、いくつかのレクチンが炎症を抑制することが示されているのに対し、他のレクチンは炎症を誘発することが報告されているため、依然として論争の的となっている(Gong et al 2017)。
多くの報告は、植物レクチンが、関節リウマチ、大腸炎、セリアック病、アルツハイマー病などのような様々な炎症性疾患の発症に関与しているという事実を指摘している(Gong et al 2017;Pusztai et al 1993;VasconcelosおよびOliveira、2004;Watzl et al 2001;Kennedy et al 2003)。
Gongらは、Con AがLFA-1に結合し、それがCon Aの内部化をもたらし、小胞体ストレスを介してNLRP3 inflammasomeを活性化し、その後、IL-1βおよびIL-18のようなプロ炎症性サイトカインの放出をもたらすことを示している(Gong et al 2017)。
Con Aおよび小麦胚芽アグルチニンはまた、NLRP3インフラマソーム活性化のメカニズムであると仮定される異なる細胞タイプでの細胞内Ca2+動員を誘導することが報告されている(Grinstein et al 1987;Yatomi et al 1993)。
マメ科から単離されたレクチンであるDioclea violacea(Dvl)は、静脈内に注射すると炎症時の好中球遊走を阻害する抗炎症性を有することが報告されている(Nascimento et al 2018;Freitas et al 2015)。
Freitasらは、腎血管抵抗性、アポトーシスおよびROS生成を減少させる能力のために、急性腎損傷の治癒におけるDvlの有益な効果を報告している(Freitas et al 2015)。別の研究では、ICAM-1発現を減少させることにより、ラットモデルにおける血漿蛋白質の滲出および白血球浸潤を抑制する能力に起因するDvlの抗炎症効果を関連づけている(Clemente-Napimoga et al 2019)。
Canavalia grandiflora(ConGF)から単離された別のレクチンは、D-グルコース/D-マンノース特異的なレクチンであり、IL-1βおよびTNF-αのような様々なプロ炎症性サイトカインの産生を阻害することが示されており、したがって、用量依存的な方法で、炎症中の白血球内皮相互作用および好中球のトランスミグレーションに影響を与える(Nunes et al 2009)。
したがって、上記の特性により、植物レクチンは炎症性疾患を制御するための新しい治療法を開発するために使用することができ、新規の抗炎症性治療薬のターゲットとして機能することができる。
8.16. ワクチン製造における植物由来レクチン
ワクチン製造のための様々な伝統的なアプローチ(微生物を減弱させたり、殺したりする)は、免疫応答を刺激することができないことや効力が弱いことなど、多くの理由により、多くの病原体に対して失敗してきた。そこで、特定の疾患に対する免疫応答をブーストし、指示することができる強力な免疫調節アジュバントを用いてワクチンを投与する必要性がある(Moyle, 2017)。
医薬品用途におけるそれらの可能性に基づいて、植物レクチンは、化学療法および予防ワクチン製造における使用のためのアジュバント/担体製剤の候補として研究されている(Sander et al 2019)。また、経口ワクチンの効力は、腸管M細胞を標的としたレクチン媒介ワクチン生産により増強されている(Azizi et al 2010)。
いくつかの植物由来のレクチンは、SBA、PNA、Con A、およびPHAの場合に示されているように、マクロファージおよび/または樹状細胞上のグリコシル化TLR受容体との相互作用により、TLRアゴニストとして作用することができる(Sander et al 2019; UnittおよびHornigold、2011)。
9. 結論
植物レクチンは無数の植物によって産生され、種子、葉、花、茎、樹皮などの植物のさまざまな部分から分離することができる。これらのレクチンは、アミノ酸配列、糖特異性、安定性、分子量、サブユニットの数などで大きく異なる。
これらのレクチンの特性のすべての違いにもかかわらず、ほとんどのレクチンは共通の生物学的機能、すなわち、抗腫瘍作用、抗ウイルス作用、抗昆虫作用、抗真菌作用、抗寄生虫作用、免疫調節作用を示する。
また、免疫調節を調節する可能性があることから、様々な動物モデルにおいて微生物感染を抑制することができた。また、これらのレクチンの一部は、Th1応答を誘導することから、効果的なワクチン開発のためのアジュバントとしても利用されている。
これらの免疫療法研究は、宿主と病原体の関係についての知見を向上させ、新たな治療戦略の開発に役立つ可能性がある。植物レクチンは、そのほとんどが毒性免疫原であるため、いくつかの副作用があるが、抗がん治療に用いられるものを除けば、その効果は臨床的には評価されていない。
また、多くのレクチンを大規模に生産するための適切な精製技術がないことも欠点である。タンパク質工学やドラッグデリバリー技術の進歩により、近い将来、これらの困難を克服し、操作が容易であるだけでなく、これらの魅力的な分子が持つ高い標的特異性を保持するレクチンの小さな断片を大量に生産できるようになることが期待されている。
このように、様々な感染症や病気に対抗するための免疫調節剤としての植物レクチンの利用は、今後数年のうちに拡大していくと思われる。