Contents
Stress effects on the hippocampus: a critical review
www.ncbi.nlm.nih.gov/pmc/articles/PMC4561403/
要旨
制御不能なストレスは、様々な解析レベルで海馬に影響を与えることが認められている。行動学的には、ヒトと動物の研究では、ストレスは一般的に海馬に依存した様々な記憶課題に障害を与えることがわかっている。
神経学的には、動物実験により、ストレスが海馬ニューロンのシナプス可塑性と発火特性を変化させることが明らかになっている。構造的には、ヒトおよび動物の研究により、ストレスがニューロンの形態を変化させ、ニューロンの増殖を抑制し、海馬の体積を減少させることが示されている。
約80年前にストレス研究が始まって以来、視床下部-下垂体-副腎(HPA)軸の神経内分泌ホルモン、すなわちグルココルチコイドのレベルの違いが、海馬に対する無数のストレス効果の媒介者として、また心的外傷後ストレス障害(PTSD)などのストレス関連精神病の一因として注目されていた。しかし、海馬機能におけるグルココルチコイドによる変化の報告は、研究によって大きく異なっている。
このレビューでは、ストレス研究の簡単な歴史を紹介し、グルココルチコイド仮説がどのようにして生まれ、現代のストレス研究の指針となっているかを検証し、海馬機能に対するストレス効果の根底にあるメカニズムを理解するための代替的なアプローチを検討する。
ストレスは、生物の日常の行動や幸福に影響を与えるユビキタスな人生経験であり、極端な状況では、不安、PTSD、うつ病、統合失調症、薬物使用の再発など、人間の数多くの精神病に寄与している(Widiger and Clark 2000)。これらの障害に共通しているのは、学習や記憶などの認知過程におけるストレスに関連した変化であるように思われる(McEwen and Sapolsky 1995)。ここ数十年のヒトおよび動物の研究で、海馬は安定した宣言的(または明示的)記憶の形成に関与する内側側頭葉の構造であり、ストレスの影響を非常に受けやすいことが示されている(図1; Kim and Diamond 2002)。基礎的および臨床的なストレス研究の方向付けとなっている一般的な見解は、ストレスに反応して視床下部-下垂体-副腎(HPA)軸によって合成・分泌されるコルチコステロイド(図2)が海馬へのストレス影響の媒介者であるというものである(ストレスの他の神経化学的仮説については、Maier 1984を参照のこと)。例えば、いくつかのヒトの研究では、PTSDの重症度とコルチゾールレベルとの関連性を模索している(例:Yehuda er al)。 ここでは、ストレスのグルココルチコイド仮説を支持する証拠と対立する証拠を批判的にレビューし、提案されている代替仮説を検討する。ここからは、ストレスという用語は、制御不能な(予測不能で不可避な)ストレス(Kim and Diamond 2002)を意味するために使用され、ストレスの影響は主に海馬の生理学とニーモニック機能に焦点を当てることになる。
図1. 海馬に対するストレスの生物学的影響。
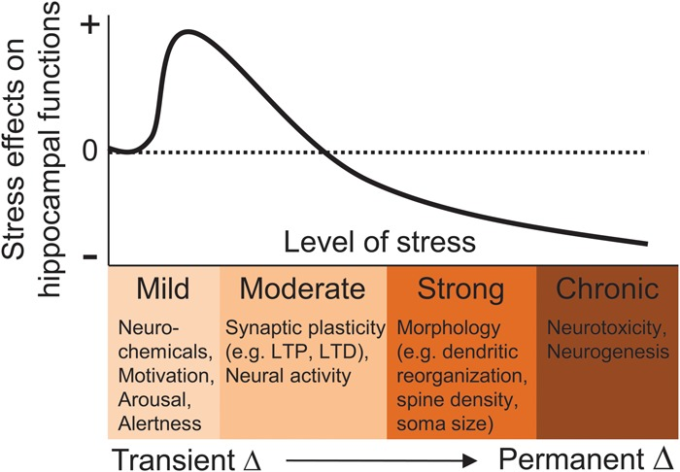
ストレスの重症度(強度、持続時間)が高くなると、海馬では神経化学物質、シナプス可塑性、神経活動、サイトアーキテクチャー、神経新生に変化が生じ、学習や記憶などのその後の認知機能に影響を与え、精神疾患の一因となる。+ と-はそれぞれ海馬機能の増加と減少を示す。Kim and Yoon (1998)より引用。
図2. 視床下部-下垂体-副腎(HPA)軸
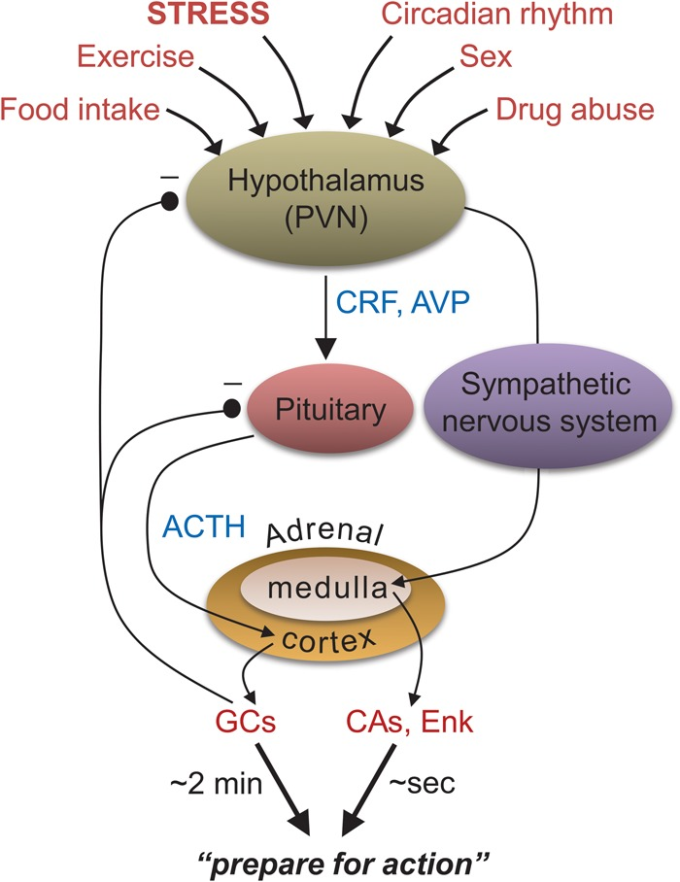
様々な身体活動および行動活動に関連する主要な神経内分泌系。これらの化合物や構造はいずれもストレスに特異的に反応する。(PVN)視床下部傍室核、(CRF)コルチコトロピン放出因子、(AVP)アルギニン-バソプレシン、(ACTH)副腎皮質刺激ホルモン、(GCs)グルココルチコイド、(CAs)カテコールアミン、(Enk)エンケファリン。
ストレスの科学的研究は、ハンス・セリエ(Hans Selye, 1936)が、異種の急性非毒性物質(ストレッサー)がステレオタイプの生理作用(副腎の肥大、胸腺の収縮、脾臓リンパ節の収縮、胃潰瘍化)をもたらすことを報告し、警報反応段階、適応段階、疲弊段階からなる「一般適応症候群」と呼んだことと広く関連している(図3)。要するに、ストレス反応は警報反応期や適応期には適応機能を発揮するが、外部からの攻撃を防御するための化学基質が枯渇すると(重度・長期のストレス環境下では身体機能が病気にかかりやすくなるという仮説である。しかし、HPA軸に関連した「ストレス化合物」の探索は、結局のところ根拠のないものであることが判明した(例えば、Kosten er al)。
図3.ストレスの2つのHPA軸に基づくモデル
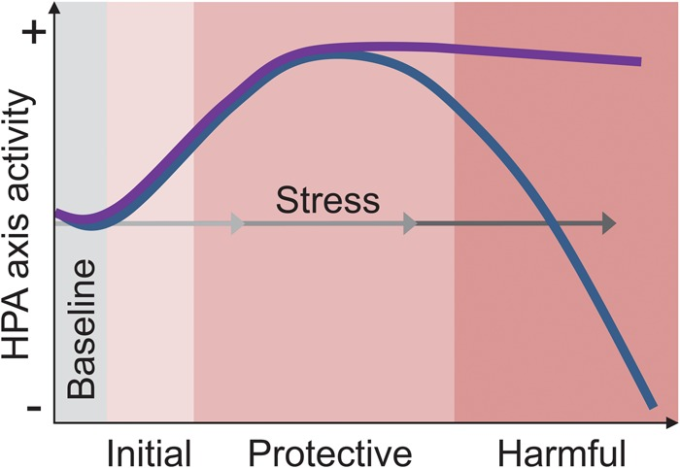
Selye(1936)の一般適応症候群は、持続的なストレスによって神経内分泌因子が枯渇すると、体が病気にかかりやすくなると提唱している(青線)。対照的に、現在の見解では、神経内分泌活動が異常に上昇したり、長く続くと体に害を及ぼすという仮説を立てている(紫色の線)。3つの灰色の勾配の矢印は、軽度、中等度、重度のストレスを表している。
Selyeの一般適応症候群の概念を受け継ぐのは、現在のグルココルチコイドに基づく仮説である(McEwen and Sapolsky 1995を参照)。ここではまだHPA軸に焦点が当てられているが、その代わりに、グルココルチコイド仮説は、ストレスの有害な影響を引き起こすのは副腎ホルモンの持続的な上昇であって、Selyeが最初に提案したような枯渇ではないと提案しており、過活動性の免疫系が体にダメージを与える自己免疫疾患にやや類似している。ストレスのグルココルチコイド仮説は、海馬の機能に関して特に魅力的である。なぜなら、海馬はコルチコステロイド(ヒトではコルチゾール、げっ歯類ではコルチコステロン、コルチゾール(コルチコステロン))の受容体が密集しており、HPA軸のグルココルチコイド媒介の負帰還に参加し(McEwen and Sapolsky 1995その結果、コルチゾール(コルチコステロン)の作用が増強された影響を受けやすいからである。このことから、コルチコイドは海馬へのストレス作用の一因であると考えられている(図3)。
ストレスと記憶
ストレス、学習、精神病理との関係についての最も古い科学的説明の一つは、Pavlov (1927)に由来している。彼は、識別の難しい条件付き刺激(例えば、円と楕円)や、強烈で予測不可能な刺激の使用は、条件付き(学習)反応を悪化させ、動物の行動障害を引き起こしたと報告しており、これを “実験神経症 “と表現している。同様に、YerkesとDodson(1908)は、困難な課題における学習の低下を、衝撃の強さの関数として逆U関数として記述した(Diamond er al 2007参照)。1960年代後半、Seligman、Maier、Overmaierは、犬(後に猫、ラット、魚、人間)が脱出不可能な衝撃にさらされると、その後の脱出回避反応の学習に障害が生じることを報告した(これは彼らが学習性無力感と呼んでいる現象である)。彼らは、生物が自分の行動が回避結果(ストレッサー)とは無関係であることを内在化すると、この学習が認知系、感情系、動機付け系に変化をもたらし、それがその後の学習を阻害すると提案した。ストレスに関連した学習がその後の学習に否定的な影響を与える学習無力化現象は、本質的には、人間におけるメタ学習の概念の否定的な対応であり、Maudsley(1979)は「学習者が内在化した知覚、探究、学習、成長の習慣に気づき、その習慣をますますコントロールできるようになるプロセス」と説明している。ここ数十年の間に、多くの研究が、ストレスの多い経験が動物や人間の海馬のニーモニック機能を変化させることを示していた。
大多数の研究では、ストレスへの暴露やコルチゾール(コルチコステロン)の上昇レベルが海馬に依存する記憶タスクのパフォーマンスを損なうことが報告されている(McEwen and Sapolsky 1995; Kim and Diamond 2002)。ヒトを対象とした研究では、PTSDおよびうつ病と診断された患者は、さまざまな言語想起試験で障害を受けている(Bremner et al 2000)。コルチゾール(コルチコステロン)の直接的な役割の証拠は、クッシング症候群患者(慢性高コルチゾール血症を伴う;Starkman et al 1992)およびコルチゾール(コルチコステロン)を投与された健常者における記憶障害の所見に基づいている(Newcomer et al 1994)。同様に、げっ歯類の研究では、ストレスへの暴露および高用量のコルチゾール(コルチコステロン)の注射が、海馬を関与する空間記憶課題の障害をもたらすことが示されている(de Quervain et al 1998)。記憶障害はまた、コルチコトロピン放出因子(CRF;Heinrichs et al 1996)の中枢的過剰発現に起因するコルチゾール(コルチコステロン)上昇を有するトランスジェニックマウスにおいても報告されている。空間ナビゲーションおよび記憶をサポートすると考えられている海馬の場所細胞の発火特性をストレスが変化させるという最近の知見(例えば、Kim et al 2007)は(O’Keefe and Dostrovsky 1971空間記憶課題に対するストレス効果と一致している。
しかし、ストレスは小脳依存性のアイリンク条件付け(Beylin and Shors 2003)や扁桃体と海馬依存性の文脈的恐怖条件付けを強化することが示されているように、ストレスが大域的な記憶障害を引き起こすわけではない。興味深いことに、海馬の記憶課題を損なうのと同じストレスは、ラットとヒトでは、競合する非海馬の記憶課題(例えば、尾状突起依存性刺激反応)の相対的な使用を促進するようである(Kim er al 2001; Schwabe and Wolf 2012)。現在のところ、記憶に対するこれらの異なる効果が間接的なものであるのか、すなわち、ストレスが海馬の他の脳記憶系との相互作用(例えば、競合)能力を低下させた結果なのか、あるいは、非海馬記憶系に対する直接的な促進効果なのかは不明である。
ストレスと海馬の可塑性
最初に海馬で示された求心性線維の短い高周波刺激から生じる長期増強(LTP)は、そのような迅速な誘導、長寿、刺激閾値要件(協調性反復、入力特異性、および連想性によって強化されるように、記憶のシナプスモデルの望ましい特性を持っている(BlissとCollingridge 1993を参照)。LTPとストレスをリンクする最初の証拠は、拘束の30分間の間に30断続的な尾部衝撃を経験したラットから調製された海馬スライスにおけるシャッファー側副詞/交感神経-CA1 LTPの障害を発見したトンプソン、レヴィーンと同僚によって報告された(Foy et al 1987)。重要なことに、CA1のLTPは、尾部衝撃の同じ量を受けたが、自発的にそれらを終了することができたラットから海馬スライスで比較的正常であったが、学習した無力感と同様に、LTPの障害は、主にストレスの物理的な資質ではなく、心理的なものに起因していることを示している(Shors et al 1989)。
ストレスに関連したLTP障害は、歯状回(Shors and Dryver 1994)と海馬のCA3領域(Pavlides er al)。 他の研究では、ストレスのLTPに対する時間依存的で二相性の効果が発見されている-最初の増強効果に続いて、LTPに対するより長く持続する抑制効果がある(Akirav and Richter-Levin 1999)。また、ストレスはθバースト刺激によって誘導されるLTPを増強するが、高周波刺激によって誘導されるLTPを損なうことも報告されている。これらの知見は、ストレスのパラダイム、試験管内試験と生体内試験の記録の違い、および刺激パターンの違いが、ストレスがLTPに及ぼす影響をより複雑に描き出していることを示している。
ストレスと海馬のLTPの関係を発見したことは、ストレスが記憶に及ぼす影響を説明することができる検証可能なシナプスメカニズムと、異なるストレスパラダイムを用いた研究からの行動結果を比較するための「神経生理学的マーカー」の両方を提供してくれるので、意義深いものである。例えば、すべての想定されるストレスパラダイムが海馬のLTP障害を引き起こすわけではなく、これは異なるストレス手順によって影響を受ける可能性のある記憶の種類についての洞察を提供することになる。理論的には、シナプス強度の低下がシナプス伝達を正常化し、海馬のシナプスが飽和するのを防ぐために必要とされるため、LTPだけでは記憶の効果的なシナプスモデルを提供するには不十分である。求心性線維(DudekとBear 1992)の異なる(すなわち、低周波)刺激パターンに続くシナプス強度の低下によって特徴づけられる長期うつ病(LTD)は、情報を処理し、保存するためにLTPと一緒に働くと考えられている。ストレスに関するLTPとLTDの間のダイナミックな関係は、LTPが障害されるのと同じストレスがCA1海馬のLTDを増加させ、これらの効果はN-メチル-d-アスパラギン酸(NMDA)受容体の活性化を介して媒介されるという知見によって支持されている(Kim er al)。 1996)。
シナプス可塑性に対するストレスの相反する効果は、ストレス経験の間、対象者が学習性無力感を発症すると、LTPまたはLTP様の変化が起こり、海馬のシナプスが飽和し、海馬がそれ以上のLTPをサポートすることができなくなり、LTDの範囲が増加している可能性に起因しているかもしれない(Kim er al)。 1996)。別の可能性としては、ストレスが「メタ可塑性」効果を生み出し、シナプス可塑性の閾値がLTP誘導よりもLTDに偏るということが考えられる(図4; Abraham and Tate 1997; Kim and Yoon 1998を参照)。現在のところ、どちらの仮説を支持する決定的な証拠はない。
図4. 海馬のシナプス可塑性に対するストレス効果のメタ可塑性モデル
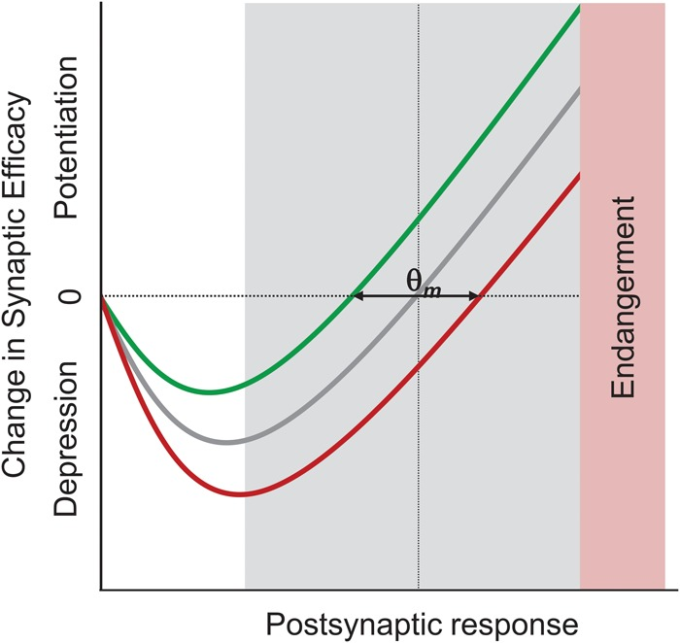
メタ可塑性仮説に基づいて、ストレスとグルココルチコイドは抑圧と増強のダイナミックな範囲(修飾閾値θmで表される)を右にシフトさせ、その後のシナプス可塑性がLTPよりLTDに有利になるように提案されている。網掛け部分は、動物の内因性状態(例えば、概日リズム、年齢、性別)の変化に関連したθmの生理的範囲を表している。Kim and Yoon (1998)より。
海馬の形態に対するストレスの影響
長時間および/または外傷性のストレス要因は、海馬の形態学的変化を引き起こすことも示されている。特に、臨床的に重要な意味を持つヒトの脳画像研究では、PTSD患者では海馬体積が小さく、言語記憶の障害と相関があることが報告されている(例えば、Bremner et al 1995)。その後の一卵性双生児研究では、海馬体積の減少が外傷後のPTSD発症の素因となることが示唆されているが(Gilbertson et al 2002)ラットを用いた最近の縦断的MRI研究では、慢性的な拘束ストレスが海馬体積の減少を引き起こすことが示されている(Lee et al 2009)。これらの効果は、海馬の神経細胞の形態や神経新生に対するストレスの影響によって引き起こされると考えられている。慢性的な拘束ストレスは一過性にCA3の樹状突起や錐体ニューロンの枝の数を減少させ(Conrad er al)。 1999海馬の歯状回(Schoenfeld and Gould 2012)領域での新しい顆粒ニューロンの産生を抑制する。ストレス後の海馬へのこれらの構造変化は、ストレスによって生じる空間ナビゲーションやエピソード記憶の障害に対応しているように思われる(Kim and Diamond 2002; Vyas er al)。
ストレスのグルココルチコイド仮説:互換性のある証拠と互換性のない証拠
序文で述べたように、多くの基礎的および臨床的ストレス研究では、海馬におけるストレス効果の原因因子として、HPA軸の神経内分泌ホルモンであるグルココルチコイドのレベルの違いに焦点が当てられてきた(McEwen and Sapolsky 1995)。海馬には高親和性の I 型ミネラルコルチコイド受容体(MR)と低親和性の II 型グルココルチコイド受容体(GR)の両方が豊富に存在し、コルチゾール(コルチコステロン) のレベルと LTP の間には二重の関係があるようで、コルチゾール(コルチコステロン) のレベルが低い(副腎摘出術による)場合と高い(急性投与による)場合の両方が LTP の障害と関連している(Diamond er al)。 その後の研究では、MRの選択的活性化はLTPを増加させる一方で、GRのさらなる活性化はLTPを減少させ、LTDを増加させることが報告されている(例えば、Pavlides et al 1995;行動に対する並行効果についてはVaher et al 1994を参照のこと)。これらの知見は、低レベルのコルチゾール(コルチコステロン)は高親和性MRの優先的な刺激によりLTPを増強するが、ストレス時にはコルチゾール(コルチコステロン)は低親和性受容体を飽和させるのに十分なほど高レベルになり、LTPの障害につながることを示唆している(McEwen and Sapolsky 1995)。サポートでは、コルチゾール(コルチコステロン)の浴用塗布は海馬スライスのCA1 LTPを減少させることが報告されている(例えば、Alfarez et al 2002)。
注射、移植可能なペレット、または飲料水を介してコルチゾール(コルチコステロン)への長期暴露はまた、形態学的および分子的変化を引き起こし、神経新生を減少させ、海馬のシナプス可塑性を損なうことが示されている、海馬依存性の記憶障害および不安と抑うつのような行動を沈殿させると考えられている生理的な結果(SternerとKalynchuk 2010)。海馬に対する慢性的なコルチゾール(コルチコステロン)上昇のこれらの長期的影響は、HPA軸のエピジェネティックなメカニズム(すなわち、DNAメチル化およびヒストン修飾)を介して起こると仮定されている(例えば、McEwen et al 2012)。
最近、コルチゾール(コルチコステロン)の海馬内注入はPTSD様の記憶障害を誘発することが示されている。すなわち、衝撃を予測する文脈に対する凍結は低レベルであるが、衝撃を予測しない離散的な手がかりに対する凍結は高レベルである(Kaouane et al 2012)。また、コルチゾール(コルチコステロン)は基底側扁桃体のカテコールアミンと相互作用して、感情的な出来事の長期記憶の定着を強めることも示されている(Schwabe et al 2012)。しかし、CRF1受容体欠損マウス(コルチゾール(コルチコステロン)上昇欠損マウス)は正常な恐怖学習を示し(Tovote et al 2005遠隔恐怖記憶の低下を示したが、最近の文脈的恐怖記憶は示さなかった(Thoeringer et al 2012)。
繰り返しになるが、コルチゾール(コルチコステロン)の高値が必ずしもストレスの高値を示すわけではないことを強調する(図2)。ストレスが実際にコルチコステロイドのレベルの変化に還元されることができるならば、ストレス時のコルチゾール(コルチコステロン)上昇を除去し、ナイーブ動物のコルチゾール(コルチコステロン)レベルを直接上昇させることは、それぞれストレスの影響を除外し、シミュレートするべきであることは次のとおりである。しかし、コルチゾール(コルチコステロン)レベルとストレスの大きさとの間に直線的な関係があるというこの考え方を支持しない行動学的および神経生理学的研究がある(例えば、Shors et al 1989年;Woodson et al 2003)。むしろ、高レベルのコルチゾール(コルチコステロン)が認知機能に及ぼす影響は、コルチゾール(コルチコステロン)が発生している間の心理状態に依存している。例えば、最近の研究では、ストレスと環境の豊かさの両方がコルチゾール(コルチコステロン)レベルを有意かつ同等に上昇させる一方で、海馬の神経新生にはそれぞれが反対の効果をもたらすことが明らかにされている(例えば、Schoenfeld and Gould 2012)。同様に、回避性(猫への暴露)ではコルチゾール(コルチコステロン)レベルが高いが、食欲(メスラットへの暴露)ではない状態では記憶力が低下する(Woodson er al)。 コルチゾール(コルチコステロン)およびストレスに関与する他の神経化学物質には多面的な機能があり、どれもストレスに特異的に反応することが知られていない(すなわち特異性に欠ける)という事実を認識することが重要であり、したがって、単一のものがストレス効果の十分なメディエーターになることはないと思われる(Koolhaas er al)。 例えば、ストレスと運動の両方が コルチゾール(コルチコステロン) を上昇させるが、反対の生理学的効果をもたらす場合、風呂で塗布した コルチゾール(コルチコステロン) を用いた 試験管内試験 海馬組織は、ストレスを受けた動物の海馬を代表するものではない。HPA軸ホルモンはストレスに対する反応性が高いが、広範な細胞代謝プロセスの調節に関与しているため、ストレスホルモンと呼ぶのは誤りである。
海馬へのストレス影響のシステムレベルでの解析
近年、扁桃体と前頭前皮質(PFC)が海馬へのストレス影響の発現に関与していることが示唆されている。両構造は、様々な脳領域(例えば、視床や感覚野)からの感覚入力を受け、防御反応に関連する様々な構造に投射されるため、ストレス操作を行うために必要とされる広範な感覚防御回路の接続を有している(例えば、mPFCは扁桃体と相互に接続されており、ストレスホルモンを活性化するために末梢筋の床核に投射され、防御行動を行うために灰白質周囲帯に投射され、交感神経の活性化のために側視床下部に投射される;LeDoux 1996を参照)。
これまでの研究では、扁桃腺病変がストレスによって影響を受ける身体機能および行動機能の範囲を防ぐことがわかっている(例:胃びらん;Henke 1981)。これと一致して、扁桃腺病変と不活性化(GABAA受容体アゴニストであるムスキモールを介して)は、ラットの海馬のLTPと空間記憶に対するストレスの影響もブロックした(Kim er al 2001, 2005)。ストレス後すぐにムスキモールを扁桃体に注入しても、LTPと記憶に対するストレスの影響を防ぐことができなかったので、扁桃体の活動の重要な時間帯はストレスの後ではなく、ストレスの間にあるようである(Kim er al)。 扁桃体の病変/不活性化は、コルチゾール(コルチコステロン)レベルの上昇にもかかわらず、海馬のLTPと記憶に対するストレス効果をブロックしたことに言及しなければならない(Shors er al)。 最近、扁桃体の電気刺激はCA1のLTPを抑制し(Vouimba and Richter-Levin 2005場所細胞の活動を変化させるのに十分であることが明らかになった(Kim er al)。 これらの知見は、扁桃体が海馬の機能に影響を与える中枢性ストレスメカニズムの重要な構成要素であることを示唆している。
扁桃体はストレスに反応してグルココルチコイドの分泌を促進する(LeDoux 1996)。海馬とは対照的に、ストレスによって扁桃体ではLTPが亢進し、樹状突起や棘が増加することから、これらの変化がストレス性不安障害のメカニズムとして提案されている(Vyas er al 2002)。しかし、現在のところ、扁桃体の神経生理学的変化がストレス誘発性の海馬の変化に必要なのか、あるいはその逆なのかは不明である。
PFCはストレスの影響を受けやすいもう一つの脳構造であり(例えば、LTPの障害、PFCニューロンの形態学的変化;Maroun and Richter-Levin 2003)海馬へのストレス影響を調節することに関与している。特に、内側PFC(mPFC)は扁桃体と海馬の両方に接続しており、mPFCの「エグゼクティブ」レベルの処理(Maier et al 2006)はストレス時に海馬に影響を与える。この見解と一致するように、mPFCの活動は回避的に動機づけられた行動の抑制(または消滅)と密接に相関している(Maren and Quirk 2004を参照)。これらの知見を合わせると、ストレスは複数の要素で構成されており、神経化学的レベルの単純な変化によって表されるものではないことが示唆されており、制御不能なストレスが海馬に及ぼす有害な影響を理解するためには、システムレベルのアプローチが必要であることがわかる(図5)。
図5. ストレスのシステムレベルモデル
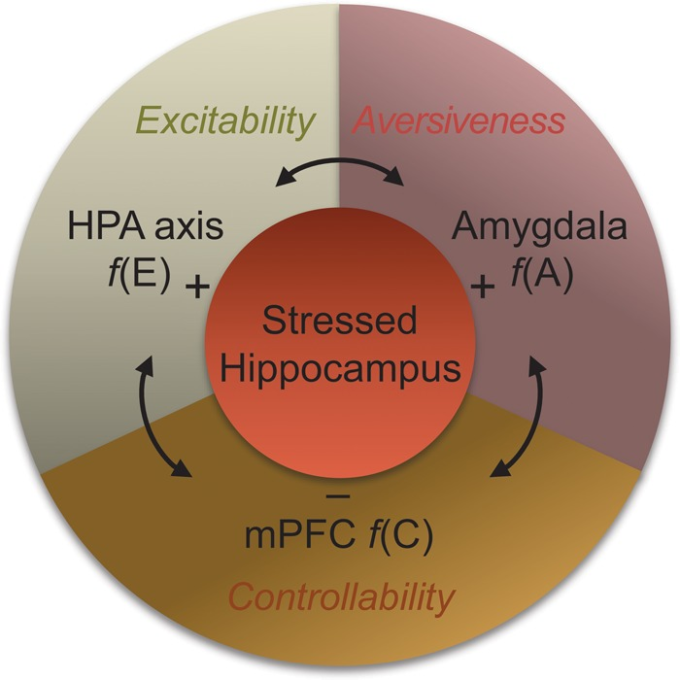
ストレスの複雑性は、覚醒性または興奮性の亢進 [f(E) ]、知覚された回避性 [f(A) ]、制御性の低下 [f(C) ]からなると運用上定義されており、それぞれHPA軸、扁桃体、およびmPFCが生物学的に対応するものと仮定されている(Kim and Diamond 2002)。これらの成分間の相互作用は、海馬(および他の脳構造)へのストレス効果を媒介していると考えられている。
概要
彼の輝かしい科学者としてのキャリアの黄昏時に、Selye (1973)は、「ストレスとは、そのホルモン(コルチコイド)の副腎皮質による分泌を引き起こすものではない。副腎刺激性下垂体ホルモンであるACTHは、ストレスの証拠を出さずにこれらのホルモンを排出することができる。
しかし、現代のストレス研究は、HPA軸ホルモン(グルココルチコイドなど)のレベルの異常および/または長期化が、海馬における様々な神経生物学的変化を引き起こす原因となっており、それが記憶機能に影響を与える可能性があり(McEwen and Sapolsky 1995などPTSD(Yehuda er al)。 1990など)などの精神病の原因となっているという見解に大きく左右され続けている。
このアプローチは、海馬の細胞内シグナル伝達カスケード、シナプス可塑性、構造変化、細胞死、神経発生に関する豊富な情報を生み出していたが、ストレスの心理学的・生物学的複雑性を明らかにするものではなかった。
さらに、海馬に対するストレスの影響のいくつかの側面(およびヒトにおけるストレス障害)は、ニューロンの構造変化や特定の化学レベルの変化を示すのではなく、むしろストレスが脳の神経計算を微妙に変化させている可能性があることを認識することが重要である。したがって、ストレス研究は、ストレスの多面的な性質を捉えるために、通常の神経化学的な研究から、システムレベルの神経計算アプローチに焦点を移す時期に来ているのかもしれない。
