Contents
STABILITY AND QUALITY OF FISH OIL DURING TYPICAL DOMESTIC APPLICATION
記事 2005年1月
Margrét Bragadóttir
概要
本プロジェクトの目的は、魚油の酸化度を調査し、家庭での使用を想定した場合のトコフェロールの添加による安定性の向上を図ることである。研究には、n-3系多価不飽和脂肪酸(EPA, 18.2%; DHA, 12.2%)を多く含む魚種から得られた新鮮な油を使用した。魚油を10℃で保存し,室温に30分間さらした状態で1日分の魚油を摂取するという,典型的な家庭での使用をシミュレーションした。魚油の安定性と品質は,過酸化物値とアニシジン値を測定することで評価した。最初の30日間は魚油の過酸化物値に軽微な変化が見られたが,酸化防止剤を含まない魚油を安全に摂取するためには,国内で消費される保存条件では最大36日間の保存期間が推奨される。0.01%のトコフェロールを添加しても魚油の自動酸化を遅らせる効果はなく,トコフェロールの酸化防止効果は0.05%以上の濃度では増加しなかった。トコフェロールを0.05%添加した魚油の場合,トコフェロールを添加していない魚油と比較して,41日で食用の過酸化物値の許容限界(PV = 8meq/kg)に達し,安定性が14%向上した。最も長い保存期間でPV-8 meq/kgまでの最長保存期間は,Ronaxan 0.05%を添加した試料では44日であり,魚油の酸化安定性が約22%向上したことになる。また,魚油の二次酸化はほとんど見られず,保存期間中のアニシジン値の変化に対する酸化防止剤の有意な影響は見られなかった。
キーワード:魚油,EPA,DHA,安定性,トコフェロール,抗酸化。
1 はじめに
タラの肝油やスケソウダラの肝油などの魚油は,高度不飽和脂肪酸(HUFAまたはPUFA)と呼ばれるDHA(ドコサヘキサエン酸)とEPA(エイコサペンタエン酸)の豊富な供給源である。ここ数十年の間に、n-3系PUFAの食生活への影響に対する関心が高まっている。その理由は、HUFAが血清トリアシルグリセロールとコレステロールを低下させる能力を持ち、血栓症を減少させることが知られているエイコサノイドに変換されるためである。さらに、これらの脂肪酸は、冠状動脈性心臓病、高血圧、関節炎、その他の炎症性疾患や自己免疫疾患の予防や可能な治療に重要な役割を果たしており、DHAは特に脳の発達に重要だ。
オメガ3系長鎖PUFAの重要性が強調されたことで、精製された魚油のサプリメントが健康食品店で市販されるようになった。そのため、魚油は人の健康や栄養に有用な効果があることから人気を集め、その品質や安定性がより重要視されるようになった。しかし,魚油は健康上の利点があるにもかかわらず,酸化劣化に非常に敏感であり,実用上の問題がある。魚油の自己酸化の際には,誘導期間中であっても,非常に低い過酸化物値で望ましくない風味や臭気が発生する。脂質の酸化は、腐敗臭や風味を発生させるだけでなく、二次生成物の形成によって栄養学的品質や安全性を低下させる可能性がある。この問題を解決するために、より安全で効果的な天然の抗酸化物質の研究が進められており、いくつかの天然の供給源が検討されている。
アイスランドでの一般的な魚油の消費は、朝食時にタラ肝油またはオメガ3系魚油を1日1回スプーンで摂取するという形である。魚油の大瓶(500ml)は、空になるまで1〜2ヶ月は持つ。その間、毎日冷蔵庫から取り出して、朝食時に30分ほど放置しておくことができる。北朝鮮でもスケソウダラの肝油が同様に消費されていることが分かっている。しかし、魚油摂取時の正しい抗酸化方法は見つかっておらず、場合によっては油の酸化により好ましくない味や臭いが発生したり、EPAやDHAの酸化変化が予想されたりする。このような行為は、油製品の安全性と価値に対する消費者の信頼を低下させる。したがって、安全に摂取するためには、魚油の安定性を向上させることが重要である。
本プロジェクトの目的は,酸化防止剤を添加することにより,通常の国内使用時における魚油の安定性を向上させることである。
このプロジェクトの目標は以下の通りである。
- 酸化防止剤を添加していない魚油の家庭での使用時の酸化度を調べる。
- 酸化防止剤を添加した場合の魚油の安定性を評価する。
- 魚油を安全に摂取するための酸化防止剤の濃度を決定する。
2 文献調査
2.1 人間の健康にとっての魚油の重要性
海洋油には多価不飽和脂肪酸(PUFA)特にエイコサペンタエン酸(EPA)やドコサヘキサエン酸(DHA)などのω3系の脂肪酸が豊富に含まれている(Wanasundara and Shahidi 1998, Heinzelmann and Franke 1999)。n-3系多価不飽和脂肪酸(n-3 PUFA)は、健康に重要な役割を果たすことが認識されている(Uauy and Valenzuela 2000, Paez er al 2002, Liu er al 2005)。
2.1.1 n-3(オメガ3)PUFAとは?
もともとn-3系脂肪酸は、ギリシャ語の「Omega」(英語では「last」)と、最初の二重結合が最後の炭素(すなわち脂肪酸鎖のメチル末端)から数えられることを利用して、オメガ3脂肪酸と名付けられた(Curtis er al)。 したがって、オメガ-3脂肪酸の場合、最初の不飽和炭素結合はメチル末端から3番目の炭素に生じる。同様に、オメガ-6脂肪酸およびオメガ-9脂肪酸では、最初の不飽和炭素結合は、それぞれメチル末端から6番目と9番目の炭素に生じる。その後、オメガ-3,-6,-9という呼称は、それぞれn-3,n-6,n-9に変更された。
n-3系PUFAの供給源としては、アマニ油などの植物油や緑葉があり、これらにはα-リノレン酸が含まれている。このα-リノレン酸は、哺乳類では脱飽和と伸長を経てEPAとDHAに変換される(Curtis er al)。 しかし、動物およびヒトの生体におけるEPAおよびDHAの生合成はむしろ遅いプロセスであり、加齢とともにさらに減速する(Arkhipenko and Sazontova 1995)。また、人間はこれらを合成することができないため、EPAおよびDHAは最適な健康状態を保つために食生活に不可欠な栄養素である(Leaf er al)。 EPAとDHAは、油性の魚(サバ、ニシン、イワシ、サケなど)やタラ肝油などの魚油抽出物に高濃度で含まれているため、直接摂取することができる(Curtis er al 2004)。
2.1.2 n-3 PUFAsの健康効果
2.1.2.1 心血管に対する効果
n-3系多価不飽和脂肪酸(n-3 PUFAs)の大量摂取が心血管疾患の死亡率を低下させることは、20年以上前に初めて指摘された(Abeywardena and Head 2001)。n-3系脂肪酸と疾患との影響を示す最も強い証拠は、食事、血中、組織中のn-3系脂肪酸の量と冠動脈疾患の発生との間に逆相関があることである(Uauy and Valenzuela 2000)。冠状動脈性心臓病に対するn-3系脂肪酸の効果は、動物やヒトを使った何百もの実験、組織培養研究、臨床試験で明らかになっている(Leaf er al)。 食事性n-3脂肪酸は、不整脈の予防、抗炎症作用のあるプロスタノイドやロイコトリエンの生成、炎症を増強しプラーク形成を促進するサイトカインやマイトジェンの合成抑制など、様々な作用によって心臓病を予防する働きがある(Uauy and Valenzuela 2000)。さらに、これらの化合物は、血管平滑筋を弛緩させる内皮由来の一酸化窒素を刺激し、内皮の修復を促進し、血漿脂質(主にトリアシルグリセロールとVLDL(超低密度リポタンパク質))を低下させる。
2.1.2.2 脳と目への効果
脳は、オメガ3系PUFAの摂取が不可欠な器官のひとつである(Garciaら 2004, Mezaら 2003)。この器官の組織には特にDHAが豊富に含まれており、この酸の消費と細胞膜への蓄積には密接な関係があることがわかっている。DHAは、網膜の光受容体の膜や神経組織、特に脳の灰白質に特に多く含まれ、これらの組織の脂質の30〜50%を占めている(Arterburn er al)。 DHAは妊娠中の子供の脳の発達と網膜の形成に関与しており(Garcia er al 2004)網膜の発達と脳の成長が最も急速に進むのは妊娠第3期であり、この時期にDHAの蓄積率が最も高くなる(Arterburn er al 2000)。したがって、将来の母親は、オメガ3系PUFAの供給源として魚を食生活に取り入れることが推奨される(Garcia er al 2004)。脳の発達とDHAの蓄積は、生後2年間を通じて急速に進んでいる(Arterburn et al 2000)。神経膜の長鎖多価不飽和脂肪酸(LC-PUFA)組成は脳の発達にとって重要な因子であり(Högyes er al 2003)正常な成人の脳は20g以上のDHAを含んでいる(Paez er al 2002)。DHAは成人の正常な脳機能の維持に必要である(Horrocks and Yeo 1999)。豊富なDHAを食事に取り入れると学習能力が向上するが、DHAが不足すると学習能力が低下すると言われている。PUFAの濃度を維持することで、認知、学習、記憶の機能を高めることができると考えられる(Youdim et al 2000)。
2.1.2.3 癌への影響
PUFAの癌発生に対する影響については多くの報告がある(Jiang et al 1998年、Moyad 2005,Horrocks and Yeo 1999年、Nano et al 2003,Horia et al 2005,Smyth et al 2005,Mahéo et al 2005,Barascu et al 2006)。PUFAのいくつかの特性が、癌の治療において魅力的な選択肢となることは明らかである(Jiang er al)。
PUFAは
- 細胞膜のリン脂質を修飾する。
- 腫瘍の運動性/浸潤性を低下させる細胞機能の改変。
- 腫瘍細胞に直接毒性がある。
- 化学療法剤や放射線に対する腫瘍細胞の感受性を変化させる。
- 正常組織に対して保護的な役割を果たす(放射線の場合)。
- 正常細胞への細胞毒性が低い。
多くの研究により、魚油が結腸癌(Nano et al 2003,Moyad 2005,Jiang et al 1998年)乳癌(Horia and Watkins 2005,Mahéo et al 2005,Barascu et al 2006,Jiang et al 1998年)腎癌(Smyth and McGlynn 2005,Moyad 2005年)前立腺癌、膵臓細胞、肝臓癌(Jiang et al 1998年、Moyad 2005)など、いくつかのタイプの癌の予防に重要な役割を果たすことが示されている。
2.1.2.4 n-3 PUFAsとヒトの免疫・炎症反応
ここ数年、n-3 PUFAがヒトの免疫・炎症反応に及ぼす影響について多くの研究がなされてきた(Kelley 2001, Calder 2001, Uauy and Valenzuela 2000, Horrocks and Yeo 1999, Curtis er al 2004, Teitelbaum and Walker 2001)。LCPUFAの補給がさまざまな生理学的機能に及ぼす影響は、さまざまなエイコサノイドの産生によって説明できるかもしれない(Uauy and Valenzuela 2000)。エイコサノイドは、免疫系内で作用する化学的メッセンジャーの第2のグループである(Calder 2001)。これらの化合物は、PUFA、炎症および免疫機能の間のリンクを提供している。エイコサノイドはPUFAから合成され、プロスタグランジン(PG)トロンボキサン、ロイコトリエン(LT)リポキシン、ヒドロペルオキシエイコサテトラエン酸(HPETE)ヒドロキシエイコサテトラエン酸(HETE)などがある。LCPUFA由来のプロスタグランジン、プロスタサイクリン、スロボキサン、ロイコトリエンは、炎症、サイトカイン放出、免疫反応、血小板凝集、血管反応性、血栓症、アレルギー現象などの調節に重要な役割を果たしている(Uauy and Valenzuela 2000)。生体膜におけるAA(アラキドン酸、n-6)とEPA(n-3)のバランスは、食事による供給に基づいて調節されている。リン脂質中のn-6/n-3比は、AAとEPAに由来する2系列と3系列のプロスタノイドのバランスを調節している。3系列のプロスタノイドは弱いアゴニストであり、場合によっては2系列のプロスタノイドの活性に拮抗する。2系列のエイコサノイドは、炎症や血小板凝集を促進し、免疫反応を活性化する。一方、シリーズ3のプロスタノイドはこれらの作用を改善する傾向がある。
2.1.2.5 血漿脂質への影響
海洋油は、正常または高脂血症の被験者のトリグリセリドを低下させる効果が実証されている(Uauy and Valenzuela 2000)。これは、LDL(低密度リポ蛋白質)コレステロールを低下させるn-6系植物油の効果とは全く異なる。ヒトと動物を対象とした研究では、魚油濃縮物が肝トリアシルグリセロール合成と肝臓からのVLDLの分泌を阻害することが示されている。n-3系脂肪酸を投与しても、ヘパリン投与後のリポ蛋白リパーゼや肝リパーゼ活性を刺激することは一貫してないので、n-3系脂肪酸がトリグリセリドを低下させる主な機序は、クリアランスの促進ではなく、生成の低下によるものだと考えられている。n-3系脂肪酸はポストヘパリンの酵素活性に影響を与えないが、n-3系脂肪酸がVLDLのリポ蛋白リパーゼおよび/または肝リパーゼを介した脂肪分解に対する感受性を高め、それによってVLDLからLDLの産生が増加する可能性がある。
2.1.3 DHAおよびEPAの推奨摂取量
オメガ3系長鎖PUFAの重要性が強調されたことで、精製された魚油のサプリメントが健康食品店で販売されるようになった(Horrocks and Yeo 1999)。消費者の中には、推奨された摂取量に十分な注意を払わず、これらのカプセル化されたオメガ3サプリメントを乱用する人もいる。DHAの過剰摂取は、膜の伝染性や一部の酵素活性を阻害し、また十分な抗酸化物質がなければ過酸化脂質の蓄積を引き起こす。
ω-3 PUFAsの1日の摂取量に関する推奨事項は、いくつかの国際的な科学機関から発表されている(Kroes er al 2003)。カナダ保健福祉省が発表した栄養勧告では、1日当たり1.0〜1.8gのω-3 PUFAを摂取することが推奨されているが、個々のω-3 PUFAの区別は確認されていない。国際脂肪酸・脂質学会(ISSFAL)では、DHAとEPAを合わせて0.22g/日以上の適切な摂取量(AI)を推奨しており、英国栄養財団(BNF)では、DHAとEPAを合わせて1.1g(女性)と1.4g(男性)/日の摂取が望ましいとしている。米国では、米国医学研究所(IOM)が、乳児に対して0.5gのω-3 PUFA(DHAを含む)/日の推奨AIを発表している。米国食品医薬品局(US FDA)は、メンハーデンオイルに含まれるDHAとEPAの合計を3g/日まで摂取しても安全であると結論づけている。
2.2 保存中の魚油の品質劣化
2.2.1 魚油の酸化的劣化
トリグリセリドを高濃度に含む他の一般的な油と同様に、風味や臭気の観点から魚油の品質を劣化させる最も重要な原因は、大気中の酸素による酸化である。酸素に攻撃される部位は、トリグリセリドの脂肪酸部分の不飽和部分である(Stansby 1967)。EPAやDHAなどの多価不飽和脂肪酸を多く含む魚油は、酸化による腐敗の影響を受けやすく、魚油の酸化速度は他の油とは大きく異なる(Boran er al)。 通常、多価不飽和油では、腐敗の開始はゆっくりと始まり、ポリエン酸エステル(LH)がフリーラジカルを与える(反応1)(Beddows et al 2001,Frankel 1996)。これが酸素と反応して(反応2)すぐにペルオキシ種を生成し、さらにこれが新鮮なアルキルプロトンと反応して新たなフリーラジカルを生成する(反応3)。
不飽和の中心で起こる酸化反応には、さまざまな要因が影響する(Stansby 1967)。温度や不飽和度の影響を受けるだけでなく、様々な触媒によって酸化が促進されたり遅延されたりする。特定の金属、可視光や短波長の光、一部の酸化酵素、ヘモグロビンなどの生体物質は、この種の酸化劣化を著しく促進する。魚油の自己酸化では、酸化の初期段階、つまり誘導期間中であっても、非常に低い過酸化物の値で望ましくない風味や臭気が発生する(Boran er al 2006)。過酸化水素は、酸化された油の風味や臭気の悪化にはあまり寄与しない(Stanby 1967)。ほとんどの場合、有機光学的に検出可能な物質は低分子量であり、過酸化物の分解や、過酸化物とその分解物のさらなる酸化によって形成されるようだ。酸化した油からは、多くの飽和・不飽和アルデヒド、ケトン、酸などが分離され、好ましくない味や 匂いの原因となっていることがわかっている。
2.2.2 酸化した脂質の健康被害
脂質の酸化は、腐敗臭や風味を発生させるだけでなく、二次生成物の形成によって栄養学的な品質や安全性を低下させる可能性がある(Frankel 1996)。脂質の酸化生成物は、老化、膜の損傷、心臓病、がんなどと関連しているため、健康被害をもたらすことが知られている(Suja er al 2004)。このような酸化した脂肪を摂取すると、実験動物の組織において下痢、肝臓肥大、成長抑制、組織学的変化を引き起こすことが報告されている(Nwanguma er al)。 脂質が酸化されると、アクロレイン、マロナルドアルデヒド(MA)4-ヒドロキシル-2-ノネナール(4-HN)などの生物学的に活性なカルボニル化合物が生成されることが多くの研究者によって報告されている(Miyake and Shibamoto 1996)。これらの化学物質は、動脈硬化、白内障、老化などのヒトの疾病と関連している。例えば、アクロレインは、ヒト気管支上皮の多段階発癌に関連するいくつかの細胞障害を引き起こすことが報告されている。MAは、老化、変異原性、発癌に関与していると言われている。これらのアルデヒドの毒性は、タンパク質に架橋したり、核酸に共有結合する能力に起因する。ほとんどすべてのアミノ酸は、酸化された脂質の一次および二次生成物と反応し、それによってタンパク質、アミノ酸、脂肪の消化利用率を低下させ、体重増加に影響を与える可能性がある(Varela er al)。1995)。
急性中毒の例として、日本では約 40 年前に即席麺の油脂劣化による食中毒が報告されている(Gotoh er al 2005)。これらの事件で死亡した人はいないが、劣化した即席めんを食べた多くの人が、下痢、吐き気、嘔吐、腹痛、疲労感、頭痛などの急性症状を発症した。食中毒の原因となった即席めんの脂質の酸化度は、過酸化物価(PV)で100meq/kg以上であった。
2.3 抗酸化物質の利用
2.3.1 酸化防止剤の作用のメカニズム
酸化防止剤とは、比較的低濃度で、酸素との反応速度を著しく阻害する物質と定義することができる(Stansby 1967, Markley 1961)。この現象に関する情報は、一般に脂肪酸が高度に不飽和であるため、空気中の酸素による攻撃を受けやすい魚油では特に重要である(Stansby 1967)。酸化防止剤は、開始段階または伝播段階の初期段階のいずれかを妨害する物質である。酸化防止剤は、元のフリーラジカルまたは初期段階で形成されたフリーラジカルと反応して、連鎖を継続できない中間体を生成する。以下は、これらの反応の簡略版である(AHは酸化防止剤を表す)。
抗酸化物質として働くことができる物質は、容易に取り出せるプロトンを持っており、残ったフリーラジカルは、不飽和基質の別の分子からプロトンを抽出することができない。そのため、反応の連鎖が停止する。
2.3.2 天然抗酸化物質の利用
2.3.2.1 合成酸化防止剤の使用制限について
油脂の安定性の問題を解決するために、ブチル化ヒドロアニソール(BHA)、ブチル化ヒドロキシトルエン(BHT)、ターブチルヒドロキノン(TBHQ)などの合成酸化防止剤は、天然の酸化防止剤よりも効果的で安価であることから、食品添加物として使用されてきた(Iqbal and Bhanger 2005, Suja er al 2004, Krings er al 2000)。しかし、最近の報告では、これらの化合物が、癌や発癌を含む多くの健康リスクに関与している可能性が明らかになっている(Iqbal and Bhanger 2005)。そのため、日本、カナダ、ヨーロッパでは、最も強力な合成酸化防止剤(TBHQ)の食品への使用が認められていない。同様に、BHAとBHTも、一般的に安全と認められている化合物のリストから外されている(Iqbal and Bhanger 2005, Suja er al)。 このような安全性への懸念から、食品科学者の間では、これらの合成抗酸化物質を、一般的に安全性が高いとされる天然の抗酸化物質に置き換える傾向が強まっている。
2.3.2.2 主な天然抗酸化物質
天然の抗酸化物質への関心が高まり続けているのは、食品中に存在し、何世紀にもわたって使用されてきたことから安全性が高いと推定され、その結果、合成化合物の安全性の問題を回避することができるからである(Frankel 1996)。より安全で効果的な天然の抗酸化物質の研究が進められており、いくつかの天然の供給源が検討されている(Suja er al 2004, Wanasundara and Shahidi 1998, Lee and Shibamoto 2001, Yu er al 2005, Peschel er al 2005, Balasundram er al 2005)。
今日、技術的に最も重要な天然の抗酸化物質は、トコフェロールと香辛料の抽出物、アスコルビン酸とクエン酸とその塩である(Hraš er al 2000, Tsimidou er al)。 1995)。天然の抗酸化物質の分野で発表された研究の大半は、トコフェロールに焦点を当てている(Kalucka er al 2005)。α-、β-、γ-、δ-トコフェロールは、植物油に混合して含まれており、油脂中の主要な天然抗酸化物質である(Hraš er al 2000)。α-トコフェロールは、ペルオキシルラジカルと反応して鎖の伝播を止め、アルコキシルラジカルと反応してヒドロペルオキシドの分解を抑制し、アルデヒドの生成を減少させることで、フリーラジカルの酸化を抑制する(Frankel 1996)。
アスコルビン酸は、条件に応じて、抗酸化剤、酸化促進剤、金属キレート剤、還元剤、酸素捕捉剤として作用する。ビタミンCの脂溶性エステルであるパルミチン酸アスコルビル(AP)は、腐敗の開始を遅らせる合成抗酸化剤として承認されている(Beddows et al 2001)。
同様に、リン脂質がα-トコフェロールと相乗的な相互作用を示すことも報告されている。ホスファチジルエタノールアミンはホスファチジルコリンよりも効果的である。しかし、商業的には後者の方が入手しやすい(Vicetti er al 2005)。リン脂質はヒドロペルオキシドを分解し、それに伴ってカルボニルや揮発性の生成物を形成する。したがって、リン脂質がトリグリセリドと接触すると、培養中にPV値は上昇しない。
クエン酸は、ほとんどすべての動植物種に含まれている(Hraš er al 2000)。クエン酸は、金属とクエン酸分子のカルボキシル基またはヒドロキシル基との間に結合を形成することにより、金属イオンをキレートすることができる。クエン酸は、食品中の脂質の酸化劣化を抑制する効果が高く、脱臭後の植物油によく添加されている。
香辛料やハーブを加工食品の酸化防止剤として使用することは、合成の酸化防止剤を使用する代わりに有望である(Madsen et al . 1998)。天然の食品添加物に対する消費者の関心の高まりを受けて、香辛料の抗酸化活性に関する数多くの報告がなされている。多くの香辛料やその抽出物は、様々な食品や脂質系において抗酸化活性が評価されている(Tsimidou er al)。 1995)。これまでのところ、ほとんどの研究はローズマリーとローズマリー抽出物の抗酸化作用に集中している(Hraš er al 2000, Madsen er al)。1998)。ローズマリーの抗酸化活性を担う化合物は、主にカルノシン酸、カルノソール、ロスマノール、エピロスマノール、イソロスマノール、カルノシン酸メチルなどのフェノール性ジテルペン類と、ロスマリン酸などの他のフェノール酸類である(Hraš et al 2000,Kalucka et al 2005)。現在、食品用のローズマリー抽出物が多数販売されている。しかし、ローズマリーの強烈で特徴的な香りは、非常に高い抗酸化能力が確立されているにもかかわらず、このスパイスの使用を制限する可能性がある(Madsen er al)。 1998)。クローブの芽の抽出物とその主な香り成分であるオイゲノールと酢酸オイゲニルの抗酸化作用は、天然の抗酸化物質であるα-トコフェロール(ビタミンE)と同等のものであった(Lee and Shibamoto 2001)。クローブの芽の抽出物は、タラ肝油中のマロナルドアルデヒドの生成を抑制した。
また、穀類、野菜、果物、油糧種子など、多くの食品や農産物からも抗酸化物質が検出されている(Yu er al 2005, Madsen er al)。 1998)。ヨーロッパの食品加工産業で生産される膨大な量の植物残渣、主にブドウの種やオリーブの廃棄物の抽出物から、副産物由来の抗酸化物質がいくつか開発され成功を収めている(Peschel er al)。 最近では、ブラックキャラウェイ、キャロット、ヘンプ、クランベリーシードオイルなどのコールドプレスシードオイルが市販されるようになった(Yu er al 2005)。12種類の果物と5種類の市販果汁の総抗酸化活性を調べたところ、イチゴの抗酸化活性が最も高く、次いでプラム、オレンジ、赤ブドウ、キウイフルーツ、ピンクグレープフルーツ、白ブドウ、バナナ、リンゴ、トマト、ナシ、ハニーデューメロンと続いた(Mokbel and Hashinaga 2006)。ゴマ粕抽出物の抗酸化効果についても研究されている(Suja er al 2004)。ゴマ粕のメタノール抽出物が提供する抗酸化保護は、広く使用されている合成抗酸化物質BHTに匹敵するか、場合によってはそれよりも優れている。
お茶の抗酸化作用については、多くの研究が行われている(Wanasundara and Shahidi 1998, Zandi and Gordon 1999, Krings er al 2000)。緑茶の葉には、乾燥重量ベースで最大36%のポリフェノールが含まれており、茶葉の抽出物は、主にフラバノールであるエピガロカテキンガレート、エピカテキンガレート、エピガロカテキン、エピカテキンの存在により、強力な抗酸化物質となる。茶カテキンは、合成抗酸化剤と同様の効果で海洋油の酸化を抑制し、緑茶抽出物は天然抗酸化剤として大規模な応用が期待されている。茶カテキンは、フリーラジカルを除去する効果があり、金属キレート剤としても作用する。また、緑茶の有機抽出物に含まれるクロロフィルは、抽出物の抗酸化活性に影響を与える。
3 材料と方法
3.1 材料
3.1.1 魚油
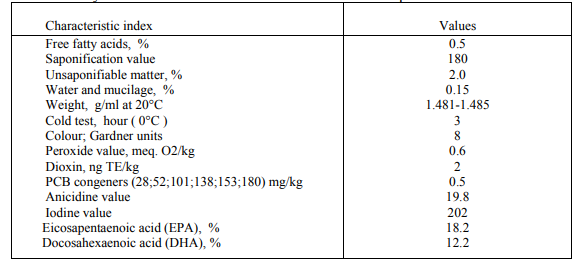
アイスランドのLysi Ltd.から供給された魚油は,n-3系多価不飽和脂肪酸を多く含む魚種から加工されたもので,淡い黄色をしており,扉や味はほとんどない。この魚油は、精製、漂白、乾燥、低温ろ過、脱臭されていた。この魚油は、精製、漂白、乾燥、冷間ろ過、脱臭されており、遺伝子組み換え原料や成分も含まれなかった。この魚油の物理化学的特性を表1に示す。
表1:魚油サンプルの物理化学的特性
3.1.2 酸化防止剤
実験に使用した酸化防止剤は、70%のトコフェロール混合物を含むCoviox T-70(Cognis社)と、5%のdl-αトコフェロール、25%のパルミチン酸アスコルビル、70%のレシチンを含むRonoxan(DMS社)である。試料に添加する酸化防止剤の濃度は、活性酸化防止剤の含有量に基づいて調製した。酸化防止剤はアイスランドのLysi Ltd.から提供された。
3.2 方法
3.2.1 試料の調製
魚油に酸化防止剤を以下の量で添加した。
- サンプル1 トコフェロール 0.02 wt %。
- サンプル2 トコフェロールを0.05 wt %。
- サンプル3…トコフェロール0.1wt %。
- サンプル4…ロノキサン0.05wt%含有
コントロールには、酸化防止剤を含まないサンプルを使用した(コントロール)。慎重に混合した後、サンプルを500mlの茶色のボトルに移した(各魚油サンプルに2ボトル)。
3.2.2 酸化的安定性の評価
酸化防止剤を添加した魚油サンプルと酸化防止剤を添加していない魚油サンプルを500mlの茶色い瓶に入れ、10℃の冷蔵庫で保存した。毎日(週5回)冷蔵庫から取り出し、室温(20~24℃)で30分保存した後、一部(15ml)を採取して測定した。酸化安定性は,過酸化物値を6~7週間隔日(週3回),アニシジン値を週1回測定した。
3.2.3 過酸化物値
一次酸化生成物であるハイドロパーオキサイドは、過酸化物値の測定によって決定される。オイルの過酸化値は,AOAC 公定法 965.33(AOAC 1990)に従い,遊離ヨウ素を標準化されたチオ硫酸 ナトリウム溶液で滴定することにより測定する。
3.2.4 アニシジン値
二次酸化産物の生成は、p-アニシジン値で測定した。油のアニシジン値は,標準法(IUPAC 1987)に従って,油中のアルデヒド化合物とp-アニシジンを反応させ,350 nmで吸光度を測定して求めた。
3.2.5 統計解析
統計分析は、Number Cruncher Statistical Software (NCSS 2000 and Pass Trial, Kaysville, Utah)を用いて、分散分析(ANOVA)によりデータを解析した。サンプル間の違いを判断するために、Tukey比較検定を行った(P<0.05)。
4 結果
4.1 国内消費における魚油の過酸化物価の変化
4.1.1 酸化防止剤を含まない魚油の過酸化物価の変化
油の一次酸化は,過酸化物値を測定することで行った。酸化防止剤を使用していない魚油の国内消費時の過酸化値の変化を図1に示す。
図1:国内消費における酸化防止剤なしの魚油の過酸化物値の変化
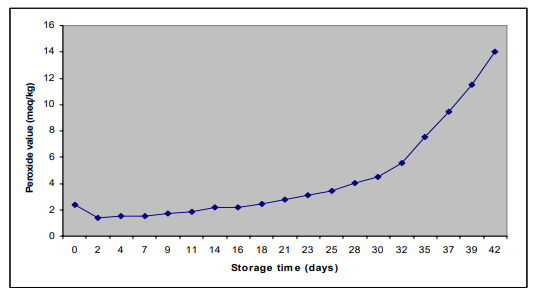
当初、魚油の過酸化物値にはほとんど変化がなかった。すなわち、30日までの保存では、過酸化物値は約2から4.5(meq/kg)まで増加した。しかし,その後は過酸化物値の急激な増加が見られ,実験終了時(保存42日目)には14(meq/kg)まで増加していた。
4.1.2 酸化防止剤を添加した魚油の過酸化物値の変化
異なる濃度のトコフェロールを添加した魚油の国内消費時の過酸化物値の変化を図2に示す。
保存期間(日)
図2:酸化防止剤を添加した魚油の国内消費を模擬した場合の過酸化物値の変化
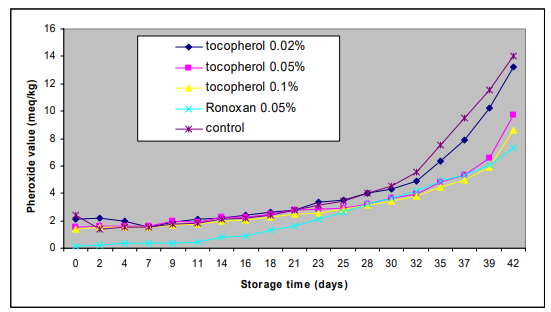
実験開始から3週目まで、トコフェロールを添加したサンプルと添加しないサンプルの過酸化物値には、ほとんど変化がなく、差もなかった。23日目まではサンプル間でわずかな差が見られた。その後,保存期間の増加に伴い,明らかな差が観察された。Ronoxanを添加した場合、実験開始から 23日目まで、過酸化物の値は他のサンプルの値と比較して低く、トコフェロール0.05%とトコフェロール0.1%でも同様の傾向が見られた。実験終了時(保存42日目)の過酸化物の値は,コントロール試料が14meq/kgと最も高く,次いでトコフェロール0.02%(PV=13. meq/kg),トコフェロール0.05%(PV=9.7meq/kg),トコフェロール0.1%(PV=8.6meq/kg),ロノキサン0.05%(PV=7.3meq/kg)の順であった。
トコフェロールを添加したサンプルの統計解析の結果、コントロールとトコフェロール0.02%を添加したサンプルの間、およびトコフェロール0.05%と0.1%のサンプルの間には差がなかった(P>0.05)。対照とトコフェロール0.05%(トコフェロール0.1%)の間では有意差(P<0.05)が認められた。Ronoxanのサンプルの場合,過酸化物値は実験開始時から他の1つのサンプルよりも低い値を示し(P<0.05),保存終了時にはトコフェロール0.05%および0.1%のサンプルとの間に有意な差(P>0.05)を示さなかった。
すべてのサンプルの過酸化物値は,一般的に油が腐敗するために必要と考えられている20meq/kgまで上昇しなかった(Hraš er al 2000)。
4.1.3 PV = 8 までの保存期間
人間が消費する油の品質と許容性のための過酸化物の限界値は、8meq/kg である (Boran er al 2006)。酸化防止剤を添加した魚油と添加しない魚油のPV=8までの保存期間を図3に示す。
図3:酸化防止剤を添加した魚油と添加しない魚油
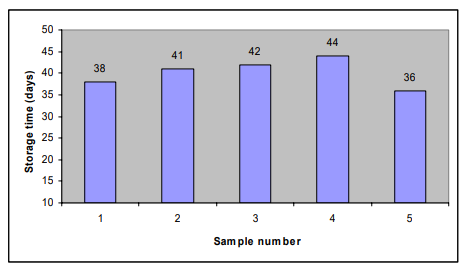
(試料1:トコフェロール0.02%、試料2:トコフェロール0.05%、試料3:トコフェロール0.1%、試料4:Ronaxan 0.05%、試料5:コントロール)のPV=8までの保存時間。
国内消費を模擬したPV=8までの保存期間は、対照試料では36日、トコフェロール濃度の増加に伴い、38日(トコフェロール0.02%)41日(トコフェロール0.05%)42日(トコフェロール0.1%)と増加し、Ronoxan試料では約44日と最も長かった。これは、Ronoxanサンプルが実験終了までにPV=8に到達しなかったため、図2からグラフで推定した。その結果、コントロールとトコフェロール0.02%のサンプル、トコフェロール0.05%,0.1%とRonoxan 0.05%のサンプルの間には、差がなかった(P>0.05)。コントロールとトコフェロール0.05%を添加したサンプル(トコフェロール0.1%とロノキサン0.05%)の間では、有意な差(P<0.05)が認められた。
4.2 国内消費における魚油のアニシジン値の変化
二次酸化生成物の形成をp-アニシジン値で測定した。酸化防止剤を添加した魚油と酸化防止剤を添加しない魚油の家庭内消費を模擬した場合のアニシジン値の変化を図4に示す。
図4:国内消費時の酸化防止剤を使用した魚油と使用しない魚油のアニシジン値の変化
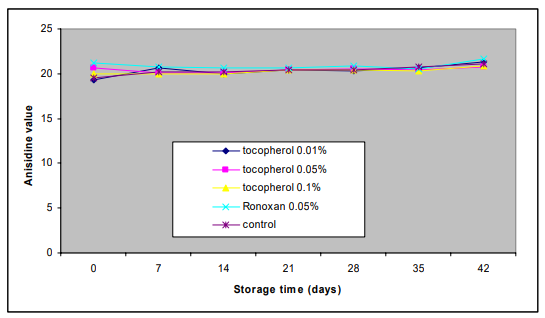
図4に示すように、酸化防止剤を添加した魚油と添加していない魚油のアニシジン値は、実験開始時から終了時までほとんど変化や差がなかった。実験開始時に19.8であったサンプルのアニシジン値は、実験終了時には21(コントロール)21.3(トコフェロール0.02%)20.8(トコフェロール0.05%)20.8(トコフェロール0.1%)21.6(ロノキサン0.05%)とわずかに上昇した。酸化防止剤を添加した魚油と添加しない魚油では、アニシジンの値に有意な差は見られなかった(P>0.05)。
5 考察
5.1 国内消費における魚油の過酸化物増加
多価不飽和脂肪酸を多く含む魚油は,保存条件や脂肪酸組成に強く依存して,様々な速度で酸化劣化しやすい。現在の国内消費を模擬した状態では、最初の30日間は魚油の過酸化物値にほとんど変化が見られず、その時の過酸化物値は約4.5meq/kgであった。その後、過酸化物値の急激な変化が見られ、実験42日目には14meq/kgまで上昇した。食用油の許容限界である過酸化物値8meq/kgには36日で到達した。
同様の結果は、(Boran et al 2006)の研究でも見られた。彼らの報告によると,4℃で保存した場合,いくつかの魚油の過酸化物値は,60日または90日後に許容限界である8meq/kgに達し,-18℃では少なくとも150日後に達した。この事実は,保存温度が魚油の保存安定性に重要な影響を与えることを示していた。Boranの研究と比較して、我々の実験で観察された許容限界までの保存期間の短さは、保存温度の影響に加えて、毎日ボトルからオイルを取り出し、ボトルに新鮮な酸素を導入していることで説明できる。もう一つの理由は,使用した魚油のヨウ素価の違いにある。私たちの実験で使用した魚油のヨウ素価は202で、Boranの研究で使用した魚油のヨウ素価(177〜197)よりも高かった。不飽和度が高いほど油の自己酸化率が高くなることはよく知られている事実である(Stansby 1967)。
この結果から、酸化防止剤を含まないこの魚油を安全に摂取するためには、国内で消費される保存条件では、最大36日間の保存期間が示唆された。
5.2 魚油の国内消費における酸化防止剤による過酸化物生成の抑制
トコフェロールの抗酸化作用は多くの研究で示されており、一般的な天然抗酸化物質として知られている。また、パルミチン酸アスコルビルとレシチンは相乗効果があることが知られている。私たちの実験でも、トコフェロールとロノキサンの抗酸化作用は明らかであった(図2)。コントロールとトコフェロール0.02%を添加したサンプル、トコフェロール0.05%,0.1%とRonoxanを添加したサンプルの間には差がなかった(P>0.05)。コントロールとトコフェロール0.05%を添加したサンプル(トコフェロール0.1%、ロノキサン0.05%)との間には有意な差(P<0.05)が認められた。0.02%のトコフェロールの添加は、実際には魚油の自動酸化の遅延には意味がなく、トコフェロールの抗酸化作用は,0.05%よりも高い濃度では増加しなかった。Frankelの報告(1996)でも、トコフェロールの抗酸化作用は400〜600μg/gの濃度で最適になるという同様の現象が見られた。その結果,トコフェロールのみを添加した場合,国内での模擬消費時の魚油の安定性を向上させるためには,0.05%のトコフェロールが最適であることがわかった。この場合,41日で食用の過酸化物値の許容限界に達し,酸化防止剤を添加していない魚油と比較して,魚油の酸化安定性が約14%向上したことになる。Ronoxanを添加した魚油は、他のサンプルとの違いが見られ、実験開始時から過酸化物の値が低いことが明らかになった。Ronoxanにはレシチンが含まれており、レシチンのようなリン脂質はヒドロペルオキシドを分解することができることが知られている(Vicetti er al 2005)。しかし、十分に明確なデータが文献には見当たらず、さらなる調査が必要であることが示唆された。本研究では、PV = 8 meq/kgまでの最長保存期間は、Ronoxan 0.05%を添加したサンプルで44日であった。この結果は、魚油の酸化安定性が22%向上したことを意味し、トコフェロールと組み合わせたレシチンとパルミチン酸アスコルビルの重要な働きを示唆している。
酸化安定性をさらに向上させるためには、レシチンやパルミチン酸アスコルビルなどの相乗剤をトコフェロールと併用することが考えられるが、トコフェロールの添加濃度は高くしないことが望ましい。また、魚油の酸化安定性については、短時間で消費するために500mlよりも小さいボトル、例えば250mlや300mlのボトルを使用することも考慮される。
5.3 国内消費における魚油の二次酸化
二次酸化生成物の形成は,アニシジン値の上昇で表された。実験の最初から最後までほとんど変化は見られず、酸化防止剤を添加した魚油と添加しない魚油のアニシジン値の差は有意ではなかった(P>0.05)(図4)。初期のアニシジン値19.8は、ベニバナ油(アニシジン値1.1)菜種(アニシジン値3.5)オリーブ油(アニシジン値5.1)などの他の油と比較して、かなり高い値であった(Guillén and Cabo 2002)。しかし、初期のサンプルでアニシジン値が高いのは、オイルの酸化が進んでいるのではなく、魚油の特性である可能性がある。新油のアニシジン値が高いことは、ヒマワリのアニシジン値が18.8,魚油のアニシジン値が19.8であることが報告されている(Suja er al 2004, United States Patent 6623774)。また、油源によって初期値が異なるため、アニシジン値は各油種内でのみ比較可能であると指摘する著者もいる(Guillén and Cabo 2002)。
本研究の実験結果では、魚油の二次酸化はほとんど見られず、国内での消費を模擬した場合のアニシジン値の変化に対する抗酸化物質の有意な影響も見られなかった。
6 おわりに
魚油を国内で消費する条件下では、最初の30日間は酸化防止剤を含まない魚油の過酸化物値にほとんど変化が見られず、酸化防止剤を含まない魚油を安全に消費するためには、最大で36日間の保存期間が提案される。
魚油にはトコフェロールとRonoxanの抗酸化作用が認められた。トコフェロールの抗酸化作用は、トコフェロールの濃度が0.05%以上では増加せず,0.01%のトコフェロールの添加では、自動酸化を抑制する意義はなかった。トコフェロールを0.05%添加したケースでは,41日で食用として許容される過酸化物値に達し,酸化防止剤を添加していない魚油と比較して,酸化安定性が約14%向上したことになる。PV = 8 meq/kgまでの最長の保存期間は、Ronoxan 0.05%を添加したサンプルで44日となった。これは、魚油の酸化安定性が約22%向上したことを意味し、レシチンとパルミチン酸アスコルビルの重要な働きを示唆している。
魚油の二次酸化はほとんど見られず,保存期間中のアニシジン値の変化に対するトコフェロールの有意な影響も見られなかった。
酸化安定性をさらに向上させるためには,トコフェロールの濃度を上げるのではなく,レシチン,クエン酸,アスコルビン酸などの相乗剤を併用することが考えられる。また、魚油の酸化安定性に関しては、短時間で消費するために500mlよりも小さいボトル、例えば250mlや300mlのボトルを使用することも考えられる。
