Contents
Small dense low-density lipoprotein-lowering agents
pubmed.ncbi.nlm.nih.gov/32427116/
2020年9月1日オンライン公開
概要
肥満、糖尿病、高脂血症などの代謝性疾患、および動脈硬化を中心とする心血管疾患(心血管疾患)は、現在も世界的に主要な死因となっている。低密度リポタンパク質(LDL)の血漿中濃度は、これらの疾患、特にアテローム性動脈硬化症の重要な危険因子として考えられている。LDLは不均一な性質を持っているため、そのサブクラス、特にsmall dense LDL (sdLDL)については、すでに多くの研究が行われている。その結果、sdLDLはLDLに代わる理想的な指標であり、心血管疾患のモニタリングや動脈硬化の早期診断に有効であると考えられている。近年、いくつかの研究者がsdLDL値を低下させ、健康の質を向上させることができる要因に注目している。そこで、本研究の目的は、sdLDL粒子の製造過程を説明し、sdLDL血漿レベルに対する医薬品、食事療法、および生活習慣の影響について検討することである。また、その作用機序についても簡単に述べる。
コレステロールやLDLを低下させる化合物は、sdLDLレベルの低下にも有効であることは明らかである。また、脂質プロファイルの改善、特にトリグリセリド値の低下、適切な治療法、生活習慣などがsdLDL値を低下させる。このように、sdLDL濃度を下げるためには、前述のすべてのパラメータを同時に考慮する必要がある。
キーワード:アテローム性動脈硬化症、心血管疾患、コレステロール、低比重リポ蛋白、トリグリセリド。
はじめに
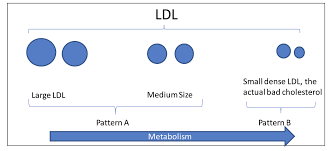
低密度リポタンパク質(LDL)は、よく知られたコレステロールを多く含むリポタンパク質であり、現在、心血管疾患(心血管疾患)や代謝異常の主要な危険因子(バイオマーカー)として広く考えられている(Ference et al 2017;Grundy 2002)。そのため、現在、心血管疾患や代謝性疾患の治療やコントロールのために、スタチンなどの様々なLDL低下剤が処方されている(Ference er al 2017)。LDL粒子は不均一であり、血漿中のフェノタイプに基づいてパターンA(large buoyant LDL[lbLDL])とパターンB(small dense LDL[sdLDL])の2つのパタンに分類される。sdLDL粒子は、(lbLDLと比較して)コレステロールが減少しており、肝臓や血液循環における酵素反応によって生成される。この粒子は、特にメタボリックシンドローム(MetS)や2型糖尿病などの代謝異常がある場合、心血管疾患に関与していると言われている(Toth 2014)。SDLDLの特徴として、動脈壁への侵入が容易であること、LDL受容体(LDLR)との親和性が低いこと、酸化されやすいこと、メタボリックシンドロームの人に多いことなどが挙げられる(Ai et al 2010,Anber et al 1996年、Nordestgaard and Zilversmit 1989)。SdLDLレベルは、いくつかの心血管疾患、特にアテローム性動脈硬化症の主要な原因であり、早期診断のための貴重なバイオマーカーであることが示唆されている(Ai er al 2010; Ivanova er al 2017)。また、LDL粒子レベルが心血管疾患リスクの重要な指標であることも指摘されている。したがって、心血管疾患の病態生理におけるsdLDLの重要な役割を考慮すると、sdLDLの濃度が上昇するとその有害な作用が高まることになる(Allaire er al 2017)。機能的バイオマーカーとしてのsdLDL濃度の測定は、まだ研究室では日常的に行われていないが、血漿中のsdLDL濃度を低下させることは、動脈硬化の進行を抑制するのに有用であるというエビデンスがある(Rizzo er al 2009)。したがって、動脈硬化の進展にsdLDLが大きく関与していることを考慮すると、その血漿レベルを低下させることができる因子や薬剤に重点を置くべきである。このような観点から、ここ数年、研究者たちは数多くのsdLDLを低下させる化合物や因子を探索してきた。この総説では、特に動脈硬化などの疾患に関連して行われたsdLDL低下剤に関する研究を明らかにすることを目的としている。さらに、これらの薬剤の主な作用機序についても考察した(図1)。
LDL粒子の不均一性
LDL粒子は、脱シアル化、酸化、糖化など、血流中で起こる様々な修飾により、化学組成が非常に多様である(Toth 2014; Younis er al 2009)。このような変化は、血中のLDLの半減期を長くすることで、動脈硬化の発症につながる(Anber er al)。1996)。例えば、酸化的な修飾が動脈硬化発症の原因となり、抗酸化酵素が動脈硬化病変を改善するとも言える(Khosravi er al 2019)。LDLは、アポリポタンパク質E(apo-E)アポB100,コレステロール、TGを含む粒子で、血流中で超低密度リポタンパク質(VLDL)から変換される。TGが低い状態では、肝臓でVLDL2(TG-poor)が作られ、リポタンパク質リパーゼ(LPL)阻害剤であるアポCIIIが少なく、TGリッチリポタンパク質(TRL)除去促進剤であるアポEが多く含まれているため(肝臓での粒子取り込みによる)血液中から速やかに除去される。逆に、TGが高い状態では、肝臓でVLDL1(TGリッチ)が産生され、アポ-CIIIが多く、アポ-Eが少ないため、血中に長く留まり、他のLDL、特にsdLDLに変換される。したがって、TGのレベルは、sdLDLの生成過程とLDLの代謝において重要な意味を持つ。血管内でのVLDLの低分子化には、コレステリルエステル転送タンパク(CETP)LPL、肝リパーゼ(HL)など、いくつかのタンパク質や酵素が関与している。CETPは、LDLやVLDLに含まれるTGやコレステロールを転移することでsdLDLの産生を増加させる。そのため、CETPの活性レベルもsdLDLの産生に不可欠である(Krauss er al)。) さらに、ソーターリン、CETP、LPL、アポA1の変異や一塩基多型など、遺伝的要因もsdLDLの産生に影響を与えている(Hoogeveen er al 2014; Musunuru er al 2010)。最近まで、sdLDLは研究で実験的に測定されておらず、設計された計算式によってのみ算出されていた(Takagi er al 2014)。しかし今日では、塩基密度超遠心法、ヨードキサノール勾配超遠心法、勾配ゲル電気泳動法、イオンモビリティー、核磁気共鳴(NMR)ホモジニアスアッセイなど、sdLDLレベルを測定できるLDLのサブクラスを測定するいくつかの正確な方法がある(Ivanova et al 2017)。
アテローム性動脈硬化症とsdLDL
動脈硬化は現代社会において最も一般的な疾患の一つであり、血漿コレステロール値はその代表的な危険因子の一つである(総コレステロール(TC)/高密度リポタンパク質(HDL)-コレステロールまたは非HDL-コレステロールと置き換えられている)(Dobiasova and Frohlich 2001)。LDLは血流中で主にコレステロールの移動を担い、動脈硬化の主要な予測因子となっている。コレステロールは脂質滴として、アテロームプラークの泡沫細胞の形成に関与していると考えられている(Khosravi er al 2018)。そのため、LDL値はアテローム性動脈硬化症発症の最も重要な危険因子の1つであるが、LDLが正常な被験者にアテローム性動脈硬化症があることを示す証拠がある(Baigent er al 2010)。LDL粒子の不均一性のため、その集団、特にsdLDLがアテローム性動脈硬化症のリスクを高めることが想定される(Hoogeveen er al 2014)。近年、アテローム性動脈硬化症やその他の心血管疾患の発症におけるsdLDLの主要な役割が研究されている(Carmena er al 2004)。sdLDLレベルの増加は、心血管疾患、冠状動脈性心疾患(CHD)および虚血性心疾患のリスク増加と有意な相関関係があるというエビデンスがある(Arai et al 2013;Ivanova et al 2017;Lamarche et al 1997)。sdLDLレベルは、動脈壁への容易な伝染性、LDLRへの低い結合親和性、高い酸化感受性、長期の血漿半減期、およびプロテオグリカンを付着させることによる血管壁への高い保持力など、sdLDLのいくつかの特徴により、LDLよりも心血管疾患の優れたバイオマーカーであると主張されている(Ai et al 2010;Anber et al 1996;Dejager et al 1993;Hurt-Camejo et al 1990)。sdLDLは、その酸化されやすさから、動脈硬化の初期段階の一つである動脈壁での炎症性プロプロセスの開始につながると主張できる。一方、脂質異常症、2型糖尿病、MetS、肥満などのいくつかの疾患において、sdLDLレベルが上昇すると、動脈硬化やその他の心血管疾患のリスクが高まることが多くの研究で示されている(Fukushima er al 2011; Hirano er al 2004; Toledo er al 2006)。このような証拠から、現在、全米コレステロール教育プログラム(NCEPIII)では、sdLDLレベルが心血管疾患の強力な危険因子として考慮されている(Grundy 2002)。
SdLDL値低下剤 医薬品
LDL低下薬
スタチン類
スタチンは、HMG-CoA(3-ヒドロキシ-3-メチルグルタリルコエンザイムA)還元酵素阻害剤の一種であり、高コレステロール血症の被験者の血漿コレステロール値を低下させるために広く使用されている(Raper er al 2012)。スタチンは、TC、アポB100(Adams et al 2018)LDL、および中間LDL(IDL)レベルを定常的に低下させるが、血漿TGまたはHDLレベルには有意な効果が認められないことが明らかにされている(Marz et al 2001)。多くの研究に基づき、2型糖尿病、MetS(Bahadir et al 2009年)高脂血症(Guerin et al 2000年)家族性高コレステロール血症、閉経後の被験者にスタチンを投与すると、sdLDLレベルの有意な低下につながると結論づけることができる(表1)(Marz et al 2001)。しかし、いくつかの研究の結果には矛盾がある。このような矛盾は、疾患の種類、スタチンの種類、スタチンの投与量、ベースラインの血漿TG値、LDLRの変異やアポE多型を含むいくつかの遺伝的要因など、様々な要因に起因する。疾患の種類は、スタチンの効果に大きく影響する。ある研究では、高コレステロール血症の被験者にアトルバスタチンを投与すると、sdLDLレベルが上昇することが報告されている(O’Keefe Jr. et al 2004)。また、脂質異常症の被験者にプラバスタチンとフルバスタチンを投与しても、sdLDLレベルの上昇は見られないと報告されている(Backes and Gibson 2005)。また、別の研究では、高コレステロール血症の被験者にシンバスタチンを投与してもLDL粒子の大きさには影響しないが、糖尿病患者やMetSではLDLレベルが上昇すると言われている(van Tits er al 2004)。さらに、2型糖尿病患者に20mg/日のシムバスタチンを投与すると、sdLDLレベルを低下させることができた(Winkler er al 2012)。スタチンの投与量を増やすとsdLDLレベルが大幅に低下する可能性があるため、スタチンの効果は用量依存性であると思われる(Nishikido er al 2016)。スタチンのsdLDL低下作用以外のメカニズムとして、いくつかのシナリオが考えられている。最も重要なものは、LDL粒子のサイズが大きくなることである(それはsdLDLレベルを下げることを意味する)。LDLの直径は、血中TGのベースラインと密接に関係している。どうやら、TGが肝臓からVLDL1として血中に放出され、血漿中のsdLDLレベルの増加を招いているようだ(Stampfer er al)。 1996)。この点、CETP、LPL、HLはLDL粒子の大きさを決定する役割を果たしており、その結果、sdLDLの形成(sdLDLレベルの上昇)につながっている。スタチンは、CETPのレベルを低下させ、LPLの活性を増加させることにより、sdLDLレベルを低下させると推測されている(Schneider er al 2004)。
さらに、スタチンはLDLサイズを増加させる(lbLDLレベルの増加)だけでなく、コレステロールの細胞内合成を阻害し、LDLRの活性をアップレギュレートし、アポB100を減少させる(したがって、VLDLレベルを減少させる)ことにより、血漿中の総LDLレベルを減少させることができる。その結果、スタチンは、TGのレベルに直接影響を与えることなく、間接的にその代謝を調節することができる(Lamon-Fava er al 2007)。最後に、sdLDL濃度を有意に低下させるために、スタチンを効果的な組み合わせとして処方することができるが、いくつかの必要な点を考慮する必要がある。まず、スタチンの効果は用量に依存しており、最大量を使用する必要がある。さらに、臨床試験によれば、ロスバスタチンとピタバスタチンは、アトルバスタチンよりもsdLDLレベルの低下に適している(Bahadir er al)。) 最後に、スタチン系薬剤は、コレステロール低下薬(エゼチミブなど)や、フィブラートやエイコサペンタノイック酸(EPA)などのTG低下薬との併用が不可欠である(Florentin er al)。)
エゼチミブ
コレステロールを低下させる新しい化合物が登場しており、スタチンに取って代わる、あるいはスタチンと併用することができる。エゼチミブは、小腸でのコレステロールの吸収を低下させ、血漿LDLを減少させる化合物の一つである(Yunoki er al)。) 治療ガイドでは、この化合物はスタチンに反応しない人のセカンドラインとして、あるいはスタチンとの併用で処方されることになっている(Langreth er al 2016)。エゼチミブがsdLDLレベルを上昇させ、スタチンのsdLDL低下作用を阻害すると報告した研究があるが、大半の研究では、エゼチミブがすべてのLDLサブクラス、特にsdLDLレベルを有意に低下させることが強調されている(Berneis et al 2010,Florentin et al 2010,Nakou et al 2008,Roeters van Lennep et al 2008)。エゼチミブは低用量のスタチンと併用することが推奨されており、高用量のスタチンを避けることができる(Roeters van Lennep et al 2008,Sakamoto et al 2015,Sakamoto et al 2017)。エゼチミブは、脂質異常症(Tribble et al 2008)および高コレステロール血症(表2)を有する被験者のLDL-コレステロール値の総量を減らすことしかできないと言われている(Ose et al 2007)。
フィブラート類
薬理学上、フィブラートは、フェノフィブラート、ベザフィブラート、ゲムフィブロジル、ペマフィブラートなどの両親媒性カルボン酸の一種である。現在、高コレステロール血症や高トリグリセリド血症の治療薬として広く処方されている。研究によると、フェノフィブラートは、TG濃度が高く、HDL濃度が低い被験者において、TG濃度とHDL濃度を顕著に逆転させることにより、心血管疾患のリスクを著しく低減することが示されている(ベザフィブラート2000,スタイナー1996)。また、細胞内受容体であるペルオキシソーム増殖因子活性化受容体α(PPARα)を強力に選択的に調節するペマフィブラートは、血清中のTG濃度を有意に低下させ、HDLコレステロール濃度を上昇させることが明らかになっている。したがって、sdLDL粒子のレベルを低下させる効果があると考えられるが、sdLDLレベルに対するペマフィブラートの効果についてはさらなる研究が必要である(Reiner 2017; Yamashita er al)。)
フィブラートのsdLDL低下作用のメカニズムとしては、(sdLDLレベルの最も重要な決定因子である)TGを有意に減少させることによるlbLDLレベルの増加(Yoshino et al 2002)LDL密度の減少、CETPの減少によるsdLDLレベルの減少、LPLの活性増加などが考えられている。フィブラート(ペマフィブラートなど)は、PPARαの活性化により、TGのメタボリズムに関与する遺伝子の発現を誘導することが示されている(Fruchart et al 1999; Patti et al 2019)。このように、TGのベースラインレベルは、スタチン系薬剤がsdLDLレベルを低下させる活性において、必須の変数の一つである。また、スタチンとフィブラートの併用により、TG値とsdLDL値が大幅に低下し、HDL値も上昇することが報告されている(Steiner 2007)。したがって、上記の組み合わせは、sdLDLレベルの低下と動脈硬化のリスクの低減につながる可能性があると推奨されている。
グルコース低下剤
今日、2型糖尿病は人間社会で最も普及している疾患の一つであり、その主な原因はインスリン抵抗性(IR)である(Akash er al 2018)。2型糖尿病の被験者における死亡率および罹患率の主要な原因の1つは、脂質異常症である。これらの患者では、心血管疾患のリスクが健常者の約3倍になる(Hsueh and Law 1998)。いくつかの研究では、TG、LDL、sdLDL濃度の増加、HDLおよびアポA1の減少がIRに直接関係することが示されている。このような観点から、これらの患者のsdLDL濃度は健常者の2倍であることがわかっている(Feingold er al)。1992)。インスリン療法は、TG濃度を低下させることによりsdLDL濃度を低下させることがわかっている(Hayashi er al)。) 2型糖尿病患者では、VLDL1の産生量は増加するが、インスリン治療によって減少することが観察されている(Packard 2003)。また、インスリン治療によりアポCIIIの濃度が低下することから、インスリン治療はアポCIIIの産生を抑制することでTGの加水分解を促進する(その結果、LPL活性が上昇する)と考えられている(Altomonteら 2004; McConathyら 1992)。
インスリン療法に加えて、メトホルミン、ナトリウム-グルコース共輸送体2(SGLT2)阻害剤、グルカゴン様ペプチド-1受容体アゴニスト(GLP-1RA)ジペプチジルペプチダーゼ-4(DPP-4)阻害剤、グリタゾンなどのグルコース低下薬が、糖尿病患者の治療と心血管疾患リスクの低減のためにインスリン感受性(IS)を高めることが示唆されている。これらの化合物は、IRを低下させることにより、インスリン活性を改善し、さらにTGおよびsdLDLレベルを低下させる(Dormandy et al 2005;Ghazzi et al 1997;
er al 2005)。したがって、治療の第一段階では、糖尿病患者に糖低下薬を使用してISを改善し、動脈硬化のリスクを軽減することが提案されている。そして、病状が進行した段階では、これらの患者に最適な薬はインスリン療法であるとしている(Scheen 2015)。
メトホルミン
メトホルミンは、グルコースの腸内利用をエスカレートさせ、ポストレセプターレベルでISを改善し、インスリンを介するグルコース処分を刺激することで、基本的に血糖値を下げることができる(Kocer er al 2014)。Goldbergらは、耐糖能異常を有する被験者にメトホルミン(850mg/日)を投与し、低脂肪食による7%の体重減少と週150分以上の運動量増加による集中的な生活習慣の改善(ILS)を行って糖尿病を進行させた臨床試験を行い、ILSとメトホルミン投与は、1年後の中間期にIR、BMI、アディポネクチンの介入による変化を主とするリポプロテインサブクラスに望ましい結果をもたらすことを示した。ILSでは、VLDL、sdLDL、HDLが減少し、HDLが増加したが、メトホルミンでは、sdLDLが減少し、HDLが増加した。糖尿病の進行を遅らせる介入は、アテローム性動脈硬化症の発症を遅らせる可能性もある(Goldberg et al 2013)。Kocerらは、多嚢胞性卵巣症候群(PCOS)の女性の心血管疾患リスクに関する研究において、メトホルミン(850mg、1日2回、6カ月間)は、TG(LPL酵素の活性増加を介して)とアンドロゲンレベルを顕著に低下させることでsdLDLレベルを有意に低下させて脂質異常症を改善するとともに、酸化ストレスを軽減し、IRと内皮障害を改善することを示した。したがって、PCOSにおける心血管疾患のリスクを低減することができる(Kocer et al 2014)。
ナトリウム-グルコース・コトランスポーター2(SGLT2)阻害剤
膜タンパク質であるナトリウム-グルコース共輸送体は、細胞内でナトリウムとグルコースの結合輸送を媒介する。SGLT2阻害剤(ダパグリフロジン、カナグリフロジン、エンパグリフロジン、テルツグリフロジン、イプラグリフロジン)は、腎臓でのグルコース再吸収を抑制することにより、2型糖尿病患者の高血糖を改善する新世代の血糖降下剤として欧米で承認されている。2型糖尿病患者におけるダパグリフロジンの効果を評価したところ、CETPを介した脂質の異種交換を減少させ、TG濃度を低下させることでHDL-2を増加させ、sdLDLを緩和し、LPL活性を増加させることでISを増加させ、体重減少とβ細胞機能の改善が認められた(Filippas-Ntekouan er al 2018; Hayashi er al 2017; Kur-iyama 2019)。イプラグリフロジン50mgを12週間毎日摂取した2型糖尿病患者の評価では、この薬剤は血清sdLDLレベルを低下させることで脂質異常症も改善することが示された。そのメカニズムとしては、血漿中のグルコースと遊離脂肪酸(FFA)の基質としての消費量を増やすことで、肝のTGとTGリッチなVLDLの産生を抑えることも考えられる(Bando er al)。) カナグリフロジン錠100mgを1日1回朝食後に3カ月間服用しても、血清sdLDL濃度は有意に低下しなかった(Kamijo er al 2019)。
グルカゴン様ペプチド-1受容体アゴニスト(GLP-1RA)
近年、GLP-1RAやジペプチジルペプチダーゼ4(DPP-4)阻害剤と呼ばれる新しいクラスの治療薬が開発されている。GLP-1RAは、グルコース依存性のインスリン分泌を刺激し、グルカゴン産生を抑制し、肝グルコース産生を緩和することで、血糖コントロールを改善し、体重減少を促進する(Sposito er al 2018)。また、小腸でのTGの吸収、肝臓でのリポ生成を減少させ、肝VLDL産生を阻害し、肝性脂肪症を改善することで、2型糖尿病を有する被験者の脂質異常症を改善する(Hasegawa er al 2018)。2型糖尿病患者にエクセナチド(2mg週1回または10μg bid)を30週間投与したところ、その週1回の投与でLDL粒子の分布パターンがsdLDLからlbLDLへと変化した。エキセナチドの週1回の摂取で血清TGが減少したことにより、CETPによるコレステロールエステルとTGの移動も減少し、それに伴いHL活性も低下したため、LDL粒子はアテローム性の低いlbLDLの形で残ったという。本研究では、脂質異常症を改善したエキセナチドの摂取が心血管疾患のリスクを再上昇させることも報告されている(Chiquette er al 2012)。また、NMR画像を用いた解析では、2型糖尿病患者において、メトホルミンとスルホニルウレアの服用歴がある場合、二相性インスリン・アスパルトと比較して、エキセナチドを52週間投与したところ、sdLDLからlbLDLへの変化が認められた(Nauck et al 2007)。しかし、他の知見とは異なり、exenatideを1年間投与しても血漿中のsdLDL濃度は変化しなかった(Matikainen and Taskinen 2013)。脂質異常症の改善、特にLDLパターンをsdLDLからlbLDLに変更、体重減少の増加、空腹時血糖値の低下により糖尿病予備力となった過体重・肥満の被験者を対象に、リラグルチド(0.6mgから開始して1日1回1.8mgになるまで皮下注射)とカロリー制限(1日500kcal減)を14週間併用したところ、心血管疾患のリスクが減少した(Ariel er al 2014)。リラグルチドを1日1回,0.6mgから1.8mgまで皮下注射した結果、リラグルチドを単独または複数の患者に投与することで、心血管疾患リスクを低減することができた。 8mgを1日1回)単独またはメトホルミン(500mg~1gを1日2回)と併用して26週間投与した結果、長島はリラグルチド単独ではLDLサブクラスを変化させることはできなかったが、脂質異常症の改善によるメトホルミンとの併用療法では、アテローム性sdLDL粒子を有意に減少させる(分布がパターンBからパターンAに変化)だけでなく、動脈硬化のリスクも低減することがわかった。だけでなく、これらの個体におけるアテローム性動脈硬化症のリスクを低減することができる(Anholm er al 2019). 最後に言えることは、GLP-1RA単独または他の血糖降下薬との併用により、脂質異常症を改善し、特にsdLDLを有意に減少させることで、2型糖尿病患者の心血管疾患リスクを改善できることを示した研究は少ないということである。
ジペプチジルペプチダーゼ-4(DPP-4)阻害剤。DPP-4阻害剤(グリプチン)は、生理学的に最も豊富な高機能インクレチンであるGLP-1の効率を高め、その不活性化を防ぐ。その結果、グルコース依存性インスリン分泌を煽り、グルカゴン分泌を抑制し、空腹時および非空腹時の血糖値を低下させ、ヘモグロビンA1c値を改善する(Ahren and Foley 2016; Ueda er al 2018)。新規の強力かつ選択的なDPP-4阻害薬であるビルダグリプチン(50mg×2回/日)を2型糖尿病患者に4週間投与して評価した結果、食後のTRL反応が低下し、その主な理由は腸内でのアポB-48を含むリポタンパク質粒子の形成が減少することであると考えられる。また、赤血球を減少させ、脂肪生成に利用可能なグルコースを減少させるなど、代謝状態を改善することにより、血漿VLDLレベルを低下させることができる。また、ビルダグリプチンの摂取により、アポA5とアポCIIIに変化がないことから、主にアポB-48の代謝を含むリポタンパク質に作用することが確認された。以前にも、アポB-100を含むVLDLを低下させることによるアログリプチンの治療は、肝臓由来のTGリッチリポタンパク質の減少を確認することが示されている(Matikainen er al 2006; Matikainen and Tas-kinen 2013)。2型糖尿病患者を対象としたビルダグリプチン療法の別の研究結果では、食後のレムナント様粒子TGおよびレムナント様粒子コレステロール(RLP-C)を減少させ、続いてsdLDL濃度を低下させることが示されている(Matikainen and Taskinen 2013)。これまでの研究と同様に、2型糖尿病患者にビルダグリプチンを投与(50mg×2回/8週間)すると、DPP-4阻害薬で示唆されているメカニズムにより、TG代謝関連マーカー(TG、レムナント様粒子コレステロール、アポ-B、アポ-CII、アポ-CIII)が減少し、血漿中のsdLDL濃度が有意に低下した(Tani er al)。) また、アナグリプチンは、2型糖尿病患者において、肝臓のステロール調節要素結合蛋白質2を介したTCの合成を減少させ、小腸からのTCの吸収を減少させることにより、sdLDL中のTCを減少させた(Hirai er al 2019)。
グリタゾン
グリタゾンまたはチアゾリジンジオン(TZD)は、ペルオキシソーム増殖剤活性化受容体γ(PPAR-γ)アゴニストであり、糖尿病患者の管理において重要なクラスの薬剤であり、肝臓や骨格筋などの組織におけるIRを特異的に減少させ、その後、グルコースの取り込みを増加させることにより、肝グルコース出力を減少させて血糖値を低下させる。また、脂質代謝にも特異的に作用する(Krische 2000; Olefsky and Saltiel 2000)。TZDは、主に脂肪組織に影響を与え、小型のインスリン感受性脂肪細胞の分化を促進し、大型の炎症促進性およびインスリン抵抗性脂肪細胞の数を減少させることで、ISを改善する。これらの脂肪組織の変化は、血漿中のFFAの減少とアディポネクチンの増加を伴い、これらはいずれもIRの減少につながる。また、アポトーシスの減少など、β細胞の保護にも好影響を与える(Verges 2007)。
トログリタゾン(TOG)は、核内受容体であるPPAR-γを活性化し、糖質代謝に関わる遺伝子の発現を変化させることでIRを低下させ、続いて脂質代謝経路を変化させるとともに、ISを増加させることで脂質プロファイルを改善し、最終的にLPL活性を増加させる。LPL活性が高まると、血清中のTGとVLDLの濃度が低下し、その結果、血清中のsdLDL濃度も低下する(Sunayama er al)。 TOGはその化学構造にビタミンEを有しているので、血清sdLDL濃度の低下と酸化に対する抵抗力の増加は、TOGの抗酸化活性に起因するとされたが(Tack et al 1998)この説はBavirtiらの研究で否定された(Bavirti et al 2003)。
ロシグリタゾン(RSG)は、TZDクラスのPPAR-γアゴニストとして、血糖コントロールを改善し、標的組織のISを増加させることにより、2型糖尿病患者の糖質および脂質の代謝を調節する(Rizzo er al 2010)。また、HL活性を低下させることで、血漿中のsdLDL濃度を低下させる(Freed er al 2002)。また、Yu et al 2006)の研究では、スタチン治療を受けている2型糖尿病患者の血清sdLDLレベルの低下が報告されている。しかし、HIV感染者の脂肪萎縮症患者にRSGを投与すると、sdLDLが有意に増加し、HDLが減少するなど、脂質プロファイルが悪化することが明らかになった。したがって,RSGクラスのTZDは,HIV感染者には慎重に使用する必要がある(Hadigan er al 2007)。したがって、TZD薬(特にRSG)の効果については、HIV感染者が多く参加する研究で広く徹底的に調査することが推奨される。これらの受け入れ可能な結果に基づいて、その正確なメカニズムを知る必要がある。
ピオグリタゾン(POG)は、合成PPAR-γリガンドであり、グルコース低下薬としてTZDのクラスに属する。他のTZDと同様に、POGは末梢および肝のISを改善することで血糖降下作用を発揮する。POGは、他のTZDよりも糖尿病患者の脂質異常の治療に適していると思われる。なぜなら、ほとんどの研究で、POGは脂質プロファイルを改善し、特に糖尿病患者のsdLDLを有意に減少させることが示されているからである。POGは、PPAR-γアゴニストであるだけでなく、PPAR-αと反応する可能性が高い薬剤である。肝臓はPPAR-αアゴニストの重要な標的であり、その実質的な結果は、TGの代謝を合成から酸化へと変化させることである。POGはまた、主にLPLを介した脂肪分解を増加させることにより、血流からのTGのクリアランスを増加させる。TGの代謝はsdLDLと関連しているため、TG濃度の低下に伴いsdLDLの血清レベルも低下する(Berneis er al 2008; Hanefeld 2009; Verges 2007)。
その他の薬剤
ドキサゾシン
ドキサゾシンはキノリン系化合物で、α1遮断薬としての主な機能は高血圧を下げることである(Wolak er al 2014)。しかし、ドキサゾシンは脂質異常症に対しても治療効果を発揮することが明らかになっている(Hirano er al 2001)。ドキサゾシンは、血圧を下げるだけでなく、血漿中のTG、アポCIII、アポBの濃度を下げ、HDLを増加させますが、糖尿病患者および非糖尿病患者の総LDL濃度には有意な影響を与えない(Andersson and Lithell 1996)。
ドキサゾシンは、von Willebrand因子を減少させることにより、血管障害を改善する。一方、ISを増加させ、アポ-CIIIとアポ-Bの活性を低下させることにより、LPLの活性を増加させる。また、LPLアンカーとTRLおよび血管内皮との相互作用を改善することにより、TGの異化を促進し、sdLDLの合成を抑制する。さらに、ドキサゾシンはTGレベルを低下させ、ISを改善することにより、動脈硬化の重大な危険因子であるRLP-Cを減少させる(Hirano er al 2001)。その結果、ドキサゾシンは重要な危険因子、特にsdLDLとRLP-Cを低下させることにより、心血管疾患のリスクを低減させることができる。したがって、MetS、糖尿病、アテローム性動脈硬化症の患者にとって、ドキサゾシンは良い選択肢であると推奨することができる。
シロスタゾール
シロスタゾールは、ホスホジエステラーゼ3を選択的に阻害し、サイクリックアデノシン一リン酸を増加させることにより、血小板凝集抑制剤として知られている。血管の拡張性を高めることで微小循環を改善し、最近ではアスピリンに代わる虚血性脳卒中の再発防止薬としても注目されている(Huang er al)。) また、シロスタゾールは、脂質異常症の状態を改善する(sdLDL、TG、LDLを減少させ、HDLを増加させる)効果がある。つまり、sdLDLを減少させ、内皮前駆細胞(EPC)を増加させることで、脳虚血を有する糖尿病患者の心血管疾患リスクを低減させることができる。EPCは、血管の維持、修復、統合に不可欠な役割を果たしている。EPCの数は、将来の心血管イベントの独立した予測因子であり、血管の機能と心血管疾患のリスクを評価するための天然の代替マーカーである(Ueno er al 2011)。したがって、シロスタゾールは、血小板凝集を抑制するとともに、脂質異常症を改善し、特にsdLDLを減少させることから、アスピリンの理想的な代替薬となり得る。
成長ホルモン(GH)
GH(ソマトトロピン)は一本鎖のポリペプチドで、下垂体前葉の側翼にある成長ホルモン細胞から分泌される(Ranabir and Reetu 2011)。GHが欠乏すると、sdLDL、LDL、リポタンパク質関連ホスホリパーゼA2(Lp-PLA2)が増加し、HDLが減少するため、心血管疾患のリスクが高まることが確認されている。GH欠乏症の子供にGHを1年間投与すると、LDL、sdLDL、Lp-PLA2が有意に減少すると言われている。GHは肝のLDLRを刺激し、LDLとsdLDLの血漿中クリアランスを増加させることが知られている。さらに、HDL2a、2bレベルを上昇させますが、HDL3を減少させる(Krebs er al 2016)。
先端巨大症は、GHの過剰産生によって引き起こされるホルモン障害である(Zahr and Fleseriu 2018)。GHは、インスリン様成長因子1の産生を刺激することで、グルコースと脂肪酸の濃度をインクリメントする。したがって、本疾患では、アテローム性のsdLDLとRLP-Cの血清レベルが上昇することで、心血管疾患の発症率が高まる。SdLDL値は、IR、TRLの産生、TRLの代謝に重要な役割を果たすLPL活性の低下により、通常、疾患中に高くなるが、GHは脂肪組織でその活性を阻害します(Tan er al 2003)。サンドスタチン®LAR®は、ソマトスタチンの機能を模倣したオクタペプチドであり、強力なGH阻害剤として作用し、先端巨大症の治療に処方されている。LPLの活性を高めてTRLの加水分解を促進するとともに、GHによるVLDL分泌促進作用を抑制し、sdLDLの産生を低下させる。TRLの加水分解が進むと、RLP-Cの生成量が増加する。しかし、末梢組織では、LPLによって調節されて増加したRLP-Cが吸収され、LDLRによってRLP-Cの血漿クリアランスが増加するため、ISが改善されて血漿RLP-Cが減少する。さらに、GHの低下によりLPL活性が上昇してTRLの加水分解が促進されると、HDL2および3の合成量が増加し、心血管疾患リスクが低下する(Biermasz et al 2003)。したがって、HDLの産生増加を含む血漿中の脂質プロファイルを改善し、特にアテローム性リポタンパク質、sdLDL、RLP-Cの産生を減少させることにより、アクロメガリック患者にサンドスタチン®LAR®を使用することは、有用な治療方法となる。
オルリスタット
オルリスタットは、TGを脂肪酸とモノグリセリドに変換する酵素である腸内リパーゼを強力に阻害することから、第一級の抗肥満薬として知られている。本薬は、脂質や脂肪酸の肝臓への移行を抑制し、その後、肝臓のLDLRの発現を増加させることで、脂質の代謝を改善する。肥満症のMetS患者にオルリスタットとフェノフィブラートを投与すると、Lp-PLA2とsdLDLの血清レベルが有意に改善することが報告されている。併用療法では、単剤療法と比較して、sdLDLが有意に低下する(おそらく体重減少の増加によるものと考えられる)。MetS患者では、総Lp-PLA2活性の上昇(ただし、HDL-Lp-PLA2活性は低下)により、心血管疾患、特にアテローム性動脈硬化症のリスクが高まる(Filippatos er al)。) Lp-PLA2(platelet-activating factor acetylhydrolaseとも呼ばれる)は、酸化して断片化したリン脂質を分解する酵素で、動脈形成に重要な役割を果たしており(Rizos et al 2005年)その活性は血清sdLDLマーカーとして考えられている。Lp-PLA2の活性は、主にLDLやHDLなどのアポBを含むリポタンパク質と関係している。上記のプロトコルやフェノフィブラート単独でHDL-Lp-PLA2の活性を高めることは、血清TGの低下と逆の関係にある。フェノフィブラートは、LPLを誘導し、アポBを多く含むリポタンパク質からHDLに移行したTGの脂肪分解を促進することにより、HDL-Lp-PLA2の活性を高める。フェノフィブラートの単独投与またはオルリスタットとの併用によるHDL-Lp-PLA2活性の上昇は、両薬剤の抗動脈硬化作用を示す有力な証拠である(Filippatos et al 2007)。さらに、高コレステロール血症の肥満患者にオルリスタットとエゼチミブを共同投与すると、sdLDLが有意に減少する。sdLDLの濃度を低下させる主な理由は、脂肪吸収の低下と体重減少による血清TG値の低下である。また、BMIやHOMA-IR(インスリン抵抗性の恒常性モデル評価)の有意な低下、ISの改善がオルリスタット/エゼチミブで認められた。したがって、オルリスタットとエゼチミブの処方だけでは、血清中のsdLDL濃度は低下するが、併用療法では、コレステロールや脂肪酸の吸収を阻害するとともに、それらのクリアランスを増加させ、その後のsdLDLの産生を減少させることにより、血清中の濃度を低下させることができるといえる(Nakou er al 2008)。したがって、アテローム性動脈硬化症のリスクがある患者には、コンビナトリアル・セラピーが強く推奨される。しかし、その効果を確認するにはさらなる研究が必要である。
ナイアシン
ナイアシン(ビタミンB3)は、主に穀類、豆類、卵、赤身の肉、魚などに含まれる水溶性ビタミンである。ナイアシンは、ニコチンアミドアデニンジヌクレオチド(NAD+)およびニコチンアミドアデニンジヌクレオチドリン酸(NADP+)補酵素の主要な前駆体として、酸化還元反応や細胞の代謝に関与している。多くの研究で、脂質異常症やペラグラ(ナイアシン欠乏症)に対するナイアシンの効果が実証されている。ナイアシンはTC、LDL、TGレベルを低下させ、HDLを増加させる効果が最も高いことが示されている(Momtazi-Borojeni er al 2019; Peechakara and Gupta 2020)。即放性のナイアシンを使用すると、sdLDLを減少させることができる。さらに、徐放性ナイアシンは、LDL、TG、sdLDLを有意に減少させるとともに、HDLとlbLDLを増加させる。したがって、ナイアシンはLDL粒子の分布をpattern-Bからpattern-Aへと有意に変化させる(Backes and Gibson 2005)。ナイアシンは、脂肪組織での脂肪分解の抑制、肝臓でのTG形成の抑制、LPL活性の増加、apo-B100,VLDLおよび欠陥コレステロールの合成の抑制を通じて、脂質プロファイルを改善すると言える。最後に、ナイアシンは、抗炎症作用と抗酸化作用に加え、アディポネクチンを増加させ、sdLDLレベルを低下させることから、動脈硬化症の人に適切なサプリメントとして処方することができると結論づけることができます(Peechakara and Gupta 2020)。
ミオイノシトール
ビタミンB複合体の一員であるミオイノシトールは、食品の天然成分であり、筋肉、肝臓、脳、腎臓で合成される(Chmielewski er al 2013)。ミオイノシトールは、果物、豆類、穀物、ナッツ類に最も多く含まれている(Clements Jr.とDarnell 1980)。ミオイノシトールの摂取効果は、MetSの高脂血症患者で検証されており、治療後にsdLDL濃度の有意な低下が確認されている。ミオイノシトールがsdLDL濃度を低下させるメカニズムはまだ完全には解明されていないが、ミオイノシトールによるプラズマローゲンの増加は、グルコースメタボリズムの改善による脂質異常症の軽減につながる。また、抗酸化作用により脂質や血管が酸化ストレスを受けるのを防ぐ(Maeba er al 2008)。
食餌療法・生活習慣
ニュートラシューティカルズ
アルモリピッドプラス(AP)
食物繊維、プレバイオティクス、プロバイオティクス、多価不飽和脂肪酸、抗酸化物質、その他様々な種類のハーブや自然食品を含む食品は、栄養補助食品に分類される。これらは、肥満、心血管疾患、がん、骨粗しょう症、関節炎、糖尿病などの一般的な慢性疾患の予防と治療に幅広い役割を果たしている(Das er al 2012)。家族性複合高脂血症患者に標準的な食事とAP(MEDA-Rottapharm S.p.A., Monza, Italy)を投与してsdLDLレベルの変化を評価したところ、血清sdLDLレベルが有意に低下した。APは、紅麹抽出物(モナコリンKを3mg含有)ベルベリン(BRB)ポリコサノール、葉酸、コエンザイムQ10,アスタキサンチンを含有する栄養補助食品である。APの脂質低下作用は、構成成分間の相乗効果によるものである。β-シトステロールとカンペステロールを含むRYRは、3T3-L1細胞の転写因子を調節し、グリセロール-3-リン酸デヒドロゲナーゼ活性を低下させることにより、脂肪生成を抑制する。また、HMG-CoA還元酵素の阻害作用もある。BRBは、JNK/c-jun経路やERKシグナルの活性を高め、PCSK9によるリソソームでの分解を抑制することで、肝細胞表層のLDLRの発現量と半減期を増加させる。また、BRBは、アデノシン一リン酸キナーゼを介して脂肪酸合成の鍵となる酵素であるアセチル-CoAカルボキシラーゼを不活性化することにより、脂肪酸酸化の亢進、その合成量の減少、TG合成の抑制をもたらす。ポリコサノールは、血小板の凝集や平滑筋細胞の増殖を阻害することでLDL酸化を抑制するだけでなく、細胞内のHMG-CoA還元酵素の発現を低下させる(Galletti er al 2019; Gentile er al 2015)。MetSおよび左心室肥大症の患者におけるAP(Rottapharm Madaus, Italy)投与による血清sdLDLのかなりの減少は、脂質プロファイル、血管内皮機能障害を改善し、心血管疾患特にアテローム性動脈硬化症を多面的に減少させる栄養補助食品の有効性を裏付けるものである(Galletti er al 2019)。
エイコサペンタエン酸(EPA)とドコサヘキサエン酸(DHA)
EPAとDHAは、脂質プロファイルの改善に有益な化合物として使用されているオメガ3系脂肪酸で、食品、特に魚油から腸で自然に吸収される。また、現在、脂質低下剤として処方される医薬品のサプリメントとして販売されており、1日に1.8g(純度98%以上)の摂取が推奨されている(Lucanicら 2011; Mizuguchiら 1993; Satohら 2007)。このサプリメントは、sdLDLの酸化を抑え、抗酸化作用とおそらく一酸化窒素合成酵素の活性を高めることにより、内皮機能を改善する(Mason er al)。) ある研究では、EPAが単独またはスタチンとの併用でsdLDLのレベルを低下させることがわかった(Lopez-Huertas 2012)。また、別の研究では、スタチンにエゼチミブとEPAを併用することで、sdLDLレベルが有意に低下したと報告されている(Labonté er al 2008)。ある研究によると、DHAは高脂血症の子供のsdLDLレベルの有意な低下をもたらす(Engler er al 2005)。ある研究では、高トリアシルグリセロール血症の患者にn-3 PUFA(EPAおよびDHA、3.0g/d)を投与すると、sdLDL値が低下し、HDL値が上昇することが示されている(Vecka er al 2012)。EPAのsdLDL低下作用は、肝臓のTGの産生を抑制することによるものと考えられるが、DHAはEPAよりもTGを低下させることができることがわかっている(Allaire er al 2016)。また、EPAはCETPの活性を阻害することでsdLDLレベルを低下させる役割を果たしていることが報告されている(Calabresi er al 2004)。DHAによるTG低減のもう一つの方法は、肝臓からのアポCIIIの分泌を低下させることであり、おそらく炭水化物応答要素結合タンパク質やフォークヘッドBOXO転写因子O1を含む転写因子の調節によって行われる(Jump et al 2008)。EPAは、DHAと同様に、血漿中のproprotein convertase subtilisin/kexin type 9 (PCSK9)酵素の濃度を低下させる。PCSK9濃度の低下は、血漿LDL粒子濃度の低下をもたらすと言える(Allaire er al 2018)。したがって、LDLの主な調節因子であり、sdLDLレベルとも正の相関がある。このような背景から、最近ではalirocumabやevolocumabなどのPCSK9阻害剤が使用されており、sdLDL濃度を有意に低下させている(Inoue er al 2017; Patti er al 2019; Zhang er al 2015)。
食事由来の油脂類
食事がsdLDL濃度に及ぼす影響については、最近、多くの議論がなされている。一部の研究者は、食事中の脂肪分を制限することでsdLDL濃度が低下し、その結果、有益な効果を発揮すると強く信じているが、他の研究者は顕著な効果を記録していない。この点に関して、Dreonら(1999)は、LDLサブクラスの表現型がAである男性において、超低脂肪(VLF)食がsdLDLの血清レベルを上昇させることを報告している。一方、Ornishらは、TGレベルが上昇し、HDL濃度が低下するにもかかわらず、VLF食が動脈硬化の発生を抑制することを明らかにした。また、コレステロール低下剤の投与を受けているにもかかわらず、より中程度の脂肪分の食事を摂取している人では、動脈硬化の発症率が増加していることも観察された(Ornish er al)。1998)。Dreonら(1999)の結果は、Kenneyら(1999)が報告した結果とは異なる。Kenneyらは、VLF食によって22人の被験者のうち6人のLDLの状態がパターンBからパターンAに変化したと述べている。この2つの研究が相反する結果となった理由として、KenneyらはVLFダイエットに加えて運動を処方していたことが考えられる。運動はHDLを増加させ、トリアシルグリセロールを減少させるので、sdLDL粒子の優位性を低下させる可能性がある(Kenney et al 1999)。食物繊維が血中脂質を改善することはよく知られているが、高脂肪食品の多くは食物繊維が少ない(Jenkins et al 1993)。主に脂肪や炭水化物の含有量を操作することによる様々な食事療法の血漿中sdLDL濃度への影響についての詳細は、表3に示した。継続的な努力にもかかわらず、脂肪と炭水化物の最適なバランスはまだ確立されておらず、利用可能な証拠は少し議論の余地がある。例えば、RISCK研究では、飽和脂肪酸を一価不飽和脂肪酸または炭水化物で等エネルギー置換すると、ISまたはLDL粒子に好影響を与えるという仮説は支持されず、sdLDL血漿レベルも栄養介入の影響を受けなかった(Jebb er al)。) 脂質プロファイル、特にLDL分画における遺伝子の重要な役割を忘れてはならない。ある研究によると、アポリポタンパク質A5遺伝子の変異は、食事による脂肪摂取量と相互作用して、地中海沿岸の人々の肥満と循環TGを調節している(Sanchez-Moreno er al)。)
今日、CHDは人類の第一の死因であり、主な病因は栄養不足によるLDLおよびsdLDLレベルの上昇である(Malakar er al 2019)。脂質プロファイルを改善し、CHDを予防するためには、毎日の食事でオメガ3脂肪酸(EPAなど)と不飽和脂肪酸油(α-リノレン酸など)を摂取することが必要である(Ajith and Jayakumar 2019)。一方、SFA油(パルミチン酸)は、TC、LDLを増加させ、LDLR値を低下させることで、動脈硬化のリスクを高める。α-リノレン酸(ALA、18:3,n-3)は、LDLのアポBプールを低下させ、LDLRレベル、分画異化率、X肝受容体(コレステロール-7α-水酸化酵素の発現を誘導することで、コレステロールの細胞内濃度を調整する)を増加させることで、脂質プロファイルを改善する(Utarwuthipong er al)。) 様々な研究により、肝臓におけるALAは主にEPA(20:5, n-3)に変換され、DHA(22:6, n-3)への変換はより少ない(5%以下)ことが示されている。PUFA/SFAの比率、トランス脂肪酸の摂取量、摂取したタンパク質の量と種類が変換率に有効である。例えば、リノール酸(18:2, n-6)はALAと競合して-6-デサチュラーゼ制限酵素に結合し、ALAからEPAやDHAへの変換を阻害する。ALA、EPA、DHAなどのオメガ3系脂肪酸は、アポB-100の分泌を抑え、その分解を誘導することで、VLDLの産生を減少させる。続いて、sdLDLの産生も減少する。EPAはCETPの活性を低下させることにより、sdLDLの濃度を低下させる。Kawakami et al 2015)の研究では、亜麻仁油(FO)を摂取した被験者のALAとEPAの濃度はコーン油(CO)よりも有意に高かったが、Apo B- 100とCETPの濃度は有意に低かったことから、上記のようなメカニズムが確認された(Kawakami et al 2015); Pan et al 2004))。高コレステロール血症患者を対象とした研究では、大豆油(SBO)米ぬか油(RBO)米ぬか/パーム油の混合油[RBO/PO(3:1)]で、TCとLDLの血清レベルが有意に低下した。また、SBOとRBO/POの使用はsdLDLの濃度を有意に減少させるが、POの摂取だけでは増加させる。RBOはオレイン酸が豊富な上に酸化されにくく、LDLRを増加させますが、単独ではsdLDL濃度を下げることはできない。sdLDL粒子のリノール酸量を増やし、パルミチン酸を減らしてSBOを使用すると、酸化されやすくなる傾向がある。リノール酸の量を減らし、パルミチン酸とオレイン酸の量を増やしてPOを摂取すると、sdLDL粒子が酸化に対して安定する。RBO/POの混合物(3:1)を摂取すると、リノール酸が少なく、ステアリン酸が多いsdLDL粒子が生成され、ステアリン酸のオレイン酸になる能力が高いため、最終的にSBOよりも高い酸化安定性が得られる。したがって、酸化LDL粒子の形成によるRBO/POの使用と比較して、SBOの使用はアテローム性動脈硬化症のリスクを高める。ある研究では、オリーブ油、ヒマワリ油、菜種油を含む食事では、sdLDLのレベルに有意な差がないことが示された(Pedersen er al 2000; Utarwuthipong er al 2009)。別の研究では、血清sdLDL濃度はFOの摂取によって減少し、特に血清TGが100mg/dl以上の患者では減少した。しかし、COの摂取ではsdLDL濃度に有意な差は見られなかった。さらに、TC、LDL、アポA1,アポB、CETPの濃度は、FOの摂取によりCOに比べて有意に低下した。また、EPAの濃度はCOに比べてFOの方が有意に高かったが、DHAの濃度には有意な差は見られなかった(Kawakami er al 2015)。運動不足や不適切な栄養は、心血管疾患、MetS、脂肪肝、高脂血症など多くの疾患のリスク要因となる。これらの疾患における脂質の異常は、栄養、特に食用油の重要性を示している。油は、動脈硬化性の脂質プロファイルを防ぐだけでなく、それを改善するために選択する必要がある。RBO/POやFOを用いて脂質プロファイルを改善し、特にsdLDLの減少とその酸化耐性の向上を図ることは、脂質異常症の予防につながる。したがって、食用油のSFA、MUFA、PUFAのバランスを保つことは、慎重に検討する必要がある。
植物性ステロール
植物ステロールは、コレステロール低下作用があるため、メタボリックシンドロームの治療に用いられる。ある研究によると、植物ステロールを摂取しても、LDL粒子を大きいものから小さいものへと変化させることはできないが、LDL粒子の数を減少させることができた。
さらに、非エステル化植物ステロールおよびスタノールは、高コレステロール血症患者のLDLサブクラスのサイズおよび組成に有意な影響を及ぼさなかった。推奨量内の植物ステロールと無トランス脂肪酸マーガリンの使用は、アポBレベルとHDLの脂質受容能力を低下させるが、sdLDL濃度には有意な影響を及ぼさなかった。西洋風の食事を摂っているMetS患者において、フィトステロールサプリメント(4g/日)を2ヶ月間摂取したところ、血清の総コレステロール値、LDL値、sdLDL値、TG値、アポB値が有意に低下したことが報告されている。TGとsdLDLの減少は、HDLのレベルが変化していないにもかかわらず、CETPが影響を受けたことを意味する。TG濃度の低下は、VLDLやカイロミクロンからLDLやHDLへのTGの伝達が低下することを意味する。したがって、HLはTGを加水分解してsdLDL粒子を生成することができない(Sialvera er al 2012)。別の研究結果では、高コレステロール血症の子供と青年にハーブステロール(2g/日、6〜12ヶ月)を使用すると、sdLDL濃度は有意に低下したが、HDL濃度は低下しなかった(Garoufi er al 2014)。
地中海式ダイエット
地中海式ダイエットは、オリーブオイル、豆類、未精製の穀物、果物、野菜など、植物由来の材料を使った食事が多いことから、ここで取り上げるべき最も重要な食事の1つである。心血管疾患とその危険因子に対するMediterra-neanスタイルの食事の効果は非常に難しく、議論の余地がある。この食事が心臓病や早期死亡のリスクを下げるという証拠はいくつかある。このような観点から、Dinuらは地中海食の複数の健康アウトカムを系統的に検討し、地中海食が心血管疾患、CHD、心筋梗塞を減少させることを確信を持って報告している。しかし、LDL値については効果が認められなかった(Dinu er al 2018)。
それとは逆に、Reesらが行った最新のシステマティックレビューでは、一次予防と二次予防の両方における心血管疾患危険因子に対する地中海食の効果については、まだ不確実性があると主張している(Reesら 2019)。さらに、LDL密度に対する食事の効果についても、多くの議論がなされている。一部の研究者がsdLDLの減少に対する地中海食の有益な効果を報告しているにもかかわらず、他の研究者は効果がないとしている(Ambring et al 2004,Jones et al 2012,Kolomvotsou et al 2013)。観察された不一致は、主にこれらの研究の期間とサンプルサイズに関連している。
PREDIMED研究(PREvención con DIeta MEDi-terránea)は、地中海食の枠内でオリーブオイルやナッツ類の摂取量増加が心血管疾患に及ぼす影響を評価した重要な研究であり、オリーブオイルではなくナッツ類のみがsdLDL値を低下させると報告している(Zampelas 2013)。(Damasceno et al 2013)が行ったPREDIMED研究の結果によると、ミックスナッツを30g/日補給した地中海食による1年間の介入で、ウエスト周囲長(-5cm)アテローム性の中・小LDL(-10%)および超小LDL(-11%)の濃度が低下した。また、LDL粒子数を4%減少させ、大型LDL濃度を18%増加させ、LDLサイズの平均増加量は0.2nmであった(Damasceno et al 2013)。
以上のことから、MetS患者や高コレステロール血症患者が植物ステロールを日常的に摂取することは、おそらくsdLDL濃度を低下させることで、動脈硬化のリスクを減少させると考えられる。したがって、食生活を健康的なものに変える一方で、植物ステロールは、脂肪プロファイルを改善し、心血管疾患のリスクを低減する実用的な効果を持つ優れた選択肢と考えることができる。
漢方薬
脂質のホメオスタシスを維持するための薬理学的手法はかなり進歩しているが、治療を受けている患者の中には、LDLの目標値に到達せず、心血管疾患リスクが高まるなどの障害に悩まされている方もいらっしゃいる(Alagona and Ahmad 2015)。さらに、合成薬剤、特にスタチン系薬剤には、長期にわたる忍容性や大きな副作用がある。このような背景から、研究者たちは、利用可能な薬理学的化合物を、より安全な天然の薬剤に置き換えることに熱心に取り組んでいる。この点において、植物由来の原料は、安全性、安価性、入手のしやすさから、注目を集めている。最近、Tothらは、中等度の高コレステロール血症の被験者を対象に、ベルガモット(Citrus Bergamia)由来の市販サプリメント(Bergavit®)のLDL減算効果を調べる6カ月間の前向き試験を実施した。フラボノイド150mg(ネオエリオシトリン16%、ネオヘスペリジン47%、ナリンギン37%)を1日1回定量摂取したところ、ベースラインと比較してsdLDL値が有意に低下し、lbLDL値が有意に上昇したことが確認された。彼らは、ベルガモットジュースに含まれるフラボノイド配糖体であるネオリオシトリン、ネオヘスペリジン、ナリンギンの存在が、この効果の可能性に関係しているとし、いくつかの考えられるメカニズムを説明した。まず第一に、フラボノイドはミトコンドリアの酸化を活性化することで脂質消費量を増加させ、同時にVLDLの合成を減少させると考えられる。第二に、フラボノイドはおそらく、プロテインキナーゼCの活性化を介してLDLR遺伝子の転写を増加させ、PPAR-γの活性化を介してこの受容体の膜転位を増加させると考えられる(Toth er al 2015)。さらに最近の短期研究(5日間)では、Tuccinardiらは、10人の肥満の被験者をクロスオーバー無作為化二重盲検プラセボ対照臨床試験に参加させ、クルミ(Juglans regia)が心血管代謝の結果に及ぼす影響を評価した。48gのくるみを含むスムージー、またはナッツ類を含まない多量栄養素を含むプラセボのスムージーを摂取したところ、空腹時のsdLDL粒子が減少し、食後の大型HDL粒子が増加した。また、心代謝リスクへの影響を媒介するとされる有害なセラミド、ヘキソシルセラミド、スフィンゴミエリンがしっかりと減少したことも記録されている(Tucci-nardi er al 2019)。
これらを総合すると、ハーブ素材は、心血管疾患の予防と治療のための優れた選択肢として考えることができる。多種多様な生理活性成分を含んでいるため、素材はsdLDLを減少させ、脂質プロファイルを改善することができる。しかし、残念なことに、sdLDLレベルに対する有益な効果に関する情報は少ないようである。したがって、心血管疾患リスクを減少させる強力な薬剤としてハーブ素材を紹介するためには、十分な参加者と期間を用いた無作為化対照試験をさらに確立する必要がある。
喫煙
タバコには6,000種類以上の化学物質が含まれており、煙草には4,000種類以上の化学物質が含まれている。これらの化合物の多くはアテローム性作用を持ち、心血管疾患のリスクを増大させる。タバコはLDL粒子を酸化させるが、sdLDLはlbLDLに比べてより速く、より簡単に酸化される。残念ながら、酸化したLDL粒子は肝のLDLRによって吸収されない。そのため、泡沫細胞の形成とともに、動脈硬化のリスクを高めることになる。LPLによるTGリッチなVLDL1粒子の脂肪分解によるsdLDLの産生に加えて、sdLDLを産生するもう一つのメカニズムがある。前述のメカニズムでは、HLが増加すると徐々にIDLの脂肪分解が起こり、sdLDLが産生される。タバコを吸うと、TNFγなどの炎症性サイトカインの産生が増加する。炎症に反応して、LIGHT(リンパトキシンは誘導性発現を抑制し、単純ヘルペスウイルスの糖タンパク質DとT細胞に発現する受容体HVEMを競合させる)やリンパトキシン因子が免疫細胞で産生される。また、喫煙によってLIGHTが過剰に発現し、リンパトキシンβ受容体に結合した後、HLのmRNAを著しく減少させてその活性を阻害する。したがって、LIGHTは肝細胞におけるHLの発現を抑制することで、sdLDLの産生を抑えることができる。そのほか、吉田らの研究では、喫煙者と非喫煙者の血中脂質濃度に差はないが、喫煙者ではsdLDLの濃度が有意に低いことが示されている(Lo er al 2007; Urahama er al 2008)。しかし、血清sdLDL濃度の低下に対する喫煙の直接的な有益性を報告した研究はすでに1件のみである。sdLDL低下作用の原因となるタバコの化学物質を明らかにするには、さらなる研究が必要である。今のところ、一般的に喫煙は動脈硬化のリスクを高めるものの、血清sdLDLレベルの有意な低下をもたらすとしか言えない。
ビリルビン
ビリルビンは、ヘム異化作用の主な副産物であり、肝機能指標の一つとして、神経障害を引き起こす可能性がある。溶血、赤血球生成異常、胆道閉塞による胆汁分泌の低下、肝内胆汁うっ滞などにより、ビリルビンの血清濃度が上昇する。また、UDP-グルクロノシルトランスフェラーゼやビリベルジンリダクターゼなどの内因性因子や、絶食などの外因性因子が血清ビリルビン濃度に影響を与えることを示す証拠もある。今回の結果は、血清ビリルビンの増加が、糖尿病、MetS、心血管疾患と逆相関することを示している。ビリルビンは、強力な抗酸化剤、抗炎症剤として作用するだけでなく、直接的なビリルビンは生理的にも活性が高く、脂質の過酸化を防ぐ上で重要な役割を果たす。その高い抗酸化力によりLDLの酸化を防ぎ、sdLDLの生成を抑えることができる。その証拠に、Tapanらはギルバート症候群の被験者が慢性的な高ビリルビン血症のためにsdLDLの血清レベルが低下することを示した。また、TNF、IL-1,IL-2,IL-6などの炎症性サイトカインが減少することも考えられる。そのほか、ビリルビンはPPARγアディポネクチンの発現を増加させ、HOMA-IRを低下させることでISを高める(Kwon et al 2018,Tapan et al 2011,Vitek2012)。一般的に、直接ビリルビンは、抗酸化Ca-pacityを増加させ、sdLDLを減少させることで、動脈硬化の初期密度を低下させることができると言える。したがって、血清ビリルビンは、動脈硬化の予知や予防のための貴重なバイオマーカーと考えられる。しかし、その有効性を証明できるようになるには、いくつかの研究が必要である。
おわりに
sdLDLの増加のような脂質プロファイルの乱れは、心血管疾患、特にアテローム性動脈硬化症の重大な危険因子である。そのため、動脈硬化の予防と治療のために、sdLDLのレベルを低下させる薬理学的および非薬理学的な薬剤を特定するための広範な努力がなされている。今回のレビューでは、医薬品(スタチン、エゼチミブ、フィブラート、ドキサゾシン、オルリスタット、ナイアシン、シロスタゾール、GH、メトホルミン、SGLT2阻害剤、GLP-1RA、DPP-4阻害剤、グリタゾン)食事療法、生活習慣病対策などが紹介されている。また、食事療法や生活習慣(ニュートラシューティカルズ、フィトステロール、ハーブ、喫煙、ビリルビン)によっても、様々なメカニズムでsdLDLの産生が大幅に抑制され、動脈硬化のリスクが減少する。一般的には、主なメカニズムはTGレベルとVLDL1の産生を減少させることであると結論づけることができる。
